Method Article
Utilizzo di reagenti di riferimento per confermare la robustezza dei saggi di rilascio di citochine per la previsione della sicurezza degli anticorpi monoclonali
In questo articolo
Riepilogo
L'uso di reagenti di riferimento per il test di rilascio di citochine consente di ottenere profili di sicurezza in vitro più riproducibili e standardizzati degli anticorpi monoclonali immunoterapeutici. Qui descriviamo come i saggi di rilascio di citochine possono essere utilizzati insieme a un pannello di reagenti di riferimento per prevedere la sicurezza di alcuni anticorpi monoclonali terapeutici.
Abstract
I nuovi farmaci anticorpali immunostimolatori progettati per stimolare direttamente specifiche cellule immunitarie o per migliorare indirettamente la risposta immunitaria bloccando o attivando un regolatore endogeno del sistema immunitario hanno il potenziale di causare gravi eventi avversi immuno-correlati come la sindrome da rilascio di citochine (CRS). È quindi fondamentale valutare il profilo di sicurezza di tali farmaci con una combinazione di esperimenti in vivo e in vitro prima della somministrazione della prima dose nell'uomo. I saggi di rilascio di citochine (CRA), in cui la terapia anticorpale proposta viene co-coltivata con cellule immunitarie umane (come le cellule mononucleate del sangue periferico (PBMC), sangue intero o altro) e viene misurata la quantità di citochina infiammatoria prodotta, sono fondamentali per l'identificazione dei pericoli. Tuttavia, laboratori diversi che utilizzano anticorpi di controllo diversi possono minacciare l'armonizzazione dei CRA e i controlli clinicamente rilevanti (come TGN1412) possono essere difficili da reperire, il che può portare a risultati meno accurati o affidabili o a dati difficili da confrontare tra i laboratori. L'inclusione di controlli positivi e negativi in una CRA può garantire l'accuratezza e l'affidabilità dei risultati. Il National Institute for Biological Standards and Control (NIBSC) ha prodotto un pannello di controlli anticorpali liofilizzati destinati all'uso in varie piattaforme CRA per armonizzare i risultati tra vari laboratori e metodi di analisi. Un set di tre diversi anticorpi di controllo positivo include il superagonista anti-CD52, anti-CD3 e anti-CD28 (SA), che sono noti per indurre CRS dose-dipendente nei pazienti. Ogni anticorpo è dotato di un anticorpo di controllo negativo corrispondente all'isotipo. Questo pannello di reagenti di riferimento ha precedentemente dimostrato di avere una buona riproducibilità interlaboratorio e di essere un controllo adatto per aumentare l'affidabilità e la robustezza dei dati di sicurezza provenienti da una varietà di piattaforme CRA.
Introduzione
Il rilascio indotto di citochine può essere un effetto anticipato e desiderato di alcuni anticorpi monoclonali immunomodulatori (mAb). Tuttavia, il rilascio imprevisto di citochine pro-infiammatorie può provocare la sindrome da rilascio di citochine (CRS) in pazienti caratterizzati da febbre, affaticamento e persino insufficienza multiorgano1. È quindi fondamentale che i nuovi anticorpi monoclonali immunostimolatori siano testati in vitro per il loro potenziale di causare CRS misurando il rilascio di citochine in un test di rilascio di citochine (CRA).
TGN1412 è un anticorpo monoclonale che è stato sviluppato come potenziale trattamento per la leucemia linfocitica cronica a cellule B agendo come superagonista CD28 (CD28SA), in grado di attivare i linfociti T reticolando il recettore co-stimolatore CD282. Nel 2006, sei volontari sani a cui è stato somministrato TGN1412 in uno studio clinico hanno sperimentato gravi effetti collaterali, tra cui la CRS, entro poche ore dalla somministrazionedel farmaco. Ciò ha portato all'interruzione della sperimentazione e al ritiro TGN1412 dall'ulteriore sviluppo. Altri anticorpi noti per causare CRS come effetto collaterale includono l'anticorpo monoclonale anti-CD52, Campath-1H3, e l'anticorpo monoclonale anti-CD3, Muromonab (OKT3)4. Data la loro capacità di indurre CRS dose-dipendente nei pazienti, TGN1412, OKT3 e Campath-1H sono anticorpi di controllo positivo adatti per la generazione di risultati robusti e affidabili da un CRA. Tuttavia, questi anticorpi di controllo non erano in precedenza facilmente ottenibili a causa dei costi elevati o della disponibilità limitata.
Tuttavia, un pannello di riferimento liofilizzato rigenerato di questi tre anticorpi 5,6,7 insieme a controlli negativi isotipi corrispondenti è stato recentemente reso disponibile dal National Institute for Biological Standards and Control (NIBSC). Questo pannello di reagenti di riferimento ha precedentemente dimostrato di avere una buona riproducibilità interlaboratorio8 ed è, quindi, un controllo adatto per aumentare l'affidabilità e la robustezza dei dati di sicurezza provenienti da una varietà di piattaforme CRA. Pertanto, la logica alla base dell'uso di questo protocollo insieme a questi reagenti è quella di migliorare l'armonizzazione delle CRA, con il vantaggio che questi reagenti sono stati convalidati in uno studio collaborativo internazionale8.
Qui descriviamo come utilizzare al meglio questo pannello di reagenti di riferimento in un CRA PBMC in fase solida (SP) e in un CRA di sangue intero (WB) in fase acquosa (AQ) per prevedere la CRS indotta da anticorpi. Entrambi questi formati di CRA sono complementari a causa della modalità di presentazione degli anticorpi (indiretta per la fase solida rispetto a quella diretta per la fase acquosa) e per il fatto che si rivolgono a diversi gruppi di cellule responder. Lo stesso protocollo può essere adattato per l'uso con sangue intero diluito (dWB) o con co-colture endoteliali: PBMC.
Protocollo
Il seguente protocollo segue le linee guida del comitato etico di ricerca NIBSC. In conformità con le normative e le linee guida applicabili, ottenere il consenso informato scritto del donatore o dei pazienti sani. Utilizzare tecniche sterili per eseguire tutte le fasi di preparazione del protocollo in una cappa di coltura cellulare a flusso laminare. Vedere la Tabella dei materiali per i dettagli su tutti i reagenti e le apparecchiature.
1. Preparazione di piastre rivestite con mAb per il saggio in fase solida (SP)
- Ricostituire il contenuto delle fiale del reagente di riferimento con 1 mL di acqua distillata sterile. Attendere 5-10 minuti per la reidratazione prima di miscelare la soluzione anticorpale e trasferirla in una provetta sterile con tappo.
- Dopo la ricostituzione in 1 mL di acqua, la concentrazione stock dei seguenti anticorpi ricombinanti sarà di 200 μg/mL: anti-CD3 (15/162), anti-CD52 (15/178), controllo dell'isotipo IgG1K (15/198) per l'anti-CD52, controllo dell'isotipo IgG2a (15/218) per l'anti-CD3, controllo dell'isotipo IgG4 (15/232) per l'anti-CD28SA.
- Dopo la ricostituzione in 1 mL di acqua, la concentrazione stock di anti-CD28SA (15/144) sarà di 100 μg/mL. Per una conservazione a breve termine fino a 7 giorni, trasferire il materiale ricostituito in una provetta sterile tappata a 4 °C.
- Diluire gli anticorpi ricostituiti e gli anticorpi di prova a 10 μg/mL in PBS sterile e rivestire i pozzetti di una piastra per microtitolazione sterile in polipropilene con fondo a U non trattato TC con 96 pozzetti con 100 μl di soluzione anticorpale diluita (1 μg/pozzetto) e incubare per una notte a 4 °C.
NOTA: È importante utilizzare piastre in polipropilene per l'adsorbimento delle proteine, poiché queste sono state utilizzate nella convalida dei reagenti standard9.
2. Preparazione delle PBMC
- Raccogliere un minimo di 30 ml di sangue intero periferico (WB) in provette eparinizzate/contenenti eparina e capovolgere più volte per garantire una corretta miscelazione con l'eparina sodica.
- Trasferire 15 mL di WB in una provetta separata da utilizzare successivamente nella preparazione del saggio su sangue intero in fase acquosa (fase 3.1)
- Diluire i restanti 15 mL di sangue in un rapporto di volume 1:1 con PBS o terreno RPMI-1640 privo di siero e sovrapporre delicatamente il sangue diluito sopra 15 mL di terreno a gradiente di densità (ad es. linfoprepto, Ficoll-Hypaque) in una provetta da 50 mL.
- Centrifugare la provetta a 500 x g per 20 minuti a temperatura ambiente in un rotore oscillante senza freno e con un'accelerazione ridotta per separare il sangue nei suoi diversi componenti.
- Dopo la centrifugazione, il gradiente di densità si separerà come uno strato superiore di plasma seguito da un sottile strato di buffy coat contenente PBMC e uno strato inferiore contenente globuli rossi (RBC) e granulociti polimorfonucleati tra cui neutrofili ed eosinofili. Raccogliere con cura le PBMC inserendo una pipetta direttamente attraverso lo strato superiore di plasma fino alle PBMC. In alternativa, rimuovere lo strato superiore prima della raccolta delle cellule.
- Risospendere delicatamente il buffy coat in 10 mL di PBS o di terreno RPMI-1640 senza siero. Centrifugare nuovamente la provetta a 500 x g per 10 minuti per pellettare le cellule. Rimuovere il surnatante e gettarlo.
- Ripetere il passaggio di lavaggio 2.6. e risospendere il pellet in 2 mL di RPMI con FCS al 10% (RPMI-1640 completo, cRPMI)
- Contare le cellule utilizzando un emocitometro10.
- Regolare le PBMC a una concentrazione di 1 x 106 cellule/mL in cRPMI.
3. Preparazione del saggio di rilascio di citochine nel sangue intero (WB) in fase acquosa (AQ)
- Aggiungere 190 μl di WB ai pozzetti di una piastra di polistirene con fondo a U a 96 pozzetti. Se non già a 100 μg/mL, pre-diluire tutti gli anticorpi del trattamento e i reagenti di riferimento a 100 μg/mL in PBS.
- Aggiungere 10 μL di anticorpi diluiti a 190 μL di WB per ottenere una concentrazione anticorpale finale di 5 μg/mL di anticorpo nel 95% di WB.
- Incubare la piastra per 48 ore in un'incubatrice umidificata a 37 °C.
4. Preparazione del saggio di rilascio di citochine PBMC in fase solida (SP)
- Con una pipetta multicanale, rimuovere ed eliminare la soluzione di anticorpi dalle piastre rivestite (descritta nella fase 1), riempire un serbatoio di reagenti con PBS e lavare la piastra 3 volte con 200 μL di PBS per rimuovere gli anticorpi monoclonali non legati.
- Aggiungere 200 μl della sospensione cellulare del passaggio 2.8 a ciascun pozzetto. Incubare la piastra per 48 ore in un'incubatrice umidificata a 37 °C, 5% CO2.
5. Raccolta di surnatante o plasma
- Dopo l'incubazione per 48 ore con mAb di controllo e test, centrifugare le piastre a 400 x g per 5 minuti e raccogliere il terreno condizionato con cellule o il plasma, facendo attenzione a non disturbare il pellet cellulare. Congelare il surnatante o il plasma raccolto a -20 °C.
NOTA: Assicurarsi di non disturbare il pellet dei globuli rossi durante la raccolta del plasma.
6. Esecuzione della quantificazione delle citochine nel surnatante o nel plasma
- Utilizzando il surnatante o il plasma raccolto, eseguire l'analisi delle citochine delle concentrazioni di IFN-γ, IL-2, TNF-α e IL-6 utilizzando l'opzione multiplex preferita. In precedenza è stato pubblicato un metodo di esempio per l'analisi delle citochine multiplex utilizzando un saggio citometrico a microsfere11.
NOTA: Fare riferimento alla tabella dei materiali per il kit multiplex utilizzato nella generazione dei risultati rappresentativi.
Risultati
I risultati del test SP dovrebbero dimostrare un rilascio di IL-2, IFN-γ, IL-6 e TNF-α12 nell'intervallo pg/mL da tutti gli anticorpi di controllo positivi a 48 ore e dovrebbero essere statisticamente significativamente maggiori rispetto ai controlli isotipici abbinati. I nostri risultati rappresentativi dimostrano che gli anticorpi di controllo positivi, αCD28, αCD3 e αCD28SA inducono livelli significativamente elevati di IFN-γ, IL-6 e TNF-α rispetto ai controlli isotipici abbinati, quando eseguiti nel test PBMC SP (Figura 1). Questo test è anche caratterizzato da un'elevata variazione di fold del rilascio di IL-2 dalla stimolazione con αCD28SA rispetto al suo isotipo corrispondente (859.0). Mentre αCD3 e αCD52, pur inducendo ancora l'espressione di IL-2, determinano variazioni di fold inferiori rispetto a αCD28SA (6,2 e 3,3 per αCD3 e αCD52, rispettivamente, Figura 2).
Nel test WB AQ (Figura 3), il livello di citochine rilevabili è notevolmente inferiore rispetto al test PBMC SP, ma è caratterizzato da una maggiore sensibilità alla stimolazione da parte dell'anticorpo αCD52 (Figura 2 e Figura 3) con variazioni medie di IL-2, IFN-γ e IL-6 superiori a 100.
Un anticorpo di prova per il quale si potrebbe prevedere che la futura somministrazione per la prima volta nell'uomo non causi alcun aumento significativo imprevisto del rilascio di citochine rispetto ai controlli isotipici pertinenti. Tuttavia, piuttosto che interrompere lo sviluppo di un nuovo anticorpo monoclonale terapeutico, un risultato positivo in un CRA dovrebbe essere considerato come parte della gestione del rischio/beneficio13. Quando si sviluppa una nuova piattaforma CRA, il test deve essere ripetuto utilizzando un diverso set di donatori per garantire la riproducibilità della piattaforma. Dovrebbe anche essere data importanza a tenere conto della variabilità della risposta tra i donatori14, e quindi si raccomanda un esperimento ben potenziato15. Al fine di comprendere l'ampiezza delle risposte e ottenere una rappresentazione completa della variabilità che potrebbe essere osservata nelle risposte dei donatori, il test dovrebbe idealmente essere eseguito con più donatori individuali oltre a saggiare la terapia in esperimenti replicati.
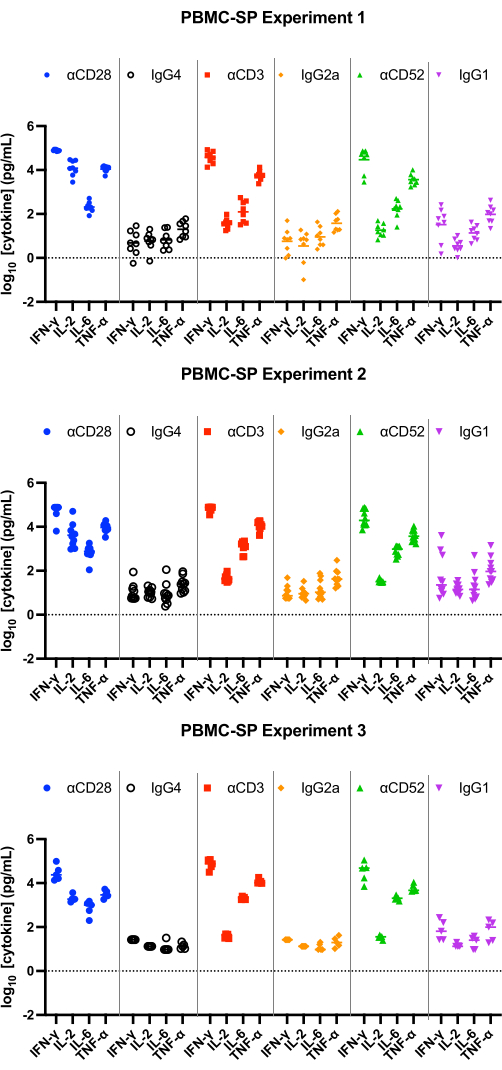
Figura 1: Rilascio di citochine dall'esperimento PBMC-SP. Risultati rappresentativi del rilascio di IFN-γ, IL-2, IL-6 e TNF-α ottenuti dai saggi di rilascio di citochine PBMC-SP (3 esperimenti indipendenti contenenti ciascuno 5-8 donatori per esperimento; n=8, n=10, n=5 [dall'alto verso il basso]) dopo 48 ore utilizzando anticorpi reagenti di riferimento. Abbreviazioni: PBMC = cellule mononucleate del sangue periferico; SP = fase solida; IFN-γ = interferone-gamma; IL-2 = interleuchina 2; IL-6 = interleuchina 6; TNF-α = fattore di necrosi tumorale alfa. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Aumento del cambiamento di piega delle citochine dagli esperimenti PBMC-SP e WB-AQ. Variazione di piega del rilascio di IFN-γ, IL-2, IL-6 e TNF-α dei reagenti di riferimento anticorpali che inducono CRS rispetto ai controlli isotipici corrispondenti, ottenuti da saggi di rilascio di citochine PBMC-SP e WB-AQ dopo 48 ore. Abbreviazioni: PBMC = cellule mononucleate del sangue periferico; SP = fase solida; WB = sangue intero; AQ = acquoso (fase); IFN-γ = interferone-gamma; IL-2 = interleuchina 2; IL-6 = interleuchina 6; TNF-α = fattore di necrosi tumorale alfa; CRS = sindrome da rilascio di citochine. Clicca qui per visualizzare una versione più grande di questa figura.
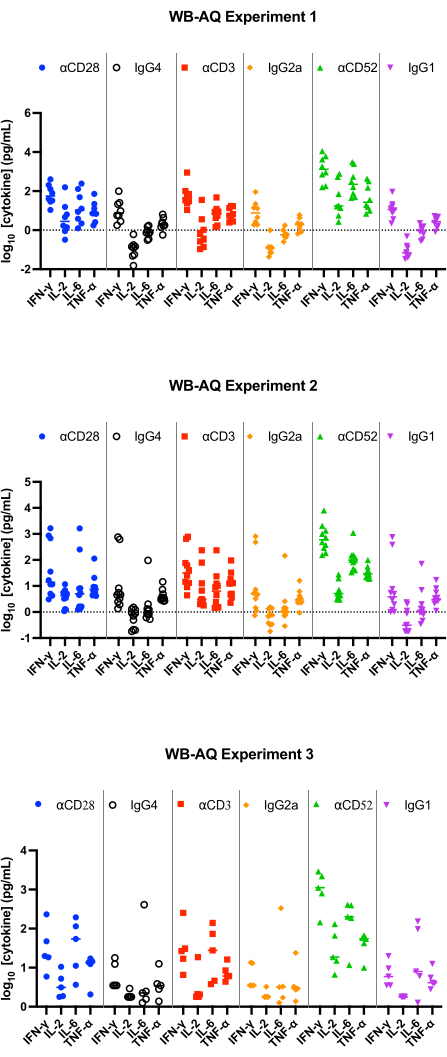
Figura 3: Rilascio di citochine dall'esperimento WB-AQ. Risultati rappresentativi del rilascio di IFN-γ, IL-2, IL-6 e TNF-α ottenuti da saggi di rilascio di citochine WB-AQ (3 esperimenti indipendenti contenenti ciascuno 5-8 donatori per esperimento; n=8, n=10, n=5 [dall'alto verso il basso]) dopo 48 ore utilizzando anticorpi reagenti di riferimento. Abbreviazioni: WB = sangue intero; AQ = acquoso (fase); IFN-γ = interferone-gamma; IL-2 = interleuchina 2; IL-6 = interleuchina 6; TNF-α = fattore di necrosi tumorale alfa. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Di seguito sono descritti i metodi per misurare il rilascio di citochine da PBMC e WB in seguito a stimolazione mediata da anticorpi da una piastra rivestita di anticorpi o con anticorpi in soluzione, utilizzando un pannello di reagenti di riferimento per controlli positivi e negativi. Ognuno di questi test ha i propri punti di forza e di debolezza associati. I saggi PBMC e WB sono complementari poiché la proporzione di varie cellule immunitarie come linfociti, monociti e granulociti è diversa nelle due matrici sperimentali utilizzate per i CRA. È interessante osservare che, sebbene un test WB possa rappresentare meglio la condizione in vivo rispetto alla monocoltura PBMC, la prima piattaforma è meno predittiva del rischio di CRS mediata da cellule T da TGN1412 e OKT315; un risultato della glicoforina A sui globuli rossi che inibisce l'espansione delle cellule T mediata da IL-216. Ciononostante, la predizione del rischio di CRS da anti-CD52 rimane intatta nella CRA WB, a causa della presenza di neutrofili (persi durante i metodi convenzionali di gradiente di densità descritti nella fase 2, utilizzati per l'isolamento di PBMC).
Il formato della CRA (presentazione SP o AQ) è fondamentale per l'individuazione del meccanismo specifico della CRS. Ad esempio, la presentazione in fase acquosa dell'anticorpo monoclonale ai linfociti umani17,18, impiegata durante i test di sicurezza preclinici in vitro di TGN1412 non è riuscita a identificare il rischio di CRS probabilmente dovuto alla mancanza di clustering e coinvolgimento localizzato dei recettori cellulari19 e alla conseguente attivazione delle cellule T mediata dagli anticorpi in fase acquosa. Infatti, la CRS mediata da TGN1412 può essere rilevata con precisione solo in formato SP che replica artificialmente il cross-linking del recettore Fc-gamma (FcγR), come presentato qui, o mediante priming dipendente dal contatto in precoltura di PBMC ad alta densità e interazione Fc con cellule immunitarie CD32+ (come le cellule B20 e i monociti21).
Oltre a queste piattaforme, esistono altri modi per eseguire CRA con sistemi di co-coltura più complessi. Un esempio di CRA alternativo a quelli descritti in questi metodi è la co-coltura di PBMC con cellule endoteliali autologhe di crescita del sangue (BOEC)22. Questo test è stato descritto nel 2015 come un miglioramento rispetto all'allora convenzionale test HUVEC:PBMC a donatore misto, rimuovendo la discrepanza tissutale confondente. Dimostra una migliore sensibilità alla CRS anti-CD28SA rispetto al test WB e supera anche i limiti del test di monocoltura PBMC imitando la combinazione di cellule endoteliali e leucociti presenti in vivo, ma al costo di passaggi procedurali più lunghi che richiedono tecniche di coltura cellulare specializzate22.
Inoltre, mentre questo protocollo si concentra specificamente sul rilascio di IFN-γ, IL-2, IL-6 e TNF-α, i colleghi dell'MHRA hanno precedentemente esaminato IL-12 e altri in questo contesto23. La produzione di IL-12 è aumentata da questi anticorpi CRS di controllo positivi, sebbene non sia particolarmente sensibile, e quindi forse non è un grande predittore di CRS in questa modalità. Alcune citochine, come l'IL-15 tra le altre, non sono mai state testate, sebbene le 4 citochine valutate nel nostro protocollo forniscano una buona indicazione del potenziale rischio di CRS. Naturalmente, a seconda della modalità e degli anticorpi testati, potrebbero essere valutate altre citochine.
Combinate, queste osservazioni evidenziano l'importanza di notare che, sebbene l'uso di reagenti di riferimento possa aiutare a identificare il rischio di CRS di nuovi anticorpi, è necessario prestare attenzione per evitare una piattaforma CRA non ottimale che potrebbe non riuscire a identificare il potenziale CRS. Fondamentalmente, il meccanismo d'azione previsto di una terapia, sia attraverso la sua regione Fc che la sua azione ipotizzata sulle cellule che esprimono l'antigene, deve corrispondere alla biologia del test. Pertanto, sebbene le differenze nel meccanismo d'azione dei reagenti terapeutici in esame e dei reagenti di riferimento discussi in questo articolo possano rappresentare una potenziale limitazione in modo tale che una CRA pertinente per l'anticorpo in esame potrebbe essere incompatibile con la biologia dei reagenti di riferimento, il test fornisce una piattaforma solida e affidabile per l'identificazione dei pericoli. I risultati di diversi formati di CRA che coprono vari meccanismi d'azione e sottogruppi di cellule immunitarie possono tuttavia essere necessari per un'affidabilità ottimale dei dati di valutazione della sicurezza.
Divulgazioni
EM è stato precedentemente impiegato presso l'Agenzia di regolamentazione dei medicinali e dei prodotti sanitari (MHRA). Gli altri autori non hanno conflitti di interesse.
Riconoscimenti
Questo lavoro è stato finanziato dal National Institute for Biological Standards and Control. Ringraziamo Sandra Diebold per aver esaminato il manoscritto e per gli utili commenti e suggerimenti. Siamo anche grati a Ka Seng Ieong per aver girato il video.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 ml Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | |
| Fetal Bovine Serum, qualified, heat inactivated | ThermoFisher | 10500064 | |
| Heparinized tubes | ThermoFisher | 12967676 | |
| Heracell 150i CO2 Incubator | ThermoFisher | 16406639 | |
| MESO QuickPlex SQ 120 Human Proinflammatory Panel 1 V-PLEX kit | Meso Scale Discovery | K15049 | |
| MESO QuickPlex SQ 120MM | Meso Scale Discovery | AI1AA-0 | |
| Neubauer Improved Haemocytometer Counting Chamber | Hawksley | AS1000 | |
| Panel of lyophilized recombinant antibody controls for Cytokine Release Assays | NISBC | 19/156 | |
| PBS | ThermoFisher | 10010023 | |
| Polypropylene 96-well microtiter plate | Corning | 3879 | |
| Polystyrene 96-well microtiter plate | Corning | 3799 | |
| RPMI 1640 | ThermoFisher | 11875093 | |
| Sorvall ST 40 Centrifuge | ThermoFisher | 75004525 | |
| Sterile water | ThermoFisher | 15230162 |
Riferimenti
- Suntharalingam, G., et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. The New England Journal of Medicine. 355 (10), 1018-1028 (2006).
- Hünig, T. The storm has cleared: lessons from the CD28 superagonist TGN1412 trial. Nature Reviews Immunology. 12 (5), 317-318 (2012).
- Wing, M. G., et al. Mechanism of first-dose cytokine-release syndrome by CAMPATH 1-H: involvement of CD16 (FcgammaRIII) and CD11a/CD18 (LFA-1) on NK cells. Journal of Clinical Investigation. 98 (12), 2819-2826 (1996).
- Gaston, R. S., et al. OKT3 first-dose reaction: Association with T cell subsets and cytokine release. Kidney International. 39 (1), 141-148 (1991).
- Riechmann, L., Clark, M., Waldmann, H., Winter, G. Reshaping human antibodies for therapy. Nature. 332 (6162), 323-327 (1988).
- Kung, P., Goldstein, G., Reinherz, E. L., Schlossman, S. F. Monoclonal antibodies defining distinctive human T cell surface antigens. Science. 206 (4416), 347-349 (1979).
- Ball, C., et al. Antibody C region influences TGN1412-like functional activity in vitro. Journal of Immunology. 189 (12), 5831-5840 (2012).
- Vessillier, S., et al. Development of the first reference antibody panel for qualification and validation of cytokine release assay platforms - Report of an international collaborative study. Cytokine: X. 2 (4), 100042(2020).
- Findlay, L., et al. Improved in vitro methods to predict the in vivo toxicity in man of therapeutic monoclonal antibodies including TGN1412. Journal of Immunological Methods. 352 (1-2), 1-12 (2010).
- oVE Science Education Database. Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. Journal of Visualized Experiments. , (2023).
- Lehmann, J. S., Zhao, A., Sun, B., Jiang, W., Ji, S. Multiplex Cytokine Profiling of Stimulated Mouse Splenocytes Using a Cytometric Bead-based Immunoassay Platform. Journal of Visualized Experiments. (129), e56440(2017).
- Murthy, H., Iqbal, M., Chavez, J. C., Kharfan-Dabaja, M. A. Cytokine Release Syndrome: Current Perspectives. Immunotargets Therapy. 8, 43-52 (2019).
- Vidal, J. M., et al. In vitro cytokine release assays for predicting cytokine release syndrome: the current state-of-the-science. Report of a European Medicines Agency Workshop. Cytokine. 51 (2), 213-215 (2010).
- Grimaldi, C., et al. Cytokine release: A workshop proceedings on the state-of-the-science, current challenges and future directions. Cytokine. 85, 101-108 (2016).
- Vessillier, S., et al. Cytokine release assays for the prediction of therapeutic mAb safety in first-in man trials - Whole blood cytokine release assays are poorly predictive for TGN1412 cytokine storm. Journal of Immunological Methods. 424, 43-52 (2015).
- Chu, J. W. K., Sharom, F. J. Glycophorin A interacts with interleukin-2 and inhibits interleukin-2-dependent T-lymphocyte proliferation. Cellular Immunology. 145 (2), 223-239 (1992).
- Stebbings, R., Eastwood, D., Poole, S., Thorpe, R. After TGN1412: recent developments in cytokine release assays. Journal of Immunotoxicology. 10 (1), 75-82 (2013).
- Hanke, T. Lessons from TGN1412. Lancet. 368 (9547), author reply 1570 1569-1570 (2006).
- Stebbings, R., et al. #34;Cytokine storm" in the phase I trial of monoclonal antibody TGN1412: better understanding the causes to improve preclinical testing of immunotherapeutics. Journal of Immunology. 179 (5), 3325-3331 (2007).
- Bartholomaeus, P., et al. Cell contact-dependent priming and Fc interaction with CD32+ immune cells contribute to the TGN1412-triggered cytokine response. Journal of Immunology. 192 (5), 2091-2098 (2014).
- Hussain, K., et al. Upregulation of FcγRIIb on monocytes is necessary to promote the superagonist activity of TGN1412. Blood. 125 (1), 102-110 (2015).
- Reed, D. M., et al. An autologous endothelial cell:peripheral blood mononuclear cell assay that detects cytokine storm responses to biologics. The FASEB Journal. 29 (6), 2595-2602 (2015).
- Eastwood, D., et al. Severity of the TGN1412 trial disaster cytokine storm correlated with IL-2 release. British Journal of Clinical Pharmacology. 76 (2), 299-315 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon