Method Article
연구 세포 배양 실험실에서 곰팡이 및 박테리아에 의한 오염을 방지하기 위한 세포 배양 기술 및 관행
요약
이 프로토콜은 곰팡이 및 박테리아에 의한 오염을 피하기 위해 연구 세포 배양 실험실에서 사용되는 필수 세포 배양 기술 및 관행을 제시합니다. 박테리아 범주 내에서 마이코플라스마 오염 방지에 특히 중점을 둘 것입니다.
초록
세포 배양은 통제된 환경에서 인간, 동물 및 곤충 세포 또는 기타 조직을 성장시키는 데 필요한 섬세한 기술입니다. 이 프로토콜의 목표는 곰팡이와 박테리아의 오염을 방지하기 위해 실험실에서 사용되는 올바른 기술을 강조하는 것입니다. 마이코플라스마 오염을 피하는 데 특히 중점을 두고 있는데, 이는 마이코플라스마의 크기가 작고 세포 배양에 사용되는 대부분의 항생제에 대한 내성으로 인해 세포 배양실의 주요 관심사입니다. 이러한 동일한 기술은 지속적인 성장을 보장하고 건강한 세포를 유지합니다. 신규 및 숙련된 세포 배양 사용자 모두에게 오염 위험을 완화하기 위해 이러한 모범 사례를 일관되게 준수하는 것이 중요합니다. 일년에 한 번, 실험실은 세포 배양 모범 사례를 검토하고 필요한 경우 토론 또는 추가 교육을 통해 후속 조치를 취해야 합니다. 애초에 오염을 방지하기 위한 조기 조치를 취하면 오염이 발생한 후 청소하는 것과 비교하여 시간과 비용을 절약할 수 있습니다. 보편적인 모범 사례는 세포 배양을 건강하게 유지하여 새로운 세포를 지속적으로 해동하고, 값비싼 세포 배양 배지를 구매하고, 인큐베이터 오염 제거 및 가동 중지 시간을 줄여야 할 필요성을 줄입니다.
서문
세포 배양은 연구실에서 많은 용도로 사용됩니다. 20세기 초 세포 배양의 기원 이후, 세포주는 과학을 발전시키는 데 도움이 되었습니다. 세포주에는 몇 가지 장점이 있습니다. 다양한 세포주는 연구자들이 세포 생물학을 연구하거나, 추가 연구를 위해 바큘로바이러스를 생산하거나, 관심 있는 단백질을 대량으로 생산하는 데 도움이 될 수 있습니다1. 일부 추가 용도로는 조직 성장 연구, 백신 개발 촉진, 독성학 연구, 건강한 유기체 및 질병 모델에서 유전자의 역할 연구, 하이브리드 세포주생산 등이 있습니다 2,3. 세포주는 또한 약물 생산을 가능하게 할 수 있다3. 세포주로 작업할 때 적절한 무균 기술이 필요합니다. 이 원고에 요약된 관행과 기술은 세포 배양 작업이 수행되는 연구 실험실에 적용할 수 있습니다. 다른 실험실 설정은 논의되지 않습니다.
오염은 종종 세포 배양 작업을 수행할 때 주요 관심사입니다. 이 논문의 맥락에서 오염은 일반적으로 곰팡이와 박테리아를 의미합니다. 이 백서에 설명된 방법의 전반적인 목표는 오염을 방지하기 위한 모범 사례를 철저히 설명하는 것입니다. 모든 실험실 구성원은 연구실의 세포 배양실에서 작업할 때 이러한 관행을 준수해야 합니다. 실험실은 모든 작업자가 오염을 방지하기 위해 이러한 모범 사례를 사용하는 데 적극적으로 참여하도록 해야 합니다. 올바른 관행과 기술에 대한 지식은 세포 배양이 생존 가능하고 건강하며 오염되지 않도록 하는 데 도움이 됩니다. 이 기술의 개발은 문헌 연구, 세포 배양 작업 7년 경험, 초보자와 숙련된 세포 배양 작업자 모두가 매년 참조할 수 있는 방법의 필요성을 기반으로 합니다.
모든 연구 세포 배양 실험실이 따라야 하는 명확하고 표준화된 기술이 필요합니다. 세포 배양 오염에 관한 많은 문헌은 마이코플라스마 검출, 무균 기술, 오염원, 오염 물질 제거, 항생제 사용 및 정기 검사에 의한 예방에 대해 논의합니다 4,5,6,7,8. 이 정보는 도움이 되지만 따라야 하는 적절한 세포 배양 기술을 보여주는 비디오는 문헌에 없습니다. 대체 기술에 비해 제시된 관행의 장점은 나중에 실수를 감지하고 수정하는 것이 아니라 오염이 발생하기 전에 예방하는 데 중점을 둔다는 것입니다. 또한 무균 기술에 대한 철저한 시연, 곰팡이 및 박테리아 성장 방지에 대한 논의, 생물 안전 캐비닛 공기 흐름에 관한 정보는 초보자와 숙련된 세포 배양 작업자 모두에게 가치가 있습니다.
박테리아와 곰팡이는 가장 흔한 두 가지 유형의 오염 물질입니다. 박테리아 범주 내에서 마이코플라스마는 크기가 작고 눈에 띄지 않으면서 증식할 수 있는 능력으로 인해 주요 관심사입니다. 그들은 성장하기 위해 진핵 세포에 의존하는 단단한 세포벽이 없는 자가 복제 유기체입니다. 투과 전자 현미경은 마이코 플라스마 9,10을 검출 할 수 있지만 세포 배양의 일상적인 육안 검사 및 정기적 인 현미경 분석에서 인식되지 않는 동안 대사 능력이 감소하고 크게 증식 할 수 있습니다. 또한, 미생물 필터10을 통과 할 수 있습니다. 세포 배양 배지는 마이코플라스마에 영양분을 공급하지만, 불행히도 배지에 항생제를 보충해도 마이코플라스마10에는 영향을 미치지 않습니다. 일반적으로 항생제로 배지를 보충 할 필요는 없습니다. 적절한 기술만으로도 오염을 막을 수 있습니다. 마이코플라스마 감염은 즉각적인 세포 사멸로 이어지지는 않지만 데이터 재현성과 품질에 영향을 미치기 때문에 연구자들에게는 우려스러운 일입니다.
모든 실험실 직원은 우수한 세포 배양 관행을 엄격히 준수해야 합니다. 배양균은 새로 구입한 후, 현재 재배 중인 동안, 냉동 보존 전, 액체 질소에서 해동할 때 마이코플라스마 검사를 받아야 합니다 2,10. 중합효소연쇄반응(PCR), 효소결합면역분석법(ELISA) 또는 면역염색을 사용하여 다양한 검사를 시중에서 구할 수 있습니다. 3 문헌은 "인간 분리주가 세포 배양에서 발견되는 마이코플라스마 오염 물질의 상당 부분을 차지한다"고 지적합니다.5. 200종 이상의 마이코플라스마 종이 기술되었지만 이 중 약 6종이 대부분의 감염을 차지합니다. 이 6 종은 M. arginini, M. fermentans, M. hominis, M. hyorhinis, M. orale 및 Acholeplasma laidlawii10입니다. 다른 유형의 오염과 마찬가지로 공기와 에어로졸은 이를 세포 배양으로 가져옵니다5. 이것은 "인간 조작자가 실험실에서 잠재적으로 가장 큰 위험"이기 때문에 다른 논문에서도 반향을 일으킨다.7. 이것은 인적 오류를 통해 이루어 지지만 표준 절차를 따르면 위험을 제거 할 수 있습니다. 직원의 탈락은 마이코플라스마 오염에만 국한되지 않습니다. 한 실험실의 세포 배양은 일반적으로 동일한 마이코플라스마 종에 감염되며, 이는 부적절한 세포 배양 기술로 인해 오염이 한 플라스크에서 다른 플라스크로 퍼진다는 것을 나타낸다10.
교차 오염 방지는 적절한 세포 배양 기술을 따라야 하는 또 다른 이유입니다. 전 세계 세포주의 최소 15%-18%가 교차 오염되거나 잘못 식별될 수 있습니다11,12. 세포주에서 마이코플라스마 오염을 검사하는 것 외에도 교차 오염에 대해서도 검사해야 한다10. 인간 세포주의 경우, 짧은 직렬 반복(STR) 프로파일링이라고 하는 저렴한 DNA 기반 기술에 의한 세포주 인증은 세포주 동일성을 확인하는 쉬운 방법이기 때문에 현재 국제 참조 표준입니다 2,10,13,14. STR은 잘못 표지되거나 교차 오염된 세포주를 식별할 수 있지만, 잘못된 조직 기원을 검출할 수는 없다10,13,14. 세포주가 잘못 표시되거나, 잘못 식별되거나, 오염된 경우 연구 데이터의 유효성이 손상될 수 있다13. 다른 유형의 오염과 마찬가지로, 교차 오염은 에어로졸 확산을 유발하는 잘못된 기술, 잘못된 접촉으로 인해 잘못된 세포 유형이 플라스크에 들어가거나, 동일한 배지 병 및 시약을 다른 세포주와 함께 사용하기 때문에 발생할 수 있다10. 미디어 병을 공유해서는 안 됩니다. 두 개의 서로 다른 세포주 간에 배지 한 병을 공유하면 해당 세포 집단을 혼합할 수 있으므로 더 빠르게 성장하는 세포 유형이 플라스크를 완전히 장악할 수 있습니다. 이 교체는 눈에 띄지 않으며 잘못된 라벨링 및 오인으로 이어집니다2. 또한 배양 과정에서 배양이 혼동되는 경우 세포주를 다른 세포주로 오인할 수 있다10. 시약, 배지 및 플라스크를 서로 분리하는 데 세심한 주의를 기울여야 합니다. 각 실험실 구성원은 자신의 미디어 병을 가지고 있어야 합니다. 랩 구성원 간에 공유가 발생하지 않아야 합니다. 세포주 자체는 자격을 갖춘 세포 은행 및 공급자로부터 구입해야 합니다. 실험실은 세포를 공유해서는 안됩니다. 연구에 따르면, STR 검사와 마이코플라스마 검사가 정기적으로 사용되지만, 문헌에 실린 많은 연구 논문에서는 이미 잘못 식별되거나 오염된 세포주를 사용하고 있다15. 이러한 문제가 있는 논문을 찾고 독자들에게 이 문제에 대해 소급하여 알리기 위해 연구를 샅샅이 뒤지는 것은 번거로운 일입니다. 예방은 애초에 이 문제가 발생하지 않도록 하는 가장 좋은 방법입니다.
70% EtOH로 품목을 살포하는 간단한 행동은 유기체를 죽일 수 있습니다. 70% EtOH는 박테리아와 곰팡이를 포함하여 가장 흔하게 오염되는 유기체에서 단백질을 변성시키고 지질을 용해시키는 방식으로 작용한다16. 연구에 따르면 70%가 가장 효과적인 농도입니다. 표면 단백질은 70% EtOH로 빠르게 응고되지 않아 세포에 들어갈 수 있는 반면, 단백질에 포함된 물은 단백질의 변성 과정에 필요합니다. 세포벽의 양쪽에 있는 물과 알코올의 농도 차이로 인해 70% EtOH가 세포로 들어가 효소 및 구조 단백질을 모두 변성시킵니다. 플라스크에서 곰팡이 성장이 관찰되는 경우, 먼저 70% EtOH를 분무하고 닦아내어 건조시킨 다음 60°C에서 16시간 동안 배양하여 전체 인큐베이터를 오염 제거해야 합니다17. 이것은 대부분의 곰팡이와 박테리아를 죽입니다.
오염이 발생한 후 제거하는 대체 기술에 비해 예방 관행의 주요 이점은 오염을 조기에 방지함으로써 실험실 작업자가 세포 배양이 건강하다는 것을 확신할 수 있고 인큐베이터의 오염 제거 또는 세포 배양 폐기와 관련된 높은 비용이 발생하지 않는다는 것입니다. 예를 들어, 마이코플라스마 오염 물질의 제거는 효율적이지 않다7. 실험실 직원이 적절한 교육을 받고, 세포 배양실이 독립적이며, 표준 절차를 사용하는지 확인하기 위해 초기에 시간을 할애하면 시간과 비용을 절약할 수 있습니다.
프로토콜
1. 준비
- 일반
- 세포 배양실에서만 착용하고 실험실의 다른 부분에서는 착용하지 않도록 지정된 깨끗한 실험실 코트를 착용하십시오.
참고: 실험복은 멸균 상태일 필요가 없습니다. - 다른 표면에 닿지 않은 새 장갑을 착용하십시오. 장갑이 단단히 끼워졌는지 확인하십시오. 니트릴, 파우더가 없는 장갑이 가장 좋습니다.
알림: 장갑은 멸균 상태일 필요가 없습니다. - 작업을 준비하려면 장갑, 실험복 슬리브 및 생물 안전 캐비닛 내부에 70% EtOH를 뿌립니다. 보푸라기가 없는 종이 타월로 작업 표면과 유리 패널을 닦아냅니다.
참고: 70% EtOH를 사용하면 가장 높은 효율로 박테리아를 죽일 수 있습니다16. 종이 타월은 멸균 될 필요가 없습니다. - 세포 배양실 내부에 수조를 보관하고 배양 배지를 데우거나 세포를 해동하는 데만 사용하십시오. 제조업체의 청소 지침에 따라 일주일에 한 번 수조를 배수하고 씻으십시오.
- 세포 배양실에서만 착용하고 실험실의 다른 부분에서는 착용하지 않도록 지정된 깨끗한 실험실 코트를 착용하십시오.
- 생물 안전 캐비닛 내부
- 캐비닛에 반입하는 품목의 수를 제한하십시오. 전면 또는 후면 그릴을 막아 생물 안전 캐비닛 내부의 공기 흐름을 방해하지 마십시오.
주: 캐비닛 내부의 공기 흐름에 대한 설명은 그림 1 을 참조하십시오. - 캐비닛 내부에 있는 모든 품목에 70% EtOH를 뿌리고 물기를 닦아냅니다. 미디어 병 상단에 스프레이를 뿌리고 아래로 작업하는 것으로 시작합니다. 마찬가지로 깨끗한 종이 타월로 물기를 닦아내고 점진적으로 바닥까지 작업합니다. 캡 쪽으로 다시 올라가지 마십시오.
- 캐비닛이 혈청학적 피펫을 수용할 수 있을 만큼 충분히 크면 내부에 배치할 수 있고, 그렇지 않으면 캐비닛 외부에 장착된 용기에 보관할 수 있습니다. 사용하기 전에 포장에 구멍, 찢어짐 또는 구멍이 있는지 밀봉된 피펫의 양쪽 면을 확인하십시오. 포장을 뜯지 마십시오. 대신, 포장의 끝을 부드럽게 벗기고 혈청학적 피펫을 피펫 보조제에 삽입한 다음 한 번의 유체 동작으로 포장을 제거합니다.
- 열린 병이나 플라스크 위로 마우스를 가져가지 마십시오. 열린 병이나 플라스크 위로 손을 뻗거나 생물 안전 캐비닛에서 이미 열린 품목의 상단 위로 품목을 엽니다.
알림: 캐비닛 내부의 공기 흐름은 작업 표면을 아래로 밀어내므로 예를 들어 슬리브에 존재하는 모든 오염 물질이 세포 배양에 들어갈 수 있습니다. - 액체를 붓지 마십시오. 대신 혈청 학적 피펫을 사용하여 추가하십시오. 배지를 보충한 후 내용물을 완전히 혼합하고 병을 이니셜로 만듭니다. 또한 미디어에 보완된 내용에 대한 레이블을 포함해야 합니다.
- 캐비닛에 반입하는 품목의 수를 제한하십시오. 전면 또는 후면 그릴을 막아 생물 안전 캐비닛 내부의 공기 흐름을 방해하지 마십시오.
2. 부착 세포주 작업
- 플라스틱 플라스크가 필요한 경우 전체 가방에 스프레이를 뿌리고 캐비닛 안에 넣으십시오.
- 고압 증기 멸균 유리 피펫 또는 일회용 멸균 플라스틱 피펫을 사용하여 매체 또는 세척 용액을 흡입하십시오. 보관 용기에서 금속 캡을 조심스럽게 제거합니다. 용기를 비스듬히 부드럽게 흔들어 하나의 유리 피펫을 분리합니다. 용기에 손을 뻗을 때 다른 피펫을 만지지 마십시오.
알림: 선택한 피펫은 한쪽 끝에서만 다루십시오. - 가능한 한 빨리 병의 캡을 빨리 교체하십시오. 림이 작업대에 닿지 않도록 작업대에 캡을 거꾸로 놓습니다. 상단이나 하단에서 캡을 잡지 마십시오. 대신 측면에서 캡을 만지십시오.
- 액체를 흡입할 때는 캐비닛 외부에 있는 진공 트랩 플라스크를 바닥의 보조 용기에 사용하십시오.
알림: 백이 누출될 수 있으므로 생물학적 위험 폐기물 백에 액체 폐기물을 버리지 마십시오. 캐비닛 내부에서 작업하는 동안 폐기물이 생성됩니다. 캐비닛 안팎으로 손을 너무 자주 움직이면 공기 흐름이 중단됩니다. 캐비닛 내부에 쓰레기는 임시로 두십시오. 작업을 방해하지 않도록 옆으로 치우십시오. - 장갑이 마를 때마다 70% EtOH를 넉넉히 뿌립니다. 장갑이 젖지 않도록 손을 문지릅니다.
- 혈청 학적 피펫이 실수로 캐비닛의 무언가를 만지면 주저하지 말고 버리십시오. 오염될 수 있는 피펫을 사용하는 대신 깨끗한 혈청학적 피펫으로 새로 시작하십시오.
4. 세포 확인 및 보관
- 인큐베이터에 세포를 넣기 전에 현미경으로 어떻게 보이는지 확인하십시오. 세포가 완전히 현탁 된 경우 단일 세포를 관찰해야합니다.
- 인큐베이터에 말하거나, 재채기하거나, 기침하거나, 심하게 숨을 들이쉬지 마십시오. 인큐베이터 도어를 빠르게 열고 닫습니다. 필요 이상으로 문을 열어 두면 공기 중에 존재하는 오염 물질이 인큐베이터로 들어갈 수 있습니다.
참고: 세포 배양실에서 작업하는 동안 마스크를 착용하면 마이코플라스마가 사람의 입에 존재할 수 있으므로 도움이 될 수 있습니다. 세포 배양실에서 휴대폰 사용을 피하십시오., 대화는 권장하지 않습니다. - 캐비닛에서 병을 꺼내기 전에 모든 병의 캡이 단단히 닫혀 있는지 확인하십시오.
- 세포 배양 배지는 빛에 민감하기 때문에 사용하지 않을 때는 4°C의 어두운 곳에 보관하십시오.
- 세포 배양 작업이 완료된 후 캐비닛 내부에 다시 70% EtOH를 뿌리고 종이 타월로 표면을 닦아 건조시킵니다. 생물학적 위험 쓰레기 봉투를 비우십시오. 이 과정을 반복하고 다른 세포주로 전환할 때 장갑을 교체하십시오.
5. 현탁 세포주 작업
- 유리 플라스크에서 성장한 현탁액 세포의 경우 장갑에 70% EtOH를 완전히 뿌린 다음 젖은 장갑으로 알루미늄 호일을 만지고 플라스크 바닥만 분무한 후 캐비닛 안에 넣습니다.
- 세포 계수를 위해 샘플을 채취할 때 용기에서 1.5mL 튜브 하나만 제거합니다. 다른 튜브를 만지지 마십시오. 작업 표면에 캡을 거꾸로 놓습니다. 안쪽 테두리를 만지지 마십시오. 측면에서 조심스럽게 다루고 완료되면 교체하십시오.
- 플라스크의 목 전체를 덮고 있는 두 번 접힌 알루미늄 호일 조각을 조심스럽게 제거합니다. 호일이 벗겨지면 유리 플라스크를 바닥에서만 다루고 목에서 만지지 마십시오. 1mL 혈청학적 피펫을 사용하여 세포 계수를 위한 샘플을 채취합니다.
- 미디어가 플라스크 측면으로 떨어지지 않도록 하십시오. 그렇다면 종이 타월에 70% EtOH를 뿌리고 즉시 청소하십시오.
- 생물학적 안전 캐비닛에서 병이나 플라스크를 제거하기 전에 캡과 알루미늄 호일이 조여졌는지 확인하십시오.
6. 세포 배양
- 서로 다른 세포 유형에 대해 별도의 인큐베이터를 사용하여 서로 다른 세포 유형의 교차 오염을 방지합니다.
7. 액체 폐기물 수집
- 캐비닛 외부에 있는 진공 트랩 플라스크에 '폐기물'이라고 표시된 보조 용기에 액체 폐기물을 수집합니다.
알림: 호스는 매월 교체되는 고효율 미립자 흡수(HEPA) 필터에 연결됩니다.
8. 정리
- 생물학적 위험 폐기물 봉투를 제거하고 가능한 한 빨리 유리 플라스크를 세척하십시오. 싱크대 옆에서 유리 세척 프로토콜을 유지하십시오. 보충 참조 file 세척 프로토콜에 대한 1.
- 세포 배양 유리 제품을 유리 세척 시설로 보내는 대신 오토클레이브하십시오. 실험실의 주요 영역에 있는 유리 제품과 분리하여 보관하십시오.
알림: SF-9 세포는 유리를 잘 문지르지 않으면 플라스크 측면에 죽은 세포 테두리를 남깁니다. 오토클레이브 프로토콜에 대한 보충 파일 1 을 참조하십시오.
9. 조직
- 모든 공급품이 한 영역에 위치하도록 세포 배양실을 구성하여 실험실 구성원이 공급품을 찾기 위해 방을 떠날 필요성을 최소화합니다.
- 세포를 수확하는 데 사용되고 나중에 세포 배양에 재사용되는 모든 플라스틱 병에 '세포 배양 전용'이라는 라벨을 붙입니다. 하나의 특정 세포 유형에 대해 지정된 세포 배양 병을 사용하십시오. 쉽게 접근할 수 있도록 병을 세포 배양실에 보관하십시오.
10. 박테리아, 곰팡이 및 마이코플라스마 오염 식별
알림: 위의 워크플로를 따르지 않으면 박테리아, 곰팡이 및 마이코플라스마 오염이 발생할 수 있습니다.
- 작업을 시작하기 전에 항상 플라스크에서 무거운 탁도, 퍼지 볼 형태의 추가 성장 및 측면에 조밀 한 세포 축적이 있는지 관찰하십시오.이 모든 것이 오염의 지표입니다.
참고: 숙련된 눈으로 미생물 오염으로 인한 탁도와 실제 세포의 차이를 알 수 있습니다. 세포는 일반적으로 맑은 배지를 흐리게 보이게 하는 반면, 박테리아 오염은 흰색으로 심한 탁도를 유발합니다.- 매체에 떠 있는 둥글고 흐릿한 공의 모양을 확인하여 곰팡이 오염을 시각적으로 식별합니다( 그림 2 참조).
- 매체가 흐리거나, 흰색이거나, 난류인 경우 박테리아 오염을 시각적으로 식별합니다( 그림 2 참조).
- 매월 마이코플라스마 검사를 실시하여 마이코플라스마 오염을 확인합니다. 한 PCR 기반 테스트는 사용자에게 1.5mL의 세포 샘플을 채취하고, 10μL를 사용하여 세포 계수를 수행하고, 0.08 x 106 cells/mL로 희석하고, 세포를 스핀다운하고, 키트에 포함된 버퍼를 사용하여 세포를 용해하고, 마지막으로 한 번 스핀다운하도록 지시합니다. 상청액은 다양한 마이코플라스마 종을 증폭하는 프라이머와 함께 배양됩니다. DNA 젤을 실행하여 밴드를 시각화합니다. 밴드가 없다는 것은 마이코플라스마가 확인되지 않았다는 것을 의미합니다.
알림: 이 주요 오염 물질은 사람의 입에 존재할 수 있습니다. 세포를 해동한 후와 실험에 사용하기 전에 세포의 마이코플라스마 오염 여부를 테스트하는 것이 좋습니다. 그 후, 한 달에 한 번 마이코플라스마 오염에 대해 세포를 모니터링합니다. 많은 회사들이 마이코플라스마 테스트 키트를 제공합니다. 적합한 것을 선택하십시오.
결과
이 백서에 설명된 적절한 세포 배양 기술과 관행을 따르지 않으면 연구 세포 배양 실험실에서 곰팡이 및 박테리아에 의한 오염이 발생할 수 있습니다. 그림 2 는 현탁액과 부착 배양 모두에서 오염을 포함하는 플라스크를 보여줍니다.
무균 기술을 따르지 않으면 2-3일 후에 곰팡이 오염이 발생할 수 있습니다. 매체에 떠 있는 둥근 퍼지 볼은 현탁 세포에서 눈에 띄는 반면, 부착된 세포에서 곰팡이 성장은 크고 불규칙하며 흰색 또는 녹색 패치로 관찰될 수 있습니다.
박테리아의 경우 다음날 오염이 관찰됩니다. 미디어는 난류, 흰색, 흐림입니다. 흰색은 세포주보다 훨씬 빠르게 증식하는 박테리아 세포의 전형입니다. 숙련 된 눈은 오염되지 않은 미디어와 오염 된 미디어의 차이점을 알 수 있습니다. 부착 된 세포의 경우 개봉하지 않은 배지 병을 플라스크와 비교하여 플라스크에 난류가 보이는지 확인할 수 있습니다.
생물 안전 캐비닛 내부에는 품목 수를 최소한으로 유지해야 합니다. 후면 및 전면 그릴에 물건을 올려 놓지 마십시오(그림 3 참조). 이 캐비닛에는 피펫 세트, 팁, 오토클레이브 유리 피펫, 피펫 보조 장치 및 마커가 내부에 있습니다. 중간의 작업 영역이 깨끗합니다. 이런 식으로 캐비닛을 정리하는 것이 좋습니다. 또한 작업자는 작업을 시작하기 전에 깨끗한 실험복과 장갑을 착용해야 합니다. 작업자가 장갑을 자주 뿌릴 수 있도록 70% EtOH가 함유된 스프레이 병을 가까이에 두어야 합니다. 피부는 장갑이나 실험복으로 덮여 있습니다. 작업자는 캐비닛 내부에서 작업할 때 팔이 90° 각도가 되도록 의자를 조정해야 하며 캐비닛 내부에서 품목이 쉽게 닿을 수 있어야 합니다(그림 4 참조).
많은 종류의 마이코플라스마는 PCR 기반 분석을 사용하여 확실하게 식별할 수 있습니다. 그림 5 는 마이코플라즈마 검사에서 음성으로 나온 결과입니다. 왼쪽의 밴드는 DNA의 분자량 표준을 나타냅니다. 오른쪽에 있는 4개의 밴드는 양성 대조군입니다. 마이코플라스마가 검출되지 않았기 때문에 테스트된 세포 유형에는 밴드가 나타나지 않습니다.
배지에 pH 표시기가 포함되어 있으면 7.4에서 세포의 최적 pH 값에 대해 빨간색으로 표시됩니다. 세포가 자라면 배지의 색이 빨간색에서 노란색으로 바뀝니다3. 이 색상 변화는 박테리아가 플라스크를 점령하고 과도하게 자라는 경우에도 발생할 수 있습니다(그림 6). 노란색은 pH가 낮음을 나타냅니다. 플라스크 옆에 개봉하지 않은 새 배지 병을 관찰하는 것은 부착된 세포의 오염을 관찰하는 객관적인 방법입니다. 현탁 배양의 경우, 사용자는 플라스크에서 배지에 떠 있는 성장이 있는지 또는 유리 플라스크 내부에 자란 박테리아 세포의 두꺼운 고리가 존재하는지 여부를 면밀히 관찰할 수 있습니다. 두 세포 유형 모두 작은 샘플을 채취하여 현미경으로 관찰할 수 있습니다. 다른 성장 또는 세포 모양이 관찰되는 경우, 특히 세포가 움직이는 경우 이는 오염의 지표입니다 (그림 7). 이러한 유형의 파편은 세포 배양 자체가 아닌 혈구계에만 존재할 수 있으므로 세포 계수 전에 혈구계의 철저한 세척을 수행해야 합니다.
냄새는 인큐베이터의 오염을 나타내는 또 다른 지표 일 수 있습니다. 박테리아 과증식은 숙련된 세포 배양 사용자가 알아차릴 수 있는 전형적인 냄새를 가지고 있습니다. 냄새는 항상 오염 된 플라스크와 일치하지만, 감염된 플라스크 하나가 항상 전체 인큐베이터에서 냄새를 맡는 것은 아닙니다.
곰팡이 오염은 현탁액에서 성장한 HEK 293 S 세포에서 더 많이 발생하는 경향이 있습니다. 박테리아 오염은 SF-9 세포에서 더 흔합니다. 이는 RIC 세포가 습도와 함께 성장하여 인큐베이터에 수분이 축적되기 때문일 수 있습니다. SF-9 세포는 습도 없이 성장하므로 환경이 더 건조합니다. 부착 배양의 오염률은 현탁 배양의 오염률보다 낮습니다. 이는 플라스크 크기가 작거나, 플라스크의 재사용이 불가능한 특성 또는 알루미늄 호일을 사용하는 대신 통풍이 잘되는 캡 때문일 수 있습니다.
마이코플라스마는 육안이나 일반 광학 현미경으로는 관찰할 수 없지만 특수 투과 전자 현미경으로 마이코플라스마를 검출할 수 있습니다. 마이코플라스마 식별 키트를 사용하여 매월 세포 배양을 테스트해야 합니다. 많은 종류의 마이코플라스마는 PCR 기반 분석을 사용하여 확실하게 식별할 수 있습니다. 이 PCR 검사가 수행되는 방법에 대한 간략한 설명은 프로토콜 섹션에서 찾을 수 있으며 마이코플라스마에 대한 자세한 내용은 토론 섹션에서 찾을 수 있습니다.
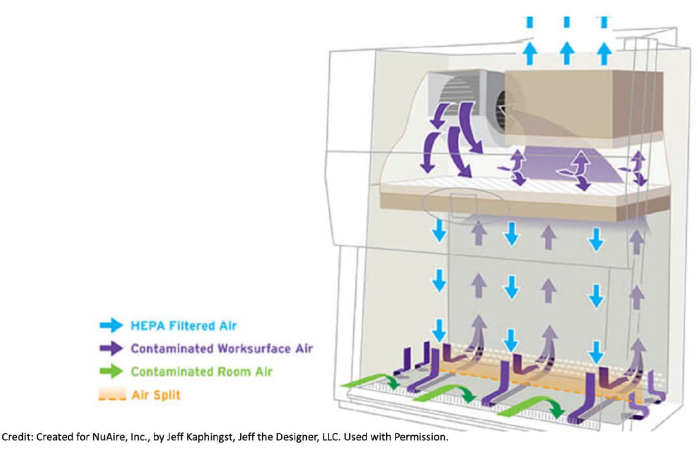
그림 1: 생물 안전 캐비닛의 공기 흐름 방식. 생물 안전 캐비닛은 전면 및 후면 그릴을 통해 실내 자체와 캐비닛에서 오염된 공기를 끌어들입니다. 이 공기는 금속 작업 표면 아래, 캐비닛 후면, HEPA 필터가 있는 장치 상단까지 이동합니다. 거기에서 공기는 필터를 통과하여 여과됩니다. 이 깨끗한 공기는 작업 표면을 아래로 밀어냅니다. 여과된 공기의 흐름이 캐비닛 내부로 밀려나는 방식 때문에 호버링하지 않는 것이 좋습니다. 예를 들어, 열린 병 위에 슬리브를 두는 것은 바람직하지 않으며 잠재적인 오염 물질이 매체로 밀려날 위험이 있습니다. 캐비닛 내부로 가져오는 품목의 수는 최소한으로 유지해야 하며 공기 흐름을 방해하지 않도록 전면 또는 후면 그릴에 품목을 올려 놓지 마십시오. 캐비닛 안팎으로 팔을 너무 빨리 움직이면 공기 흐름이 방해받을 수 있습니다. NuAire, Inc.를 위해 Jeff Kaphingst, Jeff the Designer, LLC가 제작했습니다. 허가를 받아 사용함. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 오염되지 않은 현탁액과 부착 세포 및 곰팡이 또는 박테리아로 오염된 세포. 왼쪽의 첫 번째 이미지에는 오염되지 않은 곤충 세포(SF-9 세포)가 포함되어 있습니다. 두 번째 이미지는 곰팡이로 오염 된 이들 세포의 또 다른 플라스크를 보여줍니다. 세 번째 플라스크는 두껍고 흰색이며 흐린 모양으로 알 수 있듯이 박테리아에 의해 오염되었습니다. 두 번째 및 세 번째 플라스크는 적절한 세포 배양 기술과 관행을 따르지 않았기 때문에 오염되었습니다. 모든 플라스크는 같은 날에 준비되었습니다. 박테리아 오염에 대해서는 다음날에, 곰팡이 오염에 대해서는 2일 후에 성장이 관찰되었습니다. 오염되지 않은 부착 세포(Hek293 세포)는 부착 배양에서 곰팡이 및 박테리아 오염과 함께 표시됩니다. 곰팡이 오염은 둥근 페트리 접시의 두 번째 줄에 표시됩니다. 사진은 접시 상단에서 찍은 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 세포 배양 캐비닛 구성. 생물 안전 캐비닛 내부에는 품목의 양을 최소한으로 유지해야 합니다. 후면과 전면 그릴에 물건을 올려놓는 것은 피해야 합니다. 이 캐비닛에는 피펫 세트, 팁, 오토클레이브 유리 피펫, 피펫 보조 장치 및 마커가 내부에 있습니다. 중간의 작업 영역이 깨끗합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 작업자가 플로우 후드 아래에서 작업하는 올바른 방법. 작업자는 작업을 시작하기 전에 깨끗한 실험복과 장갑을 착용해야 합니다. 작업자가 장갑을 자주 뿌릴 수 있도록 70% EtOH가 함유된 스프레이 병을 가까이에 두어야 합니다. 피부는 장갑이나 실험복으로 덮여 있습니다. 작업자는 캐비닛 내부에서 작업할 때 팔이 90° 각도가 되도록 의자를 조정해야 합니다. 품목은 캐비닛 내부에 쉽게 닿을 수 있는 곳에 있어야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 마이코플라스마 검사 결과 음성. 많은 종류의 마이코플라스마는 PCR 기반 분석을 사용하여 확실하게 식별할 수 있습니다. 왼쪽의 밴드는 DNA의 분자량 표준을 나타냅니다. 오른쪽에 있는 4개의 밴드는 양성 대조군입니다. 마이코플라스마가 검출되지 않았기 때문에 테스트된 세포 유형에는 밴드가 나타나지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 일반 용지 색상이 빨간색에서 노란색으로 변경됩니다. 세포 배양 배지는 pH 지표가 있는 경우 빨간색에서 노란색으로 색상을 변경합니다. 노란색은 pH가 낮고 매체를 교체해야 함을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 광학 현미경으로 관찰한 오염 물질. 세포 수를 수행하는 동안 광학 현미경으로 다른 성장 또는 세포 모양이 관찰되면 이는 오염의 지표가 될 수 있습니다. 이러한 유형의 파편은 세포 배양 자체가 아닌 혈구계에만 존재할 수 있으므로 세포 계수 전에 혈구계의 철저한 세척을 수행해야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1: 부록 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
오염은 세포 배양 작업을 수행할 때 주요 관심사 중 하나이지만, 이 원고에 요약된 관행과 기술은 위험을 완화하는 데 도움이 될 것입니다. 중요한 단계에는 세포 배양실에서만 사용되는 깨끗한 실험실 코트 착용, 70% EtOH가 자주 분사되고 세포주 간 전환 시 교체되는 깨끗한 분말 없는 장갑 사용, 각 개인이 배지 병을 공유하지 않도록 권장, 작업 완료 전후에 캐비닛을 철저히 청소하는 것이 포함됩니다. 혈청학적 피펫의 포장을 깔끔하게 풀고, 열린 병이나 플라스크와의 장기간 밀접한 접촉을 피하고, 여러 세포주 간에 배지 병을 공유하지 않고, 인큐베이터 도어를 빠르게 열고 닫습니다. 또한 자신의 유리 제품을 세척하고 고압 증기 멸균하여 품질 관리를 보장하여 외부 오염 물질이 유입 될 가능성을 줄입니다. 품질 관리 방법에는 오토클레이브 테이프를 사용하여 멸균기가 121°C의 적절한 온도에 도달했는지 표시하고, 장비를 정기적으로 예방 유지 관리하고, 플라스크가 제대로 문질러졌는지 육안으로 검사하는 것이 포함됩니다(18). 또 다른 중요한 점은 서로 다른 세포 유형에 대해 별도의 인큐베이터를 사용하여 한 세포 유형의 오염이 다른 세포 유형으로 전달되지 않도록 하고 세포와의 교차 오염이 발생하지 않도록 하는 것입니다.
박테리아 및 곰팡이 감염은 세포 배양에서 가장 흔한 두 가지 침입자입니다. 주요 오염 물질 중 하나인 M. orale은 인간의 입에서 가장 흔한 마이코플라스마 종이며 또한 "세포 배양에서 모든 마이코플라스마 감염의 20%-40%를 차지하는 가장 흔한 단일 분리주를 나타냅니다"4. 즉, 실험실 직원이 이러한 오염의 주요 원인입니다. 마이코플라스마는 0.45μm필터를 통과할 수 있는 단단한 세포벽이 없는 작고 느리게 성장하는 미생물이기 때문에 세포 배양실에서 항상 우려되는 사항입니다4. 연구에 따르면 마이코플라스마 오염 발생률은 인간 또는 동물 세포주의 15%-35%이다4. 또한 통계에 따르면 전 세계 세포주의 약 5%에서 30%가 마이코플라스마에 오염되어 있다6. 안타깝게도 마이코플라스마는 세포 배양에 사용되는 대부분의 항생제에 내성이 있으며 감염은 세포 생리 및 신진대사에 영향을 미칠 수 있습니다 4,6. 오염이 세포 대사를 늦추지는 않지만 최종 생성물을 오염시킬 수 있다6. 감염은 실험실 구성원이 세포 손상을 알아차리지 못한 채 계속 남아 있을 수 있습니다. 오염이 발생하면 새로운 세포를 해동하는 데 드는 비용, 새로운 배양물을 전파하는 데 소요되는 시간, 낭비된 값비싼 배지, 인큐베이터의 오염 제거, 동료들이 실험을 다시 시작하기 위해 기다리는 데 소요되는 시간이 엄청납니다. 우리 연구실은 총 손실 시간이 2 주를 차지하고 8 L의 전형적인 인간 포유류 세포 단백질 발현의 오염과 관련된 총 비용은 $ 1,400입니다. 이 원고에 요약된 관행과 기술은 추가 비용, 세포 손실 및 가동 중지 시간을 완화하기 위한 좋은 예방 조치를 제공합니다.
이러한 관행을 수정하는 것은 권장되지 않습니다. 모든 실험실 구성원은 세포 배양실에서 일하기 전에 교육을 받은 후 매년 재교육을 받아야 한다7. 실험실 구성원은 또한 필요한 모든 공급품이 한 영역에 있도록 세포 배양실을 구성하여 실험실 구성원이 공급품을 찾기 위해 세포 배양실을 나갈 필요성을 최소화해야 합니다.
혈청, 인큐베이터, 오작동하는 오토클레이브, 더러운 실험실 코트 또는 세포 공급원과 같은 외부 소스에서 오염이 발생하는 경우 제시된 기술의 한계가 관찰됩니다. 이 프로토콜을 엄격하게 준수함에도 불구하고 오염이 발생하는 경우 기술 문제 해결이 필요할 수 있습니다. 많은 외부 요인이 이러한 유형의 오염에 기여할 수 있습니다. 실험실 구성원은 신중하고 외부 소스를 확인해야 합니다. 예를 들어, 공급업체로부터 구입한 많은 양의 소 태아 혈청(FBS)이 마이코플라스마로 오염되었을 수 있습니다. 1950 년대와 비교하면 지금은 드물게 발생하지만 여전히 발생할 수 있습니다6. 오염이 발견되면 모든 배지 병을 버려야 하며, 새 세포를 해동하고 새 배지를 사용하여 프로토콜을 다시 시작해야 합니다. 곰팡이나 박테리아인 경우 인큐베이터 내부에 오염이 이미 존재했을 수 있습니다. 동일한 인큐베이터 내부의 다른 플라스크는 박테리아 또는 곰팡이 성장이 관찰되는지 확인해야 합니다. 오염 된 모든 플라스크를 버리고 인큐베이터의 오염을 제거해야합니다. 오염이 발견되지 않으면 오토클레이브에 오작동 오류가 있는지 확인해야 합니다. 유리 제품은 처음부터 제대로 고압 멸균되지 않았을 수 있습니다. 오토클레이브 테이프는 오토클레이브가 121°C에 도달하지 않더라도 색상이 변할 수 있습니다. 그 후, 사용된 항생제 용액의 만료 날짜를 확인해야 합니다. 새로운 솔루션을 구입해야 할 수도 있습니다. 마지막으로 세포의 출처를 고려해야 합니다. 신뢰할 수 있는 실험실 공급업체에서 제공했습니까, 아니면 다른 실험실에서 빌린 것입니까? 세포는 항상 신뢰할 수 있는 실험실 공급업체에서 구입해야 하며 다른 실험실에서 빌려서는 안 됩니다. 마지막으로, 실험복은 청결을 위해 세탁해야 한다19. 인큐베이터의 오염 제거는 플라스크가 오염 될 때마다 고려해야합니다. 박테리아, 세포 또는 곰팡이 포자가 증식하여 오염을 계속 퍼뜨리지 않도록 해야 합니다.
기존 방법은 오염 제거를 반영합니다. 이 원고에 요약된 방법은 오염 제거보다는 예방에 중점을 둡니다. 마이코플라스마20을 제거하기 위해 항생제를 사용하는 것과 관련된 몇 가지 절차가 있습니다. 그러나 항생제의 사용은 감염을 완전히 제거하지 못할 수 있고 "내성 유기체가 발달하도록 허용할 수 있기 때문에" 위험합니다.12. 사실, "항생제에서 지속적으로 성장한 배양액의 72%가 마이코플라스마 양성인 것으로 나타났고, 항생제가 없는 상태에서 성장한 배양균은 7%만이 감염되었습니다"12. 이 데이터는 항생제 사용이 권장되고 도움이 될 수 있지만 항생제 남용 또는 완전한 의존은 유익하지 않다는 생각을 강조합니다. 또한 오염을 제거하기 위해 항생제를 사용하면 문제가 지속될 수 있습니다. 항생제 용액은 필요하지 않습니다. 이 백서의 기술을 따르면 오염을 성공적으로 방지해야 합니다.
이 원고에 요약된 관행과 기술은 향후 월간 마이코플라스마 검사를 수행할 때와 수제 유능한 박테리아 세포를 만들 때 무균 환경을 유지하는 데 사용할 수 있습니다. 두 프로토콜 모두 최종 제품이 오염되지 않도록 세포 배양 작업과 유사한 깨끗한 환경이 필요합니다.
공개
저자는 상충되는 이해 관계가 없습니다.
감사의 말
이 작업은 Howard Hughes Medical Institute(HHMI)의 자금 지원 덕분에 가능했습니다. 원고를 읽고 지속적인 지원을 해주신 연구실장인 Jue Chen, 도움이 되는 편집과 의견을 주신 Donna Tallent, 이 원고의 비디오 구성 요소에 도움을 주신 Rockefeller University 정보 기술과의 Jeff Hennefeld에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| DPBS | Gibco | 14-190-144 | |
| DMEM F-12 Media | ATCC | 30-2006 | |
| Glass Baffled Flask | Pyrex | 09-552-40 | |
| Glass Pipettes | Fisher | 13-678-6B | |
| Pipette Aid | Drummond | 13-681-15A | |
| Serological Pipette | Corning | 07-200-573 | |
| T75 flask | Corning | 07-202-004 | |
| Trypsin | Gibco | 25-300-054 | |
| *Items may vary because this video is about general cell culture techniques |
참고문헌
- Johnson, Z. L., Chen, J. Structural basis of substrate recognition by the multidrug resistance protein MRP1. Cell. 168 (6), 1075-1085 (2017).
- Capes-Davis, A., et al. Cell lines as biological models: practical steps for more reliable research. Chemical Research in Toxicology. 32 (9), 1733-1736 (2019).
- Segeritz, C. P., Vallier, L. Cell culture: growing cells as model systems in vitro. Basic Science Methods for Clinical Researchers. , 151-172 (2017).
- Drexler, H. G., Uphoff, C. C. Mycoplasma contamination of cell cultures: Incidence, sources, effects, detection, elimination, prevention. Cytotechnology. 39 (2), 75-90 (2002).
- Lincoln, C. K., Gabridge, M. G. Cell culture contamination: sources, consequences, prevention, and elimination. Methods in Cell Biology. 57, 49-65 (1998).
- Nikfarjam, L., Farzaneh, P. Prevention and detection of mycoplasma contamination in cell culture. Cell Journal. 13 (4), 203-212 (2012).
- Stacey, G. N. Cell culture contamination. Methods in Molecular Biology. 731, 79-91 (2011).
- Young, L., Sung, J., Stacey, G., Masters, J. R. Detection of Mycoplasma in cell cultures. Nature Protocols. 5 (5), 929-934 (2010).
- Barth, O. M., Majerowicz, S. Rapid detection by transmission electron microscopy of mycoplasma contamination in sera and cell cultures. Memorias do Instituto Oswaldo Cruz. 83 (1), 63-66 (1988).
- Mirabelli, P., Coppola, L., Salvatore, M. Cancer cell lines are useful model systems for medical research. Cancers. 11 (8), 1098 (2019).
- A cell culture master class: What your cells wish they could tell you. Science Available from: https://www.science.org/content/webinar/cell-culture-master-class-your-cells-wish-they-could-tell-you (2020)
- Langdon, S. P. Cell culture contamination: an overview. Methods in Molecular Medicine. 88, 309-317 (2004).
- Babic, Z., et al. Meta-research: Incidences of problematic cell lines are lower in papers that use RRIDs to identify cell lines. eLife. 8, e41676 (2019).
- Visconti, P., et al. Short tandem repeat profiling for the authentication of cancer stem-like cells. International Journal of Cancer. 148 (6), 1489-1498 (2021).
- Horbach, S. P. J. M., Halffman, W. The ghosts of HeLa: How cell line misidentification contaminates the scientific literature. PLoS One. 12 (10), 0186281 (2017).
- Why 70% isopropyl alcohol is a better disinfectant than 99% isopropyl alcohol when it comes to Covid-19. MunGlobal Available from: https://munglobal.com.au/resources/knowledge-base/pathogens/why-70-isopropyl-alcohol-is-a-better-disinfectant-than-99-isopropyl-alcohol/#:~:text=Due%20to%20the%20concentration%20difference (2023)
- United States Department of Agriculture. Processing and Safety. Food Safety Publications Available from: https://www.ars.usda.gov/ARSUserFiles/60701000/FoodSafetyPublications/p328.pdf (2004)
- Sterilizing Practices. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/infectioncontrol/guidelines/disinfection/sterilization/sterilizing-practices.html (2023)
- Coté, R. J. Aseptic technique for cell culture. Current Protocols in Cell Biology. , (2001).
- Uphoff, C. C., Drexler, H. G. Eradication of Mycoplasma contamination from cell cultures. Current Protocols in Molecular Biology. 106, 1-12 (2014).
- Bykowski, T., Stevenson, B. Aseptic technique. Current Protocols in Microbiology. 56 (1), e98 (2020).
- How a Class II, Type A2 Biosafety Cabinet Works. Nuaire Available from: https://www.nuaire.com/resources/class-ii-type-a2-biosafety-cabinet-how-it-works-article (2020)
- Phelan, K., May, K. M. Mammalian cell tissue culture techniques. Current Protocols in Pharmacology. 73, 1-23 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유