Method Article
Tecniche e pratiche di coltura cellulare per evitare la contaminazione da funghi e batteri nel laboratorio di coltura cellulare di ricerca
In questo articolo
Riepilogo
Questo protocollo presenta le tecniche e le pratiche essenziali di coltura cellulare da utilizzare nel laboratorio di coltura cellulare di ricerca per evitare la contaminazione da funghi e batteri. All'interno della categoria dei batteri, particolare enfasi sarà posta sulla prevenzione della contaminazione da micoplasma.
Abstract
La coltura cellulare è un'abilità delicata necessaria per la crescita di cellule umane, animali e di insetti, o altri tessuti, in un ambiente controllato. L'obiettivo del protocollo è quello di sottolineare le corrette tecniche utilizzate in un laboratorio di ricerca per prevenire la contaminazione da funghi e batteri. Particolare enfasi è posta sull'evitare la contaminazione da micoplasma, una delle principali preoccupazioni nella sala di coltura cellulare a causa delle sue piccole dimensioni e della resistenza alla maggior parte degli antibiotici utilizzati per la coltura cellulare. Queste stesse tecniche assicurano una crescita continua e mantengono le cellule sane. Sia per gli utenti nuovi che per quelli esperti, è importante aderire costantemente a queste migliori pratiche per mitigare il rischio di contaminazione. Una volta all'anno, i laboratori dovrebbero rivedere le migliori pratiche di coltura cellulare e seguire con una discussione o una formazione aggiuntiva, se necessario. Agire tempestivamente per prevenire la contaminazione in primo luogo farà risparmiare tempo e denaro, rispetto alla pulizia dopo che si è verificata la contaminazione. Le migliori pratiche universali mantengono sane le colture cellulari, riducendo così la necessità di scongelare costantemente nuove cellule, acquistare costosi terreni di coltura cellulare e ridurre la quantità di decontaminazione e tempi di fermo dell'incubatore.
Introduzione
La coltura cellulare ha molti usi nel laboratorio di ricerca. Fin dalle origini della coltura cellulare all'inizio del 20 ° secolo, le linee cellulari hanno contribuito a far progredire la scienza. Le linee cellulari hanno diversi vantaggi; Varie linee cellulari possono aiutare i ricercatori a studiare la biologia cellulare, produrre baculovirus per ulteriori studi o produrre grandi quantità di una proteina di interesse, per citarne alcune1. Alcuni usi aggiuntivi includono lo studio della crescita dei tessuti, contribuendo a far progredire lo sviluppo di vaccini, la ricerca tossicologica, lo studio del ruolo dei geni negli organismi sani e nei modelli malati e la produzione di linee cellulari ibride 2,3. Le linee cellulari possono anche consentire la produzione di farmaci3. Sono necessarie tecniche asettiche adeguate quando si lavora con linee cellulari; Le pratiche e le tecniche descritte in questo manoscritto sono applicabili ai laboratori di ricerca in cui viene eseguito il lavoro di coltura cellulare. Altre impostazioni di laboratorio non sono discusse.
La contaminazione è spesso la preoccupazione principale quando si esegue il lavoro di coltura cellulare. Nel contesto di questo documento, la contaminazione si riferisce generalmente a funghi e batteri. L'obiettivo generale del metodo delineato in questo documento è quello di descrivere in modo approfondito le migliori pratiche per evitare la contaminazione. Tutti i membri del laboratorio dovrebbero aderire a queste pratiche quando lavorano nella sala di coltura cellulare di un laboratorio di ricerca. I laboratori dovrebbero garantire che tutti i lavoratori partecipino attivamente all'utilizzo di queste migliori pratiche per prevenire la contaminazione. La conoscenza delle pratiche e delle tecniche corrette contribuirà a garantire che le colture cellulari rimangano vitali, sane e prive di contaminazioni. Lo sviluppo di questa tecnica si basa sulla ricerca della letteratura, sette anni di esperienza di lavoro con colture cellulari e la necessità di un metodo a cui sia i principianti che gli esperti di colture cellulari possano fare riferimento su base annuale.
C'è bisogno di una tecnica chiara e standardizzata che tutti i laboratori di colture cellulari di ricerca dovrebbero seguire. Gran parte della letteratura sulla contaminazione da colture cellulari discute la rilevazione di micoplasma, tecniche asettiche, fonti di contaminazione, eliminazione di contaminanti e prevenzione mediante l'uso di antibiotici e test regolari 4,5,6,7,8. Mentre queste informazioni sono utili, non ci sono video presenti in letteratura che dimostrano le corrette tecniche di coltura cellulare da seguire. Il vantaggio delle pratiche presentate rispetto alle tecniche alternative è l'attenzione alla prevenzione della contaminazione prima che accada, piuttosto che rilevare e correggere gli errori in seguito. Inoltre, una dimostrazione approfondita delle tecniche asettiche, una discussione sulla prevenzione della crescita di funghi e batteri e informazioni sul flusso d'aria dell'armadio di biosicurezza sono preziose sia per i principianti che per gli esperti di colture cellulari.
Batteri e funghi sono i due tipi più comuni di contaminanti. All'interno della categoria dei batteri, il micoplasma è una delle principali preoccupazioni a causa delle sue piccole dimensioni e della capacità di proliferare rimanendo inosservato. Sono organismi autoreplicanti senza parete cellulare rigida che si basano su cellule eucariotiche per crescere. Hanno ridotte capacità metaboliche e possono moltiplicarsi notevolmente pur rimanendo non riconosciuti nell'ispezione visiva di routine delle colture cellulari e nelle regolari analisi microscopiche, sebbene la microscopia elettronica a trasmissione possa rilevare il micoplasma 9,10. Inoltre, possono passare attraverso filtri microbiologici10. Il terreno di coltura cellulare fornisce al micoplasma sostanze nutritive, anche se sfortunatamente l'integrazione dei terreni con antibiotici non influisce sul micoplasma10. Si dovrebbe notare che, in generale, non è necessario integrare i media con antibiotici; Le tecniche adeguate dovrebbero essere sufficienti per tenere a bada la contaminazione. L'infezione da micoplasma non porta alla morte cellulare immediata, ma è preoccupante per i ricercatori in quanto influisce sulla riproducibilità e sulla qualità dei dati.
Tutto il personale di laboratorio deve attenersi rigorosamente alle buone pratiche di coltura cellulare. Le colture dovrebbero essere testate per il micoplasma dopo che sono state appena acquistate, mentre sono attualmente in fase di coltivazione, prima della crioconservazione e quando sono scongelate dall'azoto liquido 2,10. Sul mercato sono disponibili diversi test che utilizzano la reazione a catena della polimerasi (PCR), il saggio immunoassorbente enzimatico (ELISA) o l'immunocolorazione. 3 La letteratura indica che "gli isolati umani rappresentano una grande percentuale dei contaminanti del micoplasma presenti nelle colture cellulari"5. Sebbene siano state descritte più di 200 specie di micoplasmi, circa sei di queste rappresentano la maggior parte delle infezioni. Queste sei specie sono M. arginini, M. fermentans, M. hominis, M. hyorhinis, M. orale e Acholeplasma laidlawii10. Come per altri tipi di contaminazione, l'aria e gli aerosol li portano in colture cellulari5. Questo è riecheggiato in altri articoli poiché "l'operatore umano è potenzialmente il più grande pericolo in laboratorio"7. Sebbene ciò avvenga attraverso l'errore umano, il rischio può essere eliminato se viene seguita una procedura standard. Lo spargimento da parte del personale non è limitato alla sola contaminazione da micoplasma; Le colture cellulari in un laboratorio sono generalmente infettate dalla stessa specie di micoplasma, il che indica che la contaminazione si diffonde da un matraccio all'altro a causa di tecniche di coltura cellulare improprie10.
La prevenzione della contaminazione incrociata è anche un altro motivo per cui dovrebbero essere seguite adeguate tecniche di coltura cellulare. Si noti che almeno il 15%-18% delle linee cellulari in tutto il mondo può essere contaminato o erroneamente identificato11,12. Oltre a testare le linee cellulari per la contaminazione da micoplasma, dovrebbero anche essere testate per la contaminazione incrociata10. Per le linee cellulari umane, l'autenticazione della linea cellulare mediante una tecnica economica basata sul DNA chiamata short tandem repeat (STR) è l'attuale standard internazionale di riferimento, in quanto è un modo semplice per confermare l'identità della linea cellulare 2,10,13,14. STR può identificare linee cellulari erroneamente etichettate o contaminate incrociate, ma non può rilevare l'origine errata del tessuto10,13,14. La validità dei dati di ricerca può essere compromessa se le linee cellulari sono etichettate in modo errato, identificate erroneamente o contaminate13. Analogamente ad altri tipi di contaminazione, la contaminazione incrociata può verificarsi a causa di una tecnica scadente che causa la diffusione di aerosol, un contatto errato che porta al tipo di cellula sbagliato che entra in un pallone o utilizza lo stesso flacone di supporto e reagenti con linee cellulari diverse10. Non dovrebbe verificarsi alcuna condivisione di bottiglie multimediali; La condivisione di una bottiglia di terreno tra due diverse linee cellulari può consentire a quelle popolazioni cellulari di essere mescolate, portando il tipo di cellula a crescita più rapida a prendere completamente il controllo del pallone. Questa sostituzione non è evidente e porta a errori di etichettatura e identificazione errata2. Una linea cellulare può anche essere scambiata per un'altra se le colture vengono confuse durante la manipolazione o l'etichettatura10. Si dovrebbe prestare particolare attenzione a mantenere i reagenti, i mezzi e i palloni separati l'uno dall'altro. Ogni membro del laboratorio dovrebbe avere le proprie bottiglie di supporto; Non deve verificarsi alcuna condivisione tra i membri del lab. Le linee cellulari stesse dovrebbero essere acquistate da una banca cellulare qualificata e da un fornitore. I laboratori non dovrebbero condividere le cellule. Gli studi dimostrano che, sebbene i test STR e micoplasma siano regolarmente utilizzati, molti articoli di ricerca in letteratura hanno già utilizzato linee cellulari identificate erroneamente o contaminate15. Spulciare la ricerca per trovare questi documenti problematici e informare retroattivamente i lettori su questo argomento è ingombrante. La prevenzione è il modo migliore per garantire che questo problema non si verifichi in primo luogo.
La semplice azione di spruzzare articoli con il 70% di EtOH può uccidere gli organismi; Il 70% di EtOH agisce denaturando le proteine e sciogliendo i lipidi negli organismi più comunemente contaminanti, inclusi batteri e funghi16. Gli studi hanno dimostrato che il 70% è la concentrazione più efficace; le proteine di superficie non coagulano rapidamente con il 70% di EtOH quindi possono entrare nella cellula, mentre l'acqua che contiene è necessaria per il processo di denaturazione delle proteine. A causa della differenza di concentrazione di acqua e alcol su entrambi i lati della parete cellulare, il 70% di EtOH entra nella cellula per denaturare sia le proteine enzimatiche che strutturali. Se si osserva la crescita di muffe in palloni, l'intera incubatrice deve essere decontaminata spruzzandola prima con il 70% di EtOH e asciugandola, seguita da un'incubazione notturna di 16 ore a 60 °C17. Questo uccide la maggior parte delle muffe e di tutti i batteri.
Il principale vantaggio delle pratiche di prevenzione rispetto alle tecniche alternative di eliminazione della contaminazione dopo che si è verificata è che prevenendo la contaminazione nella fase iniziale, gli operatori di laboratorio possono essere sicuri che le loro colture cellulari siano sane e non ci saranno costi elevati associati alla decontaminazione degli incubatori o allo scarto delle colture cellulari. L'eliminazione dei contaminanti del micoplasma dopo, ad esempio, non è efficiente7. Prendersi il tempo in anticipo per garantire che il personale di laboratorio sia adeguatamente addestrato, la sala di coltura cellulare sia autonoma e venga utilizzata una procedura standard consentirà di risparmiare tempo e denaro.
Protocollo
1. Preparativi
- Generale
- Indossare un camice pulito designato per essere indossato solo nella sala di coltura cellulare e in nessun'altra parte del laboratorio.
NOTA: il camice da laboratorio non deve essere sterile. - Indossare guanti nuovi che non abbiano toccato altre superfici. Assicurati che i guanti aderiscano perfettamente. I guanti in nitrile e senza polvere sono i migliori.
NOTA: I guanti non devono essere sterili. - Per prepararsi al lavoro, spruzzare i guanti, le maniche del camice da laboratorio e l'interno dell'armadio di sicurezza biologica con il 70% di EtOH. Pulire la superficie di lavoro e il pannello di vetro con un tovagliolo di carta privo di lanugine.
NOTA: L'uso del 70% di EtOH uccide i batteri con la massima efficienza16. Il tovagliolo di carta non ha bisogno di essere sterile. - Tenere i bagni d'acqua all'interno della stanza di coltura cellulare e utilizzarli solo per riscaldare i terreni di coltura o scongelare le cellule. Scolare e lavare i bagni d'acqua una volta alla settimana, seguendo le istruzioni del produttore per la pulizia.
- Indossare un camice pulito designato per essere indossato solo nella sala di coltura cellulare e in nessun'altra parte del laboratorio.
- All'interno dell'armadio di sicurezza biologica
- Limitare il numero di elementi portati nell'armadio. Non interrompere il flusso d'aria all'interno dell'armadio di sicurezza biologica bloccando le griglie anteriori o posteriori.
NOTA: vedere la Figura 1 per una spiegazione di come l'aria scorre all'interno di un armadio. - Spruzzare tutti gli articoli posizionati all'interno dell'armadio con il 70% di EtOH e asciugarli. Inizia spruzzando la parte superiore della bottiglia del supporto e lavorando verso il basso. Allo stesso modo, con un tovagliolo di carta pulito, asciugarlo, lavorando progressivamente verso il basso. Non risalire verso il tappo.
- Se l'armadio è abbastanza grande da ospitare pipette sierologiche, possono essere collocate all'interno, altrimenti possono essere conservate in un recipiente montato all'esterno dell'armadio. Controllare su entrambi i lati della pipetta incassata la presenza di fori, strappi o forature nella confezione prima dell'uso. Non strappare l'involucro. Invece, sbucciare delicatamente le estremità dell'involucro, inserire la pipetta sierologica in un ausilio per pipette e rimuovere l'involucro con un movimento fluido.
- Non passare sopra bottiglie o fiaschi aperti; Raggiungere bottiglie o boccette aperte o aprire oggetti sopra le parti superiori di articoli già aperti nell'armadio di sicurezza biologica.
NOTA: Il flusso d'aria all'interno dell'armadio spinge verso il basso sulla superficie di lavoro, quindi qualsiasi contaminazione presente sul manicotto, ad esempio, può entrare nelle colture cellulari. - Non versare liquidi. Invece, aggiungili usando una pipetta sierologica. Dopo aver completato il supporto, mescolare accuratamente il contenuto e inizializzare il flacone. Inoltre, assicurati di includere un'etichetta per ciò con cui è stato integrato il supporto.
- Limitare il numero di elementi portati nell'armadio. Non interrompere il flusso d'aria all'interno dell'armadio di sicurezza biologica bloccando le griglie anteriori o posteriori.
2. Lavorare con linee cellulari aderenti
- Se è necessaria una fiaschetta di plastica, spruzzare l'intero sacchetto e posizionarlo all'interno dell'armadietto.
- Utilizzare pipette di vetro autoclavate o pipette sterili di plastica monouso per aspirare i fluidi o le soluzioni di lavaggio. Rimuovere con attenzione il tappo metallico dal contenitore di stoccaggio. Isolare una pipetta di vetro agitando delicatamente il contenitore ad angolo. Quando si raggiunge il contenitore, evitare di toccare altre pipette.
NOTA: maneggiare la pipetta scelta da una sola estremità. - Sostituire rapidamente i tappi sulle bottiglie il prima possibile. Posizionare i cappucci sul piano di lavoro capovolti in modo che il bordo non tocchi il piano di lavoro. Non afferrare il cappuccio dall'alto o dal basso; Invece, tocca i tappi dai lati.
- Quando si aspirano liquidi, utilizzare un pallone a trappola a vuoto situato all'esterno dell'armadio in un contenitore secondario sul pavimento.
NOTA: Non gettare rifiuti liquidi nei sacchetti per rifiuti a rischio biologico poiché i sacchetti perderanno. I rifiuti verranno creati mentre si lavora all'interno dell'armadio. Muovere le mani dentro e fuori dall'armadio troppo spesso interromperà il flusso d'aria. Lasciare temporaneamente eventuali rifiuti all'interno dell'armadio. Posizionalo di lato in modo che non interrompa il lavoro. - Spruzzare generosamente i guanti con il 70% di EtOH ogni volta che diventano asciutti. Strofinare le mani insieme in modo che i guanti non gocciolino bagnati.
- Se una pipetta sierologica tocca erroneamente qualcosa nell'armadietto, non esitate a buttarla fuori. Ricominciare con una pipetta sierologica pulita invece di usarne una che potrebbe essere contaminata.
4. Controllo e conservazione delle celle
- Prima di posizionare le cellule nell'incubatore, controllare per vedere come appaiono al microscopio. Se le cellule sono state completamente sospese, devono essere osservate singole cellule.
- Non parlare, starnutire, tossire o respirare pesantemente nelle incubatrici. Aprire e chiudere rapidamente le porte dell'incubatore. Lasciare le porte aperte più a lungo del necessario può consentire ai contaminanti presenti nell'aria di entrare negli incubatori.
NOTA: Indossare una maschera mentre si lavora nella sala di coltura cellulare può aiutare poiché il micoplasma può essere presente nella bocca umana. Evitare l'uso di telefoni cellulari nella stanza della coltura cellulare, poiché parlare non è raccomandato. - Assicurarsi che i tappi su tutte le bottiglie siano ben chiusi prima di rimuovere le bottiglie dall'armadio.
- Conservare i terreni di coltura cellulare al buio a 4 °C quando non sono in uso poiché sono sensibili alla luce.
- Spruzzare nuovamente l'interno dell'armadio con il 70% di EtOH dopo aver completato il lavoro di coltura cellulare e asciugare la superficie con un tovagliolo di carta. Svuotare i sacchetti dei rifiuti a rischio biologico. Ripetere questo processo e sostituire i guanti quando si passa a una linea cellulare diversa.
5. Lavorare con linee cellulari di sospensione
- Per le celle di sospensione coltivate in boccette di vetro, assicurarsi che i guanti siano spruzzati accuratamente con il 70% di EtOH, quindi toccare il foglio di alluminio con i guanti bagnati e spruzzare solo il fondo del pallone prima di posizionarlo all'interno dell'armadio.
- Quando si preleva un campione per il conteggio delle cellule, rimuovere solo un tubo da 1,5 ml dal suo contenitore. Non toccare altri tubi. Posizionare il cappuccio capovolto sulla superficie di lavoro. Non toccare il bordo interno. Maneggiarlo con cura dai lati e sostituirlo una volta finito.
- Rimuovere con attenzione il pezzo di alluminio a doppia piega che copre l'intero collo del pallone. Maneggiare il pallone di vetro solo dal basso, non toccarlo dal collo, una volta spento il foglio. Utilizzare una pipetta sierologica da 1 mL per prelevare un campione per il conteggio delle cellule.
- Non lasciare che i media gocciolino lungo il lato dei palloni; se lo fa, spruzzare un tovagliolo di carta con il 70% di EtOH e pulirlo immediatamente.
- Assicurarsi che i tappi e i fogli di alluminio siano serrati prima di rimuovere bottiglie o boccette dagli armadietti di sicurezza biologica.
6. Incubazione cellulare
- Utilizzare incubatori separati per diversi tipi di cellule per prevenire la contaminazione incrociata dei diversi tipi di cellule.
7. Raccolta dei rifiuti liquidi
- Raccogliere i rifiuti liquidi in un pallone con trappola sottovuoto situato all'esterno dell'armadio sul pavimento in un contenitore secondario etichettato "Rifiuti".
NOTA: Il tubo è collegato a un filtro HEPA (Particulate Absorbing) ad alta efficienza, che viene sostituito su base mensile.
8. Pulizia
- Rimuovere il sacchetto dei rifiuti a rischio biologico e lavare i palloni di vetro il prima possibile. Tenere un protocollo di lavaggio del vetro vicino al lavandino. Vedere il file supplementare 1 per il protocollo di lavaggio.
- Autoclavare la vetreria per colture cellulari invece di inviarla a un impianto di lavaggio del vetro. Tenerlo separato dalla vetreria nell'area principale del laboratorio.
NOTA: Le celle SF-9 lasciano un bordo di cellule morte sul lato dei palloni se il vetro non viene lavato bene. Vedere il file supplementare 1 per il protocollo dell'autoclave.
9. Organizzazione
- Organizzare la sala di coltura cellulare in modo che tutte le forniture si trovino in un'unica area, riducendo così al minimo la necessità per i membri del laboratorio di lasciare la stanza in cerca di forniture.
- Etichettare tutte le bottiglie di plastica utilizzate per raccogliere le cellule e riutilizzate in coltura cellulare in seguito come "Solo per uso in coltura cellulare". Utilizzare i flaconi di coltura cellulare designati per un tipo di cellula specifico. Conservare i flaconi nella stanza di coltura cellulare per un facile accesso.
10. Identificazione della contaminazione da batteri, funghi e micoplasma
NOTA: non seguire il flusso di lavoro sopra riportato può portare a contaminazione da batteri, funghi e micoplasmi.
- Sempre prima di iniziare il lavoro, osservare i palloni per una torbidità pesante, una crescita extra sotto forma di palline sfocate e densi accumuli di cellule sul lato, tutti indicatori di contaminazione.
NOTA: Un occhio esperto può distinguere tra torbidità causata dalla contaminazione microbica rispetto alle cellule reali. Mentre le cellule fanno apparire i mezzi normalmente trasparenti torbidi, la contaminazione batterica provoca una forte torbidità con colore bianco.- Identificare visivamente la contaminazione da muffa notando l'aspetto di sfere rotonde e sfocate che galleggiano nel supporto (vedere la Figura 2).
- Identificare visivamente la contaminazione batterica se il fluido è torbido, bianco o turbolento (vedere la Figura 2).
- Identificare la contaminazione da micoplasma eseguendo un test mensile del micoplasma. Un test basato su PCR istruisce gli utenti a prelevare un campione di cellule da 1,5 ml, eseguire un conteggio delle cellule utilizzando 10 μL, diluire a 0,08 x 106 cellule / ml, centrifugare le cellule, lisare le cellule utilizzando il tampone contenuto nel kit e girare verso il basso un'ultima volta. Il surnatante viene incubato con primer che amplificano una serie di specie di micoplasmi. Esegui un gel di DNA per visualizzare le bande. Nessuna banda significa che il micoplasma non è identificato.
NOTA: Questo importante contaminante può essere presente nella bocca umana. È buona norma testare la contaminazione da micoplasma nelle cellule dopo averle scongelate e prima di utilizzarle per esperimenti. Successivamente, monitorare le cellule per la contaminazione da micoplasma una volta al mese. Molte aziende offrono kit per il test del micoplasma. Scegline uno adatto.
Risultati
Se non vengono seguite le tecniche e le pratiche di coltura cellulare descritte in questo documento, la contaminazione da funghi e batteri può verificarsi nel laboratorio di coltura cellulare di ricerca. La figura 2 mostra i palloni contenenti contaminazione sia nelle colture in sospensione che in quelle aderenti.
Quando non si seguono tecniche asettiche, la contaminazione della muffa può verificarsi 2-3 giorni dopo. Le sfere rotonde sfocate che galleggiano nei media sono evidenti nelle celle di sospensione, mentre la crescita della muffa nelle cellule attaccate può essere osservata come macchie grandi, irregolari, bianche o verdi.
Per i batteri, la contaminazione viene osservata il giorno seguente. I media sono turbolenti, bianchi e nuvolosi. Il colore bianco è tipico delle cellule batteriche, che si moltiplicano molto più rapidamente delle linee cellulari. Un occhio esperto è in grado di distinguere tra mezzi non contaminati e mezzi contaminati. Per le celle attaccate, si può confrontare una bottiglia di supporto non aperto con un pallone per verificare se si vede qualche turbolenza nel pallone.
All'interno dell'armadio di sicurezza biologica, il numero di articoli deve essere ridotto al minimo. Evitare di posizionare oggetti sulle griglie posteriore e anteriore (vedere la Figura 3). In questo cabinet sono presenti una serie di pipette, punte, pipette in vetro autoclavate, un ausilio per pipette e pennarelli. L'area di lavoro al centro è chiara. Mantenere gli armadi organizzati in questo modo è una buona idea. Inoltre, l'operatore deve indossare un camice e guanti puliti prima di iniziare il lavoro. Un flacone spray con il 70% di EtOH deve essere tenuto nelle vicinanze in modo che l'operatore possa spruzzare spesso i guanti. La pelle è coperta da guanti o camice da laboratorio. L'operatore deve regolare la sedia in modo che le braccia abbiano un angolo di 90° quando lavora all'interno dell'armadio e gli oggetti devono essere facilmente raggiungibili all'interno dell'armadio (vedere la Figura 4).
Molte specie di micoplasma possono essere identificate in modo affidabile utilizzando un test basato sulla PCR. La figura 5 mostra i risultati di un test negativo del micoplasma. La banda a sinistra mostra gli standard di peso molecolare per il DNA. Le quattro bande a destra sono controlli positivi. Nessuna banda appare sotto i tipi di cellule testati perché il micoplasma non è stato rilevato.
Se il mezzo contiene indicatori di pH, sarà rosso per il valore pH ottimale delle celle a 7,4. Una volta che le cellule crescono, il supporto cambierà colore da rosso a giallo3. Questo cambiamento di colore può verificarsi anche se i batteri prendono il sopravvento sul pallone e crescono troppo (Figura 6). Il colore giallo indica che il pH è basso. Osservare una nuova bottiglia di supporto non aperta accanto a un pallone è un modo oggettivo per osservare la contaminazione nelle celle attaccate. Per le colture in sospensione, l'utente può osservare da vicino il pallone per eventuali escrescenze che galleggiano nel mezzo o se uno spesso anello di cellule batteriche troppo cresciute è presente all'interno del pallone di vetro. Per entrambi i tipi di cellule, un piccolo campione può essere prelevato e osservato al microscopio. Se si osservano altre crescite o forme cellulari, specialmente se le cellule si muovono, questo è un indicatore di contaminazione (Figura 7). Una pulizia approfondita dell'emocitometro deve essere eseguita prima del conteggio delle cellule, poiché questo tipo di detriti può essere presente solo sull'emocitometro e non nelle colture cellulari stesse.
L'odore può essere un altro indicatore di contaminazione in un'incubatrice. La crescita eccessiva batterica ha un odore tipico che un utente esperto di colture cellulari noterà. L'odore coincide sempre con un pallone contaminato, anche se un pallone infetto potrebbe non sempre causare l'odore dell'intera incubatrice.
La contaminazione da muffa tende ad essere più prevalente nelle cellule HEK 293 S cresciute in sospensione. La contaminazione batterica è più comune nelle cellule SF-9. Ciò può essere dovuto al fatto che le celle RIC vengono coltivate con umidità, portando così all'accumulo di umidità negli incubatori. Le cellule SF-9 vengono coltivate senza umidità, quindi l'ambiente è più secco. Il tasso di contaminazione nelle colture aderenti è inferiore al tasso di contaminazione nelle colture in sospensione. Ciò può essere dovuto alla dimensione più piccola del pallone, alla natura non riutilizzabile del pallone o al tappo ventilato invece dell'uso di un foglio di alluminio.
Il micoplasma non può essere osservato ad occhio nudo né con un normale microscopio ottico, sebbene la microscopia elettronica a trasmissione specializzata possa rilevare il micoplasma. Un kit di identificazione del micoplasma deve essere utilizzato per testare mensilmente le colture cellulari. Molte specie di micoplasma possono essere identificate in modo affidabile utilizzando un test basato sulla PCR. Una breve descrizione su come viene eseguito questo test PCR può essere trovata nella sezione protocollo e ulteriori informazioni sul micoplasma possono essere trovate nella sezione di discussione.
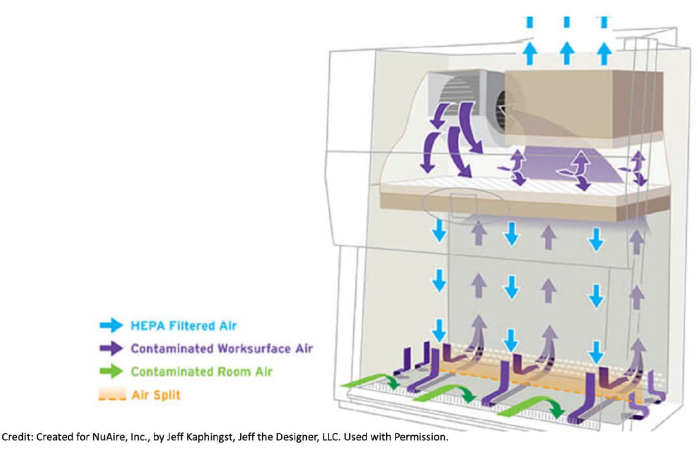
Figura 1: Come scorre l'aria in un armadio di biosicurezza. Gli armadi di sicurezza biologica estraggono l'aria contaminata dalla stanza stessa e dall'armadio attraverso le griglie anteriore e posteriore. Quest'aria va sotto la superficie di lavoro del metallo, verso la parte posteriore dell'armadio e fino alla parte superiore dell'unità in cui si trova un filtro HEPA. Lì, l'aria passa attraverso il filtro e viene filtrata. Questa aria pulita spinge verso il basso sul piano di lavoro. A causa del modo in cui il flusso di aria filtrata viene spinto verso il basso all'interno dell'armadio, è buona norma non librarsi. Ad esempio, non è auspicabile avere un manicotto sopra una bottiglia aperta e rischiare che eventuali contaminanti vengano spinti nei supporti. Il numero di articoli portati all'interno dell'armadio deve essere ridotto al minimo e gli oggetti non devono essere posizionati sulle griglie anteriori o posteriori per non interrompere il flusso d'aria. Spostare le braccia dentro e fuori dall'armadio troppo rapidamente può anche disturbare il flusso d'aria. Creato per NuAire, Inc., da Jeff Kaphingst, Jeff the Designer, LLC. Utilizzato con autorizzazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Sospensione non contaminata e cellule aderenti e cellule contaminate da muffe o batteri. La prima immagine a sinistra contiene cellule di insetti (cellule SF-9) che non sono contaminate. La seconda immagine mostra un'altra fiaschetta di queste cellule contaminate da muffa. Il terzo pallone era contaminato da batteri, come si può notare dall'aspetto spesso, bianco e torbido. Il secondo e il terzo pallone sono stati contaminati perché non è stata seguita nessuna delle tecniche e delle pratiche di coltura cellulare appropriate. Tutti i palloni sono stati preparati lo stesso giorno. La crescita è stata osservata il giorno successivo per la contaminazione batterica e 2 giorni dopo per la contaminazione da muffa. Vengono mostrate cellule aderenti non contaminate (cellule Hek293) insieme a muffe e contaminazioni batteriche nelle colture aderenti. La contaminazione da muffa è mostrata nella seconda riga in una piastra di Petri rotonda. La foto è presa dalla parte superiore del piatto. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Organizzazione del gabinetto di coltura cellulare. All'interno dell'armadio di sicurezza biologica, la quantità di articoli deve essere mantenuta al minimo. Posizionare oggetti sulle griglie posteriori e anteriori dovrebbe essere evitato. In questo cabinet sono presenti una serie di pipette, punte, pipette in vetro autoclavate, un ausilio per pipette e pennarelli. L'area di lavoro al centro è chiara. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4: Il modo corretto per un operatore di lavorare sotto la cappa di flusso. Un operatore dovrebbe indossare un camice da laboratorio pulito e guanti prima di iniziare il lavoro. Un flacone spray con il 70% di EtOH deve essere tenuto nelle vicinanze in modo che l'operatore possa spruzzare spesso i guanti. La pelle è coperta dai guanti o dal camice da laboratorio. L'operatore deve regolare la sedia in modo che le braccia siano inclinate di 90° quando lavora all'interno dell'armadio. Gli oggetti dovrebbero essere facilmente raggiungibili all'interno dell'armadio. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 5: Un risultato negativo del test del micoplasma. Molte specie di micoplasma possono essere identificate in modo affidabile utilizzando un test basato sulla PCR. La banda a sinistra mostra gli standard di peso molecolare per il DNA. Le quattro bande a destra sono controlli positivi. Nessuna banda appare sotto i tipi di cellule testati perché il micoplasma non è stato rilevato. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 6: Il colore normale dei supporti cambia da rosso a giallo. I terreni di coltura cellulare cambiano il colore da rosso a giallo se sono presenti indicatori di pH. Il colore giallo indica che il pH è basso e il supporto deve essere sostituito. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 7: Contaminanti osservati al microscopio ottico. Se si osservano altre crescite o forme cellulari al microscopio ottico durante l'esecuzione del conteggio delle cellule, questo potrebbe essere un indicatore di contaminazione. Va notato che una pulizia approfondita dell'emocitometro deve essere eseguita prima del conteggio delle cellule poiché questo tipo di detriti può essere presente solo sull'emocitometro e non nelle colture cellulari stesse. Fare clic qui per visualizzare una versione ingrandita di questa figura.
File supplementare 1: Appendice Fare clic qui per scaricare questo file.
Discussione
Mentre la contaminazione è una delle preoccupazioni principali quando si esegue il lavoro di coltura cellulare, le pratiche e le tecniche descritte in questo manoscritto aiuteranno a mitigare i rischi. I passaggi critici includono indossare un camice da laboratorio pulito, che viene utilizzato solo nella sala di coltura cellulare, utilizzare guanti puliti e privi di polvere che vengono spruzzati spesso con il 70% di EtOH e che vengono cambiati quando si passa da una linea cellulare all'altra, incoraggiare ogni individuo a non condividere bottiglie di supporto, pulire accuratamente l'armadio prima e dopo aver terminato il lavoro, Scartare ordinatamente le pipette sierologiche, evitare il contatto ravvicinato prolungato con bottiglie o boccette aperte, non condividere i flaconi dei supporti tra più linee cellulari e aprire e chiudere rapidamente le porte dell'incubatore. Inoltre, il lavaggio e l'autoclave della propria vetreria garantiscono il controllo della qualità, riducendo così la probabilità di introdurre contaminanti esterni. I metodi di controllo della qualità includono l'uso di nastro adesivo per autoclave per indicare se lo sterilizzatore ha raggiunto la temperatura corretta di 121 °C, una regolare manutenzione preventiva dell'apparecchiatura e l'ispezione visiva del pallone per assicurarsi che sia stato lavato correttamente18. Un altro punto importante è quello di utilizzare incubatori separati per diversi tipi di cellule per garantire che la contaminazione da un tipo di cellula non venga trasferita ad altri e per garantire anche che non si verifichi una contaminazione incrociata con le cellule.
Le infezioni batteriche e fungine sono i due intrusi più comuni nelle colture cellulari. Uno dei principali contaminanti, M. orale, è la specie di micoplasma più comune nella bocca umana e inoltre "rappresenta il singolo isolato più comune che rappresenta il 20%-40% di tutte le infezioni da micoplasma nelle colture cellulari"4. In altre parole, il personale di laboratorio è la principale fonte di questa contaminazione. È sempre una preoccupazione nella stanza di coltura cellulare poiché il micoplasma è un piccolo microrganismo a crescita lenta privo di una parete cellulare rigida che può passare attraverso filtri da 0,45 μm4. Gli studi dimostrano che l'incidenza della contaminazione da micoplasma è del 15%-35% delle linee cellulari umane o animali continue4. Inoltre, le statistiche indicano che circa il 5-30% delle linee cellulari del mondo sono contaminate da micoplasmi6. Sfortunatamente, il micoplasma è resistente alla maggior parte degli antibiotici utilizzati per la coltura cellulare e l'infezione può influenzare la fisiologia e il metabolismo cellulare 4,6. Sebbene la contaminazione non rallenti il metabolismo cellulare, può contaminare il prodotto finale6. Le infezioni possono rimanere in giro senza che i membri del laboratorio notino danni cellulari. Se si verifica la contaminazione, il costo dello scongelamento di nuove cellule, il tempo speso per propagare le nuove colture, i costosi mezzi che sono stati sprecati, la decontaminazione degli incubatori e la quantità di tempo che i colleghi trascorrono in attesa di ricominciare i loro esperimenti, è enorme. Il nostro laboratorio stima che il tempo totale perso rappresenti 2 settimane e il costo totale associato alla contaminazione di una tipica espressione proteica di cellule di mammifero umano di 8 L è di $ 1.400. Le pratiche e le tecniche descritte in questo manoscritto offrono buone misure preventive per mitigare i costi aggiuntivi, le cellule perse e i tempi di inattività.
Le modifiche di queste pratiche non sono raccomandate. Tutti i membri del laboratorio dovrebbero essere formati prima di lavorare nella sala di coltura cellulare e quindi ricevere una formazione di aggiornamento ogni anno7. I membri del laboratorio dovrebbero anche organizzare la sala di coltura cellulare in modo che tutte le forniture necessarie siano in un'area, riducendo così al minimo la necessità per i membri del laboratorio di uscire dalla sala di coltura cellulare in cerca di forniture.
I limiti delle tecniche presentate sono osservati se la contaminazione proviene da fonti esterne come siero, incubatori, autoclavi malfunzionanti, camici sporchi o la fonte delle cellule. La risoluzione dei problemi della tecnica può essere necessaria se la contaminazione si verifica nonostante la stretta aderenza a questo protocollo. Molti fattori esterni possono contribuire a questo tipo di contaminazione. I membri del laboratorio devono essere prudenti e controllare le fonti esterne. Ad esempio, il lotto di siero bovino fetale (FBS) acquistato dal fornitore potrebbe essere stato contaminato da micoplasma. Rispetto al 1950, questo è ora un evento raro, ma può ancora accadere6. Tutte le bottiglie di supporto devono essere gettate via se si nota una contaminazione e il protocollo deve essere riavviato scongelando nuove cellule e utilizzando nuovi supporti. La contaminazione potrebbe essere già stata presente all'interno dell'incubatore se si tratta di muffe o batteri; Gli altri palloni all'interno della stessa incubatrice devono essere controllati per vedere se si osserva la crescita batterica o di muffa. Tutti i palloni contaminati devono essere gettati via e l'incubatore decontaminato. Se non viene rilevata alcuna contaminazione, è necessario controllare l'autoclave per eventuali errori di malfunzionamento; La vetreria potrebbe non essere stata autoclavata correttamente in primo luogo. Il nastro dell'autoclave può cambiare colore nonostante l'autoclave non raggiunga i 121 °C. Successivamente, devono essere controllate le date di scadenza delle soluzioni antibiotiche utilizzate; Potrebbe essere necessario acquistare nuove soluzioni. Infine, dovrebbe essere considerata la fonte delle cellule; Provenivano da un fornitore di laboratorio di fiducia o erano presi in prestito da un altro laboratorio? Le celle dovrebbero sempre essere acquistate da un fornitore di laboratorio di fiducia e non dovrebbero mai essere prese in prestito da un altro laboratorio. Infine, i camici da laboratorio devono essere lavati per garantirne la pulizia19. La decontaminazione degli incubatori deve essere presa in considerazione ogni volta che un pallone è stato contaminato. Le cellule batteriche o le spore della muffa non devono essere lasciate moltiplicarsi e continuare a diffondere la contaminazione.
I metodi esistenti riflettono sull'eliminazione della contaminazione. I metodi descritti in questo manoscritto si concentrano sulla prevenzione piuttosto che sull'eliminazione della contaminazione. Esistono diverse procedure per quanto riguarda l'uso di antibiotici per rimuovere il micoplasma20. Tuttavia, l'uso di antibiotici è rischioso in quanto potrebbero non eliminare completamente l'infezione e "possono consentire lo sviluppo di organismi resistenti"12. Infatti, "il 72% delle colture coltivate continuamente in antibiotici si è dimostrato positivo al micoplasma mentre solo il 7% coltivato in assenza di antibiotici è stato infettato"12. Questi dati sottolineano l'idea che mentre l'uso di antibiotici è raccomandato e può essere utile, l'uso eccessivo o la completa dipendenza dagli antibiotici non è vantaggioso. Inoltre, l'uso di antibiotici per rimuovere la contaminazione può solo consentire al problema di persistere. Le soluzioni antibiotiche non sono necessarie; Se vengono seguite le tecniche contenute in questo documento, la contaminazione dovrebbe essere prevenuta con successo.
Le pratiche e le tecniche descritte in questo manoscritto possono essere utilizzate in futuro per mantenere un ambiente asettico quando si esegue il test mensile del micoplasma e quando si producono cellule batteriche competenti fatte in casa. Entrambi i protocolli richiedono un ambiente pulito, simile al lavoro di coltura cellulare, in modo che il prodotto finale non sia contaminato.
Divulgazioni
L'autore non ha interessi contrastanti.
Riconoscimenti
Questo lavoro è stato reso possibile grazie al finanziamento dell'Howard Hughes Medical Institute (HHMI). Desideriamo ringraziare il nostro capo del laboratorio, Jue Chen, per aver letto il manoscritto e per il suo continuo supporto, Donna Tallent per le sue utili modifiche e commenti, e Jeff Hennefeld del Dipartimento di Information Technology della Rockefeller University per il suo aiuto con la componente video di questo manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| DPBS | Gibco | 14-190-144 | |
| DMEM F-12 Media | ATCC | 30-2006 | |
| Glass Baffled Flask | Pyrex | 09-552-40 | |
| Glass Pipettes | Fisher | 13-678-6B | |
| Pipette Aid | Drummond | 13-681-15A | |
| Serological Pipette | Corning | 07-200-573 | |
| T75 flask | Corning | 07-202-004 | |
| Trypsin | Gibco | 25-300-054 | |
| *Items may vary because this video is about general cell culture techniques |
Riferimenti
- Johnson, Z. L., Chen, J. Structural basis of substrate recognition by the multidrug resistance protein MRP1. Cell. 168 (6), 1075-1085 (2017).
- Capes-Davis, A., et al. Cell lines as biological models: practical steps for more reliable research. Chemical Research in Toxicology. 32 (9), 1733-1736 (2019).
- Segeritz, C. P., Vallier, L. Cell culture: growing cells as model systems in vitro. Basic Science Methods for Clinical Researchers. , 151-172 (2017).
- Drexler, H. G., Uphoff, C. C. Mycoplasma contamination of cell cultures: Incidence, sources, effects, detection, elimination, prevention. Cytotechnology. 39 (2), 75-90 (2002).
- Lincoln, C. K., Gabridge, M. G. Cell culture contamination: sources, consequences, prevention, and elimination. Methods in Cell Biology. 57, 49-65 (1998).
- Nikfarjam, L., Farzaneh, P. Prevention and detection of mycoplasma contamination in cell culture. Cell Journal. 13 (4), 203-212 (2012).
- Stacey, G. N. Cell culture contamination. Methods in Molecular Biology. 731, 79-91 (2011).
- Young, L., Sung, J., Stacey, G., Masters, J. R. Detection of Mycoplasma in cell cultures. Nature Protocols. 5 (5), 929-934 (2010).
- Barth, O. M., Majerowicz, S. Rapid detection by transmission electron microscopy of mycoplasma contamination in sera and cell cultures. Memorias do Instituto Oswaldo Cruz. 83 (1), 63-66 (1988).
- Mirabelli, P., Coppola, L., Salvatore, M. Cancer cell lines are useful model systems for medical research. Cancers. 11 (8), 1098 (2019).
- A cell culture master class: What your cells wish they could tell you. Science Available from: https://www.science.org/content/webinar/cell-culture-master-class-your-cells-wish-they-could-tell-you (2020)
- Langdon, S. P. Cell culture contamination: an overview. Methods in Molecular Medicine. 88, 309-317 (2004).
- Babic, Z., et al. Meta-research: Incidences of problematic cell lines are lower in papers that use RRIDs to identify cell lines. eLife. 8, e41676 (2019).
- Visconti, P., et al. Short tandem repeat profiling for the authentication of cancer stem-like cells. International Journal of Cancer. 148 (6), 1489-1498 (2021).
- Horbach, S. P. J. M., Halffman, W. The ghosts of HeLa: How cell line misidentification contaminates the scientific literature. PLoS One. 12 (10), 0186281 (2017).
- Why 70% isopropyl alcohol is a better disinfectant than 99% isopropyl alcohol when it comes to Covid-19. MunGlobal Available from: https://munglobal.com.au/resources/knowledge-base/pathogens/why-70-isopropyl-alcohol-is-a-better-disinfectant-than-99-isopropyl-alcohol/#:~:text=Due%20to%20the%20concentration%20difference (2023)
- United States Department of Agriculture. Processing and Safety. Food Safety Publications Available from: https://www.ars.usda.gov/ARSUserFiles/60701000/FoodSafetyPublications/p328.pdf (2004)
- Sterilizing Practices. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/infectioncontrol/guidelines/disinfection/sterilization/sterilizing-practices.html (2023)
- Coté, R. J. Aseptic technique for cell culture. Current Protocols in Cell Biology. , (2001).
- Uphoff, C. C., Drexler, H. G. Eradication of Mycoplasma contamination from cell cultures. Current Protocols in Molecular Biology. 106, 1-12 (2014).
- Bykowski, T., Stevenson, B. Aseptic technique. Current Protocols in Microbiology. 56 (1), e98 (2020).
- How a Class II, Type A2 Biosafety Cabinet Works. Nuaire Available from: https://www.nuaire.com/resources/class-ii-type-a2-biosafety-cabinet-how-it-works-article (2020)
- Phelan, K., May, K. M. Mammalian cell tissue culture techniques. Current Protocols in Pharmacology. 73, 1-23 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon