Method Article
研究細胞培養実験室における真菌や細菌による汚染を回避するための細胞培養技術と実践
要約
このプロトコルは、真菌や細菌による汚染を避けるために研究細胞培養ラボで使用される重要な細胞培養技術と実践を提示します。細菌のカテゴリー内では、マイコプラズマ汚染の防止に特に重点が置かれます。
要約
細胞培養は、制御された環境でヒト、動物、昆虫の細胞、またはその他の組織を成長させるために必要な繊細なスキルです。プロトコルの目的は、真菌や細菌による汚染を防ぐために研究室で使用される正しい技術を強調することです。特に、サイズが小さいため、細胞培養室で大きな懸念事項であるマイコプラズマ汚染の回避に重点が置かれており、細胞培養に使用されるほとんどの抗生物質に対する耐性があります。これらの同じ技術は、継続的な成長を保証し、健康な細胞を維持します。新規および経験豊富な細胞培養ユーザーにとって、汚染のリスクを軽減するために、これらのベストプラクティスを一貫して遵守することが重要です。年に一度、ラボは細胞培養のベストプラクティスを確認し、必要に応じてディスカッションまたは追加のトレーニングでフォローアップする必要があります。そもそも汚染を防ぐための早期の行動を取ることは、汚染が発生した後のクリーンアップと比較して、時間とお金を節約できます。普遍的なベストプラクティスは、細胞培養を健康に保ち、それによって新しい細胞を絶えず解凍し、高価な細胞培養培地を購入する必要性を減らし、インキュベーターの除染とダウンタイムの量を減らします。
概要
細胞培養は研究室で多くの用途があります。20世紀初頭の細胞培養の起源以来、細胞株は科学の進歩に貢献してきました。細胞株にはいくつかの利点があります。さまざまな細胞株は、研究者が細胞生物学を研究したり、さらなる研究のためにバキュロウイルスを産生したり、目的のタンパク質を大量に産生したりするのに役立ちます。その他の用途には、組織成長の研究、ワクチン開発の進歩の支援、毒物学研究、健康な生物および疾患モデルにおける遺伝子の役割の研究、ハイブリッド細胞株の製造などがあります2,3。細胞株は医薬品製造も可能にします3。細胞株を扱う際には、適切な無菌技術が必要です。この原稿で概説されている実践と技術は、細胞培養作業が行われる研究所に適用できます。他の実験室の設定については説明しません。
細胞培養作業を行う際には、汚染が主な懸念事項であることがよくあります。この論文の文脈では、汚染は一般的に真菌とバクテリアを指します。このホワイト ペーパーで概説されている方法の全体的な目標は、汚染を回避するためのベスト プラクティスを徹底的に説明することです。すべてのラボメンバーは、ラボの細胞培養室で作業する際にこれらの慣行を遵守する必要があります。研究所は、すべての労働者が汚染を防ぐためにこれらのベストプラクティスを使用することに積極的に参加していることを確認する必要があります。正しい実践と技術の知識は、細胞培養が生存可能で健康であり、汚染のない状態を維持するのに役立ちます。この技術の開発は、文献の研究、細胞培養での7年の経験、および初心者と経験豊富な細胞培養労働者の両方が毎年参照できる方法の必要性に基づいています。
すべての研究細胞培養ラボが従うべき明確で標準化された技術が必要です。細胞培養汚染に関する文献の多くは、マイコプラズマの検出、無菌技術、汚染源、汚染物質の除去、抗生物質の使用による予防、および定期的な検査について説明しています4,5,6,7,8。この情報は役に立ちますが、従うべき適切な細胞培養技術を示すビデオは文献に存在しません。代替技術よりも提示された慣行の利点は、後で間違いを検出して修正するのではなく、汚染が発生する前に防止することに重点を置いていることです。さらに、無菌技術の徹底的なデモンストレーション、真菌や細菌の増殖防止に関する議論、およびバイオセーフティキャビネットの気流に関する情報は、初心者と経験豊富な細胞培養作業員の両方にとって貴重です。
細菌と真菌は、最も一般的な2種類の汚染物質です。細菌のカテゴリーの中で、マイコプラズマは、そのサイズが小さく、気付かれずに増殖する能力があるため、大きな懸念事項です。それらは、真核細胞に依存して成長する硬い細胞壁を持たない自己複製生物です。透過型電子顕微鏡はマイコプラズマ9,10を検出できますが、それらは代謝能力を低下させ、細胞培養の日常的な目視検査および定期的な顕微鏡分析では認識されないまま大きく増殖する可能性があります。また、微生物学的フィルター10を通過できる。細胞培養培地はマイコプラズマに栄養素を提供しますが、残念ながら培地に抗生物質を補給してもマイコプラズマ10には影響しません。一般に、培地に抗生物質を補給する必要はないことに注意する必要があります。汚染を寄せ付けないようにするには、適切な技術で十分です。マイコプラズマの感染は即時の細胞死にはつながりませんが、データの再現性と品質に影響を与えるため、研究者にとっては懸念事項です。
すべてのラボ担当者は、適切な細胞培養慣行を厳守する必要があります。培養物は、新たに購入した後、現在栽培中、凍結保存前、および液体窒素2,10から解凍したときに、マイコプラズマについてテストする必要があります。ポリメラーゼ連鎖反応(PCR)、酵素結合免疫吸着アッセイ(ELISA)、または免疫染色を使用したさまざまな検査が市場で入手可能です。3文献は、「ヒト分離株は、細胞培養で見つかったマイコプラズマ汚染物質の大部分を占める」ことを示しています5。200種以上のマイコプラズマ種が記載されているが、そのうち約6種がほとんどの感染症を占めている。これらの6種は、M. arginini、M. fermentans、M. hominis、M. hyorhinis、M. orale、およびAcholeplasma laidlawii10です。他の種類の汚染と同様に、空気とエアロゾルはこれらを細胞培養物に持ち込みます5。これは、「人間のオペレーターは実験室で潜在的に最大の危険である」7ため、他の論文にも反映されています。これは人為的ミスによって行われますが、標準的な手順に従えばリスクを排除できます。人員からの脱落は、マイコプラズマ汚染だけに限定されません。あるラボでの細胞培養は通常、同じマイコプラズマ種に感染しており、不適切な細胞培養技術のために汚染がフラスコから別のフラスコに広がっていることを示しています10。
交差汚染の防止も、適切な細胞培養技術に従うべきもう一つの理由です。世界中の細胞株の少なくとも15%〜18%が交差汚染または誤認されている可能性があることに注意してください11,12。マイコプラズマ汚染について細胞株をテストすることに加えて、それらは交差汚染についてもテストする必要があります10。ヒト細胞株の場合、ショートタンデムリピート(STR)プロファイリングと呼ばれる安価なDNAベースの技術による細胞株認証は、細胞株の同一性を確認する簡単な方法であるため、現在の国際標準です2,10,13,14。STRは、誤ってラベル付けされた細胞株や交差汚染された細胞株を識別できますが、誤った組織起源を検出することはできません10、13、14。細胞株が誤ってラベル付けされたり、誤って識別されたり、汚染されたりすると、研究データの妥当性が損なわれる可能性があります13。他のタイプのコンタミネーションと同様に、クロスコンタミネーションは、エアロゾルの拡散を引き起こす不十分な技術、フラスコに入る誤った細胞タイプにつながる誤った接触、または異なる細胞株を有する同じ培地ボトルおよび試薬の使用によって起こり得る10。メディアボトルの共有は行われません。2つの異なる細胞株間で1本の培地を共有することで、これらの細胞集団を混合することができ、成長の速い細胞タイプがフラスコを完全に引き継ぐことができます。この交換は目立たず、誤ったラベル付けと誤認につながります2。細胞株は、取り扱いまたは標識中に培養物が混同された場合、別の細胞株と間違われる可能性もあります10。試薬、培地、フラスコを互いに分離しておくことに細心の注意を払う必要があります。各ラボメンバーは、独自のメディアボトルを持っている必要があります。ラボ メンバー間での共有は行われません。細胞株自体は、資格のある細胞バンクおよびプロバイダーから購入する必要があります。実験室は細胞を共有するべきではありません。研究によると、STRおよびマイコプラズマ検査は定期的に使用されていますが、文献の多くの研究論文はすでに誤認または汚染された細胞株を使用しています15。これらの問題のある論文を見つけ、この問題について読者に遡及的に知らせるために研究をふるいにかけるのは面倒です。予防は、この問題が最初に発生しないようにするための最良の方法です。
アイテムに70%のEtOHをスプレーするという単純なアクションは、生物を殺すことができます。70%のEtOHは、細菌や真菌を含む最も一般的に汚染されている生物のタンパク質を変性させ、脂質を溶解することによって機能します16。研究によると、70%が最も効果的な濃度です。表面タンパク質は70%のEtOHで急速に凝固しないため、細胞に入ることができますが、表面タンパク質に含まれる水はタンパク質の変性プロセスに必要です。細胞壁の両側の水とアルコールの濃度差により、70%のEtOHが細胞に入り、酵素タンパク質と構造タンパク質の両方を変性させます。フラスコ内でカビの成長が観察された場合は、最初に70%EtOHを噴霧して拭いて乾かし、次に60°Cで16時間一晩インキュベートすることにより、インキュベーター全体を除染する必要があります17。これはほとんどのカビとバクテリアを殺します。
汚染発生後に汚染を除去する代替技術に対する予防慣行の主な利点は、汚染を早期に防止することにより、実験室の労働者は細胞培養が健康であることを確信でき、インキュベーターの除染や細胞培養物の廃棄に関連する高額なコストがかからないことです。たとえば、マイコプラズマ汚染物質の除去は効率的ではありません7。ラボ担当者が適切に訓練されていることを確認するために早い段階で時間をかけると、細胞培養室は自己完結型であり、標準的な手順が使用されるため、時間とお金を節約できます。
プロトコル
1. 事前準備
- 全般
- 細胞培養室でのみ着用するように指定された清潔な白衣を着用し、実験室の他の部分は着用しないでください。
注意: 白衣は無菌である必要はありません。 - 他の表面に触れていない新しい手袋を着用してください。手袋がしっかりとフィットしていることを確認してください。ニトリル、パウダーフリーの手袋が最適です。
注意: 手袋は無菌である必要はありません。 - 作業の準備として、手袋、白衣の袖、および生物学的安全キャビネットの内部に70%EtOHをスプレーします。作業面とガラスパネルを糸くずの出ないペーパータオルで拭いて乾かします。
注:70%のEtOHを使用すると、最高の効率でバクテリアを殺します16。ペーパータオルは無菌である必要はありません。 - 細胞培養室内に水浴を保管し、培地の加温または細胞の解凍にのみ使用してください。製造元のクリーニングの指示に従って、週に一度ウォーターバスを排水して洗浄してください。
- 細胞培養室でのみ着用するように指定された清潔な白衣を着用し、実験室の他の部分は着用しないでください。
- 生物学的安全キャビネットの内部
- キャビネットに持ち込まれるアイテムの数を制限します。前面または背面のグリルを塞いで、生物学的安全キャビネット内の空気の流れを妨げないでください。
メモ: キャビネット内の空気の流れについては 、図1 を参照してください。 - キャビネット内に置かれたすべてのアイテムに70%EtOHをスプレーし、拭いて乾かします。まず、メディアボトルの上部にスプレーして下に向かって作業します。同様に、清潔なペーパータオルで拭いて乾かし、徐々に底に向かって作業します。キャップに向かって戻らないでください。
- キャビネットが血清学的ピペットを収容するのに十分な大きさであれば、それらは内部に置くことができ、そうでなければそれらはキャビネットの外側に取り付けられたレセプタクルに保管することができる。使用前に、包装に穴、裂け目、穴がないか、ピペットの両側を確認してください。ラッピングをはがさないでください。代わりに、ラッピングの端をそっとはがし、血清学的ピペットをピペットエイドに挿入し、1回の流動的な動きでラッピングを取り外します。
- 開いたボトルやフラスコの上にカーソルを合わせないでください。開いたボトルやフラスコに手を伸ばすか、生物学的安全キャビネット内のすでに開いているアイテムの上部にアイテムを開きます。
注意: キャビネット内の空気の流れが作業面を押し下げるため、たとえばスリーブに存在する汚染物が細胞培養物に入る可能性があります。 - 液体を注がないでください。代わりに、血清学的ピペットを使用して追加してください。培地を補充した後、内容物を完全に混合し、ボトルを初期化します。また、メディアが補足された内容のラベルを必ず含めてください。
- キャビネットに持ち込まれるアイテムの数を制限します。前面または背面のグリルを塞いで、生物学的安全キャビネット内の空気の流れを妨げないでください。
2. 接着細胞株の取り扱い
- プラスチックフラスコが必要な場合は、バッグ全体にスプレーしてキャビネット内に置きます。
- オートクレーブ滅菌ガラスピペットまたは使い捨て滅菌プラスチックピペットを使用して、培地または洗浄液を吸引します。保管容器から金属キャップを慎重に取り外します。容器を斜めに静かに振って、1つのガラスピペットを分離します。容器に手を伸ばすときは、他のピペットに触れないでください。
注意: 選択したピペットは片端からのみ取り扱ってください。 - できるだけ早くボトルのキャップを交換してください。リムが作業面に触れないように、キャップを作業面に逆さまに置きます。上部または下部からキャップをつかまないでください。代わりに、側面からキャップに触れます。
- 液体を吸引するときは、キャビネットの外側にある真空トラップフラスコを床の二次容器に入れます。
注意: バッグが漏れるため、バイオハザード廃棄物バッグに液体廃棄物を投げないでください。キャビネット内での作業中に廃棄物が発生します。キャビネットに手を出し入れする頻度が高すぎると、空気の流れが妨げられます。廃棄物は一時的にキャビネット内に残してください。作業を中断しないように横に置きます。 - 手袋が乾いたらいつでも70%EtOHをたっぷりとスプレーしてください。手袋が濡れないように手をこすり合わせます。
- 血清学的ピペットが誤ってキャビネット内の何かに触れた場合は、遠慮なく捨ててください。汚染されている可能性のあるピペットを使用する代わりに、清潔な血清学的ピペットで新たに始めてください。
4.セルのチェックと保存
- 細胞をインキュベーターに入れる前に、顕微鏡でどのように見えるかを確認してください。細胞が完全に懸濁されている場合は、単一細胞を観察する必要があります。
- 話したり、くしゃみをしたり、咳をしたり、インキュベーターに大量に吸い込んだりしないでください。インキュベーターのドアをすばやく開閉します。必要以上にドアを開けたままにしておくと、空気中に存在する汚染物質がインキュベーターに入る可能性があります。
注:細胞培養室での作業中にマスクを着用すると、マイコプラズマが人間の口の中に存在する可能性があるため、役立ちます。細胞培養室での携帯電話の使用は、会話が推奨されないため、避けてください。 - キャビネットからボトルを取り出す前に、すべてのボトルのキャップがしっかりと閉じていることを確認してください。
- 細胞培養培地は光に敏感であるため、使用しないときは4°Cの暗所で保管してください。
- 細胞培養作業が完了したら、キャビネットの内部に70%EtOHを再度スプレーし、ペーパータオルで表面を拭いて乾かします。バイオハザードのゴミ袋を空にします。このプロセスを繰り返し、別の細胞株に切り替えるときに手袋を交換します。
5. 浮遊細胞株の操作
- ガラスフラスコで成長させた懸濁細胞の場合は、手袋に70%EtOHを完全にスプレーしてから、濡れた手袋でアルミホイルに触れ、フラスコの底部のみをスプレーしてからキャビネット内に置きます。
- 細胞計数用のサンプルを採取する場合は、容器から1.5 mLチューブを1本だけ取り出してください。他のチューブには触れないでください。キャップを逆さまにして作業面に置きます。内側の縁には触れないでください。側面から注意して取り扱い、終了したら交換してください。
- フラスコの首全体を覆っている二重に折りたたまれたアルミホイルを慎重に取り除きます。ホイルが外れたら、ガラスフラスコを下からのみ取り扱い、首からは触れないでください。1 mLの血清学的ピペットを使用して、細胞カウント用のサンプルを採取します。
- フラスコの側面にメディアを滴らせないでください。もしそうなら、70%EtOHをペーパータオルにスプレーし、すぐにそれをきれいにしてください。
- 生物学的安全キャビネットからボトルまたはフラスコを取り外す前に、キャップとアルミホイルが締められていることを確認してください。
6.細胞インキュベーション
- 異なる細胞タイプの交差汚染を防ぐために、異なる細胞タイプに別々のインキュベーターを使用してください。
7.廃液収集
- 「廃棄物」というラベルの付いた二次容器の床のキャビネットの外側にある真空トラップフラスコに液体廃棄物を収集します。
注意: ホースは高効率粒子吸収(HEPA)フィルターに接続されており、毎月交換されます。
8.クリーンアップ
- バイオハザード廃棄物袋を取り外し、できるだけ早くガラスフラスコを洗浄します。シンクのそばにガラス洗浄プロトコルを保管してください。洗浄プロトコルについては、 補足ファイル1 を参照してください。
- 細胞培養用ガラス器具をガラス洗浄施設に送る代わりにオートクレーブします。ラボのメインエリアのガラス製品とは別に保管してください。
注意: SF-9細胞は、ガラスがうまくこすられていない場合、フラスコの側面に死んだ細胞の縁を残します。オートクレーブプロトコルについては、 補足ファイル1 を参照してください。
9. 組織
- すべての消耗品が1つのエリアに配置されるように細胞培養室を整理することで、ラボメンバーが消耗品を求めて部屋を離れる必要性を最小限に抑えます。
- 細胞を回収するために使用され、後で細胞培養で再利用されるペットボトルには、「細胞培養用のみ」というラベルを付けます。特定の細胞タイプに指定された細胞培養ボトルを使用してください。ボトルは細胞培養室に保管し、簡単にアクセスできます。
10.細菌、真菌、マイコプラズマ汚染の特定
注意: 上記のワークフローに従わないと、細菌、真菌、マイコプラズマの汚染につながる可能性があります。
- 作業を開始する前に必ず、フラスコに重い濁度、ぼやけたボールの形での余分な成長、および側面の細胞の密集した蓄積を観察してください。
注:経験豊富な目は、微生物汚染によって引き起こされる濁度と実際の細胞の違いを知ることができます。細胞は通常透明な培地を曇らせて見せますが、細菌汚染は白色の重い濁りを引き起こします。- メディアに浮かぶ丸いぼやけたボールの外観に注目して、金型の汚染を視覚的に識別します( 図2を参照)。
- 培地が濁っている、白い、または乱流している場合は、細菌汚染を視覚的に識別します( 図2を参照)。
- 毎月のマイコプラズマ検査を行うことにより、マイコプラズマ汚染を特定します。1回のPCRベースのテストでは、1.5 mLの細胞サンプルを採取し、10 μLを使用して細胞カウントを実行し、0.08 x 106 細胞/mLに希釈し、細胞をスピンダウンし、キットに含まれているバッファーを使用して細胞を溶解し、最後にもう一度スピンダウンするようにユーザーに指示します。上清は、さまざまなマイコプラズマ種を増幅するプライマーとともにインキュベートされます。DNAゲルを実行してバンドを視覚化します。バンドがないということは、マイコプラズマが同定されていないことを意味します。
注意: この主要な汚染物質は人間の口に存在する可能性があります。細胞を解凍した後、実験に使用する前に、細胞のマイコプラズマ汚染をテストすることをお勧めします。その後、月に一度、マイコプラズマ汚染について細胞を監視します。多くの企業がマイコプラズマ検査キットを提供しています。適切なものを選んでください。
結果
この論文で概説されている適切な細胞培養技術と慣行に従わないと、研究用細胞培養実験室で真菌や細菌による汚染が発生する可能性があります。 図2 は、懸濁培養物および付着培養物の両方における汚染を含むフラスコを示す。
無菌技術に従わない場合、カビの汚染は2〜3日後に発生する可能性があります。培地に浮遊する丸いぼやけたボールは浮遊細胞で目立ちますが、付着した細胞ではカビの成長が大きく、不規則で、白、または緑色の斑点として観察できます。
細菌の場合、汚染は翌日観察されます。メディアは乱流で、白く、曇っています。白色は細菌細胞の典型であり、細胞株よりもはるかに急速に増殖します。経験豊富な目は、汚染されていない媒体と汚染された媒体の違いを見分けることができます。付着した細胞については、未開封の培地のボトルとフラスコを比較して、フラスコに乱流が見られるかどうかを確認できます。
生物学的安全キャビネット内では、アイテムの数を最小限に抑える必要があります。背面グリルと前面グリルにアイテムを置くことは避けてください(図3を参照)。このキャビネットには、ピペット、チップ、オートクレーブ滅菌ガラスピペット、ピペットエイド、マーカーのセットが入っています。真ん中の作業エリアは明確です。このようにキャビネットを整理しておくことをお勧めします。さらに、オペレーターは作業を開始する前に清潔な白衣と手袋を着用する必要があります。オペレーターが手袋を頻繁にスプレーできるように、70%のEtOHを含むスプレーボトルを近くに置いておく必要があります。皮膚は手袋または白衣で覆われています。オペレータは、キャビネット内で作業するときに腕が90°の角度になるように椅子を調整し、アイテムがキャビネット内で簡単に手の届くところにある必要があります (図4を参照)。
マイコプラズマの多くの種は、PCRベースのアッセイを使用して確実に同定できます。 図5 は、マイコプラズマ検査陰性の結果を示す。左側のバンドはDNAの分子量基準を示しています。右側の4つのバンドはポジティブコントロールです。マイコプラズマが検出されなかったため、テストした細胞型の下にバンドは現れませんでした。
培地にpH指示薬が含まれている場合、細胞の最適pH値は7.4で赤くなります。細胞が成長すると、培地の色が赤から黄色に変わります3。この色の変化は、細菌がフラスコを乗っ取って増殖した場合にも発生する可能性があります(図6)。黄色はpHが低いことを示す。フラスコの横にある新しい未開封の培地ボトルを観察することは、付着した細胞の汚染を観察する客観的な方法です。浮遊培養の場合、ユーザーはフラスコを注意深く観察して、培地に浮遊する増殖がないか、またはガラスフラスコの内側に生い茂った細菌細胞の厚いリングが存在するかどうかを観察できます。どちらの細胞型でも、小さなサンプルを採取して顕微鏡で観察することができます。他の増殖や細胞の形状が観察された場合、特に細胞が動いている場合、これは汚染の指標です(図7)。このタイプの破片は血球計算盤にのみ存在し、細胞培養自体には存在しない可能性があるため、血球計算盤の徹底的な洗浄は細胞計数の前に実行する必要があります。
臭いはインキュベーター内の汚染の別の指標かもしれません。細菌の異常増殖には、経験豊富な細胞培養ユーザーが気付く典型的な匂いがあります。臭いは常に汚染されたフラスコと一致しますが、1つの感染したフラスコが常にインキュベーター全体の臭いを引き起こすとは限りません。
カビ汚染は、懸濁液中で増殖したHEK 293 S細胞でより一般的である傾向があります。細菌汚染はSF-9細胞でより一般的です。これは、RIC細胞が湿度とともに増殖し、それによってインキュベーター内に水分が蓄積するためである可能性があります。SF-9細胞は湿度なしで増殖するため、環境はより乾燥しています。付着培養における汚染率は、浮遊培養における汚染率よりも低い。これは、フラスコのサイズが小さいこと、フラスコが再利用できない性質、またはアルミホイルを使用する代わりに通気キャップが原因である可能性があります。
マイコプラズマは肉眼でも通常の光学顕微鏡でも観察できませんが、特殊な透過型電子顕微鏡でマイコプラズマを検出できます。マイコプラズマ同定キットを使用して、毎月細胞培養をテストする必要があります。マイコプラズマの多くの種は、PCRベースのアッセイを使用して確実に同定できます。このPCR検査の実施方法に関する簡単な説明はプロトコルセクションにあり、マイコプラズマの詳細についてはディスカッションセクションにあります。
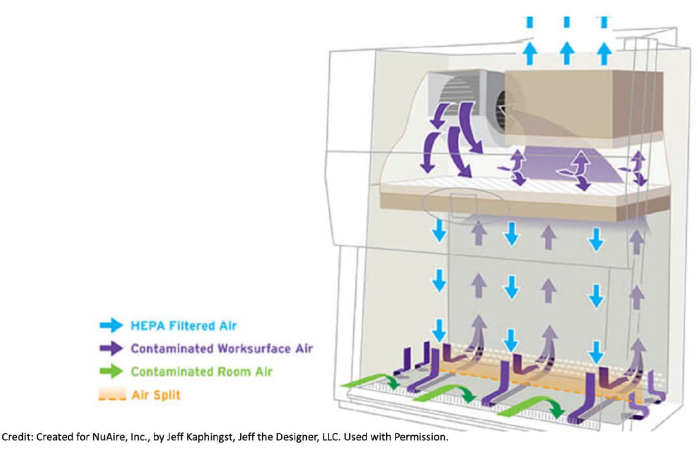
図1:バイオセーフティキャビネット内の空気の流れ。生物学的安全キャビネットは、部屋自体とキャビネットからフロントグリルとバックグリルを介して汚染された空気を引き出します。この空気は、金属作業面の下、キャビネットの背面、HEPAフィルターが配置されているユニットの上部まで行きます。そこで、空気はフィルターを通過し、ろ過されます。このきれいな空気が作業面を押し下げます。ろ過された空気の流れがキャビネット内で押し下げられる方法のため、ホバリングしないことをお勧めします。たとえば、開いたボトルの上にスリーブがあり、潜在的な汚染物質がメディアに押し込まれるリスクがあることは望ましくありません。キャビネット内に持ち込まれるアイテムの数は最小限に抑え、空気の流れを妨げないようにアイテムをフロントグリルまたはバックグリルに配置しないでください。アームをキャビネットに出し入れするのが速すぎると、空気の流れが妨げられる可能性もあります。Jeff Kaphingst, Jeff the Designer, LLCによってNuAire, Inc.のために作成されました。 許可を得て使用。この図の拡大版を表示するには、ここをクリックしてください。

図2:汚染されていない懸濁液および付着細胞およびカビまたは細菌で汚染された細胞。 左の最初の画像には、汚染されていない昆虫細胞(SF-9細胞)が含まれています。2番目の画像は、カビで汚染されたこれらの細胞の別のフラスコを示しています。3番目のフラスコは、厚くて白い曇った外観でわかるように、バクテリアによって汚染されていました。2番目と3番目のフラスコは、適切な細胞培養技術と慣行に従わなかったため、汚染されていました。全てのフラスコは同日に調製した。細菌汚染については翌日、カビ汚染については2日後に増殖が観察された。非汚染接着細胞(Hek293細胞)が、付着培養物中のカビおよび細菌汚染とともに示されています。カビの汚染は、丸いペトリ皿の2行目に示されています。写真は皿の上から撮ったものです。 この図の拡大版を表示するには、ここをクリックしてください。

図3:細胞培養キャビネットの構成。 生物学的安全キャビネット内では、アイテムの量を最小限に抑える必要があります。背面と前面のグリルにアイテムを配置することは避けてください。このキャビネットには、ピペット、チップ、オートクレーブ滅菌ガラスピペット、ピペットエイド、マーカーのセットが入っています。真ん中の作業エリアは明確です。 この図の拡大版を表示するには、ここをクリックしてください。

図4:オペレータがフローフードの下で作業するための正しい方法。 オペレーターは、作業を開始する前に清潔な白衣と手袋を着用する必要があります。オペレーターが手袋を頻繁にスプレーできるように、70%のEtOHを含むスプレーボトルを近くに置いておく必要があります。皮膚は手袋または白衣で覆われています。オペレーターは、キャビネット内で作業するときに腕が90°の角度になるように椅子を調整する必要があります。アイテムはキャビネット内で簡単に手の届くところにある必要があります。 この図の拡大版を表示するには、ここをクリックしてください。

図5:マイコプラズマ検査結果が陰性。 マイコプラズマの多くの種は、PCRベースのアッセイを使用して確実に同定できます。左側のバンドはDNAの分子量基準を示しています。右側の4つのバンドはポジティブコントロールです。マイコプラズマが検出されなかったため、テストした細胞型の下にバンドは現れませんでした。 この図の拡大版を表示するには、ここをクリックしてください。

図6:通常のメディアの色が赤から黄色に変わります。 細胞培養培地は、pH指示薬が存在する場合、色を赤から黄色に変化させます。黄色はpHが低く、培地を交換する必要があることを示します。 この図の拡大版を表示するには、ここをクリックしてください。

図7:光学顕微鏡で観察された汚染物質。 細胞カウントの実行中に光学顕微鏡で他の増殖または細胞形状が観察される場合、これは汚染の指標である可能性があります。このタイプの破片は血球計算盤にのみ存在し、細胞培養物自体には存在しない可能性があるため、血球計算盤の徹底的な洗浄は細胞計数の前に実行する必要があることに注意してください。 この図の拡大版を表示するには、ここをクリックしてください。
補足ファイル1:付録このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
汚染は細胞培養作業を行う際の主な懸念事項の1つですが、この原稿で概説されている実践と技術はリスクを軽減するのに役立ちます。重要なステップには、細胞培養室でのみ使用される清潔な白衣の着用、70%EtOHを頻繁に噴霧し、細胞株を切り替えるときに交換される清潔で粉末を含まない手袋の使用、各個人に培地ボトルを共有しないように促すこと、作業終了の前後にキャビネットを徹底的に清掃することが含まれます。 血清学的ピペットをきちんと開梱し、開いたボトルやフラスコとの長時間の密接な接触を避け、複数の細胞株間で培地ボトルを共有しず、インキュベーターのドアをすばやく開閉します。さらに、自分のガラス製品を洗浄してオートクレーブすることで品質管理が保証され、外部の汚染物質が持ち込まれる可能性が低くなります。品質管理方法には、オートクレーブテープを使用して滅菌器が121°Cの適切な温度に達したかどうかを示すこと、機器の定期的な予防保守、フラスコが適切にこすられたことを確認するためのフラスコの目視検査が含まれます18。もう一つの重要なポイントは、細胞タイプごとに別々のインキュベーターを使用して、ある細胞タイプからの汚染が他の細胞タイプに移らないようにし、細胞との交差汚染が発生しないようにすることです。
細菌感染症と真菌感染症は、細胞培養における2つの最も一般的な侵入者です。主要な汚染物質の1つであるM. oraleは、ヒトの口の中で最も一般的なマイコプラズマ種であり、「細胞培養におけるすべてのマイコプラズマ感染の20%〜40%を占める単一の最も一般的な分離株を表しています」4。言い換えれば、ラボの人員がこの汚染の主な原因です。マイコプラズマは小さくて成長の遅い微生物であり、0.45 μmのフィルターを通過できる硬い細胞壁がないため、細胞培養室では常に懸念事項です4。研究によると、マイコプラズマ汚染の発生率は、連続したヒトまたは動物の細胞株の15%〜35%です4。さらに、統計によると、世界の細胞株の約5%から30%がマイコプラズマ6で汚染されています。残念ながら、マイコプラズマは細胞培養に使用されるほとんどの抗生物質に耐性があり、感染は細胞の生理学と代謝に影響を与える可能性があります4,6。汚染は細胞代謝を遅くしないが、最終生成物6を汚染する可能性がある。感染は、ラボのメンバーが細胞の損傷に気付かずに続く可能性があります。汚染が発生した場合、新しい細胞の解凍コスト、新しい培養物の増殖に費やす時間、無駄になった高価な培地、除染インキュベーター、および同僚が実験を再開するのを待つのに費やす時間は莫大です。私たちの研究室では、2週間の総損失時間を説明し、8 Lの典型的なヒト哺乳類細胞タンパク質発現の汚染に関連する総コストは1,400ドルであると推定しています。この原稿で概説されているプラクティスとテクニックは、追加コスト、細胞の損失、およびダウンタイムを軽減するための優れた予防策を提供します。
これらのプラクティスの変更は推奨されません。すべてのラボメンバーは、細胞培養室で作業する前にトレーニングを受け、その後、毎年再教育トレーニングを受ける必要があります7。ラボメンバーはまた、必要なすべての消耗品が1つのエリアにあるように細胞培養室を整理し、それによってラボメンバーが消耗品を求めて細胞培養室を出る必要性を最小限に抑える必要があります。
提示された技術の限界は、汚染が血清、インキュベーター、機能不全のオートクレーブ、汚れた白衣、または細胞の供給源などの外部源に由来する場合に観察されます。このプロトコルを厳守しているにもかかわらず汚染が発生した場合は、この技術のトラブルシューティングが必要になる場合があります。多くの外的要因がこのタイプの汚染の一因となる可能性があります。ラボのメンバーは慎重に、外部ソースを確認する必要があります。たとえば、供給者から購入したウシ胎児血清(FBS)の多くは、マイコプラズマで汚染されている可能性があります。1950年代と比較すると、これは今ではまれな出来事ですが、それでも発生する可能性があります6。汚染に気付いた場合は、すべてのメディアボトルを捨て、新しい細胞を解凍して新しいメディアを使用してプロトコルを再開する必要があります。カビやバクテリアの場合、汚染はすでにインキュベーター内に存在している可能性があります。同じインキュベーター内の他のフラスコをチェックして、細菌またはカビの成長が観察されるかどうかを確認する必要があります。汚染されたフラスコはすべて捨て、インキュベーターを除染する必要があります。汚染が見つからない場合は、オートクレーブに誤動作エラーがないかチェックする必要があります。ガラス製品は、そもそも適切にオートクレーブ処理されていない可能性があります。オートクレーブが121°Cに達していないにもかかわらず、オートクレーブテープの色が変わることがあります。 その後、使用する抗生物質溶液の有効期限を確認する必要があります。新しいソリューションの購入が必要になる場合があります。最後に、セルのソースを考慮する必要があります。それらは信頼できるラボサプライヤーからのものでしたか、それとも別のラボから借りましたか?セルは常に信頼できるラボサプライヤーから購入する必要があり、他のラボから借りてはなりません。最後に、白衣は清潔さを確保するために洗う必要があります19。インキュベーターの除染は、フラスコが汚染されているときはいつでも考慮する必要があります。細菌細胞またはカビ胞子が増殖して汚染を広げ続けることを許してはなりません。
既存の方法は、汚染の除去を反映しています。この原稿で概説されている方法は、汚染の除去ではなく予防に焦点を当てています。マイコプラズマ20を除去するための抗生物質の使用に関して、いくつかの手順が存在します。しかし、抗生物質の使用は、感染を完全に排除することができず、「耐性菌の発生を可能にする可能性がある」ため、危険です12。実際、「抗生物質で継続的に増殖した培養物の72%がマイコプラズマ陽性であることが示されましたが、抗生物質の非存在下で増殖した培養物の7%のみが感染しました」12。このデータは、抗生物質の使用が推奨され、役立つ可能性があるが、抗生物質の過剰使用または完全な依存は有益ではないという考えを強調しています。さらに、抗生物質を使用して汚染を除去すると、問題が持続することしかできません。抗生物質溶液は必要ありません。この論文の手法に従えば、汚染はうまく防止できるはずです。
この原稿で概説されている実践と技術は、毎月のマイコプラズマテストを実行するとき、および自家製の有能な細菌細胞を作るときに無菌環境を維持するために将来使用することができます。どちらのプロトコルも、最終製品が汚染されないように、細胞培養作業と同様にクリーンな環境を必要とします。
開示事項
著者には相反する利害関係はありません。
謝辞
この作業は、ハワードヒューズ医学研究所(HHMI)からの資金提供のおかげで可能になりました。原稿を読んでくださった研究室長のJue Chen氏、有益な編集とコメントをくださったDonna Tallent氏、そしてこの原稿のビデオコンポーネントを手伝ってくれたロックフェラー大学情報技術学部のJeff Hennefeld氏に感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| DPBS | Gibco | 14-190-144 | |
| DMEM F-12 Media | ATCC | 30-2006 | |
| Glass Baffled Flask | Pyrex | 09-552-40 | |
| Glass Pipettes | Fisher | 13-678-6B | |
| Pipette Aid | Drummond | 13-681-15A | |
| Serological Pipette | Corning | 07-200-573 | |
| T75 flask | Corning | 07-202-004 | |
| Trypsin | Gibco | 25-300-054 | |
| *Items may vary because this video is about general cell culture techniques |
参考文献
- Johnson, Z. L., Chen, J. Structural basis of substrate recognition by the multidrug resistance protein MRP1. Cell. 168 (6), 1075-1085 (2017).
- Capes-Davis, A., et al. Cell lines as biological models: practical steps for more reliable research. Chemical Research in Toxicology. 32 (9), 1733-1736 (2019).
- Segeritz, C. P., Vallier, L. Cell culture: growing cells as model systems in vitro. Basic Science Methods for Clinical Researchers. , 151-172 (2017).
- Drexler, H. G., Uphoff, C. C. Mycoplasma contamination of cell cultures: Incidence, sources, effects, detection, elimination, prevention. Cytotechnology. 39 (2), 75-90 (2002).
- Lincoln, C. K., Gabridge, M. G. Cell culture contamination: sources, consequences, prevention, and elimination. Methods in Cell Biology. 57, 49-65 (1998).
- Nikfarjam, L., Farzaneh, P. Prevention and detection of mycoplasma contamination in cell culture. Cell Journal. 13 (4), 203-212 (2012).
- Stacey, G. N. Cell culture contamination. Methods in Molecular Biology. 731, 79-91 (2011).
- Young, L., Sung, J., Stacey, G., Masters, J. R. Detection of Mycoplasma in cell cultures. Nature Protocols. 5 (5), 929-934 (2010).
- Barth, O. M., Majerowicz, S. Rapid detection by transmission electron microscopy of mycoplasma contamination in sera and cell cultures. Memorias do Instituto Oswaldo Cruz. 83 (1), 63-66 (1988).
- Mirabelli, P., Coppola, L., Salvatore, M. Cancer cell lines are useful model systems for medical research. Cancers. 11 (8), 1098 (2019).
- A cell culture master class: What your cells wish they could tell you. Science Available from: https://www.science.org/content/webinar/cell-culture-master-class-your-cells-wish-they-could-tell-you (2020)
- Langdon, S. P. Cell culture contamination: an overview. Methods in Molecular Medicine. 88, 309-317 (2004).
- Babic, Z., et al. Meta-research: Incidences of problematic cell lines are lower in papers that use RRIDs to identify cell lines. eLife. 8, e41676 (2019).
- Visconti, P., et al. Short tandem repeat profiling for the authentication of cancer stem-like cells. International Journal of Cancer. 148 (6), 1489-1498 (2021).
- Horbach, S. P. J. M., Halffman, W. The ghosts of HeLa: How cell line misidentification contaminates the scientific literature. PLoS One. 12 (10), 0186281 (2017).
- Why 70% isopropyl alcohol is a better disinfectant than 99% isopropyl alcohol when it comes to Covid-19. MunGlobal Available from: https://munglobal.com.au/resources/knowledge-base/pathogens/why-70-isopropyl-alcohol-is-a-better-disinfectant-than-99-isopropyl-alcohol/#:~:text=Due%20to%20the%20concentration%20difference (2023)
- United States Department of Agriculture. Processing and Safety. Food Safety Publications Available from: https://www.ars.usda.gov/ARSUserFiles/60701000/FoodSafetyPublications/p328.pdf (2004)
- Sterilizing Practices. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/infectioncontrol/guidelines/disinfection/sterilization/sterilizing-practices.html (2023)
- Coté, R. J. Aseptic technique for cell culture. Current Protocols in Cell Biology. , (2001).
- Uphoff, C. C., Drexler, H. G. Eradication of Mycoplasma contamination from cell cultures. Current Protocols in Molecular Biology. 106, 1-12 (2014).
- Bykowski, T., Stevenson, B. Aseptic technique. Current Protocols in Microbiology. 56 (1), e98 (2020).
- How a Class II, Type A2 Biosafety Cabinet Works. Nuaire Available from: https://www.nuaire.com/resources/class-ii-type-a2-biosafety-cabinet-how-it-works-article (2020)
- Phelan, K., May, K. M. Mammalian cell tissue culture techniques. Current Protocols in Pharmacology. 73, 1-23 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved