Method Article
Técnicas y prácticas de cultivo celular para evitar la contaminación por hongos y bacterias en el laboratorio de investigación de cultivos celulares
En este artículo
Resumen
Este protocolo presenta técnicas y prácticas esenciales de cultivo celular para ser utilizadas en el laboratorio de investigación de cultivos celulares para evitar la contaminación por hongos y bacterias. Dentro de la categoría de bacterias, se hará especial hincapié en la prevención de la contaminación por micoplasma.
Resumen
El cultivo celular es una habilidad delicada necesaria para cultivar células humanas, animales e insectos, u otros tejidos, en un ambiente controlado. El objetivo del protocolo es enfatizar las técnicas correctas utilizadas en un laboratorio de investigación para prevenir la contaminación por hongos y bacterias. Se hace especial hincapié en evitar la contaminación por micoplasma, una preocupación importante en la sala de cultivo celular debido a su pequeño tamaño y resistencia a la mayoría de los antibióticos utilizados para el cultivo celular. Estas mismas técnicas aseguran el crecimiento continuo y mantienen las células sanas. Tanto para los usuarios nuevos como para los experimentados de cultivos celulares, es importante adherirse constantemente a estas mejores prácticas para mitigar el riesgo de contaminación. Una vez al año, los laboratorios deben revisar las mejores prácticas de cultivo celular y hacer un seguimiento con una discusión o capacitación adicional si es necesario. Tomar medidas tempranas para prevenir la contaminación en primer lugar ahorrará tiempo y dinero, en comparación con la limpieza después de que ocurra la contaminación. Las mejores prácticas universales mantienen los cultivos celulares saludables, reduciendo así la necesidad de descongelar constantemente nuevas células, comprar costosos medios de cultivo celular y reducir la cantidad de descontaminación de la incubadora y el tiempo de inactividad.
Introducción
El cultivo celular tiene muchos usos en el laboratorio de investigación. Desde los orígenes del cultivo celular a principios del siglo 20, las líneas celulares han ayudado a avanzar en la ciencia. Las líneas celulares tienen varias ventajas; Varias líneas celulares pueden ayudar a los investigadores a estudiar la biología celular, producir baculovirus para estudios posteriores o producir grandes cantidades de una proteína de interés, por nombrar algunas1. Algunos usos adicionales incluyen el estudio del crecimiento de tejidos, ayudar a avanzar en el desarrollo de vacunas, la investigación toxicológica, el estudio del papel de los genes en organismos sanos y modelos enfermos, y la producción de líneas celulares híbridas 2,3. Las líneas celulares también pueden permitir la producción de fármacos3. Las técnicas asépticas adecuadas son necesarias cuando se trabaja con líneas celulares; Las prácticas y técnicas descritas en este manuscrito son aplicables a los laboratorios de investigación donde se realiza el trabajo de cultivo celular. No se discuten otros entornos de laboratorio.
La contaminación es a menudo la principal preocupación cuando se realiza el trabajo de cultivo celular. En el contexto de este documento, la contaminación generalmente se refiere a hongos y bacterias. El objetivo general del método descrito en este documento es describir a fondo las mejores prácticas para evitar la contaminación. Todos los miembros del laboratorio deben adherirse a estas prácticas cuando trabajen en la sala de cultivo celular de un laboratorio de investigación. Los laboratorios deben asegurarse de que todos los trabajadores participen activamente en el uso de estas mejores prácticas para prevenir la contaminación. El conocimiento de las prácticas y técnicas correctas ayudará a garantizar que los cultivos celulares permanezcan viables, sanos y libres de contaminación. El desarrollo de esta técnica se basa en la investigación de la literatura, siete años de experiencia trabajando con cultivos celulares y la necesidad de un método al que tanto los principiantes como los trabajadores experimentados de cultivos celulares puedan consultar anualmente.
Existe la necesidad de una técnica clara y estandarizada que todos los laboratorios de cultivo celular de investigación deben seguir. Gran parte de la literatura sobre contaminación por cultivos celulares discute la detección de micoplasma, técnicas asépticas, fuentes de contaminación, eliminación de contaminantes y prevención mediante el uso de antibióticos y pruebas regulares 4,5,6,7,8. Si bien esta información es útil, no hay videos presentes en la literatura que demuestren las técnicas adecuadas de cultivo celular que uno debe seguir. La ventaja de las prácticas presentadas sobre las técnicas alternativas es un enfoque en prevenir la contaminación antes de que ocurra, en lugar de detectar y corregir errores más tarde. Además, una demostración exhaustiva de técnicas asépticas, una discusión sobre la prevención del crecimiento de hongos y bacterias, e información sobre el flujo de aire del gabinete de bioseguridad son valiosos tanto para los trabajadores de cultivos celulares novatos como para los experimentados.
Las bacterias y los hongos son los dos tipos más comunes de contaminantes. Dentro de la categoría de bacterias, el micoplasma es una preocupación importante debido a su pequeño tamaño y capacidad para proliferar sin ser notado. Son organismos autorreplicantes sin pared celular rígida que dependen de las células eucariotas para crecer. Tienen capacidades metabólicas reducidas y pueden multiplicarse en gran medida mientras permanecen sin ser reconocidos en la inspección visual rutinaria de cultivos celulares y análisis microscópicos regulares, aunque la microscopía electrónica de transmisión puede detectar micoplasma 9,10. Además, pueden pasar a través de filtros microbiológicos10. El medio de cultivo celular proporciona nutrientes al micoplasma, aunque desafortunadamente la suplementación de los medios con antibióticos no afecta al micoplasma10. Se debe tener en cuenta que, en general, no es necesario complementar los medios con antibióticos; Las técnicas adecuadas deberían ser suficientes para mantener a raya la contaminación. La infección con micoplasma no conduce a la muerte celular inmediata, pero es preocupante para los investigadores, ya que afecta la reproducibilidad y la calidad de los datos.
Todo el personal de laboratorio debe adherirse estrictamente a las buenas prácticas de cultivo celular. Los cultivos deben analizarse para detectar micoplasma después de que se hayan comprado recientemente, mientras se cultivan actualmente, antes de la criopreservación y cuando se descongelan del nitrógeno líquido 2,10. Hay diferentes pruebas disponibles en el mercado utilizando reacción en cadena de la polimerasa (PCR), ensayo inmunoabsorbente ligado a enzimas (ELISA) o inmunotinción. 3 La literatura indica que "los aislados humanos representan un gran porcentaje de los contaminantes de micoplasma encontrados en el cultivo celular"5. Aunque se han descrito más de 200 especies de micoplasmas, alrededor de seis de ellas representan la mayoría de las infecciones. Estas seis especies son M. arginini, M. fermentans, M. hominis, M. hyorhinis, M. orale y Acholeplasma laidlawii10. Al igual que con otros tipos de contaminación, el aire y los aerosoles los llevan a los cultivos celulares5. Esto se repite en otros documentos, ya que el "operador humano es potencialmente el mayor peligro en el laboratorio"7. Aunque esto se hace a través de un error humano, el riesgo puede eliminarse si se sigue un procedimiento estándar. El desprendimiento del personal no se limita solo a la contaminación por micoplasma; Los cultivos celulares en un laboratorio generalmente están infectados con la misma especie de micoplasma, lo que indica que la contaminación se propaga de un matraz a otro debido a técnicas inadecuadas de cultivo celular10.
La prevención de la contaminación cruzada es también otra razón por la que se deben seguir las técnicas adecuadas de cultivo celular. Se observa que al menos entre el 15% y el 18% de las líneas celulares en todo el mundo pueden estar contaminadas o identificadas erróneamente11,12. Además de analizar las líneas celulares para detectar contaminación por micoplasma, también deben analizarse para detectar contaminación cruzada10. Para las líneas celulares humanas, la autenticación de líneas celulares mediante una técnica económica basada en el ADN llamada perfil de repetición corta en tándem (STR) es el estándar de referencia internacional actual, ya que es una manera fácil de confirmar la identidad de la línea celular 2,10,13,14. STR puede identificar líneas celulares mal etiquetadas o contaminadas de forma cruzada, pero no puede detectar el origen incorrecto del tejido10,13,14. La validez de los datos de la investigación puede verse comprometida si las líneas celulares están mal etiquetadas, identificadas erróneamente o contaminadas13. Al igual que otros tipos de contaminación, la contaminación cruzada puede ocurrir debido a una técnica deficiente que hace que los aerosoles se propaguen, un contacto erróneo que conduce a que el tipo de célula incorrecto ingrese a un matraz, o el uso de la misma botella de medios y reactivos con diferentes líneas celulares10. No se debe compartir botellas de medios; Compartir una botella de medios entre dos líneas celulares diferentes puede permitir que esas poblaciones celulares se mezclen, lo que lleva al tipo de célula de crecimiento más rápido a hacerse cargo completamente del matraz. Este reemplazo no se nota y conduce a un etiquetado incorrecto y una identificación errónea2. Una línea celular también puede confundirse con otra si se confunden cultivos durante la manipulación o el etiquetado10. Se debe prestar especial atención a mantener los reactivos, medios y frascos separados entre sí. Cada miembro del laboratorio debe tener sus propias botellas de medios; No se debe compartir entre los miembros del laboratorio. Las líneas celulares deben comprarse a un banco de células y proveedor calificado. Los laboratorios no deben compartir células. Los estudios muestran que, aunque las pruebas de STR y micoplasma se utilizan regularmente, muchos trabajos de investigación en la literatura ya han utilizado líneas celulares mal identificadas o contaminadas15. Examinar la investigación para encontrar estos documentos problemáticos e informar retroactivamente a los lectores sobre este asunto es engorroso. La prevención es la mejor manera de garantizar que este problema no ocurra en primer lugar.
La simple acción de rociar artículos con 70% de EtOH puede matar organismos; 70% EtOH actúa desnaturalizando proteínas y disolviendo lípidos en los organismos más comúnmente contaminantes, incluyendo bacterias y hongos16. Los estudios han demostrado que el 70% es la concentración más efectiva; Las proteínas de superficie no coagulan rápidamente con un 70% de EtOH para que puedan entrar en la célula, mientras que el agua que contiene es necesaria para el proceso de desnaturalización de las proteínas. Debido a la diferencia de concentración de agua y alcohol a ambos lados de la pared celular, el 70% de EtOH ingresa a la célula para desnaturalizar las proteínas enzimáticas y estructurales. Si se observa crecimiento de moho en matrazs, toda la incubadora debe descontaminarse rociándola primero con EtOH al 70% y secándola, seguida de una incubación nocturna de 16 h a 60 °C17. Esto mata la mayoría del moho y cualquier bacteria.
La principal ventaja de las prácticas de prevención sobre las técnicas alternativas para eliminar la contaminación después de que ocurra es que al prevenir la contaminación desde el principio, los trabajadores de laboratorio pueden estar seguros de que sus cultivos celulares están sanos y no habrá altos costos asociados con la descontaminación de incubadoras o el descarte de cultivos celulares. La eliminación de contaminantes de micoplasma después, por ejemplo, no es eficiente7. Tomarse el tiempo desde el principio para garantizar que el personal del laboratorio esté debidamente capacitado, que la sala de cultivo celular sea autónoma y que se utilice un procedimiento estándar ahorrará tiempo y dinero.
Protocolo
1. Preparativos
- General
- Use una bata de laboratorio limpia designada para usarse solo en la sala de cultivo celular y no en otras partes del laboratorio.
NOTA: La bata de laboratorio no necesita ser estéril. - Use guantes nuevos que no hayan tocado ninguna otra superficie. Asegúrese de que los guantes queden bien. Los guantes de nitrilo sin polvo son los mejores.
NOTA: Los guantes no necesitan ser estériles. - Para prepararse para el trabajo, rocíe los guantes, las mangas de la bata de laboratorio y el interior del gabinete de seguridad biológica con 70% de EtOH. Limpie la superficie de trabajo y el panel de vidrio con una toalla de papel sin pelusa.
NOTA: El uso de EtOH al 70% mata las bacterias con la mayor eficiencia16. La toalla de papel no necesita ser estéril. - Mantenga baños de agua dentro de la sala de cultivo celular y solo utilícelos para calentar medios de cultivo o descongelar células. Drene y lave los baños maríacos una vez a la semana, siguiendo las instrucciones del fabricante para la limpieza.
- Use una bata de laboratorio limpia designada para usarse solo en la sala de cultivo celular y no en otras partes del laboratorio.
- Dentro del armario de seguridad biológica
- Limite el número de artículos traídos al gabinete. No interrumpa el flujo de aire dentro del gabinete de seguridad biológica bloqueando las rejillas delanteras o traseras.
NOTA: Consulte la Figura 1 para obtener una explicación de cómo fluye el aire dentro de un gabinete. - Rocíe todos los artículos colocados dentro del gabinete con 70% de EtOH y séquelos. Comience rociando la parte superior de la botella de medios y trabajando hacia abajo. Del mismo modo, con una toalla de papel limpia, séquela, trabajando progresivamente hasta el fondo. No vuelva a subir hacia la tapa.
- Si el gabinete es lo suficientemente grande como para acomodar pipetas serológicas, se pueden colocar en el interior, de lo contrario se pueden almacenar en un recipiente montado en el exterior del gabinete. Compruebe si hay agujeros, rasgaduras o pinchazos en el envase a ambos lados de la pipeta revestida antes de usarlos. No arranque el envoltorio. En su lugar, despegue suavemente los extremos de la envoltura, inserte la pipeta serológica en una ayuda de pipeta y retire la envoltura con un movimiento fluido.
- No pase el cursor sobre botellas o frascos abiertos; Alcance sobre botellas o frascos abiertos, o abra artículos sobre la parte superior de los artículos ya abiertos en el gabinete de seguridad biológica.
NOTA: El flujo de aire dentro del gabinete empuja hacia abajo la superficie de trabajo, por lo que cualquier contaminación presente en el manguito, por ejemplo, puede ingresar a los cultivos celulares. - No vierta líquidos. En su lugar, añádalos con una pipeta serológica. Después de complementar los medios, mezcle bien el contenido e inicie la botella. Además, asegúrese de incluir una etiqueta para lo que se complementó con los medios.
- Limite el número de artículos traídos al gabinete. No interrumpa el flujo de aire dentro del gabinete de seguridad biológica bloqueando las rejillas delanteras o traseras.
2. Trabajo con líneas celulares adherentes
- Si se necesita un matraz de plástico, rocíe toda la bolsa y colóquela dentro del gabinete.
- Use pipetas de vidrio esterilizadas en autoclave o pipetas de plástico estériles desechables para aspirar los medios o las soluciones de lavado. Retire con cuidado la tapa metálica del recipiente de almacenamiento. Aísle una pipeta de vidrio agitando suavemente el recipiente en ángulo. Al meter la mano en el recipiente, evite tocar cualquier otra pipeta.
NOTA: Manipule la pipeta elegida desde un solo extremo. - Reemplace rápidamente las tapas de las botellas lo antes posible. Coloque las tapas en la superficie de trabajo boca abajo para que la llanta no toque la superficie de trabajo. No agarre la tapa desde la parte superior o inferior; En su lugar, toque las tapas desde los lados.
- Al aspirar líquidos, utilice un matraz de vacío situado fuera del armario en un recipiente secundario en el suelo.
NOTA: No arroje ningún residuo líquido en bolsas de residuos de riesgo biológico ya que las bolsas tendrán fugas. Los residuos se crearán mientras se trabaja dentro del gabinete. Mover las manos dentro y fuera del gabinete con demasiada frecuencia interrumpirá el flujo de aire. Deje cualquier residuo dentro del gabinete temporalmente. Colóquelo a un lado para que no interrumpa el trabajo. - Rocíe generosamente los guantes con 70% de EtOH cada vez que se sequen. Frote las manos para que los guantes no se mojen.
- Si una pipeta serológica toca por error algo en el gabinete, no dude en tirarla. Comience de nuevo con una pipeta serológica limpia en lugar de usar una que pueda estar contaminada.
4. Comprobación y almacenamiento de celdas
- Antes de colocar células en la incubadora, verifique cómo se ven bajo el microscopio. Si las células han sido completamente suspendidas, se deben observar células individuales.
- No hable, estornude, tosa ni respire pesadamente en las incubadoras. Abra y cierre rápidamente las puertas de la incubadora. Dejar las puertas abiertas durante más tiempo del necesario puede permitir que los contaminantes presentes en el aire entren en las incubadoras.
NOTA: Usar una máscara mientras se trabaja en la sala de cultivo celular puede ayudar ya que el micoplasma puede estar presente en la boca humana. Evite el uso de teléfonos celulares en la sala de cultivo celular, ya que no se recomienda hablar. - Asegúrese de que las tapas de todas las botellas estén bien cerradas antes de retirarlas del gabinete.
- Almacene los medios de cultivo celular en la oscuridad a 4 °C cuando no estén en uso, ya que son sensibles a la luz.
- Rocíe el interior del gabinete con EtOH al 70% nuevamente después de que se complete el trabajo de cultivo celular y seque la superficie con una toalla de papel. Vacíe las bolsas de basura de riesgo biológico. Repita este proceso y reemplace los guantes cuando cambie a una línea celular diferente.
5. Trabajo con líneas celulares de suspensión
- Para las células de suspensión cultivadas en matraces de vidrio, asegúrese de que los guantes estén bien rociados con 70% de EtOH, luego toque el papel de aluminio con los guantes húmedos y rocíe solo la parte inferior del matraz antes de colocarlo dentro del gabinete.
- Cuando tome una muestra para el recuento celular, retire solo un tubo de 1,5 ml de su recipiente. No toque ningún otro tubo. Coloque la tapa boca abajo sobre la superficie de trabajo. No toque el borde interior. Manéjelo con cuidado desde los lados y reemplácelo una vez terminado.
- Retire con cuidado la pieza de papel de aluminio doblada doble que cubre todo el cuello del matraz. Manipule el matraz de vidrio solo desde la parte inferior, no lo toque desde el cuello, una vez que la lámina esté apagada. Utilice una pipeta serológica de 1 ml para tomar una muestra para el recuento celular.
- No deje que los medios goteen por el costado de los matraces ; si lo hace, rocíe una toalla de papel con 70% de EtOH y límpiela de inmediato.
- Asegúrese de que las tapas y el papel de aluminio estén apretados antes de retirar las botellas o frascos de los gabinetes de seguridad biológica.
6. Incubación celular
- Utilice incubadoras separadas para diferentes tipos de células para evitar la contaminación cruzada de los diferentes tipos de células.
7. Recogida de residuos líquidos
- Recoger los residuos líquidos en un matraz trampa de vacío situado fuera del armario en el suelo en un recipiente secundario etiquetado como «Residuos».
NOTA: La manguera está conectada a un filtro absorbente de partículas de alta eficiencia (HEPA), que se reemplaza mensualmente.
8. Limpieza
- Retire la bolsa de residuos de riesgo biológico y lave los frascos de vidrio lo antes posible. Mantenga un protocolo de lavado de vidrio junto al fregadero. Consulte el archivo complementario 1 para conocer el protocolo de lavado.
- Autoclave la cristalería de cultivo celular en lugar de enviarla a una instalación de lavado de vidrio. Manténgalo separado de la cristalería en el área principal del laboratorio.
NOTA: Las células SF-9 dejan un borde de células muertas en el lado de los matraces si el vidrio no se frota bien. Consulte Archivo complementario 1 para el protocolo de autoclave.
9. Organización
- Organice la sala de cultivo celular para que todos los suministros estén ubicados en un área, minimizando así la necesidad de que los miembros del laboratorio salgan de la sala en busca de suministros.
- Etiquete cualquier botella de plástico utilizada para cosechar células y reutilizada en cultivo celular después como "Solo para uso de cultivo celular". Utilice los frascos de cultivo celular designados para un tipo de célula específico. Guarde las botellas en la sala de cultivo celular para facilitar el acceso.
10. Identificación de bacterias, hongos y contaminación por micoplasma
NOTA: No seguir el flujo de trabajo anterior puede provocar contaminación bacteriana, por hongos y micoplasma.
- Siempre antes de comenzar a trabajar, observe los frascos para detectar turbidez pesada, crecimiento adicional en forma de bolas borrosas y acumulaciones densas de células en el costado, todos los cuales son indicadores de contaminación.
NOTA: Un ojo experimentado puede diferenciar entre la turbidez causada por la contaminación microbiana y las células reales. Mientras que las células hacen que los medios normalmente claros aparezcan turbios, la contaminación bacteriana causa una gran turbidez con color blanco.- Identifique visualmente la contaminación por moho observando la aparición de bolas redondas y borrosas flotando en los medios (consulte la Figura 2).
- Identifique visualmente la contaminación bacteriana si el medio está turbio, blanco o turbulento (ver Figura 2).
- Identifique la contaminación por micoplasma haciendo una prueba mensual de micoplasma. Una prueba basada en PCR indica a los usuarios que tomen una muestra de células de 1,5 ml, realicen un recuento de células utilizando 10 μL, diluyan a 0,08 x 106 células/ml, disminuyan las células, lisen las células utilizando el tampón contenido en el kit y giren una última vez. El sobrenadante se incuba con cebadores que amplifican una variedad de especies de micoplasma. Ejecute un gel de ADN para visualizar las bandas. Sin bandas significa que el micoplasma no está identificado.
NOTA: Este contaminante importante puede estar presente en la boca humana. Es una buena práctica probar la contaminación por micoplasma en las células después de descongelarlas y antes de usarlas para experimentos. Después, controle las células para detectar contaminación por micoplasma una vez al mes. Muchas compañías ofrecen kits de prueba de micoplasma. Elija uno que sea adecuado.
Resultados
Si no se siguen las técnicas y prácticas adecuadas de cultivo celular descritas en este documento, puede ocurrir contaminación por hongos y bacterias en el laboratorio de cultivo celular de investigación. La figura 2 muestra matraces que contienen contaminación tanto en la suspensión como en los cultivos adherentes.
Cuando no se siguen técnicas asépticas, la contaminación por moho puede ocurrir 2-3 días después. Las bolas redondas y difusas que flotan en los medios son notables en las celdas de suspensión, mientras que el crecimiento de moho en las células unidas se puede observar como parches grandes, irregulares, blancos o verdes.
Para las bacterias, la contaminación se observa al día siguiente. Los medios de comunicación son turbulentos, blancos y nublados. El color blanco es típico de las células bacterianas, que se multiplican mucho más rápidamente que las líneas celulares. Un ojo experimentado es capaz de distinguir entre medios no contaminados y medios contaminados. Para las células adheridas, se puede comparar una botella de medio sin abrir con un matraz para verificar si se observa alguna turbulencia en el matraz.
Dentro del gabinete de seguridad biológica, el número de artículos debe mantenerse al mínimo. Evite colocar artículos en las parrillas trasera y delantera (consulte la figura 3). En este gabinete, un conjunto de pipetas, puntas, pipetas de vidrio esterilizadas en autoclave, una ayuda para pipetas y marcadores están dentro. El área de trabajo en el medio está despejada. Mantener los gabinetes organizados de esta manera es una buena idea. Además, el operador debe usar una bata de laboratorio limpia y guantes antes de comenzar a trabajar. Una botella de spray con 70% de EtOH debe mantenerse cerca para que el operador pueda rociar sus guantes con frecuencia. La piel está cubierta por guantes o una bata de laboratorio. El operador debe ajustar su silla para que sus brazos estén en un ángulo de 90° cuando trabaje dentro del gabinete, y los artículos deben estar al alcance de la mano dentro del gabinete (ver Figura 4).
Muchas especies de micoplasma se pueden identificar de manera confiable mediante un ensayo basado en PCR. La figura 5 muestra los resultados de una prueba de micoplasma negativa. La banda de la izquierda muestra los estándares de peso molecular para el ADN. Las cuatro bandas de la derecha son controles positivos. No aparecen bandas bajo los tipos de células analizadas porque no se detectó micoplasma.
Si el medio contiene indicadores de pH, será rojo para el valor óptimo de pH de las células a 7.4. Una vez que las células crecen, los medios cambiarán de color de rojo a amarillo3. Este cambio de color también puede ocurrir si las bacterias se apoderan del matraz y crecen demasiado (Figura 6). El color amarillo indica que el pH es bajo. Observar una nueva botella de medios sin abrir junto a un matraz es una forma objetiva de observar la contaminación en las celdas adheridas. Para los cultivos en suspensión, el usuario puede observar de cerca el matraz para detectar cualquier crecimiento que flote en el medio o si hay un anillo grueso de células bacterianas demasiado grandes alrededor del interior del matraz de vidrio. Para ambos tipos de células, se puede tomar una pequeña muestra y observarla bajo el microscopio. Si se observan otros crecimientos o formas celulares, especialmente si las células se mueven, entonces esto es un indicador de contaminación (Figura 7). Se debe realizar una limpieza completa del hemocitómetro antes del recuento celular, ya que este tipo de residuos puede estar presente solo en el hemocitómetro y no en los cultivos celulares mismos.
El olor puede ser otro indicador de contaminación en una incubadora. El sobrecrecimiento bacteriano tiene un olor típico que un usuario experimentado de cultivo celular notará. El olor siempre coincide con un matraz contaminado, aunque un matraz infectado no siempre puede hacer que toda la incubadora huela.
La contaminación por moho tiende a ser más frecuente en las células HEK 293 S cultivadas en suspensión. La contaminación bacteriana es más común en las células SF-9. Esto puede deberse a que las células RIC se cultivan con humedad, lo que conduce a la acumulación de humedad en las incubadoras. Las células SF-9 se cultivan sin humedad, por lo que el ambiente es más seco. La tasa de contaminación en cultivos adherentes es menor que la tasa de contaminación en cultivos en suspensión. Esto puede deberse al tamaño más pequeño del matraz, la naturaleza no reutilizable del matraz o la tapa ventilada en lugar del uso de papel de aluminio.
El micoplasma no se puede observar a simple vista ni con un microscopio de luz regular, aunque la microscopía electrónica de transmisión especializada puede detectar micoplasma. Se debe usar un kit de identificación de micoplasma para probar los cultivos celulares mensualmente. Muchas especies de micoplasma se pueden identificar de manera confiable mediante un ensayo basado en PCR. Una breve descripción sobre cómo se realiza esta prueba de PCR se puede encontrar en la sección de protocolo, y se puede encontrar más información sobre el micoplasma en la sección de discusión.
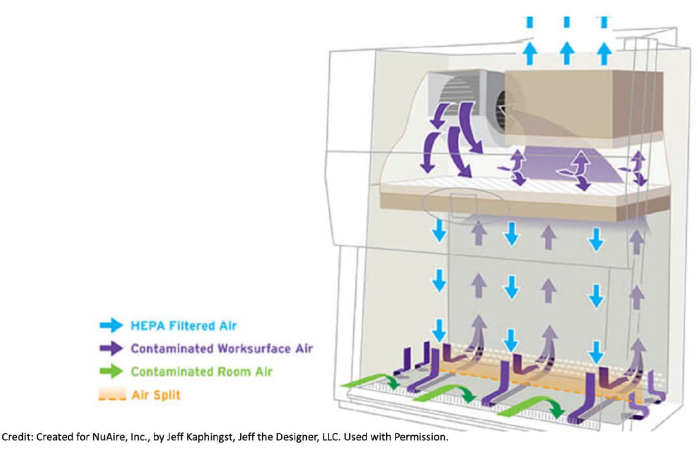
Figura 1: Cómo fluye el aire en un gabinete de bioseguridad. Los gabinetes de seguridad biológica extraen el aire contaminado de la habitación misma y del gabinete a través de las rejillas delanteras y traseras. Este aire pasa por debajo de la superficie de trabajo del metal, hacia la parte posterior del gabinete y hasta la parte superior de la unidad donde se encuentra un filtro HEPA. Allí, el aire pasa a través del filtro y se filtra. Este aire limpio empuja hacia abajo sobre la superficie de trabajo. Debido a cómo el flujo de aire filtrado es empujado hacia abajo dentro del gabinete, es una buena práctica no flotar. Por ejemplo, no es deseable tener una manga encima de una botella abierta y arriesgarse a que cualquier contaminante potencial sea empujado a los medios de comunicación. El número de artículos traídos dentro del gabinete debe mantenerse al mínimo, y los artículos no deben colocarse en las rejillas delanteras o traseras para no interrumpir el flujo de aire. Mover los brazos dentro y fuera del gabinete demasiado rápido también puede perturbar el flujo de aire. Creado para NuAire, Inc., por Jeff Kaphingst, Jeff the Designer, LLC. Usado con permiso. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Suspensión no contaminada y células adherentes y células contaminadas con moho o bacterias. La primera imagen de la izquierda contiene células de insectos (células SF-9) que no están contaminadas. La segunda imagen muestra otro matraz de estas células contaminadas con moho. El tercer matraz estaba contaminado por bacterias, como se puede observar por el aspecto grueso, blanco y turbio. El segundo y tercer matraz estaban contaminados porque no se siguieron las técnicas y prácticas adecuadas de cultivo celular. Todos los frascos fueron preparados el mismo día. El crecimiento se observó al día siguiente para la contaminación bacteriana y 2 días después para la contaminación por moho. Se muestran células adherentes no contaminadas (células Hek293) junto con moho y contaminación bacteriana en cultivos adherentes. La contaminación por moho se muestra en la segunda línea en una placa de Petri redonda. La foto está tomada desde la parte superior del plato. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Organización del gabinete de cultivo celular. Dentro del gabinete de seguridad biológica, la cantidad de artículos debe mantenerse al mínimo. Se debe evitar colocar artículos en las parrillas traseras y delanteras. En este gabinete, un conjunto de pipetas, puntas, pipetas de vidrio esterilizadas en autoclave, una ayuda para pipetas y marcadores están dentro. El área de trabajo en el medio está despejada. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: La forma correcta para que un operador trabaje debajo de la campana de flujo. Un operador debe usar una bata de laboratorio limpia y guantes antes de comenzar a trabajar. Una botella de spray con 70% de EtOH debe mantenerse cerca para que el operador pueda rociar sus guantes con frecuencia. La piel está cubierta por los guantes o la bata de laboratorio. El operador debe ajustar su silla para que sus brazos estén en un ángulo de 90 ° cuando trabaje dentro del gabinete. Los artículos deben estar al alcance de la mano dentro del gabinete. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Resultado negativo de la prueba de micoplasma. Muchas especies de micoplasma se pueden identificar de manera confiable mediante un ensayo basado en PCR. La banda de la izquierda muestra los estándares de peso molecular para el ADN. Las cuatro bandas de la derecha son controles positivos. No aparecen bandas bajo los tipos de células analizadas porque no se detectó micoplasma. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Cambio de color normal del medio de rojo a amarillo. Los medios de cultivo celular cambian el color de rojo a amarillo si hay indicadores de pH presentes. El color amarillo indica que el pH es bajo y el medio debe ser reemplazado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Contaminantes observados bajo el microscopio óptico. Si se observan otros crecimientos o formas celulares bajo el microscopio óptico mientras se realizan recuentos celulares, entonces esto puede ser un indicador de contaminación. Cabe señalar que se debe realizar una limpieza exhaustiva del hemocitómetro antes del recuento celular, ya que este tipo de desechos puede estar presente solo en el hemocitómetro y no en los cultivos celulares mismos. Haga clic aquí para ver una versión más grande de esta figura.
Archivo complementario 1: Apéndice Haga clic aquí para descargar este archivo.
Discusión
Si bien la contaminación es una de las principales preocupaciones al realizar trabajos de cultivo celular, las prácticas y técnicas descritas en este manuscrito ayudarán a mitigar los riesgos. Los pasos críticos incluyen usar una bata de laboratorio limpia, que solo se usa en la sala de cultivo celular, usar guantes limpios y sin polvo que se rocían con 70% de EtOH a menudo y que se cambian al cambiar entre líneas celulares, alentar a cada individuo a no compartir botellas de medios, limpiar el gabinete a fondo antes y después de terminar el trabajo, Desenvolver cuidadosamente las pipetas serológicas, evitar el contacto cercano prolongado con frascos o frascos abiertos, no compartir frascos de medios entre múltiples líneas celulares y abrir y cerrar rápidamente las puertas de la incubadora. Además, el lavado y esterilizado en autoclave de la propia cristalería garantiza el control de calidad, reduciendo así la probabilidad de introducir contaminantes externos. Los métodos de control de calidad incluyen el uso de cinta de autoclave para indicar si el esterilizador ha alcanzado la temperatura adecuada de 121 °C, el mantenimiento preventivo regular del equipo y la inspección visual del matraz para asegurarse de que se ha fregado correctamente18. Otro punto importante es utilizar incubadoras separadas para diferentes tipos de células para garantizar que la contaminación de un tipo de célula no se transfiera a otros y también para garantizar que no se produzca contaminación cruzada con células.
Las infecciones bacterianas y fúngicas son los dos intrusos más comunes en los cultivos celulares. Uno de los principales contaminantes, M. orale, es la especie de micoplasma más común en la boca humana y también "representa el aislado más común que representa el 20%-40% de todas las infecciones por micoplasma en cultivos celulares"4. En otras palabras, el personal de laboratorio es la principal fuente de esta contaminación. Siempre es una preocupación en la sala de cultivo celular ya que el micoplasma es un microorganismo pequeño y de crecimiento lento que carece de una pared celular rígida que puede pasar a través de filtros de 0,45 μm4. Los estudios muestran que la incidencia de contaminación por micoplasma es del 15%-35% de las líneas celulares humanas o animales continuas4. Además, las estadísticas indican que alrededor del 5% al 30% de las líneas celulares del mundo están contaminadas con micoplasmas6. Desafortunadamente, el micoplasma es resistente a la mayoría de los antibióticos utilizados para el cultivo celular, y la infección puede afectar la fisiología celular y el metabolismo 4,6. Aunque la contaminación no ralentiza el metabolismo celular, puede contaminar el producto final6. Las infecciones pueden persistir sin que los miembros del laboratorio noten daño celular. Si se produce contaminación, el costo de descongelar nuevas células, el tiempo dedicado a propagar los nuevos cultivos, los costosos medios que se han desperdiciado, la descontaminación de las incubadoras y la cantidad de tiempo que los colegas pasan esperando para comenzar sus experimentos nuevamente, es enorme. Nuestro laboratorio estima que el tiempo perdido total representa 2 semanas y el costo total asociado con la contaminación de una expresión típica de proteína de células de mamíferos humanos de 8 L es de $ 1,400. Las prácticas y técnicas descritas en este manuscrito ofrecen buenas medidas preventivas para mitigar los costos adicionales, la pérdida de células y el tiempo de inactividad.
No se recomiendan modificaciones de estas prácticas. Todos los miembros del laboratorio deben recibir capacitación antes de trabajar en la sala de cultivo celular y luego recibir capacitación de actualización cada año7. Los miembros del laboratorio también deben organizar la sala de cultivo celular para que todos los suministros necesarios estén en un área, minimizando así la necesidad de que los miembros del laboratorio salgan de la sala de cultivo celular en busca de suministros.
Se observan limitaciones de las técnicas presentadas si la contaminación proviene de fuentes externas como suero, incubadoras, autoclaves que funcionan mal, batas de laboratorio sucias o la fuente de las células. La solución de problemas de la técnica puede ser necesaria si se produce contaminación a pesar del estricto cumplimiento de este protocolo. Muchos factores externos pueden contribuir a este tipo de contaminación. Los miembros del laboratorio deben ser prudentes y verificar las fuentes externas. Por ejemplo, el lote de suero fetal bovino (FBS) comprado al proveedor puede haber sido contaminado con micoplasma. En comparación con la década de 1950, esto es ahora una ocurrencia rara, pero aún puede suceder6. Todas las botellas de medios deben desecharse si se nota alguna contaminación, y el protocolo debe reiniciarse descongelando nuevas células y utilizando nuevos medios. La contaminación puede haber estado presente dentro de la incubadora si es moho o bacterias; Los otros frascos dentro de la misma incubadora deben revisarse para ver si se observa crecimiento bacteriano o de moho. Todos los frascos contaminados deben desecharse y la incubadora debe descontaminarse. Si no se encuentra contaminación, se debe verificar el autoclave para detectar errores de mal funcionamiento; Es posible que la cristalería no haya sido esterilizada en autoclave correctamente en primer lugar. La cinta del autoclave puede cambiar de color a pesar de que el autoclave no alcance los 121 °C. Después, se deben verificar las fechas de vencimiento de las soluciones antibióticas utilizadas; Es posible que sea necesario comprar nuevas soluciones. Finalmente, se debe considerar la fuente de las células; ¿Eran de un proveedor de laboratorio de confianza o prestados de otro laboratorio? Las células siempre deben comprarse a un proveedor de laboratorio de confianza y nunca deben tomarse prestadas de otro laboratorio. Finalmente, las batas de laboratorio deben lavarse para garantizar su limpieza19. Se debe considerar la descontaminación de las incubadoras siempre que un matraz haya sido contaminado. No se debe permitir que las células bacterianas o las esporas de moho se multipliquen y continúen propagando la contaminación.
Los métodos existentes se basan en la eliminación de la contaminación. Los métodos descritos en este manuscrito se centran en la prevención más que en la eliminación de la contaminación. Existen varios procedimientos con respecto al uso de antibióticos para eliminar el micoplasma20. Sin embargo, el uso de antibióticos es riesgoso, ya que pueden no eliminar completamente la infección y "pueden permitir el desarrollo de organismos resistentes"12. De hecho, "el 72% de los cultivos cultivados continuamente en antibióticos demostraron ser micoplasmas positivos, mientras que solo el 7% cultivados en ausencia de antibióticos estaban infectados"12. Estos datos enfatizan la idea de que, si bien se recomienda el uso de antibióticos y puede ser útil, el uso excesivo o la dependencia completa de los antibióticos no es beneficioso. Además, el uso de antibióticos para eliminar la contaminación solo puede permitir que el problema persista. Las soluciones antibióticas no son necesarias; Si se siguen las técnicas de este documento, la contaminación debe prevenirse con éxito.
Las prácticas y técnicas descritas en este manuscrito se pueden utilizar en el futuro para mantener un ambiente aséptico al realizar la prueba mensual de micoplasma y al fabricar células bacterianas competentes hechas en casa. Ambos protocolos requieren un ambiente limpio, similar al trabajo de cultivo celular, para que el producto final no esté contaminado.
Divulgaciones
El autor no tiene intereses contrapuestos.
Agradecimientos
Este trabajo ha sido posible gracias a la financiación del Instituto Médico Howard Hughes (HHMI). Queremos agradecer a nuestro jefe de laboratorio, Jue Chen, por leer el manuscrito y por su continuo apoyo, Donna Tallent por sus útiles ediciones y comentarios, y Jeff Hennefeld del Departamento de Tecnología de la Información de la Universidad Rockefeller por su ayuda con el componente de video de este manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| DPBS | Gibco | 14-190-144 | |
| DMEM F-12 Media | ATCC | 30-2006 | |
| Glass Baffled Flask | Pyrex | 09-552-40 | |
| Glass Pipettes | Fisher | 13-678-6B | |
| Pipette Aid | Drummond | 13-681-15A | |
| Serological Pipette | Corning | 07-200-573 | |
| T75 flask | Corning | 07-202-004 | |
| Trypsin | Gibco | 25-300-054 | |
| *Items may vary because this video is about general cell culture techniques |
Referencias
- Johnson, Z. L., Chen, J. Structural basis of substrate recognition by the multidrug resistance protein MRP1. Cell. 168 (6), 1075-1085 (2017).
- Capes-Davis, A., et al. Cell lines as biological models: practical steps for more reliable research. Chemical Research in Toxicology. 32 (9), 1733-1736 (2019).
- Segeritz, C. P., Vallier, L. Cell culture: growing cells as model systems in vitro. Basic Science Methods for Clinical Researchers. , 151-172 (2017).
- Drexler, H. G., Uphoff, C. C. Mycoplasma contamination of cell cultures: Incidence, sources, effects, detection, elimination, prevention. Cytotechnology. 39 (2), 75-90 (2002).
- Lincoln, C. K., Gabridge, M. G. Cell culture contamination: sources, consequences, prevention, and elimination. Methods in Cell Biology. 57, 49-65 (1998).
- Nikfarjam, L., Farzaneh, P. Prevention and detection of mycoplasma contamination in cell culture. Cell Journal. 13 (4), 203-212 (2012).
- Stacey, G. N. Cell culture contamination. Methods in Molecular Biology. 731, 79-91 (2011).
- Young, L., Sung, J., Stacey, G., Masters, J. R. Detection of Mycoplasma in cell cultures. Nature Protocols. 5 (5), 929-934 (2010).
- Barth, O. M., Majerowicz, S. Rapid detection by transmission electron microscopy of mycoplasma contamination in sera and cell cultures. Memorias do Instituto Oswaldo Cruz. 83 (1), 63-66 (1988).
- Mirabelli, P., Coppola, L., Salvatore, M. Cancer cell lines are useful model systems for medical research. Cancers. 11 (8), 1098 (2019).
- A cell culture master class: What your cells wish they could tell you. Science Available from: https://www.science.org/content/webinar/cell-culture-master-class-your-cells-wish-they-could-tell-you (2020)
- Langdon, S. P. Cell culture contamination: an overview. Methods in Molecular Medicine. 88, 309-317 (2004).
- Babic, Z., et al. Meta-research: Incidences of problematic cell lines are lower in papers that use RRIDs to identify cell lines. eLife. 8, e41676 (2019).
- Visconti, P., et al. Short tandem repeat profiling for the authentication of cancer stem-like cells. International Journal of Cancer. 148 (6), 1489-1498 (2021).
- Horbach, S. P. J. M., Halffman, W. The ghosts of HeLa: How cell line misidentification contaminates the scientific literature. PLoS One. 12 (10), 0186281 (2017).
- Why 70% isopropyl alcohol is a better disinfectant than 99% isopropyl alcohol when it comes to Covid-19. MunGlobal Available from: https://munglobal.com.au/resources/knowledge-base/pathogens/why-70-isopropyl-alcohol-is-a-better-disinfectant-than-99-isopropyl-alcohol/#:~:text=Due%20to%20the%20concentration%20difference (2023)
- United States Department of Agriculture. Processing and Safety. Food Safety Publications Available from: https://www.ars.usda.gov/ARSUserFiles/60701000/FoodSafetyPublications/p328.pdf (2004)
- Sterilizing Practices. Centers for Disease Control and Prevention Available from: https://www.cdc.gov/infectioncontrol/guidelines/disinfection/sterilization/sterilizing-practices.html (2023)
- Coté, R. J. Aseptic technique for cell culture. Current Protocols in Cell Biology. , (2001).
- Uphoff, C. C., Drexler, H. G. Eradication of Mycoplasma contamination from cell cultures. Current Protocols in Molecular Biology. 106, 1-12 (2014).
- Bykowski, T., Stevenson, B. Aseptic technique. Current Protocols in Microbiology. 56 (1), e98 (2020).
- How a Class II, Type A2 Biosafety Cabinet Works. Nuaire Available from: https://www.nuaire.com/resources/class-ii-type-a2-biosafety-cabinet-how-it-works-article (2020)
- Phelan, K., May, K. M. Mammalian cell tissue culture techniques. Current Protocols in Pharmacology. 73, 1-23 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados