Method Article
Aqueous One-step Crosslinking 및 Co-nanopolymerization을 이용한 Stimuli-responsive Nanogel 합성
요약
나노겔은 생물학적 제제 전달을 위한 우수하고 다재다능한 나노입자 플랫폼입니다. 단백질 기반 페이로드를 캡슐화할 수 있는 자극 반응성 폴리(에틸렌) 글리콜 기반 고분자 나노 겔은 수성 조건에서 1단계 가교 공동 나노중합 전략을 사용하여 합성되었습니다. 이러한 새로운 나노 입자의 최적 제조 및 특성화가 여기에 제시되어 있습니다.
초록
가교 고분자 나노 입자로 구성된 나노 젤은 다재다능한 상향식 합성 및 생체 적합성으로 인해 수많은 화학 및 생물학적 치료제의 전달을 위해 개발되었습니다. 현재까지 나노겔 합성을 위해 다양한 방법이 사용되었지만, 생물학적 페이로드의 무결성을 손상시킬 수 있는 가혹한 유기 용매나 고온을 사용하지 않고 이를 달성한 방법은 거의 없습니다. 대조적으로, 여기에 제시된 방법론은 온화한 반응 조건을 사용하여 100nm 미만의 단백질 부하 나노겔의 합성을 수행합니다. 여기에서는 수성 기반, 단일 단계, 가교 공중합 기술을 사용하여 합성된 나노 겔 내 단백질 기반 페이로드의 비공유 캡슐화 방법을 제시합니다. 이 기술에서는 처음에 단백질 기반 페이로드를 양이온성 4차 암모늄 단량체에 정전기적으로 결합하고 동시에 과황산암모늄과 N,N,N',N'-테트라메틸에틸렌디아민을 사용하여 가교 및 공중합하여 단백질 페이로드를 포획하는 나노겔을 형성합니다. 나노겔의 크기 및 다분산 지수는 동적 광산란(DLS)을 사용하여 측정되는 반면, 표면 형태는 투과 전자 현미경(TEM)으로 평가됩니다. 나노겔 내에 포획된 단백질의 질량은 캡슐화 효율을 계산하여 결정됩니다. 또한, 산화 환원 반응성 구조 요소의 점진적인 분해를 통한 나노겔의 제어 방출 능력은 생물 환원 분석에서도 평가됩니다. 이 기술을 사용한 나노겔 합성 및 특성화의 모든 주의 사항을 보여주기 위해 나노 입자 최적화 데이터의 예를 제공합니다. 일반적으로 평균 크기가 57nm이고 다분산 지수 값이 0.093인 균일한 크기의 나노겔을 수득하였다. 76%의 높은 캡슐화 효율이 달성되었습니다. 또한, 나노겔은 48시간 동안 글루타티온의 존재 하에서 새로운 산화 환원 반응성 성분의 점진적인 분해에 의해 캡슐화된 단백질의 최대 86%의 제어된 방출을 나타냈습니다.
서문
나노겔은 가교 결합된 폴리머 네트워크 구조를 가진 3차원 서브미크론 크기의 하이드로겔로, 형태학적 무결성에 영향을 주지 않고 코어 쉘 내에 많은 양의 유체를 보유할 수 있습니다1. 일반적으로 나노겔은 수중유 역 마이크로에멀젼 2,3과 같은 이종 콜로이드 시스템에서 물리적 또는 화학적 가교를 통한 기능성 단량체의 중합에 의해 합성됩니다. 양친매성 공중합체는 수성 환경에서 나노 크기의 구조로 자체 조립할 수 있습니다. 그러나 이황화물 또는 아미드 기반 커플링, 클릭 화학을 포함하는 화학적 가교 전략을 사용하여 안정화해야 하며, 물리적으로 유도(소수성, 정전기 또는 수소 결합 전략) 또는 광 유도4. 이러한 전략 중 고분자의 물리적 자기 조립에 이은 화학적 가교는 성공적인 나노겔 제조 기술로 보고되었습니다5. 역사적으로 최초의 나노겔은 1990년대에 Vingradov 등6, Akiyoshi 등7 및 Lemieux 등8에 의해 소개되었지만, 최근에는 천연 및 합성 고분자로 구성된 다양한 스마트 나노겔이 다양한 생물 의학 응용 분야를 위해 개발 및 탐구되고 있습니다9.
나노겔은 광범위한 화물 보유 능력, 넓은 표면적, 생체 내 안정성, 맞춤형 화학적 및 기계적 특성을 가지고 있습니다10. 나노겔의 합성도 확장 가능하며 수성 기반이 될 수 있습니다. 또한, 나노겔의 향상된 수분 함량은 민감한 생물학적 페이로드(11)의 효과적인 운반체를 만든다. 또한, 높은 표면적은 다양한 생체접합 요구 사항을 충족할 수 있으며, 이를 통해 표적 양식의 부착을 허용하여 활성 표적화를 가능하게 합니다. 특히, 나노겔 설계의 다양성은 물리화학적 특성을 정밀하게 제어할 수 있는 광범위한 자극 반응성 단량체의 사용을 가능하게 합니다9. 이러한 독특한 공학성은 나노겔 설계의 합리적인 개선을 가능하게 하며, 이는 종래에 사용되는 리포좀, 미셀 또는 폴리메로솜으로는 달성하기 어렵다(12,13). 특별히 설계된 단량체 내에 자극 반응성 부분을 통합함으로써 나노겔은 pH, 산화 환원 조건, 효소 등과 같은 다양한 생리학적으로 관련된 자극에 반응하여 페이로드의 제어된 방출을 트리거하도록 설계할 수 있습니다.9,14. 이러한 스마트 나노겔은 혈액 순환 연장을 위한 우수한 안정성을 가지고 있기 때문에 기존 나노겔보다 더 유용하며, 화물의 무결성을 유지하고 원하는 표적 부위에서 제어된 방출을 중재하기 위해 생리적 조건을 견딜 수 있습니다(15). 실제로, 다재다능한 특성으로 인해 나노겔은 생물 의학 분야에서 견인력을 얻었으며, 수많은 테라노스틱 및 진단 응용 분야를 위한 자극 반응 나노겔 개발에서 주목할만한 발전을 이루었습니다 2,16,17.
생물학적 제제는 단백질, 펩타이드 및/또는 핵산으로 구성된 의약품의 범주를 대표할 수 있으며, 뛰어난 선택성으로 인해 치료 환경에 혁명을 일으켜 가장 빠르게 성장하는 치료제 클래스가 되었습니다18. 실제로, 이러한 치료제에 대한 시장의 성장은 2023년에 생물학적 제제가 전체 약물 승인의 ~40%를 차지한 미국 연방 약물 협회(FDA)의 승인이 가파르게 증가한 것에서 분명합니다19. 특이성과 효능 외에도 새로운 약물 표적의 빠른 발견, 보다 효율적인 생명공학 프로세스 및 이러한 치료제의 생체 내 운명에 대한 더 많은 지식으로 인해 사용이 증가했습니다20. 전통적인 생물학적 제제에는 일반적으로 재조합 DNA 기술을 사용하여 생성되는 간섭 RNA, 대체 단백질, 사이토카인 및 호르몬이 포함됩니다21. 1982년 인간 재조합 인슐린이 승인된 이래 암(예: 트라스투주맙, 아벨루맙), 염증성 장 질환(예: 아달리무맙, 세르톨리주맙) 및 희귀 유전 질환(예: 미포머산, 마이오자임, 알두라자임, 파브라자임)을 포함한 많은 질환에 대한 생물학적 제제가 개발되었습니다21. 생물학적 제제와 표적의 상호작용의 높은 특이성은 이론적으로 모든 off-target 효과를 상쇄해야 하지만, 원치 않는 부작용과 관련하여 생물학적 제제의 사용과 관련하여 몇 가지 임상적 우려가 제기되고 있다22. 이러한 부작용은 과장된 약리학(표적의 과도한 자극)과 면역원성의 두 가지 범주로 분류할 수 있습니다. 또한 짧은 반감기, 제한된 생체이용률, 프로테아제 손상, 짧은 유통 기한 및 비용이 많이 드는 생산 공정으로 인해 치료 이점이 제한됩니다21. 이러한 문제를 완화하기 위한 기존의 방법은, 이러한 생물학적 제제의 기능을 손상시킬 수 있는 이러한 생물학적 제제의 공유 변형을 포함하며, 따라서 효능23. 대안적으로, 치료 페이로드를 캡슐화하기 위한 나노의학 접근법은 약리학적 특성에 수많은 이점을 제공할 수 있으며, 가장 중요한 것은 향상된 투과 및 유지(EPR) 효과를 통해 염증 부위에 대한 수동적 표적화(EPR) 효과24를 제공할 수 있습니다. 다른 나노입자 관련 이점에는 순환 시간 향상, 청소율 감소, 제형 유연성 향상, 혈관 투과 및 세포 흡수 개선이 포함될 수 있습니다25. 현재 생물학적 페이로드의 전달을 위해 매우 다양한 나노 입자 제형이 연구되고 있지만 나노겔의 다기능성을 모방할 수 있는 것은 거의 없습니다. 실제로, 나노겔은 리포솜 및 미셀 기반 나노입자가 달성한 로딩 용량을 초과하며 대부분의 무기 나노입자보다 더 큰 콜로이드 안정성을 나타냅니다. 이와 같이 나노겔은 다양한 생물학적 치료제의 전달을 위한 귀중한 플랫폼을 제공합니다.
우리는 이전에 새로운 매트릭스 금속단백분해효소 반응성 가교 고분자 나노겔 내에서 항산화 효소를 성공적으로 전달했으며, 사용된 온화한 캡슐화 전략은 방출26 시 단백질의 생체 활성을 유지했습니다. 이 연구에서는 단백질 기반 페이로드의 전달을 위한 산화 환원 반응성 나노겔의 최적화된 합성을 보여줍니다. 특히, 합성 방법론은 가혹한 유기 용매나 고온을 사용하지 않고 원하는 페이로드를 캡슐화하기 위해 온화한 조건을 사용하여 나노겔 합성을 가능하게 합니다. 우리는 캡슐화된 페이로드27,28의 방출을 조절하기 위해 세포 내 환경 내에서 산화 환원 항상성을 이용했습니다. 전형적으로, 자연적으로 풍부한 산화 방지제 글루타티온 (GSH)는 세포외 및 세포내 산화 환원 전위를 조절하며, 여기서 농도는 2-20 μM 및 1-10 mM, 각각29,30 사이입니다. 현재까지 수많은 산화 환원에 민감한 나노 입자가보고되었으며, 이는 생체 내 약물의 제어 방출을 가능하게하는 입증되고 신뢰할 수있는 전략입니다 27,28. 실제로, 이황화물 함유 가교제(31,32), 이황화물 함유 단량체(33)로부터의 생분해성 고분자 자가 조립, 산화 환원 반응성 고분자 전구약물 또는 약물/고분자 접합체(34,35)를 사용하여 고분자 나노물질 내에 이황화물 결합이 설치되었습니다. 따라서 이 연구는 고분자 나노입자 내에 독특하고 GSH에 매우 민감한 이황화물 가교제의 통합을 조사하여 캡슐화된 단백질 페이로드의 제어된 방출을 가능하게 합니다.
이 연구에서 나노겔 설계는 특이성 및 페이로드 전달을 다루기 위해 다음과 같은 기준에 중점을 두었습니다: 내피의 효율적인 침투와 생체 내 안정성을 보장하기 위한 작은 크기(~100nm) 및 균일한 크기 분포(다분산 지수(PI)<0.3); 단백질 페이로드의 효율적인 캡슐화 및 GSH에 대한 응답으로 페이로드의 제어된 방출. 우리는 원하는 단백질 페이로드의 76% 캡슐화 효율로 균일한 sub-100nm 크기의 나노입자를 입증한 GSH 반응성 가교 나노겔의 합성을 보고합니다.
프로토콜
1. 산화 환원 반응성 가교제의 합성
- 2-아미노에틸메타크릴레이트 염산염(44.79mg, 0.270mmol)과 0.063mL의 트리에틸아민을 3mL의 무수 디클로로메탄에 넣고 25mL의 둥근 바닥 플라스크에 불활성N2 가스 아래에서 20분 동안 혼합합니다.
- 4,7,10,13,16,19,22,25,32,35,38,41,44,47,50,53-Hexadecaoxa-28,29-dithiahexapentacontanedioic acid di-N-succinimidyl ester(100mg, 0.045mmol)를 무수 디클로로메탄 1mL에 녹이고 플라스크에 첨가합니다.
- 플라스크에 무수 디클로로메탄 4mL를 추가합니다. 반응 플라스크를 알루미늄 호일로 싸고 실온에서 N2 이하에서 교반합니다.
- 박층 크로마토그래피로 제품 형성을 확인합니다. 이 방법으로 제품 형성을 확인하는 동안 시작 물질에 대한 올바른 참조를 확인하십시오.
- 박층 크로마토그래피는 반응 혼합물에서 원하는 화합물을 분리하는 데 사용되는 친화성 기반 방법입니다. 여기서, 극성이 높고 흡착성이 있는 실리카판을 고정상으로 사용합니다. 시작 물질 샘플과 반응 혼합물 샘플을 실리카 플레이트의 한쪽 끝에 놓고 용리액이 있는 닫힌 유리 비커에 수직으로 놓습니다(이동상: 5% 메탄올: 디클로로메탄).
- 모세관 작용에 의해 이동상은 실리카판 위로 이동하고 시료 화합물은 고정상 및 이동상에 대한 친화력에 따라 다양한 거리를 이동합니다. 솔벤트 전면이플레이트의 3 /4을 교차하면 플레이트를 제거하고 건조시킵니다. 분리된 화합물은 플레이트에 반점으로 나타납니다. 원하는 화합물의 머무름 계수(Rf) 를 화합물이 이동한 거리/용매가 이동한 거리로 정량화합니다. 여기서,생성물의 Rf 는 0.35였다. UV 광선 또는 염색을 사용하여 반점(과망간산칼륨)을 시각화할 수 있습니다.
- 혼합물을 진공에서 농축하고 플래시 컬럼 크로마토그래피(5% 메탄올의 등용매 혼합물: 디클로로메탄)36를 통해 정제합니다. 반응 혼합물을 실리카(고정상)로 충전된 유리 컬럼 상단에 도입한 다음 용매 시스템(이동상)36으로 용리합니다. 모든 분획을 수집하고 이전에 결정된 Rf 값을 사용하여 생성물 분획을 구별하기 위해 TLC를 사용하여 분석합니다.
- 회전 증발기(온도: 40°C)를 사용하여 용매를 증발시켜 정제된 분획을 농축하고 진공 압력을 대기압으로 설정하여 먼저 끓는 하부 디클로로메탄을 제거합니다. 용매의 수준이 감소를 멈추면 진공 압력을 337mbar로 설정하여 메탄올을 제거하고 옅은 노란색 오일을 얻은 다음 제품 형성(37)을 확인하기 위해 추가 특성화를 거칩니다.
- 푸리에 변환 적외선(FT-IR) 분석(38), 1HNMR(DEUTERATED DIMETHYLSULFOXIDE(DMSO-D 6))39, 13CNMR(39) 및 MALDI-ToF(matrix-assisted laser desorption/ionization time-of-flight)40 분석을 수행하여 다음 단계를 수행하기 전에 제품 형성을 확인합니다.
- FT-IR 분석의 경우 1mg의 오일을 기기에 로드하여 스펙트럼을 얻습니다.
- NMR 분석의 경우 관련 NMR 용매 10mL에 제품 0.75mg을 다시 용해시키고 NMR 튜브로 옮기고 누출을 방지하기 위해 단단히 밀봉합니다. 샘플을 NMR 기기에 로드한 후 스펙트럼을 얻습니다(39).
- 질량 분석 분석을 위해 제품 1mg을 바이알에 밀봉하고 DMSO에 용해시킨 다음 기기에 로드합니다.
참고: 적외선 분석은 원하는 제품의 주요 작용기, 즉 1650cm-1의 날카로운 피크로 식별되는 카르보닐 스트레치(C=O)에 대한 정보를 제공하여 아미드 결합의 형성을 나타내어 제품 형성을 강조합니다. 1HNMR 및 13C는 화학적 환경에 대한 정보를 제공하므로 화합물에 존재하는 화학적 환경의 식별을 통해 원하는 제품의 화학적 조성을 결정하는 데 사용할 수 있습니다. 마지막으로, 질량 분석법을 사용하면 원하는 제품의 정확한 질량을 확인할 수 있습니다.
2. 글루타티온을 이용한 이황화물 가교제의 절단 테스트
- 이황화물 가교제(최종 농도 4.55mg/mL)를 환원제 글루타치온(최종 [GSH]: 10mM)과 함께 1.5mL 유리 바이알에 24시간 동안 1mL의 최종 부피로 배양합니다.
- 이황화물 링커의 절단을 확인하려면 MALDI-ToF 분석을 위한 바이알을 제출하십시오26,40.
3. 산화 환원 반응성 나노겔 합성
- 여과된(0.20μm) 탈이온수로 세척한 후 흄후드 측면의 압축 공기 유틸리티를 통해 접근할 수 있는 압축 공기를 사용하여 유리 제품을 건조하여 반응에 사용할 모든 유리 용기에 먼지가 없는지 확인합니다. 접근 용이성을 위해 압축 공기 배출구에 안전한 노즐을 부착하십시오. 바이알을 단단히 잡고 노즐을 바이알에 넣습니다. 압축 공기를 활성화하여 제어된 스트림을 바이알로 방출합니다. 효과적인 건조를 위해 공정을 관찰하고 남아 있는 오염 물질이나 수분이 있는지 확인하십시오.
- 10mL 유리 바이알에 탈이온수를 채우고 플라스크를 고무 격막으로 밀봉합니다. 반응을 시작하기 전에 적어도 30분 동안N2 를 통해 물을 버블링하여 물을 탈산소화합니다. 이렇게하려면 풍선에 N2 가스를 채우고 풍선에 바늘을 부착하십시오. 중격에 놓고 바늘을 사용하여 고무 중격을 뚫고 N2 가 흐르도록합니다. N2의 일정한 흐름을 보장하기 위해 배출 바늘을 플라스크에 부착합니다.
- 소 혈청 알부민(BSA, 2mg, 30nmol) 또는 Cy7 태그 BSA(2mg, 30nmol)를 탈산소화된 탈이온수 1mL에 녹이고 다른 깨끗한 10mL 유리 바이알에 추가합니다.
- [2-(아크릴로일옥시)에틸]트리메틸암모늄클로라이드(AETC) 용액(12.00mg/10.86μL, 0.060mmol)을 플라스크에 넣고 다른 고무 격막으로 밀봉합니다. 반응 혼합물이N2 가스의 일정한 흐름 하에서 유지되는지 확인하고 30분 동안 교반합니다.
- 아크릴아미드(9.21mg, 0.13mmol)를 탈산소화된 탈이온수 1mL에 녹이고 바이알의 혼합물에 첨가합니다.
- 이황화물 가교제(4.44mg, 0.004mmol)를 탈이온수 1mL에 녹이고 바이알의 혼합물에 첨가합니다. N2 가스로 혼합물을 20 분 동안 씻어냅니다.
- 소듐 도데실 설페이트(2mg, 0.007mmol)를 탈산소화된 탈이온수 1mL에 녹이고N2 가스 플러시 주사기를 통해 혼합물에 첨가하고 혼합물을 30분 동안 교반합니다.
참고:N2 로 주사기를 플러시하면 라디칼 중합 반응을 억제할 수 있는 대기 중 산소에 대한 반응 혼합물의 노출을 최소화할 수 있습니다. - N,N,N',N'-테트라메틸에틸렌디아민(1.5 μL, 0.010 mmol)을 첨가하고 반응 혼합물을N2 가스 하에서 3분 동안 탈산소화합니다.
- 과황산암모늄(1mg, 0.004mmol)을 탈산소화된 탈이온수 1mL에 용해시키고 반응 혼합물에 첨가합니다. N2 가스가 10분 동안 반응 혼합물을 통해 버블링하는지 확인합니다.
참고:N2 첨가 단계를 생략하면 반응 플라스크에 흰색 미립자가 형성될 가능성이 있습니다. 이들은 더 큰 크기의 입자 및/또는 응집체이며 추가 특성 분석을 혼란스럽게 할 수 있습니다. - 플라스크를 N2 분위기에서 밀봉하고 실온에서 3시간 30분 동안 저어줍니다.
- 반응을 종료하려면 플라스크에서 씰을 제거하고 반응 혼합물을 최소 10분 동안 저어줍니다. 이것은 반응 혼합물을 O2 가스의 대기 수준에 노출시킨 다음 반응 혼합물에 남아있는 라디칼을 소멸시킵니다. 혼합물이 맑은 파란색 유백색 모양을 가정할 때 반응이 종료됩니다.
- 나노겔을 정제하기 위해 반응 혼합물을 15mL 원심 필터 장치(100kDa MWCO)에 넣고 탈이온수를 첨가하여 원심 장치를 채웁니다. 반응 혼합물을 1000 x g 에서 10분 동안 원심분리합니다. 이렇게 하면 100kDa보다 작은 미반응 화학 물질(또는 캡슐화되지 않은 페이로드)이 제거되고 나노겔 샘플이 농축됩니다.
- 원심 장치의 수분이 감소하면 2mL의 탈이온수를 첨가하여 나노겔 샘플을 희석하고 원심분리기를 사용하여 제품을 농축합니다. 이 단계를 3번 반복합니다.
- 캡슐화된 단백질의 분해를 방지하기 위해 샘플을 2-8°C에서 보관합니다.
- 중합을 확인하기 위해 FT-IR 및 1HNMR(중수소화 디메틸 설폭사이드(DMSO-d 6)) 분석을 수행합니다. 샘플을 준비하려면 1.5mL 바이알에 1mL의 나노겔 용액을 동결 건조합니다. 동결 건조 공정에는 샘플을 동결한 다음 진공을 적용하여 승화를 통해 동결된 용매를 제거하고 분말 잔류물을 남기는 작업이 포함됩니다. 동결 건조 후 샘플을 관련 NMR 용매에 다시 용해시키고 NMR 튜브로 옮겨 단단히 밀봉합니다. 앞에서 설명한 대로 샘플을 NMR 기계에 로드합니다39. FT-IR 분석의 경우 스펙트럼을 얻기 위해 1mg의 건조 분말을 기기에 로드해야 합니다.
4. 나노겔 형태학적 특성 분석
- 동적 광 산란(DLS)
참고: 유체역학적 직경(nm), 다분산 지수(PI) 및 제타 전위는 DLS 기계를 사용하여 25°C, 632.8nm 레이저 파장 및 173° 신호 검출기에서 측정되었습니다. 각 실행은 25개의 하위 스캐닝 주기를 측정했습니다.- 유체역학적 크기(nm) 측정
- 큐벳 또는 일회용 접힌 모세관 셀을 여과된 탈이온수로 세척하여 준비합니다. 압축 공기를 큐벳에 불어넣어(DLS 및 제타 전위 측정 모두에 적합) 큰 먼지 입자가 없는지 확인합니다.
- 큐벳에 최소 50-100 μL의 샘플을 채우고 750-1000 μL의 여과된 탈이온수로 희석합니다. 제타 전위 큐벳을 사용하는 동안 큐벳이 측정을 방해할 수 있는 기포 형성 없이 샘플로 채워졌는지 확인하십시오.
- 큐벳을 DLS 기기 내부에 넣고 올바르게 삽입되었는지 확인합니다. 이렇게 하려면 DLS 기기의 샘플 컴파트먼트 커버를 엽니다. 광학 창에 지문이 묻지 않도록 큐벳의 상단 가장자리를 잡으십시오. 큐벳이 큐벳 홀더에 제대로 장착되었는지 확인하고 수평을 이루고 기기의 광학 경로와 정렬되어 있는지 확인합니다. 주변광 간섭을 방지하기 위해 시료 격실을 닫습니다.
참고: 희석 매체는 0.45μm 기공 크기 주사기 필터를 사용하여 여과됩니다. - 관련 DLS 기계 소프트웨어에서 입자 크기 측정을 시작하려면 클릭하십시오.
- 시료에 해당하는 결과를 선택하여 z-평균(평균 입자 크기), 평균 PI, 초당 킬로 수(kcps), 제타 전위 및 관련 그래픽을 얻을 수 있습니다. 상관 함수가 균일한 표본을 암시하므로 부드러운 시그모이드 곡선을 나타내는지 확인하십시오.
- 분석이 완료되면 DLS에서 큐벳을 제거합니다.
- 유체역학적 크기(nm) 측정
- 투과 전자 현미경 (TEM)
- 10μL의 나노입자 용액(0.077mg/mL)을 탄소 코팅된 구리 그리드에 놓아 샘플을 준비합니다. 실온에서 1시간 동안 자연 건조합니다.
- 여과된 탈이온수로 그리드를 세척하고 여과된 1% 우라닐 아세테이트 5μL로 물에 2분 동안 염색합니다.
- 여분의 염색제를 여과지에 담근 후 그리드를 실온에서 밤새 건조시킵니다. 다음 날 명시야 카메라를 사용하여 45,000x 배율로 TEM 이미지를 캡처할 수 있습니다.
- 이미지 처리를 위해 제공된 소프트웨어를 사용하십시오(해상도: 2048 x 2048 픽셀).
5. 마이크로 비신코닌산(BCA) 분석을 사용하여 나노겔 내에 캡슐화된 단백질(BSA)의 정량화
- microBCA 분석 프로토콜(제조업체 웹 사이트에 제공)에 따라 사전 정의된 단백질 농도42를 기반으로 표준 곡선을 생성합니다.
- 합성 후 3.12-3.14 단계에 설명 된대로 100kDa MWCO (1000 x g, 10 분)로 15mL 원심 필터 장치를 사용하여 단백질 캡슐화 나노겔을 정제합니다.
- 여과액을 수집하고 microBCA 분석(프로토콜은 제조업체 웹사이트에서 사용 가능)을 사용하여 분석합니다. 플레이트 리더를 사용하여 562nm에서 흡광도를 측정합니다. 이 측정은 캡슐화되지 않은 단백질 농도와 관련이 있으므로 캡슐화된 단백질의 질량을 측정하십시오. 캡슐화 효율(EE) %를 계산하려면 다음 방정식을 사용합니다.
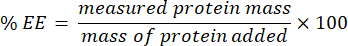
6. 글루타티온의 존재 하에서 나노겔로부터의 단백질 방출의 정량화
- 0.5mL 원심 필터 장치(100kDa MWCO)에서 200μL의 10mM 글루타치온(GSH)과 함께 5mg/mL의 Cy7BSA 부하 나노겔 200μL를 배양합니다. 필터 장치를 수조에 넣어 온도를 37°C로 유지합니다.
- 1000 x g 에서 3분 동안 원심분리기, 최소 1시간 동안 10분마다, 그 후에는 2-8시간마다.
- 여과액을 수집하여 추가 분석에 사용합니다. 탈이온수 또는 PBS를 더 추가하여 원심 필터 장치 내의 여과액 부피를 500μL로 유지합니다.
- Cy7BSA 부하 나노겔에 대한 표준 곡선을 참조하여 여과액 내 단백질의 양을 측정하며, 여기서 형광 단백질의 흡광도는 750nm에서 나노드롭 기기를 사용하여 측정되었습니다.
참고: 이 표준 곡선은 0mg/mL에서 2mg/mL 범위 내에서 Cy7BSA의 연속 희석을 준비하여 계산할 수 있습니다. nanodrop에서 얻은 값은 캡슐화 효율을 결정하기 위해 이 보정 곡선에 대해 보간될 수 있습니다.
결과
폴리(에틸렌 글리콜)(PEG) 디설파이드 디아크릴레이트 가교제의 합성 및 특성화 산화 환원 반응성 교차결합제는 아미드 결합의 형성을 통해 2-아미노에틸 메타크릴레이트에 의한 N-하이드록시숙신이미드(NHS) 에스테르의 친핵성 치환에 의해 합성되었습니다(그림 1). 필요한 생성물의 합성은 주로 1HNMR(보충 그림 1)에 의해 검증되었으며, 이는 제품 샘플을 중수소화 DMSO에 용해시켜 수행되었으며, 여기서 δ3.48-3.53에서 PEG 사슬의 에틸렌 단위에 해당하는 공명과 (N)CH2-CH 2 에 해당하는 삼중항의 조합δ3.59-3.65의 그룹을 사용하여 제품 형성을 식별할 수 있습니다. 형성된 생성물의 추가 특성화는 FT-IR(보충 그림 2), MALDI-ToF(보충 그림 3) 및 13CNMR(보충 그림 4)을 사용하여 수행되었습니다.
나노겔 내에 혼입하기 전에, 가교제(4.55mg/mL)의 절단성은 PBS에서 37°C에서 24시간 동안 GSH(11mM)로 배양하여 평가하였다. 그런 다음 APCI-MS를 사용하여 결과 제품을 검사했습니다(그림 2). 586.2969m/z([M + H]+ , 여기서 M = CH3C(CH2) COOCH2CH2NHOOCCH2CH2O[CH2CH2 O]7CH2CH2SH)에서 절단된 단편 피크를 식별할 수 있었습니다(그림 2).
나노겔 합성 및 물리화학적 특성 분석
나노겔의 합성 절차는 그림 3에 나와 있습니다. 나노겔의 합성을 확인하기 위해, 나노겔의 동결건조에 이어 1HNMR 및 FT-IR을 수행하였다. NMR 스펙트럼의 경우 δ1.25 및 δ2.10의 피크는 고분자 구조의 메탄트리일 및 메탄릴리디엔 수소 원자를 나타냅니다(보충 그림 5). 또한, δ3.70에서의 넓은 피크는 PEG의 메틸렌 수소 원자에 해당합니다(보충 그림 5). 따라서 NMR 스펙트럼은 아크릴아마이드 사슬의 존재를 확인하고 따라서 원하는 생성물을 형성하기 위한 중합이 발생함을 확인합니다. FT-IR 스펙트럼의 경우, 아크릴아마이드의 C=C 스트레치에 해당하는 1637-1640 cm-1 영역에서 피크가 없다는 것은 중합을 나타냅니다(보충 그림 6). 중합 및 페이로드 캡슐화를 추가로 확인하기 위해 나노겔 반응 혼합물을 프로토콜에 제공된 반응 시간 동안 일정한 시간 간격으로 DLS 측정을 수행했습니다(그림 4). 여기서 8.302nm에서 BSA에 해당하는 피크는 더 많은 것이 나노겔 내에 캡슐화됨에 따라 점차 감소하며, 정제 후 BSA 피크가 보이지 않아 나노겔 구조(26) 내에서 단백질의 캡슐화를 시사합니다.
표 1은 개념 증명으로서 Cy7 태그 소 혈청 알부민(Cy7BSA) 로딩 나노겔의 물리화학적 특성 분석 결과를 보여줍니다. 합성 후, 나노 겔을 원심 분리 또는 투석으로 정제하고, 물리 화학적 특성을 TEM 및 DLS로 특성화했습니다 (그림 5A, B). 나노겔의 유체역학적 반경은 50-100nm 사이일 때 적절한 것으로 간주됩니다. 강도 분포 그래프에 여러 개의 피크가 표시되는 경우, 이는 다양한 크기의 나노겔 집단이 존재하기 때문일 가능성이 높습니다(보충 그림 7A). 또한, 이러한 제품 샘플의 경우, 상관 함수가 부드러운 시그모이드 곡선과 대조적으로 불규칙하게 나타납니다. 이것은 부정적인 결과로 해석되어야 하며 폐기되어야 합니다. 허용 가능한 DLS 크기 결과는 관심 크기에서 정의된 단일 피크의 존재에 의해 관찰될 수 있습니다(보충 그림 7B). 또한, PI는 일정해야 하며 0.227까지 허용 가능해야 합니다. 이에 비해 빈 나노겔은 일관되지 않고 더 큰 크기를 보여줍니다(그림 5C,D). 나노겔의 제타 전위는 또한 나노겔의 양전하를 보장하기 위해 특성화되었으며, 이는 세포막과의 정전기 상호 작용을 가능하게 하여 세포 흡수를 촉진합니다(표 1).
보관 시 빈 및 Cy7BSA 부하 나노겔의 안정성은 4°C에서 보관하고 25°C에서 탈이온수에서 크기와 제타 전위를 측정한 후 1개월 후에 조사되었습니다(보충 그림 8A, B). 전체 크기 또는 제타 전위에서 거의 변화가 관찰되지 않았으며, 이는 이러한 공유 가교 나노겔의 안정성이 향상되었음을 나타냅니다.
측정해야 할 또 다른 중요한 파라미터는 나노겔의 캡슐화 효율이며, 이는 생리적 분해로부터 페이로드를 보호하는 데 필요합니다43,44. 이 프로토콜은 공급업체의 지침에 따라 단백질 포착의 캡슐화 효율(EE%)을 분석하기 위해 개발되었습니다. 그러므로, 이 프로토콜은 본질적으로 BSA의 표준 농도 곡선을 참조하여 세척액의 알려지지 않은 단백질 농도를 보간하는 것을 포함합니다. micro-BCA 분석에서 얻은 값은 정제된 나노겔의 세척에 존재하는 단백질 비율에 대한 아이디어를 제공합니다. 따라서 나노겔에 성공적으로 포획된 단백질 비율을 간접적으로 나타냅니다(표 1). 얻어진 효율 값은 70% 이상이어야 하며 각 합성 간에 큰 차이를 나타내지 않아야 합니다. 캡슐화 효율 값이 낮으면 음의 결과를 나타내며 이러한 제형을 폐기해야 함을 나타냅니다. 이러한 결과는 나노겔의 높은 캡슐화 용량을 확인시켜주어 단백질 전달에 대한 유망한 응용 분야를 강조합니다.
나노겔의 산화 환원 반응성 평가
나노겔의 GSH 반응성은 37°C에서 GSH(10mM)의 생리학적 농도에서 조사되었습니다(그림 6A)29. GSH의 이러한 농도는 GSH와 GSH 반응성 나노 물질28,32의 생리적 측정에 관한 문헌을 참조하여 결정되었다. 캡슐화된 Cy7BSA의 최대 86%가 48시간 이내에 방출되었습니다(그림 6B). 반면에, GSH가 첨가되지 않은 대조 실험은 15%의 단백질만 방출되었으며, 이는 표면 흡착된 단백질14,45의 파열 방출을 반영할 수 있습니다.
캡슐화된 단백질의 생물학적 무결성이 나노겔 합성, 분해 또는 보관 중에 손상되었는지 여부를 확인하기 위해 여과를 통해 분리한 단백질을 동결건조하고 FT-IR 분석을 실시했습니다(그림 7A). 단백질 3차원 구조는 폴리펩티드 사슬(46) 내에서 펩티드 결합의 C=O 및 N-H 그룹의 수소 결합에 의해 생성되는 α-나선, β-시트, β-턴 및 랜덤 코일을 포함하는 2차 구조로 구성됩니다. 이러한 2 차 구조와 관련된 적외선 흡수는 1700 cm-1 및 1600 cm-1 영역에서 나타납니다. 이 영역에 나타나는 아미드 I 띠의 분석은 단백질이 나노겔 합성, 분해 및 저장 중 어느 단계에서나 변성을 겪는지 여부를 나타낼 수 있다47. 천연 BSA의 적외선 흡수를 반응 혼합물에서 분리한 BSA와 비교하고, GSH로 나노겔을 배양한 후 30일 동안 나노겔 보관 후. 나노겔 합성 및 포스트 GSH 배양 중에 분리된 BSA의 경우, 1662cm-1의 피크는 BSA 구조에서 온전한 β회전의 우세를 나타냅니다. 그러나 30일 동안 보관된 나노겔에서 분리된 BSA에서 1613cm-1의 피크가 나타나는 것은 단백질 응집으로 인한 분자간 β장 구조의 형성을 나타냅니다. FT-IR 분석을 통해 얻은 결과를 확인하기 위해 원형 이색성(CD) 분석도 수행했습니다(그림 7B). 네이티브 BSA의 곡선과 일치하는 곡선에서 알 수 있듯이, 나노겔 반응 혼합물 및 포스트 GSH 배양에서 분리된 단백질은 단백질의 α나선 구조의 특징인 CD 스펙트럼의 208nm 및 222nm에서 자외선 영역의 두 음극 대역에 변화가 없기 때문에 변경되지 않았습니다. 30일 후 나노겔에서 분리한 BSA의 경우, 이러한 피크에서 경미한 수차가 보였는데, 이는 일부 응집을 나타낼 수 있습니다.
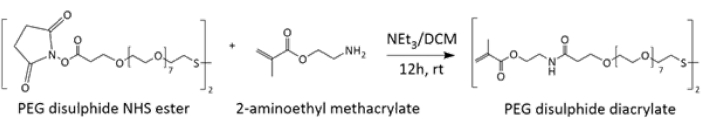
그림 1: PEG 디설파이드 디아크릴레이트 가교제의 합성을 보여주는 계획. 기본 조건에서 NHS 에스테르에 대한 1차 아민인 2-아미노에틸메타크릴레이트의 친핵성 공격은 아미드 결합을 형성하여 가교제를 생성합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
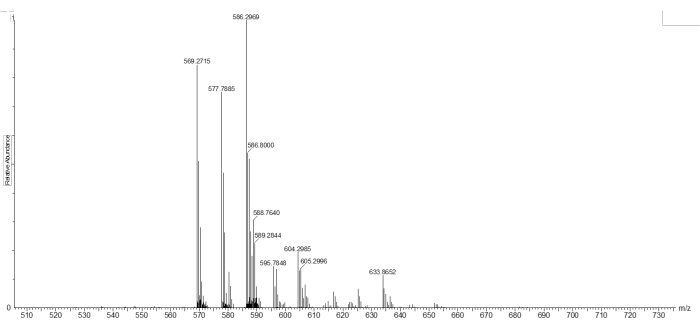
그림 2: 대기압 화학 이온화 - GSH로 배양한 후 절단된 PEG 디아크릴레이트 이황화물 생성물의 질량 스펙트럼. 데이터는 절단된 제품 M = C26H49NO11SH+의 분자 이온 피크를 보여주며, 여기서 [M + H]+ = 586.2969 m/z. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
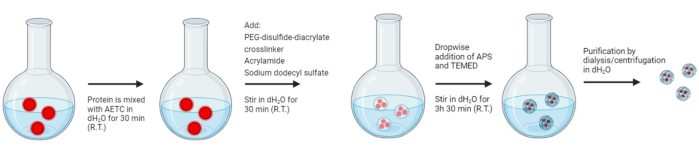
그림 3: 산화 환원 반응성 고분자 나노겔의 합성. 원스텝 수성 라디칼 중합 나노겔 합성. 단량체는 초기에 소듐 도데실 설페이트(SDS)의 미셀 내에 캡슐화되었으며, 여기서 현장 중합은 N,N,N',N'-테트라메틸에틸렌디아민(TEMED) 및 과황산암모늄(APS)에 의해 시작되었습니다. 고용해성 아크릴아미드(AM)는 수성 환경에서 나노겔 안정성을 유지하고, 2-(아크릴로일옥시)에틸트리메틸암모늄클로라이드(AETC)는 원하는 단백질 페이로드의 정전기 템플릿을 유지하고 조기 방출을 줄입니다. 또한, PEG 디설파이드 디아크릴레이트 가교제는 페이로드의 제어된 방출을 가능하게 합니다. SDS는 나중에 정제 방법에 의해 제거됩니다. 탈이온수 또는 투석에 의한 3회 세척으로 원심분리. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
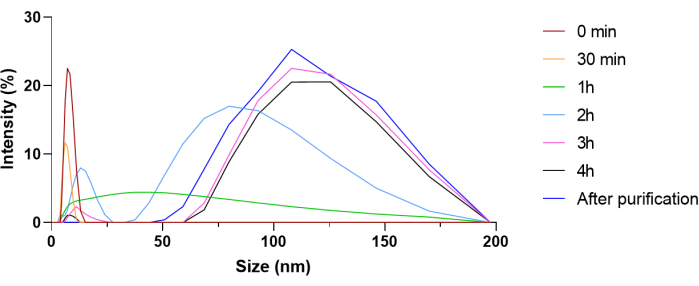
그림 4: 특정 시간 간격에서 나노겔 반응 혼합물의 동적 광 산란(DLS) 측정. BSA 단백질(8.302nm)과 관련된 피크 강도의 점진적인 감소를 사용하여 4시간 동안 단백질 캡슐화 및 중합 진행을 추적했습니다 . 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
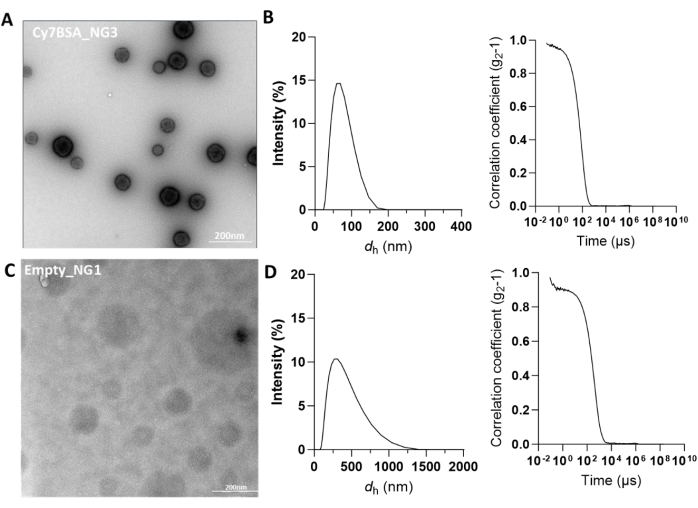
그림 5: Cy7-BSA_NG3 및 Empty_NG1의 특성 (A) Cy7BSA 부하 나노겔의 음성 염색 TEM(Cy7BSA_NG3). 200nm에서 눈금 막대. (B) Cy7BSA_NG3에 대한 크기 분포 및 상관 함수를 나타내는 DLS 트레이스. x 축의 dh는 나노 겔의 유체 역학적 직경 또는 크기를 나타냅니다. (C) 빈 나노겔의 음성 염색 TEM (Empty_NG1). 200nm에서 눈금 막대. (D) Empty_NG1에 대한 크기 분포 및 상관 함수를 나타내는 DLS 추적. x 축의 dh는 나노 겔의 유체 역학적 직경 또는 크기를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
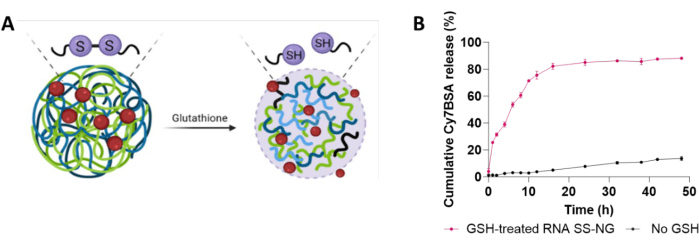
그림 6: Cy7BSA 캡슐화 나노겔에 대한 GSH 활성 조사(Cy7BSA_NG3). (A) 캡슐화된 페이로드의 GSH 매개 제어 방출. (B) 37°C에서 48시간 동안 10mM GSH 배양과 함께 Cy7BSA의 누적 방출. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
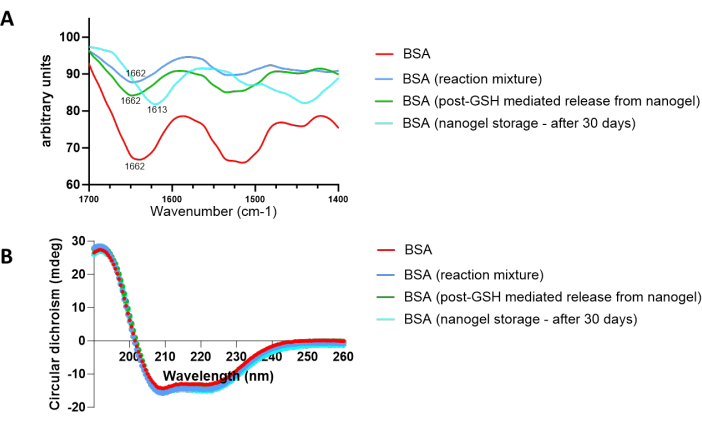
그림 7: 나노겔 반응 조건, GSH 매개 나노겔 분해 및 장기간의 나노겔 보관이 캡슐화된 BSA의 구조적 무결성에 미치는 영향. 다양한 조건에 노출되었을 때 BSA의 2차 구조의 변화는 (A) FT-IR 및 (B) 원형 이색성(CD)에 의해 확인되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 나노겔 | 크기 (nm) | 다분산 지수(PI) | 파생 평균 카운트 비율(kcps) | 제타 전위(mV) | 캡슐화 효율(%) |
| Empty_NG1 | 269.1 ± 14.80 | 0.4965 ± 0.0875 | 1820 ± 189 | -8.23 ± 0.04 | 0 |
| BSA_NG2 | 107.4 ± 36.22 | 0.201 ± 0.0035 | 2645 ± 174 | -2.977 ± 0.07 | 83.40 ± 0.5 |
| Cy7BSA_NG3 | 57.15 ± 11.79 | 0.093 ± 0.0019 | 4965 ± 233 | 24.78 ± 0.86 | 76.40 ± 0.2 |
표 1: 나노겔의 완전한 물리화학적 특성 분석. 나노겔의 구조적 특성은 크기, 다분산성(PI), 유도 평균 계수율, 제타 전위를 포함하여 요약됩니다. 각각의 캡슐화 효율성도 비교를 위해 포함되었습니다.
보충 그림 1: PEG 디아크릴레이트 디설파이드 가교제의 1HNMR 스펙트럼. 1H NMR (400 MHz, (CD3) 2SO) : δ8.05 (t, 2H), 6.07 (s, 2H), 5.69-76 (m, 2H), 4.05-4.09 (m, 8H), 3.61-3.65 (t, 4H), 3.57-3.59 (t, 4H), 3.48-3.53 (m, 56H), 2.88-20.91 (t, 4H), 2.31-2.34 (t, 4H), 1.88 (s, 6H). * 잔류 용매 (CH3) 2SO (δ 2.50). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: PEG 디아크릴레이트 디설파이드 가교제의 푸리에 변환 적외선 분광법(FT-IR). N- 아민 C (O) NH 스트레치 : 3700-3200 cm-1 (넓은); 알킬 sp3 C-H 스트레치 : 2950-2850cm-1 (강함), 카르 보닐 C = O 스트레치 : 1650cm-1 (강함). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 3: PEG 디아크릴레이트 디설파이드의 MALDI-ToF(Matrix-assisted laser desorption/ionization-time of flight) 스펙트럼. 계산 질량 (C50H92N2O22S2 +) : 1137.5656 m / z, 실제 : 1137.5660 m / z. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 4: PEG 디아크릴레이트 디설파이드 가교제의 13C핵 자기 공명(NMR) 스펙트럼. 13C NMR (400 MHz, (CD3) 2SO) : δ171.04, 166.89, 135.18, 125.36, 69.98-70.24, 69.20, 64.38, 64.54, 38.23, 36.79, 35.58, 18.49. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 5 : 동결 건조 된 나노 겔의 1H NMR 스펙트럼. 1H NMR (400 MHz, D2O) : δ3.70 (s), δ2.1 (m), δ1.25 (m). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 6: 동결건조된 나노겔의 푸리에 변환 적외선 분광법(FT-IR). N- 아민 C (O) N-H 스트레치 : 3700-3200 cm-1; 알킬 sp3 C-H 스트레치 : 2950-2850 cm-1 (강함), 카르 보닐 C = O 스트레치 : 1655 cm-1 (강함); C-O-C 스트레치: 1095cm-1 (샤 프). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 7: 나노겔의 특성화. (A) 여러 피크의 존재와 불규칙한 상관 곡선을 특징으로 하는 음의 DLS 결과. (B) 잘 정의된 단일 피크와 부드러운 시그모이드 상관 곡선의 존재를 특징으로 하는 양성 DLS 결과. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 8: 크기 및 제타 전위 측정에 의한 나노겔의 장기 안정성 조사. (A) 빈 나노겔 및 (B) Cy7BSA 로딩 나노겔 모두 30일 동안 DLS 분석을 받았습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
바이오 제약 산업에서 표적 특이적 생물학적 제제에 대한 수요가 증가함에 따라 급격한 생리학적 저하를 방지하고 원치 않는 부작용을 상쇄하는 동시에 생체 내 약리학적 프로필을 개선할 수 있는 기술에 대한 필요성이 높아졌습니다. 이를 염두에 두고, 단백질 로딩 나노겔의 합성을 위한 간단한 절차를 설명합니다. 프로토콜에서 나타난 바와 같이, 산화 환원 반응성 교차결합제는 나노겔 합성 전에 합성되어야 합니다. 그런 다음 주요 잔류 단량체를 첨가하고 소듐 도데실 설페이트(SDS)를 첨가한 후 N,N,N',N'-테트라메틸에틸렌디아민(TEMED) 및 과황산암모늄(APS)에 의해 현장 라디칼 중합을 시작합니다. 고용해성 아크릴아미드(AM)는 수성 환경에서 나노겔 안정성을 유지하고, 2-(아크릴로일옥시)에틸 트리메틸암모늄 클로라이드(AETC) 염은 원하는 단백질 페이로드의 정전기 템플릿을 유지하고 조기 방출을 줄입니다26. 또한, PEG 디설파이드 디아크릴레이트 가교제는 페이로드28,32의 제어된 방출을 가능하게 한다. SDS는 나중에 정제 방법에 의해 제거됩니다. 탈이온수 또는 투석에 대해 세 번 세척하는 원심분리.
전 세계의 많은 연구자들이 다양한 합성 전략을 사용하여 고분자 나노 입자를 합성했습니다 1,48,49. 당사의 합성 프로토콜은 유기 용매나 고온의 사용을 포함하지 않기 때문에 일반적으로 사용되는 방법과 근본적으로 다릅니다. 이것을 고려하면, 우리 절차의 참신함은 사용자의 능력이 나노겔의 성공적인 합성에 중요한 역할을 할 수 있음을 의미합니다. 나노겔 합성의 중요한 단계는 불활성 분위기의 유지를 보장하는 것이며, 이는 공기 중의 산소가 아크릴레이트 및 메타크릴레이트의 중합을 방해할 수 있기 때문에 원하는 생성물의 손실을 방지하기 위해 제어된 방식으로 이루어져야 합니다. 따라서 불활성 조건에서 각 시약을 혼합하고 첨가하려면 올바르게 수행하기 위해 약간의 연습이 필요할 수 있습니다. 그럼에도 불구하고, 개략적으로 설명 된 프로토콜은 수많은 다른 단량체를 합성에 추가하여 나노 겔에 특정 특성을 부여 할 수 있기 때문에 다양한 방법론을 제공합니다 (예 : 아크릴 화 된 이종 작용 단량체의 사용으로 나노 겔을 추가 생체 접합 절차에 적합하게 만듭니다). 또한, 충분한 최적화를 통해 핵산 기반 페이로드의 캡슐화를 탐색하는 것이 가능하며, 이는 희귀한 단일 유전자 질환뿐만 아니라 만성 및 진행성 질환을 치료하기 위한 유전자 요법의 사용이 엄청나게 부활했기 때문입니다50.
요약하면, 우리는 sub-100 nm 크기와 효율적인 페이로드 유지 능력을 가진 나노겔을 재현성 있게 합성하기 위한 온화한 수성 기반 전략을 제시했습니다. 또한, 나노겔 내에 새로운 이황화물 가교제를 통합함으로써 세포 내 환원제에 대한 반응으로 갇힌 페이로드의 제어된 방출을 입증했습니다. 우리는 또한 이 합성 전략이 페이로드를 손상시키지 않는다는 것을 보여주었습니다. 이 프로토콜은 자극 반응 나노 요법 분야에서 더 많은 혁신을 위한 기반을 제공할 것입니다. 독특하고 유연한 합성 조건으로 인해 나노겔은 앞으로 약물 전달 분야에서 중요한 역할을 할 것으로 예상됩니다.
공개
저자는 공개할 이해 상충이 없습니다. 신고할 재정 세부 정보가 없습니다.
감사의 말
임페리얼 칼리지 런던(Imperial College London) 화학과와 의학연구위원회(Medical Research Council Institute of Life Sciences)의 지원에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| 2-( acryloyloxy)ethyl]trimethylammonium chloride solution | Sigma Aldrich | 496146 | |
| 2-aminoethyl methacrylatehydrochloride | Sigma Aldrich | 516155 | |
| 4,7,10,13,16,19,22,25,32,35,38,41, 44,47,50,53-Hexadecaoxa-28,29-dithiahexapentacontanedioic acid di-N-succinimidyl ester | Sigma Aldrich | 671630 | |
| Acrylamide | Sigma Aldrich | 23701 | |
| Ammonium persulfate | Sigma Aldrich | 248614 | |
| Bovine serum albumin | Sigma Aldrich | B6917 | |
| Cy7- labelled bovine serum albumin | Nanocs | BS1-S7-1 | |
| Deuterated dimethyl sulfoxide | Sigma Aldrich | 547239 | |
| Dichloromethane | Sigma Aldrich | 270997 (anhydrous) and D65100 | |
| Glutathione | Sigma Aldrich | G4251 | |
| Methanol | Sigma Aldrich | 34860 | |
| N,N,N’,N’-tetramethylethylenediamine | Sigma Aldrich | 411019 | |
| Phosphate buffered saline | ThermoFisher | 10010023 | |
| Sodium dodecyl sulfate | Sigma Aldrich | 436143 | |
| Triethylamine | Sigma Aldrich | 471283 | |
| Uranyl Acetate | Agar Scientific | AGR1260A | |
| Equipment necessary for nanogel synthesis and characterisation | |||
| Amicon Ultra-15 Centrifugal filter units (100kDa MWCO) | Merck Millipore | C7715 | |
| Camera | Olympus | Veleta | |
| Carbon-coated copper grids | Agar Scientific | AGS160 | |
| Dialysis tubing (100kDa MWCO) | Spectrum labs | 11405949 | |
| Dynamic Light Scattering | Malvern | Zetasizer Nano Ultra | |
| Freeze dryer | Labconco | WZ-03336-01 | |
| Infrared spectroscopy | Agilent | Cary 630 FTIR | |
| iTEM software | Olympus | ||
| Mass spectrometry | Waters | Micromass MALDI microMX MALDI Q-ToF | |
| MF-MilliporeTM membrane filter (0.45/0.2μm pore size) | Merck Millipore, UK | HAWP04700, GSWP04700 | |
| Micro BCA Protein Assay Kit | ThermoFisher | 23235 | |
| Plate reader | Beckman | Coulter-PARADIGM | |
| Proton and Carbon-13 nuclear magnetic resonance data | Bruker | 400MHz AV-400 NMR spectrometer | |
| Rotary evaporator | Buchi | R-114 Rotary Vap System | |
| Single-use needles | Sterican | 4665643 | |
| Suba-Seal septa | Sigma Aldrich | Z124575 | |
| Transmission electron microscopy | Phillips | CM 100 TEM | |
| UV-vis spectrophotometer | Nanodrop | Nanodrop One/One C microvolume |
참고문헌
- Zhang, X., Malhotra, S., Molina, M., Haag, R. Micro- and nanogels with labile crosslinks - from synthesis to biomedical applications. Chem Soc Rev. 44 (7), 1948-1973 (2015).
- Chacko, R. T., Ventura, J., Zhuang, J., Thayumanavan, S. Polymer nanogels: A versatile nanoscopic drug delivery platform. Adv Drug Del Rev. 64 (9), 836-851 (2012).
- Hajebi, S., et al. Stimulus-responsive polymeric nanogels as smart drug delivery systems. Acta Biomaterialia. 92, 1-18 (2019).
- Lee, V. Y., et al. Nanogel star polymer architectures: A nanoparticle platform for modular programmable macromolecular self-assembly, intercellular transport, and dual-mode cargo delivery. Adv Mat. 23 (39), 4509-4515 (2015).
- Ekkelenkamp, A., Rachèl Elzes, M., Engbersen, J. F., Paulusse, J. M. Responsive crosslinked polymer nanogels for imaging and therapeutics delivery. J Mat Chem B. 6 (2), 210-235 (2018).
- Vinogradov, S. V., Zeman, A. D., Batrakova, E. V., Kabanov, A. V. Polyplex nanogel formulations for drug delivery of cytotoxic nucleoside analogs. J Control Rel. 107 (1), 143-157 (2015).
- Akiyoshi, K., Deguchi, S., Moriguchi, N., Yamaguchi, S., Sunamoto, J. Self-aggregates of hydrophobized polysaccharides in water. Formation and characteristics of nanoparticles. Macromol. 26 (12), 3062-3068 (1993).
- Lemieux, P., et al. Block and graft copolymers and NanoGel copolymer networks for DNA delivery into cell. J Drug Target. 8 (2), 91-105 (2000).
- Preman, N. K., Barki, R. R., Vijayan, A., Sanjeeva, S. G., Johnson, R. P. Recent developments in stimuli-responsive polymer nanogels for drug delivery and diagnostics: A review. Euro J Pharma Biopharmac. 157, 121-153 (2020).
- Oh, J. K., Drumright, R., Siegwart, D. J., Matyjaszewski, K. The development of microgels/nanogels for drug delivery applications. Prog Poly Sci. 33 (4), 448-477 (2008).
- Jiang, Y., Chen, J., Deng, C., Suuronen, E. J., Zhong, Z. Click hydrogels, microgels and nanogels: Emerging platforms for drug delivery and tissue engineering. Biomat. 35 (18), 4969-4985 (2014).
- Napier, M. E., DeSimone, J. M. Nanoparticle drug delivery platform. Poly Rev. 47 (3), 321-327 (2007).
- Malmsten, M. Soft drug delivery systems. Soft Matt. 2 (9), 760-769 (2006).
- Kamaly, N., Yameen, B., Wu, J., Farokhzad, O. C. Degradable controlled-release polymers and polymeric nanoparticles: Mechanisms of controlling drug release. Che Rev. 116 (4), 2602-2663 (2016).
- Molina, M., et al. Stimuli-responsive nanogel composites and their application in nanomedicine. Chem Soc Rev. 44 (17), 6161-6186 (2015).
- Ma, Y., Ge, Y., Li, L. Advancement of multifunctional hybrid nanogel systems: Construction and application in drug co-delivery and imaging technique. Mat Sci Eng: C. 71, 1281-1292 (2017).
- Wang, H., Qian, J., Ding, F. Recent advances in engineered chitosan-based nanogels for biomedical applications. J Mat Chem B. 5 (34), 6986-7007 (2017).
- Durán-Lobato, M., Niu, Z., Alonso, M. J. Oral delivery of biologics for precision medicine. Adv Mat. 32 (13), 1901935(2020).
- de la Torre, B. G., Albericio, F. The pharmaceutical industry in 2022: An analysis of FDA drug approvals from the perspective of molecules. Molecules. 28 (3), 1038(2023).
- Škalko-Basnet, N. Biologics: The role of delivery systems in improved therapy. Biologics. 8, 107-114 (2014).
- Andrews, L., Ralston, S., Blomme, E., Barnhart, K. A snapshot of biologic drug development: Challenges and opportunities. Human Exp Toxicol. 34 (12), 1279-1285 (2015).
- Sathish, J. G., et al. Challenges and approaches for the development of safer immunomodulatory biologics. Nat Rev Drug Disc. 12 (4), 306-324 (2013).
- Pfister, D., Morbidelli, M. Process for protein PEGylation. J Control Rel. 180, 134-149 (2014).
- Blanco, E., Shen, H., Ferrari, M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nat Biotechnol. 33 (9), 941-951 (2015).
- Golombek, S. K., et al. Tumor targeting via EPR: Strategies to enhance patient responses. Adv Drug Del Rev. 130, 17-38 (2018).
- Basak, S., et al. Simultaneous cross-linking and cross-polymerization of enzyme responsive polyethylene glycol nanogels in confined aqueous droplets for reduction of low-density lipoprotein oxidation. Biomacromol. 22 (2), 386-398 (2021).
- Morgulchik, N., Kamaly, N. Meta-analysis of in vitro drug-release parameters reveals predictable and robust kinetics for redox-responsive drug-conjugated therapeutic nanogels. ACS Appl Nano Mat. 4 (5), 4256-4268 (2021).
- Ghorbani, M., Hamishehkar, H. Redox-responsive smart nanogels for intracellular targeting of therapeutic agents: Applications and recent advances. J Drug Target. 27 (4), 408-422 (2019).
- Bajic, V. P., et al. Glutathione "redox homeostasis" and its relation to cardiovascular disease. Oxi Med Cell Long. 2019, e5028181(2019).
- Forman, H. J., Zhang, H., Rinna, A. Glutathione: Overview of its protective roles, measurement, and biosynthesis. Mol Asp Med. 30 (1-2), 1-12 (2009).
- Wang, Y. C., et al. Core-shell-corona micelle stabilized by reversible cross-linkage for intracellular drug delivery. Macromol Rapid Comm. 31 (13), 1201-1206 (2010).
- Elkassih, S. A., Kos, P., Xiong, H., Siegwart, D. J. Degradable redox-responsive disulfide-based nanogel drug carriers via dithiol oxidation polymerization. Biomat Sci. 7 (2), 607-617 (2019).
- Hu, X., et al. Stimuli-responsive polymersomes for biomedical applications. Biomacromol. 18 (3), 649-673 (2017).
- Navath, R. S., Wang, B., Kannan, S., Romero, R., Kannan, R. M. Stimuli-responsive star poly(ethylene glycol) drug conjugates for improved intracellular delivery of the drug in neuroinflammation. J Control Release. 142 (3), 447-456 (2010).
- Ling, X., et al. Glutathione-responsive prodrug nanoparticles for effective drug delivery and cancer therapy. ACS Nano. 13 (1), 357-370 (2019).
- Still, W. C., Kahn, M., Mitra, A. Rapid chromatographic technique for preparative separations with moderate resolution. J Org Chem. 43 (14), 2923-2925 (1978).
- JoVE. JoVE science education database - Organic chemistry. Rotary evaporation to remove solvent. JoVE. , Cambridge, MA. (2023).
- JoVE. JoVE science education database - Organic chemistry II. Infrared spectroscopy. JoVE. , Cambridge, MA. (2024).
- JoVE. science education database - Organic chemistry. Nuclear magnetic resonance (NMR) spectroscopy. JoVE. , Cambridge, MA. (2023).
- Kim, J. Sample preparation for matrix-assisted laser desorption/ionization mass spectrometry. Mass Spec Lett. 6, 27-30 (2015).
- Liu, P., Pearce, C. M., Anastasiadi, R. M., Resmini, M., Castilla, A. M. Covalently crosslinked nanogels: An NMR study of the effect of monomer reactivity on composition and structure. Polymers. 11 (2), 353(2019).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal Biochem. 150 (1), 76-85 (1985).
- Yu, M., Wu, J., Shi, J., Farokhzad, O. C. Nanotechnology for protein delivery: Overview and perspectives. J Control Release. 240, 24-37 (2016).
- Zhang, Y., Zhang, D., Wang, J. T., Zhang, X., Yang, Y. Fabrication of stimuli-responsive nanogels for protein encapsulation and traceless release without introducing organic solvents, surfactants, or small-molecule cross-linkers. Poly Chem. 12 (4), 554-563 (2021).
- Kamaly, N., et al. Targeted interleukin-10 nanotherapeutics developed with a microfluidic chip enhance resolution of inflammation in advanced atherosclerosis. ACS Nano. 10 (5), 5280-5292 (2016).
- Lu, R., et al. Probing the secondary structure of bovine serum albumin during heat-induced denaturation using mid-infrared fiberoptic sensors. Analyst. 140 (3), 765-770 (2015).
- Abrosimova, K. V., Shulenina, O. V., Paston, S. V. FTIR study of secondary structure of bovine serum albumin and ovalbumin. J Phys: Conf Ser. 769, 012016(2016).
- Kabanov, A. V., Vinogradov, S. V. Nanogels as pharmaceutical carriers: Finite networks of infinite capabilities. Ang Chem Int Ed Eng. 48 (30), 5418-5429 (2009).
- Li, C., Obireddy, S. R., Lai, W. F. Preparation and use of nanogels as carriers of drugs. Drug Del. 28 (1), 1594-1602 (2021).
- Kulkarni, J. A., et al. The current landscape of nucleic acid therapeutics. Nat Nanotechnol. 16 (6), 630-643 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유