Method Article
تخليق الهلاميات النانوية المستجيبة للمنبهات باستخدام التشابك المائي أحادي الخطوة والبلمرة النانوية المشتركة
In This Article
Summary
Nanogels هي منصة ممتازة ومتعددة الاستخدامات للجسيمات النانوية لتقديم الأدوية البيولوجية. تم تصنيع المواد الهلامية النانوية البوليمرية القائمة على البولي (الإيثيلين) جلايكول المستجيبة للمنبهات ، والقادرة على تغليف الحمولات القائمة على البروتين ، باستخدام استراتيجية البلمرة النانوية المشتركة ذات الربط المتقاطع من خطوة واحدة في الظروف المائية. يتم تقديم التصنيع والتوصيف الأمثل لهذه الجسيمات النانوية الجديدة هنا.
Abstract
تم تطوير الهلاميات النانوية التي تتكون من جزيئات نانوية بوليمرية متشابكة لتقديم العديد من العلاجات الكيميائية والبيولوجية ، نظرا لتوليفها المتعدد الاستخدامات من الأسفل إلى الأعلى والتوافق الحيوي. في حين تم استخدام طرق مختلفة لتخليق الهلام النانوي حتى الآن ، إلا أن القليل جدا منهم حققها دون استخدام مذيبات عضوية قاسية أو درجات حرارة عالية يمكن أن تلحق الضرر بسلامة الحمولة البيولوجية. في المقابل ، فإن المنهجية المعروضة هنا تحقق تخليق المواد الهلامية النانوية المحملة بالبروتين بحجم أقل من 100 نانومتر باستخدام ظروف تفاعل معتدلة. هنا ، نقدم طريقة للتغليف غير التساهمي للحمولات القائمة على البروتين داخل المواد الهلامية النانوية التي تم تصنيعها باستخدام تقنية البلمرة المشتركة القائمة على الماء ، أحادية الخطوة ، المتشابكة. في هذه التقنية ، نقوم في البداية بربط حمولة قائمة على البروتين إلكتروستاتيكيا بمونومر الأمونيوم الرباعي الكاتيوني وفي نفس الوقت نربط البلمرة المشتركة باستخدام بيرسلفات الأمونيوم و N ، N ، N '، N'-tetramethylethylenediamine لتشكيل المواد الهلامية النانوية التي تحبس حمولة البروتين. يتم تحديد حجم ومؤشر التشتت المتعدد للهلاميات النانوية باستخدام تشتت الضوء الديناميكي (DLS) ، بينما يتم تقييم مورفولوجيا السطح عن طريق المجهر الإلكتروني للإرسال (TEM). يتم تحديد كتلة البروتين المحاصر داخل المواد الهلامية النانوية عن طريق حساب كفاءة التغليف. علاوة على ذلك ، يتم أيضا تقييم قدرة الإطلاق المتحكم فيها للهلاميات النانوية عبر التحلل التدريجي للعناصر الهيكلية المستجيبة للأكسدة والاختزال في فحوصات الاختزال الأحيائي. نقدم أمثلة على بيانات تحسين الجسيمات النانوية لتوضيح جميع محاذير تخليق الهلام النانوي وتوصيفه باستخدام هذه التقنية. بشكل عام ، تم الحصول على هلاميات نانوية متجانسة الحجم بمتوسط حجم 57 نانومتر وقيمة مؤشر تشتت متعدد تبلغ 0.093. تم تحقيق كفاءة تغليف عالية بنسبة 76٪. علاوة على ذلك ، أظهرت المواد الهلامية النانوية إطلاقا محكما بنسبة تصل إلى 86٪ من البروتين المغلف عن طريق التحلل التدريجي للمكونات الجديدة المستجيبة للأكسدة والاختزال في وجود الجلوتاثيون على مدار 48 ساعة.
Introduction
الهلاميات النانوية عبارة عن هلاميات مائية ثلاثية الأبعاد بحجم ميكرون فرعي مع هياكل شبكة بوليمر متشابكة يمكنها الاحتفاظ بكميات كبيرة من السوائل داخل غلافها الأساسي دون التأثير على سلامتها المورفولوجية1. بشكل عام ، يتم تصنيع الهلاميات النانوية عن طريق بلمرة المونومرات الوظيفية عبر التشابك الفيزيائي أو الكيميائي في الأنظمة الغروية غير المتجانسة ، مثل المستحلبات الدقيقة العكسية للماء في الزيت2،3. يمكن أن تتجمع البوليمرات المشتركة البرمائية ذاتيا في هياكل نانوية في البيئات المائية. ومع ذلك ، يجب تثبيتها باستخدام استراتيجيات التشابك الكيميائية التي تتضمن ثاني كبريتيدات أو اقتران قائم على الأميد ، أو كيمياء النقر ، أو يمكن أن تكون مستحثة جسديا (استراتيجيات كارهة للماء أو إلكتروستاتيكية أو رابطة هيدروجينية) أو مستحثةبالضوء 4. من بين هذه الاستراتيجيات ، تم الإبلاغ عن التجميع الذاتي الفيزيائي للبوليمرات متبوعا بالتشابك الكيميائي كتقنية تصنيع نانوهلامناجحة 5. بينما تاريخيا ، تم تقديم أول نانو هلام في التسعينيات من قبل Vingradov et al.6 و Akiyoshi et al.7 و Lemieux et al.8 ، في الآونة الأخيرة ، تم تطوير واستكشاف مجموعة متنوعة من المواد الهلامية النانوية الذكية المكونة من البوليمرات الطبيعية والاصطناعية لتطبيقات طبية حيويةمتنوعة 9.
تمتلك Nanogels قدرة واسعة على الاحتفاظ بالبضائع ، ومساحة سطح كبيرة ، واستقرار في الجسم الحي ، بالإضافة إلى خصائص كيميائية وميكانيكية قابلة للتخصيص10. تخليق الهلاميات النانوية قابل للتطوير أيضا ويمكن أن يكون قائما على الماء. بالإضافة إلى ذلك ، فإن المحتوى المائي المعزز للهلاميات النانوية يجعلها ناقلات فعالة للحمولات البيولوجيةالحساسة 11. علاوة على ذلك ، يمكن أن تلبي مساحة السطح العالية احتياجات متعددة من الاقتران الحيوي ، مما يسمح بربط طرائق الاستهداف لتمكين الاستهداف النشط. والجدير بالذكر أن تعدد استخدامات تصميم الهلام النانوي يسمح باستخدام مجموعة واسعة من المونومرات المستجيبة للمنبهات التي تسمح بالتحكم الدقيق في خصائصها الفيزيائية والكيميائية9. تتيح هذه الهندسة الفريدة التحسين العقلاني لتصميم النانو هلام ، والذي يصعب تحقيقه باستخدام الجسيمات الشحمية أو المذيلات أو البوليميروسومات المستخدمة تقليديا12،13. من خلال دمج الشقوق المستجيبة للمنبهات داخل المونومرات المصممة خصيصا ، يمكن تصميم الهلاميات النانوية لتحفيز الإطلاق المتحكم فيه لحمولتها استجابة للعديد من المحفزات ذات الصلة من الناحية الفسيولوجية ، مثل الأس الهيدروجيني ، وظروف الأكسدة والاختزال ، والإنزيمات ، وما إلى ذلك.9،14. تعتبر هذه الهلاميات النانوية الذكية أكثر فائدة من الهلاميات النانوية التقليدية ، لأنها تمتلك ثباتا فائقا لدورة الدم الممتدة ، ويمكنها تحمل الظروف الفسيولوجية للحفاظ على سلامة حمولتها والتوسط في إطلاقها المتحكم فيه في المواقع المستهدفةالمرغوبة 15. في الواقع ، نظرا لطبيعتها متعددة الاستخدامات ، اكتسبت المواد الهلامية النانوية زخما في الساحة الطبية الحيوية ، مع تقدم ملحوظ في تطوير الهلاميات النانوية المستجيبة للمنبهات للعديد من التطبيقات العلاجية والتشخيصية2،16،17.
يمكن أن تمثل البيولوجيا فئة من المنتجات الصيدلانية تتكون من البروتينات و / أو الببتيدات و / أو الأحماض النووية وقد أحدثت ثورة في المشهد العلاجي نظرا لانتقائيتها الرائعة ، وبالتالي أصبحت فئة العلاجات الأسرعنموا 18. في الواقع ، يتضح السوق المتنامي لمثل هذه العلاجات في الزيادة الحادة في الموافقة عليها من قبل جمعية الأدوية الفيدرالية الأمريكية (FDA) ، حيث مثلت الأدوية البيولوجية ~ 40٪ من إجمالي الموافقات على الأدوية ، في عام 202319. بالإضافة إلى خصوصيتها وفعاليتها ، أدت الاكتشافات السريعة لأهداف الأدوية الجديدة ، وعمليات الهندسة الحيوية الأكثر كفاءة ومعرفة أكبر بمصير هذه العلاجات في الجسم الحي إلى زيادة استخدامها20. تشمل البيولوجية التقليدية الحمض النووي الريبي المتداخل والبروتينات البديلة والسيتوكينات والهرمونات التي يتم إنشاؤها عادة باستخدام تقنية الحمض النووي المؤتلف21. منذ الموافقة على الأنسولين المؤتلف البشري في عام 1982 ، تم تطوير الأدوية البيولوجية للعديد من الحالات بما في ذلك السرطان (على سبيل المثال ، trastuzumab ، avelumab) ، ومرض التهاب الأمعاء (على سبيل المثال ، adalimumab ، certolizumab) والأمراض الوراثية النادرة (على سبيل المثال ، mipomersan ، myozyme ، aldurazyme ، fabrazyme) 21. في حين أن الخصوصية العالية لتفاعلات الأدوية البيولوجية مع أهدافها يجب أن تعوض نظريا أي تأثيرات خارج الهدف ، فقد ظهرت العديد من المخاوف السريرية مع استخدامها فيما يتعلق بالآثار الجانبية غير المرغوبفيها 22. يمكن تجميع هذه الآثار الجانبية في فئتين ، بما في ذلك علم الأدوية المبالغ فيه (التحفيز المفرط للأهداف) والمناعة. علاوة على ذلك ، فإن نصف عمرها القصير ، والتوافر البيولوجي المحدود ، وتلف البروتياز ، وقصر العمر الافتراضي ، وعمليات الإنتاج المكلفة تحد من فوائدها العلاجية21. تتضمن الطرق التقليدية للتخفيف من هذه المشكلات التعديل التساهمي لهذه البيولوجيا التي يمكن أن تضر بوظيفتها ، وبالتالي الفعالية23. بدلا من ذلك ، يمكن أن يمنح نهج الطب النانوي لتغليف الحمولات العلاجية العديد من المزايا للخصائص الدوائية ، وأهمها الاستهداف السلبي للموقع الملتهب عبر تأثير النفاذية والاحتفاظ المحسن (EPR)24. يمكن أن تشمل الفوائد الأخرى المرتبطة بالجسيمات النانوية أوقات الدورة الدموية المحسنة ، وانخفاض معدل التصفية ، وزيادة مرونة الصياغة ، وتحسين نفاذية الأوعية الدموية والامتصاص الخلوي25. في حين أن مجموعة كبيرة ومتنوعة من تركيبات الجسيمات النانوية قيد التحقيق حاليا لتوصيل الحمولات البيولوجية ، إلا أن القليل منها يمكنه محاكاة الوظائف المتعددة للهلاميات النانوية. في الواقع ، تتجاوز المواد الهلامية النانوية قدرات التحميل التي تحققها الجسيمات النانوية القائمة على الدهون والمذيلات ، وتظهر استقرارا غرويا أكبر من معظم الجسيمات النانوية غير العضوية. على هذا النحو ، تقدم المواد الهلامية النانوية منصة قيمة لتقديم العلاجات البيولوجية المختلفة.
لقد نجحنا سابقا في تقديم إنزيم مضاد للأكسدة داخل المواد الهلامية النانوية البوليمرية المتشابكة المستجيبة للبروتين المعدني ، حيث حافظت استراتيجية التغليف الخفيفة المستخدمة على النشاط الحيوي للبروتين عند الإصدار26. في هذا العمل ، نوضح التوليف الأمثل للهلاميات النانوية المستجيبة للأكسدة والاختزال لإيصال الحمولات القائمة على البروتين. والجدير بالذكر أن المنهجية التركيبية تمكن من تخليق الهلام النانوي باستخدام ظروف معتدلة لتغليف الحمولة المطلوبة ، دون استخدام مذيبات عضوية قاسية أو درجات حرارة عالية. لقد استغلنا توازن الأكسدة والاختزال داخل البيئة داخل الخلايا لتنظيم إطلاق الحمولة المغلفة27،28. عادة ما يتحكم الجلوتاثيون المضاد للأكسدة الوفيرة بشكل طبيعي (GSH) في إمكانات الأكسدة والاختزال خارج الخلية وداخل الخلايا ، حيث يتراوح تركيزه بين 2-20 ميكرومتر و 1-10 ملي مولار ، على التوالي29،30. حتى الآن ، تم الإبلاغ عن العديد من الجسيمات النانوية الحساسة للأكسدة والاختزال ، مما يجعل هذه استراتيجية مجربة وموثوقة لتمكين الإطلاق الخاضع للرقابة من الأدوية في الجسم الحي27،28. في الواقع ، تم تركيب روابط ثاني كبريتيد داخل المواد النانوية البوليمرية باستخدام الروابط المتشابكة المحتوية على ثاني كبريتيد31،32 ، والتجميع الذاتي للبوليمرات القابلة للتحلل الحيوي من المونومرات المحتوية على ثاني كبريتيد33 ، والأدوية الأولية البوليمرية المستجيبة للأكسدة والاختزال أو مترافقات الدواء / البوليمر34،35. لذلك ، تبحث هذه الدراسة في دمج الوصلة المتشابكة لثاني كبريتيد فريدة وحساسة للغاية ل GSH داخل الجسيمات النانوية البوليمرية ، مما يتيح الإطلاق المتحكم فيه لحمولة البروتين المغلفة.
في هذه الدراسة ، تركز تصميم النانو هلام على المعايير التالية لمعالجة الخصوصية وتسليم الحمولة: الحجم الصغير (~ 100 نانومتر) وتوزيع الحجم المنتظم (مؤشر التشتت المتعدد (PI)<0.3) لضمان الاختراق الفعال للبطانة والاستقرار في الجسم الحي 27. تغليف فعال لحمولة البروتين ، والتحكم في إطلاق الحمولة استجابة ل GSH. أبلغنا عن تخليق الهلاميات النانوية المتشابكة المستجيبة ل GSH ، والتي أظهرت جسيمات نانوية متجانسة بحجم 100 نانومتر ، مع كفاءة تغليف 76٪ لحمولة البروتين المطلوبة.
Protocol
1. توليف الرابط المتشابك المستجيب للأكسدة والاختزال
- أضف 2-أمينوإيثيل ميثاكريليت هيدروكلوريد (44.79 مجم ، 0.270 ملليمول) و 0.063 مل من ثلاثي إيثيل أمين إلى 3 مل من ثنائي كلورو الميثان اللامائي واتركه يخلط لمدة 20 دقيقة تحت غاز N2 الخامل في قارورة دائرية القاع سعة 25 مل.
- قم بإذابة 4،7،10،13،16،19،22،25،32،35،38،41،44،47،50،53-Hexadecaoxa-28،29-dithiahexapentacontanedioic acid di-N-succinimidyl ester (100 مجم ، 0.045 مليمول) في 1 مل من ثنائي كلورو ميثان اللامائي وأضفه إلى القارورة.
- أضف 4 مل من ثنائي كلورو الميثان اللامائي إلى القارورة. لف قارورة التفاعل بورق الألمنيوم واتركها لتقلب تحت N2 في درجة حرارة الغرفة.
- تأكيد تكوين المنتج بواسطة كروماتوغرافيا طبقة رقيقة. تأكد من المراجع الصحيحة للمواد الأولية مع تأكيد تشكيل المنتج بهذه الطريقة.
- كروماتوغرافيا الطبقة الرقيقة هي طريقة قائمة على التقارب تستخدم لفصل المركبات المرغوبة عن خليط التفاعل. هنا ، استخدم صفيحة السيليكا شديدة القطبية والممتزة كمرحلة ثابتة. ضع عينة المادة الأولية وعينة خليط التفاعل على أحد طرفي صفيحة السيليكا وضعها عموديا في دورق زجاجي مغلق مع المادة المساءلة (المرحلة المتنقلة: 5٪ ميثانول: ثنائي كلورو ميثان).
- من خلال العمل الشعري ، تتحرك المرحلة المتحركة لأعلى صفيحة السيليكا وتهاجر مركبات العينة لمسافات متفاوتة اعتمادا على صلاتها للمرحلتين الثابتة والمتنقلة. عندما تعبر مقدمة المذيب 3/4من اللوحة ، قم بإزالة اللوحة وجففها. تظهر المركبات المنفصلة على شكل بقع على اللوحة. حدد كمية عامل الاحتفاظ (Rf) للمركب المطلوب كمسافة يقطعها المركب / المسافة المقطوعة بواسطة المذيب. هنا ، كان Rf للمنتج 0.35. يمكن استخدام ضوء الأشعة فوق البنفسجية أو التلوين لتصور البقع (برمنجنات البوتاسيوم).
- تركيز الخليط في الفراغ وتنقيته عن طريق كروماتوغرافيا عمود الفلاش (خليط متساوي من 5٪ ميثانول: ثنائي كلورو ميثان)36. أدخل خليط التفاعل على الجزء العلوي من عمود زجاجي معبأ بالسيليكا (الطور الثابت) ثم قم بإزالته بنظام المذيبات (المرحلة المتنقلة)36. اجمع كل الكسور وفحصها باستخدام TLC لتمييز كسور المنتج باستخدام قيمة Rf المحددة مسبقا.
- قم بتركيز الكسور المنقاة عن طريق تبخير المذيب باستخدام مبخر دوار (درجة الحرارة: 40 درجة مئوية) ، واضبط ضغط الفراغ على الضغط الجوي لإزالة ثنائي كلورو ميثان الغليان المنخفض أولا. عندما يتوقف مستوى المذيب عن الانخفاض ، اضبط ضغط الفراغ على 337 ملي بار لإزالة الميثانول والحصول على زيت أصفر باهت ، والذي سيخضع بعد ذلك لمزيد من التوصيف لتأكيد تكوين المنتج37.
- إجراء تحليل الأشعة تحت الحمراء لتحويل فورييه (FT-IR)38 ، 1H NMR (في ثنائي ميثيل سلفوكسيد مزيل (DMSO-d 6)) 39 ، 13C NMR39 وتحليل وقت الامتصاص / التأين بالليزر بمساعدة المصفوفة (MALDI-ToF) 40 لتأكيد تكوين المنتج قبل تنفيذ الخطوات التالية.
- لتحليل FT-IR ، قم بتحميل 1 مجم من الزيت على الجهاز للحصول على الأطياف.
- لتحليلات الرنين المغناطيسي النووي ، أعد إذابة 10 مجم من المنتج في 0.75 مل من مذيب الرنين المغناطيسي النووي ذي الصلة ، ونقله إلى أنبوب الرنين المغناطيسي النووي وأغلقه بإحكام لمنع التسرب. قم بتحميل العينة على أداة الرنين المغناطيسي النووي ، وبعد ذلك يتم الحصول على الأطياف39.
- لتحليل قياس الطيف الكتلي ، قم بإغلاق 1 مجم من المنتج في قارورة ، ثم قم بإذابته في DMSO وتحميله على الجهاز.
ملاحظة: يوفر تحليل الأشعة تحت الحمراء معلومات تتعلق بالمجموعات الوظيفية الرئيسية في المنتج المطلوب ، وهي امتدادات الكربونيل (C = O) التي تم تحديدها بواسطة الذروة الحادة عند 1650 سم -1 تشير إلى تكوين رابطة الأميد ، وبالتالي تسليط الضوء على تكوين المنتج. يوفر الرنين المغناطيسي النووي 1H و 13C معلومات عن البيئات الكيميائية وبالتالي يمكن استخدامها لتحديد التركيب الكيميائي للمنتج المطلوب من خلال تحديد البيئات الكيميائية الموجودة في المركب. أخيرا ، يمكن أن يؤدي استخدام قياس الطيف الكتلي إلى التحقق من الكتلة الدقيقة للمنتج المطلوب.
2. اختبار انقسام الرابط المتقاطع ثنائي كبريتيد مع الجلوتاثيون
- احتضان الرابط المتقاطع لثاني كبريتيد (إلى تركيز نهائي يبلغ 4.55 مجم / مل) مع عامل الجلوتاثيون المختزل (النهائي [GSH]: 10 مل) ، إلى حجم نهائي قدره 1 مل ، لمدة 24 ساعة في قارورة زجاجية سعة 1.5 مل.
- لتأكيد انقسام رابط ثاني كبريتيد ، أرسل القارورة لتحليل MALDI-ToF26،40.
3. تخليق nanogel المستجيب للأكسدة والاختزال
- تأكد من خلو جميع الأواني الزجاجية التي سيتم استخدامها في التفاعل من الغبار عن طريق الغسيل بالماء منزوع الأيونات المصفى (0.20 ميكرومتر) ثم تجفيف الأواني الزجاجية باستخدام الهواء المضغوط الذي يمكن الوصول إليه عبر أداة الهواء المضغوط على جانب الدخان. قم بتوصيل فوهة آمنة بمخرج الهواء المضغوط لتسهيل إمكانية الوصول. أمسك القارورة بإحكام وضع الفوهة فيها. قم بتنشيط الهواء المضغوط ، وإطلاق تيار متحكم فيه في القارورة. راقب العملية لضمان التجفيف الفعال ، والتحقق من وجود أي ملوثات أو رطوبة متبقية.
- قم بإعداد قارورة زجاجية سعة 10 مل عن طريق ملئها بالماء منزوع الأيونات وإغلاق القارورة بحاجز مطاطي. قم بإزالة الأكسجين من الماء عن طريق فقاعات N2 من خلاله لمدة 30 دقيقة على الأقل قبل بدء التفاعل. للقيام بذلك ، املأ بالونا بغاز N2 وقم بإرفاق إبرة بالبالون ؛ ضعه على الحاجز واستخدم الإبرة لاختراق الحاجز المطاطي والسماح بتدفق N2 . قم بتوصيل إبرة خروج بالقارورة لضمان التدفق المستمر ل N2.
- قم بإذابة ألبومين مصل الأبقار (BSA ؛ 2 مجم ، 30 نانومول) أو BSA الموسم ب Cy7 (2 مجم ، 30 نانومول) في 1 مل من الماء منزوع الأيونات منزوع الأكسجين وأضفه إلى قارورة زجاجية نظيفة أخرى سعة 10 مل.
- أضف محلول [2- (أكريلويل لوكسي) إيثيل] ثلاثي ميثيل أمونيوم كلوريد (AETC) (12.00 مجم / 10.86 ميكرولتر ، 0.060 ملليمول) إلى القارورة وأغلقها باستخدام حاجز مطاطي آخر. تأكد من الاحتفاظ بخليط التفاعل تحت تدفق مستمر من غاز N2 وحركه لمدة 30 دقيقة.
- قم بإذابة مادة الأكريلاميد (9.21 مجم ، 0.13 ملليمول) في 1 مل من الماء منزوع الأيونات منزوع الأكسجين وأضفه إلى الخليط في القارورة.
- قم بإذابة الوصلة المتشابكة بثاني كبريتيد (4.44 مجم ، 0.004 ملليمول) في 1 مل من الماء منزوع الأيونات وأضفه إلى الخليط في القارورة. اغسل الخليط بغاز N2 لمدة 20 دقيقة.
- قم بإذابة كبريتات دوديسيل الصوديوم (2 مجم ، 0.007 ملليمول) في 1 مل من الماء منزوع الأيونات منزوع الأكسجين وأضفه إلى الخليط عبر حقنة مغسولة بغاز N2 وحرك الخليط لمدة 30 دقيقة.
ملاحظة: عن طريق شطف المحقنة ب N2 ، نقلل من تعرض خليط التفاعل للأكسجين في الغلاف الجوي الذي يمكن أن يثبط تفاعل البلمرة الجذرية. - أضف N ، N ، N '، N'-tetramethylethylenediamine (1.5 ميكرولتر ، 0.010 مليمول) واترك خليط التفاعل يزيل الأكسجين لمدة 3 دقائق تحت غاز N2 .
- قم بإذابة بيرسلفات الأمونيوم (1 مجم ، 0.004 ملليمول) في 1 مل من الماء منزوع الأيونات منزوع الأكسجين وأضفه إلى خليط التفاعل. تأكد من أن غاز N2 يتدفق عبر خليط التفاعل لمدة 10 دقائق.
ملاحظة: إذا تم حذف خطوة الجمع N2 ، فمن المحتمل أن تتشكل جسيمات بيضاء في قارورة التفاعل. هذه جزيئات و / أو مجاميع أكبر حجما ويمكن أن تربك أي توصيف آخر. - أغلق القارورة تحت جو N2 واتركها لتقليب لمدة 3 ساعات و 30 دقيقة في درجة حرارة الغرفة.
- لإنهاء التفاعل ، قم بإزالة الختم من القارورة واترك خليط التفاعل يتحرك لمدة 10 دقائق على الأقل. هذا من شأنه أن يعرض خليط التفاعل لمستويات الغلاف الجوي لغاز O2 ، والذي من شأنه بعد ذلك إخماد أي جذور متبقية في خليط التفاعل. ينتهي التفاعل عندما يفترض الخليط مظهرا أزرق لامعا صافيا.
- من أجل تنقية المواد الهلامية النانوية ، أضف خليط التفاعل إلى وحدة مرشح الطرد المركزي سعة 15 مل (100 كيلو دالتون MWCO) وأضف الماء منزوع الأيونات لملء وحدة الطرد المركزي. الطرد المركزي خليط التفاعل عند 1000 × جم لمدة 10 دقائق. سيؤدي ذلك إلى إزالة أي مواد كيميائية غير متفاعلة (أو حمولة غير مغلفة) أصغر من 100 كيلو دالتون وتركيز عينة الهلام النانوي.
- بمجرد انخفاض مستوى الماء في وحدة الطرد المركزي ، أضف 2 مل من الماء منزوع الأيونات لتخفيف عينة الهلام النانوي وجهاز الطرد المركزي لتركيز المنتج. كرر هذه الخطوة 3x.
- قم بتخزين العينة في درجة حرارة 2-8 درجة مئوية لمنع تدهور البروتين المغلف.
- إجراء تحليل FT-IR و 1H NMR (في ثنائي ميثيل سلفوكسيد مزيل (DMSO-d 6)) لتأكيد البلمرة39،41. لتحضير العينة ، جفف 1 مل من محلول النانو في قارورة سعة 1.5 مل. تتضمن عملية التجفيف بالتجميد تجميد العينة ثم تطبيق فراغ لإزالة المذيب المجمد من خلال التسامي ، تاركا وراءه بقايا مسحوق. بعد التجفيف بالتجميد ، أعد إذابة العينة في مذيب الرنين المغناطيسي النووي ذي الصلة ، وانقلها إلى أنبوب الرنين المغناطيسي النووي وأغلقها بإحكام. قم بتحميل العينة على جهاز الرنين المغناطيسي النووي ، كما هو موضح سابقا39. لتحليل FT-IR ، يجب تحميل 1 مجم من المسحوق الجاف على الجهاز للحصول على الأطياف.
4. التوصيف المورفولوجي نانوجيل
- تشتت الضوء الديناميكي (DLS)
ملاحظة: تم قياس القطر الهيدروديناميكي (نانومتر) ومؤشر التشتت المتعدد (PI) وإمكانات زيتا عند 25 درجة مئوية ، وطول موجة ليزر 632.8 نانومتر وكاشف إشارة 173 درجة باستخدام جهاز DLS. تم قياس كل تشغيل 25 دورة مسح فرعية.- قياس الحجم الهيدروديناميكي (نانومتر)
- قم بإعداد كوفيت أو خلية شعرية مطوية يمكن التخلص منها عن طريق تنظيفها بالماء منزوع الأيونات المصفى. نفخ الهواء المضغوط في الكوفيت (مناسب لكل من قياسات DLS و zeta) لضمان خلوها من جزيئات الغبار الكبيرة.
- املأ الكوفيت بما لا يقل عن 50-100 ميكرولتر من العينة وخفف في 750-1000 ميكرولتر من الماء منزوع الأيونات المصفى. أثناء استخدام كوفيت زيتا المحتمل ، تأكد من ملء الكوفيت بعينة دون تكوين فقاعات ، مما قد يزعج القياسات.
- ضع الكوفيت داخل أداة DLS ، مع التأكد من إدخالها بشكل صحيح. للقيام بذلك ، افتح غطاء حجرة العينة لأداة DLS. أمسك الكوفيت من حوافها العلوية لتجنب بصمات الأصابع على النوافذ البصرية. تأكد من تثبيت الكوفيت بشكل صحيح في حامل الكوفيت مع التأكد من أنه مستوي ومحاذاة مع المسار البصري للجهاز. أغلق حجرة العينة لمنع تداخل الإضاءة المحيطة.
ملاحظة: يتم تصفية وسائط التخفيف باستخدام مرشح حقنة بحجم المسام 0.45 ميكرومتر. - انقر لبدء قياس حجم الجسيمات على برنامج آلة DLS ذي الصلة.
- حدد النتائج المقابلة للعينة للحصول على المتوسط z (متوسط حجم الجسيمات) ، ومتوسط PI ، وعدد الكيلوغرامات في الثانية (kcps) ، وإمكانات zeta والرسومات ذات الصلة. تأكد من أن وظيفة الارتباط تظهر منحنى سيني سلس ، لأن هذا يشير إلى عينة موحدة.
- بمجرد اكتمال التحليل ، قم بإزالة الكوفيت من DLS.
- قياس الحجم الهيدروديناميكي (نانومتر)
- الفحص المجهري الإلكتروني للإرسال (TEM)
- تحضير العينات عن طريق وضع 10 ميكرولتر من محلول الجسيمات النانوية (0.077 مجم / مل) على شبكات نحاسية مطلية بالكربون. يجف في الهواء في درجة حرارة الغرفة لمدة 1 ساعة.
- اغسل الشبكات بالماء منزوع الأيونات المصفى وصمة عار ب 5 ميكرولتر من أسيتات اليورانيل المصفاة بنسبة 1٪ في الماء لمدة دقيقتين.
- بعد نقع عامل التلوين الزائد بورق الترشيح ، جفف الشبكات طوال الليل في درجة حرارة الغرفة. التقط صور TEM في اليوم التالي بتكبير 45,000 مرة باستخدام كاميرا المجال الساطع.
- استخدم البرنامج المقدم لمعالجة الصور (الدقة: 2048 × 2048 بكسل).
5. القياس الكمي للبروتين (BSA) المغلف داخل الهلاميات النانوية باستخدام مقايسة حمض البيسينشونيك الصغير (BCA)
- وفقا لبروتوكول فحص microBCA (الموجود على موقع الشركة المصنعة) ، قم بإنشاء منحنى قياسي بناء على تركيز بروتين محددمسبقا 42.
- بعد تخليقها ، قم بتنقية المواد الهلامية النانوية المغلفة بالبروتين باستخدام وحدات مرشح الطرد المركزي سعة 15 مل مع 100 كيلو دالتون MWCO (1000 × جم ، 10 دقائق) كما هو موضح في الخطوات 3.12-3.14.
- اجمع الترشيح وقم بتحليله باستخدام مقايسة microBCA (البروتوكول المتاح على موقع الشركة المصنعة). قم بقياس الامتصاص عند 562 نانومتر باستخدام قارئ لوحة. نظرا لأن هذا القياس يرتبط بتركيز البروتين غير المغلف ، حدد كتلة البروتين المغلف. لحساب كفاءة التغليف (EE) ٪ ، استخدم المعادلة التالية:
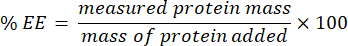
6. القياس الكمي لإطلاق البروتين من الهلاميات النانوية في وجود الجلوتاثيون
- احتضان 200 ميكرولتر من 5 مجم / مل من المواد الهلامية النانوية المحملة ب Cy7BSA مع 200 ميكرولتر من 10 ملي مولار من الجلوتاثيون (GSH) في وحدات مرشح الطرد المركزي 0.5 مل (100 كيلو دالتون MWCO). ضع وحدات الفلتر في حمام مائي للحفاظ على درجة الحرارة عند 37 درجة مئوية.
- جهاز طرد مركزي عند 1000 × جم لمدة 3 دقائق كل 10 دقائق لمدة ساعة واحدة على الأقل - ثم كل 2-8 ساعات.
- اجمع المرشح واستخدمه لمزيد من التحليل. حافظ على حجم المرشح داخل وحدات مرشح الطرد المركزي عند 500 ميكرولتر عن طريق إضافة المزيد من الماء منزوع الأيونات أو PBS.
- قم بقياس كمية البروتين في المرشحات من خلال الرجوع إلى منحنى قياسي للهلاميات النانوية المحملة ب Cy7BSA ، حيث تم قياس امتصاص البروتين الفلوري باستخدام أداة قطرة نانوية عند 750 نانومتر.
ملاحظة: يمكن حساب هذا المنحنى القياسي عن طريق إعداد التخفيفات التسلسلية ل Cy7BSA في نطاق 0 مجم / مل إلى 2 مجم / مل. يمكن استيفاء القيم التي تم الحصول عليها من القطرة النانوية مقابل منحنى المعايرة هذا لتحديد كفاءة التغليف.
النتائج
تخليق وتوصيف الوصلة المتشابكة متعددة (الإيثيلين جلايكول) (PEG) ثاني كبريتيد دياكريليت تم تصنيع الرابط المتقاطع المستجيب للأكسدة والاختزال عن طريق الاستبدال النووي لإستر N-hydroxysuccinimide (NHS) بواسطة 2-aminoethyl methacrylate عن طريق تكوين ارتباط أميد (الشكل 1). تم التحقق من صحة تخليق المنتج المطلوب بشكل أساسي بواسطة 1H NMR (الشكل التكميلي 1) ، والذي تم إجراؤه عن طريق إذابة عينة المنتج في DMSO المنزوع ، حيث تم الجمع بين الرنين المقابل لوحدات الإيثيلين لسلاسل PEG عند δ3.48-3.53 والتوائم الثلاثية المقابلة ل (N) CH2-CH 2 يمكن استخدام المجموعات في δ3.59-3.65 لتحديد تكوين المنتج. كما تم إجراء مزيد من التوصيف للمنتج المشكل باستخدام FT-IR (الشكل التكميلي 2) و MALDI-ToF (الشكل التكميلي 3) و 13C NMR (الشكل التكميلي 4).
قبل دمجها في الهلاميات النانوية ، تم تقييم قابلية انقسام الرابط المتقاطع (4.55 مجم / مل) عن طريق الحضانة مع GSH (11 ملليمتر) لمدة 24 ساعة عند 37 درجة مئوية في PBS. ثم تم فحص المنتجات الناتجة باستخدام APCI-MS (الشكل 2). كان من الممكن تحديد ذروة الشظية المشقوقة عند 586.2969 م / z ([M + H]+ حيث M = CH3C (CH2) COOCH2CH2NHOOCCH2CH2O [CH2CH2O] 7CH2CH2SH) (الشكل 2).
تخليق النانو هلام والتوصيف الفيزيائي الكيميائي
يظهر إجراء التوليف للهلام النانوي في الشكل 3. لتأكيد تخليق الهلاميات النانوية ، تم إجراء 1H NMR و FT-IR ، بعد تجفيد المواد الهلامية النانوية. بالنسبة لطيف الرنين المغناطيسي النووي ، تشير القمم عند δ1.25 و δ2.10 إلى ذرات الهيدروجين ميثانيتريل والميثانيليدين في بنية البوليمر (الشكل التكميلي 5). علاوة على ذلك ، فإن الذروة العريضة عند δ3.70 تتوافق مع ذرات هيدروجين الميثيلين في PEG (الشكل التكميلي 5). لذلك ، يؤكد طيف الرنين المغناطيسي النووي وجود سلسلة الأكريلاميد وبالتالي حدوث البلمرة لتشكيل المنتج المطلوب. بالنسبة لطيف FT-IR ، فإن عدم وجود الذروة في المنطقة 1637-1640 سم -1 التي تتوافق مع امتداد C = C للأكريلاميد يدل على البلمرة (الشكل التكميلي 6). لتأكيد البلمرة وتغليف الحمولة بشكل أكبر ، خضع خليط تفاعل الهلام النانوي لقياسات DLS على فترات زمنية منتظمة طوال وقت التفاعل الوارد في البروتوكول (الشكل 4). هنا تنخفض الذروة المقابلة ل BSA عند 8.302 نانومتر تدريجيا حيث يتم تغليف المزيد داخل الهلام النانوي ، ولا تظهر ذروة BSA بعد التنقية ، مما يشير إلى تغليف البروتين داخل بنية الهلامالنانوي 26.
يوضح الجدول 1 نتائج التوصيف الفيزيائي الكيميائي لألبومين مصل الأبقار المحمل بعلامة Cy7 (Cy7BSA) ، كدليل على المفهوم. بعد تخليقها ، تم تنقية المواد الهلامية النانوية عن طريق الطرد المركزي أو غسيل الكلى ، وتميزت خصائصها الفيزيائية والكيميائية بواسطة TEM و DLS (الشكل 5 أ ، ب). يعتبر نصف القطر الهيدروديناميكي للهلاميات النانوية مناسبا عندما يتراوح بين 50-100 نانومتر. لاحظ أنه إذا كانت هناك قمم متعددة موضحة على الرسم البياني لتوزيع الشدة ، فمن المرجح أن يكون ذلك بسبب وجود مجموعات نانوية مختلفة الحجم (الشكل التكميلي 7 أ). بالإضافة إلى ذلك ، مع عينات المنتج هذه ، تبدو وظيفة الارتباط غير منتظمة ، على عكس المنحنى السيني السلس. وينبغي تفسير ذلك على أنه نتيجة سلبية وينبغي تجاهله. يمكن ملاحظة نتيجة حجم DLS المقبولة من خلال وجود ذروة واحدة محددة بحجم الاهتمام (الشكل التكميلي 7 ب). علاوة على ذلك ، يجب أن يكون مؤشر الأداء ثابتا ومقبولا حتى 0.227. بالمقارنة ، تظهر المواد الهلامية النانوية الفارغة أحجاما غير متسقة وأكبر (الشكل 5 ج ، د). تم أيضا وصف إمكانات زيتا للهلاميات النانوية لضمان الشحنة الموجبة للهلاميات النانوية ، والتي من شأنها أن تمكن من التفاعل الكهروستاتيكي مع غشاء الخلية ، وبالتالي تسهيل امتصاص الخلايا (الجدول 1).
كما تم التحقيق في استقرار المواد الهلامية النانوية الفارغة والمحملة ب Cy7BSA عند التخزين بعد شهر واحد من تخزينها عند 4 درجات مئوية وقياس حجمها وإمكانات زيتا في الماء منزوع الأيونات عند 25 درجة مئوية (الشكل التكميلي 8 أ ، ب). لوحظ تغيير طفيف في الحجم الكلي أو إمكانات زيتا ، مما يشير إلى الاستقرار المعزز لهذه الهلاميات النانوية المتشابكة تساهميا.
معلمة مهمة أخرى يجب قياسها هي كفاءة تغليف الهلاميات النانوية ، وهي مطلوبة لحماية الحمولة من التدهور الفسيولوجي43،44. تم تطوير البروتوكول لتحليل كفاءة التغليف (EE٪) لانحباس البروتين باتباع تعليمات المورد. لذلك ، يتضمن البروتوكول بشكل أساسي استيفاء التركيز غير المعروف للبروتين في الغسيل من خلال الإشارة إلى منحنى التركيز القياسي ل BSA. تعطي القيمة التي تم الحصول عليها من مقايسة micro-BCA فكرة عن نسبة البروتين الموجودة في غسالات الهلاميات النانوية المنقاة. لذلك ، فإنه يشير بشكل غير مباشر إلى نسبة البروتين التي تم احتجازها بنجاح في المواد الهلامية النانوية (الجدول 1). يجب أن تكون قيم الكفاءة التي تم الحصول عليها أعلى من 70٪ ويجب ألا تظهر فروقا كبيرة بين كل توليف. تمثل قيم كفاءة التغليف المنخفضة نتيجة سلبية وتشير إلى أنه يجب التخلص من هذه الصيغ. تؤكد هذه النتائج قدرة التغليف العالية للهلاميات النانوية ، مما يسلط الضوء على تطبيقها الواعد في توصيل البروتين.
تقييم استجابة الأكسدة والاختزال للهلاميات النانوية
تم فحص استجابة GSH للهلاميات النانوية عند التركيز الفسيولوجي ل GSH (10 ملليمتر) عند 37 درجة مئوية (الشكل 6 أ) 29. تم تحديد هذا التركيز من GSH من خلال الرجوع إلى الأدبيات المتعلقة بالقياسات الفسيولوجية للمواد النانوية المستجيبة ل GSH والمواد النانوية المستجيبة ل GSH28،32. تم إطلاق ما يصل إلى 86٪ من Cy7BSA المغلف في غضون 48 ساعة (الشكل 6 ب). من ناحية أخرى ، أدت تجارب التحكم التي لا تحتوي على GSH مضاف إلا إلى إطلاق 15٪ من البروتين ، والذي يمكن أن يعكس إطلاق الانفجار لأي بروتينات ممتصة على السطح14،45.
لتحديد ما إذا كانت السلامة البيولوجية للبروتين المغلف قد تعرضت للخطر أثناء تخليق الهلام النانوي أو تحلله أو تخزينه ، تم تجميد البروتين المعزول عن طريق الترشيح وإخضاعه لتحليل FT-IR (الشكل 7 أ). يتكون هيكل البروتين ثلاثي الأبعاد من هياكل ثانوية بما في ذلك الحلزونات α ، والصفائح β ، واللفات β ، والملفات العشوائية ، والتي يتم إنشاؤها عن طريق الترابط الهيدروجيني لمجموعات C = O و N-H من روابط الببتيد داخل سلاسل عديد الببتيد46. يظهر امتصاص الأشعة تحت الحمراء المرتبط بهذه الهياكل الثانوية في المنطقة 1700 سم -1 و 1600 سم -1. يمكن أن يشير تحليل نطاق الأميد الأول الذي يظهر في هذه المنطقة إلى ما إذا كان البروتين يخضع للتمسخ في أي مرحلة أثناء تخليق الهلام النانوي وتحللهوتخزينه 47. تمت مقارنة امتصاص الأشعة تحت الحمراء ل BSA الأصلي مع BSA المعزول من خليط التفاعل ، بعد حضانة الهلاميات النانوية مع GSH وبعد تخزين الهلام النانوي لمدة 30 يوما. بالنسبة ل BSA المعزولة أثناء تخليق الهلام النانوي وحضانة ما بعد GSH ، تمثل الذروة عند 1662 سم -1 غلبة المنعطفات β السليمة في بنية BSA. ومع ذلك ، فإن ظهور الذروة عند 1613 سم -1 في BSA المعزولة من الهلاميات النانوية المخزنة لمدة 30 يوما يدل على تكوين بنية β بين الجزيئات الناتجة عن تراكم البروتين. كما تم إجراء تحليل ثنائي اللون الدائري (CD) لتأكيد النتائج التي تم الحصول عليها من خلال تحليل FT-IR (الشكل 7 ب). كما يتضح من المنحنيات التي تتزامن مع منحنيات BSA الأصلية ، لم يتغير البروتين المعزول من خليط تفاعل الهلام النانوي وحضانة ما بعد GSH حيث لا توجد تغييرات في النطاقين السالبين في منطقة الأشعة فوق البنفسجية عند 208 نانومتر و 222 نانومتر من أطياف القرص المضغوط ، والتي تميز التركيب الحلزوني α للبروتين. بالنسبة ل BSA المعزولة من الهلاميات النانوية بعد 30 يوما ، كانت الانحرافات الطفيفة في هذه القمم مرئية ، والتي يمكن أن تكون مؤشرا على بعض التجميع.
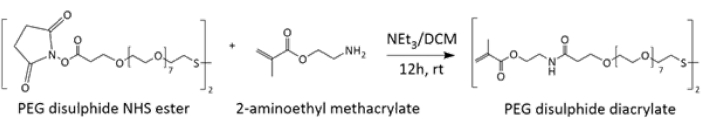
الشكل 1: مخطط يوضح تخليق الرابط المتقاطع لثنائي كبريتيد PEG diacrylate. في ظل الظروف الأساسية ، يؤدي الهجوم النووي للأمين الأساسي ، 2-أمينوإيثيل ميثاكريلات ، على استرات NHS إلى تكوين روابط أميد ، وبالتالي توليد الرابط المتقاطع. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
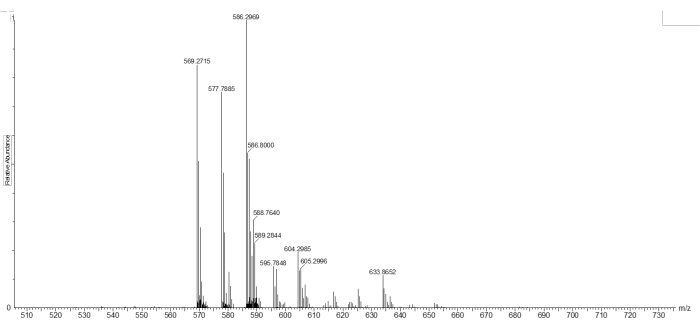
الشكل 2: التأين الكيميائي للضغط الجوي - الأطياف الكتلية لمنتج ثنائي كبريتيد بيكريليت PEG المشقوق بعد الحضانة مع GSH. تظهر البيانات ذروة الأيونات الجزيئية للمنتج المشقوق M = C26H49NO11SH + ، حيث [M + H] + = 586.2969 م / ز. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
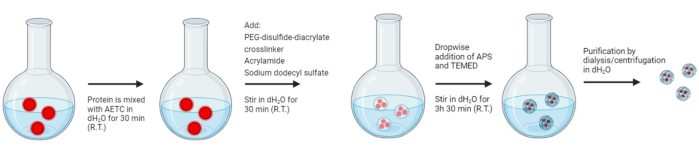
الشكل 3: تخليق المواد الهلامية البوليمرية النانوية المستجيبة للأكسدة والاختزال. تخليق نانوهلام البلمرة الجذرية المائية بخطوة واحدة. تم تغليف المونومرات في البداية داخل مذيلات كبريتات دوديسيل الصوديوم (SDS) ، حيث بدأت البلمرة في الموقع بواسطة N ، N ، N '، N'-tetramethylethylenediamine (TEMED) وبيرسلفات الأمونيوم (APS). يحافظ مادة الأكريلاميد عالية الذوبان (AM) على استقرار الهلام النانوي في البيئات المائية ، ويحافظ 2- (أكريلويل لوكسي) إيثيل تري ميثيل أمونيوم كلوريد (AETC) على القوالب الكهروستاتيكية لحمولة البروتين المرغوبة ويقلل من الإطلاق المبكر. علاوة على ذلك ، يتيح الرابط المتقاطع ثنائي الكبريتيد PEG إطلاق الحمولة المتحكم فيه. تتم إزالة SDS لاحقا عن طريق طرق التنقية. الطرد المركزي بثلاث غسلات ضد الماء منزوع الأيونات أو عن طريق غسيل الكلى. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
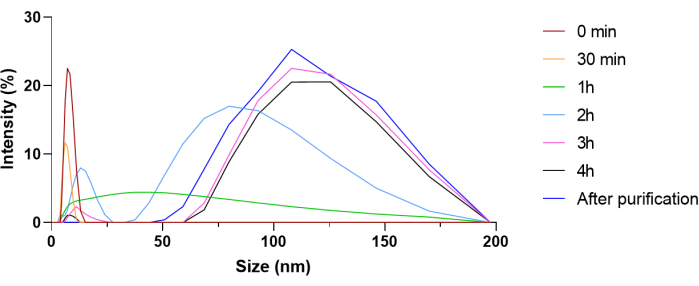
الشكل 4: قياسات تشتت الضوء الديناميكي (DLS) لخليط تفاعل الهلام النانوي على فترات زمنية محددة. تم استخدام الانخفاض التدريجي في شدة الذروة المرتبطة ببروتين BSA (8.302 نانومتر) لتتبع تغليف البروتين وتقدم البلمرة على مدار 4 ساعات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
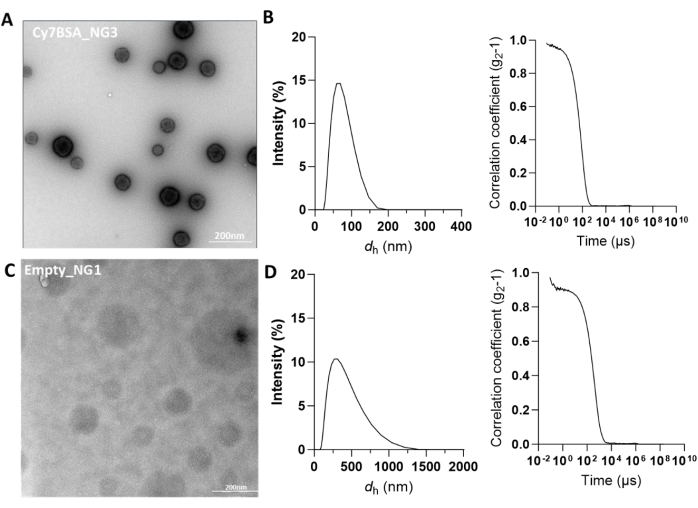
الشكل 5: توصيف Cy7-BSA_NG3 و Empty_NG1. (أ) صبغة سلبية TEM للهلاميات النانوية المحملة ب Cy7BSA (Cy7BSA_NG3). شريط المقياس عند 200 نانومتر. (ب) آثار DLS التي تظهر توزيع الحجم ووظيفة الارتباط Cy7BSA_NG3. يشير DH على المحور X إلى القطر الهيدروديناميكي أو الحجم للهلاميات النانوية. (ج) صبغة سالبة TEM للهلاميات النانوية الفارغة (Empty_NG1). شريط المقياس عند 200 نانومتر. (د) آثار DLS التي تظهر توزيع الحجم ووظيفة الارتباط Empty_NG1. يشير DH على المحور X إلى القطر الهيدروديناميكي أو الحجم للهلاميات النانوية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
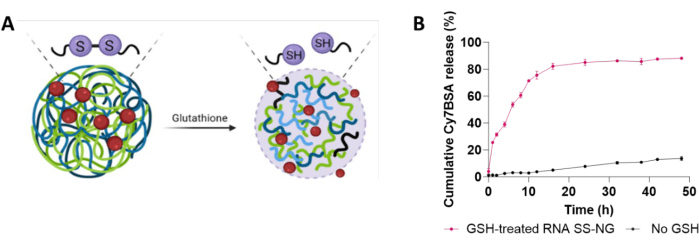
الشكل 6: تحقيقات نشاط GSH على المواد الهلامية النانوية المغلفة Cy7BSA (Cy7BSA_NG3). (أ) الإطلاق الخاضع للرقابة بوساطة GSH للحمولة المغلفة. (ب) الإطلاق التراكمي ل Cy7BSA عند 37 درجة مئوية مع حضانة 10 ملي مولار GSH على مدار 48 ساعة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
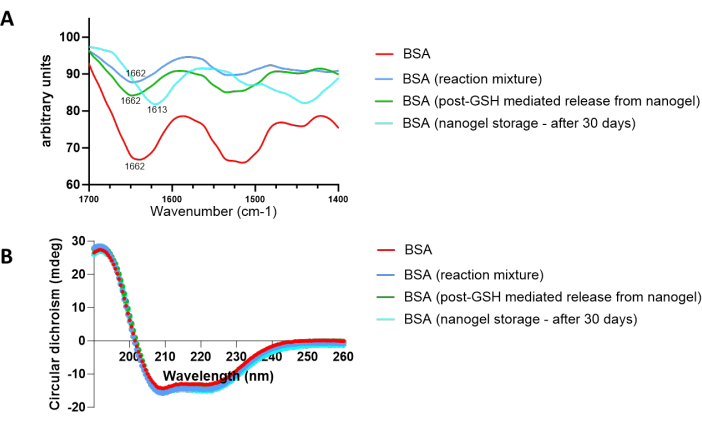
الشكل 7: تأثير ظروف تفاعل الهلام النانوي ، وتدهور الهلام النانوي بوساطة GSH والتخزين النانوي لفترات طويلة على السلامة الهيكلية ل BSA المغلف. تم تأكيد التغييرات في الهيكل الثانوي ل BSA عند التعرض لظروف مختلفة من خلال (أ) FT-IR و (ب) ازدواج اللون الدائري (CD). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| نانوجيل | الحجم (نانومتر) | مؤشر تعدد التشتت (PI) | متوسط معدل العد المشتق (kcps) | إمكانات زيتا (مللي فولت) | كفاءة التغليف (٪) |
| Empty_NG1 | 269.1 ± 14.80 | 0.4965 ± 0.0875 | 1820 ± 189 | -8.23 ± 0.04 | 0 |
| BSA_NG2 | 107.4 ± 36.22 | 0.201 ± 0.0035 | 2645 ± 174 | -2.977 ± 0.07 | 83.40 ± 0.5 |
| Cy7BSA_NG3 | 57.15 ± 11.79 | 0.093 ± 0.0019 | 4965 ± 233 | 24.78 ± 0.86 | 76.40 ± 0.2 |
الجدول 1: التوصيف الفيزيائي الكيميائي الكامل للهلام النانوي. يتم تلخيص الخصائص الهيكلية للنانو ، بما في ذلك الحجم ، والتشتت المتعدد (PI) ، ومتوسط معدل العد المشتق ، وإمكانات زيتا. كما أدرجت كفاءات التغليف ذات الصلة للمقارنة.
الشكل التكميلي 1: 1H طيف الرنين المغناطيسي النووي من الرابط المتقاطع ثنائي كبريتيد ثنائي الكبريتيد PEG. 1H الرنين المغناطيسي النووي (400 ميجاهرتز ، (CD3) 2SO): δ8.05 (t ، 2H) ، 6.07 (s ، 2H) ، 5.69-76 (m ، 2H) ، 4.05-4.09 (m ، 8H) ، 3.61-3.65 (t ، 4H) ، 3.57-3.59 (t ، 4H) ، 3.48-3.53 (م ، 56 ساعة) ، 2.88-20.91 (t ، 4H) ، 2.31-2.34 (t ، 4H) ، 1.88 (s ، 6H). * المذيبات المتبقية (CH3) 2SO (δ 2.50). الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 2: التحليل الطيفي بالأشعة تحت الحمراء لتحويل فورييه (FT-IR) من الرابط المتقاطع ثنائي الكبريتيد ثنائي الكبريتيد PEG. تمتد N-Amine C (O) N-H: 3700-3200 سم -1 (عريض) ؛ تمتد الألكيلSP 3 C-H: 2950-2850 سم -1 (قوي) ، الكربونيل C = O تمدد: 1650 سم -1 (قوي). الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 3: طيف الامتصاص بالليزر بمساعدة المصفوفة / وقت التأين (MALDI-ToF) لثاني كبريتيد ثنائي الكبريتيد PEG. الكتلة المحسوبة (ج50ح92ن2س22ثانية2+): 1137.5656 م / ز ، الفعلي: 1137.5660 م / ز. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 4: طيف الرنين المغناطيسي النووي 13C (NMR) من الرابط المتشابك ثنائي كبريتيد ثنائي الكبريتيد PEG. 13C الرنين المغناطيسي النووي (MHz 400، (CD3)2SO): δ171,04, 166,89, 135,18, 125,36, 69,98-70,24, 69,20, 64,38, 64,54, 38,23, 36,79, 35,58, 18,49. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 5: 1H طيف NMR من الهلاميات النانوية المجففة. 1H NMR (MHz 400, D2O): δ3.70 (s), δ2,1 (m), δ1,25 (m). الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 6: التحليل الطيفي بالأشعة تحت الحمراء لتحويل فورييه (FT-IR) للهلاميات النانوية المجففة. تمتد N-amine C (O) N-H: 3700-3200 سم -1 ؛ الألكيل SP3 C-H تمدد: 2950-2850 سم -1 (قوي) ، الكربونيل C = O تمديد: 1655 سم -1 (قوي) ؛ تمدد C-O-C: 1095 سم -1 (حاد). الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 7: توصيف الهلاميات النانوية. (أ) نتيجة DLS السلبية ، كما تتميز بوجود قمم متعددة ومنحنى ارتباط غير منتظم. (ب) نتيجة DLS الإيجابية ، كما تتميز بوجود ذروة واحدة محددة جيدا ومنحنى ارتباط سيني سلس. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 8: التحقيق في الاستقرار طويل الأمد للهلاميات النانوية حسب الحجم وقياسات زيتا المحتملة. تم إخضاع كل من (أ) الهلاميات النانوية الفارغة و (ب) الهلاميات النانوية المحملة ب Cy7BSA لتحليل DLS على مدى 30 يوما. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
أدى الطلب المتزايد على الأدوية البيولوجية المحددة للأهداف في صناعة المستحضرات الصيدلانية الحيوية إلى الحاجة إلى تقنيات يمكن أن تحسن ملامحها الدوائية في الجسم الحي ، مع منع تدهورها الفسيولوجي السريع وتعويض أي آثار جانبية غير مرغوب فيها. مع وضع ذلك في الاعتبار ، يتم وصف إجراء مباشر لتخليق المواد الهلامية النانوية المحملة بالبروتين. كما هو موضح في البروتوكول ، يجب تصنيع الرابط المتقاطع المستجيب للأكسدة والاختزال قبل تخليق الهلام النانوي. بعد ذلك ، تتم إضافة المونومرات الرئيسية المتبقية وبعد إضافة كبريتات دوديسيل الصوديوم (SDS) ، تبدأ البلمرة الجذرية في الموقع بواسطة N ، N ، N '، N'-tetramethylethylenediamine (TEMED) وبيرسلفات الأمونيوم (APS). يحافظ مادة الأكريلاميد عالية الذوبان (AM) على استقرار النانو هلام في البيئات المائية ، ويحافظ ملح 2-(أكريلويل لوكسي) إيثيل ثلاثي ميثيل الأمونيوم (AETC) على القوالب الكهروستاتيكية لحمولة البروتين المرغوبة ويقلل من الإطلاق المبكر26. علاوة على ذلك ، يتيح الرابط المتقاطع ثنائي كبريتيد PEG إطلاق الحمولة28،32 المتحكم فيه. تتم إزالة SDS لاحقا عن طريق طرق التنقية. الطرد المركزي بثلاث غسلات ضد الماء منزوع الأيونات أو غسيل الكلى.
قام العديد من الباحثين في جميع أنحاء العالم بتصنيع الجسيمات النانوية البوليمرية باستخدام مجموعة متنوعة من الاستراتيجيات التركيبية المختلفة1،48،49. يختلف بروتوكولنا الاصطناعي عن الطرق شائعة الاستخدام بطريقة أساسية ، لأنه لا ينطوي على استخدام المذيبات العضوية أو درجات الحرارة المرتفعة. مع أخذ ذلك في الاعتبار ، فإن حداثة إجراءنا تعني أن قدرة المستخدم قد تلعب دورا رئيسيا في التوليف الناجح للهلام النانوي. تتمثل إحدى الخطوات المهمة في تخليق الهلام النانوي في ضمان الحفاظ على الجو الخامل ، والذي يجب أن يحدث بطريقة خاضعة للرقابة لتجنب فقدان المنتج المطلوب ، حيث يمكن للأكسجين الموجود في الهواء أن يعيق بلمرة الأكريلات والميثاكريلات. لذلك ، قد يتطلب خلط وإضافة كل كاشف في ظل ظروف خاملة بعض الممارسة لتحقيقها بشكل صحيح. ومع ذلك ، فإن البروتوكول الموضح يقدم منهجية متعددة الاستخدامات ، حيث يمكن إضافة العديد من المونومرات الأخرى إلى التوليف لمنح الهلاميات النانوية خصائص محددة ، على سبيل المثال استخدام مونومرات الأكريلية غير المتجانسة لجعل الهلاميات النانوية قابلة لمزيد من الإجراءات الاقترانية الحيوية. علاوة على ذلك ، من الممكن ، مع التحسين الكافي ، استكشاف تغليف الحمولات القائمة على الحمض النووي ، حيث كان هناك عودة هائلة في استخدام العلاجات الجينية لعلاج ليس فقط الأمراض أحادية الجين النادرة ، ولكن أيضا الأمراض المزمنةوالتقدمية 50.
باختصار ، قدمنا استراتيجية معتدلة قائمة على الماء لتصنيع الهلاميات النانوية بشكل متكرر بأحجام أقل من 100 نانومتر وقدرات فعالة للاحتفاظ بالحمولة. بالإضافة إلى ذلك ، من خلال دمج رابط متقاطع جديد لثاني كبريتيد داخل الهلاميات النانوية ، أظهرنا الإطلاق المتحكم فيه للحمولة المحاصرة استجابة لعامل اختزال داخل الخلايا. لقد أثبتنا أيضا أن هذه الاستراتيجية التركيبية لا تضر بالحمولة. سيوفر هذا البروتوكول أساسا لمزيد من الابتكار في مجال العلاج النانوي المستجيب للمنبهات. نظرا لظروفها الاصطناعية الفريدة والمرنة ، من المتوقع أن تلعب الهلاميات النانوية دورا مهما في مجال توصيل الأدوية في المستقبل.
Disclosures
ليس لدى المؤلفين تضارب في المصالح للإفصاح عنهم. لا توجد تفاصيل مالية للإعلان عنها.
Acknowledgements
نشكر قسم الكيمياء في إمبريال كوليدج لندن ومعهد مجلس البحوث الطبية لعلوم الحياة على دعمهم.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| 2-( acryloyloxy)ethyl]trimethylammonium chloride solution | Sigma Aldrich | 496146 | |
| 2-aminoethyl methacrylatehydrochloride | Sigma Aldrich | 516155 | |
| 4,7,10,13,16,19,22,25,32,35,38,41, 44,47,50,53-Hexadecaoxa-28,29-dithiahexapentacontanedioic acid di-N-succinimidyl ester | Sigma Aldrich | 671630 | |
| Acrylamide | Sigma Aldrich | 23701 | |
| Ammonium persulfate | Sigma Aldrich | 248614 | |
| Bovine serum albumin | Sigma Aldrich | B6917 | |
| Cy7- labelled bovine serum albumin | Nanocs | BS1-S7-1 | |
| Deuterated dimethyl sulfoxide | Sigma Aldrich | 547239 | |
| Dichloromethane | Sigma Aldrich | 270997 (anhydrous) and D65100 | |
| Glutathione | Sigma Aldrich | G4251 | |
| Methanol | Sigma Aldrich | 34860 | |
| N,N,N’,N’-tetramethylethylenediamine | Sigma Aldrich | 411019 | |
| Phosphate buffered saline | ThermoFisher | 10010023 | |
| Sodium dodecyl sulfate | Sigma Aldrich | 436143 | |
| Triethylamine | Sigma Aldrich | 471283 | |
| Uranyl Acetate | Agar Scientific | AGR1260A | |
| Equipment necessary for nanogel synthesis and characterisation | |||
| Amicon Ultra-15 Centrifugal filter units (100kDa MWCO) | Merck Millipore | C7715 | |
| Camera | Olympus | Veleta | |
| Carbon-coated copper grids | Agar Scientific | AGS160 | |
| Dialysis tubing (100kDa MWCO) | Spectrum labs | 11405949 | |
| Dynamic Light Scattering | Malvern | Zetasizer Nano Ultra | |
| Freeze dryer | Labconco | WZ-03336-01 | |
| Infrared spectroscopy | Agilent | Cary 630 FTIR | |
| iTEM software | Olympus | ||
| Mass spectrometry | Waters | Micromass MALDI microMX MALDI Q-ToF | |
| MF-MilliporeTM membrane filter (0.45/0.2μm pore size) | Merck Millipore, UK | HAWP04700, GSWP04700 | |
| Micro BCA Protein Assay Kit | ThermoFisher | 23235 | |
| Plate reader | Beckman | Coulter-PARADIGM | |
| Proton and Carbon-13 nuclear magnetic resonance data | Bruker | 400MHz AV-400 NMR spectrometer | |
| Rotary evaporator | Buchi | R-114 Rotary Vap System | |
| Single-use needles | Sterican | 4665643 | |
| Suba-Seal septa | Sigma Aldrich | Z124575 | |
| Transmission electron microscopy | Phillips | CM 100 TEM | |
| UV-vis spectrophotometer | Nanodrop | Nanodrop One/One C microvolume |
References
- Zhang, X., Malhotra, S., Molina, M., Haag, R. Micro- and nanogels with labile crosslinks - from synthesis to biomedical applications. Chem Soc Rev. 44 (7), 1948-1973 (2015).
- Chacko, R. T., Ventura, J., Zhuang, J., Thayumanavan, S. Polymer nanogels: A versatile nanoscopic drug delivery platform. Adv Drug Del Rev. 64 (9), 836-851 (2012).
- Hajebi, S., et al. Stimulus-responsive polymeric nanogels as smart drug delivery systems. Acta Biomaterialia. 92, 1-18 (2019).
- Lee, V. Y., et al. Nanogel star polymer architectures: A nanoparticle platform for modular programmable macromolecular self-assembly, intercellular transport, and dual-mode cargo delivery. Adv Mat. 23 (39), 4509-4515 (2015).
- Ekkelenkamp, A., Rachèl Elzes, M., Engbersen, J. F., Paulusse, J. M. Responsive crosslinked polymer nanogels for imaging and therapeutics delivery. J Mat Chem B. 6 (2), 210-235 (2018).
- Vinogradov, S. V., Zeman, A. D., Batrakova, E. V., Kabanov, A. V. Polyplex nanogel formulations for drug delivery of cytotoxic nucleoside analogs. J Control Rel. 107 (1), 143-157 (2015).
- Akiyoshi, K., Deguchi, S., Moriguchi, N., Yamaguchi, S., Sunamoto, J. Self-aggregates of hydrophobized polysaccharides in water. Formation and characteristics of nanoparticles. Macromol. 26 (12), 3062-3068 (1993).
- Lemieux, P., et al. Block and graft copolymers and NanoGel copolymer networks for DNA delivery into cell. J Drug Target. 8 (2), 91-105 (2000).
- Preman, N. K., Barki, R. R., Vijayan, A., Sanjeeva, S. G., Johnson, R. P. Recent developments in stimuli-responsive polymer nanogels for drug delivery and diagnostics: A review. Euro J Pharma Biopharmac. 157, 121-153 (2020).
- Oh, J. K., Drumright, R., Siegwart, D. J., Matyjaszewski, K. The development of microgels/nanogels for drug delivery applications. Prog Poly Sci. 33 (4), 448-477 (2008).
- Jiang, Y., Chen, J., Deng, C., Suuronen, E. J., Zhong, Z. Click hydrogels, microgels and nanogels: Emerging platforms for drug delivery and tissue engineering. Biomat. 35 (18), 4969-4985 (2014).
- Napier, M. E., DeSimone, J. M. Nanoparticle drug delivery platform. Poly Rev. 47 (3), 321-327 (2007).
- Malmsten, M. Soft drug delivery systems. Soft Matt. 2 (9), 760-769 (2006).
- Kamaly, N., Yameen, B., Wu, J., Farokhzad, O. C. Degradable controlled-release polymers and polymeric nanoparticles: Mechanisms of controlling drug release. Che Rev. 116 (4), 2602-2663 (2016).
- Molina, M., et al. Stimuli-responsive nanogel composites and their application in nanomedicine. Chem Soc Rev. 44 (17), 6161-6186 (2015).
- Ma, Y., Ge, Y., Li, L. Advancement of multifunctional hybrid nanogel systems: Construction and application in drug co-delivery and imaging technique. Mat Sci Eng: C. 71, 1281-1292 (2017).
- Wang, H., Qian, J., Ding, F. Recent advances in engineered chitosan-based nanogels for biomedical applications. J Mat Chem B. 5 (34), 6986-7007 (2017).
- Durán-Lobato, M., Niu, Z., Alonso, M. J. Oral delivery of biologics for precision medicine. Adv Mat. 32 (13), 1901935(2020).
- de la Torre, B. G., Albericio, F. The pharmaceutical industry in 2022: An analysis of FDA drug approvals from the perspective of molecules. Molecules. 28 (3), 1038(2023).
- Škalko-Basnet, N. Biologics: The role of delivery systems in improved therapy. Biologics. 8, 107-114 (2014).
- Andrews, L., Ralston, S., Blomme, E., Barnhart, K. A snapshot of biologic drug development: Challenges and opportunities. Human Exp Toxicol. 34 (12), 1279-1285 (2015).
- Sathish, J. G., et al. Challenges and approaches for the development of safer immunomodulatory biologics. Nat Rev Drug Disc. 12 (4), 306-324 (2013).
- Pfister, D., Morbidelli, M. Process for protein PEGylation. J Control Rel. 180, 134-149 (2014).
- Blanco, E., Shen, H., Ferrari, M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nat Biotechnol. 33 (9), 941-951 (2015).
- Golombek, S. K., et al. Tumor targeting via EPR: Strategies to enhance patient responses. Adv Drug Del Rev. 130, 17-38 (2018).
- Basak, S., et al. Simultaneous cross-linking and cross-polymerization of enzyme responsive polyethylene glycol nanogels in confined aqueous droplets for reduction of low-density lipoprotein oxidation. Biomacromol. 22 (2), 386-398 (2021).
- Morgulchik, N., Kamaly, N. Meta-analysis of in vitro drug-release parameters reveals predictable and robust kinetics for redox-responsive drug-conjugated therapeutic nanogels. ACS Appl Nano Mat. 4 (5), 4256-4268 (2021).
- Ghorbani, M., Hamishehkar, H. Redox-responsive smart nanogels for intracellular targeting of therapeutic agents: Applications and recent advances. J Drug Target. 27 (4), 408-422 (2019).
- Bajic, V. P., et al. Glutathione "redox homeostasis" and its relation to cardiovascular disease. Oxi Med Cell Long. 2019, e5028181(2019).
- Forman, H. J., Zhang, H., Rinna, A. Glutathione: Overview of its protective roles, measurement, and biosynthesis. Mol Asp Med. 30 (1-2), 1-12 (2009).
- Wang, Y. C., et al. Core-shell-corona micelle stabilized by reversible cross-linkage for intracellular drug delivery. Macromol Rapid Comm. 31 (13), 1201-1206 (2010).
- Elkassih, S. A., Kos, P., Xiong, H., Siegwart, D. J. Degradable redox-responsive disulfide-based nanogel drug carriers via dithiol oxidation polymerization. Biomat Sci. 7 (2), 607-617 (2019).
- Hu, X., et al. Stimuli-responsive polymersomes for biomedical applications. Biomacromol. 18 (3), 649-673 (2017).
- Navath, R. S., Wang, B., Kannan, S., Romero, R., Kannan, R. M. Stimuli-responsive star poly(ethylene glycol) drug conjugates for improved intracellular delivery of the drug in neuroinflammation. J Control Release. 142 (3), 447-456 (2010).
- Ling, X., et al. Glutathione-responsive prodrug nanoparticles for effective drug delivery and cancer therapy. ACS Nano. 13 (1), 357-370 (2019).
- Still, W. C., Kahn, M., Mitra, A. Rapid chromatographic technique for preparative separations with moderate resolution. J Org Chem. 43 (14), 2923-2925 (1978).
- JoVE. JoVE science education database - Organic chemistry. Rotary evaporation to remove solvent. JoVE. , Cambridge, MA. (2023).
- JoVE. JoVE science education database - Organic chemistry II. Infrared spectroscopy. JoVE. , Cambridge, MA. (2024).
- JoVE. science education database - Organic chemistry. Nuclear magnetic resonance (NMR) spectroscopy. JoVE. , Cambridge, MA. (2023).
- Kim, J. Sample preparation for matrix-assisted laser desorption/ionization mass spectrometry. Mass Spec Lett. 6, 27-30 (2015).
- Liu, P., Pearce, C. M., Anastasiadi, R. M., Resmini, M., Castilla, A. M. Covalently crosslinked nanogels: An NMR study of the effect of monomer reactivity on composition and structure. Polymers. 11 (2), 353(2019).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal Biochem. 150 (1), 76-85 (1985).
- Yu, M., Wu, J., Shi, J., Farokhzad, O. C. Nanotechnology for protein delivery: Overview and perspectives. J Control Release. 240, 24-37 (2016).
- Zhang, Y., Zhang, D., Wang, J. T., Zhang, X., Yang, Y. Fabrication of stimuli-responsive nanogels for protein encapsulation and traceless release without introducing organic solvents, surfactants, or small-molecule cross-linkers. Poly Chem. 12 (4), 554-563 (2021).
- Kamaly, N., et al. Targeted interleukin-10 nanotherapeutics developed with a microfluidic chip enhance resolution of inflammation in advanced atherosclerosis. ACS Nano. 10 (5), 5280-5292 (2016).
- Lu, R., et al. Probing the secondary structure of bovine serum albumin during heat-induced denaturation using mid-infrared fiberoptic sensors. Analyst. 140 (3), 765-770 (2015).
- Abrosimova, K. V., Shulenina, O. V., Paston, S. V. FTIR study of secondary structure of bovine serum albumin and ovalbumin. J Phys: Conf Ser. 769, 012016(2016).
- Kabanov, A. V., Vinogradov, S. V. Nanogels as pharmaceutical carriers: Finite networks of infinite capabilities. Ang Chem Int Ed Eng. 48 (30), 5418-5429 (2009).
- Li, C., Obireddy, S. R., Lai, W. F. Preparation and use of nanogels as carriers of drugs. Drug Del. 28 (1), 1594-1602 (2021).
- Kulkarni, J. A., et al. The current landscape of nucleic acid therapeutics. Nat Nanotechnol. 16 (6), 630-643 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved