Method Article
Label-free Super-resolution Imaging(부풀어 오른 조직의 진동 이미징 및 분석으로 가능)
요약
이 프로토콜은 시료 팽창 하이드로겔 화학과 무표지 화학물질 특이적 유도 라만 산란 현미경을 결합하여 생물학적 시료에서 무표지 초고해상도 체적 이미징을 달성하는 방법을 설명합니다. 추가 기계 학습 이미지 분할 알고리즘을 사용하여 항체 표지가 없는 조직에서 단백질 특이적 다중 성분 이미지를 얻었습니다.
초록
형광 현미경, 특히 초고해상도 현미경의 보편적인 활용은 현대 생물학에 대한 지식을 크게 발전시켰습니다. 반대로, 형광 기술에서 형광단 라벨링의 요구 사항은 형광 프로브의 광표백 및 불균일 라벨링, 장시간의 샘플 처리와 같은 중요한 문제를 제기합니다. 이 프로토콜에서는 부풀어 오른 조직의 진동 이미징 및 분석(VISTA)의 자세한 작업 절차가 제시됩니다. VISTA는 형광단과 관련된 장애물을 우회하고 78nm의 공간 분해능으로 생물학적 샘플에서 무표지 초고해상도 체적 이미징을 달성합니다. 이 절차는 세포와 조직을 하이드로겔에 삽입하고, 하이드로겔 샘플 하이브리드를 등방성으로 확장하고, 유도 라만 산란 현미경을 사용한 진동 이미징을 통해 내인성 단백질 분포를 시각화함으로써 확립됩니다. 이 방법은 세포와 쥐의 뇌 조직 모두에서 입증되었습니다. 상관관계가 높은 VISTA 및 면역형광 이미지가 관찰되어 이미징 특이성의 단백질 기원을 검증했습니다. 이러한 상관 관계를 활용하여 기계 학습 기반 이미지 분할 알고리즘을 훈련하여 레이블이 없는 마우스 뇌 이미지에서 핵, 혈관, 신경 세포 및 수상돌기의 다중 구성 요소 예측을 달성했습니다. 이 절차는 세포의 병리학적 폴리글루타민(polyQ) 응집체와 처리량이 높은 뇌 조직의 아밀로이드-베타(Aβ) 플라크를 조사하기 위해 더욱 조정되어 대규모 임상 샘플에 대한 잠재력을 정당화했습니다.
서문
광학 이미징 방법의 개발은 세포 내 단백질에서 전체 장기에 이르기까지 다양한 규모에 걸쳐 표적에 대한 전례 없는 공간 및 시간 정보를 제공하기 때문에 현대 생물학의 이해에 혁명을 일으켰습니다1. 그 중 형광 현미경 검사는 높은 흡광 계수와 양자 수율2, 사용하기 쉬운 유전자 인코딩 형광 단백질3, 나노미터 규모의 구조를 이미징하기 위한 STED, PALM 및 STORM과 같은 초고해상도 방법을 가진 대규모 유기 염료 팔레트 4,5를 갖춘 가장 잘 확립된 방법입니다. 또한 팽윤성 폴리머 하이드로겔 6,7,8에 내장된 시료를 확장하는 샘플 엔지니어링 및 보존 화학의 최근 발전으로 인해 기존 형광 현미경에서 sub-diffraction limited resolution이 가능해졌습니다. 예를 들어, 일반적인 확장 현미경(ExM)은 4배 등방성 시료 팽창7을 통해 이미지 해상도를 4배 효과적으로 향상시킵니다.
이러한 장점에도 불구하고 초고해상도 형광 현미경 검사는 형광단 라벨링에서 비롯된 한계를 공유합니다. 첫째, 형광단의 광표백 및 불활성화는 반복적이고 정량적인 형광 평가 능력을 저하시킵니다. 광표백은 빛이 전자를 계속 전자 여기 상태로 펌핑할 때 불가피한 사건입니다9. 둘째, 형광단을 원하는 표적에 라벨링하는 것이 항상 간단한 작업은 아닙니다. 예를 들어, 면역염색은 길고 힘든 시료 전처리 과정을 요구하며 이미징 처리량을 저해합니다10. 또한 불균일한 항체 표지로 인한 인공물, 특히 조직 내부 깊은 곳에 인공물을 유발할 수 있습니다11. 더욱이, 원하는 단백질에 대한 형광단을 표적으로 하는 적절한 라벨링 전략은 충분히 개발되지 않았을 수 있습니다. 예를 들어, Aβ 플라크12에 대한 효과적인 항체를 찾기 위해 광범위한 스크리닝이 필요했습니다. 콩고 레드(Congo red)와 같은 작은 유기 염료는 종종 특이성이 제한되어 Aβ 플라크의 핵심만 염색합니다. 따라서 형광단 표지의 단점을 우회하고 세포에서 조직, 심지어 대규모 인간 샘플에 이르기까지 보완적인 고해상도 이미징을 제공하는 표지가 없는 초해상도 방식을 개발하는 것이 매우 바람직합니다.
라만 현미경은 화학 특이적 구조에 대한 무표지 대비를 제공하고 여기된 진동 전이13을 관찰하여 보이지 않는 화학 결합의 분포를 매핑합니다. 특히, 무표지 또는 소형 표지 샘플에 대한 유도 라만 산란(SRS) 이미징은 형광 현미경 검사법과 유사한 속도와 해상도를 갖는 것으로 입증되었습니다14,15. 예를 들어, 건강한 뇌 영역은 인간과 쥐 조직에서 종양 침투 영역과 쉽게 구별됩니다16,17. Aβ 플라크는 또한 아무런 표지 없이 갓 동결된 뇌 절편에서 단백질 CH3 진동(2940 cm-1) 및 아미드 I(1660 cm-1)을 표적으로 하여 명확하게 이미지화되었습니다18. 따라서 라만 산란은 형광단의 한계를 극복하는 강력한 무표지 대비를 제공합니다. 그런 다음 문제는 생물학적 샘플에서 나노 단위의 구조적 세부 사항과 기능적 의미를 밝힐 수 있는 라만 산란을 사용하여 초고해상도 용량을 달성할 수 있는 방법이었습니다.
우아한 광학 기기로 라만 현미경의 초해상도를 달성하기 위해 광범위한 노력이 기울여졌지만 생물학적 샘플의 해상도 향상은 다소 제한적이었습니다 19,20,21. 여기에서는 최근 연구22,23을 기반으로 VISTA(Vibrational Imaging of Swelled Twelled Tissues) 및 분석이라는 초고해상도 무표지 진동 이미징을 위해 샘플 확장 전략과 유도 라만 산란을 결합한 프로토콜을 제시합니다. 첫째, 세포와 조직은 최적화된 단백질-하이드로겔 혼성화 프로토콜을 통해 하이드로겔 매트릭스에 내장되었습니다. 그런 다음 하이드로겔 조직 하이브리드를 탈지질을 위해 세제가 풍부한 용액에서 배양한 다음 물에서 팽창시켰습니다. 그런 다음 확장된 샘플을 잔류 내인성 단백질의 CH3 진동을 표적으로 하여 일반 SRS 현미경으로 이미지화했습니다. VISTA는 label-free 이미징 기능으로 인해 형광단 라벨링으로 인해 발생하는 광표백 및 불균일한 라벨링을 우회하여 훨씬 더 높은 샘플 처리 처리량을 제공합니다. 이것은 또한 보고된 최초의 sub-100nm(78nm까지) label-free 이미징입니다. 일반적인 SRS 설정22,24 외에 추가 광학 기기가 필요하지 않으므로 쉽게 적용할 수 있습니다. 상관 VISTA 및 면역 형광 이미지를 통해 확립된 기계 학습 이미지 분할 알고리즘이훈련되었습니다 25,26 단일 채널 이미지에서 단백질 특이적 다중 이미지를 생성했습니다. 이 방법은 쥐의 뇌 조직에서 Aβ plaque를 조사하기 위해 추가로 적용되었으며, 세포핵과 혈관으로 둘러싸인 플라크 코어와 주변 필라멘트의 미세한 보기를 기반으로 하위 표현형에 적합한 전체적인 이미지를 제공했습니다.
프로토콜
이 연구에서 수행된 모든 동물 절차는 캘리포니아 공과 대학 기관 동물 관리 및 사용 위원회(IACUC)의 승인을 받았으며 프로토콜 절차는 모든 관련 윤리 규정을 준수했습니다.
1. 정착과 표본 확장을 위한 재고 해결책의 준비
- 먼저 12g의 아크릴아미드(30% w/v) 고체를 뉴클레아제가 없는 물 26mL에 용해시켜 40mL의 고정 용액을 준비합니다. 그런 다음 혼합물에 16% PFA 원액 10mL를 추가합니다. 마지막으로 10x 인산염 완충 식염수(PBS, pH 7.4) 4mL를 추가합니다. 준비된 용액은 4°C에서 최대 2주 동안 보관할 수 있습니다.
참고: 아크릴아마이드는 위험하므로 아크릴아미드를 물에 고체로 용해시키는 단계는 흄 후드에서 수행해야 합니다. - 420μL의 초순수에 아크릴레이트나트륨 70mg(7% w/v), 아크릴아미드 200mg(20% w/v) 및 N, N'-메틸렌비스아크릴아미드 50μL(0.1% w/v)를 용해하여 겔화 용액(스톡 X)을 준비합니다. 마지막에 멸균 여과된 10x PBS(pH 7.4) 57μL를 추가하고 이 용액을 -20°C에서 최대 1주일 동안 보관합니다.
참고: 덩어리를 형성하는 아크릴산 나트륨 고체를 피하십시오. 사용된 아크릴산나트륨이 분산 분말 형태인지 확인하십시오. 만들어진 재고 X는 무색 액체가 될 것입니다. 액체가 연한 노란색으로 보이면 새로운 아크릴산 나트륨을 구하십시오. - 1g의 과황산암모늄(APS, 10% w/w)을 뉴클레아제가 없는 물 9mL에 용해시켜 중합 개시제 용액을 준비합니다. 마찬가지로, 테트라메틸에틸렌디아민 1g(TEMED, 10% w/w) 1g을 뉴클레아제가 없는 물 9mL에 용해시켜 중합 촉진 용액을 준비합니다. 생성된 용액을 분취하고 -20°C에서 보관합니다.
- 뉴클레아제가 없는 물에 도데실황산나트륨 2.88g(SDS, 200mM), 염화나트륨 0.584g(200mM) 및 1M Tris-HCl 완충액 2.5mL(50mM, pH 8)를 용해하여 50mL의 변성 완충액을 준비합니다.
알림: SDS의 농도는 포화 상태에 가깝습니다. 완충액의 일부 결정화는 정상입니다. 37°C까지 약간 가열하면 용액을 투명하게 만들고 바로 사용할 수 있습니다.
2. 포유류 세포 시료의 준비
- 3.5 x 104 HeLa 세포를 24웰 플레이트의 12mm 붕규산 커버슬립(#1.5)에 파종한 다음 37°C에서 5% CO2 의 가습된 분위기 하에서 10% 소 태아 혈청 및 1% 페니실린-스트렙토마이신 항생제(완전한 DMEM)가 포함된 400μL의 Dulbecco's Modified Eagle Medium(DMEM)에서 세포를 배양합니다.
- 서로 다른 유사분열 단계에서 세포를 얻으려면 60% 포화도가 될 때까지 완전한 DMEM에서 세포를 배양합니다. 그런 다음 소 태아 혈청이 없는 DMEM으로 20시간 동안 세포를 처리하여 세포 단계를 동기화합니다. 동기화 후, 세포가 DMEM을 완료하도록 배지를 전환하고 다양한 유사 분열 단계를 표적으로 삼기 위해 2-6 시간 동안 더 배양합니다.
- 멸균 PBS로 커버슬립의 HeLa 세포를 세척하고 추가 처리 전에 37°C에서 7-8시간 동안 고정 용액(PBS의 경우 4% PFA 30% 아크릴아미드[AA])으로 배양합니다.
참고 : 높은 농도의 아크릴 아미드와 함께 더 높은 고정 온도는 고정 과정에서 단백질 간의 분자간 가교를 억제하는 데 도움이되며 단백질의 상세한 초 구조를 보존하는 것으로보고됩니다8. - polyQ 응집체가 있는 세포의 경우, 세포가 70%-90% 포화도에 도달할 때까지 완전한 DMEM으로 세포를 성장시킵니다. 새로운 완전한 DMEM으로 변경한 후 transfection agent를 사용하여 mHtt97Q-GFP를 인코딩하는 1μg의 플라스미드를 세포에 transfection합니다( 자세한 내용은 재료 표 참조). 제조업체의 프로토콜에 따라 transfection을 수행합니다.
- 24-48시간의 형질주입 후 배양 배지를 제거하고 세포가 있는 커버슬립에 800μL의 고정 용액(4% PFA, 30% AA)을 추가합니다. 커버슬립을 37°C에서 6-8시간 동안 배양합니다. PBS 3x로 커버슬립을 세척하면 생성된 세포 샘플이 추가 처리를 위한 준비가 됩니다.
3. 마우스 뇌 샘플 준비
- C57BL/6J 마우스(생후 6-8주, 수컷과 암컷, 마우스 6마리)와 알츠하이머 마우스(생후 9개월, 암컷, 마우스 3마리)를 상업적인 출처에서 구입합니다( 자세한 내용은 재료 표 참조). 표준 프로토콜27에 따라 이산화탄소 마취를 통한 안락사를 수행합니다. 간단히 말해서, 마우스를 챔버에 놓고 챔버/분 부피의 30%-70% 정도로 100% CO2 의 흐름으로 챔버를 채우고 임상적 사망 후 최소 1분 동안 흐름을 유지합니다.
- 인도적 안락사를 확인한 후 가위를 사용하여 쥐의 목을 빠르게 베십시오. 정중선 아래로 피부를 통해 크게 절개하여 두개골을 노출시킵니다. 두개골이 완전히 드러나도록 동물의 코 쪽으로 피부를 당깁니다.
- 가위로 정중선을 따라 두개골을 자르고 두개골의 두 반쪽을 옆으로 떼어냅니다. 핀셋을 사용하여 PBS가 있는 얼음 위의 페트리 접시에 뇌를 퍼냅니다. 얼음처럼 차가운 PBS로 신선한 쥐의 뇌를 씻어내고 뇌를 10mL의 고정 완충액(4% PFA, 30% AA)으로 옮깁니다.
- 4°C의 고정 버퍼에서 마우스 뇌를 24-48시간 동안 배양한 다음 하룻밤 동안 37°C로 옮깁니다. 멸균 PBS로 세척한 후 비브라톰을 사용하여 마우스의 뇌를 150μm 절편으로 절단하고 4°C의 PBS에 보관합니다.
4. 하이드로겔 임베딩, 변성 및 세포 및 조직 샘플의 확장
- 샘플이 위에 표시된 대로 필요한 시간 동안 고정 버퍼에서 배양되었는지 확인하십시오. 스톡 X, 자유 라디칼 개시제 및 가속기 스톡 용액을 해동하고 전체 프로세스 동안 얼음 위에 보관하십시오.
참고: 배양 시간이 충분하지 않으면 하이드로겔 하이브리드에 유지되는 단백질의 수가 감소하여 신호가 감소할 수 있습니다. - 셀이 있는 커버슬립을 집어 들고 핀셋을 사용하여 유리 슬라이드에 놓습니다. 뇌 절편(150μm 두께)을 골라 부드러운 양모 붓을 사용하여 다른 유리 슬라이드에 놓고 평평하게 만듭니다. 샘플과 함께 제공되는 과도한 액체를 제거하십시오.
- 두 개의 커버슬립(#1.5)을 그 사이에 물방울을 추가하여 유리 슬라이드의 샘플 양쪽에 쌓아 겔화 챔버를 만듭니다. 샘플이 위를 향하도록 유리 슬라이드를 얼음처럼 차가운 열 블록에 놓고 4°C로 1분 동안 냉각합니다.
- 10%(w/w) TEMED를 스톡 X에 추가한 다음 10% APS 용액을 추가합니다. 빠르게 와류를 일으키고 혼합 후 1분 이내에 결과 용액을 챔버 내의 샘플에 천천히 떨어뜨려 샘플 표면을 덮고 기포를 방지합니다. 용액과 샘플을 얼음(또는 얼음처럼 차가운 열 블록) 위에 보관하여 샘플에 추가하기 전에 젤 형성(높은 수준의 중합)을 방지합니다.
- 샘플이 용액에 완전히 담가지면 샘플 위에 평평하고 투명한 필름으로 덮인 커버슬립을 챔버의 뚜껑으로 놓습니다. 챔버를 얼음이나 얼음처럼 차가운 열 블록에 1분 더 두었다가 37°C의 가습 인큐베이터에서 30분 동안 배양합니다.
- 37°C 인큐베이터에서 유리 슬라이드의 겔화 챔버를 꺼냅니다. 뚜껑을 제거한 후 투명하지 않은 젤을 관찰해야 합니다. 면도날로 절단하여 젤을 회수하거나 유리 슬라이드를 실온의 변성 버퍼에 15분 동안 넣습니다. 젤은 유리 슬라이드에서 분리됩니다.
- 더 변성 및 delipidation를 달성하기 위하여 열 조건 하에서 변성 완충액에 있는 고립된 gel를 배양하십시오. 세포 샘플의 경우 95°C에서 1시간 동안 변성합니다. 150μm 두께의 뇌 절편의 경우 70°C에서 3시간 동안 변성한 다음 95°C에서 1시간 동안 변성합니다.
참고: 겔은 실온에서 변성 완충액으로 처음 배양할 때 곱슬곱슬해질 수 있습니다. 이는 정상이며 고온 변성 후에 평평해집니다. 더 두꺼운 조직 샘플로 작업할 때는 더 긴 변성 시간이 필요합니다. - 열처리 후, 변성 샘플을 10분 동안 PBS로 3x 세척합니다. 이 시점에서 젤은 원래 크기의 약 1.5배로 팽창해야 합니다. 세척된 겔을 초순수와 함께 큰 용기(겔 부피의 최소 20배)에 배양하여 더 높은 팽창 비율을 달성합니다. 1시간 3회마다 물을 갈아주고 샘플을 밤새 어둠 속에 두십시오. 생성된 겔은 이미지화할 준비가 되었습니다.
참고: 팽창 비율은 원래 샘플의 기계적 특성에 크게 좌우됩니다. 세포 샘플에 대한 4.2배 확장과 뇌 조직 샘플에 대한 3.4배 확장이 얻어졌습니다.
5. 확장된 세포 및 조직 샘플에서 내인성 단백질 분포의 무표지 이미징
- 이미징 과정에서 팽창된 젤 샘플을 물에 보관하십시오. 젤은 팽창 후 깨지기 쉬우므로 주의해서 다루어야 합니다. 팽창된 샘플 함유 젤을 적절한 개구부 크기와 깊이의 현미경 스페이서를 사용하여 물로 채워진 현미경 슬라이드(1mm 두께)에 놓습니다. 스페이서를 커버슬립(#1.5)으로 덮고 s를 방지하기 위해 제대로 밀봉되었는지 확인하십시오.amp르 이동.
- 확장된 세포 또는 조직이 있는 샘플을 커버슬립이 대물렌즈를 향하도록 하여 전동 스테이지에 놓습니다. 소프트웨어에서 Ocular 를 클릭하여 광 경로를 명시야로 변경하고 수동 노브를 사용하여 z 위치를 조정합니다.
- 샘플 상단에 이머젼 오일을 추가하고 대물렌즈에서 25배 배율로 명시야 아래에서 관찰하면서 콘덴서를 Köhler 조명에 적합한 위치로 조정합니다. 레이저 패널의 OPO 파장 창에 791.3nm를 입력하여 2940cm-1에서 단백질 CH3 진동을 표적으로 합니다.
- LSM 버튼을 클릭하여 현미경의 빛을 명시야(접안렌즈)에서 레이저 스캐닝 모드로 전환하고 레이저 제어 패널의 셔터 버튼을 눌러 SRS 레이저 셔터를 엽니다. 현미경 소프트웨어의 LIVE 버튼을 눌러 실시간 이미지 획득을 시작합니다.
- 짧은 픽셀 체류 시간(12.5μs/픽셀)과 낮은 이미지 해상도(256 pixels x 256 pixels)에서 SRS 이미지를 보면서 z를 변경하여 적절한 초점을 찾습니다. 이상적인 z-위치를 찾으면 현미경 소프트웨어에서 해당 막대를 당겨 스캔 크기와 픽셀 체류 시간을 변경합니다.
- 락인앰플리파이어의 시간 상수와 일치하는 더 긴 픽셀 체류 시간(80μs/픽셀)을 가진 수퍼 샘플링 조건(1024 pixels x 1024 pixels)을 사용하여 LSM 버튼을 눌러 이미지를 획득합니다. z 방향으로 1μm의 스텝 크기를 가진 z-스택을 수집하여 체적 이미지를 획득합니다. ImageJ를 사용하여 소프트웨어에서 저장된 OIR 파일을 처리하고 분석합니다.
참고: 자세한 SRS 설정은 최근 Mutlu et al.24에 보고되었습니다. 여기서, 펌프(770-990nm) 및 스토크스(1031.2nm)에 대해 80MHz 반복률과 2ps 대역폭을 가진 조정 가능한 피코초 레이저를 레이저 스캐닝 컨포칼 현미경( 재료 표에 자세히 설명)으로 라우팅했습니다. 순수D2O를 갖는 신호에 대해 두 빔의 시간적 및 공간적 중첩을 최적화합니다. 명시야에서 확장된 샘플에 적합한 z를 찾는 데는 굴절률이 겔 전체에 걸쳐 매우 균일하기 때문에 약간의 노력이 필요합니다. - 25x 대물렌즈와 60x 대물렌즈를 모두 사용하여 폴리스티렌 비드(100nm)의 SRS 이미지를 촬영하여 VISTA의 해상도를 측정합니다. 펌프 레이저를 784.5nm로 설정하고, 3050cm-1의 라만 이동에 해당하며, 방향족 C-H의 특징은 폴리스티렌의 진동을 늘립니다.
참고: 여기에 사용된 펌프 레이저 파장은 VISTA에서 단백질에 사용되는 것과 유사합니다. - 60x 대물렌즈를 사용하여 비드 이미지의 실험적 전파 절반 최대(FWHM, 진폭의 절반에서 선 모양의 너비)는 276.17nm였습니다. 비드 오브젝트의 기능을 반원으로 모델링합니다.
참고: PSF 가우스 함수가 c(σ) = 269nm/2.35인 경우 컨볼루션 비드 이미지의 측정된 FWHM은 276.17nm입니다. 결과적으로 SRS 시스템의 해상도는 Rayleigh Criterion에 의해 269nm × 1.22 = 328nm입니다. VISTA는 세포 샘플이 평균 4.2배 확장되므로 유효 분해능은 328nm/4.2 = 78nm로 낮아집니다.
6. 면역 표지 및 확장 조직 샘플의 상관 VISTA 및 형광 이미징
- 변성 후 하이드로겔 내장 샘플(예: 150μm 뇌 관상 절편)을 1%(v/v) Triton X-100(PBST)에 15분 동안 사전 배양합니다. 1:100 희석에서 1차 항체가 있는 PBST로 배양 완충액을 전환합니다. 다중 이미징을 위해 여러 단백질 표적이 필요한 경우, 서로 다른 표적에 대한 각각의 1차 항체를 동일한 칵테일에서 적절한 농도로 희석하고 동시에 샘플과 함께 배양합니다.
- 37°C에서 80rpm으로 부드럽게 흔들면서 16-18시간 동안 희석된 1차 항체로 겔을 배양한 다음 37°C에서 1-2시간 동안 PBST로 3x 광범위하게 세척합니다. 배양 중에 겔을 뒤집어 여기와 이후의 모든 배양에서 불균일한 항체 표지를 방지합니다.
- 빛으로부터 보호된 37°C에서 12-16시간 동안 PBST를 사용하여 1:100 희석으로 해당 종 표적의 2차 항체와 함께 샘플을 배양합니다. 라벨링된 하이드로겔 샘플을 PBST로 3x 37°C에서 1-2시간 동안 부드럽게 흔들어 세척합니다.
- DAPI를 PBS의 최종 농도 3μM로 희석합니다. 샘플 하이드로겔에 충분한 양의 DAPI 용액을 추가하여 겔이 용액에 잠기도록 합니다. 실온에서 1-2시간 동안 배양하고 80rpm으로 부드럽게 흔듭니다. PBS로 샘플을 3x 세척합니다.
- 대량의 이중 탈이온화 H2O로 배양하여 면역 표지된 겔 샘플을 확장합니다. 1시간 3배마다 물을 갈아주고 빛으로부터 보호된 H2O에서 밤새 샘플을 배양합니다. 라벨링하는 동안 겔은 PBS 버퍼에 비해 1.5배 팽창해야 합니다.
- 5.1단계에 설명된 대로 이미징 샘플을 준비합니다. 형광 이미징을 위한 25x, 1.05 NA, Water Immersion Objective를 사용하여 이미징 샘플을 레이저 스캐닝 컨포칼 현미경에 놓습니다.
- 현미경 소프트웨어의 드롭다운 메뉴에서 표적 항체에 따라 각각의 여기 레이저(405nm, 488nm, 561nm 및 640nm) 및 PMT 쌍으로 적절한 채널을 선택합니다. 실시간 이미지 획득을 위해 LIVE 버튼을 누릅니다.
- 실시간 형광 신호를 기반으로 수동 노브로 초점 위치를 조정합니다. 실시간 형광 신호에 따라 현미경 소프트웨어에서 레이저 출력, 픽셀 체류 시간 및 PMT 게인을 최적화하여 희미한 신호 또는 과포화를 방지합니다.
참고: 서로 다른 항체의 보고된 구조를 기반으로 모양과 특징을 평가하여 잠재적인 항체 교차 반응을 제거하고 서로 다른 형광 채널 간의 누화를 방지합니다. - LSM 버튼을 눌러 상관 SRS 및 형광 이미지를 획득하기 시작합니다. 먼저, 면역 표지된 샘플에서 부피 측정 형광 이미지를 수집합니다. 형광 이미징이 완료되면 현미경 광 경로를 적외선(IR) 투명 상태로 전환합니다.
- 현미경 소프트웨어에서 검출 채널을 형광 PMT에서 SRS로 변경합니다. SRS 레이저의 셔터를 열고 동일한 z 범위를 가진 동일한 샘플의 시야에서 SRS 체적 이미징을 수행합니다. 정상 범위는 100-200μm이며 최대 700μm까지 올라갈 수 있습니다.
참고: 여기 레이저의 파장 차이로 인해 형광 이미지와 SRS 이미지 사이의 z 위치 이동을 유발하는 약간의 색수차가 있습니다. SRS와 형광 z-stack 이미지를 나란히 수동으로 비교해야 합니다. z-위치를 정확하게 일치시키기 위해 SRS와 형광 채널 모두에서 정확히 일치하는 특징을 찾습니다.
7. U-Net 아키텍처의 구축, 교육 및 검증
참고: Linux에 설치하는 것이 좋습니다. >10GB RAM이 있는 그래픽 카드가 필요합니다.
- 환경 설정
- 3-5.3.0-linux-x86_64에 Anaconda 또는 Miniconda를 설치하십시오. 다음 파일을 복제하거나 다운로드합니다. https://github.com/Li-En-Good/VISTA. 다음 명령줄을 사용하여 플랫폼에 대한 Conda 환경을 만듭니다:
conda env 생성 -f environment.yml
- 3-5.3.0-linux-x86_64에 Anaconda 또는 Miniconda를 설치하십시오. 다음 파일을 복제하거나 다운로드합니다. https://github.com/Li-En-Good/VISTA. 다음 명령줄을 사용하여 플랫폼에 대한 Conda 환경을 만듭니다:
- 예측 모델 학습
- 해당 SRS 이미지의 디렉터리를 csv 파일의 실측 이미지와 쌍을 이룹니다. SRS 이미지의 디렉터리를 path_signal 아래에 배치하고 실측 이미지를 path_target 열 아래에 배치합니다.
- csv 파일을 data/csv 폴더에 넣습니다. 필요한 경우 scripts/train_model_2d.sh에서 구성을 수정합니다. 명령줄을 사용하여 환경을 활성화합니다.
conda fnet 활성화 - 명령줄을 사용하여 모델 학습을 시작합니다.
./scripts/train_model_2d.sh 0
그러면 교육이 시작됩니다. 각 반복에 대한 손실은 명령줄에 표시되고 csv 파일의 save_models/<파일 이름> 폴더에 모델과 함께 저장됩니다.
- 명령줄을 사용하여 훈련 세트와 테스트 세트의 이미지를 검증합니다.
./scripts/train_model_2d.sh 0
예측 결과는 csv 파일의 results/.
8. VISTA는 label-free 이미지에서 단백질 특이적 다중성에 대한 U-Net 예측과 결합되었습니다.
- csv 파일의 data/csvs//test.csv을 수정합니다. path_signal 및 path_target의 디렉토리를 새 SRS 이미지의 디렉토리로 바꿉니다.
- csv 파일의 results/. 명령줄을 사용하여 예측을 실행합니다.
./scripts/train_model_2d.sh 0
예측 결과는 csv >파일의 results/
결과
이미징 및 분석 방법의 작동 원리를 확립한 후, 팽창 비율을 평가하고 샘플 처리 중 등방성 팽창을 보장하기 위해 이미지 정합을 수행했습니다(그림 1A, B). 처리되지 않은 샘플과 VISTA 샘플 모두 내인성 단백질의 CH3에서 유래한 2940cm-1에서 결합 진동을 표적으로 삼으면서 이미지화되었습니다. 처리되지 않은 샘플에서는 핵과 같은 단백질이 풍부한 구조가 주변 조직의 압도적인 지질 함량으로 인해 어두웠습니다22(그림 1A). 탈lipidation 처리를 포함하는 샘플 처리 후 결과 이미지는 반전된 대비로 동일한 특징을 보여주었습니다(그림 1B). 핵과 혈관의 모양과 상대적 위치는 완전히 변경되지 않았으며(그림 1A, B, 번호가 매겨진 구조) 처리가 등방성 과정임을 확인했습니다. 해당 핵의 크기를 비교함으로써, 이 방법은 처리되지 않은 샘플에 비해 뇌 조직 샘플에서 3.4배 확장을 달성한다는 결론을 내렸습니다22,23.
뇌 조직의 확장 비율을 알고 있는 VISTA는 이제 이전에는 분해할 수 없었던 무표지 SRS 이미지의 새로운 기능을 해결할 수 있습니다. 액틴 및 튜불린 구조가 초해상도 시연의 황금 표준이었지만, 액틴 및 튜불린 구조의 분리능 개선은 유사한 혼성화 화학을 사용하는 형광 기반 샘플 팽창 전략에 의해 잘 특성화되었습니다28. 더욱이, 이 기법으로는 신호가 내인성 단백질의 전체 앙상블에서 나오기 때문에 특정 액틴/튜불린 구조를 이미징하는 것이 덜 실현 가능한데, 튜불린과 같은 세포골격 구조는 명확하게 구별할 수 있는 충분한 대비(신호 대 배경 비율)를 갖지 않기 때문입니다. 따라서 우리는 다른 나노 스케일 구조를 이미징하기로 결정했습니다. 우리는 생쥐 피질에서 150nm까지 특징을 캡처할 수 있음을 보여주었습니다(그림 1C, D). 뉴런 수상돌기 주변의 분산 패턴에 기초하여, 관찰된 작은 구조는 146 nm 크기의 수지상 척추 머리7일 가능성이 높습니다(그림 1D). 또한, 이 방법은 약 100nm의 두께를 갖는 것으로 여겨지는 Aβ 플라크의 섬유소 구조를 이미지화하는 데 사용되었습니다29,30. 실제로, ~130nm 섬유소 구조는 이 방법을 사용하여 대표적인 확산성 Aβ 플라크에서 분해될 수 있음이 입증되었습니다(그림 1E, F).
VISTA는 효과적인 단백질 보유 및 단백질 이미징22을 가능하게 하기 때문에 핵 내의 단백질이 풍부한 핵과 배양된 HeLa 세포의 세포질에서 리본 모양의 세포골격 구조를 명확하게 구별할 수 있습니다(그림 2A, 화살촉). 이 방법은 포유류 세포에서 일시적으로 발현되는 폴리-글루타민(polyQ) 응집체를 연구하기 위해 추가로 적용되었습니다(그림 2B,C). 그 결과, 여러 복제 샘플에서 팽창 전과 후의 동일한 응집체 구조를 비교하여 예상대로 조밀하게 채워진 구조인 응집체가 등방성으로 확장되었음을 확인했습니다23. 일반 해상도 SRS 이미지에 없거나 흐릿한 고해상도 구조는 이 방법을 사용하여 얻었습니다. VISTA 응집체 이미지는 polyQ 응집체의 주변에 피브릴과 같은 돌출부와 중앙의 빈 구조를 보여주었습니다(그림 2B, 화살촉). 돌출부가 세포질 내용물에 매끄럽게 부착된다는 관찰은 응집체가 세포질의 기능성 단백질과 결합한다는 것을 시사할 수 있습니다. 돌이켜 보면, 고정 시약 포름알데히드와 하이드로겔 단량체인 아크릴 아미드 및 아크릴산나트륨은 모두 단백질 응집체 안팎으로 확산될 수 있는 작은 분자이기 때문에 밀도가 높은 응집체를 팽창시킬 수 있는 능력도 그럴듯합니다. 골재가 단량체와 공중합되어 하이드로겔로 들어가면 팽창 과정이 정상적으로 진행되어야 합니다.
그런 다음 이 방법을 쥐의 뇌 조직에 적용하여 범위를 더욱 확장했습니다. 조직 샘플은 투과성 감소, 두께 증가, 이질적인 기계적 강도와 같은 문제를 제기하지만 이 방법을 사용하여 마우스 뇌 샘플을 성공적으로 이미지화했습니다(그림 2D). 세포 샘플과 유사하게, 세포핵, 혈관 및 신경 돌기를 포함한 단백질이 풍부한 구조가 관찰되었습니다(그림 2D, 화살촉). 뇌 조직의 한계는 단지 3.4배의 확장만이 이루어졌다는 것인데, 이는 뇌 샘플의 유효 해상도를99nm22로 만든다. 우리는 핵에 대한 DAPI 염색과 혈관에 대한 렉틴 염색을 통해 상관 염료 및 항체 염색을 통해 SRS 신호의 구조적 기원을 검증했습니다(그림 2E, F). 신경 세포체 및 돌기는 또한 NeuN 및 MAP222의 면역 형광에 의해 설명되었습니다. 상관 형광 이미지를 실측 자료로 활용하는 훈련된 CNN(Convolutional Neural Network) 알고리즘을 사용하여 단일 채널 이미지를 다중 이미지를 위한 특정 단백질 구조 채널로 분할했습니다22.
마지막으로, 우리는 알츠하이머병에 대한 잘 알려진 동물 모델인 5xFAD 마우스의 뇌에서 병리학적 Aβ 플라크를 조사하는 것을 목표로 했습니다31. 절차를 따른 후 뇌 조직에 아밀로이드 플라크가 침착되는 3차원 SRS 이미지를 획득했습니다(그림 2G). 단백질 농도가 높은 푼크타(Puncta)가 관찰되었는데(그림 2G, 주황색 화살표), 이는 Aβ 플라크의 핵심을 나타냅니다. 이러한 이미지는 또한 주변 Aβ 플라크(그림 2G, 자홍색 화살촉)를 드러냈는데, 이는 Aβ 코어만 표적으로 하는 기존의 콩고 적색 염색에 의해 종종 무시됩니다. 훈련된 분할 알고리즘과 결합하면 label-free 이미지를 타겟 특이적 멀티플렉스 이미지(그림 2F)로 변환할 수 있으며 면역형광23 과 공동으로 수행하여 포괄적이고 높은 처리량 방식으로 플라크-성상세포 및 플라크-미세아교세포 미세환경 상호 작용32 을 연구할 수 있습니다.
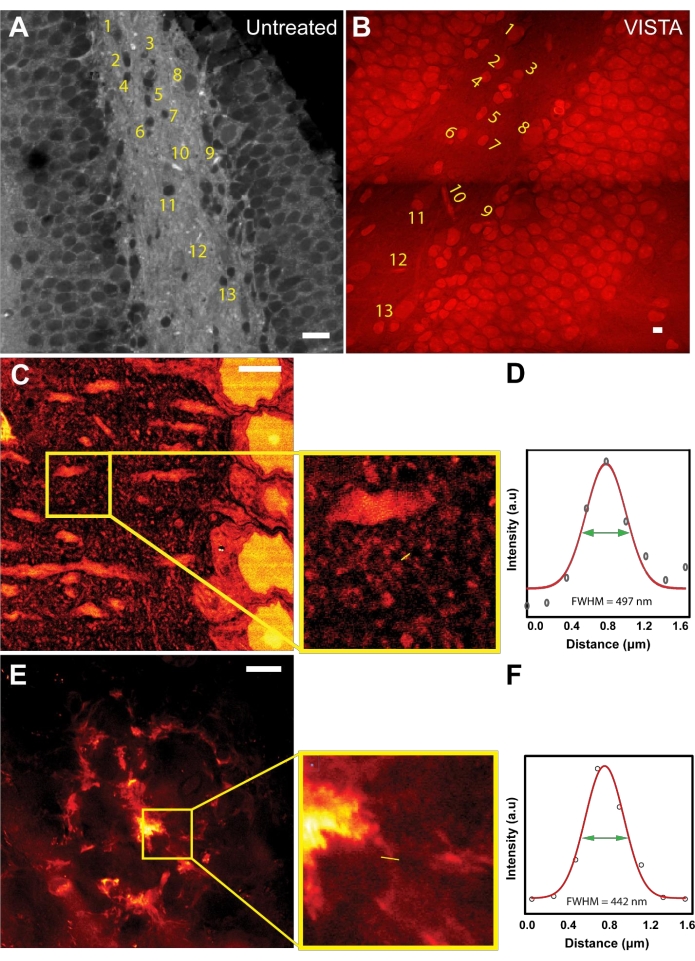
그림 1: 샘플 확장 전략은 마우스 뇌 조직에서 초고해상도 label-free 이미징을 가능하게 합니다. (A) 마우스 해마의 CH3 주파수에서의 SRS 이미지. (B) 마우스 해마의 동일한 시야에 있는 VISTA 이미지. 레이블이 지정된 영역에는 처리 전후의 해당 기능이 표시됩니다. (C) 더 미세한 특징을 보여주는 정상적인 쥐 피질의 VISTA 이미지. 삽입은 관심 영역을 표시합니다. (D) 팽창된 샘플에서 관찰된 미세 구조에 대한 분해능 정량화. 497nm의 FWHM은 3.4배 확장되는 146nm의 유효 해상도에 해당합니다. (E) 쥐의 뇌 조직에 있는 아밀로이드-베타(Aβ) 플라크의 VISTA 이미지. 삽입은 확대된 관심 영역을 표시합니다. (F) 팽창된 아밀로이드-베타 플라크의 압출 섬유 구조에 대한 해상도 정량화. 442nm의 FWHM은 3.4배 확장되는 130nm의 유효 해상도에 해당합니다. 스케일 바 = 20μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
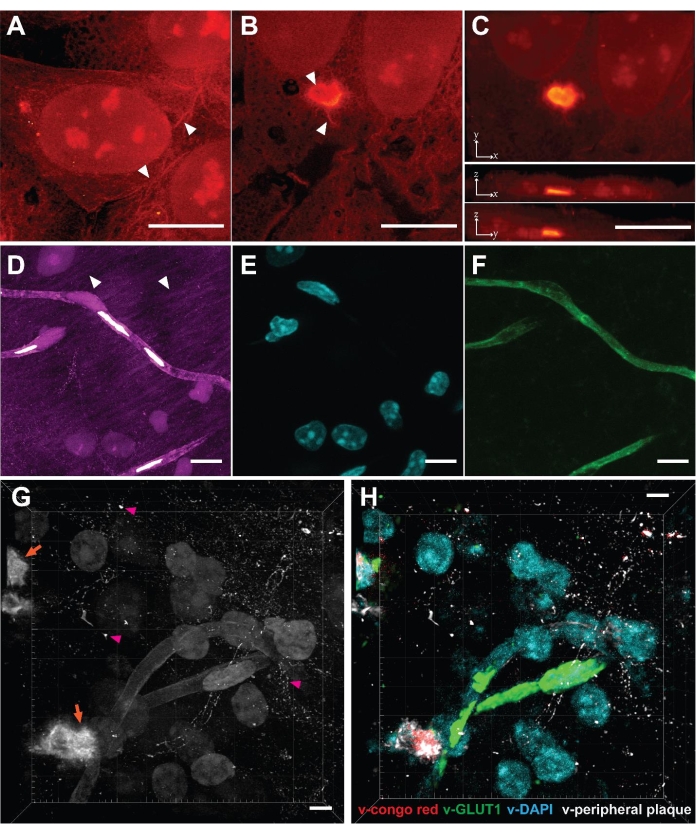
그림 2: VISTA에 의해 구현된 세포 및 조직에서의 무표지 초고해상도 체적 이미징. (A) 정상 HeLa 세포의 부피 측정 이미지. 화살촉: 세포골격과 같은 구조. (B) HeLa 세포에서 발현된 polyQ 응집체의 단일 z-슬라이스 이미지. 화살촉: 중공 구조 및 원섬유 돌출. (C) x-y, x-z 및 y-z 방향의 최대 강도 투영은 polyQ 응집체 함유 셀의 체적 보기를 보여줍니다. (D) 쥐 뇌의 관상 단면의 체적 이미지. 화살촉: 뉴런 과정. (E) 동일한 샘플 영역에서 핵의 형광 이미지(DAPI 염색)는 VISTA 이미지에서 핵과 1:1의 상관관계를 보여줍니다. (F) 동일한 샘플 영역에서 혈관의 형광 이미지(안티 렉틴)는 VISTA 이미지의 혈관 구조와 1:1 상관관계를 보여줍니다. (G) 뇌 조직을 포함하는 Aβ(주황색 화살표)의 체적 이미지. 분홍색 화살촉: 주변 Aβ 플라크. (H) 훈련된 이미지 분할 알고리즘에 의해 예측된 (G)의 다중화 이미지. V-콩고 빨간색은 Aβ 플라크의 핵심을 나타냅니다. v-GLUT1은 혈관을 나타냅니다. v-DAPI는 핵을 나타냅니다. v-peripheral plaque는 콩고 적색 염료에 의해 염색되지 않은 Aβ plaque를 나타냅니다. 스케일 바 = 10μm. 길이 스케일은 확장 전의 거리(다른 확장 비율에 맞게 조정됨)를 기준으로 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
요약하면, 세포와 조직의 단백질이 풍부한 세포 및 세포 내 구조를 이미지화하기 위한 무표지 방식인 VISTA에 대한 프로토콜을 제시합니다. 이 방법은 하이드로겔 포집 세포 및 조직의 단백질에서 내인성 CH3를 표적으로 함으로써 생물학적 샘플에서 78nm까지 효과적인 이미징 해상도를 달성하고 Aβ 플라크의 Huntingtin 응집체 및 원섬유의 미량 압출을 해결합니다. 이 기술은 label-free 이미징 양식에 대해 100nm 미만의 해상도를 보고하는 첫 번째 사례입니다22. 기존 확장 방법 6,7,8,28,33,34 와 비교하여 이 기술은 label-free SRS 이미징의 장점을 계승하므로 레이저 조명으로 인한 광표백, 불활성화 또는 담금질이 없습니다. 또한 label-free 방법으로서 DISCO12,35 및 ExM 33,34와 같은 방법에 항상 관여하는 까다롭고 비효율적이며 잠재적으로 아티팩트를 유발할 수 있는 항체 표지를 우회하여 고처리량 시료 준비와 조직 전체에 걸쳐 균일한 이미징을 제공합니다. label-free 접근법에서 다중성의 부족을 해결하기 위해, CNN 기반 이미지 분할 알고리즘25로 구현된 VISTA는 뇌 조직22에서 어떠한 표지도 없는 단백질 특이적 다성분 이미지를 제공합니다. 이 방법은 5xFAD 마우스 뇌에 추가로 적용되었으며 응집체, 코어 및 주변 원섬유, 핵 및 혈관에 대한 전체적인 체적 보기를 가능하게 했습니다23. 우리는 VISTA가 영장류 또는 인간의 뇌 절편과 같은 더 큰 샘플에 대해 잘 확장되고 궁극적으로 임상 조사에 유용할 수 있을 것으로 예상합니다.
이 방법의 성공적인 구현을 보장하는 세 가지 필수 단계가 있습니다. 첫째, 하이드로겔 샘플 하이브리드에서 최대 단백질 보유가 중요하며22. 이 목표를 달성하기 위해 고농도의 아크릴아미드28을 함유하고 단백질 분해 절차를 단백질 분해로 인한 상당한 단백질 손실을 저장하는 고농도 세제 탈지질화로 대체하도록 고정 조건을 수정했습니다. AA의 첨가는 단백질의 분자간 교차결합을 억제하고 단백질 분해 없이 등방성 확장을 가능하게 합니다28. 이전 연구에서는 아크릴아미드 하이드로겔의 지방족 CH 결합이 일정한 배경22만 발생시킨다는 것을 증명하기 위해 중수소화 단량체를 사용했습니다. 둘째, SRS와 면역 표지 간의 적절한 상관관계와 서로 다른 단백질 표적 간의 구별을 확립해야 합니다. 이 방법은 단색 SRS 이미지에 다중성을 추가하기 위해 이미지 분할 알고리즘에 의존하기 때문에 면역 형광에서 서로 다른 단백질 표적 간의 누화는 이미지 품질을 크게 손상시킵니다. 우리는 SRS 이미지에서 명백한 단백질이 풍부한 구조를 꼼꼼하게 선택하고 해당 면역 형광 기능을 검증했습니다. 셋째, 모델을 사용하여 새로운 SRS 데이터 세트에서 형광 패턴을 예측하기 전에 훈련된 기계 학습 모델의 유효성과 신뢰성을 입증해야 합니다. 학습 세트에 포함되지 않은 고유한 기능은 예측에 문제를 일으킬 수 있습니다. 예측 결과가 만족스럽지 않은 경우 사용자는 학습에 더 많은 데이터를 포함하고 학습 세트에 포함되지 않은 패턴을 예측하지 않도록 해야 합니다. Pearson의 테스트 세트와 검증 세트의 상관 관계도 예측의 품질을 보장하기 위해 모니터링해야 합니다22,23. 학습을 위해 최소 100개의 해당 이미지 세트를 갖는 것이 좋습니다.
이 방법은 생물학 연구에 엄청난 잠재력을 가지고 있지만 창의적인 솔루션을 기다리는 몇 가지 제한 사항이 있습니다. 무엇보다도 감도에 대한 개선이 더 필요합니다. 무표지 시뮬레이션된 라만 산란의 검출 한계는 낮은 밀리몰 범위이며, 3차원 샘플의 등방성 팽창은 화학 결합을 크게 희석시키고 신호를 약화시킵니다. 따라서 우리는 특이성과 다중성이 부족한 내인성 단백질의 전체 앙상블을 이미징하는 데 한계가 있습니다. VISTA와 초고감도 SRS36을 결합하면 이를 확장하여 저농도 단백질을 이미지화하고 직교 화학 결합을 표적으로 하여 초해상도 수준에서 응집체 구조 및 조성을 연구할 수 있습니다37. 둘째, 현재 뇌 조직의 3.4배 확장 비율은 중간 정도의 해상도 개선만 제공합니다. 이전에는 구별할 수 없었던 Aβ 플라크의 미세한 돌출을 이미 해결했지만, 항상 더 높은 해상도가 바람직합니다. 이 경우 단백질 앵커링 및 하이드로겔 화학의 혁신이 큰 도움이 될 것입니다. 예를 들어, 다른 겔 제형은 훨씬 더 높은 이미지 해상도38,39,40을 위해 더 큰 팽창 비율을 가능하게 할 수 있습니다. 시료 처리의 새로운 절차를 통해 널리 사용 가능한 FFPE 조직학 시료38,41에 적용할 수 있으므로 대규모 임상 연구에 더욱 적합합니다.
공개
저자는 경쟁 이익이 없음을 선언합니다.
감사의 말
소프트웨어 지원을 위해 Caltech Biological Imaging Facility를 인정합니다. L.W.는 미국 국립보건원(National Institutes of Health, NIH Director's New Innovator Award, DP2 GM140919-01), 암젠(Amgen, Amgen Early Innovation Award) 및 캘리포니아 공과대학(California Institute of Technology)의 창업 기금의 지원에 감사를 표합니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.0 M Tris pH 8 | Sigma-Aldrich | 648314 | |
| 16% Paraformaldehyde | Electron microscopy science | 15710 | diluted to 4% in PBS |
| 25x water immersion objective | Olympus | XLPLN25XWMP2 | NA 1.05 |
| 5XFAD Mice | Mutant Mouse Resource and Research Centers and the Jackson Laboratory | B6SJL-Tg (APPSwFlLon, PSEN1*M146L*L286 V) 6799Vas/Mmjax | Alzheimer brain |
| 60x water immersion objective | Olympus | UPLSAPO60XWIR | NA 1.2 |
| Acrylamide | Sigma-Aldrich | A9099 | |
| ammonium persulfate | Sigma-Aldrich | A3678 | |
| anti-MAP2 | Cell Signaling Technology | 8707 | |
| anti-NeuN | Cell Signaling Technology | 24307 | |
| borosilicate coverslip #1.5 | Fisher Scientific | 1254581 | |
| C57BL/6J Mice | Jackson Laboratory (JAX) | 664 | Normal mice |
| D2O | Sigma-Aldrich | 151882 | for SRS calibration |
| DAPI | Thermo Fisher | D1306 | |
| DMEM | GIBCO | 10566-016 | |
| FBS | GIBCO | A4766 | |
| glass slide 3" x 1" x 1 mm | VWR | 16004-430 | |
| goat anti-chicken IgY, Alexa Fluor 647 | Invitrogen | A-21449 | |
| goat anti-mouse IgG, Alexa Fluor 647 | Invitrogen | A-21236 | |
| goat anti-rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11034 | |
| goat anti-rat IgG, Alexa Fluor 568 | Invitrogen | A-11077 | |
| Grace Bio-Labs Press-To-Seal silicone isolators | Sigma-Aldrich | GBL664108 | microscope spacer |
| Htt-97Q-GFP Plasmid | Gift from Prof. R. Kopito and Prof. F.-U.Hartl. | ||
| Laser scanning microscope | Olympus | FV3000 | laser scanning confocal microscope |
| lipofectamine 3000 | Thermo Fisher | L3000001 | transfection agent |
| Lycopersicon Esculentum Lectin DyLight®594 (lectin) | Vector Laboratories | DL-1177-1 | |
| Microscope spacer | Grace Bio-Labs | 621502 | |
| N,N′-methylenebisacrylamide (BIS) | Sigma-Aldrich | M1533 | bought as 2% solution in water |
| Nuclease free water | Thermo Fisher | 10977-015 | |
| Penicillin-Streptomycin | GIBCO | 15140-122 | |
| poly-strene beads | Sigma-Aldrich | 43302 | for resolution characterization |
| Sodium Acrylate | Sigma-Aldrich | 408220 | |
| sodium dodecyl sulfate | Sigma-Aldrich | 71725 | |
| soft-wool paint brush #3 | TANIS | 000333 | |
| SRS Laser | A.P.E | picoEmerald | 2ps pulse width |
| tetramethylethylenediamine | Sigma-Aldrich | T9281 | |
| Tissue culture flask 25 cm2 | Corning | 430639 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Tween-20 | Sigma-Aldrich | P9416 | |
| tweezer | Fine Science Tool | 11295-51 | |
| Vibrotome | Leica | VT1200S | the vibratome |
참고문헌
- Ntziachristos, V. Going deeper than microscopy: The optical imaging frontier in biology. Nature Methods. 7 (8), 603-614 (2010).
- Lavis, L. D., Bright Raines, R. T. ideas for chemical biology. ACS Chemical Biology. 3 (3), 142-155 (2008).
- Tsien, R. Y. Constructing and exploiting the fluorescent protein paintbox (Nobel Lecture). Angewandte Chemie (International Edition in English). 48 (31), 5612-5626 (2009).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annual Review of Biochemistry. 78, 993-1016 (2009).
- Sahl, S. J., Hell, S. W., Jakobs, S. Fluorescence nanoscopy in cell biology. Nature Reviews Molecular Cell Biology. 18 (11), 685-701 (2017).
- Wassie, A. T., Zhao, Y., Boyden, E. S. Expansion microscopy: Principles and uses in biological research. Nature Methods. 16 (1), 33-41 (2019).
- Chen, F., Tillberg, P. W., Boyden, E. S. Expansion microscopy. Science. 347 (6221), 543-548 (2015).
- Gambarotto, D., et al. Imaging cellular ultrastructures using expansion microscopy (U-ExM). Nature Methods. 16 (1), 71-74 (2019).
- Demchenko, A. P. Photobleaching of organic fluorophores: Quantitative characterization, mechanisms, protection. Methods and Applications in Fluorescence. 8 (2), 022001(2020).
- Murray, E., et al. scalable proteomic imaging for high-dimensional profiling of intact systems. Cell. 163 (6), 1500-1514 (2015).
- Kim, S. -Y., et al. Stochastic electrotransport selectively enhances the transport of highly electromobile molecules. Proceedings of the National Academy of Sciences. 112 (46), 6274-6283 (2015).
- Liebmann, T., et al. Three-dimensional study of Alzheimer's disease hallmarks using the IDISCO clearing method. Cell Report. 16 (4), 1138-1152 (2016).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: Beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62 (1), 507-530 (2011).
- Saar, B. G., et al. Video-rate molecular imaging in vivo with stimulated Raman scattering. Science. 330 (6009), 1368-1370 (2010).
- Cheng, J. -X., Xie, X. S. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 350 (6264), 1054-1063 (2015).
- Ji, M., et al. Rapid, label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- Wei, M., et al. Volumetric chemical imaging by clearing-enhanced stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 116 (14), 6608-6617 (2019).
- Ji, M., et al. Label-free imaging of amyloid plaques in Alzheimer's disease with stimulated Raman scattering microscopy. Science Advances. 4 (11), 39(2018).
- Silva, W. R., Graefe, C. T., Frontiera, R. R. Toward label-free super-resolution microscopy. ACS Photonics. 3 (1), 79-86 (2016).
- Gong, L., Zheng, W., Ma, Y., Huang, Z. Higher-order coherent anti-stokes Raman scattering microscopy realizes label-free super-resolution vibrational imaging. Nature Photonics. 14 (2), 115-122 (2020).
- Watanabe, K., et al. Structured line illumination Raman microscopy. Nature Communication. 6 (1), 10095(2015).
- Qian, C., et al. Super-resolution label-free volumetric vibrational imaging. Nature Communications. 12 (1), 3648(2021).
- Lin, L. -E., Miao, K., Qian, C., Wei, L. High spatial-resolution imaging of label-free in vivo protein aggregates by VISTA. Analyst. 146 (13), 4135-4145 (2021).
- Mutlu, A. S., Chen, T., Deng, D., Wang, M. C. Label-free imaging of lipid storage dynamics in Caenorhabditis elegans using stimulated Raman scattering microscopy. Journal of Visualized Experiments. (171), e61870(2021).
- Ounkomol, C., Seshamani, S., Maleckar, M. M., Collman, F., Johnson, G. R. Label-free prediction of three-dimensional fluorescence images from transmitted-light microscopy. Nature Methods. 15 (11), 917-920 (2018).
- Falk, T., et al. U-Net: Deep learning for cell counting, detection, and morphometry. Nature Methods. 16 (1), 67-70 (2019).
- Yang, B., et al. Single-cell phenotyping within transparent intact tissue through whole-body clearing. Cell. 158 (4), 945-958 (2014).
- Ku, T., et al. Multiplexed and scalable super-resolution imaging of three-dimensional protein localization in size-adjustable tissues. Nature Biotechnology. 34 (9), 973-981 (2016).
- Mlodzianoski, M. J., et al. Active PSF shaping and adaptive optics enable volumetric localization microscopy through brain sections. Nature Methods. 15 (8), 583-586 (2018).
- Querol-Vilaseca, M., et al. Nanoscale structure of amyloid-β plaques in Alzheimer's disease. Scientific Reports. 9 (1), 5181(2019).
- Oakley, H., et al. Intraneuronal beta-amyloid aggregates, neurodegeneration, and neuron loss in transgenic mice with five familial Alzheimer's disease mutations: Potential factors in amyloid plaque formation. Journal of Neuroscience. 26 (40), 10129-10140 (2006).
- Bartels, T., De Schepper, S., Hong, S. Microglia modulate neurodegeneration in Alzheimer's and Parkinson's diseases. Science. 370, 66-69 (2020).
- Chen, F., et al. Nanoscale imaging of RNA with expansion microscopy. Nature Methods. 13 (8), 679-684 (2016).
- Tillberg, P. W., et al. Protein-retention expansion microscopy of cells and tissues labeled using standard fluorescent proteins and antibodies. Nature Biotechnology. 34 (9), 987-992 (2016).
- Renier, N., et al. IDISCO: A simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
- Zhuge, M., et al. Ultrasensitive vibrational imaging of retinoids by visible preresonance stimulated Raman scattering microscopy. Advanced Science. 8 (9), 2003136(2021).
- Miao, K., Wei, L. Live-cell imaging and quantification of PolyQ aggregates by stimulated Raman scattering of selective deuterium labeling. ACS Central Science. 6 (4), 478-486 (2020).
- Klimas, A., et al. Nanoscale imaging of biomolecules using molecule anchorable gel-enabled nanoscale in-situ fluorescence microscopy. Research Square. , (2021).
- Shi, L., et al. Super-resolution vibrational imaging using expansion stimulated Raman scattering microscopy. Advanced Science. , (2022).
- M'Saad, O., et al. All-optical visualization of specific molecules in the ultrastructural context of brain tissue. bioRxiv. , (2022).
- Zhao, Y., et al. Nanoscale imaging of clinical specimens using pathology-optimized expansion microscopy. Nature Biotechnology. 35 (8), 757-764 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유