Method Article
تصوير فائق الدقة خال من الملصقات يتم تمكينه عن طريق التصوير الاهتزازي للأنسجة المنتفخة والتحليل
In This Article
Summary
من خلال الجمع بين كيمياء الهيدروجيل لتوسيع العينة والفحص المجهري المشبع الكيميائي الخالي من الملصقات ، يصف البروتوكول كيفية تحقيق تصوير حجمي فائق الدقة خال من الملصقات في العينات البيولوجية. باستخدام خوارزمية إضافية لتجزئة صور التعلم الآلي ، تم الحصول على صور متعددة المكونات الخاصة بالبروتين في الأنسجة بدون وضع علامات على الأجسام المضادة.
Abstract
إن الاستخدام الشامل للفحص المجهري الفلوري ، وخاصة الفحص المجهري فائق الدقة ، قد أدى إلى تطوير المعرفة حول علم الأحياء الحديث بشكل كبير. على العكس من ذلك ، فإن متطلبات وضع العلامات على الفلوروفور في تقنيات الفلورسنت تشكل تحديات كبيرة ، مثل التبييض الضوئي ووضع العلامات غير المنتظمة لمجسات الفلورسنت ومعالجة العينات لفترات طويلة. في هذا البروتوكول ، يتم تقديم إجراءات العمل التفصيلية للتصوير الاهتزازي للأنسجة المنتفخة وتحليلها (VISTA). يتحايل VISTA على العقبات المرتبطة بالفلوروفورات ويحقق تصويرا حجميا فائق الدقة خال من الملصقات في العينات البيولوجية بدقة مكانية تصل إلى 78 نانومتر. يتم إنشاء الإجراء عن طريق تضمين الخلايا والأنسجة في الهيدروجيل ، وتوسيع عينة الهيدروجيل الهجينة بشكل متناحي الخواص ، وتصور توزيعات البروتين الذاتية عن طريق التصوير الاهتزازي باستخدام الفحص المجهري المتناثر رامان المحفز. يتم توضيح هذه الطريقة على كل من الخلايا وأنسجة دماغ الفئران. لوحظت صور VISTA والتألق المناعي عالية الارتباط ، مما يثبت صحة أصل البروتين لخصائص التصوير. لاستغلال هذا الارتباط ، تم تدريب خوارزمية تجزئة الصور القائمة على التعلم الآلي لتحقيق تنبؤ متعدد المكونات للنوى والأوعية الدموية والخلايا العصبية والتشعبات من صور دماغ الفأر الخالية من الملصقات. تم تكييف الإجراء بشكل أكبر للتحقيق في مجاميع بولي الجلوتامين المرضية (polyQ) في الخلايا ولويحات الأميلويد بيتا (Aβ) في أنسجة المخ ذات الإنتاجية العالية ، مما يبرر إمكاناتها للعينات السريرية واسعة النطاق.
Introduction
أحدث تطور طرق التصوير البصري ثورة في فهم علم الأحياء الحديث لأنها توفر معلومات مكانية وزمانية غير مسبوقة للأهداف عبر مقاييس مختلفة ، من البروتينات تحت الخلوية إلى الأعضاء الكاملة1. من بينها ، يعد الفحص المجهري الفلوري هو الأكثر رسوخا ، مع مجموعة كبيرة من الأصباغ العضوية ذات معاملات الانقراض العالية والعوائد الكمومية2 ، وبروتينات الفلورسنت المشفرة وراثيا سهلة الاستخدام3 ، وطرق فائقة الدقة مثل STED و PALM و STORM لتصوير الهياكل ذات الحجم النانومي4،5. بالإضافة إلى ذلك ، فإن التطورات الحديثة في هندسة العينات وكيمياء الحفظ ، والتي توسع العينات المضمنة في هيدروجيل البوليمرالقابل للانتفاخ 6،7،8 ، تمكن من دقة محدودة الحيود الفرعي على المجاهر الفلورية التقليدية. على سبيل المثال ، يعمل الفحص المجهري التمدد النموذجي (ExM) على تحسين دقة الصورة بشكل فعال بمقدار أربع مرات مع توسيع العينة التماثلي أربعةأضعاف 7.
على الرغم من مزاياه ، يشترك المجهر الفلوري فائق الدقة في القيود التي تنشأ من وضع العلامات على الفلوروفور. أولا ، يؤدي التبييض الضوئي وتعطيل الفلوروفورات إلى الإضرار بالقدرة على تقييمات التألق المتكررة والكمية. يعد التبييض الضوئي حدثا لا مفر منه عندما يستمر الضوء في ضخ الإلكترونات في حالات إثارةإلكترونية 9. ثانيا ، إن وضع العلامات على الفلوروفورات بالأهداف المرغوبة ليس دائما مهمة مباشرة. على سبيل المثال ، يتطلب التلوين المناعي عملية تحضير عينة طويلة وشاقة ويعيق إنتاجية التصوير10. يمكن أن يقدم أيضا القطع الأثرية بسبب وضع العلامات غير المتجانسة على الأجسام المضادة ، خاصة في أعماق الأنسجة11. علاوة على ذلك ، قد تكون استراتيجيات وضع العلامات المناسبة التي تستهدف الفلوروفورات للبروتينات المرغوبة متخلفة. على سبيل المثال ، كانت هناك حاجة إلى فحوصات مكثفة للعثور على أجسام مضادة فعالة لويحات Aβ12. غالبا ما يكون للأصباغ العضوية الأصغر ، مثل الكونغو الأحمر ، خصوصية محدودة ، مما يؤدي فقط إلى تلطيخ لب لوحة Aβ. لذلك ، من المستحسن للغاية تطوير طريقة فائقة الدقة خالية من الملصقات تتحايل على عيوب وضع العلامات بالفلوروفور وتوفر صورا تكميليا عالي الدقة من الخلايا إلى الأنسجة ، وحتى العينات البشرية واسعة النطاق.
يوفر الفحص المجهري رامان تباينا خاليا من الملصقات للهياكل الخاصة بالمواد الكيميائية ويحدد توزيع الروابط الكيميائية غير المرئية من خلال النظر إلى التحولات الاهتزازيةالمتحمسة 13. على وجه الخصوص ، ثبت أن تصوير تشتت رامان المحفز (SRS) على عينات خالية من الملصقات أو ذات العلامات الصغيرة لها سرعة ودقة مماثلة للفحص المجهري الفلوري14،15. على سبيل المثال ، تم تمييز منطقة الدماغ السليمة بسهولة عن المنطقة التي تتسلل إلى الورم في أنسجة الإنسان والفأر16،17. تم أيضا تصوير لويحات Aβ بوضوح من خلال استهداف اهتزاز البروتين CH3 (2940 سم −1) والأميد الأول (1660 سم −1) على شريحة دماغ مجمدة حديثا دون أي وضع علامات18. لذلك ، يوفر تشتت رامان تباينا قويا خاليا من الملصقات يتغلب على قيود الفلوروفور. أصبح السؤال بعد ذلك كيف يمكن للمرء تحقيق قدرة فائقة الدقة باستخدام تشتت رامان ، والذي يمكن أن يكشف عن التفاصيل الهيكلية النانوية والآثار الوظيفية في العينات البيولوجية.
على الرغم من بذل جهود مكثفة لتحقيق دقة فائقة لفحص رامان المجهري باستخدام أجهزة بصرية أنيقة ، إلا أن تحسين الدقة على العينات البيولوجية كان محدودا إلى حد ما19،20،21. هنا ، بناء على الأعمال الحديثة22،23 ، نقدم بروتوكولا يجمع بين استراتيجية توسيع العينة وتشتت رامان المحفز للتصوير الاهتزازي الخالي من الملصقات فائق الدقة ، المسمى التصوير الاهتزازي للأنسجة المنتفخة والتحليل (VISTA). أولا ، تم تضمين الخلايا والأنسجة في مصفوفات الهيدروجيل من خلال بروتوكول تهجين بروتين هيدروجيل محسن. ثم تم تحضين أنسجة الهيدروجيل الهجينة في محاليل غنية بالمنظفات لإزالة الدهون ، تليها التوسع في الماء. ثم تم تصوير العينات الموسعة بواسطة مجهر SRS عادي من خلال استهداف اهتزازات CH3 من البروتينات الداخلية المحتجزة. يتجاوز VISTA ، نظرا لميزة التصوير الخالية من الملصقات ، التبييض الضوئي ووضع العلامات غير المتجانسة الناشئة عن وضع العلامات على الفلوروفور ، مع إنتاجية معالجة عينات أعلى بكثير. هذا أيضا أول تصوير أقل من 100 نانومتر (حتى 78 نانومتر) تم الإبلاغ عنه. لا يلزم وجود أجهزة بصرية إضافية إلى جانب إعداد SRSالنموذجي 22،24 ، مما يجعلها قابلة للتطبيق بسهولة. باستخدام صور VISTA المترابطة والتألق المناعي ، تم تدريب خوارزمية تجزئة صور التعلم الآلي25،26 لإنشاء صور متعددة الإرسال الخاصة بالبروتين من الصور أحادية القناة. تم تطبيق الطريقة أيضا للتحقيق في لويحات Aβ في أنسجة دماغ الفئران ، مما يوفر صورة شاملة مناسبة للتنميط الظاهري الفرعي بناء على المناظر الدقيقة لنواة البلاك والخيوط الطرفية المحاطة بنوي الخلايا والأوعية الدموية.
Protocol
تمت الموافقة على جميع الإجراءات الحيوانية التي تم إجراؤها في هذه الدراسة من قبل لجنة رعاية واستخدام المؤسسي في معهد كاليفورنيا للتكنولوجيا (IACUC) ، وامتثلت إجراءات البروتوكول لجميع اللوائح الأخلاقية ذات الصلة.
1. تحضير حلول المخزون للتثبيت وتوسيع العينة
- قم بإعداد 40 مل من محلول التثبيت عن طريق إذابة 12 جم من مادة الأكريلاميد (30٪ وزن / حجم) صلب في 26 مل من الماء الخالي من النوكلياز. ثم أضف 10 مل من محلول مخزون PFA بنسبة 16٪ إلى الخليط. أخيرا ، أضف 4 مل من محلول ملحي مخزن بالفوسفات 10x (PBS ، درجة الحموضة 7.4). يمكن تخزين المحلول المحضر عند 4 درجات مئوية لمدة تصل إلى أسبوعين.
ملاحظة: مادة الأكريلاميد خطرة ، لذا يجب أن تتم خطوة إذابة مادة الأكريلاميد الصلبة في الماء في غطاء الدخان. - تحضير محلول التبلور (المخزون X) عن طريق إذابة 70 مجم من أكريلات الصوديوم (7٪ وزن / حجم) ، و 200 مجم من أكريل أميد (20٪ وزن / حجم) ، و 50 ميكرولتر من N ، N′-methylenebisacrylamide (0.1٪ وزن / حجم) في 420 ميكرولتر من الماء عالي النقاء. أضف 57 ميكرولتر من 10x PBS المعقم (الرقم الهيدروجيني 7.4) في النهاية وقم بتخزين هذا المحلول عند -20 درجة مئوية لمدة تصل إلى أسبوع واحد.
ملاحظة: تجنب صلبة أكريلات الصوديوم التي تشكل كتل. تأكد من أن أكريلات الصوديوم المستخدمة على شكل مساحيق مشتتة. سيكون المخزون X المصنوع سائلا عديم اللون. إذا كان السائل يبدو أصفر فاتح ، احصل على أكريلات الصوديوم الجديد. - تحضير محلول بادئ البلمرة عن طريق إذابة 1 جم من بيرسلفات الأمونيوم (APS ، 10٪ وزن / وزن) في 9 مل من الماء الخالي من النوكلياز. وبالمثل ، قم بإعداد محلول تسريع البلمرة عن طريق إذابة 1 جم من رباعي ميثيل إيثيلين ديامين (TEMED ، 10٪ وزن / وزن) في 9 مل من الماء الخالي من النوكلياز. اقتبس المحاليل الناتجة وتخزينها في درجة حرارة -20 درجة مئوية.
- قم بإعداد 50 مل من المخزن المؤقت لتغيير الطبيعة عن طريق إذابة 2.88 جم من كبريتات دوديسيل الصوديوم (SDS ، 200 مل) ، و 0.584 جم من كلوريد الصوديوم (200 مل) ، و 2.5 مل من 1M Tris-HCl المؤقت (50 ملي مولار ، درجة الحموضة 8) في الماء الخالي من النوكلياز.
ملاحظة: تركيز SDS قريب من حالة التشبع. بعض التبلور في المخزن المؤقت أمر طبيعي. يمكن أن يؤدي تسخينه الطفيف حتى 37 درجة مئوية إلى جعل المحلول واضحا وجاهزا للاستخدام.
2. تحضير عينات خلايا الثدييات
- قم بزراعة 3.5 × 104 خلايا HeLa على غطاء بورسليكات 12 مم (# 1.5) في صفيحة 24 بئرا ثم قم بزراعة الخلايا في 400 ميكرولتر من Dulbecco's Modified Eagle Medium (DMEM) مع 10٪ مصل بقري جنيني و 1٪ مضادات حيوية البنسلين والستربتومايسين (DMEM كامل) تحت جو مرطب مع 5٪ ثاني أكسيد الكربون2 عند 37 درجة مئوية.
- للحصول على خلايا في مراحل انقسامية مختلفة ، احتضان الخلايا في DMEM كامل حتى التقاء 60٪. بعد ذلك ، عالج الخلايا باستخدام DMEM بدون مصل بقري الجنين لمدة 20 ساعة لمزامنة مراحل الخلية. بعد التزامن ، قم بتبديل الوسيط للخلايا لإكمال DMEM واحتضانه لمدة 2-6 ساعات أخرى لاستهداف المراحل المختلفة من الانقسام.
- اغسل خلايا HeLa على الغطاء باستخدام PBS معقم واحتضانها بمحلول تثبيت (4٪ PFA ، 30٪ أكريلاميد [AA] في PBS) عند 37 درجة مئوية لمدة 7-8 ساعات قبل المعالجة الإضافية.
ملاحظة: تساعد درجة حرارة التثبيت المرتفعة مع التركيز العالي من مادة الأكريلاميد على إخماد التشابك بين الجزيئات بين البروتينات أثناء عمليات التثبيت ويقال إنها تحافظ على الهياكل الفائقة التفصيليةللبروتينات 8. - بالنسبة للخلايا التي تحتوي على مجاميع polyQ ، قم بزراعة الخلايا في DMEM كامل حتى تصل إلى 70٪ -90٪ من التقاء. بعد التغيير إلى DMEM كامل جديد ، قم بنقل 1 ميكروغرام من البلازميد الذي يشفر mHtt97Q-GFP في الخلايا باستخدام عامل التعداء (التفاصيل في جدول المواد). قم بإجراء التعداء وفقا لبروتوكول الشركة المصنعة.
- بعد 24-48 ساعة من التعدي ، قم بإزالة وسط المزرعة وأضف 800 ميكرولتر من محلول التثبيت (4٪ PFA ، 30٪ AA) إلى الغطاء مع الخلايا. احتضان الغطاء عند 37 درجة مئوية لمدة 6-8 ساعات. اغسل الغطاء باستخدام PBS 3x ، وتكون عينات الخلايا الناتجة جاهزة لمزيد من المعالجة.
3. تحضير عينات دماغ الفئران
- قم بشراء الفئران C57BL / 6J (من 6 إلى 8 أسابيع ، ذكور وإناث ، ستة فئران) وفئران الزهايمر (بعمر 9 أشهر ، أنثى ، ثلاثة فئران) من مصادر تجارية (التفاصيل في جدول المواد). إجراء القتل الرحيم عن طريق تخدير ثاني أكسيد الكربون وفقا للبروتوكولالقياسي 27. باختصار ، ضع الفئران في غرفة واملأ الغرفة بتدفق 100٪ من ثاني أكسيد الكربون2 في حدود 30٪ -70٪ من حجم الغرفة / دقيقة وحافظ على التدفق لمدة دقيقة واحدة على الأقل بعد الموت السريري.
- بعد التأكد من القتل الرحيم الإنساني ، قم بقطع رأس الفئران بسرعة باستخدام مقص. كشف الجمجمة بشق كبير عبر الجلد أسفل خط الوسط. اسحب الجلد باتجاه أنف لكشف الجمجمة بالكامل.
- اقطع الجمجمة على طول خط الوسط بمقص ناعم وقشر نصفي الجمجمة بعيدا إلى الجانب. استخدم الملقط لإخراج الدماغ في طبق بتري على الثلج باستخدام PBS. اغسل دماغ الفأر الطازج باستخدام PBS المثلج وانقل الدماغ إلى 10 مل من المخزن المؤقت للتثبيت (4٪ PFA ، 30٪ AA).
- احتضان دماغ الفأر في مخزن مؤقت للتثبيت عند 4 درجات مئوية لمدة 24-48 ساعة ثم انقله إلى 37 درجة مئوية بين عشية وضحاها. بعد غسله باستخدام PBS معقم ، قم بتقطيع دماغ الفأر إلى أقسام 150 ميكرومتر باستخدام اهتزاز وتخزينه في PBS عند 4 درجات مئوية.
4. تضمين الهيدروجيل ، وتمسخ ، وتوسيع عينات الخلايا والأنسجة
- تأكد من احتضان العينات في مخزن التثبيت المؤقت للفترة الزمنية المطلوبة ، كما هو موضح أعلاه. قم بإذابة حلول مخزون X ، وبادئ الجذور الحرة ، ومسرع المخزون واحتفظ بها على الجليد أثناء العملية برمتها.
ملاحظة: يمكن أن يتسبب وقت الحضانة غير الكافي في انخفاض عدد البروتينات المحتجزة على هجين الهيدروجيل ، وبالتالي يتسبب في انخفاض الإشارة. - التقط الغطاء بالخلايا وضعه على شريحة زجاجية باستخدام ملاقط. اختر شرائح الدماغ (بسمك 150 ميكرومتر) وضعها على شريحة زجاجية أخرى باستخدام فرشاة رسم من الصوف الناعم ، مع التأكد من أنها مسطحة. تخلص من السوائل الزائدة التي تأتي مع العينات.
- قم بتكديس اثنين من الغطاء (# 1.5) ، عن طريق إضافة قطرات من الماء بينهما ، على جانبي العينة على الشريحة الزجاجية لعمل غرفة التبلور. ضع الشريحة الزجاجية بحيث تكون العينة متجهة لأعلى على كتلة حرارية مثلجة وقم بتبريدها إلى 4 درجات مئوية لمدة دقيقة واحدة.
- أضف 10٪ (وزن / وزن) TEMED إلى المخزون X ثم 10٪ محلول APS. دوامة بسرعة ، وفي غضون دقيقة واحدة بعد الخلط ، قم بإسقاط المحلول الناتج ببطء في الغرفة على العينات لتغطية سطح العينة ، وتجنب فقاعات الهواء. احتفظ بالمحلول والعينات على الثلج (أو كتلة حرارية مثلجة) لتجنب تكوين الهلام (درجة عالية من البلمرة) قبل إضافتها إلى العينة.
- بمجرد غمر العينة بالكامل في المحلول ، ضع غطاء مسطح وشفاف ومغطى بالفيلم أعلى العينة كغطاء للغرفة. اترك الغرفة على الثلج أو كتلة حرارية مثلجة لمدة 1 دقيقة أخرى قبل احتضانها في حاضنة ترطيب عند 37 درجة مئوية لمدة 30 دقيقة.
- أخرج حجرة التبلور على الشريحة الزجاجية من الحاضنة 37 درجة مئوية. يجب ملاحظة هلام غير شفاف بعد إزالة الغطاء. استرجع الجل عن طريق القطع بشفرة حلاقة أو ، بدلا من ذلك ، ضع الشريحة الزجاجية في عازلة تغيير الطبيعة في درجة حرارة الغرفة لمدة 15 دقيقة. سوف يفصل الجل نفسه عن الشريحة الزجاجية.
- احتضان الجل المعزول في المخزن المؤقت لتغيير الطبيعة تحت ظروف الحرارة لتحقيق المزيد من التمسخ وإزالة الشحوم. بالنسبة لعينات الخلايا ، قم بتغيير طبيعة طبيعتها عند 95 درجة مئوية لمدة 1 ساعة. بالنسبة لشرائح الدماغ التي يبلغ سمكها 150 ميكرومتر ، تشوه عند 70 درجة مئوية لمدة 3 ساعات ، متبوعة ب 95 درجة مئوية لمدة ساعة واحدة.
ملاحظة: يمكن أن يصبح الجل مجعدا عند تحضينه لأول مرة مع مخزن مؤقت لتغيير الطبيعة في درجة حرارة الغرفة. إنه أمر طبيعي وسيصبح مسطحا بعد تمسخ درجة الحرارة العالية. عند العمل مع عينات من الأنسجة السميكة ، هناك حاجة إلى وقت تمسخ أطول. - بعد المعالجة الحرارية ، اغسل العينة المشوهة 3x باستخدام PBS لمدة 10 دقائق. في هذه المرحلة ، يجب أن يتوسع الجل إلى حوالي 1.5 ضعف الحجم الأصلي. احتضن الجل المغسول بالماء فائق النقاء في وعاء كبير (20 ضعف حجم الجل على الأقل) لتحقيق نسبة تمدد أعلى. قم بتغيير الماء كل 1 ساعة و 3x واترك العينة في الظلام طوال الليل. الجل الناتج جاهز للتصوير.
ملاحظة: تعتمد نسبة التمدد إلى حد كبير على الخواص الميكانيكية للعينة الأصلية. تم الحصول على توسع 4.2 مرة لعينات الخلايا و 3.4 مرة تمدد لعينة أنسجة المخ.
5. تصوير خال من الملصقات لتوزيع البروتين الداخلي في عينات الخلايا والأنسجة الموسعة
- احتفظ بعينات الجل الموسعة في الماء أثناء عملية التصوير. الجل هش بعد التمدد لذا يجب التعامل معه بحذر. ضع الجل الموسع الحامل للعينة على شريحة مجهرية (بسمك 1 مم) باستخدام فاصل مجهر بأحجام وأعماق فتح مناسبة مملوءة بالماء. قم بتغطية الفاصل بغطاء (# 1.5) وتأكد من إغلاقه بشكل صحيح لتجنب حركة العينة.
- ضع العينة مع الخلية أو الأنسجة الموسعة على المرحلة الآلية بحيث يكون الغطاء مواجها للهدف. انقر فوق Ocular على البرنامج لتغيير مسار الضوء إلى مجال ساطع وضبط موضع z باستخدام مقبض يدوي.
- أضف زيت الغاطس في الجزء العلوي من العينة واضبط المكثف على الموضع الصحيح لإضاءة Köhler أثناء المشاهدة تحت المجال الساطع بتكبير 25x من الهدف. أدخل 791.3 نانومتر في نافذة الطول الموجي OPO على لوحة الليزر لاستهداف اهتزاز البروتين CH3 عند 2940 سم −1.
- قم بتبديل ضوء المجهر من المجال الساطع (قطعة العين) إلى وضع المسح بالليزر بالنقر فوق الزر LSM وافتح غالق الليزر SRS عن طريق الضغط على زر الغالق على لوحة التحكم بالليزر. اضغط على الزر LIVE في برنامج المجهر لبدء الحصول على الصور في الوقت الفعلي.
- ابحث عن التركيز البؤري المناسب عن طريق تغيير z أثناء النظر إلى صورة SRS في ظل وقت سكون قصير للبكسل (12.5 ميكرو ثانية/بكسل) ودقة صورة منخفضة (256 بكسل × 256 بكسل). بمجرد العثور على موضع z المثالي ، قم بتغيير حجم المسح ووقت السكون بالبكسل عن طريق سحب الشريط المعني في برنامج المجهر.
- احصل على الصورة عن طريق الضغط على زر LSM باستخدام حالة أخذ العينات الفائقة (1024 بكسل × 1024 بكسل) مع وقت مكوث أطول للبكسل (80 ميكرو ثانية/بكسل) يطابق ثابت الوقت لمكبر الصوت القفل. احصل على صور حجمية عن طريق جمع مكدس z بحجم خطوة 1 ميكرومتر في الاتجاه z. معالجة وتحليل ملف OIR المحفوظ من البرنامج باستخدام ImageJ.
ملاحظة: تم الإبلاغ مؤخرا عن إعداد SRS التفصيلي في Mutlu et al.24. هنا ، تم توجيه ليزر بيكو ثانية قابل للضبط بمعدل تكرار 80 ميجاهرتز وعرض نطاق ترددي 2 ps للمضخة (770-990 نانومتر) و stokes (1031.2 نانومتر) إلى مجهر متحد البؤر للمسح بالليزر (مفصل في جدول المواد). تحسين التداخل الزمني والمكاني للحزمتين للإشارات ذات D2O النقي. يتطلب الأمر بعض الجهد للعثور على z الصحيح للعينة الموسعة تحت المجال الساطع لأن معامل الانكسار متجانس جدا في جميع أنحاء الجل. - حدد دقة VISTA عن طريق التقاط صورة SRS لخرز البوليسترين (100 نانومتر) باستخدام هدف 25x وهدف 60x. اضبط ليزر المضخة على 784.5 نانومتر ، وهو ما يتوافق مع إزاحة رامان 3050 سم −1 ، وهي سمة من سمات العطرية C-H التي تمتد اهتزازات البوليسترين.
ملاحظة: الطول الموجي لليزر المضخة المستخدم هنا مشابه للطول الموجي المستخدم في VISTA للبروتينات. - مع هدف 60x ، كان الحد الأقصى لنصف الموجة الكاملة التجريبية (FWHM ، وهو عرض شكل الخط عند نصف السعة) لصورة الخرزة 276.17 نانومتر. نمذجة وظيفة كائن الخرزة كنصف دائرة.
ملاحظة: عندما تحتوي الدالة PSF Gaussian على c (σ) = 269 نانومتر / 2.35 ، فإن صورة الخرزة الملتوية سيكون لها FWHM مقاس يبلغ 276.17 نانومتر. نتيجة لذلك ، تبلغ دقة نظام SRS 269 نانومتر × 1.22 = 328 نانومتر وفقا لمعيار رايلي. نظرا لأن VISTA لديها متوسط 4.2 مرة من التوسع في عينات الخلايا ، فإن الدقة الفعالة تنخفض إلى 328 نانومتر / 4.2 = 78 نانومتر.
6. التصوير الفلوري VISTA والفلورسنت المترابط لعينات الأنسجة الموسعة والموسعة
- بعد التمسخ ، قم باحتضان عينات الهيدروجيل المضمنة مسبقا (على سبيل المثال ، 150 ميكرومتر من القسم الإكليلي للدماغ) في 1٪ (حجم / حجم) Triton X-100 (PBST) لمدة 15 دقيقة. قم بتبديل المخزن المؤقت للحضانة إلى PBST مع الجسم المضاد الأساسي عند تخفيف 1: 100. إذا كانت هناك حاجة إلى أهداف بروتينية متعددة للتصوير المتعدد ، فقم بتخفيف الأجسام المضادة الأولية المعنية لأهداف مختلفة إلى تركيزات مناسبة في نفس الكوكتيل واحتضانها مع العينات في وقت واحد.
- احتضان المواد الهلامية بالأجسام المضادة الأولية المخففة عند 37 درجة مئوية مع رج لطيف عند 80 دورة في الدقيقة لمدة 16-18 ساعة ، متبوعا بغسيل مكثف 3x باستخدام PBST لمدة 1-2 ساعة عند 37 درجة مئوية. اقلب الجل أثناء الحضانة لمنع وضع العلامات غير المتجانسة على الأجسام المضادة هنا وفي جميع الحضانات اللاحقة.
- احتضان العينات بالأجسام المضادة الثانوية لأهداف الأنواع المقابلة عند 1: 100 تخفيفات مع PBST عند 37 درجة مئوية لمدة 12-16 ساعة ، محمية من الضوء. اغسل عينات الهيدروجيل المسمى 3x باستخدام PBST لمدة 1-2 ساعة عند 37 درجة مئوية مع اهتزاز لطيف.
- تخفيف DAPI إلى تركيز نهائي 3 ميكرومتر في PBS. أضف حجما كافيا من محلول DAPI إلى عينة الهيدروجيل بحيث يتم غمر الجل في المحلول. احتضن لمدة 1-2 ساعة في درجة حرارة الغرفة مع رج لطيف عند 80 دورة في الدقيقة. اغسل العينة 3x باستخدام PBS.
- قم بتوسيع عينات الجل ذات العلامات المناعية عن طريق احتضانها بكمية كبيرة من H2O منزوع الأيونات المزدوج ، قم بتغيير الماء كل 1 ساعة و 3x واحتضان العينات في H2O طوال الليل ، محمية من الضوء. أثناء وضع العلامات ، يجب أن يتمدد الجل 1.5 مرة مقارنة بالمخزن المؤقت PBS.
- قم بإعداد عينة التصوير كما هو موضح في الخطوة 5.1. ضع عينة التصوير على المجهر متحد البؤر للمسح الضوئي بالليزر باستخدام هدف الغمر في الماء 25x ، 1.05 NA للتصوير الفلوري.
- حدد القناة المناسبة باستخدام ليزر الإثارة المعني (405 نانومتر و 488 نانومتر و 561 نانومتر و 640 نانومتر) وزوج PMT وفقا للأجسام المضادة المستهدفة في القائمة المنسدلة على برنامج المجهر. اضغط على الزر LIVE للحصول على الصور في الوقت الفعلي.
- اضبط موضع التركيز البؤري بواسطة مقبض يدوي بناء على إشارة التألق في الوقت الفعلي. قم بتحسين طاقة الليزر ووقت سكون البكسل واكتساب PMT في برنامج المجهر وفقا لإشارة التألق في الوقت الفعلي لتجنب الإشارة الخافتة أو التشبع الزائد.
ملاحظة: قم بتقييم المظهر والميزات بناء على الهياكل المبلغ عنها للأجسام المضادة المختلفة للتخلص من التفاعلات المتبادلة المحتملة للأجسام المضادة وتجنب الحديث المتبادل بين قنوات التألق المختلفة. - اضغط على زر LSM لبدء الحصول على صور SRS وفلورسنت مترابطة. أولا ، اجمع صور التألق الحجمي على عينات تحمل علامة مناعية. بمجرد الانتهاء من التصوير الفلوري ، قم بتبديل مسار ضوء المجهر إلى حالة الأشعة تحت الحمراء (IR) الشفافة.
- قم بتغيير قناة الكشف من PMT الفلوري إلى SRS على برنامج المجهر. افتح الغالق الخاص بليزر SRS وقم بإجراء التصوير الحجمي SRS في مجال رؤية نفس العينة بنفس نطاق z. يتراوح النطاق الطبيعي بين 100-200 ميكرومتر ويمكن أن يصل إلى 700 ميكرومتر.
ملاحظة: هناك انحراف لوني طفيف يتسبب في حدوث تحول في موضع z بين الصور الفلورية وصور SRS بسبب اختلاف الطول الموجي في ليزر الإثارة. هناك حاجة إلى مقارنة يدوية جنبا إلى جنب بين صور SRS و z-stack الفلورية. ابحث عن ميزات المطابقة الدقيقة من كل من SRS وقناة التألق لمطابقة موضع z بدقة.
7. بناء وتدريب والتحقق من صحة بنية U-Net
ملاحظة: يوصى بالتثبيت على Linux. مطلوب بطاقة رسومات بسعة >10 جيجابايت من ذاكرة الوصول العشوائي.
- إعداد البيئة
- قم بتثبيت Anaconda أو Miniconda على 3-5.3.0-linux-x86_64. استنساخ الملفات التالية أو تنزيلها: https://github.com/Li-En-Good/VISTA. إنشاء بيئة Conda للنظام الأساسي باستخدام سطر الأوامر التالي:
conda env create -f environment.yml
- قم بتثبيت Anaconda أو Miniconda على 3-5.3.0-linux-x86_64. استنساخ الملفات التالية أو تنزيلها: https://github.com/Li-En-Good/VISTA. إنشاء بيئة Conda للنظام الأساسي باستخدام سطر الأوامر التالي:
- تدريب نموذج التنبؤ
- قم بإقران أدلة صور SRS المقابلة مع صور الحقيقة الأرضية في ملف csv. ضع دلائل صور SRS أسفل صور الحقيقة path_signal والأرضية تحت path_target الأعمدة.
- ضع ملف csv في المجلد data/csvs. قم بتعديل التكوين في البرامج النصية / train_model_2d.sh إذا لزم الأمر. تنشيط البيئة باستخدام سطر الأوامر:
Conda تنشيط FNET - ابدأ تدريب النموذج باستخدام سطر الأوامر:
./scripts/train_model_2d.sh <اسم الملف لملف CSV> 0
سيبدأ التدريب بعد ذلك. سيتم عرض الخسائر لكل تكرار في سطر الأوامر وحفظها مع النموذج في المجلد save_models / اسم الملف <لملف csv>.
- تحقق من صحة الصور في مجموعة التدريب ومجموعة الاختبار باستخدام سطر الأوامر:
./scripts/train_model_2d.sh <اسم الملف لملف CSV> 0
سيتم حفظ نتائج التنبؤ في نتائج المجلد / اسم الملف < لملف csv>.
8. VISTA جنبا إلى جنب مع تنبؤات U-Net لتعدد الإرسال الخاص بالبروتين في الصور الخالية من الملصقات
- قم بتعديل ملف csv في اسم ملف data/csvs/< لملف csv>/test.csv. استبدل دلائل كل من path_signal و path_target بدليل صور SRS الجديدة.
- قم بإزالة نتائج التنبؤ من التدريب ، وهو نتائج المجلد / اسم ملف < لملف csv>. قم بتشغيل التنبؤات باستخدام سطر الأوامر:
./scripts/train_model_2d.sh <اسم الملف لملف CSV> 0
سيتم حفظ نتائج التنبؤ في نتائج المجلد / اسم الملف < لملف csv > / test.
النتائج
بعد تحديد مبدأ العمل لطريقة التصوير والتحليل ، تم تسجيل الصور لتقييم نسبة التمدد وضمان التمدد المتناحي أثناء معالجة العينة (الشكل 1 أ ، ب). تم تصوير كل من العينات غير المعالجة و VISTA أثناء استهداف اهتزاز الرابطة عند 2940 سم −1 ، والذي ينشأ من CH3 من البروتينات الذاتية. في العينات غير المعالجة ، كانت الهياكل الغنية بالبروتين مثل النوى مظلمة بسبب محتوى الدهون الهائل من الأنسجة المحيطة22 (الشكل 1 أ). بعد معالجة العينة التي تتضمن معالجة إزالة الدهون ، أظهرت الصورة الناتجة نفس الميزة مع تباين معكوس (الشكل 1 ب). لم تتغير الأشكال والمواضع النسبية للنوى والأوعية الدموية تماما (الشكل 1 أ ، ب ؛ الهياكل المرقمة) ، مما يؤكد أن العلاج هو عملية متناحية. من خلال مقارنة أحجام النوى المقابلة ، تم استنتاج أن الطريقة تحقق توسعا بمقدار 3.4 مرة في عينات أنسجة المخ مقارنة بالعينات غير المعالجة22،23.
بمعرفة نسبة التمدد في أنسجة المخ ، يمكن ل VISTA الآن حل ميزات جديدة في صور SRS الخالية من الملصقات والتي لم تكن قابلة للحل في السابق. على الرغم من أن هياكل الأكتين والتوبولين كانت المعيار الذهبي لعروض التحليل الفائق ، إلا أن تحسينات الدقة على هياكل الأكتين والتوبولين قد تميزت جيدا باستراتيجيات توسيع العينة القائمة على التألق باستخدام كيمياء التهجينالمماثلة 28. علاوة على ذلك ، فإن تصوير هياكل الأكتين / التوبولين المحددة أقل جدوى باستخدام هذه التقنية لأن الإشارة تأتي من المجموعة الإجمالية للبروتينات الداخلية ، حيث لن يكون لهياكل الهيكل الخلوي مثل التوبولين تباين كاف (نسبة الإشارة إلى الخلفية) ليتم تمييزها بوضوح. ومن ثم ، قررنا متابعة تصوير الهياكل النانوية الأخرى. أظهرنا أنه يمكن التقاط الميزات من قشرة الفئران حتى 150 نانومتر (الشكل 1C ، D). بناء على الأنماط المشتتة حول التشعبات العصبية ، من المحتمل أن تكون الهياكل الصغيرة المرصودة هي رؤوس العمود الفقري الشجيرية7 ، والتي يبلغ حجمها 146 نانومتر (الشكل 1 د). بالإضافة إلى ذلك ، تم استخدام الطريقة لتصوير الهياكل الليفية في لويحات Aβ ، والتي يعتقد أن سمكها حوالي 100 نانومتر29،30. في الواقع ، تم إثبات أنه يمكن حل الهياكل الليفية ~ 130 نانومتر في لوحة Aβ منتشرة تمثيلية باستخدام هذه الطريقة (الشكل 1E ، F).
نظرا لأن VISTA يتيح الاحتفاظ الفعال بالبروتين وتصوير البروتين22 ، يمكن للمرء أن يميز بوضوح النوى الغنية بالبروتين في النوى وهياكل الهيكل الخلوي الشبيهة بالشريط في العصارة الخلوية لخلايا HeLa المستنبتة (الشكل 2 أ ، رأس السهم). تم تطبيق الطريقة أيضا لدراسة مجاميع بولي جلوتامين (polyQ) التي يتم التعبير عنها بشكل عابر في خلايا الثدييات (الشكل 2 ب ، ج). أكدت النتائج أن الركام ، كهيكل معبأ بكثافة متوقعة ، تم توسيعها بشكل متناحي الخواص من خلال مقارنة نفس الهياكل الركامية قبل وبعد التوسع عبر عينات متعددة مكررة23. تم الحصول على هياكل عالية الاستبانة غائبة / غير واضحة في صور SRS ذات الدقة العادية باستخدام هذه الطريقة. كشفت الصور المجمعة ل VISTA عن نتوءات تشبه الألياف على محيط مجاميع polyQ وهيكل مجوف في الوسط (الشكل 2 ب ، رأس السهم). قد تشير الملاحظة القائلة بأن النتوءات ترتبط بسلاسة بمحتويات العصارة الخلوية إلى أن المجاميع تتفاعل مع البروتينات الوظيفية في العصارة الخلوية. بعد فوات الأوان ، تصبح القدرة على توسيع الركام الكثيف معقولة أيضا لأن كاشف التثبيت الفورمالديهايد ومونومرات الهيدروجيل أكريل أميد وأكريلات الصوديوم كلها جزيئات صغيرة يمكن أن تنتشر داخل وخارج مجاميع البروتين. بمجرد أن يتبلمر الركام مع المونومرات في هيدروجيل ، يجب أن تستمر عملية التمدد كالمعتاد.
ثم طبقنا هذه الطريقة على أنسجة دماغ الفئران لتوسيع نطاقها بشكل أكبر. على الرغم من أن عينات الأنسجة تشكل تحديات مثل انخفاض النفاذية وزيادة السماكة والقوة الميكانيكية غير المتجانسة ، فقد تم تصوير عينات دماغ الفأر بنجاح باستخدام هذه الطريقة (الشكل 2 د). على غرار عينات الخلايا ، لوحظت الهياكل الغنية بالبروتين بما في ذلك نوى الخلايا والأوعية الدموية والعمليات العصبية (الشكل 2D ، رأس السهم). يتمثل الحد من أنسجة المخ في أنه تم تحقيق 3.4 مرة فقط من التمدد ، مما يجعل الدقة الفعالة في عينات الدماغ 99 نانومتر22. لقد تحققنا من صحة الأصل الهيكلي لإشارات SRS عن طريق صبغة مترابطة وتلوين الأجسام المضادة ، حيث تبقع DAPI للنوى وبقع الليكتين للأوعية الدموية (الشكل 2E ، F). كما تم تحديد أجسام الخلايا العصبية وعملياتها عن طريق التألق المناعي من NeuN و MAP222. باستخدام خوارزمية الشبكة العصبية التلافيفية المدربة (CNN) التي تستخدم الصور الفلورية المترابطة كحقيقة أرضية ، تم بعد ذلك تقسيم الصور أحادية القناة إلى قنوات بنية بروتينية محددة للصور المتعددة22.
أخيرا ، هدفنا إلى استجواب لويحات Aβ المرضية في أدمغة الفئران 5xFAD ، وهو نموذج حيواني معروف لمرض الزهايمر31. بعد اتباع الإجراءات ، تم الحصول على صورة SRS ثلاثية الأبعاد لترسب لويحات الأميلويد في أنسجة المخ (الشكل 2G). لوحظت النقاط ذات التركيزات العالية من البروتين (الشكل 2G ، السهم البرتقالي) ، والتي تمثل جوهر لوحة Aβ. كشفت هذه الصورة أيضا عن لويحات Aβ الطرفية (الشكل 2G ، رأس السهم الأرجواني) ، والتي غالبا ما يتم إهمالها من خلال تلطيخ الكونغو الأحمر التقليدي الذي يستهدف فقط نواة Aβ. عند دمجها مع خوارزمية التجزئة المدربة ، يمكن تحويل الصورة الخالية من الملصقات إلى صورة متعددة الإرسال محددة الهدف (الشكل 2F) ويمكن إجراؤها بالاشتراك مع التألق المناعي23 لدراسة تفاعلات البيئة المكروية بين الخلايا النجمية والبلاك والخلايا الدبقيةالصغيرة 32 بطريقة شاملة وعالية الإنتاجية.
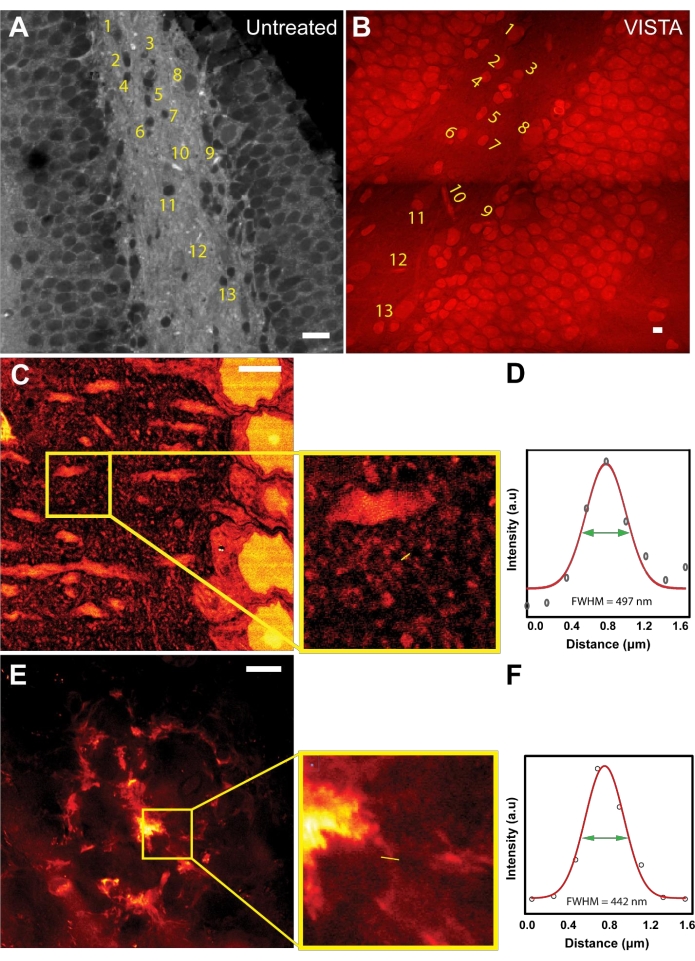
الشكل 1: تتيح استراتيجية توسيع العينة تصويرا فائق الدقة وخالي من الملصقات في أنسجة دماغ الفئران. (أ) صورة SRS بتردد CH3 لحصين الفأر. (ب) صورة VISTA في نفس مجال رؤية الحصين للفأر. تظهر المنطقة المسماة السمات المقابلة قبل العلاجات وبعدها. (ج) صورة VISTA لقشرة الفأر العادية التي تظهر ميزات أدق. يظهر Inset منطقة الاهتمام. (د) التقدير الكمي للدقة للهيكل الدقيق الذي لوحظ في العينة الموسعة. يتوافق FWHM البالغ 497 نانومتر مع دقة فعالة تبلغ 146 نانومتر مع توسع 3.4 مرة. (ه) صورة VISTA لويحة أميلويد بيتا (Aβ) في أنسجة دماغ الفئران. يظهر Inset منطقة الاهتمام الموسعة. (و) التقدير الكمي للدقة لهيكل ألياف البثق للوحة أميلويد بيتا الموسعة. يتوافق FWHM البالغ 442 نانومتر مع دقة فعالة تبلغ 130 نانومتر مع تمدد 3.4 مرة. أشرطة المقياس = 20 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
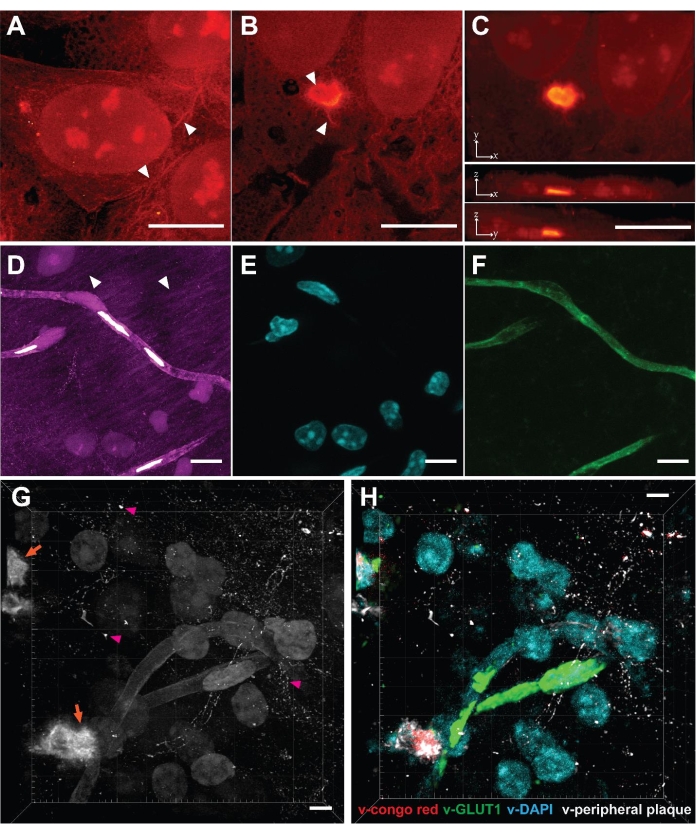
الشكل 2: التصوير الحجمي فائق الدقة الخالي من الملصقات في الخلايا والأنسجة التي تم تمكينها بواسطة VISTA. (أ) صورة حجمية لخلية HeLa طبيعية. رأس السهم: هيكل يشبه الهيكل الخلوي. (ب) صورة شريحة z واحدة لمجمع polyQ معبرا عنها في خلايا HeLa. رأس السهم: هيكل مجوف وبثق ليفي. (ج) تظهر إسقاطات الكثافة القصوى للاتجاهات xy و x-z و y-z العرض الحجمي للخلية المحتوية على الركام polyQ. (د) صورة حجمية لقسم إكليلي من دماغ الفأر. رأس السهم: العمليات العصبية. (ه) تظهر صورة التألق للنوى (تلطيخ DAPI) في نفس منطقة العينة ارتباطا من 1 إلى 1 مع النوى في صورة VISTA. (و) تظهر صورة التألق للأوعية الدموية (المضادة لليكتين) في نفس منطقة العينة ارتباطا من 1 إلى 1 بهياكل الأوعية الدموية في صورة VISTA. (ز) صورة حجمية ل Aβ (السهم البرتقالي) الذي يحتوي على أنسجة المخ. رأس السهم الوردي: لوحة Aβ الطرفية. (H) صورة تعدد الإرسال من (G)، تنبأت بها خوارزمية تجزئة الصور المدربة. يمثل V-congo red جوهر لوحة Aβ. يمثل V-GLUT1 الأوعية الدموية. يمثل v-DAPI النوى. تمثل اللويحة الطرفية على شكل حرف V لوحة Aβ غير ملطخة بصبغة الكونغو الحمراء. أشرطة المقياس = 10 ميكرومتر. مقياس الطول من حيث المسافة قبل التمدد (معدلة لنسب التمدد المختلفة). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
باختصار ، نقدم بروتوكول VITA ، وهو طريقة خالية من الملصقات لتصوير الهياكل الخلوية وتحت الخلوية الغنية بالبروتين للخلايا والأنسجة. من خلال استهداف CH3 الذاتي من البروتينات الموجودة في الخلايا والأنسجة المضمنة في الهيدروجيل ، تحقق الطريقة دقة تصوير فعالة تصل إلى 78 نانومتر في العينات البيولوجية وتحل البثق الطفيف في مجاميع والألياف هنتنغتين في لويحات Aβ. هذه التقنية هي المثيل الأول الذي يبلغ عن دقة أقل من 100 نانومتر لطرائق التصوير الخالية منالملصقات 22. بالمقارنة مع طرق التوسع الحالية6،7،8،28،33،34 ، فإن هذه التقنية ترث ميزة تصوير SRS الخالي من الملصقات ، وبالتالي فهي خالية من التبييض الضوئي أو التعطيل أو التبريد الناجم عن إضاءة الليزر. بالإضافة إلى ذلك ، كطريقة خالية من الملصقات ، فإنها تتحايل على وضع العلامات الصعبة وغير الفعالة والتي يحتمل أن تسبب القطع الأثرية والتي تشارك دائما في طرق مثل DISCO12،35 و ExM33،34 ، وبالتالي توفر تحضير عينة عالية الإنتاجية وتصويرا موحدا في جميع أنحاء الأنسجة. لمعالجة الافتقار إلى تعدد الإرسال في النهج الخالي من الملصقات ، يوفر Vista ، الذي تم تنفيذه باستخدام خوارزمية تجزئة الصور المستندة إلى CNN25 ، صورا متعددة المكونات خاصة بالبروتين دون أي ملصقات في أنسجة المخ22. تم تطبيق الطريقة بشكل أكبر على أدمغة الفئران 5xFAD ومكنت من رؤية حجمية شاملة للألياف الأساسية والمحيطية والنوى والأوعية الدموية23. نتصور أن VISTA سيتوسع بشكل جيد للعينات الأكبر مثل شرائح الرئيسيات أو الدماغ البشري ويمكن أن يكون مفيدا في النهاية للتحقيقات السريرية.
هناك ثلاث خطوات أساسية تضمن التنفيذ الناجح لهذه الطريقة. أولا ، يعد الحد الأقصى للاحتفاظ بالبروتين في عينة الهيدروجيل الهجينة أمرا بالغ الأهميةومطلوبا 22. لتحقيق هذا الهدف ، تم تعديل حالة التثبيت لاحتواء تركيز عال من مادة الأكريلاميد28 واستبدال إجراء هضم البروتين بإزالة الدهون من المنظفات عالية التركيز التي توفر فقدان البروتين بشكل كبير من هضم البروتين. تعمل إضافة AA على إخماد التشابك بين الجزيئات للبروتينات وتمكين التوسع المتناحي دون هضم البروتين28. في دراسة سابقة ، تم استخدام المونومرات الديفاتورية لإثبات أن روابط CH الأليفاتية في الهلاميات المائية من الأكريلاميد تؤدي فقط إلى خلفيةثابتة 22. ثانيا ، يجب إنشاء ارتباطات مناسبة بين SRS ووضع العلامات المناعية والفروق بين أهداف البروتين المختلفة. نظرا لأن الطريقة تعتمد على خوارزميات تجزئة الصور لإضافة تعدد الإرسال إلى صور SRS أحادية اللون ، فإن الحديث المتبادل بين أهداف البروتين المختلفة في التألق المناعي سيضر بشكل كبير بجودة الصور. اخترنا بدقة الهياكل الغنية بالبروتين الواضحة في صور SRS والتحقق من صحة ميزات التألق المناعي المقابلة لها. ثالثا ، قبل استخدام النموذج للتنبؤ بأنماط التألق من مجموعات بيانات SRS الجديدة ، يجب إثبات صحة وموثوقية نموذج التعلم الآلي المدرب. من المحتمل أن تتسبب الميزات المميزة التي لم يتم تضمينها في مجموعات التدريب في حدوث مشكلات في التنبؤ. إذا كانت نتائج التنبؤ غير مرضية ، فيجب على المستخدم محاولة تضمين المزيد من البيانات للتدريب وتجنب التنبؤ بالأنماط التي لم يتم تضمينها في مجموعات التدريب. يجب أيضا مراقبة ارتباطات بيرسون بين مجموعات الاختبار ومجموعات التحقق لضمان جودة التنبؤ22،23. يقترح أن يكون لديك ما لا يقل عن 100 مجموعة صور مقابلة للتدريب.
في حين أن هذه الطريقة لديها إمكانات هائلة للدراسات البيولوجية ، إلا أن هناك بعض القيود التي تنتظر الحلول الإبداعية. أولا وقبل كل شيء ، تحتاج الحساسية إلى مزيد من التحسين. يقع حد الكشف عن تشتت رامان المحاكي الخالي من الملصقات في نطاق المليمولار المنخفض ، كما أن التمدد التماثلي للعينات في ثلاثة أبعاد يخفف بشكل كبير من الروابط الكيميائية ويضعف الإشارة. وبالتالي ، نحن مقيدون بتصوير المجموعة الإجمالية للبروتينات الداخلية ، والتي تفتقر إلى الخصوصية وتعدد الإرسال. يمكن أن يؤدي الجمع بين VISTA و SRS36 شديد الحساسية إلى توسيع نطاق هذا لتصوير البروتينات منخفضة الوفرة ودراسة الهياكل والتركيبات الإجمالية بمستوى الدقة الفائقة من خلال استهداف الروابط الكيميائية المتعامدة37. ثانيا ، نسبة التمدد الحالية البالغة 3.4 مرة في أنسجة المخ تعطي تحسنا معتدلا في الدقة. على الرغم من أننا قمنا بالفعل بحل البثق الطفيف في لويحات Aβ التي لم يكن من الممكن تمييزها سابقا ، إلا أن الدقة العالية مرغوبة دائما. في هذه الحالة ، ستستفيد الابتكارات في كيمياء تثبيت البروتين والهيدروجيل بشكل كبير. على سبيل المثال ، يمكن أن تتيح تركيبة الجل المختلفة نسب توسع أكبر لدقة صورةأعلى 38،39،40. ستسمح الإجراءات الجديدة في معالجة العينات بتطبيقها مع عينات الأنسجة FFPE المتاحة على نطاقواسع 38،41 ، مما يجعلها أكثر ملاءمة للدراسات السريرية واسعة النطاق.
Disclosures
ويعلن أصحاب البلاغ عدم وجود مصالح متضاربة.
Acknowledgements
نحن نقدر مرفق التصوير البيولوجي في معهد كاليفورنيا للتكنولوجيا لدعم البرامج. يقر L.W. بدعم المعاهد الوطنية للصحة (جائزة المبتكر الجديد لمدير المعاهد الوطنية للصحة ، DP2 GM140919-01) ، و Amgen (جائزة Amgen للابتكار المبكر) ، وصناديق بدء التشغيل من معهد كاليفورنيا للتكنولوجيا.
Materials
| Name | Company | Catalog Number | Comments |
| 1.0 M Tris pH 8 | Sigma-Aldrich | 648314 | |
| 16% Paraformaldehyde | Electron microscopy science | 15710 | diluted to 4% in PBS |
| 25x water immersion objective | Olympus | XLPLN25XWMP2 | NA 1.05 |
| 5XFAD Mice | Mutant Mouse Resource and Research Centers and the Jackson Laboratory | B6SJL-Tg (APPSwFlLon, PSEN1*M146L*L286 V) 6799Vas/Mmjax | Alzheimer brain |
| 60x water immersion objective | Olympus | UPLSAPO60XWIR | NA 1.2 |
| Acrylamide | Sigma-Aldrich | A9099 | |
| ammonium persulfate | Sigma-Aldrich | A3678 | |
| anti-MAP2 | Cell Signaling Technology | 8707 | |
| anti-NeuN | Cell Signaling Technology | 24307 | |
| borosilicate coverslip #1.5 | Fisher Scientific | 1254581 | |
| C57BL/6J Mice | Jackson Laboratory (JAX) | 664 | Normal mice |
| D2O | Sigma-Aldrich | 151882 | for SRS calibration |
| DAPI | Thermo Fisher | D1306 | |
| DMEM | GIBCO | 10566-016 | |
| FBS | GIBCO | A4766 | |
| glass slide 3" x 1" x 1 mm | VWR | 16004-430 | |
| goat anti-chicken IgY, Alexa Fluor 647 | Invitrogen | A-21449 | |
| goat anti-mouse IgG, Alexa Fluor 647 | Invitrogen | A-21236 | |
| goat anti-rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11034 | |
| goat anti-rat IgG, Alexa Fluor 568 | Invitrogen | A-11077 | |
| Grace Bio-Labs Press-To-Seal silicone isolators | Sigma-Aldrich | GBL664108 | microscope spacer |
| Htt-97Q-GFP Plasmid | Gift from Prof. R. Kopito and Prof. F.-U.Hartl. | ||
| Laser scanning microscope | Olympus | FV3000 | laser scanning confocal microscope |
| lipofectamine 3000 | Thermo Fisher | L3000001 | transfection agent |
| Lycopersicon Esculentum Lectin DyLight®594 (lectin) | Vector Laboratories | DL-1177-1 | |
| Microscope spacer | Grace Bio-Labs | 621502 | |
| N,N′-methylenebisacrylamide (BIS) | Sigma-Aldrich | M1533 | bought as 2% solution in water |
| Nuclease free water | Thermo Fisher | 10977-015 | |
| Penicillin-Streptomycin | GIBCO | 15140-122 | |
| poly-strene beads | Sigma-Aldrich | 43302 | for resolution characterization |
| Sodium Acrylate | Sigma-Aldrich | 408220 | |
| sodium dodecyl sulfate | Sigma-Aldrich | 71725 | |
| soft-wool paint brush #3 | TANIS | 000333 | |
| SRS Laser | A.P.E | picoEmerald | 2ps pulse width |
| tetramethylethylenediamine | Sigma-Aldrich | T9281 | |
| Tissue culture flask 25 cm2 | Corning | 430639 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Tween-20 | Sigma-Aldrich | P9416 | |
| tweezer | Fine Science Tool | 11295-51 | |
| Vibrotome | Leica | VT1200S | the vibratome |
References
- Ntziachristos, V. Going deeper than microscopy: The optical imaging frontier in biology. Nature Methods. 7 (8), 603-614 (2010).
- Lavis, L. D., Bright Raines, R. T. ideas for chemical biology. ACS Chemical Biology. 3 (3), 142-155 (2008).
- Tsien, R. Y. Constructing and exploiting the fluorescent protein paintbox (Nobel Lecture). Angewandte Chemie (International Edition in English). 48 (31), 5612-5626 (2009).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annual Review of Biochemistry. 78, 993-1016 (2009).
- Sahl, S. J., Hell, S. W., Jakobs, S. Fluorescence nanoscopy in cell biology. Nature Reviews Molecular Cell Biology. 18 (11), 685-701 (2017).
- Wassie, A. T., Zhao, Y., Boyden, E. S. Expansion microscopy: Principles and uses in biological research. Nature Methods. 16 (1), 33-41 (2019).
- Chen, F., Tillberg, P. W., Boyden, E. S. Expansion microscopy. Science. 347 (6221), 543-548 (2015).
- Gambarotto, D., et al. Imaging cellular ultrastructures using expansion microscopy (U-ExM). Nature Methods. 16 (1), 71-74 (2019).
- Demchenko, A. P. Photobleaching of organic fluorophores: Quantitative characterization, mechanisms, protection. Methods and Applications in Fluorescence. 8 (2), 022001(2020).
- Murray, E., et al. scalable proteomic imaging for high-dimensional profiling of intact systems. Cell. 163 (6), 1500-1514 (2015).
- Kim, S. -Y., et al. Stochastic electrotransport selectively enhances the transport of highly electromobile molecules. Proceedings of the National Academy of Sciences. 112 (46), 6274-6283 (2015).
- Liebmann, T., et al. Three-dimensional study of Alzheimer's disease hallmarks using the IDISCO clearing method. Cell Report. 16 (4), 1138-1152 (2016).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: Beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62 (1), 507-530 (2011).
- Saar, B. G., et al. Video-rate molecular imaging in vivo with stimulated Raman scattering. Science. 330 (6009), 1368-1370 (2010).
- Cheng, J. -X., Xie, X. S. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 350 (6264), 1054-1063 (2015).
- Ji, M., et al. Rapid, label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- Wei, M., et al. Volumetric chemical imaging by clearing-enhanced stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 116 (14), 6608-6617 (2019).
- Ji, M., et al. Label-free imaging of amyloid plaques in Alzheimer's disease with stimulated Raman scattering microscopy. Science Advances. 4 (11), 39(2018).
- Silva, W. R., Graefe, C. T., Frontiera, R. R. Toward label-free super-resolution microscopy. ACS Photonics. 3 (1), 79-86 (2016).
- Gong, L., Zheng, W., Ma, Y., Huang, Z. Higher-order coherent anti-stokes Raman scattering microscopy realizes label-free super-resolution vibrational imaging. Nature Photonics. 14 (2), 115-122 (2020).
- Watanabe, K., et al. Structured line illumination Raman microscopy. Nature Communication. 6 (1), 10095(2015).
- Qian, C., et al. Super-resolution label-free volumetric vibrational imaging. Nature Communications. 12 (1), 3648(2021).
- Lin, L. -E., Miao, K., Qian, C., Wei, L. High spatial-resolution imaging of label-free in vivo protein aggregates by VISTA. Analyst. 146 (13), 4135-4145 (2021).
- Mutlu, A. S., Chen, T., Deng, D., Wang, M. C. Label-free imaging of lipid storage dynamics in Caenorhabditis elegans using stimulated Raman scattering microscopy. Journal of Visualized Experiments. (171), e61870(2021).
- Ounkomol, C., Seshamani, S., Maleckar, M. M., Collman, F., Johnson, G. R. Label-free prediction of three-dimensional fluorescence images from transmitted-light microscopy. Nature Methods. 15 (11), 917-920 (2018).
- Falk, T., et al. U-Net: Deep learning for cell counting, detection, and morphometry. Nature Methods. 16 (1), 67-70 (2019).
- Yang, B., et al. Single-cell phenotyping within transparent intact tissue through whole-body clearing. Cell. 158 (4), 945-958 (2014).
- Ku, T., et al. Multiplexed and scalable super-resolution imaging of three-dimensional protein localization in size-adjustable tissues. Nature Biotechnology. 34 (9), 973-981 (2016).
- Mlodzianoski, M. J., et al. Active PSF shaping and adaptive optics enable volumetric localization microscopy through brain sections. Nature Methods. 15 (8), 583-586 (2018).
- Querol-Vilaseca, M., et al. Nanoscale structure of amyloid-β plaques in Alzheimer's disease. Scientific Reports. 9 (1), 5181(2019).
- Oakley, H., et al. Intraneuronal beta-amyloid aggregates, neurodegeneration, and neuron loss in transgenic mice with five familial Alzheimer's disease mutations: Potential factors in amyloid plaque formation. Journal of Neuroscience. 26 (40), 10129-10140 (2006).
- Bartels, T., De Schepper, S., Hong, S. Microglia modulate neurodegeneration in Alzheimer's and Parkinson's diseases. Science. 370, 66-69 (2020).
- Chen, F., et al. Nanoscale imaging of RNA with expansion microscopy. Nature Methods. 13 (8), 679-684 (2016).
- Tillberg, P. W., et al. Protein-retention expansion microscopy of cells and tissues labeled using standard fluorescent proteins and antibodies. Nature Biotechnology. 34 (9), 987-992 (2016).
- Renier, N., et al. IDISCO: A simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2014).
- Zhuge, M., et al. Ultrasensitive vibrational imaging of retinoids by visible preresonance stimulated Raman scattering microscopy. Advanced Science. 8 (9), 2003136(2021).
- Miao, K., Wei, L. Live-cell imaging and quantification of PolyQ aggregates by stimulated Raman scattering of selective deuterium labeling. ACS Central Science. 6 (4), 478-486 (2020).
- Klimas, A., et al. Nanoscale imaging of biomolecules using molecule anchorable gel-enabled nanoscale in-situ fluorescence microscopy. Research Square. , (2021).
- Shi, L., et al. Super-resolution vibrational imaging using expansion stimulated Raman scattering microscopy. Advanced Science. , (2022).
- M'Saad, O., et al. All-optical visualization of specific molecules in the ultrastructural context of brain tissue. bioRxiv. , (2022).
- Zhao, Y., et al. Nanoscale imaging of clinical specimens using pathology-optimized expansion microscopy. Nature Biotechnology. 35 (8), 757-764 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved