Method Article
고함량 스크리닝 및 분석 응용을 위한 구상체의 대규모 생산을 위한 강력한 방법
요약
이 프로토콜은 대규모 고함량 스크리닝 및 분석에 적합한 방식으로 세 가지 유형의 구상체를 생산하는 방법을 자세히 설명합니다. 또한, 이들이 스페로이드 및 개별 세포 수준에서 어떻게 분석될 수 있는지를 보여주는 예들이 제시된다.
초록
고함량 스크리닝 (HCS) 및 고함량 분석 (HCA)은 연구자들에게 세포에서 대규모 정량적 표현형 측정을 추출 할 수있는 능력을 제공하는 기술입니다. 이 접근법은 세포 생물학에서 근본적인 사건과 적용된 사건의 광범위한 범위에 대한 우리의 이해를 깊게하는 데 강력한 것으로 입증되었습니다. 현재까지이 기술에 대한 대부분의 응용 프로그램은 단층에서 자란 세포의 사용에 의존해 왔지만 그러한 모델이 조직에서 발생하는 많은 상호 작용 및 과정을 재검토하지 않는다는 것이 점점 더 실현되고 있습니다. 이와 같이, 구상체 및 오가노이드와 같은 3차원(3D) 세포 어셈블리의 개발 및 사용에 있어서 출현이 있었다. 이러한 3D 모델은 암 생물학 및 약물 전달 연구의 맥락에서 특히 강력하지만, HCS 및 HCA에 적합한 재현 가능한 방식으로 생산 및 분석하는 것은 많은 도전 과제를 제시합니다. 여기에 상술된 프로토콜은 다세포 종양 구상체(MCTS)의 생성을 위한 방법을 설명하고, HCS 및 HCA와 양립가능한 방식으로 세 개의 상이한 세포주에 적용될 수 있음을 입증한다. 이 방법은 웰 당 수백 개의 구상체의 생산을 용이하게하며, 스크리닝 정권에서 사용될 때 웰 당 수백 개의 구조물로부터 데이터를 얻을 수 있으며 모두 동일한 방식으로 처리 할 수 있다는 특별한 이점을 제공합니다. 고분해능 형광 이미징을 위해 구상체를 처리하는 방법과 HCA가 각 스페로이드 내의 개별 세포뿐만 아니라 스페로이드 수준에서 정량적 특징을 추출하는 방법을 자세히 설명하는 예도 제공됩니다. 이 프로토콜은 세포 생물학에서 중요한 질문의 넓은 범위에 대답하기 위해 쉽게 적용될 수 있습니다.
서문
전통적으로, 세포-기반 분석은 고체 기질 상에서 성장하는 단층에서 수행되었으며, 이는 효과적으로 2차원(2D) 환경으로서 고려될 수 있다. 그러나, 2D 세포 배양 모델은 일부 맥락에서 생리학적 관련성이 결여되어 세포들 사이에서 발생하는 많은 복잡한 상호작용을 복제할 수 없다는 것이 점점 더 인식되고 있다1. 3차원(3D) 세포 배양 방법은 연구자들 사이에서 빠르게 인기를 얻고 있으며, 3D 세포 모델은 조직 환경에서 세포가 직면하는 생리적 조건을 더 잘 모방할 수 있는 높은 잠재력을 보여준다2. 사용 된 3D 셀 어셈블리에는 여러 가지 유형이 있지만 가장 일반적인 두 가지 유형은 구상체와 오가노이드입니다. 구상체는 다양한 세포주에서 성장할 수 있으며, 사용되는 세포 유형과 조립 방법에 따라 다양한 모양과 크기를 채택 할 수 있습니다3. 더욱이, 구상체는 또한 이들이 암 세포주로부터 성장할 때 다세포 종양 구상체 (MCTS)로 지칭될 수 있으며, 이들 모델은 전임상 시험관내 약물 전달 및 독성 연구에 특히 사용되는 것을 발견하였다4,5. 반면에 오가노이드는 우리 몸의 조직과 장기를보다 잘 모방하는 것을 목표로하며보다 복잡한 형태 학적 배열을 채택 할 수 있습니다. 오가노이드의 생산은 성체 줄기 세포 또는 만능 줄기 세포의 사용을 포함하며, 이는 관심있는 조직 또는 기관과 유사한 적절한 세포로 재 프로그래밍 될 수 있습니다. 그들은 주로 장기의 발달을 조사하고 질병 및 숙주 - 병원체 상호 작용을 모델링하는 데 사용됩니다6.
3D 셀 어셈블리를 생성하는 데 사용되는 다양한 방법이 있습니다. 스캐폴드-기반 방법은 세포가 부착되거나 성장할 수 있는 기질 또는 지지체를 제공한다. 이러한 스캐폴드는 다양한 형상을 가질 수 있으며 다양한 상이한 재료로 만들어질 수 있다. 가장 흔한 것은 세포외 매트릭스 (ECM) 성분과 하이드로젤이며, 이들은 세포의 자연적인 세포외 환경과 유사하도록 설계되어 생리적 상호작용을 촉진한다4,7. ECM basement 물질은 Engelbreth-Holm-Swarm 마우스 육종 종양으로부터 추출되었으며, 라미닌, IV형 콜라겐 및 펄레칸8을 포함하는 ECM 성분의 풍부한 혼합물을 함유하는 것으로 나타났다. 그러나, 그것의 유리한 구성에도 불구하고, 그것의 사용에는 두 가지 주요 과제, 즉 배치 대 배치 가변성과 10 °C8,9 이하와 그 이상의 두 가지 다른 응집체 상태를 갖는다는 것이 있습니다. 대조적으로, 하이드로젤은 그 성분 및 강성에 대하여 유연하다는 장점이 있으며, 이들은 원하는 특정 3D 셀 어셈블리에 적합하도록 맞춤화될 수 있다7,10. 스캐폴드 기반 방법은 오가노이드 성장에 필수적이지만 구상체에도 널리 사용됩니다. 세포가 자라는 표면에 부착되는 것을 방지하여 작동하는 스캐폴드가없는 방법은 일반적으로 스페로이드 어셈블리와 만 호환됩니다. 예를 들어 세포를 구상체로 응집시킬 수 있는 평평한 바닥 또는 U-바닥을 갖는 초저 부착(ULA) 플레이트 또는 스피너/회전 플라스크에서 세포의 지속적인 교반 사용10이 포함됩니다.
다양한 생물학적 사건을 연구하기 위해 3D 세포 어셈블리를 사용하는 것이 빠르게 인기를 얻고 있습니다. 그러나 그들의 문화를 위해 선택된 방법이 적절하고 다운 스트림 분석 계획과 양립 할 수 있어야합니다. 예를 들어, ULA 플레이트의 사용은 높은 일관성의 구상체를 생성한다; 그러나, 이 방법은 웰 당 단일 스페로이드의 생산으로 제한되고, 따라서 처리량을 제한한다. 3D 구조물의 형광 이미징이 계획될 때 특별한 고려가 필요하다. 조립체가 성장되는 기판 또는 플레이트는 광학적으로 호환될 필요가 있으며, 사용되었을 수 있는 임의의 스캐폴드에 의해 야기되는 광산란의 영향을 최소화하기 위해 주의를 기울여야 한다11. 이 특별한 문제는 현미경 대물 렌즈의 개구수가 증가함에 따라 더욱 심각해진다.
아마도 3D 세포 모델로 작업하기 위해 선택하는 주요 이유 중 하나는 전체 어셈블리뿐만 아니라 그 안에있는 개별 세포에 대한 체적 이미징 데이터를 추출하는 것입니다. 특히 MCTS 모델은 치료제가 외부에서 중앙 세포로 어떻게 전달되는지에 대한 우리의 이해를 심화시키는 데 매우 강력하다는 것을 증명하기 시작했습니다 (종양에서 필요하기 때문에)12, 따라서 다른 층의 개별 세포로부터 지식을 얻는 것이 필수적입니다. 개별 세포로부터 정량적 정보를 추출하는 이미징 기술은 고함량 분석(HCA)이라고 불리며 스크리닝13의 맥락에서 강력한 접근 방식입니다. 현재까지 HCA는 거의 독점적으로 단층 배양에 적용되어 왔지만,이 접근법이 광범위한 세포 기능 및 과정을 연구 할 수있게 해주는 3D 배양에 적용 할 수있는 힘을 가지고 있다는 인식이 증가하고 있습니다14. 많은 수의 3D 어셈블리를 분석하여 각 구조에서 셀 수준 데이터를 제공 할 수 있다는 분명한 이점이 있습니다. 그러나 잠재적으로 두꺼운 셀 어셈블리의 이미징과 관련된 문제 및 생성 된 대규모 데이터 세트는 극복해야합니다.
이 기사에서는 96-웰 포맷으로 MCTS를 대규모로 생산하기 위한 강력한 스캐폴드 기반 방법을 제시합니다. 이 방법은 각 웰에서 수백 개의 3D 셀 어셈블리를 쉽게 생산할 수 있습니다. 실시예는 간, 폐 및 결장의 고형 종양 모델을 나타내는 세 가지 상이한 세포 유형에 대해 제시된다. 형성되는 구상체는 다양한 크기일 수 있으며, 따라서 HCA는 특정 크기 및/또는 형태학의 구조를 선택하는데 사용된다. 이 기능은 관찰 된 모든 표현형이 다른 크기의 구상체에 걸쳐 비교 될 수 있지만 모두 동일한 웰에서 동일한 방식으로 처리 될 수 있다는 추가적인 이점을 제공합니다. 이 접근법은 고해상도 이미징과 호환되며, 중요한 것은 동일한 셀룰러 어셈블리에서 세포 수준 및 하위 세포 수준의 정량적 데이터를 모두 제공하는 것입니다. 스페로이드 생산의 이러한 방법은 웰 당 단일 스페로이드를 생성하는 방법에 비해 추가적인 이점을 가지며, 각 웰에서 생산된 많은 수의 스페로이드가 전사체 및 프로테옴 프로파일링과 같은 다른 다운스트림 분석을 위해 잠재적으로 충분한 바이오매스를 제공한다는 것이다.
프로토콜
1. 세포 배양
- 미디어 준비
- 세포주의 종류에 따라 특정 세포 배양 배지를 준비한다. 세포 유지를 위한 모든 배지에 10% 태아 소 혈청(FBS)이 포함되어 있는지 확인하십시오.
참고: 다른 세포주는 다른 배지를 사용합니다. HT-29 결장 암종 세포 (ATCC HTB-38)는 맥코이스 5A + 10% FBS에서 성장한다. HepG2 간세포암종 세포(ATCC HB-8065)는 최소 필수 배지 + 1% L-글루타민 + 10% FBS에서 성장한다. H358 기관지 폐포 암종 세포 (ATCC CRL-5807)는 RPMI 1640 배지 + 1% L-글루타민 + 10% FBS에서 성장한다. L-글루타민과 FBS를 포함하는 모든 배지는 완전한 배지로 지칭된다. 세포를 도금하여 구상체로 성장할 때, ECM 지하실 물질의 착색을 피하기 위해 10 % FBS가있는 페놀 적색이없는 배지가 필요하며, 이는 이미징 과정에서 아티팩트를 유발할 수 있습니다.
- 세포주의 종류에 따라 특정 세포 배양 배지를 준비한다. 세포 유지를 위한 모든 배지에 10% 태아 소 혈청(FBS)이 포함되어 있는지 확인하십시오.
- 계대 배양 세포
- 세포가 약 80% 합류할 때, 2mL의 트립신-EDTA(0.25% (w/v) 트립신/0.53 mM EDTA)로 간단히 세척하십시오. 트립신-EDTA를 흡인하고, 신선한 트립신-EDTA 3 mL를 첨가하고, 37°C에서 3-5분 동안 인큐베이션한다.
- 세포가 세포 배양 접시에서 분리되면 신선한 완전 배지 7 mL를 첨가하십시오.
- 세포 현탁액 1 mL를 새로운 10 cm 세포 배양 접시에 넣고 신선한 완전 배지 9 mL를 첨가하여 1:10 희석된 세포를 수득하였다.
- 세포를 5% CO2가 있는 가습된 인큐베이터에서 37°C에서 배양한다.
- 세포주에 따라 3-5일마다 세포를 계대배양한다.
2. 구상체의 생성
- ECM 지하실 재료로 96웰 플레이트를 코팅하십시오.
- ECM 지하 재료를 얼음 위에서 하룻밤 사이에 해동하십시오.
- ECM basement 물질을 -20°C로 유지된 미리 냉각된 팁을 사용하여 차가운 페놀 적색 무혈청 배지에 희석한다.
참고: ECM basement 물질의 최종 농도는 사용된 세포주에 따라 달라진다. HT-29 및 H358 세포의 경우 ECM 지하실 재료 4mg·mL-1 을 사용하십시오. HepG2 세포의 경우, 환원 성장 인자 ECM basement 물질의 4 mg·mL-1 을 사용하십시오. - ECM basement 재료/배지 용액 15μL를 96웰 이미징 플레이트에 피펫팅합니다.
참고: 대규모 스페로이드 생산의 경우, ECM 지하실 재료가 들어있는 팁과 저장소가 냉각되는 한 이 단계는 8채널 피펫과 96채널 피펫팅 헤드를 모두 사용하여 수행할 수 있습니다. - 플레이트를 4°C에서 91 x g 에서 20분 동안 원심분리한다.
- 플레이트를 37°C에서 30분 이상 인큐베이션하지 않는다.
- 계대 배양 및 세포 수
- 플레이트 인큐베이션 기간 동안, 세포를 트립신-EDTA로 인큐베이션하고, 이들을 10% FBS를 함유하는 완전한 배지에 재현탁시킨다.
- 10 μL의 세포 현탁액을 혈구계 계수 챔버에 피펫한다. 챔버의 4 사분면에있는 세포 수를 계산하십시오.
- 4개의 사분면 내의 평균 세포 수를 결정함으로써 세포 현탁액 내의 세포 수를 계산한다.
참고: 셀은 자동화된 셀 카운팅 장치를 사용하여 계산할 수도 있습니다. - 세포를 실온에서 4분 동안 135 x g 에서 원심분리한다 (RT).
- 일단 세포가 펠릿화되면, 상청액을 흡인하고, 세포를 페놀 적색이 없는 완전 배지에 재현탁시켜 mL당 1 x 106 세포의 농도를 얻는다.
- ECM 지하실 물질 코팅 플레이트에 세포를 시드
- 세포를 페놀 적색이 없는 완전 배지에 희석한다.
참고: 시딩된 세포의 밀도는 사용된 세포주에 의존한다. HT-29 및 HepG2 세포의 경우, 웰 당 3 x 104 세포가 시딩되고; H358 세포의 경우, 웰 당 4 x 104 세포가 시딩됩니다. - 세포를 웰 당 35 μL의 총 부피로 시드한다. 원형 동작으로 드롭 방향으로 추가하십시오.
참고: 대규모 스페로이드 생산의 경우 피펫팅 원형 운동을 달성할 수 있는 한 이 단계를 8채널 피펫으로 수행할 수 있습니다. - 세포를 5% CO2가 있는 가습된 인큐베이터에서 37°C에서 1시간 동안 인큐베이션한다.
- 페놀 레드-프리 완전 매질에서 ECM 기저 물질의 용액을 준비하고, 이는 웰 내의 최종 농도 2% ECM 기저 물질을 초래한다. 이를 달성하기 위해, 웰 당 23.8 μL의 페놀 적색이 없는 완전한 배지에 1.2 μL의 ECM basement 물질을 첨가하여, 웰 당 60 μL의 최종 부피를 생성한다.
- 세포를 5% CO2가 있는 가습된 인큐베이터에서 37°C에서 인큐베이션한다.
- 다음날, 배지를 100 μL의 신선한 페놀 무함유 완전 배지로 교체한다.
- 매초마다 배지를 100 μL의 신선한 페놀 적색 무함유 완전 배지로 교체하십시오.
- 세포를 페놀 적색이 없는 완전 배지에 희석한다.
3. 구상체의 면역형광염색
참고: 이 프로토콜은 Nürnberg et al., 202015에서 채택되었습니다. 이러한 적응은 주로이 프로토콜에 설명 된 구상체가 Nürnberg et al. work15 에서 사용 된 것보다 작기 때문에 더 짧은 배양 시간을 촉진한다는 사실에 근거합니다. 예를 들어, 차단 시간은 2h에서 1h로 감소합니다. 또한, 프로토콜이 스페로이드의 높은 처리량 생산을 위해 설계됨에 따라, 모든 처리 단계는 구상체가 배양되는 웰에서 수행되며, 이는 개별 스페로이드를 튜브로 옮길 필요가 없음을 의미합니다.
- 고정 및 염색에 필요한 모든 용액과 완충액을 준비하십시오.
- 물 200 mL 당 PBS 정제 1개를 첨가하여 인산완충식염수(PBS)를 제조하였다. PBS를 오토클레이브합니다.
- 파라포름알데히드(PFA)를 3.1.3-3.1.4 단계에 따라 준비한다.
- 가열된 교반기를 사용하여 PBS 400 mL를 흄 후드에서 60-70°C로 가열한다. 교반하면서 PFA 15g을 첨가한다. 일단 PFA가 용해되면, 50 μL의 1 M CaCl2 및 50 μL의 1 M MgCl2를 첨가한다.
- PBS 100 mL를 첨가하여 최종 부피를 500 mL로 만든다. NaOH를 사용하여 PFA를 pH 7.4로 평형화시킨다. PFA를 멸균 진공 필터(기공 크기 0.22 μm)를 통해 여과하고, 분취량을 -20°C에서 저장한다.
- PBS 50 mL에 글리신 3.75 g을 첨가하여 1 M 글리신 원액을 제조하였다. 4°C에서 보관한다.
- PBS 2.4 mL에 100 μL의 트리톤 X-100, 1 mL의 디메틸설폭사이드(DMSO) 및 1.5 mL의 1 M 글리신을 첨가하여 5 mL의 투과화 완충액을 제조하였다. 4°C에서 2주 이상 보관하지 마십시오.
- PBS 4.9 mL에 100 μL의 트리톤 X-100, 0.5 mL의 DMSO 및 0.05 g의 소 혈청 알부민(BSA)을 첨가하여 5 mL의 블로킹 완충액을 제조하였다. 블로킹 완충액을 1.5 mL 튜브 내로 분취하고, -20°C에서 보관한다.
- PBS 4.74 mL에 10 μL의 폴리소르베이트 20, 0.05 g의 BSA 및 250 μL의 DMSO를 첨가하여 5 mL의 항체 인큐베이션 완충액을 제조하였다. 항체 인큐베이션 완충액을 1.5 mL 튜브에 분취하고, 이를 -20°C에 보관한다.
참고: 여기에 설명된 프로토콜에서 구상체는 96웰 플레이트의 내부 60개 웰에만 조립되지만, 플레이트의 96개 웰 모두에서 준비할 수 있습니다. 내부 60 웰에서만 구상체를 준비하는 이유는 일부 높은 수치 조리개 대물 렌즈가 일부 플레이트 유형의 '스커트'로 인해 외부 웰의 전체 우물을 물리적으로 이미지 할 수 없기 때문입니다. 위의 부피는 구상체를 함유 한 60 웰의 제조에 충분합니다.
- 구상체를 고치고 침투하십시오.
- 구상체에서 배지를 조심스럽게 제거하여 ECM basement 재료 층이 방해받지 않도록하십시오.
- 구상체를 매번 3분 동안 70 μL의 PBS로 두 번 세척한다.
- 구상체를 37°C에서 1시간 동안 70 μL의 3% PFA로 고정시켰다.
- 구상체를 매번 3분 동안 70 μL의 PBS로 두 번 세척한다.
- 70 μL의 0.5 M 글리신 용액으로 37°C에서 30분 동안 켄칭한다.
- RT에서 30분 동안 70 μL의 투과화 완충액을 사용하여 구상체를 투과시킨다.
- 구상체를 매번 3분 동안 70 μL의 PBS로 두 번 세척한다.
- 구상체를 70 μL의 블로킹 완충액 중에서 37°C에서 1시간 동안 인큐베이션한다.
참고: 구상체가 고정되면 모든 후속 처리 단계는 8채널 피펫 또는 96웰 피펫팅 헤드(사용 가능한 경우)를 사용하여 수행할 수 있습니다. 이것은 이미징 전에 스페로이드 준비의 속도를 증가시킵니다.
- 일차 및 이차 항체를 이용한 면역염색 구상체
- 일차 항체를 항체 인큐베이션 완충액에서 적절한 희석액으로 희석하고 각 웰에 70 μL를 첨가한다. 구상체를 일차 항체와 함께 밤새 인큐베이션한다.
주: 희석은 사용된 특정 항체에 의존한다. 본원에 나타낸 예에서, 리소좀은 1:500의 희석을 사용하여 마우스 항-LAMP1 항체로 면역염색된다. - 다음날, 구상체를 매번 3분 동안 PBS 70 μL로 5회 세척한다.
- 2차 항체를 1:500의 희석액으로, 형광 접합된 팔로이드인을 1:500에, 및 Hoechst 33342 (1 mg mL-1 스톡으로부터)를 항체 인큐베이션 완충액에서 1:5000으로 희석하고, 각 웰에 70 μL를 첨가한다. 하룻밤 동안 배양하십시오.
주: 항체 희석은 사용된 특정 항체에 의존한다. 높은 광안정성과 높은 밝기를 보여주는 고도로 교차 흡착된 이차 항체를 권장합니다. - 다음날, 구상체를 매번 3분 동안 PBS 70 μL로 5회 세척한다.
참고: 플레이트는 구상체가 PBS로 덮여 있는 한 이미징 전에 RT에서 최대 두 주 동안 보관할 수 있습니다.
- 일차 항체를 항체 인큐베이션 완충액에서 적절한 희석액으로 희석하고 각 웰에 70 μL를 첨가한다. 구상체를 일차 항체와 함께 밤새 인큐베이션한다.
4. 구상체의 이미지 수집 및 분석
- 이미지 수집
- 구상체가 들어있는 96-웰 플레이트를 공초점 고함량 스크리닝 현미경에 삽입하십시오.
- 사용 된 형광단을 자극하기 위해 적절한 레이저를 선택하십시오.
- 크로스 토크를 피하기 위해 채널을 순차적으로 획득하십시오.
- 적절한 목표를 사용하여 구상체를 이미지화하십시오.
참고: 가능한 경우 침수 목표를 사용하는 것이 좋습니다. 예를 들어, 20x/1.0 NA 목표는 ~77개의 시야각에서 전체 우물을 이미지화할 수 있습니다. 63x/1.15 NA 목표는 약 826개의 시야각으로 우물 전체를 이미지화할 수 있습니다. - 이미지는 구상체의 깊이에 따라 ~ 30-40 개의 슬라이스를 이미지화하고, 각 슬라이스는 앞의 슬라이스에서 1.5 μm 간격으로 촬영됩니다.
- 이미지 분석
- 구상체의 형태학적 분석을 위해서는 4.2.2-4.2.6단계를 따르십시오.
- 형광 컨쥬게이션된 팔로이드 염색에 기초하여 구상체를 분절한다.
- Hoechst 33342 염색에 기초하여 핵을 분절한다.
- 세포질에 존재하는 잔류 Hoechst 33342 염색에 의해 각 세포의 세포질을 분절한다.
- 부피, 표면적, 구형도 및 구상체 당 핵 수를 포함하여 구상체의 다양한 형태 학적 특성을 계산하십시오.
참고: 이 정보는 선택한 이미지 분석 소프트웨어에 내장된 다양한 알고리즘을 사용하여 추출됩니다. - 이미지를 추가로 처리하여 75,000 μm3 보다 작고 900,000 μm3보다 큰 구상체를 제거합니다.
참고: 이 값은 여러 구상체의 융합으로 인해 발생할 수 있는 매우 작은 셀 어셈블리 및 대형 어셈블리를 제거할 수 있도록 하기 위한 제안입니다. 스페로이드는 이 단계에서 다른 크기 클래스로 분류할 수도 있습니다. - 구상체 내의 단일 세포를 분석하려면 4.2.8-4.2.12단계를 따르십시오.
- 형광 컨쥬게이션된 팔로이드 염색에 기초하여 구상체를 분절한다.
- Hoechst 33342 염색에 기초하여 핵을 분절한다.
- 세포질에 존재하는 잔류 Hoechst 33342 염색에 의해 각 세포의 세포질을 분절한다.
- 이차 항체 염색에 기초하여 리소좀을 분절한다.
- 세포당 리소좀의 수, 세포 부피 및 세포 표면적을 포함하여 각 구상체 내의 세포의 상이한 형태학적 특성을 계산한다.
참고: 이 정보는 선택한 이미지 분석 소프트웨어에 내장된 다양한 알고리즘을 사용하여 추출됩니다.
결과
이 프로토콜에서는 다양한 종양 조직을 표현하기 위해 다양한 세포 유형을 사용하여 구상체 형태의 3D 세포 배양 어셈블리를 생산하는 강력한 방법이 자세히 설명되어 있습니다. 이 방법을 사용하면 웰 당 수백 개의 구상체를 생성 할 수 있으므로 세포 기반 분석을 고함량 방식으로 수행 할 수 있습니다 (그림 1). 이 접근법은 이전에 HT-29 구상체16 에서의 나노입자 흡수 및 HepG2 구상체17에서의 나노입자-유도 독성을 연구하는데 사용되어 왔다. 이 방법은 광학 품질 플레이트의 우물 바닥을 가로 질러 스캐폴드 재료의 얇고 균일 한 분포를 생산하는 데 의존합니다. 세포는 각 웰에 시딩되고, 더 나아가 스캐폴드 물질은, 낮은 농도에서, 세포 상에 오버레이로서 첨가된다. 이것은 구상체의 성장도 지원하는 염기를 초래하며, 이는 수백 개의 구상체가 96-웰 플레이트의 각 웰에서 배양될 수 있음을 의미한다. 낮은 배율 목표는 전체 모집단의 개요 이미지를 생성하는 데 사용됩니다(그림 2). 그런 다음 우물의 하위 영역을 선택하고 고해상도 목표를 사용하여 이미징 할 수 있으며 각 위치에서 완전한 공초점 스택이 획득됩니다. 이것은 각 구상체의 후속 용적 분석에 필요한 정보를 제공합니다.
개별 구상체는 HCA에 의해 분석 될 수 있으며, 이에 따라 구상체의 형태 학적 특성에 대한 정보를 제공 할 수 있습니다. 일반적으로 첫 번째 단계는 각 스페로이드를 단일 개체로 식별하는 것입니다. 이를 위해, 스페로이드 전체에 걸쳐 일관된 염색 또는 분포를 줄 가능성이 있는 형광 채널이 선택된다. 여기에 도시된 예에서, 형광 컨쥬게이션된 팔로이드 채널 내의 신호는 액틴이 상이한 스페로이드 유형의 모든 세포에서 원형질막에 가깝게 발견되는 바와 같이 사용된다(도 2 및 도 3A). 완전한 공초점 스택이 생성되는 결과로, 모든 HCA 단계는 슬라이스 기준이 아닌 체적 방식으로 수행될 수 있다. 이는 소수의 선택된 평면의 분석과 관련된 바이어스를 제거하기 때문에 중요합니다. 이 체적 접근법은 이미지의 다른 채널에 적용됩니다. 핵은 Hoechst 33342 염색에 기초하여 검출되고 분절되었으며, 낮은 수준으로 존재하는 잔류 Hoechst 33342가 존재하기 때문에 이 동일한 채널이 세포 세포질을 검출하는데 사용될 수 있다(도 3B). 스페로이드 내의 개별 세포의 하류 분석이 필요한 경우, 다른 채널 (예를 들어, 항-LAMP1 항체로 면역염색된 리소좀)도 유사한 방식으로 처리될 수 있다. 용적 접근법은 모든 형광 표지된 구조물이 모든 뷰로부터 시각화될 수 있게 한다(그림 3C).
스페로이드를 별개의 물체로 확인하면, 스페로이드 수준에서 다양한 형태학적 측정이 이루어질 수 있다. 이러한 측정에는 스페로이드 당 핵 수의 계산(도 4A)뿐만 아니라 구상체의 구형도(도 4B), 부피(도 4C) 및 표면적(도 4D)이 포함된다. 사용된 HCA 소프트웨어에 따라 단면적, 내부 디스크 반지름 및 내부 구 반지름과 같은 다른 형태학적 특징도 계산할 수 있습니다. 여기에 표시된 예에서 75,000 μm3 이하의 구상체와 900,000 μm3 이상의 구상체는 측정에서 폐기되었지만 이러한 매개 변수는 분석을 위해 원하는 스페로이드 특성에 따라 사용자가 설정할 수 있습니다. 스프레드 시트는 이미지 분석 소프트웨어에 의해 생성되어 분석을 위해 RStudio로 가져 왔습니다. 다양한 유형의 구상체의 형태학적 특성을 표시하기 위해 박스플롯 그래프가 생성되었다(도 4). 이 상자 그림은 집단에서 스페로이드 이질성의 수준을 나타내므로 한 실험에서 많은 수의 구상체를 정량화하는 것이 중요합니다. 이것은 웰 당 단일 스페로이드를 생성하는 방법에 비해 주요 이점입니다. 여기에 표시된 세 가지 스페로이드 유형은 부피 및 표면적과 관련하여 높은 수준의 유사성을 보여 주지만 HepG2 구상체의 구형도가 여기에 표시된 다른 유형보다 다소 낮다는 점은 주목할 만합니다 (그림 4B).
여기에 사용된 63x 수침 목표와 같은 고해상도 목표를 가진 구상체를 이미징하면 스페로이드 내의 개별 세포의 세포 내 분해능을 달성할 수 있습니다. 상이한 소기관은 사용된 항체에 따라 분절될 수 있다. 본원에 나타낸 예에서, 리소좀은 항-LAMP1 항체를 사용한 면역염색에 기초하여 확인되었고, 이어서 이차 항체 첨가가 뒤따랐다(도 3C). 그런 다음 각 세포 내의 각 소기관의 세분화는 세포 수준 측정의 정량화를 허용합니다. 세 가지 스페로이드 유형에서 각 세포의 전형적인 부피 (도 5A), 뿐만 아니라 세포 당 리소좀의 수 (도 5B)가 도시되어 있다. 이러한 세포하층 세부사항에 대한 필요성은 구상체가 사용될 검정에 의해 결정된다.
스페로이드 생성 초기에 초기 세포 시딩 밀도를 최적화하는 것은 중요한 단계입니다. 너무 많은 세포를 추가하면 여전히 스페로이드 형성이 가능합니다. 그러나 이로 인해 구상체가 융합될 수 있습니다(그림 6). 이로 인해 불규칙한 모양의 어셈블리가 생성되며, 이는 구상체의 하류 식별에 매우 문제가 될 수 있습니다. 구상체가 별개의 구조로 잘못 식별되면 개별 세포의 분석에도 문제가있을 수 있습니다. 이와 같이, 세포 시딩 밀도 및 성장 시간의 길이를 포함하는 스페로이드 생성에 사용되는 각 세포주의 신중한 최적화는 확립에 중요한 파라미터이다.

그림 1: HCS 및 HCA용 구상체를 생성하는 데 사용되는 프로토콜을 개략적으로 상세히 기술합니다 . 96-웰 플레이트는 ECM 기저 물질 층으로 코팅된 후 세포를 시딩한 다음 스페로이드 형성을 시작합니다. 매체는 다음 날과 그 후 매 이틀마다 교체됩니다. 이미징을 준비하기 위해 구상체는 고정되고, 투과되고, 특정 항체로 면역염색됩니다. 그런 다음 구상체는 공초점 HCS 현미경을 사용하여 이미징됩니다. BioRender.com 로 만든 그래픽입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
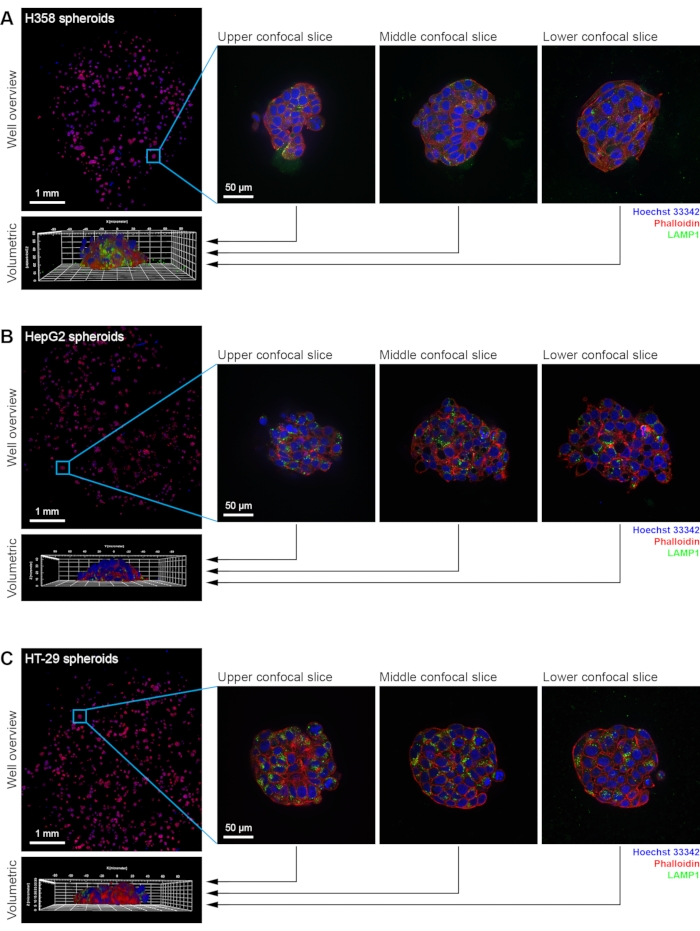
그림 2: H358, HepG2 및 HT-29 구상체의 예제 이미지. (A) H358, (B) HepG2 및 (C) HT-29 구상체의 완전 자동화된 HCS 공초점 영상. 패널은 단일 웰 개요뿐만 아니라 세 가지 예의 공초점 슬라이스 및 각 세포주로부터 하나의 스페로이드의 체적 재구성을 보여준다. Hoechst 33342로 염색된 핵은 파란색으로, 액틴은 빨간색으로 형광 공액 팔로이드인으로 염색하고, 리소좀은 녹색으로 LAMP1에 대해 면역염색하였다. 웰 개요의 이미지는 20x 물 침지 목표(NA 1.0)로 획득되었다. 개별 구상체의 이미지는 63x 물 침지 목표 (NA 1.15)로 획득되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
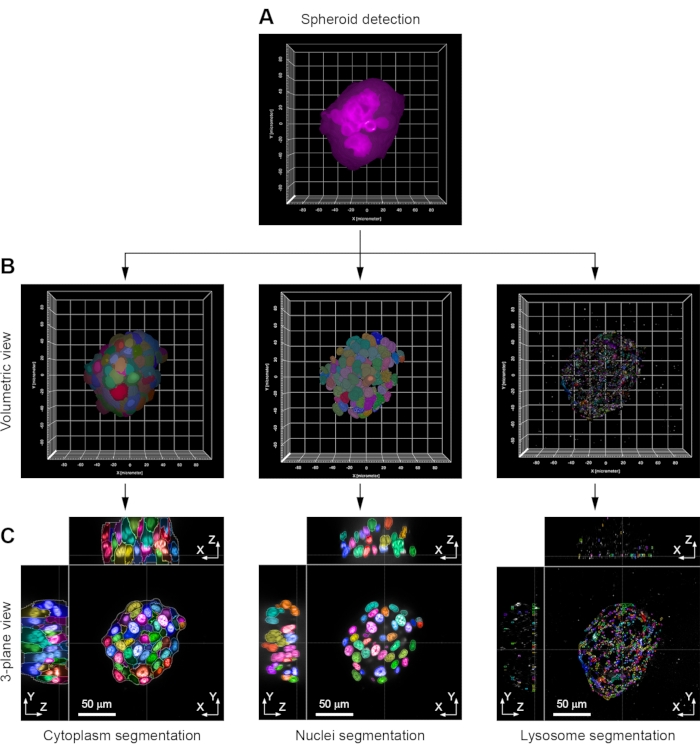
그림 3: 이미지 분석의 주요 단계 예제 (a) 각 스페로이드는 먼저 형광 공액 플라로이드 염색의 검출에 의해 용적 모드에서 확인된다. (b) 이 정보를 마스크로 사용하여, 각 세포의 세포질은 세포질에 존재하는 잔류 Hoechst 33342 염색에 의해 분절된다. 핵은 Hoechst 33342 얼룩에 의해 분할됩니다. 리소좀은 항체 (항-LAMP1) 면역염색을 사용하여 분절된다. 체적 뷰가 표시됩니다. (C) 동일한 구상체의 3 평면보기. 도시된 예는 H358 세포 구상체의 것이다. 이미지는 63x 물 침수 목표 (NA 1.15)로 획득되었습니다 .이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
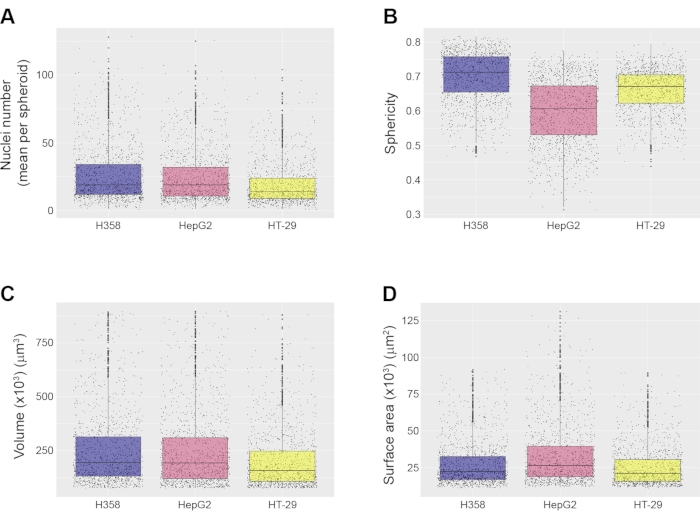
그림 4: 구형 수준 측정의 예. 모든 측정은 자동화 된 이미지 분석 파이프 라인을 사용하여 이루어졌으며 H358, HepG2 및 HT-29의 세 가지 유형의 구상체에 대해 20x 목표로 이미징되었습니다. 도시된 것은 (A) 스페로이드 당 평균 핵 수, (B) 스페로이드 구형도, (C) 스페로이드 부피, 및 (D) 스페로이드 표면적이다. 모든 상자 그림은 각 스페로이드 유형에 대한 중앙값과 사분위수를 표시합니다. 데이터는 3 복제 웰에서 가져온 것입니다. 분석된 구상체의 총 수는 1259 (H358), 1522 (HepG2) 및 1326 (HT-29)이었다. 이미지는 20x 물 침지 목표(NA 1.0)로 획득되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 구상체로부터의 세포 수준 측정의 예. 모든 측정은 자동화된 이미지 분석 파이프라인을 사용하여 이루어졌으며, 세 가지 유형의 구상체, 즉 H358, HepG2 및 HT-29에 대해 63x 목표로 이미징되었습니다. 도시된 것은 (A) 개별 세포의 부피, 및 (B) 세포당 리소좀의 평균 수이다. 분석된 총 세포 수는 각 세포주의 20개 구상체로부터 1410개(H358), 1625개(HepG2), 및 1401개(HT-29)였다. 이미지는 63x 물 침수 목표 (NA 1.15)로 획득되었습니다 .이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 스페로이드 형성에 대한 세포의 과다 도금의 효과를 보여주는 예제 이미지. H358, HepG2 및 HT-29 구상체에 대한 예제 이미지가 도시되어 있습니다. 화살표는 구상체가 융합되었을 가능성이 높은 장소를 나타냅니다. 이미지는 20x 물 침지 목표(NA 1.0)로 획득되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에 설명된 접근법은 HCS 및 HCA에 적합한 방식으로 웰당 수백 개의 구상체를 생성하기 위한 플랫폼을 상세히 설명한다. 웰 당 하나의 스페로이드 형성 만 허용하는 평평한 바닥 및 둥근 바닥 ULA 플레이트의 사용과 같은 다른 인기있는 방법과 비교할 때,18,19,이 방법은 스크리닝 형식으로 많은 수의 구상체로부터 고해상도 정보를 추출 할 수있는 기회를 제공합니다. 특히,이 방법은 다양한 종양 유형을 나타내는 3 개의 다른 세포주에서 입증되었으며, 다양한 모델에서 다양한 세포 과정을 연구하는 데 광범위한 적합성을 강조합니다. 이 방법을 사용하여 생성 된 구상체는 크기와 모양에 약간의 변동성을 보여 주지만 HCA는 크기 (또는 관심있는 다른 매개 변수)별로 쉽게 분류 할 수 있습니다. 우리 실험실은이 접근법을 성공적으로 사용하여 스페로이드 크기의 함수로서 나노 입자 유도 독성을 연구했습니다. 중요하게도, 구상체의 모든 상이한 크기 부류가 동일한 우물에서 연구될 수 있다는 것은, 모두가 동일한 치료에 노출되었다는 것을 의미하며, 이는 큰 스페로이드 집단으로부터 매우 강력한 산출물을 제공한다는 것을 의미한다17. 여기에 설명된 방법론은 상이한 조직을 나타내는 다른 세포 유형과 함께 사용하기 위해 쉽게 적응될 수 있다. 또한, 이러한 구상체는 상이한 생물학적 과정을 평가하는데 사용될 수 있다14. 구상체가 형광 태깅된 단백질을 안정적으로 발현하는 세포와 함께 생성된다면, 살아있는 세포 이미징이 또한 가능하다.
이 프로토콜의 한 가지 중요한 단계는 세포가 도금되는 ECM 지하 물질 층의 생산입니다. 층이 너무 두꺼우면 웰의 중앙에 단층의 성장을 촉진하고 우물의 바깥 쪽 테두리에서만 구상체의 성장을 촉진하는 메니스커스(meniscus20 )를 형성할 수 있다. 따라서, ECM 지하실 물질의 정확한 농도와 부피가 웰 전체에 걸쳐 균일한 스페로이드 형성을 허용하도록 선택되는 것이 필수적이다; 이것은 항상 세포주에 따라 다릅니다. 또한 주목할만한 것은 과도한 ECM 지하실 물질이 쉽게 용해되지 않기 때문에 면역 염색 과정 중에 문제를 일으킬 수 있다는 것입니다. 이것은 차례로 HCS 공초점 현미경 시스템을 사용할 때 이미지 획득 중에 합병증을 유발할 수 있습니다. 한 가지 다른 고려사항은 상이한 세포주가 상이한 ECM 제형을 필요로 할 수 있다는 것이다. 예를 들어, HepG2 구상체는 H358 및 HT-29 구상체에 의해 사용되는 것에 비해 성장 인자의 감소된 농도를 갖는 ECM 지하실 재료를 필요로 한다. 셀 도금의 방법 또한 중요한데, 이는 셀이 웰에 어떻게 분포되는지를 결정하기 때문이다. 너무 많은 세포가 시딩되거나 제대로 분포되지 않은 경우 스페로이드 융합으로 이어질 수 있습니다(그림 6). ECM 스캐폴드 사용의 또 다른 과제 중 하나는 저온(10°C 이하)에서 처리해야 한다는 것인데, 이는 HCS용 자동화를 사용할 때 특히 문제가 됩니다. 그러나이 문제는 ECM 지하실 재료 및 세포의 0.2 μL 방울을 챔버 슬라이드로 발견하기 위해 마이크로 어레이 기술을 채택 한 Eismann과 동료 (2020)에 의해 최근에 해결되었습니다. 이것은 작은 구상체21의 성장을 촉진시키기에 충분한 물질이었다. 이러한 접근법이 더 많은 양의 ECM 지하실 재료를 다중 웰 플레이트의 우물에 도금하는 데에도 효과가 있을지 여부는 아직 입증되지 않았습니다.
현미경을 사용한 3D 세포 모델 분석과 관련된 한 가지 문제점은 이러한 어셈블리의 중앙 평면에서 정보를 추출하는 기능입니다. 이와 관련하여, 면역염색 과정 동안 투과화 및 항체 접근이 문제가 될 수 있다. 그러나, 뉘른베르크와 동료들15 에 의해 발표된 프로토콜은 전체 구상체의 매우 일관된 면역염색을 가능하게 한다. 이 프로토콜에 약간의 변형을 사용하여, 이 기술은 세포가 전체 스페로이드 구조에 대하여 중앙 또는 주변부인지 여부에 관계없이 높은 수준의 일관성을 갖는 작은 세포 하부 구조 (예를 들어, 리소좀)조차도 면역염색할 수 있다. 새로운 항체를 사용할 때이 단계는 신중하게 최적화되는 것이 중요합니다.
또 다른 중요한 단계는 선택한 이미징 체제입니다. 스페로이드를 통해 적절한 수의 z-슬라이스를 이미징하는 것이 중요한데, 이는 분석 및 저장해야 하는 데이터의 양을 결정하기 때문입니다. 예를 들어, 너무 큰 간격으로 제한된 수의 z-평면을 이미징하면 전체 스페로이드 크기 및 부피가 과소 평가될 수 있습니다. 반면에 너무 많은 z-평면을 캡처하면 데이터 분석 및 저장 문제가 발생할 수 있습니다. 또한 매우 큰 데이터 세트는 특히 체적 모드에서 분석을 위해 더 집중적인 계산 능력을 필요로 합니다. z-평면에서의 최적 샘플링 간격은 주로 대물 렌즈의 특성에 의해 결정되지만, 여기에 표시된 예의 경우, 구상체의 전체 깊이를 통한 이미징을 용이하게하기 위해 1.5 μm 간격으로 약 40 개의 공초점 조각이 필요합니다.
앞서 언급한 바와 같이, 선택된 평면의 분석으로부터의 바이어스를 감소시키기 위해, 용적 기반 이미지 분석 접근법의 사용이 강력하게 권장된다. 이를 통해 구상체 수준 정보뿐만 아니라 각 개별 스페로이드의 세포 수준 데이터도 추출 할 수 있습니다. 궁극적으로, HCA 파이프라인은 그들이 묻는 특정 생물학적 질문을 해결하는 방식으로 설계되어야 한다. 다중 모수 출력은 복잡한 표현형을 정량적으로 설명할 수 있게 합니다. 이는 상용 HCA 소프트웨어16,17뿐만 아니라 CellProfiler22,23과 같이 자유롭게 액세스할 수 있는 소프트웨어를 사용하는 3D 셀 어셈블리에서 작동하는 것으로 입증되었습니다. 용적 분석 방법은 오가노이드 및 생체외 환자 유래 외식편(PDEs)과 같은 다른 3D 세포 모델 유형에 적용될 수 있는 잠재력을 가지며, 이는 생체내 조건에서도 더 잘 복제된다. 최근에, 뇌 오가노이드를 생산하기 위한 고처리량 파이프라인이 설명되었다24. 이것은 96-웰 플레이트에서 오가노이드를 생성하고 이어서 고함량 스크리닝 현미경을 사용하여 이들을 이미징하는 것을 포함한다24. PDEs는 종양으로부터 본래의 조직학을 나타낸다는 점에서 매우 유리하며, 따라서 종양 미세환경과 같은 특징을 포함하는 생체내 조건을 되풀이하는 세포 모델을 제공한다25. 이들 모델은 또한, 원칙적으로, 본원에 기재된 접근법을 사용하여 면역염색, 이미징 및 분석될 수 있다26,27.
요약하면, 이 프로토콜은 HCS 및 HCA 응용을 위한 구상체의 대규모 생산을 위한 접근 가능하고 강력한 방법을 기술한다. 그것의 적용 가능성은 세 가지 다른 세포주로 나타나며, 고해상도로 이미징 할 수있는 구상체를 생산합니다. 이 프로토콜은 또한 용적 분석이 단일 세포 및 아세포 수준뿐만 아니라 스페로이드 집단에 대한 정량적 정보를 제공 할 수 있음을 보여 주므로 다양한 분석에 유용합니다.
공개
저자들은 이 작품과 관련된 경쟁적인 이해관계가 없다고 선언한다.
감사의 말
저자들은 Science Foundation Ireland (SFI) (16 / RI / 3745)에서 JCS에 대한 인프라 연구 보조금의 지원을 인정합니다. UCD 세포 스크리닝 실험실에서의 작업은 UCD 과학 대학의 지원을 받습니다. ASC는 아일랜드 연구위원회 (IRC) 아일랜드 대학원 장학금 (GOIPG / 2019 / 68)의 정부에서 자금을 지원합니다. 저자는 또한 실험실의 모든 구성원에게 그들의 의견과 도움이되는 토론에 감사드립니다. 그림 1의 아트웍은 BioRender에서 생성되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1x), phenol red | Gibco | 25300054 | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A6003 | |
| Calcium chloride | Fisher Scientific | 10050070 | |
| CellCarrier-96 Ultra Microplates, tissue culture treated, black, 96-well with lid | Perkin Elmer | 6055302 | These plates have been renamed as Phenoplates |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| Foetal Bovine Serum (FBS), qualified, EU approved, South America origin, heat inactivated | Gibco | 10500064 | |
| Glycine | Fisher Scientific | BP381-1 | |
| Goat anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Invitrogen | A-11029 | |
| L-Glutamine solution, 200 mM | Gibco | 25030024 | |
| Hoechst 33342 | Sigma Aldrich | 14533 | |
| Magnesium chloride | Fisher Scientific | 10647032 | |
| Matrigel Basement Membrane Matrix, Phenol Red-free, LDEV-free, 10 mL | Corning | 356237 | This Matrigel formulation can be also found with the same catalogue number at BD Biosciences |
| Matrigel Growth Factor Reduced Matrigel | BD Biosciences | 356231 | This Matrigel formulation can be also found with the same catalogue number at Corning |
| McCoy's 5A medium | Gibco | 26600023 | |
| McCoy's 5A medium with L glutamine and sodium bicarbonate, without phenol red | Hyclone | 10358633 | |
| Minimum Essential Medium (MEM) | Gibco | 21090022 | |
| Minimum Essential Medium (MEM), without glutamine, without phenol red | Gibco | 51200046 | |
| Mouse monoclonal anti-LAMP1 antibody (concentrate) | Developmental Studies Hybridoma Bank | H4A3-a | |
| Neubauer counting chamber | Hirschmann | 8100203 | |
| Nunclon tissue culture dish with lid, polystyrene, 92 mm x 17 mm | ThermoFisher Scientific | 150350 | |
| Opera Phenix HCS System and Harmony HCA software | Perkin Elmer | HCSHH14000000 | |
| Paraformaldehyde (PFA) | Sigma Aldrich | P6148 | |
| Phalloidin Alexa Fluor 568 | Invitrogen | A12380 | |
| Phosphate Buffered Saline (PBS) tablets | Sigma Aldrich | P4417 | |
| Polysorbate 20 | Sigma Aldrich | P5927 | |
| RPMI 1640 Medium, GlutaMAX Supplement | Gibco | 61870010 | |
| RPMI 1640 Medium, without glutamine, without phenol red | Gibco | 11835063 | |
| Triton X-100 | Sigma Aldrich | T9284 | |
| Stericup sterile vacuum filter units | Millipore | SCGVU05RE |
참고문헌
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6 (2018).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay and Drug Development Technologies. 12 (4), 207-218 (2014).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Zhang, X., Jiang, T., Chen, D., Wang, Q., Zhang, L. W. Three-dimensional liver models: state of the art and their application for hepatotoxicity evaluation. Critical Reviews in Toxicology. 50 (4), 279-309 (2020).
- Dutta, D., Heo, I., Clevers, H. Disease modeling in stem cell-derived 3D organoid systems. Trends in Molecular Medicine. 23 (5), 393-410 (2017).
- Nunes, A. S., Barros, A. S., Costa, E. C., Moreira, A. F., Correia, I. J. 3D tumor spheroids as in vitro models to mimic in vivo human solid tumors resistance to therapeutic drugs. Biotechnology and Bioengineering. 116 (1), 206-226 (2019).
- Kleinman, H. K., Martin, G. R. Matrigel: Basement membrane matrix with biological activity. Seminars in Cancer Biology. 15, 378-386 (2005).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Foglietta, F., Canaparo, R., Muccioli, G., Terreno, E., Serpe, L. Methodological aspects and pharmacological applications of three-dimensional cancer cell cultures and organoids. Life Sciences. 254, 117784 (2020).
- Bardsley, K., Deegan, A. J., El Haj, A., Yang, Y. Current state-of-the-art 3D tissue models and their compatibility with live-cell imaging. Advances in Experimental Medicine and Biology. 1035, 3-18 (2017).
- Darrigues, E., et al. Tracking gold nanorods' interaction with large 3D pancreatic-stromal tumor spheroids by multimodal imaging: Fluorescence, photoacoustic, and photothermal microscopies. Scientific Reports. 10 (1), 3362 (2020).
- Boutros, M., Heigwer, F., Laufer, C. Microscopy-based high-content screening. Cell. 163 (6), 1314-1325 (2015).
- Mysior, M. M., Simpson, J. C. Cell3: A new vision for study of the endomembrane system in mammalian cells. Bioscience Reports. , (2021).
- Nürnberg, E., et al. Routine optical clearing of 3D-cell cultures: Simplicity forward. Frontiers in Molecular Biosciences. 7 (20), (2020).
- Cutrona, M. B., Simpson, J. C. A High-throughput automated confocal microscopy platform for quantitative phenotyping of nanoparticle uptake and transport in spheroids. Small. 15 (37), 1902033 (2019).
- Kelly, S., Byrne, M. H., Quinn, S. J., Simpson, J. C. Multiparametric nanoparticle-induced toxicity readouts with single cell resolution in HepG2 multicellular tumour spheroids. Nanoscale. 13 (41), 17615-17628 (2021).
- Sirenko, O., Mitlo, T., Hesley, J., Luke, S., Owens, W., Cromwell, E. F. High-content assays for characterizing the viability and morphology of 3D cancer spheroid cultures. Assay and Drug Development Technologies. 13 (7), 402-414 (2015).
- Redondo-Castro, E., Cunningham, C. J., Miller, J., Cain, S. A., Allan, S. M., Pinteaux, E. Generation of human mesenchymal stem cell 3D spheroids using low-binding plates. Bio-protocol. 8 (16), (2018).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nature Methods. 4 (4), 359-365 (2007).
- Eismann, B., et al. Automated 3D light-sheet screening with high spatiotemporal resolution reveals mitotic phenotypes. Journal of Cell Science. 133 (11), 245043 (2020).
- Alsehli, H., et al. An integrated pipeline for high-throughput screening and profiling of spheroids using simple live image analysis of frame to frame variations. Methods. 190, 33-43 (2021).
- Stirling, D. R., et al. CellProfiler 4: improvements in speed, utility and usability. BMC Bioinformatics. 22 (1), 1-11 (2021).
- Renner, H., et al. A fully automated high-throughput workflow for 3D-based chemical screening in human midbrain organoids. eLife. 9, 52904 (2020).
- Powley, I. R., et al. Patient-derived explants (PDEs) as a powerful preclinical platform for anti-cancer drug and biomarker discovery. British Journal of Cancer. 122 (6), 735-744 (2020).
- Collins, A., Miles, G. J., Wood, J., MacFarlane, M., Pritchard, C., Moss, E. Patient-derived explants, xenografts and organoids: 3-dimensional patient-relevant preclinical models in endometrial cancer. Gynecologic Oncology. 156 (1), 251-259 (2020).
- Miles, G. J., et al. Evaluating and comparing immunostaining and computational methods for spatial profiling of drug response in patient-derived explants. Laboratory Investigation. 101 (3), 396-407 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유