Method Article
طريقة قوية لإنتاج الكرويات على نطاق واسع لتطبيقات الفحص والتحليل عالية المحتوى
In This Article
Summary
يفصل هذا البروتوكول طريقة لإنتاج ثلاثة أنواع مختلفة من الكرويات بطريقة تجعلها مناسبة للفحص والتحليل عالي المحتوى على نطاق واسع. بالإضافة إلى ذلك ، يتم تقديم أمثلة توضح كيف يمكن تحليلها على مستويات الخلايا الكروية والفردية.
Abstract
الفحص عالي المحتوى (HCS) والتحليل عالي المحتوى (HCA) هما تقنيتان توفران للباحثين القدرة على استخراج قياسات النمط الظاهري الكمي واسعة النطاق من الخلايا. وقد أثبت هذا النهج قوته في تعميق فهمنا لمجموعة واسعة من الأحداث الأساسية والتطبيقية في بيولوجيا الخلية. حتى الآن ، اعتمدت غالبية تطبيقات هذه التكنولوجيا على استخدام الخلايا المزروعة في الطبقات الأحادية ، على الرغم من أنه من المعلوم بشكل متزايد أن هذه النماذج لا تلخص العديد من التفاعلات والعمليات التي تحدث في الأنسجة. على هذا النحو ، كان هناك ظهور في تطوير واستخدام جمعيات الخلايا ثلاثية الأبعاد (3D) ، مثل الكرويات والمواد العضوية. على الرغم من أن هذه النماذج 3D قوية بشكل خاص في سياق بيولوجيا السرطان ودراسات تسليم الأدوية ، إلا أن إنتاجها وتحليلها بطريقة قابلة للتكرار مناسبة ل HCS و HCA يمثل عددا من التحديات. يصف البروتوكول المفصل هنا طريقة لتوليد الكرويات متعددة الخلايا (MCTS) ، ويوضح أنه يمكن تطبيقها على ثلاثة خطوط خلايا مختلفة بطريقة متوافقة مع HCS و HCA. وتسهل هذه الطريقة إنتاج عدة مئات من الكرويات لكل بئر، مما يوفر ميزة محددة تتمثل في أنه عند استخدامها في نظام الفحص، يمكن الحصول على البيانات من عدة مئات من الهياكل لكل بئر، ومعالجتها جميعا بطريقة متطابقة. كما يتم تقديم أمثلة توضح بالتفصيل كيفية معالجة الكرويات للتصوير الفلوري عالي الدقة وكيف يمكن ل HCA استخراج الميزات الكمية على كل من المستوى الكروي وكذلك من الخلايا الفردية داخل كل كروية. يمكن تطبيق هذا البروتوكول بسهولة للإجابة على مجموعة واسعة من الأسئلة المهمة في بيولوجيا الخلية.
Introduction
تقليديا ، تم إجراء الفحوصات القائمة على الخلايا في طبقات أحادية تنمو على ركيزة صلبة ، والتي يمكن اعتبارها بشكل فعال بيئة ثنائية الأبعاد (2D). ومع ذلك ، أصبح من المعترف به بشكل متزايد أن نماذج زراعة الخلايا ثنائية الأبعاد تفتقر إلى الأهمية الفسيولوجية في بعض السياقات ولا يمكنها تكرار العديد من التفاعلات المعقدة التي تحدث بين الخلايا 1. أصبحت طرق زراعة الخلايا ثلاثية الأبعاد (3D) شائعة بسرعة بين الباحثين ، وتظهر نماذج الخلايا ثلاثية الأبعاد إمكانات عالية لمحاكاة الظروف الفسيولوجية التي تواجهها الخلايا في بيئة الأنسجة بشكل أفضل2. هناك عدة أنواع مختلفة من تجمعات الخلايا 3D التي تم استخدامها ، ولكن النوعين الأكثر شيوعا هما الكرويات والعضوية. يمكن زراعة الكرويات من العديد من خطوط الخلايا المختلفة، ويمكنها اعتماد أشكال وأحجام مختلفة اعتمادا على نوع الخلية المستخدمة وطريقة تجميعها3. علاوة على ذلك ، يمكن أيضا الإشارة إلى الكرويات باسم الكرويات متعددة الخلايا (MCTS) عندما تزرع من خطوط الخلايا السرطانية ، وقد وجدت هذه النماذج استخداما خاصا لتوصيل الأدوية قبل السريرية في المختبر ودراسات السمية4,5. من ناحية أخرى ، تهدف المواد العضوية إلى محاكاة الأنسجة والأعضاء في أجسامنا بشكل أفضل ويمكن أن تعتمد ترتيبات مورفولوجية أكثر تعقيدا. ينطوي إنتاج المواد العضوية على استخدام الخلايا الجذعية البالغة أو الخلايا الجذعية متعددة القدرات ، والتي يمكن إعادة برمجتها في الخلايا المناسبة لتشبه الأنسجة أو الأعضاء ذات الاهتمام. وهي تستخدم في المقام الأول للتحقيق في تطور الأعضاء ونمذجة الأمراض والتفاعلات بين المضيف والممرضات6.
هناك مجموعة من الطرق المختلفة المستخدمة لإنشاء تجميعات خلايا 3D. توفر الطرق القائمة على السقالات ركيزة أو دعما يمكن للخلايا أن تلتصق به أو تنمو داخله. يمكن أن يكون لهذه السقالات أشكال مختلفة ويمكن تصنيعها من مجموعة متنوعة من المواد المختلفة. الأكثر شيوعا هي مكونات المصفوفة خارج الخلية (ECM) والمواد الهلامية المائية ، وهي مصممة لتشبه البيئة الطبيعية خارج الخلية للخلايا وبالتالي تسهيل التفاعلات الفسيولوجية4,7. تم استخراج مادة الطابق السفلي ECM من ورم ساركوما الفئران Engelbreth-Holm-Swarm وتبين أنها تحتوي على مزيج غني من مكونات ECM ، بما في ذلك laminin والكولاجين من النوع الرابع و perlecan8. ومع ذلك ، على الرغم من تكوينه المفيد ، هناك تحديان رئيسيان في استخدامه ، وهما تقلبه من دفعة إلى أخرى وأن لديه حالتين مختلفتين من المجموع أقل وفوق 10 درجات مئوية 8,9. في المقابل ، تتمتع الهيدروجيل بميزة المرونة فيما يتعلق بمكوناتها وصلابتها ، ويمكن تخصيصها لتناسب مجموعة الخلايا ثلاثية الأبعاد المحددة المطلوبة7,10. الطرق القائمة على السقالات ضرورية للنمو العضوي ولكنها تستخدم أيضا على نطاق واسع للكرويات. عادة ما تكون الطرق الخالية من السقالات ، والتي تعمل عن طريق منع الخلايا من الالتصاق بالسطح الذي تنمو عليه ، متوافقة فقط مع التجميع الكروي. ومن الأمثلة على ذلك لوحات التعلق المنخفضة للغاية (ULA) ، إما مع قاع مسطح أو قاع U ، مما يسمح بتجميع الخلايا في كرويات ، أو استخدام التحريض المستمر للخلايا في قوارير الدوران / الدوران 10.
استخدام جمعيات الخلايا 3D لدراسة مجموعة واسعة من الأحداث البيولوجية يكتسب شعبية بسرعة. ومع ذلك ، من الضروري أن تكون الطريقة المختارة لثقافتهم مناسبة ومتوافقة مع خطط تحليلهم النهائي. على سبيل المثال ، يولد استخدام لوحات ULA كرويات ذات اتساق عال. ومع ذلك ، تقتصر هذه الطريقة على إنتاج كروي واحد لكل بئر ، مما يحد من الإنتاجية. هناك حاجة إلى اعتبار خاص عند التخطيط للتصوير الفلوري لهيكل 3D. يجب أن تكون الركيزة أو اللوحة التي تزرع عليها المجموعة متوافقة بصريا ، ويجب توخي الحذر لتقليل آثار تشتت الضوء الناجم عن أي سقالات قد تكون استخدمت 11. تصبح هذه المشكلة بالذات أكثر حدة مع زيادة الفتحة العددية للعدسات الموضوعية المجهرية.
يمكن القول إن أحد الأسباب الرئيسية لاختيار العمل مع نموذج خلية 3D هو استخراج بيانات التصوير الحجمي ليس فقط حول التجميع بأكمله ولكن أيضا الخلايا الفردية داخله. بدأت نماذج MCTS ، على وجه الخصوص ، تثبت قوتها الكبيرة لتعميق فهمنا لكيفية انتقال العلاجات من الخارج إلى الخلايا المركزية (كما تحتاج إلى ذلك في الورم)12 ، وبالتالي فإن اكتساب المعرفة من الخلايا الفردية في طبقات مختلفة أمر ضروري. تسمى تقنية التصوير التي تستخرج المعلومات الكمية من الخلايا الفردية تحليل المحتوى العالي (HCA) وهي نهج قوي في سياق الفحص13. حتى الآن ، تم تطبيق HCA بشكل حصري تقريبا على ثقافات الطبقة الأحادية ، ولكن هناك إدراك متزايد بأن هذا النهج لديه القدرة على تطبيقه على ثقافات 3D مما يتيح دراسة مجموعة واسعة من الوظائف والعمليات الخلوية14. سيكون لها ميزة واضحة أنه يمكن تحليل أعداد كبيرة من التجميعات 3D ، مما قد يوفر بيانات على مستوى الخلية من جميع أنحاء كل هيكل. ومع ذلك ، يجب التغلب على التحديات المرتبطة بتصوير مجموعات الخلايا التي يحتمل أن تكون سميكة ، وكذلك مجموعات البيانات الكبيرة التي تم إنشاؤها.
في هذه المقالة ، يتم تقديم طريقة قوية قائمة على السقالات لإنتاج MCTS على نطاق واسع بتنسيق 96 بئرا. تسهل هذه الطريقة إنتاج عدة مئات من تجميعات الخلايا 3D في كل بئر. يتم عرض أمثلة لثلاثة أنواع مختلفة من الخلايا ، تمثل نماذج الورم الصلب للكبد والرئة والقولون. يمكن أن تكون الكرويات التي تتشكل من مجموعة متنوعة من الأحجام ، وبالتالي يتم استخدام HCA لاختيار هياكل ذات حجم و / أو مورفولوجيا معينة. توفر هذه الميزة ميزة إضافية تتمثل في إمكانية مقارنة أي أنماط ظاهرية لوحظت عبر كرويات ذات أحجام مختلفة ، ولكن جميعها تعامل بنفس الطريقة في نفس البئر. يتوافق هذا النهج مع التصوير عالي الدقة ، والأهم من ذلك توفير بيانات كمية على مستوى الخلية وتحت الخلية من نفس التجميعات الخلوية. وتتمتع طريقة الإنتاج الكروي هذه بميزة إضافية على الطرق التي تولد كروية واحدة لكل بئر، وأن الأعداد الكبيرة من الكرويات المنتجة في كل بئر يحتمل أن توفر كتلة حيوية كافية للتحليلات النهائية الأخرى، مثل التنميط النسخي والبروتيني.
Protocol
1. زراعة الخلايا
- إعداد وسائل الإعلام
- قم بإعداد وسائط زراعة خلايا محددة اعتمادا على نوع خط الخلية. تأكد من أن جميع الوسائط لصيانة الخلايا تحتوي على 10٪ مصل بقري جنيني (FBS).
ملاحظة: تستخدم خطوط الخلايا المختلفة وسائط مختلفة. تزرع خلايا سرطان القولون HT-29 (ATCC HTB-38) في McCoys 5A + 10٪ FBS. تزرع خلايا سرطان الخلايا الكبدية HepG2 (ATCC HB-8065) في الحد الأدنى من الوسط الأساسي + 1٪ L-glutamine + 10٪ FBS. تزرع خلايا سرطان القصبات الهوائية السنخية H358 (ATCC CRL-5807) في RPMI 1640 متوسطة + 1٪ L-glutamine + 10٪ FBS. يشار إلى جميع الوسائط التي تحتوي على L-glutamine و FBS على أنها وسائط كاملة. عند طلاء الخلايا لتنمو كروية ، يلزم وجود وسط خال من الفينول الأحمر مع 10٪ FBS لتجنب تلوين مادة الطابق السفلي ECM ، والتي بدورها يمكن أن تسبب القطع الأثرية أثناء عملية التصوير.
- قم بإعداد وسائط زراعة خلايا محددة اعتمادا على نوع خط الخلية. تأكد من أن جميع الوسائط لصيانة الخلايا تحتوي على 10٪ مصل بقري جنيني (FBS).
- خلايا الزراعة الفرعية
- عندما تكون الخلايا متقاربة بنسبة 80٪ تقريبا ، اغسلها لفترة وجيزة باستخدام 2 مل من التربسين-EDTA (0.25٪ (w / v) trypsin / 0.53 mM EDTA). استنشق التربسين-EDTA ، وأضف 3 مل من التربسين-EDTA الطازج واحتضنه لمدة 3-5 دقائق عند 37 درجة مئوية.
- عندما يتم فصل الخلايا عن طبق زراعة الخلايا ، أضف 7 مل من الوسط الكامل الطازج.
- ماصة 1 مل من تعليق الخلية في طبق جديد لزراعة الخلايا 10 سم وإضافة 9 مل من الوسط الكامل الطازج لإعطاء تخفيف 1:10 للخلايا.
- استزرع الخلايا عند 37 درجة مئوية في حاضنة رطبة مع 5٪ CO2.
- الزراعة الفرعية للخلايا كل 3-5 أيام ، اعتمادا على خط الخلية.
2. جيل الكرويات
- قم بتغطية لوحات 96-well بمواد الطابق السفلي ECM
- تذوب مواد الطابق السفلي ECM على الجليد بين عشية وضحاها.
- قم بتخفيف مادة الطابق السفلي ECM في وسط بارد خال من المصل الخالي من الفينول الأحمر باستخدام أطراف مبردة مسبقا محفوظة عند -20 درجة مئوية.
ملاحظة: يعتمد التركيز النهائي لمواد الطابق السفلي ECM على خط الخلية المستخدم. بالنسبة لخلايا HT-29 و H358 ، استخدم 4 mg ·mL-1 من مواد الطابق السفلي ECM. بالنسبة لخلايا HepG2 ، استخدم 4 mg ·mL-1 من مادة الطابق السفلي ECM لعامل النمو المنخفض. - ماصة 15 ميكرولتر من مادة الطابق السفلي ECM / الحل المتوسط في لوحة تصوير 96 بئرا.
ملاحظة: بالنسبة لإنتاج الكرويات على نطاق واسع، يمكن تنفيذ هذه الخطوة باستخدام كل من ماصة 8 قنوات ورأس سحب 96 قناة، طالما يتم تبريد الأطراف والخزان الذي يحتوي على مادة الطابق السفلي ECM. - الطرد المركزي للصفيحة لمدة 20 دقيقة عند 91 × غرام عند 4 درجات مئوية.
- احتضن اللوحة لمدة لا تزيد عن 30 دقيقة عند 37 درجة مئوية.
- الخلايا الفرعية للزراعة والعد
- خلال فترة حضانة الصفيحة ، احتضن الخلايا بالتريبسين-EDTA وأعد تعليقها في وسط كامل يحتوي على 10٪ FBS.
- ماصة 10 ميكرولتر من تعليق الخلية في غرفة عد مقياس الدم. احسب عدد الخلايا في 4 أرباع الغرفة.
- احسب عدد الخلايا داخل تعليق الخلية عن طريق تحديد متوسط عدد الخلايا داخل 4 أرباع.
ملاحظة: يمكن أيضا حساب الخلايا باستخدام أجهزة عد الخلايا التلقائية. - الطرد المركزي للخلايا عند 135 × g لمدة 4 دقائق في درجة حرارة الغرفة (RT).
- بمجرد أن يتم تكوير الخلايا ، قم بشفط supernatant وإعادة تعليق الخلايا في وسط كامل خال من الفينول الأحمر للحصول على تركيز 1 × 106 خلية لكل مل.
- خلايا البذور في لوحات ECM المغلفة بمواد الطابق السفلي
- تمييع الخلايا في وسط كامل خال من الفينول الأحمر.
ملاحظة: تعتمد كثافة الخلايا البذرية على خط الخلية المستخدم. بالنسبة لخلايا HT-29 و HepG2 ، يتم زرع 3 × 104 خلايا لكل بئر ؛ بالنسبة لخلايا H358 ، يتم زرع 4 × 104 خلايا لكل بئر. - زرع الخلايا في حجم إجمالي قدره 35 ميكرولتر لكل بئر. تأكد من إضافتها بقطرة في حركة دائرية.
ملاحظة: بالنسبة لإنتاج كروي واسع النطاق، يمكن تنفيذ هذه الخطوة باستخدام ماصة ذات 8 قنوات، طالما يمكن تحقيق الحركة الدائرية للسحب. - احتضن الخلايا لمدة 1 ساعة عند 37 درجة مئوية في حاضنة رطبة مع 5٪ CO2.
- قم بإعداد محلول من مواد الطابق السفلي ECM في وسط كامل خال من الفينول الأحمر ، مما يؤدي إلى تركيز نهائي ل 2٪ من مواد الطابق السفلي ECM في البئر. لتحقيق ذلك ، أضف 1.2 ميكرولتر من مواد الطابق السفلي ECM إلى 23.8 ميكرولتر من الوسط الكامل الخالي من الفينول الأحمر لكل بئر ، مما يؤدي إلى حجم نهائي قدره 60 ميكرولتر لكل بئر.
- احتضان الخلايا عند 37 درجة مئوية في حاضنة رطبة مع 5٪ CO2.
- في اليوم التالي ، استبدل الوسط ب 100 ميكرولتر من الوسط الكامل الخالي من الفينول الأحمر الطازج.
- استبدل الوسط كل يومين ب 100 ميكرولتر من الوسط الكامل الخالي من الفينول الأحمر الطازج.
- تمييع الخلايا في وسط كامل خال من الفينول الأحمر.
3. تلطيخ التألق المناعي للكرويات
ملاحظة: تم تكييف هذا البروتوكول من نورنبرغ وآخرون، 202015. وتستند هذه التعديلات في المقام الأول إلى حقيقة أن الكرويات الموصوفة في هذا البروتوكول أصغر من تلك المستخدمة في عمل نورنبرغ وآخرون15 ، وعلى هذا النحو، تسهل أوقات حضانة أقصر. على سبيل المثال ، يتم تقليل أوقات الحظر من 2 ساعة إلى 1 ساعة. بالإضافة إلى ذلك ، نظرا لأن البروتوكول مصمم لإنتاج الكرويات عالية الإنتاجية ، يتم تنفيذ جميع خطوات المعالجة في البئر التي يتم فيها استزراع الكرويات ، مما يعني أن نقل الكرويات الفردية إلى أنابيب غير مطلوب.
- إعداد جميع الحلول والمخازن المؤقتة اللازمة للتثبيت والتلطيخ
- تحضير محلول ملحي مخزن مؤقتا بالفوسفات (PBS) عن طريق إضافة 1 قرص PBS لكل 200 مل من الماء. الأوتوكلاف PBS.
- تحضير بارافورمالديهايد (PFA) باتباع الخطوات 3.1.3-3.1.4.
- استخدم مقلي ساخن لتسخين 400 مل من PBS إلى 60-70 درجة مئوية في غطاء الدخان. أضف 15 جم من PFA أثناء التحريك. بمجرد ذوبان PFA ، أضف 50 ميكرولتر من 1 M CaCl2 و 50 ميكرولتر من 1 M MgCl2.
- أضف 100 مل من PBS لإنشاء حجم نهائي يبلغ 500 مل. استخدم NaOH لموازنة PFA إلى الرقم الهيدروجيني 7.4. قم بتصفية PFA من خلال مرشحات فراغ معقمة (حجم المسام 0.22 ميكرومتر) ، أليكوت ، وتخزينها عند -20 درجة مئوية.
- تحضير محلول مخزون جليكاين 1 م بإضافة 3.75 جم من الجلايسين إلى 50 مل من PBS. يخزن على درجة حرارة 4 درجات مئوية.
- قم بإعداد 5 مل من المخزن المؤقت للنفاذية عن طريق إضافة 100 ميكرولتر من Triton X-100 و 1 مل من ثنائي ميثيل سلفوكسيد (DMSO) و 1.5 مل من 1 M glycine إلى 2.4 مل من PBS. يخزن في 4 درجات مئوية لمدة لا تزيد عن 2 أسابيع.
- قم بإعداد 5 مل من المخزن المؤقت للحجب عن طريق إضافة 100 ميكرولتر من Triton X-100 و 0.5 مل من DMSO و 0.05 جم من ألبومين مصل البقر (BSA) إلى 4.9 مل من PBS. Aliquot المخزن المؤقت المانع في أنابيب 1.5 مل وتخزينها في -20 درجة مئوية.
- تحضير 5 مل من المخزن المؤقت لحضانة الأجسام المضادة عن طريق إضافة 10 ميكرولتر من بوليسوربات 20 ، 0.05 غرام من BSA ، و 250 ميكرولتر من DMSO إلى 4.74 مل من PBS. Aliquot المخزن المؤقت لحضانة الأجسام المضادة في أنابيب 1.5 مل وتخزينها في -20 درجة مئوية.
ملاحظة: في البروتوكول الموصوف هنا ، يتم تجميع الكرويات فقط في 60 بئرا داخلية من صفيحة 96 بئرا ، على الرغم من أنه يمكن تحضيرها في جميع آبار اللوحة البالغ عددها 96 بئرا. السبب في إعداد الكرويات فقط في الآبار الداخلية 60 هو أن بعض العدسات الموضوعية ذات الفتحة العددية العالية غير قادرة على أن تكون قادرة جسديا على تصوير البئر بالكامل للآبار الخارجية بسبب "التنورة" على بعض أنواع اللوحات. الكميات المذكورة أعلاه كافية لإعداد 60 بئرا تحتوي على كرويات.
- إصلاح وتخلل الكرويات
- قم بإزالة الوسط بعناية من الكرويات ، مما يضمن عدم إزعاج طبقة المواد السفلية ECM.
- اغسل الكرويات مرتين باستخدام 70 ميكرولتر من PBS لمدة 3 دقائق في كل مرة.
- إصلاح الكروية مع 70 ميكرولتر من 3٪ PFA لمدة 1 ساعة عند 37 درجة مئوية.
- اغسل الكرويات مرتين باستخدام 70 ميكرولتر من PBS لمدة 3 دقائق في كل مرة.
- يروي بمحلول جليسين سعة 70 ميكرولتر من 0.5 متر لمدة 30 دقيقة عند 37 درجة مئوية.
- تخلل الكرويات باستخدام 70 ميكرولتر من المخزن المؤقت للنفاذية لمدة 30 دقيقة في RT.
- اغسل الكرويات مرتين باستخدام 70 ميكرولتر من PBS لمدة 3 دقائق في كل مرة.
- احتضان الكرويات في 70 ميكرولتر من المخزن المؤقت المانع لمدة 1 ساعة عند 37 درجة مئوية.
ملاحظة: بمجرد إصلاح الكرويات، يمكن تنفيذ جميع خطوات المعالجة اللاحقة باستخدام ماصة ذات 8 قنوات، أو رأس سحب 96 بئرا، إن وجد. هذا يزيد من سرعة التحضير الكروي قبل التصوير.
- كرويات البقع المناعية باستخدام الأجسام المضادة الأولية والثانوية
- قم بتخفيف الجسم المضاد الأساسي إلى تخفيف مناسب في مخزن حضانة الأجسام المضادة وإضافة 70 ميكرولتر إلى كل بئر. احتضان الكرويات مع الجسم المضاد الأساسي بين عشية وضحاها.
ملاحظة: يعتمد التخفيف على الجسم المضاد المحدد المستخدم. في المثال الموضح هنا ، يتم تلطيخ الليزوسومات بالأجسام المضادة المضادة للفأر LAMP1 باستخدام تخفيف 1:500. - في اليوم التالي ، اغسل الكرويات 5 مرات ب 70 ميكرولتر من PBS لمدة 3 دقائق في كل مرة.
- قم بتخفيف الجسم المضاد الثانوي عند تخفيف 1:500 ، والفلويدين المترافق بالفلورسنت عند 1:500 ، و Hoechst 33342 (من مخزون 1 mg mL-1 ) عند 1:5000 في مخزن حضانة الأجسام المضادة المخزن المؤقت وإضافة 70 ميكرولتر إلى كل بئر. احتضان بين عشية وضحاها.
ملاحظة: يعتمد تخفيف الأجسام المضادة على الجسم المضاد المحدد المستخدم. يوصى باستخدام الأجسام المضادة الثانوية الممتزجة للغاية التي تظهر استقرارا ضوئيا عاليا وسطوعا عاليا. - في اليوم التالي ، اغسل الكرويات 5 مرات ب 70 ميكرولتر من PBS لمدة 3 دقائق في كل مرة.
ملاحظة: يمكن تخزين اللوحات لمدة تصل إلى أسبوعين في RT قبل التصوير ، طالما ظلت الكرويات مغطاة ب PBS.
- قم بتخفيف الجسم المضاد الأساسي إلى تخفيف مناسب في مخزن حضانة الأجسام المضادة وإضافة 70 ميكرولتر إلى كل بئر. احتضان الكرويات مع الجسم المضاد الأساسي بين عشية وضحاها.
4. الحصول على الصور وتحليل الكرويات
- الحصول على الصور
- أدخل الصفيحة المكونة من 96 بئرا التي تحتوي على كرويات في مجهر فحص عالي المحتوى متحد البؤرة.
- حدد أشعة الليزر المناسبة لإثارة الفلوروفورات المستخدمة.
- احصل على القنوات بالتتابع لتجنب الحديث المتبادل.
- صور الكرويات باستخدام الأهداف المناسبة.
ملاحظة: يوصى باستخدام أهداف الغمر بالماء إن وجدت. على سبيل المثال ، يمكن لهدف 20x / 1.0 NA تصوير بئر كامل في حقول رؤية ~ 77. يمكن لهدف 63x / 1.15 NA تصوير بئر كامل في حوالي 826 مجال عرض. - صورة ~ 30-40 شريحة ، اعتمادا على عمق الكروية ، مع كل شريحة مأخوذة في فاصل زمني من 1.5 ميكرومتر من الشريحة السابقة.
- تحليل الصور
- للتحليل المورفولوجي للكرويات، اتبع الخطوات 4.2.2-4.2.6.
- قم بتقسيم الكرويات بناء على تلطيخ الفيلويدين المترافق مع الفلورسنت.
- قم بتقسيم النوى بناء على تلطيخ Hoechst 33342.
- قم بتقسيم السيتوبلازم لكل خلية بواسطة بقعة Hoechst 33342 المتبقية الموجودة في سيتوبلازم الخلية.
- حساب الخصائص المورفولوجية المختلفة للكرويات، بما في ذلك الحجم، ومساحة السطح، والكروية، وعدد النوى لكل كروية.
ملاحظة: يتم استخراج هذه المعلومات باستخدام خوارزميات مختلفة مضمنة في برنامج تحليل الصور الذي تختاره. - قم بمعالجة الصور بشكل أكبر لإزالة الكرويات الأصغر من 75000 ميكرومتر 3 والأكبر من 900000 ميكرومتر 3.
ملاحظة: هذه القيم هي اقتراحات للسماح بإزالة تجميعات الخلايا الصغيرة جدا والتجميعات الكبيرة التي ربما نشأت نتيجة لاندماج كرويات متعددة. يمكن أيضا تصنيف الكرويات إلى فئات مختلفة الحجم في هذه الخطوة. - لتحليل الخلايا المفردة داخل الكرويات، اتبع الخطوات 4.2.8-4.2.12.
- قم بتقسيم الكرويات بناء على تلطيخ الفيلويدين المترافق مع الفلورسنت.
- قم بتقسيم النوى بناء على تلطيخ Hoechst 33342.
- قم بتقسيم السيتوبلازم لكل خلية بواسطة بقعة Hoechst 33342 المتبقية الموجودة في سيتوبلازم الخلية.
- قسم الليزوسومات على أساس تلطيخ الأجسام المضادة الثانوية.
- احسب الخصائص المورفولوجية المختلفة للخلايا داخل كل كروية، بما في ذلك عدد الليزوسومات لكل خلية وحجم الخلية ومساحة سطح الخلية.
ملاحظة: يتم استخراج هذه المعلومات باستخدام خوارزميات مختلفة مضمنة في برنامج تحليل الصور الذي تختاره.
النتائج
في هذا البروتوكول ، يتم تفصيل طريقة قوية لإنتاج تجمعات زراعة الخلايا 3D في شكل كرويات ، باستخدام أنواع مختلفة من الخلايا لتمثيل أنسجة الورم المختلفة. تسمح هذه الطريقة بتوليد مئات الكرويات لكل بئر ، مما يتيح إجراء الفحوصات القائمة على الخلايا بطريقة عالية المحتوى (الشكل 1). وقد استخدم هذا النهج سابقا لدراسة امتصاص الجسيمات النانوية في الكرويات HT-2916 والسمية التي تسببها الجسيمات النانوية في الكرويات HepG217. تعتمد هذه الطريقة على إنتاج توزيع رقيق ومتساو لمواد السقالة عبر قاع البئر للوحة ذات جودة بصرية. يتم زرع الخلايا في كل بئر ، ويتم إضافة المزيد من مواد السقالة ، بتركيز منخفض ، كتراكب على الخلايا. ينتج عن ذلك قاعدة تدعم حتى نمو الكرويات ، مما يعني أنه يمكن استزراع عدة مئات من الكرويات في كل بئر من صفيحة 96 بئرا. يتم استخدام هدف التكبير المنخفض لإنشاء صورة عامة لجميع السكان (الشكل 2). يمكن بعد ذلك اختيار المناطق الفرعية من البئر وتصويرها باستخدام هدف عالي الدقة ، وفي كل موضع ، يتم الحصول على مكدس بؤري كامل. وهذا يوفر المعلومات اللازمة للتحليل الحجمي اللاحق لكل كروية.
يمكن بعد ذلك تحليل الكرويات الفردية بواسطة HCA ، وبالتالي توفير معلومات حول الخصائص المورفولوجية للكرويات. عادة ما تكون الخطوة الأولى هي تحديد كل كروي ككائن واحد. للقيام بذلك ، يتم اختيار قناة التألق التي من المحتمل أن تعطي تلطيخا أو توزيعا ثابتا في جميع أنحاء الكروية. في المثال الموضح هنا ، يتم استخدام الإشارة في قناة phalloidin المترافقة مع الفلورسنت ، حيث يوجد الأكتين بالقرب من غشاء البلازما في جميع الخلايا في الأنواع الكروية المختلفة (الشكل 2 والشكل 3A). نتيجة لتوليد مكدسات متحدة البؤرة كاملة ، يمكن تنفيذ جميع خطوات HCA بطريقة حجمية بدلا من على أساس شريحة تلو الأخرى. هذا مهم لأنه يزيل أي تحيز مرتبط بتحليل عدد صغير من الطائرات المختارة. ثم يتم تطبيق هذا النهج الحجمي على القنوات الأخرى في الصورة. تم اكتشاف النوى وتقسيمها بناء على تلطيخ Hoechst 33342 ، ويمكن استخدام هذه القناة نفسها للكشف عن سيتوبلازم الخلية ، حيث يوجد Hoechst 33342 المتبقي الموجود عند مستويات منخفضة (الشكل 3B). إذا كانت هناك حاجة إلى تحليل المصب للخلايا الفردية داخل الكروية ، فيمكن أيضا معالجة القنوات الأخرى (على سبيل المثال ، الليزوسومات الملطخة بالأجسام المضادة المضادة LAMP1) بطريقة مماثلة. يسمح النهج الحجمي بتصور جميع الهياكل ذات العلامات الفلورية من جميع وجهات النظر (الشكل 3C).
بعد تحديد الكروي ككائن متميز ، يمكن إجراء قياسات مورفولوجية مختلفة على المستوى الكروي. وتشمل هذه القياسات حساب عدد النوى لكل كروي (الشكل 4A)، فضلا عن كروية (الشكل 4B)، والحجم (الشكل 4C)، ومساحة السطح (الشكل 4D) من الكروية. اعتمادا على برنامج HCA المستخدم ، يمكن أيضا حساب الميزات المورفولوجية الأخرى مثل منطقة المقطع العرضي ونصف قطر القرص الداخلي ونصف قطر الكرة الداخلية. في الأمثلة الموضحة هنا ، تم التخلص من الكرويات التي تقل عن 75000 ميكرومتر 3 وما فوق 900000 ميكرومتر 3 من القياسات ، ولكن يمكن للمستخدم تعيين هذه المعلمات ، اعتمادا على الخصائص الكروية المطلوبة للتحليل. تم إنشاء جداول البيانات بواسطة برنامج تحليل الصور واستيرادها إلى RStudio للتحليل. تم إنتاج الرسوم البيانية Boxplot لعرض الخصائص المورفولوجية للأنواع المختلفة من الكرويات (الشكل 4). تكشف هذه المخططات الصندوقية عن مستوى عدم التجانس الكروي في السكان ، وهذا هو السبب في أنه من المهم تحديد عدد كبير من الكرويات في أي تجربة واحدة. هذه ميزة رئيسية على الطرق التي تولد كروية واحدة لكل بئر. تظهر الأنواع الكروية الثلاثة الموضحة هنا مستوى عاليا من التشابه فيما يتعلق بحجمها ومساحة سطحها ، على الرغم من أنه من الملاحظ أن كروية HepG2 كروية أقل إلى حد ما من الأنواع الأخرى الموضحة هنا (الشكل 4B).
يسمح تصوير الكرويات ذات الهدف عالي الدقة ، مثل هدف الغمر المائي 63x المستخدم هنا ، بتحقيق الدقة دون الخلوية للخلايا الفردية داخل الكروية. يمكن تقسيم العضيات المختلفة اعتمادا على الأجسام المضادة المستخدمة. في المثال الموضح هنا ، تم تحديد الليزوسومات بناء على التلطيخ المناعي باستخدام الأجسام المضادة المضادة LAMP1 ، تليها إضافة الأجسام المضادة الثانوية (الشكل 3C). ثم يسمح تجزئة كل عضية داخل كل خلية بتحديد كمية القياسات على مستوى الخلية. ويظهر الحجم النموذجي لكل خلية في الأنواع الكروية الثلاثة (الشكل 5A)، وكذلك عدد الليزوسومات لكل خلية (الشكل 5B). يتم تحديد الحاجة إلى مثل هذه التفاصيل دون الخلوية من خلال الفحص الذي سيتم فيه استخدام الكرويات.
يعد تحسين كثافة بذر الخلايا الأولية في بداية التوليد الكروي خطوة حاسمة. إضافة الكثير من الخلايا لا يزال يسمح بتكوين كروية. ومع ذلك ، يمكن أن يؤدي ذلك إلى اندماج الكرويات (الشكل 6). وهذا يؤدي إلى توليد تجمعات غير منتظمة الشكل، والتي بدورها يمكن أن تكون إشكالية للغاية لتحديد المصب للكرويات. عندما يتم تحديد الكرويات بشكل غير صحيح كهياكل متميزة ، يمكن أن تكون هناك أيضا مشاكل في تحليل الخلايا الفردية. على هذا النحو ، فإن التحسين الدقيق لكل خط خلية يستخدم لتوليد كروي ، بما في ذلك كثافة بذر الخلية وطول وقت النمو ، هي معلمات حاسمة لإنشائها.

الشكل 1: تفاصيل تخطيطية للبروتوكول المستخدم لتوليد الكرويات ل HCS و HCA . يتم طلاء لوحات 96-well بطبقة من مواد الطابق السفلي ECM ، تليها بذر الخلايا ، والتي تبدأ بعد ذلك في تكوين كروي. يتم استبدال الوسط في اليوم التالي وكل يومين بعد ذلك. استعدادا للتصوير ، يتم إصلاح الكرويات واختراقها ومناعيتها بأجسام مضادة محددة. ثم يتم تصوير الكرويات باستخدام مجهر HCS متحد البؤرة. رسم تم إنشاؤه باستخدام BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
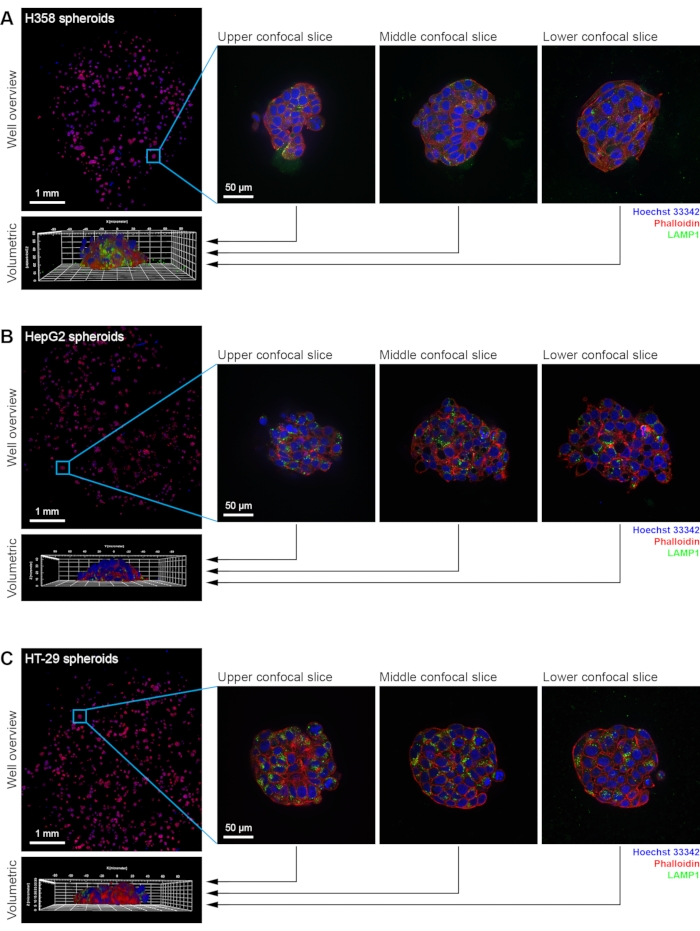
الشكل 2: أمثلة على صور كروية H358 و HepG2 و HT-29. التصوير البؤري HCS المؤتمت بالكامل ل (A) H358 و (B) HepG2 و (C) HT-29 الكروية. تعرض اللوحات نظرة عامة واحدة على البئر ، بالإضافة إلى ثلاثة أمثلة على شرائح متحدة البؤرة وإعادة البناء الحجمي لكووي واحد من كل خط خلية. تظهر النوى الملطخة ب Hoechst 33342 باللون الأزرق ، والأكتين الملطخ بالفلويدين المترافق بالفلورسنت باللون الأحمر ، والليزوسومات الملطخة بالمناعة ل LAMP1 باللون الأخضر. تم الحصول على صور لنظرة عامة على البئر بهدف غمر الماء 20x (NA 1.0). تم الحصول على صور للكرويات الفردية بهدف غمر الماء 63x (NA 1.15). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
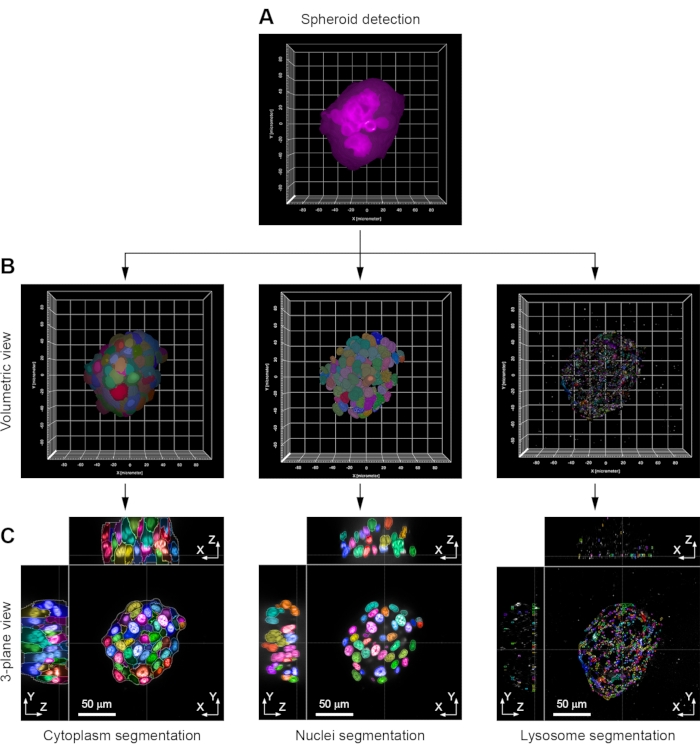
الشكل 3: مثال على الخطوات الرئيسية في تحليل الصور. (أ) يتم تحديد كل كروي لأول مرة في الوضع الحجمي عن طريق الكشف عن تلطيخ الفيلويدين المترافق مع الفلورسنت. (ب) باستخدام هذه المعلومات كقناع ، يتم تقسيم السيتوبلازم لكل خلية بواسطة بقعة Hoechst 33342 المتبقية الموجودة في سيتوبلازم الخلية. يتم تقسيم النوى بواسطة وصمة Hoechst 33342. يتم تقسيم الليزوسومات باستخدام الجسم المضاد (anti-LAMP1) المناعي. يتم عرض طرق العرض الحجمية. (ج) مناظر من 3 مستويات لنفس الكروية. المثال الموضح هو خلية كروية H358. تم الحصول على الصور بهدف غمر الماء 63x (NA 1.15) يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
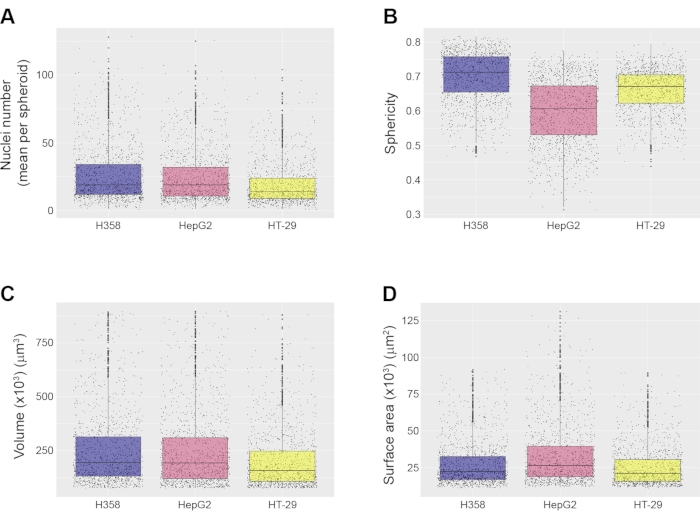
الشكل 4: أمثلة على القياسات على المستوى الكروي. تم إجراء جميع القياسات باستخدام خط أنابيب آلي لتحليل الصور ، وبالنسبة لثلاثة أنواع من الكرويات ، وهي H358 و HepG2 و HT-29 ، تم تصويرها بهدف 20x. يظهر (A) متوسط عدد النوى لكل كروية، (B) كروية كروية، (C) حجم كروي، و (D) مساحة السطح الكروي. تظهر جميع مخططات الصناديق القيمة الوسيطة والأرباع لكل نوع كروي. البيانات من 3 آبار مكررة. كان العدد الإجمالي للكرويات التي تم تحليلها 1259 (H358) و 1522 (HepG2) و 1326 (HT-29). تم الحصول على الصور بهدف الغمر بالماء 20x (NA 1.0). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: أمثلة على قياسات مستوى الخلية من الكرويات. تم إجراء جميع القياسات باستخدام خط أنابيب تحليل الصور الآلي ، وبالنسبة لثلاثة أنواع من الكرويات ، وهي H358 و HepG2 و HT-29 ، تم تصويرها بهدف 63x. يظهر (A) أحجام الخلايا الفردية ، و (B) متوسط أعداد الليزوسومات لكل خلية. كان العدد الإجمالي للخلايا التي تم تحليلها 1410 (H358) و 1625 (HepG2) و 1401 (HT-29) ، من 20 كروية من كل خط خلية. تم الحصول على الصور بهدف غمر الماء 63x (NA 1.15) يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: أمثلة على الصور التي تظهر آثار الإفراط في طلاء الخلايا على تكوين كروي. يتم عرض أمثلة على الصور للكرويات H358 و HepG2 و HT-29. تشير الأسهم إلى الأماكن التي من المحتمل أن تكون فيها الكرويات قد اندمجت. تم الحصول على الصور بهدف الغمر بالماء 20x (NA 1.0). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يفصل النهج الموصوف هنا منصة لتوليد عدة مئات من الكرويات لكل بئر بطريقة مناسبة ل HCS و HCA. بالمقارنة مع الطرق الشائعة الأخرى ، مثل استخدام لوحات ULA ذات القاع المسطح والدائري القاع ، والتي تسمح بتكوين كروي واحد فقط لكل بئر18,19 ، توفر هذه الطريقة الفرصة لاستخراج معلومات عالية الدقة من أعداد كبيرة من الكرويات في شكل فحص. والجدير بالذكر أن هذه الطريقة قد تم إثباتها في 3 خطوط خلايا مختلفة ، تمثل أنواعا مختلفة من الأورام ، مما يسلط الضوء على ملاءمتها الواسعة لدراسة مجموعة من العمليات الخلوية في نماذج مختلفة. على الرغم من أن الكرويات التي تم إنشاؤها باستخدام هذه الطريقة تظهر بعض التباين في الحجم والشكل ، إلا أن HCA يمكنها بسهولة تصنيفها حسب الحجم (أو أي معلمات أخرى ذات أهمية). وقد استخدم مختبرنا بنجاح هذا النهج لدراسة السمية التي تسببها الجسيمات النانوية كدالة للحجم الكروي. والأهم من ذلك، يمكن دراسة جميع فئات الأحجام المختلفة من الكرويات في نفس البئر، مما يعني أن جميعها تعرضت لعلاجات متطابقة، مما يعطي مخرجات قوية للغاية من مجموعة كروية كبيرة17. يمكن بسهولة تكييف المنهجية الموصوفة هنا لاستخدامها مع أنواع الخلايا الأخرى التي تمثل أنسجة مختلفة. وبالإضافة إلى ذلك، يمكن استخدام هذه الكرويات لتقييم العمليات البيولوجية المختلفة14. إذا تم إنشاء الكرويات مع خلايا تعبر بثبات عن البروتينات الموسومة بالفلورسنت ، فإن تصوير الخلايا الحية ممكن أيضا.
تتمثل إحدى الخطوات الحاسمة في هذا البروتوكول في إنتاج طبقة المواد السفلية ECM التي يتم طلاء الخلايا عليها. عندما تكون الطبقة سميكة جدا ، يمكن أن تشكل غضروفا مفصليا20 يعزز نمو الطبقات الأحادية في وسط البئر وكرويات فقط عند الحواف الخارجية للبئر. لذلك ، من الضروري اختيار التركيز والحجم الصحيحين لمواد الطابق السفلي ECM للسماح بتكوين كروي موحد في جميع أنحاء البئر ؛ هذا هو دائما خط الخلية المعتمدة. ومن الجدير بالذكر أيضا أن المواد السفلية ECM الزائدة يمكن أن تسبب مشاكل أثناء عملية تلطيخ المناعة ، حيث لا يتم إذابتها بسهولة. وهذا بدوره يمكن أن يؤدي إلى مضاعفات أثناء الحصول على الصور عند استخدام نظام المجهر البؤري HCS. أحد الاعتبارات الأخرى هو أن خطوط الخلايا المختلفة يمكن أن تتطلب تركيبات ECM مختلفة. على سبيل المثال ، تتطلب الكرويات HepG2 مواد قبو ECM مع تركيز منخفض من عوامل النمو ، مقارنة بتلك المستخدمة من قبل H358 و HT-29 الكروية. طريقة طلاء الخلايا مهمة أيضا ، لأن هذا يحدد كيفية توزيع الخلايا في البئر. عندما يتم زرع عدد كبير جدا من الخلايا أو عندما يتم توزيعها بشكل سيئ ، يمكن أن يؤدي ذلك إلى اندماج كروي (الشكل 6). أحد التحديات الأخرى لاستخدام سقالات ECM هو أنه يجب التعامل معها في درجات حرارة منخفضة (أقل من 10 درجات مئوية) ، وهو أمر إشكالي بشكل خاص عند استخدام الأتمتة ل HCS. ومع ذلك ، تم حل هذه المشكلة مؤخرا من قبل Eismann وزملاؤه (2020) ، الذين استخدموا تقنية microarray لاكتشاف قطرات 0.2 ميكرولتر من مواد الطابق السفلي ECM والخلايا في شرائح غرفة. كانت هذه مادة كافية لتسهيل نمو الكرويات الصغيرة21. ولا يزال يتعين إثبات ما إذا كان هذا النهج سيعمل أيضا على طلاء كميات أكبر من مواد الطابق السفلي لإدارة المحتوى في المؤسسة في آبار من الصفائح المتعددة الآبار.
إحدى المشكلات المرتبطة بتحليل نماذج الخلايا 3D باستخدام الفحص المجهري هي القدرة على استخراج المعلومات من المستويات المركزية لهذه التجميعات. في هذا الصدد ، يمكن أن يكون التخلل والوصول إلى الأجسام المضادة أثناء عملية تلطيخ المناعة مشكلة. ومع ذلك، فإن البروتوكول الذي نشره نورنبرغ وزملاؤه15 يتيح تلطيخا مناعيا متسقا للغاية للكروي بأكمله. باستخدام تعديلات طفيفة على هذا البروتوكول ، يمكن لهذه التقنية أن تصبغ حتى الهياكل تحت الخلوية الصغيرة (على سبيل المثال ، الليزوسومات) ، بدرجة عالية من الاتساق ، بغض النظر عما إذا كانت الخلايا مركزية أو هامشية فيما يتعلق بالبنية الكروية الشاملة. من المهم أن يتم تحسين هذه الخطوة بعناية عند استخدام أجسام مضادة جديدة.
خطوة حاسمة أخرى هي نظام التصوير المختار. يعد تصوير العدد المناسب من شرائح z عبر الكروية أمرا مهما ، لأن هذا يحدد حجم البيانات التي تحتاج إلى تحليل وتخزين. على سبيل المثال، يمكن أن يؤدي تصوير عدد محدود من الطائرات على شكل حرف z في فترة زمنية كبيرة جدا إلى التقليل من شأن الحجم والحجم الكروي الكلي. من ناحية أخرى ، يمكن أن يؤدي التقاط عدد كبير جدا من طائرات z إلى مشاكل في تحليل البيانات وتخزينها. تتطلب مجموعات البيانات الكبيرة جدا أيضا طاقة حسابية أكثر كثافة لتحليلها ، خاصة في الوضع الحجمي. تملي خصائص العدسة الموضوعية إلى حد كبير الفاصل الزمني الأمثل لأخذ العينات في المستوى z ، ولكن بالنسبة للأمثلة الموضحة هنا ، هناك حاجة إلى حوالي 40 شريحة متحدة البؤرة بفاصل زمني قدره 1.5 ميكرومتر لتسهيل التصوير عبر عمق الكروي بأكمله.
كما ذكرنا ، من أجل الحد من التحيز من تحليل الطائرات المختارة ، يوصى بشدة باستخدام نهج تحليل الصور القائم على الحجم. وهذا لا يسمح فقط باستخراج المعلومات على مستوى كروي ولكن أيضا باستخراج البيانات على مستوى الخلية من كل كروي على حدة. في نهاية المطاف، يجب تصميم خطوط أنابيب HCA بطريقة تعالج السؤال البيولوجي المحدد المطروح. تمكن المخرجات متعددة المعلمات من وصف الأنماط الظاهرية المعقدة كميا. وقد ثبت أن هذا يعمل مع مجموعات الخلايا ثلاثية الأبعاد باستخدام برنامج HCA التجاري 16,17 ، بالإضافة إلى برامج يمكن الوصول إليها بحرية مثل CellProfiler22,23. طرق التحليل الحجمي لديها القدرة على تطبيقها على أنواع أخرى من نماذج الخلايا 3D ، مثل المواد العضوية و explants المشتقة من المريض خارج الجسم الحي (PDEs) ، والتي تتكاثر بشكل أفضل في ظروف الجسم الحي. في الآونة الأخيرة ، تم وصف خط أنابيب عالي الإنتاجية لإنتاج المواد العضوية في الدماغ24. وهذا ينطوي على توليد المواد العضوية في صفيحة من 96 بئرا ومن ثم تصويرها باستخدام مجهر فحص عالي المحتوى24. تعتبر PDEs مفيدة للغاية من حيث أنها تعرض الأنسجة الأصلية من الورم ، وبالتالي توفر نموذجا للخلية يلخص في ظروف الجسم الحي ، بما في ذلك ميزات مثل البيئة الدقيقة للورم25. يمكن أيضا لهذه النماذج ، من حيث المبدأ ، أن تكون ملطخة بالمناعة وتصويرها وتحليلها باستخدام النهج الموضح هنا26،27.
باختصار ، يصف هذا البروتوكول طريقة قوية ويمكن الوصول إليها لإنتاج الكرويات على نطاق واسع لتطبيقات HCS و HCA. تظهر قابليته للتطبيق مع ثلاثة خطوط خلوية مختلفة ، مما ينتج كرويات يمكن تصويرها بدقة عالية. يوضح هذا البروتوكول أيضا أن التحليل الحجمي يمكن أن يوفر معلومات كمية عن السكان الكرويين ، وكذلك على مستوى الخلية الواحدة وتحت الخلية ، مما يجعله مفيدا لمجموعة واسعة من المقاييس.
Disclosures
يعلن المؤلفون أنه لا توجد مصالح متنافسة مرتبطة بهذا العمل.
Acknowledgements
يعترف المؤلفون بدعم منحة أبحاث البنية التحتية من مؤسسة العلوم الأيرلندية (SFI) (16/RI/3745) إلى JCS. يتم دعم العمل في مختبر فحص الخلايا UCD من قبل كلية UCD للعلوم. يتم تمويل ASC من قبل منحة الدراسات العليا التابعة لمجلس البحوث الأيرلندي (IRC) التابع لحكومة أيرلندا (GOIPG/2019/68). كما يشكر المؤلفون جميع أعضاء المختبر على مدخلاتهم ومناقشاتهم المفيدة. تم إنشاء العمل الفني في الشكل 1 في BioRender.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1x), phenol red | Gibco | 25300054 | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A6003 | |
| Calcium chloride | Fisher Scientific | 10050070 | |
| CellCarrier-96 Ultra Microplates, tissue culture treated, black, 96-well with lid | Perkin Elmer | 6055302 | These plates have been renamed as Phenoplates |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| Foetal Bovine Serum (FBS), qualified, EU approved, South America origin, heat inactivated | Gibco | 10500064 | |
| Glycine | Fisher Scientific | BP381-1 | |
| Goat anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Invitrogen | A-11029 | |
| L-Glutamine solution, 200 mM | Gibco | 25030024 | |
| Hoechst 33342 | Sigma Aldrich | 14533 | |
| Magnesium chloride | Fisher Scientific | 10647032 | |
| Matrigel Basement Membrane Matrix, Phenol Red-free, LDEV-free, 10 mL | Corning | 356237 | This Matrigel formulation can be also found with the same catalogue number at BD Biosciences |
| Matrigel Growth Factor Reduced Matrigel | BD Biosciences | 356231 | This Matrigel formulation can be also found with the same catalogue number at Corning |
| McCoy's 5A medium | Gibco | 26600023 | |
| McCoy's 5A medium with L glutamine and sodium bicarbonate, without phenol red | Hyclone | 10358633 | |
| Minimum Essential Medium (MEM) | Gibco | 21090022 | |
| Minimum Essential Medium (MEM), without glutamine, without phenol red | Gibco | 51200046 | |
| Mouse monoclonal anti-LAMP1 antibody (concentrate) | Developmental Studies Hybridoma Bank | H4A3-a | |
| Neubauer counting chamber | Hirschmann | 8100203 | |
| Nunclon tissue culture dish with lid, polystyrene, 92 mm x 17 mm | ThermoFisher Scientific | 150350 | |
| Opera Phenix HCS System and Harmony HCA software | Perkin Elmer | HCSHH14000000 | |
| Paraformaldehyde (PFA) | Sigma Aldrich | P6148 | |
| Phalloidin Alexa Fluor 568 | Invitrogen | A12380 | |
| Phosphate Buffered Saline (PBS) tablets | Sigma Aldrich | P4417 | |
| Polysorbate 20 | Sigma Aldrich | P5927 | |
| RPMI 1640 Medium, GlutaMAX Supplement | Gibco | 61870010 | |
| RPMI 1640 Medium, without glutamine, without phenol red | Gibco | 11835063 | |
| Triton X-100 | Sigma Aldrich | T9284 | |
| Stericup sterile vacuum filter units | Millipore | SCGVU05RE |
References
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33(2020).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6(2018).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay and Drug Development Technologies. 12 (4), 207-218 (2014).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Zhang, X., Jiang, T., Chen, D., Wang, Q., Zhang, L. W. Three-dimensional liver models: state of the art and their application for hepatotoxicity evaluation. Critical Reviews in Toxicology. 50 (4), 279-309 (2020).
- Dutta, D., Heo, I., Clevers, H. Disease modeling in stem cell-derived 3D organoid systems. Trends in Molecular Medicine. 23 (5), 393-410 (2017).
- Nunes, A. S., Barros, A. S., Costa, E. C., Moreira, A. F., Correia, I. J. 3D tumor spheroids as in vitro models to mimic in vivo human solid tumors resistance to therapeutic drugs. Biotechnology and Bioengineering. 116 (1), 206-226 (2019).
- Kleinman, H. K., Martin, G. R. Matrigel: Basement membrane matrix with biological activity. Seminars in Cancer Biology. 15, 378-386 (2005).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Foglietta, F., Canaparo, R., Muccioli, G., Terreno, E., Serpe, L. Methodological aspects and pharmacological applications of three-dimensional cancer cell cultures and organoids. Life Sciences. 254, 117784(2020).
- Bardsley, K., Deegan, A. J., El Haj, A., Yang, Y. Current state-of-the-art 3D tissue models and their compatibility with live-cell imaging. Advances in Experimental Medicine and Biology. 1035, 3-18 (2017).
- Darrigues, E., et al. Tracking gold nanorods' interaction with large 3D pancreatic-stromal tumor spheroids by multimodal imaging: Fluorescence, photoacoustic, and photothermal microscopies. Scientific Reports. 10 (1), 3362(2020).
- Boutros, M., Heigwer, F., Laufer, C. Microscopy-based high-content screening. Cell. 163 (6), 1314-1325 (2015).
- Mysior, M. M., Simpson, J. C. Cell3: A new vision for study of the endomembrane system in mammalian cells. Bioscience Reports. , (2021).
- Nürnberg, E., et al. Routine optical clearing of 3D-cell cultures: Simplicity forward. Frontiers in Molecular Biosciences. 7 (20), (2020).
- Cutrona, M. B., Simpson, J. C. A High-throughput automated confocal microscopy platform for quantitative phenotyping of nanoparticle uptake and transport in spheroids. Small. 15 (37), 1902033(2019).
- Kelly, S., Byrne, M. H., Quinn, S. J., Simpson, J. C. Multiparametric nanoparticle-induced toxicity readouts with single cell resolution in HepG2 multicellular tumour spheroids. Nanoscale. 13 (41), 17615-17628 (2021).
- Sirenko, O., Mitlo, T., Hesley, J., Luke, S., Owens, W., Cromwell, E. F. High-content assays for characterizing the viability and morphology of 3D cancer spheroid cultures. Assay and Drug Development Technologies. 13 (7), 402-414 (2015).
- Redondo-Castro, E., Cunningham, C. J., Miller, J., Cain, S. A., Allan, S. M., Pinteaux, E. Generation of human mesenchymal stem cell 3D spheroids using low-binding plates. Bio-protocol. 8 (16), (2018).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nature Methods. 4 (4), 359-365 (2007).
- Eismann, B., et al. Automated 3D light-sheet screening with high spatiotemporal resolution reveals mitotic phenotypes. Journal of Cell Science. 133 (11), 245043(2020).
- Alsehli, H., et al. An integrated pipeline for high-throughput screening and profiling of spheroids using simple live image analysis of frame to frame variations. Methods. 190, 33-43 (2021).
- Stirling, D. R., et al. CellProfiler 4: improvements in speed, utility and usability. BMC Bioinformatics. 22 (1), 1-11 (2021).
- Renner, H., et al. A fully automated high-throughput workflow for 3D-based chemical screening in human midbrain organoids. eLife. 9, 52904(2020).
- Powley, I. R., et al. Patient-derived explants (PDEs) as a powerful preclinical platform for anti-cancer drug and biomarker discovery. British Journal of Cancer. 122 (6), 735-744 (2020).
- Collins, A., Miles, G. J., Wood, J., MacFarlane, M., Pritchard, C., Moss, E. Patient-derived explants, xenografts and organoids: 3-dimensional patient-relevant preclinical models in endometrial cancer. Gynecologic Oncology. 156 (1), 251-259 (2020).
- Miles, G. J., et al. Evaluating and comparing immunostaining and computational methods for spatial profiling of drug response in patient-derived explants. Laboratory Investigation. 101 (3), 396-407 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.