Method Article
ハイコンテンツスクリーニングおよび分析アプリケーションのためのスフェロイドの大規模生産のための堅牢な方法
要約
このプロトコルは、大規模なハイコンテンツスクリーニングおよび分析に適した方法で3つの異なるタイプのスフェロイドを製造する方法を詳述する。さらに、回転楕円体および個々の細胞レベルでそれらをどのように分析できるかを示す例を提示する。
要約
ハイコンテントスクリーニング(HCS)およびハイコンテント分析(HCA)は、研究者が細胞から大規模な定量的表現型測定値を抽出する能力を提供する技術です。このアプローチは、細胞生物学における基本的な事象と応用事象の両方の幅広い理解を深めるのに強力であることが証明されています。今日まで、この技術の用途の大部分は単層で増殖した細胞の使用に依存してきましたが、そのようなモデルは組織で起こる相互作用やプロセスの多くを再現しないことがますます認識されています。そのため、スフェロイドやオルガノイドなどの3次元(3D)細胞アセンブリの開発と使用に出現しています。これらの3Dモデルは、がん生物学および薬物送達研究の文脈において特に強力であるが、HCSおよびHCAに適した再現可能な方法でのそれらの産生および解析は、多くの課題を提示する。ここで詳述するプロトコールは、多細胞腫瘍スフェロイド(MCTS)の生成のための方法を記載し、HCSおよびHCAと適合性のある様式で3つの異なる細胞株に適用できることを実証する。この方法は、ウェル当たり数百個のスフェロイドの産生を容易にし、スクリーニングレジームにおいて使用される場合、ウェル当たり数百個の構造からデータを得ることができ、全て同一の方法で処理され得るという特定の利点を提供する。また、高解像度蛍光イメージングのためにスフェロイドを処理する方法や、HCAがスフェロイドレベルと各スフェロイド内の個々の細胞の両方から定量的特徴を抽出する方法を詳述する例も提供されています。このプロトコルは、細胞生物学における幅広い重要な質問に答えるために容易に適用することができます。
概要
伝統的に、細胞ベースのアッセイは、固体基質上に成長する単層において行われており、これは効果的に2次元(2D)環境と考えることができる。しかし、2D細胞培養モデルは、いくつかの文脈では生理学的関連性を欠いており、細胞間で起こる複雑な相互作用の多くを再現できないことがますます認識されつつあります1。3次元(3D)細胞培養法は研究者の間で急速に普及しており、3D細胞モデルは、組織環境内の細胞が遭遇する生理学的条件をよりよく模倣する高い可能性を示しています2。採用されている3Dセルアセンブリにはいくつかの異なるタイプがありますが、最も一般的な2つのタイプは回転楕円体とオルガノイドです。スフェロイドは、多くの異なる細胞株から増殖させることができ、使用する細胞型およびそれらの組み立て方法に応じて様々な形状およびサイズを採用することができる3。さらに、スフェロイドは、癌細胞株から増殖させる場合、多細胞腫瘍スフェロイド(MCTS)と呼ばれることもあり、これらのモデルは、前臨床のインビトロ薬物送達および毒性研究に特に使用されることを見出している4,5。一方、オルガノイドは、私たちの体の組織や臓器をよりよく模倣することを目指しており、より複雑な形態学的配置を採用することができます。オルガノイドの産生は、成体幹細胞または多能性幹細胞の使用を含み、これは、目的の組織または器官に類似するように適切な細胞に再プログラムされ得る。これらは主に臓器の発達を調査し、疾患や宿主と病原体の相互作用をモデル化するために使用されます6。
3Dセルアセンブリを生成するために使用されるさまざまな方法があります。足場ベースの方法は、細胞が内部で付着または増殖することができる基質または支持体を提供する。これらの足場は、様々な形状を有することができ、様々な異なる材料から作製することができる。最も一般的なのは細胞外マトリックス(ECM)成分とヒドロゲルであり、それらは細胞の自然な細胞外環境に似せ、それによって生理学的相互作用を促進するように設計されています4,7。ECM地下材料は、エンゲルブレス・ホルム・スウォームマウス肉腫腫瘍から抽出され、ラミニン、IV型コラーゲン、およびペルレカン8を含むECM成分の豊富な混合物を含有することが示された。しかしながら、その有利な組成にもかかわらず、その使用には2つの主な課題、すなわちそのバッチ間の変動性および10°C以下および10°C以上の2つの異なる凝集状態を有する8,9がある。対照的に、ヒドロゲルは、その成分および剛性に関して柔軟であるという利点を有し、そしてそれらは、所望の特定の3D細胞集合体に合うようにカスタマイズすることができる7,10。足場ベースの方法は、オルガノイドの成長に不可欠であるが、回転楕円体にも広く使用されている。足場のない方法は、細胞が成長している表面に細胞が付着するのを防ぐことによって機能しますが、通常は回転楕円体アセンブリとのみ互換性があります。例としては、細胞をスフェロイドに凝集させる平底またはU底のいずれかを備えた超低接着(ULA)プレート、またはスピナー/回転フラスコ内の細胞の連続攪拌の使用が含まれます10。
多種多様な生物学的事象を研究するための3D細胞アセンブリの使用は、急速に人気を集めています。しかし、彼らの培養のために選択された方法が適切であり、下流分析の計画と互換性があることが不可欠です。例えば、ULAプレートを使用すると、高い一貫性の回転楕円体が生成されます。しかし、この方法はウェルあたり単一の回転楕円体の生産に制限されているため、スループットが制限されます。3D構造の蛍光イメージングが計画される際には、特に考慮が必要である。アセンブリが成長させる基板またはプレートは光学的に互換性がある必要があり、使用された可能性のある足場によって引き起こされる光散乱の影響を最小限に抑えるように注意する必要があります11。この特定の問題は、顕微鏡対物レンズの開口数が増加するにつれてより深刻になる。
おそらく、3D細胞モデルを使用することを選んだ主な理由の1つは、アセンブリ全体だけでなく、その中の個々のセルに関する体積イメージングデータを抽出することです。特にMCTSモデルは、治療薬が外部から中枢細胞にどのように移行するか(腫瘍内で必要なように)12の理解を深めるために非常に強力であることが証明され始めているため、異なる層の個々の細胞から知識を得ることが不可欠です。個々の細胞から定量的情報を抽出するイメージング技術は、ハイコンテンツ分析(HCA)と呼ばれ、スクリーニングの文脈において強力なアプローチです13。今日まで、HCAはほぼ独占的に単層培養に適用されてきましたが、このアプローチは幅広い細胞機能とプロセスを研究できる3D培養に適用する力を持っているという認識が高まっています14。多数の3Dアセンブリを解析でき、各構造全体からセルレベルのデータを提供できるという明確な利点があります。しかし、潜在的に厚い細胞集合体のイメージングに関連する課題、および生成される大規模なデータセットは、克服する必要があります。
この記事では、96ウェルフォーマットのMCTSの大規模生産のための堅牢な足場ベースの方法を紹介します。この方法は、各ウェルにおける数百の3D細胞集合体の製造を容易にする。3つの異なる細胞型について例を示し、肝臓、肺、および結腸の固形腫瘍モデルを表す。形成される回転楕円体は様々なサイズであり得るので、HCAは特定のサイズおよび/または形態の構造を選択するために使用される。この特徴は、観察された表現型を異なるサイズの回転楕円体間で比較することができるが、すべて同じウェル内で同じ方法で処理されるという追加の利点を提供する。このアプローチは高解像度イメージングと互換性があり、重要なことに、同じ細胞集合体から細胞レベルと細胞下レベルの両方の定量データを提供します。このスフェロイド生産方法は、ウェルごとに単一のスフェロイドを生成する方法よりもさらに利点があり、各ウェルで生産される多数のスフェロイドは、トランスクリプトームやプロテオームプロファイリングなどの他の下流分析に十分なバイオマスを提供する可能性があります。
プロトコル
1. 細胞培養
- メディアの準備
- 細胞株の種類に応じて特定の細胞培養培地を調製する。細胞維持のためのすべての培地に10%の胎児ウシ血清(FBS)が含まれていることを確認してください。
注:異なる細胞株は異なる培地を使用する。HT−29結腸癌細胞(ATCC HTB−38)は、マッコイズ5A+10%FBS中で増殖される。HepG2肝細胞癌細胞(ATCC HB-8065)は、最小必須培地+ 1%L-グルタミン+ 10%FBSで増殖させる。H358気管支肺胞癌細胞(ATCC CRL-5807)をRPMI 1640培地+1%L-グルタミン+10%FBS中で増殖させる。L-グルタミンおよびFBSを含むすべての培地は、完全培地と呼ばれる。細胞をスフェロイドとして増殖させるようにプレーティングする場合、ECM地下材料の着色を避けるために、10%FBSを含むフェノールレッドフリー培地が必要であり、その結果、イメージングプロセス中にアーチファクトが発生する可能性があります。
- 細胞株の種類に応じて特定の細胞培養培地を調製する。細胞維持のためのすべての培地に10%の胎児ウシ血清(FBS)が含まれていることを確認してください。
- 継代培養細胞
- 細胞が約80%コンフルエントになったら、2mLのトリプシン-EDTA(0.25%(w/v)トリプシン/0.53mM EDTA)で短時間洗浄します。トリプシン-EDTAを吸引し、3mLの新鮮なトリプシン-EDTAを加え、37°Cで3〜5分間インキュベートする。
- 細胞が細胞培養皿から剥離したら、7mLの新鮮な完全培地を加える。
- 新しい10cm細胞培養皿に1mLの細胞懸濁液をピペットし、9mLの新鮮な完全培地を加えて、細胞の1:10希釈液を得た。
- 細胞を5%CO2の加湿インキュベーター内で37°Cで培養する。
- 細胞株に応じて3〜5日ごとに細胞を継代培養する。
2. 回転楕円体の生成
- 96ウェルプレートをECM地下室材料でコーティングする
- ECMの地下室の材料を氷の上で一晩解凍する。
- ECM地下室材料を冷フェノールレッドフリー無血清培地で希釈し、-20°Cに保持した予めチルドチップを使用する。
注:ECM地下材料の最終濃度は、使用される細胞株に依存する。HT-29 および H358 細胞の場合は、4 mg·mL-1 の ECM 地下室材料を使用します。HepG2細胞の場合、4mg・mL-1 の還元成長因子ECM地下材料を使用する。 - ECM地下材料/培地溶液15 μLを96ウェルイメージングプレートにピペットで注入します。
注:大規模な回転楕円体生産の場合、ECM地下室材料を含むチップとリザーバが冷却されている限り、このステップは8チャンネルピペットと96チャンネルピペッティングヘッドの両方で実行できます。 - プレートを4°Cで91 x g で20分間遠心分離します。
- プレートを37°Cで30分以内にインキュベートする。
- 継代培養および細胞のカウント
- プレートインキュベーション期間中、細胞をトリプシン-EDTAでインキュベートし、10%FBSを含む完全培地に再懸濁する。
- 細胞懸濁液10 μLを血球計数計数チャンバーにピペットで入れた。チャンバーの4象限内の細胞数をカウントする。
- 4象限内の平均細胞数を決定することによって、細胞懸濁液内の細胞数を計算する。
メモ: 自動セルカウントデバイスを使用してセルをカウントすることもできます。 - 細胞を135 x g で室温(RT)で4分間遠心分離する。
- 細胞がペレット化されたら、上清を吸引し、フェノールレッドを含まない完全培地に細胞を再懸濁して、mLあたり1 x 106 細胞の濃度を得る。
- ECM地下材料コーティングプレートに細胞をシードする
- フェノールレッドを含まない完全培地で細胞を希釈する。
注:播種される細胞の密度は、使用される細胞株に依存する。HT-29およびHepG2細胞の場合、ウェルあたり3 x 104 細胞を播種する。H358細胞の場合、1ウェルあたり4 x 104 細胞を播種する。 - 細胞を1ウェルあたり35μLの総容量で播種する。必ず円を描くようにドロップワイズで追加してください。
注:大規模な回転楕円体生産の場合、ピペッティング円運動を達成できる限り、このステップは8チャンネルピペットで実行できます。 - 細胞を5%CO2で加湿したインキュベーター内で37°Cで1時間インキュベートする。
- フェノールレッドを含まない完全培地中のECM地下材料の溶液を調製し、これはウェル中の2%ECM地下材料の最終濃度をもたらす。これを達成するために、1ウェルあたり23.8μLのフェノールレッドフリー完全培地に1.2μLのECM地下材料を添加し、1ウェルあたり60μLの最終容量をもたらす。
- 細胞を5%CO2で加湿インキュベーター内で37°Cでインキュベートする。
- 翌日、培地を100μLの新鮮なフェノールレッドフリー完全培地と交換する。
- 2日ごとに培地を100μLの新鮮なフェノールレッドフリー完全培地と交換してください。
- フェノールレッドを含まない完全培地で細胞を希釈する。
3. スフェロイドの免疫蛍光染色
注:このプロトコルは、Nürnberg et al., 202015から適応されています。これらの適応は、主に、このプロトコルに記載されている回転楕円体がNürnbergらの研究15 で使用されているものよりも小さく、したがって、より短いインキュベーション時間を促進するという事実に基づいている。たとえば、ブロック時間は 2 時間から 1 時間に短縮されます。さらに、このプロトコルはスフェロイドのハイスループット生産のために設計されているため、すべての処理ステップはスフェロイドが培養されるウェルで行われ、個々のスフェロイドをチューブに移す必要はありません。
- 固定と染色に必要なすべての溶液とバッファーを準備する
- 水200mLあたり1PBS錠剤を加えてリン酸緩衝生理食塩水(PBS)を調製する。PBSをオートクレーブする。
- パラホルムアルデヒド(PFA)をステップ3.1.3-3.1.4に従って調製する。
- 加熱攪拌機を使用して、400mLのPBSをヒュームフード内で60〜70°Cに加熱する。攪拌しながらPFAを15g加える。PFA が溶解したら、50 μL の 1 M CaCl2 および 50 μL の 1 M MgCl2 を追加します。
- 100mLのPBSを加えて、500mLの最終容量を作る。NaOHを使用してPFAをpH7.4に平衡化します。PFAを滅菌真空フィルター(孔径0.22 μm)でろ過し、アリコートし、-20°Cで保存した。
- 50 mLのPBSに3.75 gのグリシンを加えて1 Mグリシン原液を調製した。4°Cで保存してください。
- 2.4 mLのPBSに100 μLのTriton X-100、1 mLのジメチルスルホキシド(DMSO)および1.5 mLの1 Mグリシンを加えて、5 mLの透過処理バッファーを調製する。4°Cで2週間以内に保管してください。
- 4.9 mLのPBSに100 μLのTriton X-100、0.5 mLのDMSOおよび0.05 gのウシ血清アルブミン(BSA)を加えて、5 mLのブロッキングバッファーを調製する。ブロッキングバッファーを 1.5 mL チューブにアリコートし、-20 °C で保存します。
- 4.74 mL の PBS に 10 μL のポリソルベート 20、0.05 g の BSA、および 250 μL の DMSO を加えて、5 mL の抗体インキュベーションバッファーを調製します。抗体インキュベーションバッファーを 1.5 mL チューブにアリコートし、-20 °C で保存します。
注:ここで説明するプロトコルでは、スフェロイドは96ウェルプレートの内部60ウェルにのみ組み立てられますが、プレートの96ウェルすべてで調製できます。内側の60個のウェルにスフェロイドのみを準備する理由は、一部の高開口数対物レンズは、一部のプレートタイプの「スカート」のために外側のウェル全体を物理的に撮像することができないためです。上記の容量は、スフェロイドを含む60ウェルの調製に十分である。
- 回転楕円体の修正と透過
- 回転楕円体から媒体を慎重に取り除き、ECM地下材料層が乱れていないことを確認します。
- スフェロイドを70 μLのPBSで2回、毎回3分間洗浄します。
- スフェロイドを70 μLの3%PFAで37°Cで1時間固定します。
- スフェロイドを70 μLのPBSで2回、毎回3分間洗浄します。
- 70 μLの0.5 Mグリシン溶液で37°Cで30分間クエンチする。
- 70 μLの透過処理バッファーを使用して、RT で 30 分間スフェロイドを透過処理します。
- スフェロイドを70 μLのPBSで2回、毎回3分間洗浄します。
- スフェロイドを70 μLのブロッキングバッファー中で37°Cで1時間インキュベートします。
メモ: スフェロイドが固定されると、その後のすべての処理ステップは、8 チャンネルピペットまたは 96 ウェルピペッティングヘッド (使用可能な場合) を使用して実行できます。これにより、イメージング前の回転楕円体調製の速度が増加する。
- 一次抗体および二次抗体を用いたスフェロイドの免疫染色
- 一次抗体を抗体インキュベーションバッファー中の適切な希釈液に希釈し、各ウェルに70 μLを加えます。スフェロイドを一次抗体と共に一晩インキュベートする。
注:希釈率は、使用される特異的抗体に依存する。ここに示す例では、リソソームを1:500の希釈率を用いてマウス抗LAMP1抗体で免疫染色している。 - 翌日、スフェロイドを70 μLのPBSで5回、毎回3分間洗浄する。
- 二次抗体を1:500の希釈で希釈し、蛍光結合ファロイジンを1:500に、およびヘキスト33342(1mg mL-1 ストックから)を抗体インキュベーションバッファーで1:5000で希釈し、各ウェルに70μLを加える。一晩インキュベートする。
注:抗体の希釈率は、使用される特異的抗体に依存する。高い光安定性と高輝度を示す高度に交差吸着された二次抗体が推奨されます。 - 翌日、スフェロイドを70 μLのPBSで5回、毎回3分間洗浄する。
メモ: プレートは、回転楕円体がPBSで覆われたままである限り、イメージングの前にRTで最大2週間保存できます。
- 一次抗体を抗体インキュベーションバッファー中の適切な希釈液に希釈し、各ウェルに70 μLを加えます。スフェロイドを一次抗体と共に一晩インキュベートする。
4. 回転楕円体の画像取得と解析
- 画像取得
- スフェロイドを含む96ウェルプレートを共焦点ハイコンテントスクリーニング顕微鏡に挿入する。
- 使用する蛍光色素を励起する適切なレーザーを選択します。
- クロストークを避けるために、チャンネルを順番に取得します。
- 適切な対物レンズを使用して回転楕円体をイメージします。
注: 水没水目標がある場合は、その使用をお勧めします。たとえば、20x/1.0 NA の対物レンズでは、約 77 の視野で井戸全体を画像化できます。63x/1.15 NA の対物レンズは、約 826 の視野で井戸全体を画像化できます。 - 画像〜30〜40スライス、回転楕円体の深さに応じて、各スライスは前のものから1.5μmの間隔で撮影された。
- 画像解析
- 回転楕円体の形態学的解析については、手順4.2.2~4.2.6に従ってください。
- 蛍光共役ファロイジン染色に基づいてスフェロイドをセグメント化する。
- ヘキスト33342染色に基づいて核をセグメント化する。
- 細胞質に存在する残留ヘキスト33342染色によって各細胞の細胞質をセグメント化する。
- 体積、表面積、真球度、スフェロイドあたりの核の数など、スフェロイドのさまざまな形態学的特性を計算します。
メモ:この情報は、選択した画像解析ソフトウェアに組み込まれているさまざまなアルゴリズムを使用して抽出されます。 - さらに画像を処理して、75,000 μm3 未満および 900,000 μm3 より大きいスフェロイドを除去します。
注: これらの値は、複数の回転楕円体の融合の結果として発生した可能性のある非常に小さなセルアセンブリと大きなアセンブリの除去を可能にするための提案です。回転楕円体は、このステップで異なるサイズのクラスに分類することもできます。 - スフェロイド内の単一細胞を分析するには、手順 4.2.8 ~ 4.2.12 に従います。
- 蛍光共役ファロイジン染色に基づいてスフェロイドをセグメント化する。
- ヘキスト33342染色に基づいて核をセグメント化する。
- 細胞質に存在する残留ヘキスト33342染色によって各細胞の細胞質をセグメント化する。
- 二次抗体染色に基づいてリソソームをセグメント化する。
- 細胞あたりのリソソーム数、細胞体積、および細胞表面積を含む、各スフェロイド内の細胞の異なる形態学的特性を計算する。
メモ:この情報は、選択した画像解析ソフトウェアに組み込まれているさまざまなアルゴリズムを使用して抽出されます。
結果
このプロトコルでは、さまざまな腫瘍組織を表すために異なる細胞型を使用して、スフェロイドの形態で3D細胞培養アセンブリを作製する堅牢な方法が詳述されている。この方法では、ウェルあたり数百のスフェロイドを生成できるため、細胞ベースのアッセイを高含有量の方法で実行できます(図1)。このアプローチは、HT-29スフェロイド16 におけるナノ粒子の取り込みおよびHepG2スフェロイド17におけるナノ粒子誘発毒性を研究するために以前に使用されてきた。この方法は、光学品質プレートのウェル底部全体に足場材料の薄くて均一な分布を生成することに依存しています。細胞を各ウェルに播種し、さらに足場材料を、低濃度で、細胞上にオーバーレイとして添加する。これにより、スフェロイドの成長さえもサポートするベースが得られ、数百個のスフェロイドを96ウェルプレートの各ウェルで培養できることを意味します。低倍率の対物レンズを使用して、母集団全体の概要画像を生成します(図2)。次に、ウェルのサブ領域を選択して高解像度の対物レンズを使用して画像化することができ、各位置において、完全な共焦点スタックが取得される。これにより、各回転楕円体の後続の体積解析に必要な情報が提供されます。
次いで、個々のスフェロイドをHCAによって分析することができ、それによって、スフェロイドの形態学的特性に関する情報を提供することができる。通常、最初のステップは、各回転楕円体を単一のオブジェクトとして識別することです。これを行うために、スフェロイド全体に一貫した染色または分布を与える可能性が高い蛍光チャネルが選択される。ここに示す例では、蛍光共役ファロイジンチャネルにおけるシグナルが使用され、アクチンが異なるスフェロイドタイプのすべての細胞において原形質膜の近くに見出されるようにする(図2 および 図3A)。完全な共焦点スタックが生成される結果、すべてのHCAステップは、スライス単位ではなく体積学的方法で実施することができる。これは、少数の選択された平面の解析に関連するバイアスを除去するため、重要です。このボリュームアプローチは、画像内の他のチャンネルに適用されます。核を検出し、ヘキスト33342染色に基づいてセグメント化し、残留ヘキスト33342が低レベルに存在するため、この同じチャネルを使用して細胞質を検出することができます(図3B)。スフェロイド内の個々の細胞の下流分析が必要な場合、他のチャネル(例えば、抗LAMP1抗体で免疫染色されたリソソーム)も同様の方法で処理することができる。体積アプローチにより、蛍光標識されたすべての構造をすべてのビューから視覚化できます(図3C)。
回転楕円体を別個の物体として同定したので、回転楕円体レベルで様々な形態学的測定を行うことができる。これらの測定には、回転楕円体あたりの核数(図4A)、ならびに回転楕円体の真球度(図4B)、体積(図4C)、および表面積(図4D)の計算が含まれる。使用するHCAソフトウェアに応じて、断面積、内側の円盤半径、内側の球の半径などの他の形態学的特徴も計算できます。ここに示す例では、75,000 μm3 未満および 900,000 μm3 を超えるスフェロイドは測定値から破棄されましたが、これらのパラメータは、分析に必要な回転楕円体特性に応じてユーザーが設定できます。スプレッドシートは画像解析ソフトウェアによって生成され、解析のためにRStudioにインポートされました。箱ひげ図グラフは、さまざまな種類の回転楕円体の形態学的特性を表示するために作成されました(図4)。これらの箱ひげ図は、集団における回転楕円体の不均一性のレベルを明らかにするため、任意の1つの実験で多数の回転楕円体を定量化することが重要です。これは、ウェルごとに単一の回転楕円体を生成する方法に対する重要な利点です。ここに示した3つの回転楕円体タイプは、その体積および表面積に関して高いレベルの類似性を示すが、HepG2スフェロイドの真球度が、ここに示されている他のタイプの真球度よりも幾分低いことは注目に値する(図4B)。
ここで使用する63倍の水浸漬対物レンズのような高解像度の対物レンズでスフェロイドをイメージングすることで、スフェロイド内の個々の細胞の細胞内分解能を達成することができます。異なる細胞小器官は、使用される抗体に応じてセグメント化することができる。ここに示す例では、抗LAMP1抗体を用いた免疫染色に基づいてリソソームを同定し、続いて二次抗体添加を行った(図3C)。各細胞内の各細胞小器官のセグメンテーションは、細胞レベル測定の定量化を可能にする。3つのスフェロイドタイプにおける各細胞の典型的な体積(図5A)、ならびに細胞当たりのリソソームの数(図5B)が示されている。このような細胞内詳細の必要性は、スフェロイドが使用されるアッセイによって決定される。
スフェロイド生成の開始時の初期細胞播種密度を最適化することは、重要なステップです。あまりにも多くの細胞を加えると、依然として回転楕円体形成が可能になる。ただし、これにより回転楕円体の融合が発生する可能性があります(図6)。これは不規則な形状のアセンブリの生成につながり、これは今度はスフェロイドの下流の同定にとって非常に問題になる可能性があります。スフェロイドが別個の構造として誤って識別されると、個々の細胞の分析にも問題が生じる可能性があります。そのため、細胞播種密度や増殖時間の長さなど、スフェロイド生成に使用される各細胞株の慎重な最適化は、確立するための重要なパラメータです。

図1:HCSおよびHCAのスフェロイドを生成するために使用されるプロトコルを詳述した回路図。96ウェルプレートをECM地下材料の層でコーティングし、続いて細胞を播種し、その後スフェロイド形成を開始する。培地は翌日に交換され、その後2日ごとに交換される。イメージングの準備として、スフェロイドを固定し、透過処理し、特異的抗体で免疫染色します。次いで、スフェロイドは、共焦点HCS顕微鏡を用いて画像化される。BioRender.com で作成されたグラフィック。この図の拡大版を表示するには、ここをクリックしてください。
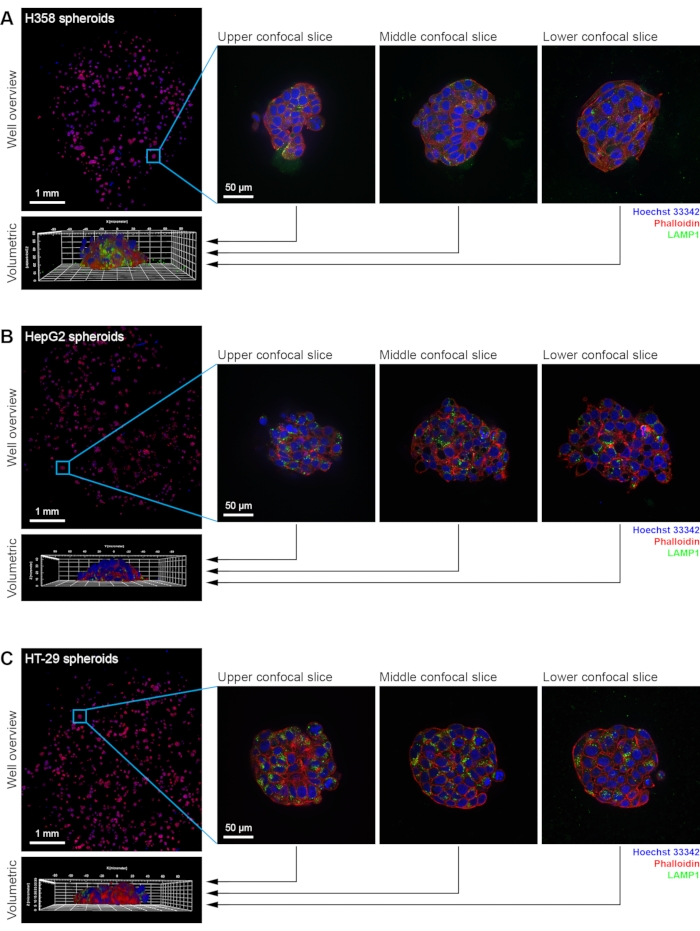
図2:H358、HepG2、およびHT-29スフェロイドの画像例。 (A)H358、(B)HepG2、および(C)HT-29スフェロイドの完全自動HCS共焦点イメージング。パネルは、単一のウェルの概要、ならびに3つの共焦点スライスの例、および各細胞株からの1つのスフェロイドの体積再構成を示す。ヘキスト33342で染色された核は青色で示され、アクチンは赤色で蛍光結合ファロイジンで染色され、リソソームは緑色でLAMP1について免疫染色された。井戸の概要の画像は、20倍の水浸漬対物レンズ(NA 1.0)で取得されました。個々の回転楕円体の画像は、63倍の水浸漬対物レンズ(NA 1.15)で取得された。 この図の拡大版を表示するには、ここをクリックしてください。
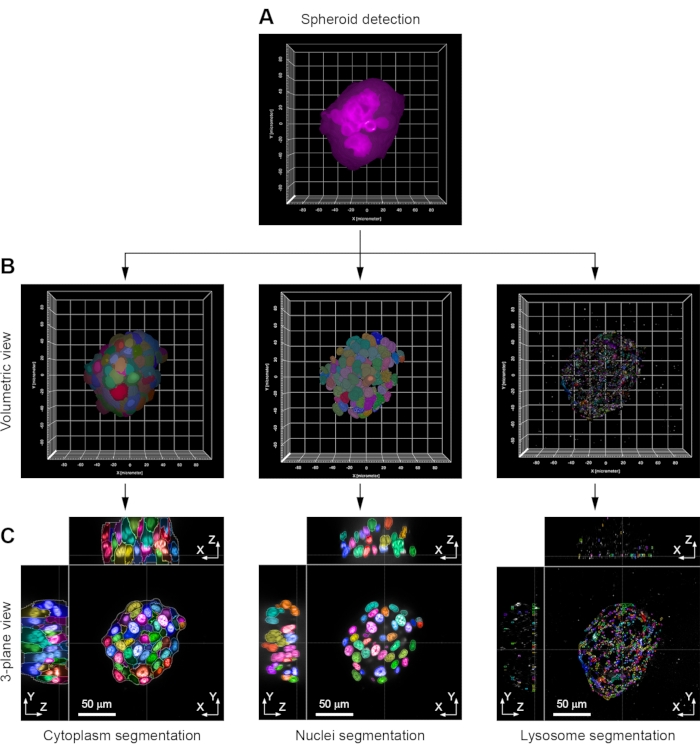
図3:画像解析の主要な手順の例 (a)各回転楕円体は、蛍光共役ファロイジン染色の検出によって、体積モードで最初に同定される。(B)この情報をマスクとして使用して、各細胞の細胞質は、細胞質内に存在する残留ヘキスト33342染色によってセグメント化される。核はヘキスト33342染色によってセグメント化されている。リソソームは、抗体(抗LAMP1)免疫染色を用いてセグメント化される。体積ビューが表示されます。(c)同一回転楕円体の3面図。示されている例は、H358細胞スフェロイドのものである。画像は63倍の水浸漬対物レンズ(NA 1.15)で取得されました この図の拡大版を見るにはここをクリックしてください。
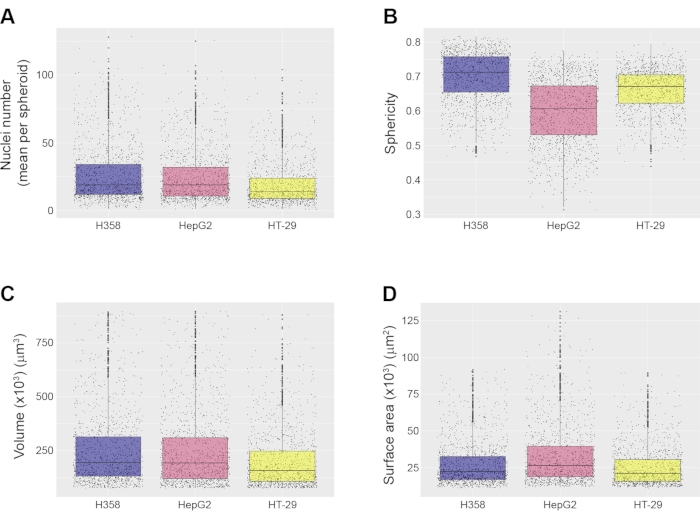
図4:回転楕円体レベルの測定例 すべての測定は、自動画像解析パイプラインを使用して行われ、3種類の回転楕円体、すなわちH358、HepG2、HT-29について、20倍の対物レンズで画像化されました。図示は、(A)スフェロイド当たりの平均核数、(B)スフェロイド真球度、(C)スフェロイド体積、及び(D)スフェロイド表面積である。すべての箱ひげ図は、各回転楕円体タイプの中央値と四分位数を示しています。データは3つの複製ウェルからのものです。分析された回転楕円体の総数は、1259(H358)、1522(HepG2)、および1326(HT-29)であった。画像は、20倍の水浸漬対物レンズ(NA 1.0)で取得されました。 この図の拡大版を表示するには、ここをクリックしてください。

図5:回転楕円体からの細胞レベルの測定の例。 すべての測定は、自動画像解析パイプラインを使用して行われ、3種類の回転楕円体、すなわちH358、HepG2、およびHT-29について、63倍の対物レンズで画像化された。示されているのは、(A)個々の細胞の体積、および(B)細胞当たりのリソソームの平均数である。分析された細胞の総数は、各細胞株の20個のスフェロイドから1410個(H358)、1625個(HepG2)、および1401個(HT−29)であった。画像は63倍の水浸漬対物レンズ(NA 1.15)で取得されました この図の拡大版を見るにはここをクリックしてください。

図6:回転楕円体形成に対する細胞の過剰プレーティングの影響を示す例の画像。 H358、HepG2、および HT-29 回転楕円体の例の画像を示します。矢印は、回転楕円体が融合した可能性が高い場所を示します。画像は、20倍の水浸漬対物レンズ(NA 1.0)で取得されました。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ここで説明するアプローチは、HCSおよびHCAに適した方法でウェルあたり数百の回転楕円体を生成するためのプラットフォームを詳述する。ウェルあたり1つの回転楕円体のみの形成を可能にする平底および丸底ULAプレートの使用など、他の一般的な方法と比較して18,19、この方法は、スクリーニング形式で多数の回転楕円体から高解像度情報を抽出する機会を提供します。特に、この方法は、様々な腫瘍タイプを表す3つの異なる細胞株で実証されており、異なるモデルにおける様々な細胞プロセスを研究するためのその広範な適合性を強調している。この方法を使用して生成された回転楕円体は、サイズと形状に多少のばらつきを示しますが、HCAはサイズ(または関心のある他のパラメータ)によってそれらを簡単に分類できます。私たちの研究室では、このアプローチを使用して、スフェロイドサイズの関数としてのナノ粒子誘発毒性の研究に成功しました。重要なことに、スフェロイドの異なるサイズのクラスはすべて同じ井戸で研究することができ、すべてが同じ治療にさらされ、大規模な回転楕円体集団から非常に堅牢な出力が得られることを意味します17。ここで説明する方法論は、異なる組織を表す他の細胞型での使用に容易に適合させることができる。さらに、このようなスフェロイドは、異なる生物学的プロセスを評価するために使用することができる14。蛍光タグ付きタンパク質を安定に発現する細胞でスフェロイドが生成されれば、生細胞イメージングも可能です。
このプロトコルの重要なステップの1つは、セルがメッキされるECM地下材料層の製造です。層が厚すぎると、ウェルの中央に単層の成長を促進するメニスカス20 を形成し、ウェルの外縁でのみ回転楕円体を形成することができる。したがって、ECM地下材料の正しい濃度および体積が、ウェル全体で均一な回転楕円体形成を可能にするために選択されることが不可欠である。これは常に細胞株依存性である。また、過剰なECM地下室材料は、容易に溶解しないため、免疫染色プロセス中に問題を引き起こす可能性があることにも留意されたい。これは、ひいては、HCS共焦点顕微鏡システムを使用する場合の画像取得時の合併症を招く可能性がある。もう1つの考慮事項は、異なる細胞株が異なるECM製剤を必要とし得ることである。例えば、HepG2スフェロイドは、H358およびHT-29スフェロイドによって使用されるものと比較して、成長因子の濃度が低下したECM地下材料を必要とする。細胞プレーティングの方法も重要であり、これは細胞がウェル内でどのように分布するかを決定する。播種される細胞が多すぎるか、分布が不十分な場合、これは回転楕円体融合につながる可能性があります(図6)。ECMスキャフォールドを使用するもう1つの課題は、低温(10°C未満)で処理する必要があることであり、HCSに自動化を使用する場合に特に問題になります。しかし、この問題は最近、マイクロアレイ技術を使用してECM地下材料と細胞の0.2μLの液滴をチャンバー付きスライドにスポットしたEismannら(2020)によって解決されました。これは、小さなスフェロイド21の成長を促進するのに十分な材料であった。このようなアプローチが、大量のECM地下材料をマルチウェルプレートのウェルにメッキするのにも有効かどうかは、まだ実証されていません。
顕微鏡を用いた3D細胞モデルの解析に関連する1つの問題は、これらのアセンブリの中心平面から情報を抽出する能力である。これに関して、免疫染色プロセス中の透過処理および抗体アクセスは問題となり得る。しかし、Nürnbergら15 によって発表されたプロトコルは、スフェロイド全体の非常に一貫した免疫染色を可能にします。このプロトコールにわずかな変更を使用して、この技術は、細胞が全体的なスフェロイド構造に対して中心または末梢であるかどうかにかかわらず、高度な一貫性で、小さな細胞下構造(例えば、リソソーム)でさえも免疫染色することができる。新しい抗体を使用する場合は、このステップを慎重に最適化することが重要です。
もう1つの重要なステップは、選択されたイメージングレジームです。回転楕円体を通して適切な数の Z スライスをイメージングすることは、分析および保存する必要があるデータの量を決定するため、重要です。たとえば、限られた数の Z 平面を大きすぎる間隔で撮像すると、回転楕円体全体のサイズと体積が過小評価される可能性があります。一方、キャプチャする Z 平面が多すぎると、データ分析とストレージの問題が発生する可能性があります。また、非常に大きなデータセットでは、特に体積モードでの解析に、より集中的な計算能力が必要です。z平面における最適なサンプリング間隔は、対物レンズの特性によって大きく左右されますが、ここに示す例では、回転楕円体の全深さでの撮像を容易にするために、1.5μmの間隔で約40個の共焦点スライスが必要です。
前述のように、選択した平面の解析によるバイアスを低減するために、体積ベースの画像解析アプローチを使用することを強くお勧めします。これにより、回転楕円体レベルの情報だけでなく、個々の回転楕円体からセルレベルのデータも抽出できます。最終的に、HCAパイプラインは、尋ねられている特定の生物学的問題に対処するように設計する必要があります。マルチパラメトリック出力により、複雑な表現型を定量的に記述できます。これは、市販のHCAソフトウェア16,17や、CellProfiler22,23などの自由にアクセス可能なソフトウェアを使用した3Dセルアセンブリでも機能することが実証されています。体積分析方法は、オルガノイドやエクスビボ患者由来の外植体(PDE)など、インビボ条件下でさらに良好に複製する他の3D細胞モデルタイプにも適用できる可能性を秘めています。最近、脳オルガノイドを製造するためのハイスループットパイプラインが記載されている24。これには、96ウェルプレートでオルガノイドを生成し、その後、ハイコンテントスクリーニング顕微鏡24を使用してそれらをイメージングすることが含まれます。偏微分方程式は、腫瘍由来の元の組織像を示すという点で非常に有利であり、したがって、腫瘍微小環境などの特徴を含むインビボ条件下で反復する細胞モデルを提供する25。これらのモデルはまた、原則として、ここに記載されるアプローチを用いて免疫染色、画像化、および分析することができる26,27。
要約すると、このプロトコルは、HCSおよびHCAアプリケーション用のスフェロイドの大規模生産のためのアクセス可能で堅牢な方法を記述している。その適用性は、3つの異なる細胞株で示され、高解像度で画像化できるスフェロイドを産生する。このプロトコルはまた、体積分析が回転楕円体集団に関する定量的情報、ならびに単一細胞および細胞内レベルで提供できることを実証し、それによって多種多様なアッセイに有用である。
開示事項
著者らは、この研究に関連する競合する利益はないと宣言している。
謝辞
著者らは、アイルランド科学財団(SFI)(16/RI/3745)からJCSへのインフラ研究助成金の支援を認めている。UCD細胞スクリーニング研究所での研究は、UCD科学大学によって支援されています。ASCは、アイルランド研究評議会(IRC)のアイルランド政府大学院奨学金(GOIPG/2019/68)から資金提供を受けています。著者らはまた、ラボのすべてのメンバーの意見と有益な議論に感謝します。図 1 のアートワークは、BioRender で生成されたものです。
資料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1x), phenol red | Gibco | 25300054 | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A6003 | |
| Calcium chloride | Fisher Scientific | 10050070 | |
| CellCarrier-96 Ultra Microplates, tissue culture treated, black, 96-well with lid | Perkin Elmer | 6055302 | These plates have been renamed as Phenoplates |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| Foetal Bovine Serum (FBS), qualified, EU approved, South America origin, heat inactivated | Gibco | 10500064 | |
| Glycine | Fisher Scientific | BP381-1 | |
| Goat anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Invitrogen | A-11029 | |
| L-Glutamine solution, 200 mM | Gibco | 25030024 | |
| Hoechst 33342 | Sigma Aldrich | 14533 | |
| Magnesium chloride | Fisher Scientific | 10647032 | |
| Matrigel Basement Membrane Matrix, Phenol Red-free, LDEV-free, 10 mL | Corning | 356237 | This Matrigel formulation can be also found with the same catalogue number at BD Biosciences |
| Matrigel Growth Factor Reduced Matrigel | BD Biosciences | 356231 | This Matrigel formulation can be also found with the same catalogue number at Corning |
| McCoy's 5A medium | Gibco | 26600023 | |
| McCoy's 5A medium with L glutamine and sodium bicarbonate, without phenol red | Hyclone | 10358633 | |
| Minimum Essential Medium (MEM) | Gibco | 21090022 | |
| Minimum Essential Medium (MEM), without glutamine, without phenol red | Gibco | 51200046 | |
| Mouse monoclonal anti-LAMP1 antibody (concentrate) | Developmental Studies Hybridoma Bank | H4A3-a | |
| Neubauer counting chamber | Hirschmann | 8100203 | |
| Nunclon tissue culture dish with lid, polystyrene, 92 mm x 17 mm | ThermoFisher Scientific | 150350 | |
| Opera Phenix HCS System and Harmony HCA software | Perkin Elmer | HCSHH14000000 | |
| Paraformaldehyde (PFA) | Sigma Aldrich | P6148 | |
| Phalloidin Alexa Fluor 568 | Invitrogen | A12380 | |
| Phosphate Buffered Saline (PBS) tablets | Sigma Aldrich | P4417 | |
| Polysorbate 20 | Sigma Aldrich | P5927 | |
| RPMI 1640 Medium, GlutaMAX Supplement | Gibco | 61870010 | |
| RPMI 1640 Medium, without glutamine, without phenol red | Gibco | 11835063 | |
| Triton X-100 | Sigma Aldrich | T9284 | |
| Stericup sterile vacuum filter units | Millipore | SCGVU05RE |
参考文献
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33(2020).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6(2018).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay and Drug Development Technologies. 12 (4), 207-218 (2014).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Zhang, X., Jiang, T., Chen, D., Wang, Q., Zhang, L. W. Three-dimensional liver models: state of the art and their application for hepatotoxicity evaluation. Critical Reviews in Toxicology. 50 (4), 279-309 (2020).
- Dutta, D., Heo, I., Clevers, H. Disease modeling in stem cell-derived 3D organoid systems. Trends in Molecular Medicine. 23 (5), 393-410 (2017).
- Nunes, A. S., Barros, A. S., Costa, E. C., Moreira, A. F., Correia, I. J. 3D tumor spheroids as in vitro models to mimic in vivo human solid tumors resistance to therapeutic drugs. Biotechnology and Bioengineering. 116 (1), 206-226 (2019).
- Kleinman, H. K., Martin, G. R. Matrigel: Basement membrane matrix with biological activity. Seminars in Cancer Biology. 15, 378-386 (2005).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Foglietta, F., Canaparo, R., Muccioli, G., Terreno, E., Serpe, L. Methodological aspects and pharmacological applications of three-dimensional cancer cell cultures and organoids. Life Sciences. 254, 117784(2020).
- Bardsley, K., Deegan, A. J., El Haj, A., Yang, Y. Current state-of-the-art 3D tissue models and their compatibility with live-cell imaging. Advances in Experimental Medicine and Biology. 1035, 3-18 (2017).
- Darrigues, E., et al. Tracking gold nanorods' interaction with large 3D pancreatic-stromal tumor spheroids by multimodal imaging: Fluorescence, photoacoustic, and photothermal microscopies. Scientific Reports. 10 (1), 3362(2020).
- Boutros, M., Heigwer, F., Laufer, C. Microscopy-based high-content screening. Cell. 163 (6), 1314-1325 (2015).
- Mysior, M. M., Simpson, J. C. Cell3: A new vision for study of the endomembrane system in mammalian cells. Bioscience Reports. , (2021).
- Nürnberg, E., et al. Routine optical clearing of 3D-cell cultures: Simplicity forward. Frontiers in Molecular Biosciences. 7 (20), (2020).
- Cutrona, M. B., Simpson, J. C. A High-throughput automated confocal microscopy platform for quantitative phenotyping of nanoparticle uptake and transport in spheroids. Small. 15 (37), 1902033(2019).
- Kelly, S., Byrne, M. H., Quinn, S. J., Simpson, J. C. Multiparametric nanoparticle-induced toxicity readouts with single cell resolution in HepG2 multicellular tumour spheroids. Nanoscale. 13 (41), 17615-17628 (2021).
- Sirenko, O., Mitlo, T., Hesley, J., Luke, S., Owens, W., Cromwell, E. F. High-content assays for characterizing the viability and morphology of 3D cancer spheroid cultures. Assay and Drug Development Technologies. 13 (7), 402-414 (2015).
- Redondo-Castro, E., Cunningham, C. J., Miller, J., Cain, S. A., Allan, S. M., Pinteaux, E. Generation of human mesenchymal stem cell 3D spheroids using low-binding plates. Bio-protocol. 8 (16), (2018).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nature Methods. 4 (4), 359-365 (2007).
- Eismann, B., et al. Automated 3D light-sheet screening with high spatiotemporal resolution reveals mitotic phenotypes. Journal of Cell Science. 133 (11), 245043(2020).
- Alsehli, H., et al. An integrated pipeline for high-throughput screening and profiling of spheroids using simple live image analysis of frame to frame variations. Methods. 190, 33-43 (2021).
- Stirling, D. R., et al. CellProfiler 4: improvements in speed, utility and usability. BMC Bioinformatics. 22 (1), 1-11 (2021).
- Renner, H., et al. A fully automated high-throughput workflow for 3D-based chemical screening in human midbrain organoids. eLife. 9, 52904(2020).
- Powley, I. R., et al. Patient-derived explants (PDEs) as a powerful preclinical platform for anti-cancer drug and biomarker discovery. British Journal of Cancer. 122 (6), 735-744 (2020).
- Collins, A., Miles, G. J., Wood, J., MacFarlane, M., Pritchard, C., Moss, E. Patient-derived explants, xenografts and organoids: 3-dimensional patient-relevant preclinical models in endometrial cancer. Gynecologic Oncology. 156 (1), 251-259 (2020).
- Miles, G. J., et al. Evaluating and comparing immunostaining and computational methods for spatial profiling of drug response in patient-derived explants. Laboratory Investigation. 101 (3), 396-407 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。