Method Article
연속 흐름의 제조 및 작동, 투과화 감지 기능이 있는 미세 전기 천공 시스템
요약
이 프로토콜은 랩온어칩, 마이크로유체 전기천공 장치를 구축하는 데 필요한 미세 가공 기술을 설명합니다. 실험 설정은 연속 흐름에서 제어된 단일 세포 수준 형질주입을 수행하며 집단 기반 제어를 통해 더 높은 처리량으로 확장할 수 있습니다. 세포막 투과 정도를 실시간으로 전기적으로 모니터링하는 기능을 보여주는 분석이 제공됩니다.
초록
CAR-T 세포 요법과 같은 현재의 치료 혁신은 바이러스 매개 유전자 전달에 크게 의존하고 있습니다. 이 기술은 효율적이지만 높은 제조 비용을 수반하여 유전자 전달을 위한 대체 방법을 사용하는 데 관심을 갖게 되었습니다. 전기 천공은 유전자 및 기타 외인성 물질의 세포 내 전달을위한 전기 물리적, 비 바이러스 적 접근법입니다. 전기장을 인가하면 세포막이 일시적으로 세포 내로 분자 전달을 허용합니다. 일반적으로 전기 천공은 많은 수의 세포를 처리하기 위해 대규모로 수행됩니다. 그러나 이러한 접근 방식에는 광범위한 경험적 프로토콜 개발이 필요하며, 이는 1차 및 형질주입하기 어려운 세포 유형으로 작업할 때 비용이 많이 듭니다. 세포를 투과시키기에 충분한 전기장 강도를 달성하기 위해 큰 전압의 요구 사항과 결합 된 긴 프로토콜 개발은 마이크로 스케일 전기 천공 장치의 개발로 이어졌습니다. 이러한 미세 전기 천공 장치는 일반적인 미세 가공 기술을 사용하여 제조되며 높은 처리량 기능을 유지할 수있는 잠재력으로 더 큰 실험 제어를 허용합니다. 이 작업은 연속 흐름 하에서 단일 세포 수준에서 세포막 투과 수준을 감지 할 수있는 미세 유체 전기 천공 기술을 기반으로합니다. 그러나 이 기술은 초당 처리되는 4개의 셀로 제한되었으므로 시스템 처리량을 늘리기 위한 새로운 접근 방식이 제안되고 여기에 제시됩니다. 세포 집단 기반 피드백 제어로 표시되는이 새로운 기술은 다양한 전기 천공 펄스 조건에 대한 세포 투과 반응을 고려하고 테스트중인 세포 유형에 가장 적합한 전기 천공 펄스 조건을 결정합니다. 그런 다음 더 높은 처리량 모드가 사용되며, 여기서 이 '최적의' 펄스가 이동 중인 세포 현탁액에 적용됩니다. 장치를 제작하고, 미세유체 실험을 설정 및 실행하고, 결과를 분석하는 단계가 자세히 제시됩니다. 마지막으로, 이 미세 전기천공 기술은 녹색 형광 단백질(GFP)을 암호화하는 DNA 플라스미드를 HEK293 세포에 전달함으로써 입증됩니다.
서문
CAR-T(키메라 항원 수용체 조작 T 세포) 세포 치료 및 CRISPR(클러스터링된 규칙적인 간격의 짧은 회문 반복 DNA 서열)/Cas9를 사용한 유전자 편집과 같은 생물의학 연구의 현재 치료 혁신은 외인성 물질을 세포 내 공간1에 성공적이고 효율적으로 전달하는 능력에 크게 의존합니다. CAR-T 요법에서, 세포 치료제 제조에서 유전자 전달 단계를 수행하기 위한 황금 표준은 바이러스 벡터2를 사용하는 것이다. 바이러스 매개 유전자 전달은 효율적인 전달 방식이지만 몇 가지 단점도 있습니다. 여기에는 제조 비용, 세포 독성, 면역원성, 돌연변이 유발/종양 발생 가능성및 전달될 유전자의 크기 제한이 포함됩니다3. 이러한 한계로 인해 대체 비 바이러스 전달 기술의 연구 개발이 이루어졌습니다.
바이러스 매개 유전자 전달의 대안인 전기천공은 세포의 DNA, RNA 및 단백질 형질감염을 수행하기 위해 최적의 전기 펄스 파형의 적용에 의존합니다. 외부 전기장의 인가 후, 세포막이 잠시 손상되어, 세포가 불침투성 외인성 물질4의 세포내 전달에 취약하게 된다. 바이러스 매개 전달에 비해 전기 천공은 일반적으로 안전하고 작동하기 쉽고 운영 비용이 낮기 때문에 유리합니다. 전기천공은 소분자 화물과 대분자 화물을 모두 전달할 수 있으며 혈통에 관계없이 세포를 형질감염시키는 데 효율적일 수있습니다5. 전기천공 후 바람직한 결과, 즉 양호한 생존력 및 양호한 전기-형질주입 효율을 달성하려면, 다양한 실험 파라미터가 공동-최적화될 필요가 있다. 여기에는 세포 유형6, 세포 밀도, 분자 농도7, 전기천공 버퍼 특성(예: 분자 조성, 전도도 및 삼투압)8, 전극 크기/기하학적구조9, 전기 펄스 파형(모양, 극성, 펄스 수)10 이 포함됩니다(그림은 그림 1 참조). 이러한 각 파라미터가 전기천공 실험의 결과에 상당한 영향을 미칠 수 있지만, 적용된 펄스의 전기 에너지가 결과 세포 생존율과 전기 형질주입 효율8 사이의 본질적인 트레이드 오프의 근원이기 때문에 펄스 파형이 특히 자세히 연구되었습니다.
일반적으로 전기 천공 실험은 거시적 규모로 수행되며, 여기서 세포는 전기 천공 큐벳 내의 대형 병렬 플레이트 전극 세트 사이에 100 마이크로 리터의 버퍼에 현탁됩니다. 전극은 일반적으로 전극 거리가 1-4mm 인 알루미늄으로 제조됩니다. 피펫을 통해 셀을 수동으로 로드하면 큐벳이 부피가 큰 전기 펄스 발생기에 전기적으로 연결되어 사용자가 펄스 파형 파라미터를 설정하고 적용하여 셀 현탁액을 전기천공할 수 있습니다. 매크로 스케일 또는 벌크 전기천공은 셀 밀도>106 cells/mL를 처리할 수 있지만 전기 펄스 파형 설정을 최적화할 때 이 기능은 낭비가 될 수 있습니다. 이는 세포 집단 수가 제한될 수 있는 1차 세포 유형을 전기천공할 때 특히 중요합니다. 또한 전극 사이의 거리가 멀기 때문에 펄스 발생기는 전계 강도 >1kV / cm11)를 달성하기 위해 큰 전압을 공급할 수 있어야합니다. 이러한 고전압은 전해질 버퍼를 통한 저항성 전력 소산을 일으켜 줄 가열을 초래하며, 이는 결과적인 셀 생존율(12)에 해로울 수 있다. 마지막으로, 조밀한 세포 현탁액 상에서 전기천공을 수행하는 것은 결과적인 전기-형질감염 효율 및 세포 생존율의 선천적 가변성으로 일관되게 부담될 것이다. 현탁액의 각 셀은 주변 셀로 인해 다른 전기장 강도를 경험할 수 있습니다. 경험된 전기장 강도가 증가 또는 감소하는지 여부에 따라, 생성된 세포 생존율 또는 전기-형질주입 효율이 각각 부정적인 영향을 받을 수 있다(11). 거시적 규모의 전기 천공에 대한 이러한 단점은 마이크로 규모에서 작동하고 단일 셀 수준에서 더 나은 제어를 허용하는 대체 기술의 추구 및 개발로 이어졌습니다.
BioMEMS 또는 생물 의학 마이크로 전자 기계 시스템 분야는 마이크로 일렉트로닉스 산업의 기술 발전에서 비롯됩니다. 특히, 생물 의학 연구의 발전을위한 마이크로 장치를 개발하기 위해 미세 가공 공정을 활용합니다. 이러한 발전은 생체 내 전기 모니터링(13)을 위한 마이크로-전극 어레이, in situ 전기천공을 위한 용량성 마이크로-전극(14), 소형화된 organ-on-a-chip 장치(15), 마이크로유체 현장 진단 16, 바이오 센서(17), 및 나노-및 마이크로-전기천공 장치(19,20,21)를 포함하는 약물 전달 시스템(18)의 개발을 포함한다. . 생물학적 세포와 동일한 크기 규모로 장치를 설계하고 제조할 수 있는 능력으로 인해, 나노- 및 마이크로-전기천공 기술은 그들의 거시적 규모의 대응물(22, 23)과 비교할 때 유리하다. 이러한 전기 천공 장치는 일반적으로 10에서 100 마이크로 미터 간격의 전극 세트가 통합되므로 고전압 펄스 응용 분야의 요구 사항을 제거합니다. 이 기능은 전해질을 통한 전류를 크게 줄여 독성 전기 분해 제품의 축적과 이러한 시스템에서 줄 가열의 영향을 줄입니다. 마이크로스케일 채널은 또한 펄스 인가 동안 훨씬 더 균일한 전기장이 셀에 신뢰성 있게 인가되는 것을 보장하여, 보다 일관된 결과(24)를 초래한다. 또한, 미세-전기천공 장치가 미세유체 플랫폼에 통합되는 것도 일반적이며, 이는 세포 치료제 제조(25)에서 매우 바람직한 기능인 완전 자동화된 기술로의 미래 통합을 위해 그 자체를 제공한다. 마지막으로, 마이크로 스케일 전기 천공은 전기 천공 이벤트의 전기 조사를 허용합니다. 예를 들어, 세포막 투과화의 정도는 단일 세포 수준(26,27)에서 실시간으로 모니터링될 수 있다. 이 방법의 목적은 전기천공 프로토콜을 최적화하면서도 이전 최첨단 기술에 비해 처리량을 증가시키기 위해 세포막 투과 정도를 측정할 수 있는 미세유체, 단일 셀 미세 전기천공 장치의 미세 가공, 시스템 작동 및 분석을 설명하는 것입니다.
단일 세포 수준의 전기 천공을 수행하는 것은 더 이상 새로운 기술이 아니며, 2001 년 Rubinsky et al.에 의해 정적 세포 전기 천공 기술28의 개발로 처음 입증되었습니다. 그들의 마이크로 장치는 전기 천공 사건을 전기적으로 모니터링하는 능력을 최초로 입증했기 때문에 혁신적이었습니다. 이는 장치의 처리량을 증가시키기 위해 병렬화된 방식으로 세포막 투과 정도를 전기적으로 감지할 수 있는 정적 단일 세포 전기천공 기술의 개발로 이어졌습니다. 그러나 병렬화 및 배치 처리를 사용하더라도 이러한 장치는 단위 시간29,30 당 처리 할 수있는 총 셀 수가 심각하게 부족합니다. 이러한 제한은 훨씬 더 큰 처리량(31)에서 단일 셀 레벨 마이크로-전기천공을 수행할 수 있는 유동-관통 장치의 개발로 이어졌다. 정적에서 유동 환경으로의 이 장치 전환은 전기천공 펄스 적용 후 세포막 투과 정도를 전기적으로 모니터링하는 기능을 제한합니다. 이 작업에 설명 된 방법은 개별 세포의 세포막 투과 정도를 연속적인 직렬 방식으로 전기적으로 감지, 펄싱 및 모니터링 할 수있는 미세 전기 천공 기술인이 두 기술 간의 격차를 해소합니다.
이 기술은 최근 Zheng et al. 그 작업에서이 기술의 기능은 전기 천공 펄스의 진폭과 지속 시간이 모두 다양하고 세포막 투과를 나타내는 후속 전기 신호가 탐구 된 파라 메트릭 연구의 완료와 함께 도입되었습니다32. 결과는 전기천공 펄스의 강도의 증가(즉, 인가된 전기장의 증가 또는 펄스 지속시간의 증가)가 측정된 세포막 투과화의 증가를 야기한다는 것을 보여주었다. 시스템을 추가로 검증하기 위해 성공적인 전기 천공의 일반적인 형광 지표 인 요오드화 프로피듐33을 세포 현탁액에 추가하고 전기 펄스를 적용한 직후에 형광 이미지를 캡처했습니다. 광 신호, 즉 세포 내부의 요오드화 프로피듐의 형광 강도는 세포막 투과 정도의 전기적 측정과 강한 상관 관계가 있었으며,이 전기 측정의 신뢰성을 검증했습니다. 그러나이 연구는 번역 할 수있는 의미가 거의 또는 전혀없는 소분자 프로피듐 요오드화물의 전달만을 고려했습니다.
이 작업에서는 생물학적 활성 플라스미드 DNA(pDNA) 벡터를 전달하고 전기천공 후 재도금 및 배양된 세포의 전기 형질감염 효율을 평가하는 동시에 시스템의 처리량을 개선하기 위해 이 기술의 새로운 응용 프로그램이 도입되었습니다. 이전 작업은 전기천공 이벤트를 전기적으로 측정할 수 있는 기존 미세 전기 천공 기술을 능가하지만, 장치의 현재 상태는 여전히 세포 감지, 펄스 적용 및 세포막 투과화 측정을 수행하기 위해 전극 세트 사이의 긴 세포 이동 시간(~250ms)이 필요합니다. 단일 채널을 사용하면 처리량이 초당 4셀로 제한됩니다. 이러한 한계를 극복하기 위해, pDNA 전기-형질감염을 수행하기 위해 새로운 개념의 세포집단-기반 피드백-제어 전기천공이 도입된다. 이 시스템은 저생리학적 전도도 전기천공 버퍼를 사용하여 다양한 전기천공 펄스 응용 분야에서 단일 세포의 전기적 조사를 허용합니다. 전기적 반응에 기초하여, '최적의' 전기천공 펄스가 결정된다. 그런 다음 세포막 투과화 결정이 무효화되고 유속이 증가하며 전기천공 펄스 듀티 사이클이 세포 통과 시간과 일치하여 전극 사이를 이동하는 셀당 하나의 펄스를 보장하는 '고처리량' 모드가 구현됩니다. 이 작업은 마이크로 장치의 제조를 위한 미세 가공 단계, 실험을 수행하는 데 필요한 재료/장비 및 설정, 장치의 작동/분석 및 전기 형질주입 효율(eTE)에 대한 광범위한 세부 정보를 제공합니다.
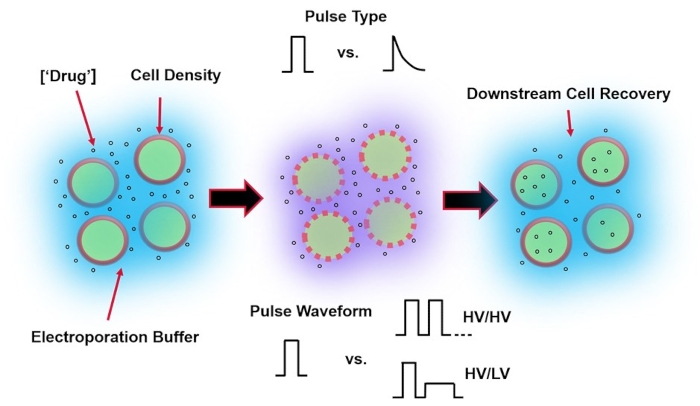
그림 1: 전기천공 결과에 영향을 미치는 실험 요인. (왼쪽) 세포 현탁액 - 전기 천공이 시작되기 전에 고려해야 할 중요한 요소에는 페이로드 (이 경우 pDNA), 농도, 세포 밀도 및 전기 천공 완충액 특성이 포함됩니다. 고려해야 할 전기천공 완충액 특성은 전도도, 삼투압 및 이러한 값에 기여하는 정확한 분자 조성입니다. (가운데) 펄스 애플리케이션-정확한 펄스 유형(구형파 대 지수 감쇠) 및 펄스 파형(단일 펄스 대 펄스 트레인)을 최적화하여 결과 세포 생존율과 전기 형질주입 효율을 모두 최대화해야 합니다. 전기 천공 공정에서 구현되는 일반적인 펄스 트레인은 일반적으로 일련의 고전압 (HV) 펄스 또는 HV와 저전압 (LV) 펄스 크기 사이에서 회전하는 일련의 펄스로 구성됩니다. (오른쪽) 세포 회수-다운스트림 처리 단계, 특히 세포가 이송되는 회수 세포 배양 배지는 최적화되어야 합니다. 특징이 없는 경우(맨 왼쪽), 전체 전기천공 공정 최적화를 위해 추가 업스트림 셀 처리 단계를 구현할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
알림: 사용자는 이 프로토콜에 사용된 재료 및 소모품에 대한 모든 MSDS를 검토해야 합니다. 각 단계에서 적절한 PPE를 착용하고 실험 중에 멸균 기술을 사용해야합니다. 섹션 1-7에서는 장치 제작에 대해 설명합니다.
1. 장치 제작 - 마스크 디자인
참고: 미세 가공 공정의 그림은 그림 2 를 참조하십시오. 미세 가공 단계는 클린룸 환경에서 수행되어야 합니다. 추가 PPE가 필요합니다 (헤어 그물, 얼굴 털 그물, 마스크, 클린 룸 슈트, 신발 커버).
- 선택한 CAD 소프트웨어를 설치하고 미세 유체 채널과 전극 모두의 2차원 '마스크'를 설계하고 설계를 원하는 파일 형식(예: .dxf, .dwg)으로 저장합니다.
알림: 1차원 마스크 회로도의 예는 보충 그림 2 를 참조하십시오. - 인쇄할 공급업체로 보냅니다. 설계의 치수가 공급업체의 해상도 능력 내에 있는지 확인합니다.
2. 장치 제작 - 포토리소그래피
참고: 제공된 미세 가공 레시피는 포토레지스트 제조업체의 권장 사항에서 채택되었으며 시작점(34)으로만 사용해야 합니다. 베이킹 시간, 노출 시간 등에 대한 정확한 값은 각 제조 프로토콜에 맞게 최적화되어야 합니다. 실리콘 웨이퍼와 유리 슬라이드를 모두 처리하기 위해 웨이퍼 핀셋을 사용하는 것이 좋습니다.
- 미세유체 채널 제조
- 실리콘 웨이퍼 및 소다석회 유리 슬라이드 청소: 2.1.2-2.1.3단계에 따라 실리콘 웨이퍼 및 1" × 3" 소다석회 유리 슬라이드 청소(둘 다 '기판'이라고 함)를 수행합니다.
- 기질을 아세톤 배스, 이소프로판올(IPA) 배스 및 탈이온수 배스에 각각 10분 동안 담그십시오. 이 3단계 세척을 실온에서 연속적으로 수행하십시오.
- 가압 질소 또는 여과 된 공기 가스 공급원을 사용하여 표면을 제거하고 건조시킵니다. 기판을 150°C 오븐에 최소 30분 동안 넣어 남은 수분을 증발시킵니다.
- 실리콘 웨이퍼의 SU-8 포토리소그래피: 2.1.5-2.1.14단계에 따라 실리콘 웨이퍼에서 포토리소그래피를 수행합니다.
참고: 20μm의 미세유체 채널 높이를 달성하기 위해 SU-8 2000 시리즈 네거티브 포토레지스트가 사용되었습니다. 정확한 스핀율은 SU-8의 제형(즉, 2010, 2015 등)에 따라 달라질 것이다; 그러나, 하기 조건은 SU-8 2010 제형35에 대한 것이다. - 150°C 오븐에서 실리콘 웨이퍼를 제거하고 실온(RT)으로 냉각시킵니다.
- 스핀 코터의 진공 시스템을 사용하여 웨이퍼를 웨이퍼 스핀 코터의 척에 고정합니다. 스피너를 프로그래밍합니다. 1단계 - 100rpm/s의 가속도에서 10초 동안 500rpm, 2단계 - 300rpm/s의 가속도에서 30초 동안 1000rpm.
- 4mL의 SU-8 2010 포토레지스트를 실리콘 웨이퍼 중앙에 분배합니다. 프로그램을 실행하십시오. 시스템이 정지되면 진공 청소기를 끕니다.
- 핀셋을 사용하여 SU-8 코팅 실리콘 웨이퍼를 95°C의 핫 플레이트에 4-5분 동안 옮겨 부드러운 베이킹을 합니다. 그런 다음 핫 플레이트에서 웨이퍼를 제거하고 RT로 식히십시오.
알림: 실험실별 포토리소그래피 마스크 얼라이너에 대한 적절한 시작 절차를 따르십시오. - 2D 미세유체 채널 설계로 포토마스크를 마스크 홀더에 고정합니다. SU-8 코팅이 위쪽을 향하도록 실리콘 웨이퍼를 웨이퍼 척에 삽입합니다.
- 노출 설정을 150mJ/cm2 로 설정하고 기기를 실행합니다.
주의 : 잠재적 인 눈 손상을 방지하기 위해 UV 광원을 직접 마십시오. - SU-8 코팅 실리콘 웨이퍼를 95°C의 핫플레이트에 놓고 노출 후 베이킹을 위해 4-5분 동안 가열합니다.
- 실리콘 웨이퍼를 SU-8 현상액 ( 재료 표 참조)에 3-4 분 동안 담그십시오. 부드러운 교반을하십시오. 용액에서 웨이퍼를 제거하고 IPA로 표면을 헹굽니다.
- 가압 질소 또는 여과 된 공기 가스 공급원을 사용하여 표면을 건조시킵니다. UV 필터를 사용하여 현미경으로 특징을 검사하고 미세 유체 채널에 명백한 결함이 없는지 확인하십시오.
- 하드 베이크를 위해 실리콘 웨이퍼를 150°C 오븐에 최소 30분 동안 넣습니다.
- RT로 냉각하고 스타일러스 프로파일 로메 트리를 사용하여 채널 측벽의 정확한 높이와 기울기를 측정합니다.
- 유리 슬라이드의 포토리소그래피
참고: 헥사메틸디실라잔(HMDS)은 S1818 포지티브 포토레지스트(36)의 접착 촉진제로서 사용된다.- 150°C 오븐에서 유리 슬라이드를 제거하고 RT로 식힙니다.
- 진공을 사용하여 유리 슬라이드를 스피너의 척에 고정하고 스피너를 프로그래밍합니다. 1단계 - 100rpm/s의 가속도에서 10초 동안 500rpm. 2단계 - 3000rpm에서 300rpm/s의 가속도로 앉았습니다.
- 유리 슬라이드 표면에 HMDS 3-4방울을 분배합니다. 프로그램을 실행하십시오.
알림: ~3μm의 표면 코팅을 달성하려면 S1800 포지티브 포토레지스트 시리즈를 사용해야 합니다. 정확한 스핀 속도는 제형에 따라 달라질 것입니다. 아래의 권장 사항은 S1818 제형34에 대한 것입니다. - 유리 슬라이드 표면에 1mL의 포토레지스트를 분배합니다. 표면적을 덮을만큼 충분히 확인하십시오.
- 프로그램을 실행하십시오. 시스템이 정지되면 진공 청소기를 끄고 유리 슬라이드를 제거합니다.
- 부드러운 베이킹을 위해 S1818 코팅 유리 슬라이드를 120°C의 핫 플레이트에 4분 동안 놓습니다. 제거하고 RT로 오도록 허용합니다.
- 2D 전극 설계로 포토마스크를 마스크 홀더에 고정합니다.
- S1818 코팅이 위를 향하도록 유리 슬라이드를 웨이퍼 척에 삽입하고 정렬합니다. 노출 설정을 250mJ/cm2 로 설정하고 기기를 실행합니다.
알림: 다른 접촉 얼라이너 모델은 비원형, 다양한 두께의 기판에 어느 정도 적합할 수 있습니다. - 유리 슬라이드를 MF-319 현상액 용액에 2분 동안 담그십시오. 부드러운 교반을하십시오. 유리 슬라이드의 표면을 탈 이온수로 헹굽니다.
- 가압 질소 또는 여과된 공기 가스 공급원을 사용하여 표면을 건조시키고 UV 필터를 사용하여 현미경으로 특징을 관찰합니다. 리소그래피 패턴에 명백한 결함이 없는지 확인하십시오.
- 유리 슬라이드를 150°C 오븐에 넣고 단단한 베이킹을 위해 최소 30분 동안 관심 있는 기판 표면이 위를 향하도록 합니다. 오븐에서 꺼내 빛으로부터 보호하십시오.
3. 장치 제작 : 불화 수소산 (HF) 에칭
주의 : 이 단계에는 깊고 고통스러운 화학적 화상을 유발할 수 있는 불산(HF)의 취급 및 폐기가 포함됩니다. 핸들러를 보호하기 위해 추가 PPE를 사용해야합니다 (안면 보호대, 팔꿈치 길이의 내 화학성 장갑, 슬리브가있는 내 화학성 앞치마). 글루 콘산 중화제와 피부 젤은 실험실 벤치 근처에 보관해야합니다. 이 단계는 단독으로 수행해서는 안 됩니다. HF는 용기가 산에 의해 에칭되므로 유리 용기에 보관하거나 분배해서는 안됩니다.
참고: HF는 노출된 유리(즉, 전극 설계)를 균일하게 에칭하여 유리에 홈을 형성하여 금속 증착 후 전극 패턴의 더 나은 에지 해상도를 허용합니다(섹션 4).
- 유리 슬라이드를 10:1 완충 HF 용액에 폴리테트라플루오로에틸렌 용기에 1분 동안 담그십시오. 유리 슬라이드를 탈이온수로 옮기고 세척합니다. 세척 단계를 3회 반복합니다.
- 가압 질소 또는 여과 된 공기 가스 공급원을 사용하여 표면을 건조시킵니다. 유리 기판을 65°C 오븐에 밤새 넣어 남아 있는 수분을 제거합니다. 빛으로부터 기판을 덮으십시오.
4. 장치 제작 : 물리적 기상 증착
참고: 이 단계는 전극 패턴을 정의하기 위해 유리 슬라이드 기판에 금속을 증착하는 것을 포함합니다. 일반적으로 사용되는 금속 전극은 크롬/금 및 티타늄/백금입니다. 금 및 백금은 유리 기판에 부착되지 않으므로, 접착력을 촉진하기 위해 각각 크롬 또는 티타늄의 종자 접착층이 요구된다(37).
- 클린룸별 프로토콜을 따라 사내 PVD 시스템을 운영하십시오. 이 작업은 DC 스퍼터링 시스템과 ~ 8mTorr의 압력과 200W 전력에서 100SCCM 아르곤 가스로 스퍼터를 사용합니다.
- ~ 100 Å / min의 속도로 8 분 동안 티타늄을 스퍼터링합니다. ~200 Å/min의 속도로 10분 동안 백금을 스퍼터링합니다. PVD 챔버에서 기판을 제거합니다.
5. 장치 제작 : 포토 레지스트 리프트 오프
참고: 이 단계는 포토레지스트 층을 아세톤 욕조에 용해시키고 부착된 백금 전극을 유리 슬라이드에 패턴화하는 것을 포함합니다.
- 금속 코팅 유리 슬라이드를 아세톤 욕조에 ~10분 동안 담그십시오.
- 접착되지 않은 금속 필름을 분해하기 위해 교반을 도입하기 위해 욕조를 초음파 처리합니다. 필요한 경우 아세톤에 적신 물티슈를 사용하여 잔여물을 제거하십시오.
- 모든 포토레지스트/금속이 제거되면 전극 패턴을 탈이온수로 세척하고 65°C 오븐에 밤새 넣어 남아 있는 표면 수분을 제거합니다.
- 스타일러스 프로파일로메트리를 사용하여 패턴화된 전극의 프로파일을 측정합니다.
6. 장치 제작 : 소프트 리소그래피
참고: 이 단계는 엘라스토머인 폴리디메틸실록산(PDMS)을 사용하여 미세유체 채널을 SU-8 마스터 릴리프 구조 상에 복제 성형하는 것을 포함합니다.
- 실리콘 웨이퍼 실란화
참고: 이 단계는 선택 사항입니다. 그러나 하위 섹션 8에서 제작된 SU-2.1 릴리프 구조의 수명을 늘릴 것입니다. 이 단계는 화학 흄 후드에서 수행해야합니다.- 웨이퍼를 페트리 접시의 바닥에 고정하고 페트리 접시를 데시케이터에 넣습니다.
- 실리콘 웨이퍼의 둘레를 약 50μL의 트리클로로(1H,1H,2H,2H-퍼플루오로옥틸) 실란으로 둘러쌉니다. 진공 (진공 펌프 또는 하우스 진공 라인)을 연결하고 20 분 동안 실행하십시오.
- PDMS 복제 성형
- 일회용 용기(예: 계량 보트, 플라스틱 컵)에 PDMS 엘라스토머 베이스와 경화제를 전자 저울 위에 10:1 중량비로 혼합합니다. PDMS 용액을 실리콘 웨이퍼 위에 붓고 혼합물을 진공 하에 두어 모든 기포를 제거합니다.
- PDMS가 응고되도록 최소 4시간 동안 65°C에서 경화합니다. 면도날의 끝을 사용하여 성형된 PDMS를 잘라내고 실리콘 웨이퍼에서 벗겨냅니다.
- 날카로운 생검 펀치를 사용하여 장치의 입구/출구에서 PDMS를 제거합니다. 이 장치의 경우 입구와 출구에 각각 0.75mm 및 3mm 생검 펀치가 사용되었습니다.
알림: 사용된 생검 펀치는 저장소에서 튜브를 단단히 밀봉하기 위해 상호 연결 튜브의 외부 직경보다 약간 작은 직경을 가져야 합니다.
- PDMS의 초음파 처리 세척
- PDMS 장치를 IPA에 담그고 30-45분 동안 초음파 처리기에 넣어 입구/출구에서 PDMS 파편을 제거합니다. PDMS는 IPA 용액에서 팽창할 수 있습니다.
- 탈이온수로 헹구고 PDMS가 정상 크기로 다시 팽윤될 수 있도록 밤새 65°C 오븐에 넣습니다.
알림: 남은 파편은 실험 중에 장치를 막을 수 있습니다. 초음파 처리 전에 스카치 테이프 조각을 사용하여 PDMS 표면에서 큰 파편을 제거 할 수 있습니다.
7. 장치 제작 : PDMS 본딩 / 와이어 부착
참고: 이 단계는 PDMS와 유리 기판의 표면을 산소 플라즈마로 처리하여 PDMS와 유리(38) 사이에 비가역적 결합을 형성하는 것을 포함한다. 제공된 레시피는 실험실에서 사용되는 정확한 시스템에 맞게 조정해야 할 수도 있습니다.
- 장치를 크기에 맞게 자르고 PDMS 장치의 표면이 깨끗한지 확인합니다. 다시 정리하지 않으면 하위 섹션 6.3의 단계를 따르십시오.
- 플라즈마 발생기를 프로그래밍하십시오. 전력을 70W로, 시간을 35초로, 압력을 325mTorr로, 산소 가스의 유량 을 60SCCM으로 설정합니다. PDMS와 전극 유리 슬라이드를 피쳐가 위를 향하도록 시스템에 놓고 프로그램을 실행합니다.
- 장치를 제거하고 스테레오스코프를 사용하여 채널 기능을 전극에 빠르게 정렬합니다. PDMS 중앙에서 측면으로 압력을 가하여 본딩 인터페이스에서 원치 않는 기포를 제거합니다.
- 95°C의 뜨거운 장소에 최소 2분 동안 두어 접합 절차를 완료하고 장치를 RT에서 식힙니다.
- ~2" 길이로 22G 단선 6개를 자르고 양쪽 끝에서 절연체를 벗겨냅니다.
- 은 전도성 에폭시를 사용하여 전선을 전극 패드에 결합합니다. 완성된 장치를 65°C 오븐에 밤새 넣습니다.

그림 2: 마이크로 장치 제조. (A) 미세 유체 채널 제조 - 주요 단계 : 실리콘 웨이퍼 세척 (단계 2.1.1-2.1.3), 포토 레지스트 코팅 및 소프트 베이크 (단계 2.1.7-2.1.8), UV 노출 (단계 2.1.10), 개발 (단계 2.1.12) 및 PDMS 주입 (하위 섹션 6.2). (b) 전극 제조 - 주요 단계 : 유리 슬라이드 청소 (단계 2.1.1-2.1.3), HMDS 코팅 및 포토 레지스트 코팅 (단계 2.2.3-2.2.4), UV 노출 (단계 2.2.8), 현상 (단계 2.2.9), HF 에칭 (섹션 3), 물리적 기상 증착 (섹션 4) 및 포토 레지스트 리프트 오프 (섹션 5). (C) 장치 마무리-주요 단계: 입구/출구 액세스 및 초음파 처리(단계 6.2.3 및 섹션 6.3), PDMS 본딩 및 와이어 부착(섹션 7). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
8. 세포 배양 및 수확
참고: 표준 세포 배양 및 멸균 취급 절차를 사용해야 합니다. 세포 배양을 위한 세포 유형별 프로토콜을 따르십시오.
- 세포 배양
- 세포 계대: 8.1.2-8.1.5단계에 따라 세포를 배양 및 계대배양한다.
- HEK293 세포를 37°C, 95% O2, 5% CO2의 인큐베이터의 T25 플라스크에서 완전한 DMEM 용액(88% DMEM, 10% 열 불활성화된 태아 소 혈청, 1% L-글루타민, 1% 페니실린-스트렙토마이신)에서 배양합니다. ~80% 컨플루언시에 도달할 때 일정에 따라 세포를 통과합니다.
- 피펫 또는 진공 시스템을 사용하여 배지를 흡인하고 세포를 0.25% 트립신-EDTA(2mL-T25 플라스크)에서 37°C에서 2분 동안 배양합니다. 배양 배지의 두 배의 부피로 트립신을 중화하십시오.
- 세포 현탁액을 15mL 원뿔형 튜브에 옮기고 HEK293 세포를 770 x g 에서 2분 동안 원심분리합니다. 피펫 또는 진공 시스템을 사용하여 상청액을 흡입합니다.
- HEK293 세포를 예열된 DMEM 1mL에 재현탁합니다.
- 셀 도금: 8.1.7-8.1.8단계에 따라 셀을 도금합니다.
- 세포를 T25 플라스크(DMEM 중 5mL)에서 10:1 내지 20:1 희석액으로 플레이트하여 배양을 계속한다.
- 전기천공 실험을 위해 수확될 세포를 6-웰 플레이트(웰당 DMEM 2mL)에 5:1 내지 20:1 희석액으로 플레이트화한다.
참고: HEK293 세포는 세포 수확 시 ~70% 컨플루언시를 달성하기 위해 전기천공 실험 24시간 전에 도말되었습니다(하위 섹션 8.3). 일관되지 않은 수확 일정은 전기 천공 결과의 변동성으로 이어질 수 있습니다.
- 전기천공 완충액
- 전기 천공 버퍼 준비
참고: 전기천공 완충액 준비8에 대한 자세한 내용은 Sherba et al.을 참조하십시오. 완충액 조성물은 285 mM 수크로스, 0.7 mMMgCl2, 1 mM KCl, 10 mM 헤페스, 3 mM NaOH (pH: 7.4; 삼투질 농도: 310 mOsm, 전도도: 500 μS/cm)였다. 전기 천공 완충액은 멸균 방식으로 공식화되어야하며 ~ 1 개월의 저장 수명 동안 4 ° C에서 보관해야합니다. 전기천공 완충액 제형은 세포 유형별로 최적화되어야 합니다.
- 전기 천공 버퍼 준비
- 세포 수확 및 pDNA 추가
- 세포 계대 (8.1.2-8.1.4)와 동일한 단계를 따르십시오.
- 멸균된 1x PBS에서 세포를 세척하고, 세포 전달 현탁액을 15mL 원뿔형 튜브에 넣고, 세포를 770 x g 에서 2분 동안 원심분리합니다.
- HEK293 셀 펠릿을 전기천공 버퍼로 세척하고 770 x g 에서 2분 동안 원심분리합니다. 전기천공 완충액에 세포를 ~5백만 세포/mL로 재현탁합니다.
참고: 셀 밀도는 셀 유형별로 최적화되어야 합니다. - 녹색 형광 단백질(GFP)을 암호화하는 pDNA를 최종 농도 20μg/mL로 추가합니다. pDNA/세포 현탁액을 부드럽게 혼합하고 실험을 위해 현탁액을 1cc 주사기에 옮깁니다.
9. 하드웨어/실험 설정
알림: 실험을 위해 세포를 수확하기 전에 세포가 전기 천공 버퍼에 현탁되는 시간을 최소화하기 위해 실험 설정이 완료되었는지 확인하십시오. 예열을 위해 실험 20-30분 전에 전자 장치를 켜십시오. 단일 셀 검출 모듈의 작동을 위한 실험 설정의 개략도는 그림 3 을 참조하십시오.
참고: 맞춤형 PA90 연산 증폭기 회로는 잠금 증폭기를 사용하는 단일 셀 레벨 감지에 필요한 감도와 충분히 강한 전기천공 펄스를 적용하는 데 필요한 고전압을 모두 수용하기 위해 개발되었습니다. 권장 회로39에 대한 사양은 PA90 데이터시트를 참조하십시오.
- 전류 전치 증폭기 설정으로 잠금 증폭기를 초기화하고 알고리즘을 통해 설정합니다. 잠금 설정32에 대한 자세한 내용은 Zheng et al.을 참조하십시오.
- 전원 공급 장치, 함수 발생기 및 증폭기
- 전원 공급 장치 1: 회로의 음극 끝에 전원을 공급하려면 -15V로 설정합니다.
- 전원 공급 장치 2(함수 발생기): DC 신호를 출력하도록 설정하고 진폭을 2V로 설정합니다. 50x 앰프 입력에 연결합니다.
- 구형파에 대한 전기 천공 펄스 발생기 프로그램 : 원하는 펄스 폭 (듀티 사이클)과 원하는 펄스 진폭 (볼트)을 설정합니다.
- 출력을 트리거 모드(1펄스)로 설정합니다. 출력을 50x 앰프의 입력에 연결합니다.
알림: 펄스 진폭을 프로그래밍할 때 50x 게인을 기억하십시오. 즉, 1kV/cm의 전계 강도를 달성하려면 총 30V, 30V/300μm(전극 간 거리)가 필요하므로 함수 발생기 출력을 30/50 또는 600mV로 설정해야 합니다. - 오실로스코프를 사용하여 50x 증폭기의 출력을 확인합니다. 전원 공급 장치 1에서 100-2V를 출력합니다(9.2.2). 출력 2- 전기 천공 펄스에 대한 가변 진폭 (9.2.4).
- 10x 프로브를 오실로스코프 채널에 연결하고 전기 천공 펄스가 적용될 단계 7.6에서 완성 된 마이크로 장치 (테스트중인 장치, DUT)에 연결합니다. 실험 중에 시스템을 모니터링하여 펄스가 적용되고 있는지 확인합니다.
- 잠금 USB가 연결되고 등록되었는지 확인합니다. 알고리즘 코드의 모든 잠금 설정(가장 중요한 잠금 출력 주파수)을 다시 확인합니다.
- 현미경/CCD 카메라
- 슬라이드 홀더를 통해 마이크로 장치를 현미경 스테이지에 놓습니다. CCD 카메라를 켜고 미세 유체 채널에 초점을 맞춥니다. 4x 또는 10x 대물렌즈를 사용합니다.
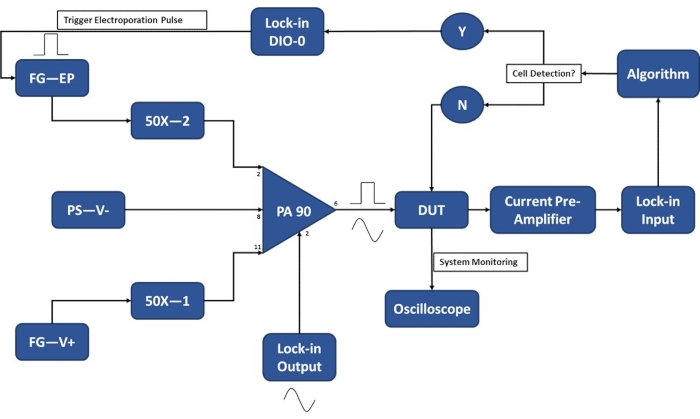
그림 3: 실험 설정 회로도-단일 세포 감지. 고전력 연산 증폭기(PA-90)를 사용하면 단일 셀 감지에 필요한 잠금 출력 AC 신호에 고전압 전기천공 펄스를 중첩할 수 있습니다. 이 여기 신호는 마이크로 전기 천공 장치 (테스트 대상 장치, DUT)를 통과하여 전류가 전류 프리 앰프에 의해 증폭되어 알고리즘에 공급됩니다. 시스템은 세포 검출 이벤트를 지속적으로 모니터링합니다. 셀 입력 시 잠금 증폭기에 의해 디지털 신호가 생성되어 전송 중인 셀에 전기천공 펄스의 적용을 트리거합니다. 범례: PA-90 (고출력 연산 증폭기), DUT(테스트 대상 장치), DIO(디지털 입력/출력), FG-EP(함수 발생기/전기 천공 펄스), 50X(50X 증폭기), PS-V-(전원 공급 장치/PA 90용 음전압), FG-V+(함수 발생기, PA 90용 포지티브 전압). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
10. 실험 작업
- 미세유체 채널 프라이밍
- 세포가 로드된 주사기에서 모든 기포를 제거합니다. 세포가 로드된 주사기에 30G 바늘을 부착합니다.
- 핀셋을 사용하여 타이곤 튜브를 바늘 길이만큼 밉니다. 배출 저장소를 회수 매체 (항생제가없는 8.1.2 단계와 동일), ~ 40-50 μL로 미리 채 웁니다.
- 엄지 손가락을 사용하여 유체가 튜브 라인의 끝에 천천히 도달하도록 플런저에 부드럽게 압력을 가합니다.
- 주사기를 주사기 펌프에 고정합니다. 주사기 펌프를 켜고 관류가 순방향으로 설정되어 있는지 확인하십시오.
- 유량이 정확한지 확인하기 위해 주사기의 적절한 직경에 맞게 펌프를 프로그래밍하십시오. 주사기 직경에 대한 자세한 내용은 펌프 설명서를 참조하십시오.
알림: 세포가 주사기에 정착하는 것을 방지하려면 주사기 끝이 아래를 향하도록 수직 위치에서 작동할 수 있도록 주사기 펌프를 클램프 스탠드에 고정합니다. - 주사기 펌프 유량을 ~10-20μL/min으로 설정하고 유체가 튜브 라인 끝에 도달할 때까지 펌프를 작동시킵니다. 튜브를 미세 유체 장치에 고정합니다.
- 주사기 펌프 유속을 ~5-10μL/min으로 낮추고 모든 공기가 미세유체 장치에서 배출되고 세포가 장치 출구로 이동할 때까지 펌프를 작동시킵니다.
- 피펫 흡인을 통해 배출구에서 세포를 제거합니다. 배출 저장소를 회수 매체 (항생제가없는 8.1.2 단계와 동일) ~ 40-50 μL로 다시 채 웁니다.
- 단일 세포 전기천공-세포막 투과화 매핑
참고: 각각 세포막 투과화 및 세포막 투과화 매핑을 나타내는 전기 데이터를 더 잘 이해하려면 그림 4 및 그림 5 를 참조하십시오.- 주사기 펌프 유량을 ~0.1-0.3μL/min으로 설정하여 전극 세트를 통한 단일 셀의 흐름을 보장합니다. 전극 사이의 셀 통과 시간은 ~ 250ms이어야합니다.
- 실행을 클릭하여 컴퓨터 프로그램을 시작하십시오. 시스템이 전기 데이터를 저장하고 있는지 확인하십시오.
- 시스템이 컴퓨터 제어 펄스 애플리케이션을 트리거하기 위해 세포를 안정적으로 감지하는지 확인합니다. 그에 따라 감지 임계값을 조정합니다.
- 초기의 가장 낮은 전기 에너지 전기 천공 펄스에 대한 펄스 매개 변수를 설정합니다. 이 연구에서 전기천공 펄스 파라미터에 대해서는 표 1 을 참조하십시오.
- 전기 천공 펄스 발생기의 출력 채널을 켭니다 (단계 9.2.3).
- 사전 결정된 수의 세포 검출/펄스 어플리케이션을 따르십시오(n =100). 테스트된 각 조건이 끝나면 마이크로 장치 배출구에서 세포를 흡입하고 배출구에 복구 매체를 보충합니다.
- 다음 전기천공 펄스 조건으로 반복합니다. 모든 전기 천공 펄스 조건이 테스트 될 때까지 반복하십시오.
- 테스트된 각 펄스 적용에 대한 세포막 투과 정도를 결정합니다. (사후 공정 검증은 하위 섹션 11.1에 설명되어 있습니다.) 세포막 투과화 맵을 생성합니다(그림 5).
- 고처리량, 모집단 기반 피드백을 위한 전기천공 펄스 파라미터를 결정합니다.
- 주사기 펌프를 끄고 배출구에서 셀을 제거한 다음 배출구에 회수 매체를 보충합니다.
- 인구 기반 피드백 제어 전기 천공 - 높은 처리량
참고: 인구 기반 피드백 프로세스를 보여주는 개략도는 그림 6 을 참조하십시오.- 주사기 펌프 유량을 ~1-3μL/min으로 설정하여 전극 세트를 통한 단일 셀의 흐름을 보장합니다. 전극 사이의 셀 통과 시간은 ~25ms여야 합니다.
- 펄스 진폭을 '최적화된' 조건(10.2.9)으로 설정하고, 트리거 모드를 끄고, 셀 이동 시간과 일치하도록 펄스 폭을 설정합니다.
- 펄스 ON 시간이 '최적화된' 조건과 일치하도록 듀티 사이클을 설정합니다. 표 1을 참조하십시오.
- 출력 채널 함수 발생기를 ON으로 설정하고 주사기 펌프를 켜고 원하는 수의 셀이 전기천공될 때까지 시스템을 실행합니다.
- 완료되면 주사기 펌프와 함수 발생기를 모두 끕니다.
- 출구 저장소에서 사전 예열된 회수 배지로 채워진 적절한 크기의 세포 배양 플라스크/플레이트로 세포를 옮기고 배양 플라스크/플레이트를 인큐베이터로 옮깁니다.
11. 분석
- 단일 세포 수준 막 투과화 검출
알림: 높은 처리량 모듈 중에 '최적의'펄스가 사용되었는지 확인하려면 실험 후 분석을 수행하여 하위 섹션 10.2에서 내 보낸 전기 데이터를 확인해야합니다. 전기 천공으로 인한 막 투과화를 나타내는 전기 신호의 그래픽 표현은 그림 4 를 참조하십시오.- 분석 소프트웨어(MATLAB, Python 등)에 데이터를 불러옵니다. 각 펄스 조건에 대해 전류 대 시간의 플롯을 생성합니다.
- 세포막 투과 정도를 수동으로 결정합니다(Δ IP / ΔIC). 그림 4를 참조하십시오. 테스트된 모든 펄스 조건에서 세포막 투과화 맵(Δ IP / ΔIC 대 전기 에너지, 그림 5)을 생성합니다. '최적' 펄스 조건을 확인합니다.
- 전기 형질주입 효율(eTE)
- 24-h 배양 기간 후, 인큐베이터에서 전기 천공 된 세포를 제거합니다.
- 살아있는 세포 염색을 수행하십시오. DRAQ5를 세포 배양 용기에서 최종 농도 5 μM로 1:1000으로 희석합니다. 세포/염색 용액을 부드럽게 혼합하고 37°C에서 5-30분 동안 배양합니다.
알림: 이 단계에서는 다른 얼룩을 구현할 수 있습니다. 형광 특성이 성공적인 전기 형질감염을 나타내는 형광 마커와 겹치지 않도록 합니다(즉, GFP는 녹색 파장이고 DRAQ5는 원적색). - 에피형광 현미경, 램프 및 카메라를 켭니다( 재료 표 참조).
- 인큐베이터에서 세포를 제거하고 현미경에 초점을 맞춥니다.
- 선택한 필드의 위상차 이미지(명시야)를 캡처합니다.
- FITC(GFP) 및 원적(DRAQ5) 필터를 사용하여 동일한 필드의 에피형광 이미지를 캡처합니다. 이미지 세트를 수동으로 또는 알고리즘을 통해 분석합니다.
참고: 대표 이미지는 그림 7 을 참조하십시오. - 모든 이미지에서 GFP 양성 세포의 총 수를 계산합니다. 모든 이미지에서 DRAQ5 염색된 세포의 총 수를 계산합니다. eTE(GFP 양성 세포와 DRAQ5 염색 세포의 비율)를 계산합니다.
결과
그림 4는 단일 펄스 진폭에 대한 단일 셀 수준 막 투과화 감지의 작동 원리를 강조합니다. 전기천공 실험 개시 후, 세포 검출 알고리즘은 포인트-바이-포인트, 기울기 기반 검출 방법을 통해 세포 검출을 위한 최적의 임계값을 결정한다. 그런 다음 시스템은 측정된 전류의 상당한 음의 변화에 대해 (1)을 지속적으로 모니터링하며, 이는 셀의 유입을 나타냅니다. 이는 생물학적 세포막의 절연 특성으로 인해 세포가 전극 세트를 통과 할 때 임피던스가 순간적으로 증가하여 측정 된 전류가 급격히 감소하여 일관된 세포 감지 (2)가 가능하여 궁극적으로 컴퓨터 제어 펄스 애플리케이션 (4)으로의 전환을 트리거합니다. 절연 셀은 전극 사이에서 부피의 전해질을 대체하여 셀 크기에 비례하는 전류 강하를 초래합니다. 이러한 전류의 변화는 ΔIC (3)로서 표기된다. ΔIC 계산 직후, 미리 결정된 전기 펄스가 이동 중인 세포에 투여된다(4). 이 순간적인 에너지 유입은 시스템에 간단한 감지 아티팩트를 도입합니다 (회색 상자). 신호에 다시 고정될 때, 즉 셀 모니터링으로 다시 전환하면, (5) 전기천공 펄스가 출구 (6) 시 전극 세트 사이의 셀 존재로 인한 전류 변화의 크기가 떨어지면서 세포막을 투과시켰음이 분명합니다. 전기천공 펄스 적용 전/후 셀의 임피던스 크기로 인한 두 전류 강하의 차이를 투과화 전류라고 하며 ΔIP로 표시됩니다. 셀이 전극 사이의 부피를 벗어나면 기준선이 안정화되고 시스템은 셀 검출 모드로 돌아갑니다(1). 미리 결정된 수의 셀이 전기천공된 후 다음으로 높은 에너지 전기천공 펄스가 테스트됩니다(펄스 설정은 표 1 참조). 테스트된 각 전기천공 펄스에 대해 평균 '막 투과화 정도'가 결정됩니다. 이 값은 Δ IP / ΔIC로 계산됩니다. 미리 결정된 각 전기천공 펄스가 테스트되면, Δ IP/ΔI C는 적용된 전기 에너지 밀도 (σ x E 2 x t)에 대해 플롯되며, 여기서 σ는 용액 전도도 (S / cm), E는 전계 강도 (kV / cm), t는 펄스 지속 시간 (ms)입니다. 본 실시예에서 사용된 HEK293 세포에 대한 세포막 투과화 맵은 도 5를 참조한다.
표 1: 전기천공 펄스 매개변수. 이 연구를 위해 전하 플럭스 (σ×E ×t)가 일정하게 유지되도록 전기 천공 펄스가 선택되었으며, 여기서 σ는 용액 전도도 (S / cm), E는 전계 강도 (kV / cm) 및 t는 펄스 지속 시간 (ms)입니다. 결과는 적용된 펄스 전기 에너지의 스펙트럼입니다. 지정된 펄스 파라미터를 달성하기 위해 요구되는 듀티 사이클(d.c.)의 예는 초기(단일 셀 검출) 유량의 5× 및 10× 증가 모두에 대해 제공됩니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
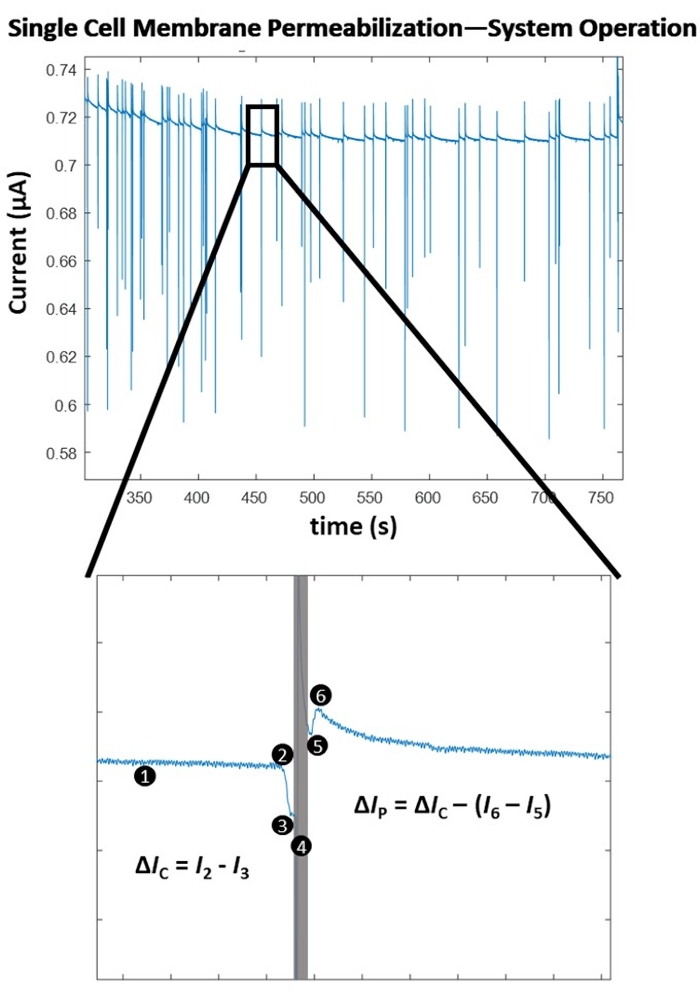
그림 4: 단일 세포막 투과화 - 알고리즘 작동. (상단) 일련의 단일 셀 검출 / 펄스 애플리케이션의 전기적 기록 (전류의 급격한 스파이크로 표시). (하단) 단일 셀의 감지 및 펄스를 위한 시스템 작동. (1) 시스템은 포인트별 기울기 계산을 통해 전류의 변화를 지속적으로 감지합니다. (2) 기울기의 급격한 감소가 감지되어 전극 사이에 셀이 들어가는 것을 나타내며 컴퓨터 제어 펄스 적용을 트리거합니다. (3) 전류 강하 (ΔIC)가 결정되고 셀의 크기에 비례합니다. (4) 전기 천공 펄스가 이동 중인 셀에 적용되어 전기 신호(회색 상자)에 감지 아티팩트가 발생합니다. (5) 잠금 증폭기는 전송 중인 셀에 다시 잠길 때 셀 모니터링으로 다시 전환됩니다. (6) 셀이 전극 세트를 빠져 나와 전류에서 또 다른 더 작은 크기의 스파이크를 일으 킵니다 (Δ IC > (I 6 - I5)). 임피던스 측정의 차이는 절연 된 세포막을 통한 기공 형성 때문입니다. 이러한 전류의 변화를 투과 전류(ΔIP)라고 합니다. 세포막 투과화의 정도가 계산된다 (Δ IP / ΔIC). 기준선이 안정화되고 시스템이 감지 모드(1)로 돌아갑니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
적용된 전기 에너지와 세포막 투과 정도 사이에 뚜렷한 상관 관계가 관찰되며(그림 5), 세포막 투과 정도가 크게 증가하는 전이 영역의 존재가 있습니다. 이를 위해 이 전이 영역을 능가하는 전기 에너지를 가진 펄스가 미세 전기천공 공정의 고처리량 단계를 위해 선택됩니다(그림 6). 이 실험에서는 1.8kV/cm:670μs 펄스가 '최적'으로 결정되었습니다. 프로토콜의 하위 섹션 10.3에서 자세히 설명한 바와 같이 시스템 유량이 증가하고 함수 발생기가 설정된 펄스 및 듀티 사이클(1.5μL/min 및 3.0μL/min 유량에 대한 펄스 설정은 표 1 참조)로 펄스를 지속적으로 출력하도록 설정되어 이동 중인 각 셀에 1 펄스가 적용되도록 합니다. 이 연구에서는 유량이 5배 증가하여 펄스 폭이 2.7%의 듀티 사이클(dc)에서 50ms(셀 통과 시간과 일치)로 설정되었습니다.
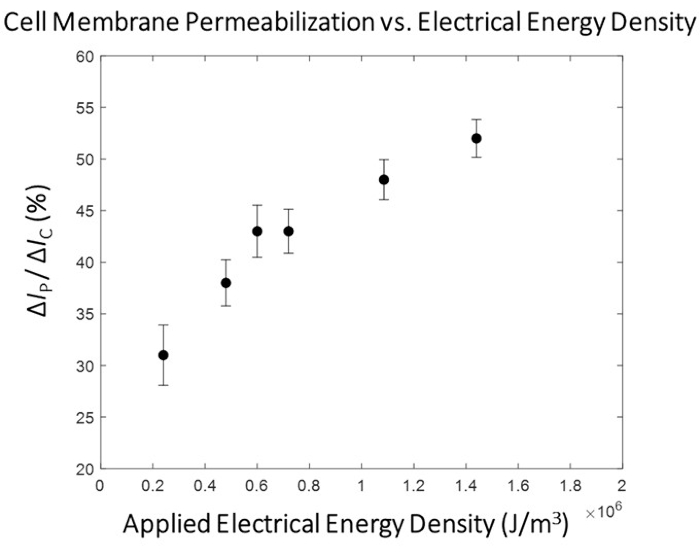
그림 5: HEK293 세포막 투과화 매핑 -ΔIp/ ΔIc 대 전기 에너지. 전기 데이터(ΔIP/ΔIC)는 평균 ± SEM으로 표시됩니다. 펄스 조건 (왼쪽에서 오른쪽으로) - 0.4 kV / cm : 3 ms, 0.8 kV / cm : 1.5 ms, 1.0 kV / cm : 1.2 ms, 1.2 kV / cm : 1 ms, 1.8 kV / cm : 0.67 ms, 2.4 kV / cm : 0.5 ms. 세포막 투과 정도와 적용된 펄스의 전기 에너지 밀도 사이에 명확한 상관 관계가 관찰됩니다. 이 실험에서는 1.8kV/cm: 0.67ms 펄스 조건이 고처리량 모듈의 '최적' 전기천공 펄스로 선택되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
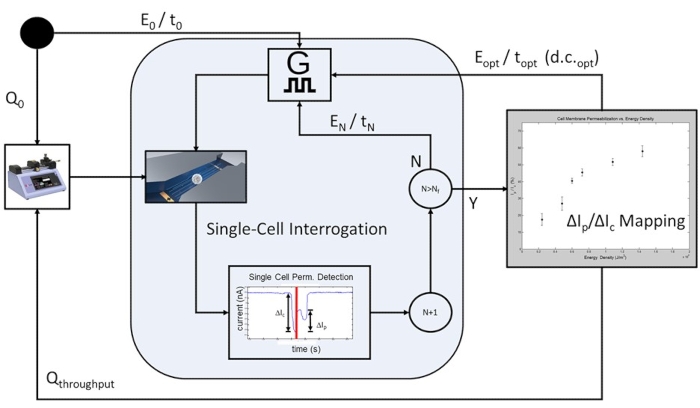
그림 6: 세포 집단 기반 피드백 제어 전기천공 공정 워크플로. 시작하기 위해, 초기 유량은 단일 셀 수준의 전기 질의를 허용하도록 프로그래밍된다(Q0). 프로그래밍 가능한 수의 셀은 미리 결정된 각 전기 천공 펄스 조건 (E 0 / t0에서 EN / t N)에서 펄스되며, 적용된 전기 에너지는 전기 천공 펄스 애플리케이션의 각 반복마다 증가합니다. 연구에 포함 된 가장 높은 전기 에너지펄스 인 EN / tN이 완료되면 세포막 투과 곡선이 그려지고 테스트중인 세포 집단에 대한 최적의 전기 천공 펄스가 결정됩니다. 시스템은 유속이 Q 처리량으로 증가하고 속도 제한 단일 셀 조사 단계가 생략되는 고처리량 모드로 진행됩니다. 최적의 펄스 트레인은 d.c.opt에서 E opt/t opt를 연속적으로 적용하여 이동 중인 각 셀이 셀 이동 시간 및 펄스 폭 듀티 사이클(dc)에 기초하여 단일 전기천공 펄스를 수신할 것이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
전기천공 후 24시간 회복 후, 세포를 이미지화하여 전기-형질감염 효율(eTE)을 결정하였다. 프로토콜의 서브섹션 11.2에 기재된 바와 같이, eTE는 DRAQ5로 염색된 세포의 총 수로 정규화된 GFP를 발현하는 세포의 총 수로서 결정되었다. 1.8kV/cm: 670μs 펄스에 대한 eTE는 ~70%로 측정되었습니다(그림 7A). 세포막 투과 정도를 정확하게 매핑하고 고처리량 모드로 전환할 때 충분히 높은 전기천공 펄스 에너지를 선택하는 시스템의 중요성을 강조하기 위해 eTE 측면에서 0.4kV/cm:3ms 펄스 조건도 살펴보았습니다(그림 7B). 이 경우, 생성된 24시간에서의 eTE는 5% 미만이었다.
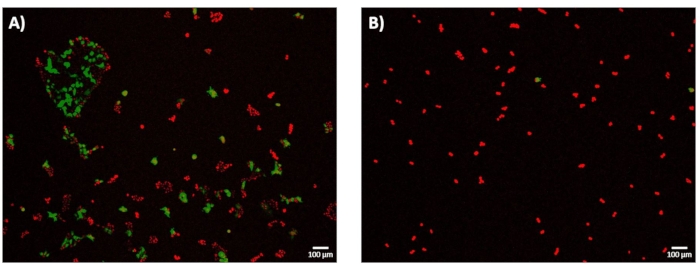
그림 7: 24시간에서의 전기형질감염 효율-GFP 발현. HEK293 세포는 마이크로 전기천공 실험 후 24시간 동안 37°C에서 배양되었다. 모든 세포를 DRAQ5 (적색)로 염색하고, 전체 세포 수 (적색)에 대한 GFP (녹색)를 발현하는 세포의 비율에 기초하여 전기 형질 감염 효율 (eTE)을 결정하였다. 세포 생존율은 본 연구에서 결과 지표로서 평가되지 않았다. (A) 대략 70%의 eTE를 보여주는 1.8 kV/cm:670 μs 펄스를 통해 성공적으로 형질감염된 HEK293 세포의 대표적인 적층형 4× 형광 이미지. (b) 대표적인, 0.4 kV/cm:3 ms 펄스를 통해 성공적으로 형질감염된 HEK293 세포의 적층된 4× 형광 이미지는 eTE << 5%를 나타낸다. 스케일 바: 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: 2차원 CAD 회로도. 마이크로 전기 천공 장치는 직경 1mm의 입구와 3mm 직경의 출구가있는 직선 100μm 너비의 마이크로 채널로 구성됩니다. 각 전극 트레이스의 폭은 100μm이며 전극 세트는 300μm 길이의 장치의 전기 천공 영역을 포함합니다. 마이크로 채널의 3차원 높이는 포토레지스트의 두께에 의해 제어된다. 이 작업에서 장치의 높이는 20 μm였습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 프로토콜에 제시된 방법론은 주로 특수 전기 천공 실험 설정에 통합되는 미세 유체 장치의 미세 가공에 중점을 둡니다. 미세 가공 공정의 세부 사항을 설명 할 때 자주 사용되는 '레시피'라는 용어는 작동하는 장치를 성공적으로 제작하기 위해 각 단계를 따르거나 최적화하는 것의 중요성을 암시합니다. 그러나 UV 노출 시간/에너지, PVD 스퍼터링 속도/지속 시간 및 산소 플라즈마 발생기 설정과 같이 최적화되지 않은 공정 내의 특정 중요한 단계는 제조 공정과 전기천공 실험의 성공적인 실행 모두에 문제가 될 수 있습니다. 제작 프로세스 문제 해결은 주로 시행 착오 또는보다 통제 된 실험 설계 실험 설계를 통해 수행됩니다. 추가적으로, 프로토콜 내에서 상이한 단계들을 수행하기 위해 대체될 수 있는 대안적인 미세가공 기술, 예컨대 DRIE(Deep Reactive Ion Etching)가 있다(즉, 연질 리소그래피 공정을 수행하기 위해 DRIE 에칭된 성형 구조를 사용함). 또한 레시피를 최적화하고 장치를 설계/제작하는 것은 현장 초보자에게 시간이 많이 소요될 수 있습니다. 그러나 미세 가공 공정이 성공적으로 개발되면 엔지니어/과학자는 특정 요구에 적합한 장치를 자유롭게 설계할 수 있습니다.
이를 위해, 이 프로토콜 내에 기술된 장치는 우리의 이전 작업(32)을 확장하기 위해 개발되었다. 이것은 단일 세포 막 투과 전기 검출의 활용을 수반했지만 더 높은 처리량 방식으로 이루어졌습니다. 여기에 설명된 실험 설정에는 표준 연구실에서 흔하지 않을 수 있는 특수 장비, 즉 잠금 증폭기가 필요하므로 이 기술의 잠재적인 도달 범위와 적응성이 제한됩니다. 그러나, '베어 본' 미세유체 전기천공 장치는 이 프로토콜에 따라 구현될 수 있으며, 전기천공 펄스를 생성하기 위해 함수 발생기와 전압 증폭기만 있으면 된다.
그럼에도 불구하고 이 미세 전기 천공 플랫폼은 다른 단일 세포 전기 천공 기술과 구별됩니다. 연속 흐름 환경에서 단일 셀 현탁액의 전기천공 파라미터를 전기적으로 감지하고 최적화하는 기능은 정말 혁신적입니다. 향후 작업에는 성공적인 전기 천공 결과와 관련된 다른 중요한 실험 매개 변수 ( 그림 1 참조)를 최적화하여이 플랫폼의 전반적인 효율성을 더욱 향상시키는 작업이 포함됩니다. 추가 생존력 및 대사 분석은 마이크로 전기 천공 플랫폼과 관련된 잠재적 인 부정적인 다운 스트림 효과를 평가하기 위해 개발 및 구현 될 것입니다. 더욱이, 마이크로유체 설계는 다른 그룹(40)에 의해 입증된 바와 같이, 더 높은 세포 처리량을 달성하기 위해 계속 개선될 수 있다. 이러한 우려를 해결하면이 기술은 폐쇄 형 및 자동화 된 공정 모두에 매우 적합하기 때문에 유전자 전달 및 / 또는 유전자 편집을 수행하기 위해 세포 치료제 제조 공정에 채택 될 가능성이 있습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 국립 과학 재단 (NSF CBET 0967598, DBI IDBR 1353918)과 미국 교육부의 정밀 및 개인화 의학 신흥 분야의 대학원 교육 (P200A150131)의 재정 지원을 인정하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
참고문헌
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O'Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053(2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications - An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods - An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU. , Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021).
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU. , Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001).
- Substrate Preparation. MicroChemicals. , Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021).
- Lisinenkova, M., Hahn, L., Schulz, J. 4M 2006 - Second International Conference on Multi-Material Micro Manufacture. , Elsevier. 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive - alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX. , Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021).
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045(2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유