Method Article
La fabricación y operación de un sistema de microelectroporación de flujo continuo con detección de permeabilización
En este artículo
Resumen
Este protocolo describe las técnicas de microfabricación necesarias para construir un dispositivo de electroporación microfluídica de laboratorio en un chip. La configuración experimental realiza transfecciones controladas a nivel de una sola célula en un flujo continuo y se puede extender a rendimientos más altos con control basado en la población. Se proporciona un análisis que muestra la capacidad de monitorear eléctricamente el grado de permeabilización de la membrana celular en tiempo real.
Resumen
Las innovaciones terapéuticas actuales, como la terapia de células CAR-T, dependen en gran medida de la administración de genes mediada por virus. Aunque eficiente, esta técnica se acompaña de altos costos de fabricación, lo que ha provocado un interés en el uso de métodos alternativos para la administración de genes. La electroporación es un enfoque electrofísico, no viral para la entrega intracelular de genes y otros materiales exógenos. Tras la aplicación de un campo eléctrico, la membrana celular permite temporalmente la entrega molecular en la célula. Típicamente, la electroporación se realiza en la macroescala para procesar un gran número de células. Sin embargo, este enfoque requiere un extenso desarrollo de protocolos empíricos, lo cual es costoso cuando se trabaja con tipos de células primarias y difíciles de transfetar. El largo desarrollo del protocolo, junto con el requisito de grandes voltajes para lograr suficientes intensidades de campo eléctrico para permeabilizar las células, ha llevado al desarrollo de dispositivos de electroporación a microescala. Estos dispositivos de microelectroporación se fabrican utilizando técnicas comunes de microfabricación y permiten un mayor control experimental con el potencial de mantener altas capacidades de rendimiento. Este trabajo se basa en una tecnología de electroporación microfluídica capaz de detectar el nivel de permeabilización de la membrana celular a nivel de una sola célula bajo flujo continuo. Sin embargo, esta tecnología se limitó a 4 celdas procesadas por segundo, y por lo tanto se propone y presenta aquí un nuevo enfoque para aumentar el rendimiento del sistema. Esta nueva técnica, denominada control de retroalimentación basado en la población celular, considera la respuesta de permeabilización celular a una variedad de condiciones de pulso de electroporación y determina las condiciones de pulso de electroporación más adecuadas para el tipo de célula bajo prueba. Luego se utiliza un modo de mayor rendimiento, donde este pulso "óptimo" se aplica a la suspensión celular en tránsito. Los pasos para fabricar el dispositivo, configurar y ejecutar los experimentos microfluídicos y analizar los resultados se presentan en detalle. Finalmente, esta tecnología de microelectroporación se demuestra mediante la entrega de un plásmido de ADN que codifica para la proteína fluorescente verde (GFP) en las células HEK293.
Introducción
Las innovaciones terapéuticas actuales en la investigación biomédica, como la terapia celular CAR-T (Chimeric Antigen Receptor Engineered T cell) y la edición genética utilizando CRISPR (secuencias de ADN de repetición palindrómica cortas agrupadas regularmente interespaciadas) / Cas9, dependen en gran medida de la capacidad de entregar material exógeno tanto con éxito como de manera eficiente en el espacio intracelular1. En la terapia CAR-T, el estándar de oro para realizar el paso de entrega de genes en la fabricación de terapia celular es el uso de vectores virales2. Aunque la administración de genes mediada por virus es una modalidad de entrega eficiente, también tiene varios inconvenientes. Estos incluyen costos de fabricación, citotoxicidad, inmunogenicidad, potencial de mutagénesis / tumorigénesis y limitaciones de tamaño en el gen (s) que se administrará3. Estas limitaciones han llevado a la investigación y el desarrollo de tecnologías alternativas de administración no viral.
La electroporación, una alternativa a la entrega de genes mediada por virus, se basa en la aplicación de una forma de onda de pulso eléctrico óptima para realizar transfecciones de ADN, ARN y proteínas de las células. Después de la aplicación de un campo eléctrico externo, la membrana celular se ve brevemente comprometida, lo que hace que la célula sea susceptible a la entrega intracelular de materiales exógenos impermeables4. En comparación con la administración mediada por virus, la electroporación es ventajosa ya que generalmente es segura, fácil de operar y tiene bajos costos operativos. La electroporación puede entregar carga molecular pequeña y grande y puede ser eficiente en la transfección de células independientemente del linaje5. Para lograr resultados deseables después de la electroporación, es decir, buena viabilidad y buena eficiencia de electrotransfección, es necesario cooptimizar una variedad de parámetros experimentales. Estos incluyen el tipo de célula6, la densidad celular, la concentración de la molécula7, las propiedades del tampón de electroporación (por ejemplo, composición molecular, conductividad y osmolaridad)8, el tamaño/geometría del electrodo9 y la forma de onda del pulso eléctrico (forma, polaridad, número de pulsos)10 (consulte la Figura 1 para una ilustración). Aunque cada uno de estos parámetros puede tener un efecto significativo en los resultados de los experimentos de electroporación, la forma de onda de pulso ha sido especialmente estudiada con gran detalle, ya que la energía eléctrica del pulso aplicado es la raíz de la compensación intrínseca entre la viabilidad celular resultante y la eficiencia de electrotransfección8.
Típicamente, los experimentos de electroporación se realizan en la macroescala, donde las células están suspendidas en 100s de microlitros de tampón entre un conjunto de electrodos grandes de placa paralela dentro de una cubeta de electroporación. Los electrodos se fabrican comúnmente en aluminio con una distancia de electrodo de 1-4 mm. Una vez que las celdas se cargan manualmente a través de una pipeta, la cubeta se conecta eléctricamente a un voluminoso generador de impulsos eléctricos donde el usuario puede configurar y aplicar los parámetros de forma de onda de pulso para electroporar la suspensión celular. Aunque la electroporación a macroescala o a granel puede procesar densidades celulares >106 células/ml, esta característica puede ser un desperdicio al optimizar los ajustes de la forma de onda del pulso eléctrico. Esto es particularmente preocupante cuando se electroporan tipos de células primarias donde el número de poblaciones celulares puede ser limitado. Además, debido a la gran distancia entre los electrodos, el generador de impulsos debe ser capaz de suministrar grandes voltajes para lograr intensidades de campo eléctrico >1kV / cm11. Estos altos voltajes causan una disipación de potencia resistiva a través del tampón electrolítico, lo que resulta en el calentamiento de Joule, lo que puede ser perjudicial para la viabilidad celular resultante12. Por último, la realización de la electroporación en una suspensión densa de células estará constantemente cargada con una variabilidad innata en la eficiencia de electrotransfección resultante y la viabilidad celular. Cada celda en suspensión podría experimentar una intensidad de campo eléctrico diferente debido a las células circundantes. Dependiendo de si la intensidad del campo eléctrico experimentado aumenta o disminuye, la viabilidad celular resultante o la eficiencia de la electrotransfección pueden verse afectadas negativamente11. Estas desventajas de la electroporación a macroescala han llevado a la búsqueda y desarrollo de tecnologías alternativas que operan a microescala y permiten un mejor control a nivel de una sola célula.
El campo de BioMEMS, o sistemas biomédicos microelectromecánicos, se deriva de los avances tecnológicos realizados en la industria de la microelectrónica. Específicamente, utilizando procesos de microfabricación para desarrollar microdispositivos para el avance de la investigación biomédica. Estos avances incluyen el desarrollo de matrices de microelectrodos para monitoreo eléctrico in vivo13, microelectrodos capacitivos para electroporación in situ 14, dispositivos miniaturizados de órgano en un chip 15, diagnósticos microfluídicos en el punto de atención16, biosensores 17 y sistemas de administración de fármacos 18, incluidos dispositivos de nano y microelectroporación 19,20,21 . Debido a la capacidad de diseñar y fabricar dispositivos a la misma escala de tamaño que las células biológicas, las tecnologías de nano y microelectroporación son ventajosas en comparación con su contraparte a macroescala22,23. Estos dispositivos de electroporación eliminan el requisito de aplicaciones de pulsos de alto voltaje, ya que los conjuntos de electrodos con espaciamientos de 10s a 100s de micrómetros suelen estar integrados. Esta característica reduce drásticamente la corriente a través del electrolito, lo que a su vez reduce la acumulación de productos tóxicos de electrólisis y los efectos del calentamiento Joule en estos sistemas. Los canales a microescala también aseguran que un campo eléctrico mucho más uniforme se aplique de manera confiable a las células durante la aplicación del pulso, lo que resulta en resultados más consistentes24. Además, también es común que los dispositivos de microelectroporación se integren en una plataforma microfluídica que se presta para la futura integración en una tecnología totalmente automatizada, una capacidad altamente deseable en la fabricación de terapia celular25. Por último, la electroporación a microescala permite la interrogación eléctrica de eventos de electroporación. Por ejemplo, el grado de permeabilización de la membrana celular puede ser monitoreado en tiempo real a un nivel de una sola célula26,27. El propósito de este método es describir la microfabricación, el funcionamiento del sistema y el análisis de un dispositivo microfluídico de microelectroporación unicelular capaz de medir el grado de permeabilización de la membrana celular para optimizar los protocolos de electroporación, pero aumentando el rendimiento sobre el estado de la técnica anterior.
La realización de electroporación a nivel unicelular ya no es una técnica novedosa, como fue demostrado por primera vez por Rubinsky et al. en 2001 con el desarrollo de una tecnología de electroporación de células estáticas28. Su microdispositivo fue innovador, ya que fueron los primeros en demostrar la capacidad de monitorear eléctricamente el evento de electroporación. Esto ha llevado al desarrollo de tecnologías estáticas de electroporación unicelular capaces de detectar eléctricamente el grado de permeabilización de la membrana celular de manera paralelizada para aumentar el rendimiento de los dispositivos. Sin embargo, incluso con paralelización y procesamiento por lotes, estos dispositivos carecen gravemente del número total de celdas que pueden procesar por unidad de tiempo29,30. Esta limitación ha llevado al desarrollo de dispositivos de flujo continuo capaces de realizar microelectroporación a nivel de una sola célula a rendimientos mucho mayores31. Esta transición del dispositivo, de entorno estático a entorno de flujo continuo, limita la capacidad de monitorear eléctricamente el grado de permeabilización de la membrana celular después de la aplicación del pulso de electroporación. El método descrito en este trabajo cierra la brecha entre estas dos tecnologías, una tecnología de microelectroporación capaz de detectar eléctricamente, pulsar y monitorear el grado de permeabilización de la membrana celular de células individuales, de manera continua y en serie.
Esta tecnología fue descrita recientemente en Zheng et al. En ese trabajo, las capacidades de esta tecnología fueron introducidas con la realización de un estudio paramétrico, donde se varió tanto la amplitud como la duración del pulso de electroporación, y se exploró la consiguiente señal eléctrica, indicativa de permeabilización de la membrana celular32. Los resultados mostraron que un aumento en la intensidad del pulso de electroporación (es decir, aumento en el campo eléctrico aplicado o aumento en la duración del pulso) causó un aumento en la permeabilización de la membrana celular medida. Para validar aún más el sistema, se agregó un indicador fluorescente común de electroporación exitosa, yoduro de propidio33, a la suspensión celular, y se capturó una imagen de fluorescencia inmediatamente después de la aplicación del pulso eléctrico. La señal óptica, es decir, la intensidad de fluorescencia del yoduro de propidio dentro de la célula, se correlacionó fuertemente con la medición eléctrica del grado de permeabilización de la membrana celular, verificando la fiabilidad de esta medición eléctrica. Sin embargo, este trabajo solo consideró la entrega de la molécula pequeña yoduro de propidio, que tiene poca o ninguna importancia traducible.
En este trabajo, se introduce una nueva aplicación de esta tecnología para mejorar el rendimiento del sistema mientras se entrega un vector de ADN plásmido (ADNp) biológicamente activo y se evalúa la eficiencia de electrotransfección de las células rechapadas y cultivadas después de la electroporación. Aunque el trabajo anterior supera las tecnologías de microelectroporación existentes que son capaces de medir eléctricamente el evento de electroporación, el estado actual del dispositivo aún requiere largos tiempos de tránsito celular entre el conjunto de electrodos (~ 250 ms) para realizar la detección celular, la aplicación de pulsos y la medición de permeabilización de la membrana celular. Con un solo canal, esto limita el rendimiento a 4 celdas/s. Para combatir esta limitación, se introduce un nuevo concepto de electroporación controlada por retroalimentación basada en la población celular para realizar la electrotransfección de ADN. Mediante el uso de un tampón de electroporación de conductividad hipofisiológica, este sistema permite la interrogación eléctrica de células individuales a través de una multitud de aplicaciones de pulso de electroporación. Sobre la base de la respuesta eléctrica, se determina un pulso de electroporación "óptimo". Luego se implementa un modo de "alto rendimiento" donde se anula la determinación de permeabilización de la membrana celular, se aumenta el caudal y el ciclo de trabajo del pulso de electroporación se adapta al tiempo de tránsito de la celda para garantizar un pulso por celda en tránsito entre los electrodos. Este trabajo proporcionará amplios detalles sobre los pasos de microfabricación para la fabricación del microdispositivo, el material / equipo y su configuración necesarios para realizar la experimentación, y la operación / análisis del dispositivo y su eficiencia de electrotransfección (eTE).
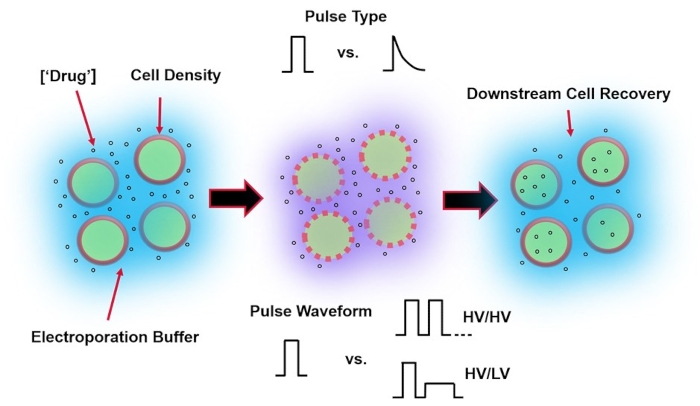
Figura 1: Factores experimentales que afectan los resultados de electroporación. (Izquierda) Suspensión celular: los factores importantes a considerar antes del inicio de la electroporación incluyen: carga útil (en este caso, ADNp), concentración, densidad celular y propiedades tampón de electroporación. Las propiedades del tampón de electroporación a considerar son la conductividad, la osmolaridad y la composición molecular exacta que contribuye a estos valores. (Medio) Aplicación de pulso: el tipo de pulso exacto (onda cuadrada vs. decaimiento exponencial) y la forma de onda de pulso (pulso único vs. tren de pulso) deben optimizarse para maximizar tanto la viabilidad celular resultante como la eficiencia de electrotransfección. Los trenes de pulsos comunes implementados en los procesos de electroporación generalmente se componen de una serie de pulsos de alto voltaje (HV) o una serie de pulsos que giran entre HV y magnitudes de pulso de bajo voltaje (LV). (Derecha) Recuperación celular: los pasos de procesamiento aguas abajo, en particular, los medios de cultivo celular de recuperación a los que se transfieren las células, deben optimizarse. No destacado (extremo izquierdo), se pueden implementar pasos adicionales de procesamiento de celdas aguas arriba para la optimización general del proceso de electroporación. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
NOTA: Los usuarios deben revisar todas las MSDS para los materiales y suministros utilizados en este protocolo. Se debe usar EPP apropiado en cada paso y se debe usar una técnica estéril durante la experimentación. Las secciones 1-7 discuten la fabricación del dispositivo.
1. Fabricación del dispositivo: diseño de la máscara
NOTA: Consulte la Figura 2 para obtener una ilustración del proceso de microfabricación. Los pasos de microfabricación deben llevarse a cabo en un entorno de sala limpia. Se necesita EPP adicional (red para el cabello, red para el vello facial, máscara, traje para salas limpias, cubiertas para zapatos).
- Instale un software CAD de su elección, diseñe una "máscara" de 2 dimensiones tanto del canal microfluídico como de los electrodos y guarde el diseño en el formato de archivo deseado (es decir, .dxf, .dwg).
NOTA: Consulte la Figura suplementaria 1 para ver un ejemplo de un esquema de máscara bidimensional. - Enviar a un proveedor de su elección para ser impreso. Asegúrese de que las dimensiones de los diseños estén dentro de las capacidades de resolución del proveedor.
2. Fabricación de dispositivos - Fotolitografía
NOTA: Las recetas de microfabricación proporcionadas se adoptan de las recomendaciones del fabricante de fotoprotectores y solo deben usarse como punto de partida34. Los valores exactos para los tiempos de cocción, los tiempos de exposición, etc., deben optimizarse para cada protocolo de fabricación. Se recomienda utilizar pinzas de obleas para manipular tanto obleas de silicio como portaobjetos de vidrio.
- Fabricación de canales microfluídicos
- Limpieza de obleas de silicio y diapositivas de vidrio sodocálcico: Siga los pasos 2.1.2-2.1.3 para realizar la limpieza de la oblea de silicio y la limpieza de la diapositiva de vidrio sodocálcico de 1" × 3" (ambas denominadas "sustrato").
- Sumerge los sustratos en un baño de acetona, un baño de isopropanol (IPA) y un baño de agua desionizado durante 10 minutos cada uno. Realice este lavado en serie de 3 pasos a temperatura ambiente.
- Retire y seque la superficie utilizando una fuente de nitrógeno presurizado o gas de aire filtrado. Coloque los sustratos en un horno a 150 °C durante un mínimo de 30 minutos para permitir la evaporación de la humedad restante.
- Fotolitografía SU-8 en oblea de silicio: Realice fotolitografía en la oblea de silicio siguiendo los pasos 2.1.5-2.1.14.
NOTA: Para lograr una altura de canal microfluídico de 20 μm, se utilizó fotorresistencia negativa de la serie SU-8 2000. Las velocidades de giro exactas variarán dependiendo de la formulación de SU-8 (es decir, 2010, 2015, etc.); sin embargo, las siguientes condiciones son para la formulación SU-8 201035. - Retire la oblea de silicio del horno a 150 °C y deje que se enfríe a temperatura ambiente (RT).
- Asegure la oblea al mandril de la recubrida de centrifugado de obleas utilizando el sistema de vacío de la recubridora de centrifugado. Programa el spinner. Paso 1 - 500 rpm en 10 s a una aceleración de 100 rpm/s, Paso 2 - 1000 rpm en 30 s a una aceleración de 300 rpm/s.
- Dispensar 4 ml de fotorresistencia SU-8 2010 en el centro de la oblea de silicio. Ejecute el programa. Una vez que el sistema se detenga, apague la aspiradora.
- Con unas pinzas, transfiera la oblea de silicio recubierta con SU-8 en una placa caliente a 95 °C durante 4-5 minutos para una cocción suave. Luego retire la oblea de la placa caliente y deje que se enfríe a RT.
NOTA: Siga el procedimiento de inicio adecuado para el alineador de máscara fotolitográfica específico del laboratorio. - Asegure la fotomáscara con los diseños de canales microfluídicos 2D en el soporte de la máscara. Inserte la oblea de silicio, con el recubrimiento SU-8 hacia arriba, en el mandril de la oblea.
- Ajuste los ajustes de exposición a 150 mJ/cm2 y ejecute la máquina.
PRECAUCIÓN: No mire directamente a la fuente de luz UV para evitar posibles daños oculares. - Coloque la oblea de silicio recubierta con SU-8 en una placa caliente a 95 °C durante 4-5 minutos para hornear después de la exposición.
- Sumerja la oblea de silicio en la solución de revelador SU-8 (consulte la Tabla de materiales) durante 3-4 minutos. Aplicar agitación suave. Retire la oblea de la solución y enjuague la superficie con IPA.
- Seque la superficie utilizando una fuente de nitrógeno presurizado o gas de aire filtrado. Inspeccione las características bajo un microscopio utilizando un filtro UV y asegúrese de que no haya defectos obvios en los canales microfluídicos.
- Coloque la oblea de silicio en un horno a 150 °C durante un mínimo de 30 minutos para una cocción dura.
- Deje enfriar a RT y use la perfilometría del lápiz óptico para medir la altura exacta y la pendiente de las paredes laterales del canal.
- Fotolitografía sobre portaobjetos de vidrio
NOTA: El hexametildisilazano (HMDS) se utiliza como promotor de adhesión para el fotorresistente positivo S181836.- Retire el portaobjetos de vidrio del horno a 150 °C y deje que se enfríe a RT.
- Asegure la corredera de vidrio al mandril del hilandero usando vacío y programe el hilador. Paso 1 - 500 rpm durante 10 s con una aceleración de 100 rpm/s. Paso 2 - 3000 rpm para 30 sentados una aceleración de 300 rpm / s.
- Dispense 3-4 gotas de HMDS a través de la superficie del portaobjetos de vidrio. Ejecute el programa.
NOTA: Para lograr un recubrimiento superficial de ~ 3 μm, se debe utilizar la serie de fotorresistencia positiva S1800. Las velocidades de centrifugado exactas variarán dependiendo de la formulación; las siguientes recomendaciones corresponden a la formulación S181834. - Dispense 1 ml de fotorresistencia sobre la superficie del portaobjetos de vidrio. Asegúrese de cubrir el área de superficie.
- Ejecute el programa. Una vez que el sistema se detenga, apague la aspiradora y retire el portaobjetos de vidrio.
- Coloque el portaobjetos de vidrio recubierto S1818 en una placa caliente a 120 °C durante 4 minutos para una cocción suave. Retire y permita que llegue a RT.
- Asegure la fotomáscara con los diseños de electrodos 2D en el soporte de la máscara.
- Inserte y alinee la diapositiva de vidrio, con el revestimiento S1818 hacia arriba, sobre el mandril de la oblea. Ajuste los ajustes de exposición a 250 mJ/cm2 y ejecute la máquina.
NOTA: Los diferentes modelos de alineadores de contacto pueden adaptarse más o menos a sustratos no circulares de espesor variable. - Sumerja la corredera de vidrio en la solución de desarrollador MF-319 durante 2 minutos. Aplicar agitación suave. Enjuague la superficie del portaobjetos de vidrio con agua desionizada.
- Seque la superficie con una fuente de nitrógeno presurizado o gas de aire filtrado y observe las características bajo un microscopio utilizando un filtro UV. Asegúrese de que no haya defectos obvios en los patrones litográficos.
- Coloque la corredera de vidrio en el horno a 150 °C, asegurándose de que la superficie del sustrato de interés esté hacia arriba, durante un mínimo de 30 minutos para una cocción dura. Retirar del horno y mantener protegido de la luz.
3. Fabricación del dispositivo: Grabado de ácido fluorhídrico (HF)
PRECAUCIÓN: Este paso implica la manipulación y eliminación del ácido fluorhídrico (HF), que puede causar quemaduras químicas profundas y dolorosas. Se debe usar EPP adicional para proteger al manipulador (protector facial, guantes resistentes a productos químicos hasta el codo, delantal químicamente resistente con mangas). El neutralizador de ácido de gluconato de calcio y el gel para la piel deben mantenerse cerca del banco de laboratorio. Este paso no debe realizarse solo. La HF nunca debe almacenarse o dispensarse en recipientes de vidrio, ya que el recipiente quedará grabado por el ácido.
NOTA: El HF graba uniformemente el vidrio expuesto (es decir, el diseño del electrodo) para formar un hueco en el vidrio, lo que permite una mejor resolución del borde del patrón del electrodo después de la deposición de metal (sección 4).
- Sumergir el portaobjetos de vidrio en una solución tamponada HF 10:1 durante 1 minuto en un recipiente de politetrafluoroetileno. Transfiera y lave los portaobjetos de vidrio en agua desionizada. Repita el paso de lavado 3 veces.
- Seque la superficie utilizando una fuente de nitrógeno presurizado o gas de aire filtrado. Coloque los sustratos de vidrio en un horno a 65 °C durante la noche para eliminar cualquier resto de humedad. Cubra los sustratos de la luz.
4. Fabricación del dispositivo: deposición física de vapor
NOTA: Este paso implica la deposición de metal sobre los sustratos de portaobjetos de vidrio para definir los patrones de electrodos. Los electrodos metálicos comúnmente utilizados son cromo/oro y titanio/platino. El oro y el platino no se adhieren al sustrato de vidrio, por lo que se requiere una capa de adhesión de semillas de cromo o titanio, respectivamente, para promover la adhesión37.
- Siga el protocolo específico de la sala limpia para operar el sistema PVD interno. Este trabajo utiliza un sistema de pulverización catódica de CC y pulverización catódica con gas argón 100 SCCM a una presión de ~ 8 mTorr y 200 W de potencia.
- Sputter titanium durante 8 min a una velocidad de ~100 Å/min. Sputter platinum durante 10 min a una velocidad de ~200 Å/min. Retire los sustratos de la cámara de PVD.
5. Fabricación del dispositivo: despegue fotorresistente
NOTA: Este paso consiste en disolver la capa fotorresistente en un baño de acetona, dejando los electrodos de platino adheridos estampados en los portaobjetos de vidrio.
- Sumerja los toboganes de vidrio recubiertos de metal en un baño de acetona durante ~ 10 min.
- Sonicar el baño para introducir agitación para romper la película de metal no adherida. Use una toallita empapada en acetona para eliminar cualquier residuo si es necesario.
- Una vez que se haya eliminado toda la fotorresistencia/metal, lave los patrones de electrodos con agua desionizada y colóquelos en un horno a 65 °C durante la noche para eliminar cualquier humedad superficial restante.
- Utilice la perfilometría del lápiz óptico para medir el perfil de los electrodos estampados.
6. Fabricación del dispositivo: litografía blanda
NOTA: Este paso implica el moldeo de réplica del canal microfluídico en la estructura de relieve maestra SU-8 utilizando un elastómero, polidimetilsiloxano (PDMS).
- Silanización de obleas de silicio
NOTA: Este es un paso opcional; sin embargo, aumentará la vida útil de la estructura de relieve SU-8 que se fabricó en la subsección 2.1. Este paso debe realizarse en una campana extractora química.- Asegure la oblea al fondo de una placa de Petri y coloque la placa de Petri en un desecador.
- Rodear el perímetro de la oblea de silicio con aproximadamente 50 μL de tricloro(1H,1H,2H,2H-perfluorooctil) silano. Conecte el vacío (bomba de vacío o línea de vacío de la casa) y funcione durante 20 minutos.
- Moldeo de réplicas PDMS
- En un recipiente desechable (por ejemplo, bote de pesaje, vaso de plástico), mezcle la base de elastómero PDMS con el endurecedor en una proporción de peso de 10: 1 sobre una balanza electrónica. Vierta la solución PDMS sobre la oblea de silicio y coloque la mezcla al vacío para eliminar todas las burbujas de aire.
- Curar a 65 °C durante un mínimo de 4 h permitiendo que el PDMS se solidifique. Con la punta de una cuchilla de afeitar, corte el PDMS moldeado y despegue de la oblea de silicio.
- Con un punzón de biopsia afilado, retire el PDMS de la entrada/salida del dispositivo. Para este dispositivo, se utilizaron punzones de biopsia de 0,75 mm y 3 mm para las entradas y las salidas, respectivamente.
NOTA: El punzón de biopsia utilizado debe tener un diámetro ligeramente menor que el diámetro exterior del tubo de interconexión para garantizar un sellado hermético de los tubos en los depósitos.
- Limpieza por sonicación de PDMS
- Sumerja los dispositivos PDMS en IPA y colóquelos en un sonicador durante 30-45 minutos para eliminar cualquier residuo PDMS de la entrada / salida. PDMS puede hincharse en la solución IPA.
- Enjuague con agua desionizada y colóquelo en un horno a 65 °C durante la noche para permitir que el PDMS se hinche de nuevo al tamaño normal.
NOTA: Cualquier residuo sobrante puede obstruir el dispositivo durante la experimentación. Se pueden eliminar grandes trozos de escombros de la superficie del PDMS usando un trozo de cinta adhesiva antes de la sonicación.
7. Fabricación del dispositivo: unión PDMS / conexión de alambre
NOTA: Este paso consiste en tratar la superficie del PDMS y el sustrato de vidrio con un plasma de oxígeno para formar un enlace irreversible entre el PDMS y el vidrio38. Es posible que la receta proporcionada deba adaptarse al sistema exacto utilizado en el laboratorio.
- Corte los dispositivos a su tamaño y asegúrese de que la superficie del dispositivo PDMS esté limpia. Si no vuelve a limpiar, siga los pasos de la subsección 6.3.
- Programe el generador de plasma. Ajuste la potencia a 70 W, el tiempo a 35 s, la presión a 325 mTorr, el caudal de oxígeno gaseoso a 60 SCCM. Coloque PDMS y deslizamiento de vidrio de electrodo en el sistema con las características hacia arriba y ejecute el programa.
- Retire los dispositivos y alinee rápidamente las características del canal con los electrodos utilizando un estereoscopio. Aplique firmemente presión desde el centro del PDMS hacia los lados para eliminar cualquier burbuja de aire no deseada en la interfaz de unión.
- Coloque en un lugar caliente a 95 °C durante al menos 2 minutos para finalizar el procedimiento de unión y deje que el dispositivo se enfríe a RT.
- Corte 2 piezas de alambre sólido de 22 G a ~6" de longitud y retire el aislante de ambos extremos.
- Conecte los cables a las almohadillas de los electrodos utilizando epoxi conductor de plata. Coloque los dispositivos terminados en un horno a 65 °C durante la noche.

Figura 2: Fabricación de microdispositivos. (A) Fabricación de canales microfluídicos: Pasos clave de fabricación de obleas de silicio: limpieza de obleas de silicio (pasos 2.1.1-2.1.3), recubrimiento fotorresistente y horneado suave (pasos 2.1.7-2.1.8), exposición a los rayos UV (paso 2.1.10), desarrollo (paso 2.1.12) y vertido de PDMS (subsección 6.2). (B) Pasos clave de fabricación de electrodos: limpieza de portaobjetos de vidrio (pasos 2.1.1-2.1.3), recubrimiento HMDS y recubrimiento fotorresistente (pasos 2.2.3-2.2.4), exposición UV (paso 2.2.8), desarrollo (paso 2.2.9), grabado HF (sección 3), deposición física de vapor (sección 4) y despegue fotorresistente (sección 5). (C) Pasos clave de finalización del dispositivo: acceso de entrada/salida y sonicación (paso 6.2.3 y sección 6.3), unión PDMS y fijación de cable (sección 7). Haga clic aquí para ver una versión más grande de esta figura.
8. Cultivo celular y cosecha
NOTA: Se deben utilizar procedimientos estándar de cultivo celular y manejo estéril. Siga el protocolo específico del tipo de célula para el cultivo celular.
- Cultivo celular
- Paso celular: Cultivo y paso de las células siguiendo los pasos 8.1.2-8.1.5.
- Cultivo de células HEK293 en solución completa de DMEM (88% DMEM, 10% de suero fetal bovino inactivado por calor, 1% de L-glutamina, 1% de penicilina-estreptomicina) en un matraz T25 en una incubadora a 37 °C, 95% O2, 5% CO2. Celdas de paso a tiempo al alcanzar ~80% de confluencia.
- Aspirar el medio utilizando una pipeta o un sistema de vacío e incubar las células en tripsina-EDTA al 0,25% (matraz de 2 mL-T25) durante 2 min a 37 °C. Neutralizar la tripsina con el doble de volumen de medios de cultivo.
- Transfiera la suspensión celular a un tubo cónico de 15 ml y centrifuga las células HEK293 a 770 x g durante 2 min. Aspirar el sobrenadante utilizando una pipeta o un sistema de vacío
- Resuspender las células HEK293 en 1 ml de DMEM precalentado.
- Recubrimiento celular: Placa de las celdas siguiendo los pasos 8.1.7-8.1.8
- Colocar las células en una dilución de 10:1 a 20:1 en un matraz T25 (5 ml de DMEM) para continuar el cultivo.
- Platear las células en una dilución de 5:1 a 20:1 en una placa de 6 pocillos (2 ml de DMEM por pocillo) para ser cosechadas para experimentos de electroporación.
NOTA: Las células HEK293 se colocaron 24 h antes de los experimentos de electroporación para lograr una confluencia de ~ 70% en la cosecha celular (subsección 8.3). Un programa de cosecha inconsistente puede conducir a la variabilidad en los resultados de electroporación.
- Tampón de electroporación
- Preparar tampón de electroporación
NOTA: Consulte Sherba et al. para obtener información específica sobre la preparación del tampón de electroporación8. La composición tampón fue de 285 mM de sacarosa, 0,7 mM de MgCl2, 1 mM de KCl, 10 mM de HEPES, 3 mM de NaOH (pH: 7,4; osmolalidad: 310 mOsm, conductividad: 500 μS/cm). El tampón de electroporación debe formularse de manera estéril y almacenarse a 4 °C durante una vida útil de ~ 1 mes. La formulación del tampón de electroporación debe optimizarse por tipo de célula.
- Preparar tampón de electroporación
- Recolección de células y adición de ADNp
- Siga los mismos pasos que el paso celular (8.1.2-8.1.4).
- Lave las células en 1x PBS estéril, suspensión de células de transferencia en un tubo cónico de 15 ml y centrífuga a 770 x g durante 2 min.
- Lavar el pellet de celda HEK293 en el tampón de electroporación y centrifugar a 770 x g durante 2 min. Resuspender las células en el tampón de electroporación a ~ 5 millones de células / ml.
NOTA: La densidad celular debe optimizarse por tipo de célula. - Añadir pDNA que codifica para la proteína verde fluorescente (GFP) a una concentración final de 20 μg/ml. Mezcle suavemente la suspensión de ADNp/célula y transfiera la suspensión a una jeringa de 1 cc para la experimentación.
9. Configuración de hardware/experimental
NOTA: Antes de recolectar células para experimentación, asegúrese de que la configuración experimental se complete para minimizar la cantidad de tiempo que las celdas están suspendidas en el tampón de electroporación. Encienda la electrónica 20-30 minutos antes de los experimentos para calentar. Consulte la Figura 3 para obtener un esquema de la configuración experimental para el funcionamiento del módulo de detección de una sola célula.
NOTA: Se desarrolló un circuito de amplificador operacional PA90 personalizado para acomodar tanto la sensibilidad requerida para la detección de nivel de celda única utilizando el amplificador de bloqueo como los altos voltajes requeridos para aplicar pulsos de electroporación suficientemente fuertes. Consulte la hoja de datos de PA90 para obtener especificaciones sobre los circuitos recomendados39.
- Inicialice el amplificador de bloqueo con la configuración actual del preamplificador y configúrelo a través del algoritmo. Consulte Zheng et al. para obtener información específica sobre la configuración de bloqueo32.
- Fuentes de alimentación, generador de funciones y amplificador
- Fuente de alimentación 1: Ajustado a -15 V para alimentar el extremo negativo del circuito.
- Fuente de alimentación 2 (generador de funciones): Ajuste para emitir señal de CC y ajuste la amplitud a 2 V. Conéctelo a una entrada de amplificador 50x.
- Programa Generador de pulsos de electroporación para la onda cuadrada: Ajuste el ancho de pulso deseado (ciclo de trabajo) y la amplitud de pulso deseada (voltios).
- Ajuste la salida al modo de disparo (1 pulso). Conecte la salida a la entrada del amplificador 50x.
NOTA: Recuerde la ganancia de 50x al programar la amplitud del pulso. Es decir, para lograr una intensidad de campo eléctrico de 1 kV / cm, se requiere un total de 30 V, 30 V / 300 μm (distancia entre electrodos), por lo tanto, la salida del generador de funciones debe ajustarse a 30/50 o 600 mV. - Verifique las salidas del amplificador 50x usando un osciloscopio. Salida 1-100 V de la fuente de alimentación 2 (9.2.2). Salida 2-Amplitud variable para el pulso de electroporación (9.2.4).
- Conecte una sonda 10x a un canal de osciloscopio y al microdispositivo completo (dispositivo bajo prueba, DUT) en el paso 7.6 donde se aplicará el pulso de electroporación. Monitoree el sistema durante la experimentación para asegurarse de que se están aplicando pulsos.
- Asegúrese de que el USB de bloqueo esté conectado y registrado. Verifique dos veces todas las configuraciones de bloqueo en el código del algoritmo (lo más importante, la frecuencia de salida de bloqueo).
- Microscopio/cámara CCD
- Coloque el microdispositivo en el escenario del microscopio a través de un portaobjetos. Encienda la cámara CCD y enfoque el canal microfluídico. Usa un objetivo 4x o 10x.
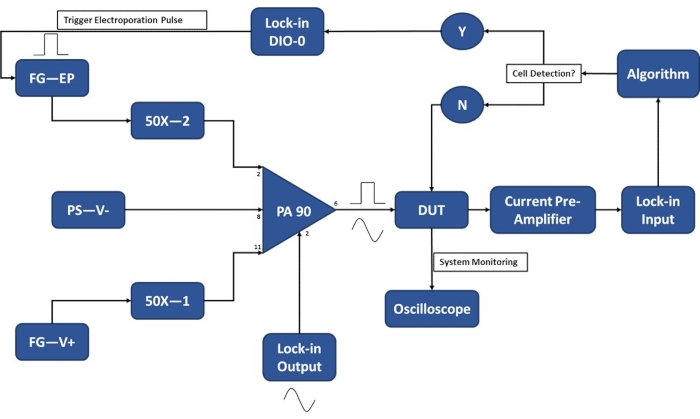
Figura 3: Esquema de configuración experimental: detección de una sola célula. El amplificador operacional de alta potencia (PA-90) permite la superposición del pulso de electroporación de alto voltaje en la señal de CA de salida de bloqueo que se requiere para la detección de una sola celda. Esta señal de excitación pasa a través del dispositivo de microelectroporación (Device Under Test, DUT) donde la corriente es amplificada por el preamplificador de corriente y alimentada al algoritmo. El sistema monitorea continuamente el evento de detección celular. Al entrar la celda, el amplificador de bloqueo genera una señal digital para activar la aplicación del pulso de electroporación a la(s) celda(s) en tránsito. Leyenda: PA-90 (amplificador operacional de alta potencia), DUT (dispositivo bajo prueba), DIO (entrada/salida digital), FG-EP (generador de funciones / pulso de electroporación), 50X (amplificador 50X), PS-V- (fuente de alimentación / voltaje negativo para PA 90), FG-V + (generador de funciones, voltaje positivo para PA 90). Haga clic aquí para ver una versión más grande de esta figura.
10. Funcionamiento experimental
- Cebado de canales microfluídicos
- Retire todas las burbujas de aire de la jeringa cargada con células. Conecte una aguja de 30 G a la jeringa cargada con células.
- Usando pinzas, deslice el tubo tygon a lo largo de la aguja. Llene previamente el depósito de salida con medios de recuperación (igual que el paso 8.1.2 sin los antibióticos), ~40-50 μL.
- Usando el pulgar, aplique presión suavemente al émbolo de tal manera que el líquido llegue lentamente al final de la línea de tubos.
- Asegure la jeringa a la bomba de la jeringa. Encienda la bomba de la jeringa y asegúrese de que esté configurada para reenviar la perfusión.
- Programe la bomba para el diámetro adecuado de la jeringa para garantizar que los caudales sean precisos. Consulte el manual de la bomba para obtener información específica sobre los diámetros de las jeringas.
NOTA: Para evitar que las células se depositen en la jeringa, fije la bomba de la jeringa en un soporte de abrazadera de modo que pueda funcionar en posición vertical con el extremo de la jeringa hacia abajo. - Ajuste el caudal de la bomba de jeringa, ~10-20 μL/min, y deje que la bomba funcione hasta que el fluido llegue al final de la línea de tubería. Asegure la tubería al dispositivo microfluídico.
- Baje el caudal de la bomba de la jeringa, ~5-10 μL/min, y permita que la bomba funcione hasta que todo el aire sea expulsado del dispositivo microfluídico y las células atraviesen la salida del dispositivo.
- Retire las células de la salida mediante aspiración de pipeta. Vuelva a llenar el depósito de salida con medios de recuperación (igual que el paso 8.1.2 sin los antibióticos), ~40-50 μL.
- Mapeo de permeabilización de membrana celular de electroporación unicelular
NOTA: Consulte la Figura 4 y la Figura 5 para una mejor comprensión de los datos eléctricos indicativos de permeabilización de la membrana celular y el mapeo de permeabilización de la membrana celular, respectivamente.- Ajuste el caudal de la bomba de la jeringa a ~0.1-0.3 μL/min para garantizar un flujo de células individuales a través del conjunto de electrodos. El tiempo de tránsito de la celda entre los electrodos debe ser ~ 250 ms.
- Inicie el programa de computadora haciendo clic en Ejecutar. Asegúrese de que el sistema está guardando los datos eléctricos.
- Asegúrese de que el sistema detecte células de manera confiable para activar las aplicaciones de pulso controladas por computadora. Ajuste el umbral de detección en consecuencia.
- Ajuste los parámetros de pulso para el pulso inicial de electroporación de energía eléctrica más bajo. Consulte la Tabla 1 para conocer los parámetros pulsantes de electroporación en este estudio.
- Encienda el canal de salida del generador de impulsos de electroporación (paso 9.2.3.).
- Siga un número predeterminado de aplicaciones de detección de células/pulsos (n = 100). Al final de cada condición probada, aspire las células de la salida del microdispositivo y reponga la salida con medios de recuperación.
- Iterar a la siguiente condición de pulso de electroporación. Repita hasta que se prueben todas las condiciones de pulso de electroporación.
- Determinar el grado de permeabilización de la membrana celular para cada aplicación de pulso probada. (La validación posterior al proceso se describe en la subsección 11.1). Generar el mapa de permeabilización de la membrana celular (Figura 5).
- Determine los parámetros de pulso de electroporación para una retroalimentación basada en la población de alto rendimiento.
- Apague la bomba de la jeringa, retire las células del depósito de salida y reponga la salida con medios de recuperación.
- Electroporación controlada por retroalimentación basada en la población: alto rendimiento
NOTA: Consulte la Figura 6 para obtener un esquema que ilustra el proceso de retroalimentación basado en la población.- Ajuste el caudal de la bomba de la jeringa a ~1-3 μL/min para garantizar un flujo de células individuales a través del conjunto de electrodos. El tiempo de tránsito de la celda entre los electrodos debe ser ~ 25 ms.
- Ajuste la amplitud del pulso a la condición "optimizada" (10.2.9), desactive el modo de disparo y ajuste el ancho del pulso para que coincida con el tiempo de tránsito de la celda.
- Establezca el ciclo de trabajo de tal manera que el tiempo de pulso ENCENDIDO coincida con la condición "optimizada". Consulte la Tabla 1.
- Ajuste el generador de funciones del canal de salida a ON, encienda la bomba de jeringa y permita que el sistema funcione hasta que se haya electroporoso el número deseado de celdas.
- Cuando haya terminado, apague tanto la bomba de jeringa como el generador de funciones.
- Transfiera las células del depósito de salida al matraz/placa de cultivo celular del tamaño adecuado lleno de medios de recuperación precalentados y transfiera el matraz/placa de cultivo a la incubadora.
11. Análisis
- Detección de permeabilización de membrana a nivel unicelular
NOTA: Para garantizar que se utilizó el pulso "óptimo" durante el módulo de alto rendimiento, se debe realizar un análisis posterior al experimento para verificar los datos eléctricos exportados de la subsección 10.2. Consulte la Figura 4 para obtener una representación gráfica de la señal eléctrica representativa de la permeabilización de la membrana debido a la electroporación.- Cargue datos en un software de análisis (MATLAB, Python, etc.). Genere una gráfica de Corriente frente a Tiempo para cada condición pulsante.
- Determinar manualmente el grado de permeabilización de la membrana celular (Δ IP/ΔIC). Consulte la figura 4. Generar el mapa de permeabilización de la membrana celular (Δ IP / ΔIC versus Energía Eléctrica, Figura 5) sobre todas las condiciones de pulso probadas. Verifique la condición de pulso "óptima".
- Eficiencia de electrotransfección (eTE)
- Después del período de incubación de 24 horas, retire las células electroporadas de la incubadora.
- Realizar una tinción de células vivas. Diluir DRAQ5 1:1000 hasta una concentración final de 5 μM en el recipiente de cultivo celular. Mezclar suavemente las células/solución de tinción e incubar a 37 °C durante 5-30 min.
NOTA: Se puede implementar una tinción diferente en este paso. Asegúrese de que las propiedades fluorescentes no se superpongan con el marcador fluorescente que indica una electrotransfección exitosa (es decir, GFP está en la longitud de onda verde y DRAQ5 es el rojo lejano). - Encienda un microscopio epifluorescente, una lámpara y cámaras (consulte la Tabla de materiales).
- Retire las células de la incubadora y póngalas enfocadas en el microscopio.
- Capture una imagen de contraste de fase (campo claro) del campo seleccionado.
- Capture imágenes epifluorescentes del mismo campo utilizando filtros FITC (GFP) y rojo lejano (DRAQ5). Analice los conjuntos de imágenes manualmente o mediante un algoritmo.
NOTA: Consulte la Figura 7 para ver imágenes representativas. - Cuente el número total de células GFP positivas en todas las imágenes. Cuente el número total de células teñidas con DRAQ5 en todas las imágenes. Calcule eTE (proporción de células GFP positivas a células teñidas con DRAQ5).
Resultados
La Figura 4 destaca los principios operativos detrás de la detección de permeabilización de membrana a nivel de una sola célula para una amplitud de pulso única. Tras el inicio del experimento de electroporación, el algoritmo de detección celular determina un umbral óptimo para la detección celular a través de un método de detección punto por punto, basado en pendientes. Luego, el sistema monitorea continuamente (1) un cambio negativo significativo en la corriente eléctrica medida, que es indicativo de la entrada de una celda. Esto se debe a la naturaleza aislante de la membrana celular biológica, de modo que cuando la célula atraviesa el conjunto de electrodos, hay un aumento instantáneo en la impedancia, lo que resulta en una fuerte disminución de la corriente medida, lo que permite una detección celular consistente (2), que finalmente desencadena el cambio a la aplicación de pulso controlada por computadora (4). La celda aislada desplaza un volumen de electrolito entre los electrodos, lo que resulta en una caída de corriente que es proporcional al tamaño de la celda. Este cambio en la corriente se denota como ΔIC (3). Inmediatamente después del cálculo de ΔIC, se administra el pulso eléctrico predeterminado (4) a la célula en tránsito. Esta afluencia instantánea de energía introduce un breve artefacto de detección en el sistema (caja gris). Al volver a bloquear la señal, es decir, volver a la monitorización celular, (5) es evidente que el pulso de electroporación permeabilizó la membrana celular a medida que la magnitud del cambio de corriente debido a la presencia de la celda entre el conjunto de electrodos cae a la salida (6). La diferencia en las dos caídas de corriente debido a la magnitud de impedancia de la célula antes / después de la aplicación del pulso de electroporación se denomina corriente de permeabilización y se denota como ΔIP. Una vez que la celda sale del volumen entre los electrodos, la línea de base se estabiliza y el sistema vuelve al modo de detección de celdas (1). Después de electroporar un número predeterminado de células, se prueba el siguiente pulso de electroporación de mayor energía (consulte la Tabla 1 para conocer los ajustes del pulso). Para cada pulso de electroporación probado, se determina un "grado de permeabilización de la membrana" promedio. Este valor se calcula como Δ IP/ΔIC. Una vez que se prueba cada pulso de electroporación predeterminado, el Δ IP/ΔIC se traza contra la densidad de energía eléctrica aplicada (σ x E 2 x t), donde σ es la conductividad de la solución (S/cm), E es la intensidad del campo eléctrico (kV/cm) y t es la duración del pulso (ms). Consulte la Figura 5 para ver el mapa de permeabilización de la membrana celular para las células HEK293 utilizadas en este ejemplo.
Tabla 1: Parámetros del pulso de electroporación. Para este estudio, los pulsos de electroporación se eligieron de tal manera que el flujo de carga (σ×E×t) permanezca constante, donde σ es la conductividad de la solución (S / cm), E es la intensidad del campo eléctrico (kV / cm) y t es la duración del pulso (ms). El resultado es un espectro de la energía eléctrica de pulso aplicada. Se proporcionan ejemplos del ciclo de trabajo requerido (c.d.) para lograr los parámetros de pulso especificados para un aumento del 5× y del 10× en el caudal inicial (detección de una sola celda). Haga clic aquí para descargar esta tabla.
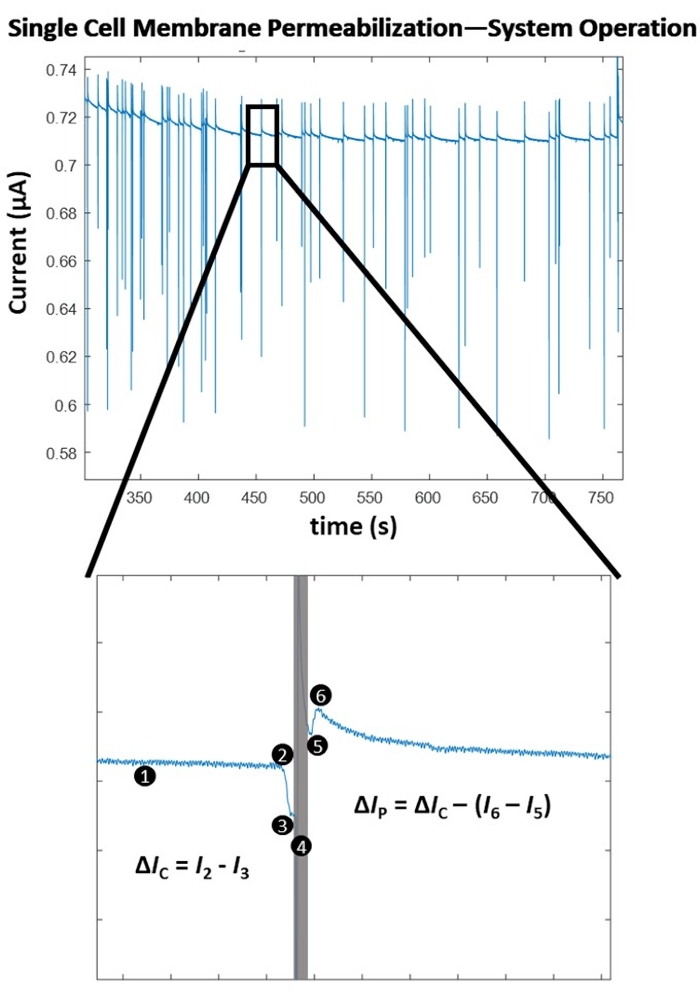
Figura 4: Permebilización de la membrana unicelular - Funcionamiento del algoritmo. (Arriba) Registro eléctrico de una serie de detecciones de una sola célula / aplicaciones de pulso (indicadas por los picos bruscos de corriente). (Abajo) Funcionamiento del sistema para la detección y pulsación de una sola celda. (1) El sistema detecta continuamente un cambio en la corriente, a través de un cálculo de pendiente punto por punto. (2) Se detecta una fuerte disminución en la pendiente, indicativa de la entrada de una celda entre los electrodos y desencadena la aplicación de pulso controlada por computadora. (3) Se determina una caída de corriente (ΔIC) y es proporcional al tamaño de la celda. (4) El pulso de electroporación se aplica a la celda en tránsito, causando un artefacto de detección en la señal eléctrica (caja gris). (5) El amplificador de bloqueo vuelve a la supervisión de la celda a medida que se vuelve a bloquear en la celda en tránsito. (6) La celda sale del conjunto de electrodos, causando otro pico de magnitud más pequeña en la corriente (Δ IC > (I 6 - I5)). La diferencia en las mediciones de impedancia se debe a la formación de poros a través de la membrana celular aislada. Este cambio en la corriente se denomina corriente de permeabilización (ΔIP). Se calcula el grado de permeabilización de la membrana celular (Δ IP/ΔIC). La línea base se estabiliza y el sistema vuelve al modo de detección (1). Haga clic aquí para ver una versión más grande de esta figura.
Se observa una clara correlación entre la energía eléctrica aplicada y el grado de permeabilización de la membrana celular (Figura 5), con la existencia de una región de transición donde se produce un aumento sustancial en el grado de permeabilización de la membrana celular. Para ello, se selecciona un pulso con energía eléctrica que supera esta región de transición para la fase de alto rendimiento del proceso de microelectroporación (Figura 6). En este experimento, el pulso de 1,8 kV/cm: 670 μs se determinó como "óptimo". Como se describió en detalle en la subsección 10.3 del protocolo, el caudal del sistema se incrementa y el generador de funciones se configura para emitir continuamente un pulso con un pulso y un ciclo de trabajo establecidos (consulte la Tabla 1 para los ajustes de pulso para caudales de 1,5 μL/min y 3,0 μL/min) para garantizar que se aplique 1 pulso a cada celda en tránsito. En este estudio, el caudal se incrementó en 5x, por lo que el ancho de pulso se estableció en 50 ms (coincidiendo con el tiempo de tránsito de la celda) a un ciclo de trabajo (c.c.) del 2,7%.
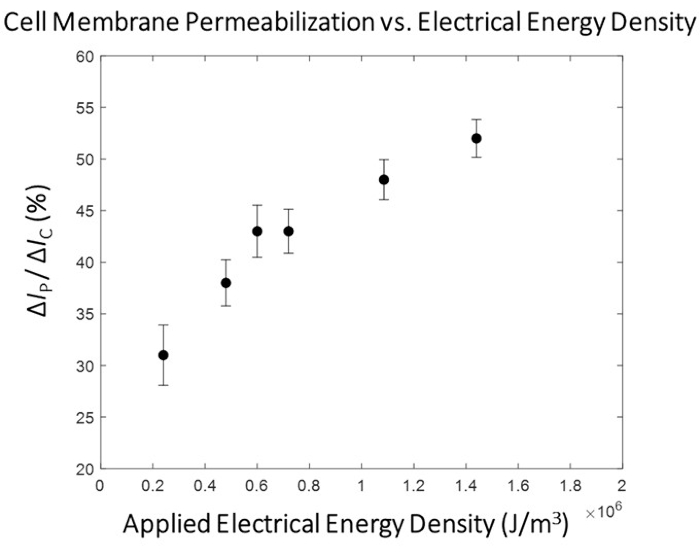
Figura 5: Mapeo de permeabilización de la membrana celular HEK293 -Δ Ip/ ΔIc versus energía eléctrica. Los datos eléctricos (Δ IP/ ΔIC) se representan como la media ± SEM. Condiciones de pulsación (de izquierda a derecha)- 0.4 kV/cm : 3 ms, 0.8 kV/cm : 1.5 ms, 1.0 kV/cm : 1.2 ms, 1.2 kV/cm : 1 ms, 1.8 kV/cm : 0.67 ms, 2.4 kV/cm : 0.5 ms. Se observa una clara correlación entre el grado de permeabilización de la membrana celular y la densidad de energía eléctrica del pulso aplicado. Para esta ronda de experimentación, se seleccionó la condición de pulso de 1,8 kV/cm: 0,67 ms como el pulso de electroporación "óptimo" para el módulo de alto rendimiento. Haga clic aquí para ver una versión más grande de esta figura.
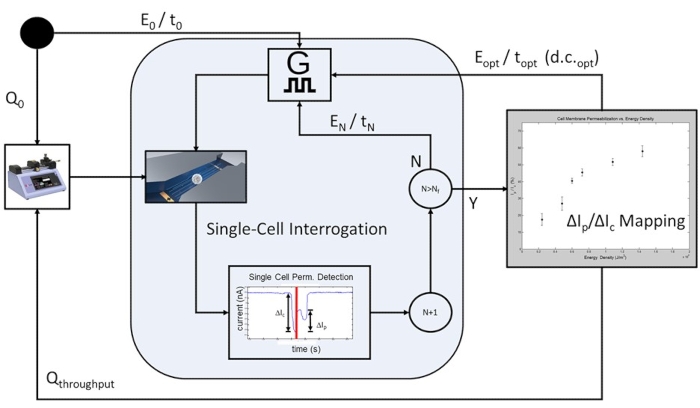
Figura 6: Flujo de trabajo de electroporación-proceso controlado por retroalimentación basado en la población celular. Para empezar, se programa un caudal inicial (Q0) para permitir la interrogación eléctrica a nivel de una sola célula. Se pulsa un número programable de celdas en cada condición de pulso de electroporación predeterminada (E 0 / t0 a E N / tN), con la energía eléctrica aplicada aumentando con cada iteración de aplicaciones de pulso de electroporación. Tras la finalización del pulso de energía eléctrica más alto incluido en el estudio, E N/tN, se traza la curva de permeabilización de la membrana celular y se determina el pulso de electroporación óptimo para la población celular bajo prueba. El sistema pasa al modo de alto rendimiento, donde el caudal se incrementa alrendimiento Q, y se omiten los pasos de interrogación de celda única que limitan la velocidad. El tren de pulsos óptimo se aplicará continuamente E opt / t opt at d.c.opt de tal manera que cada celda en tránsito recibirá un solo pulso de electroporación basado en el tiempo de tránsito de la celda y el ciclo de trabajo del ancho de pulso (d.c.). Haga clic aquí para ver una versión más grande de esta figura.
Después de 24 h de recuperación post-electroporación, las células fueron fotografiadas para determinar la eficiencia de electro-transfección (eTE). Como se describe en la subsección 11.2 del protocolo, la eTE se determinó como el número total de células que expresan GFP normalizado al número total de células teñidas con DRAQ5. Se determinó que el eTE para el pulso de 1.8 kV/cm: 670 μs era ~70% (Figura 7A). Para resaltar la importancia del sistema para mapear con precisión el grado de permeabilización de la membrana celular y seleccionar una energía de pulso de electroporación suficientemente alta al pasar al modo de alto rendimiento, también se exploró la condición de pulso de 0.4 kV / cm: 3 ms en términos de eTE (Figura 7B). En este caso, el eTE resultante a las 24 horas fue inferior al 5%.
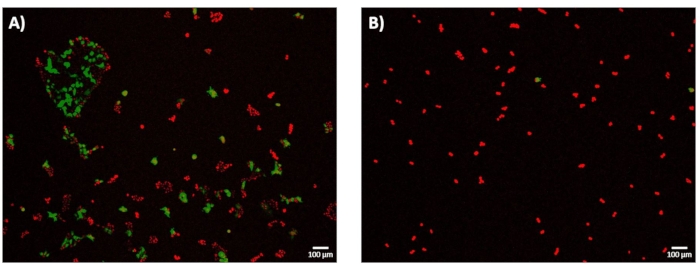
Figura 7: Eficiencia electro-Transfección-Expresión de GFP a las 24 h. Las células HEK293 se incubaron a 37 °C durante 24 horas después de experimentos de microelectroporación. Todas las células se tiñeron con DRAQ5 (rojo), y la eficiencia de electrotransfección (eTE) se determinó en función de la relación entre las células que expresan GFP (verde) y el número total de células (rojo). La viabilidad celular no se evaluó como una métrica de resultado en este estudio. (A) Imagen representativa de fluorescencia apilada de 4× de células HEK293 transfectadas con éxito a través de un pulso de 1,8 kV/cm: 670 μs que muestra eTE de aproximadamente el 70%. (B) Imagen representativa de fluorescencia apilada de 4× de células HEK293 transfectadas sin éxito a través de un pulso de 0,4 kV/cm: 3 ms que muestra eTE << 5%. Barra de escala: 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: Esquema CAD de 2 dimensiones. El dispositivo de microelectroporación consiste en un microcanal recto de 100 μm de ancho con una entrada de 1 mm de diámetro y una salida de 3 mm de diámetro. Cada traza de electrodo tiene 100 μm de ancho y el conjunto de electrodos abarca la región de electroporación del dispositivo, que tiene una longitud de 300 μm. La altura 3 dimensional del microcanal está controlada por el grosor de la fotorresistencia. En este trabajo, la altura del dispositivo era de 20 μm. Haga clic aquí para descargar este archivo.
Discusión
La metodología presentada dentro de este protocolo se centra principalmente en la microfabricación de un dispositivo microfluídico que luego se integra en una configuración experimental especializada de electroporación. El término "receta", que a menudo se usa cuando se describen los detalles del proceso de microfabricación, sugiere la importancia de seguir / optimizar cada paso para fabricar con éxito un dispositivo que funcione. Sin embargo, ciertos pasos críticos dentro del proceso, cuando no están optimizados, como el tiempo / energía de exposición UV, las tasas / duraciones de pulverización catódica PVD y la configuración del generador de plasma de oxígeno, pueden ser problemáticos tanto para el proceso de fabricación como para la ejecución exitosa de los experimentos de electroporación. La solución de problemas del proceso de fabricación se realiza principalmente a través de prueba y error o un diseño experimental de diseño de experimentos más controlado. Además, existen técnicas alternativas de microfabricación, como el grabado iónico reactivo profundo (DRIE), que se pueden sustituir para realizar los diferentes pasos dentro del protocolo (es decir, utilizando una estructura de moldeo grabado DRIE para realizar el proceso de litografía blanda). Además, la optimización de recetas y el diseño / fabricación de dispositivos puede llevar mucho tiempo para los principiantes en el campo. Sin embargo, una vez que el proceso de microfabricación se ha desarrollado con éxito, el ingeniero / científico tiene la libertad de diseñar un dispositivo que sea adecuado para sus necesidades específicas.
Con ese fin, el dispositivo descrito dentro de este protocolo fue desarrollado para ampliar nuestro trabajo anterior32. Esto implicó la utilización de la detección eléctrica de permeabilización de membrana unicelular, pero de una manera de mayor rendimiento. La configuración experimental descrita dentro requiere la necesidad de equipos especializados, es decir, amplificador de bloqueo, que puede ser poco común para el laboratorio de investigación estándar y, por lo tanto, limita el alcance potencial y la adaptabilidad de esta técnica. Sin embargo, se puede implementar un dispositivo de electroporación microfluídica "básico" siguiendo este protocolo, requiriendo solo un generador de funciones y posiblemente un amplificador de voltaje para generar los pulsos de electroporación.
Sin embargo, esta plataforma de microelectroporación se distingue de otras tecnologías de electroporación de una sola célula. La capacidad de detectar eléctricamente y optimizar los parámetros de electroporación en una suspensión de una sola celda en un entorno de flujo continuo es realmente innovadora. El trabajo futuro implica optimizar los otros parámetros experimentales importantes relacionados con los resultados exitosos de la electroporación (ver Figura 1) para mejorar aún más la efectividad general de esta plataforma. Se desarrollarán e implementarán ensayos metabólicos y de viabilidad adicionales para evaluar cualquier posible efecto negativo posterior asociado con la plataforma de microelectroporación. Además, el diseño microfluídico puede seguir siendo mejorado para lograr un mayor rendimiento celular, como ha sido demostrado por otros grupos40. Al abordar estas preocupaciones, esta tecnología tiene el potencial de ser adoptada en el proceso de fabricación de terapia celular para realizar la entrega de genes y / o edición de genes, ya que esta metodología es altamente susceptible tanto a un proceso cerrado como automatizado.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer el apoyo financiero de la National Science Foundation (NSF CBET 0967598, DBI IDBR 1353918) y la Capacitación de Posgrado en Áreas Emergentes de Precisión y Medicina Personalizada del Departamento de Educación de los Estados Unidos (P200A150131) para financiar al estudiante graduado J.J.S. en beca.
Materiales
| Name | Company | Catalog Number | Comments |
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
Referencias
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O'Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053(2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications - An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods - An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU. , Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021).
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU. , Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001).
- Substrate Preparation. MicroChemicals. , Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021).
- Lisinenkova, M., Hahn, L., Schulz, J. 4M 2006 - Second International Conference on Multi-Material Micro Manufacture. , Elsevier. 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive - alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX. , Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021).
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045(2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados