Method Article
具有透化检测功能的连续流动微电穿孔系统的制造和操作
摘要
该协议描述了构建芯片实验室微流体电穿孔设备所需的微加工技术。该实验装置在连续流中执行受控的单细胞水平转染,并且可以通过基于群体的对照扩展到更高的通量。提供了实时电监测细胞膜透化程度的能力的分析。
摘要
目前的治疗创新,如CAR-T细胞疗法,严重依赖于病毒介导的基因传递。虽然高效,但这种技术伴随着高昂的制造成本,这引起了人们对使用替代方法进行基因传递的兴趣。电穿孔是一种用于基因和其他外源性物质的细胞内递送的电物理、非病毒方法。在施加电场时,细胞膜暂时允许分子传递到细胞中。通常,电穿孔在宏观上进行以处理大量细胞。然而,这种方法需要大量的经验方案开发,这在处理原代和难以转染的细胞类型时成本高昂。漫长的协议开发,加上需要大电压才能达到足够的电场强度来透化细胞,导致了微型电穿孔设备的发展。这些微电穿孔设备采用常见的微细加工技术制造,允许更大的实验控制,并有可能保持高通量能力。这项工作建立在微流体电穿孔技术的基础上,该技术能够在连续流动下检测单细胞水平的细胞膜透化水平。然而,该技术仅限于每秒处理4个单元,因此本文提出并介绍了一种提高系统吞吐量的新方法。这种新技术,表示为基于细胞群的反馈控制,考虑细胞对各种电穿孔脉冲条件的透化响应,并确定最适合被测细胞类型的电穿孔脉冲条件。然后使用更高通量模式,其中该"最佳"脉冲应用于运输中的细胞悬液。详细介绍了制造设备、设置和运行微流体实验以及分析结果的步骤。最后,通过将编码绿色荧光蛋白(GFP)的DNA质粒递送到HEK293细胞中来证明这种微电穿孔技术。
引言
目前生物医学研究中的治疗创新,如CAR-T(嵌合抗原受体工程T细胞)细胞疗法和使用CRISPR(成簇规则间隔短回文重复DNA序列)/ Cas9的基因编辑,在很大程度上依赖于成功和有效地将外源性物质递送到细胞内空间的能力1。在CAR-T疗法中,在细胞疗法生产中执行基因递送步骤的金标准是使用病毒载体2。虽然病毒介导的基因递送是一种有效的递送方式,但它也有几个缺点。这些包括制造成本、细胞毒性、免疫原性、诱变/肿瘤发生潜力以及要递送的基因的大小限制3.这些限制导致了替代性非病毒递送技术的研究和开发。
电穿孔是病毒介导的基因递送的替代方法,它依赖于应用最佳电脉冲波形来执行细胞的DNA、RNA和蛋白质转染。在施加外部电场后,细胞膜短暂受损,使细胞容易受到细胞内递送其他不可渗透的外源性物质的影响4。与病毒介导的递送相比,电穿孔是有利的,因为它通常是安全的,易于操作的,并且运行成本低。电穿孔可以传递小分子和大分子货物,并且可以有效地转染细胞,无论谱系如何5。为了在电穿孔后获得理想的结果,即良好的活性和良好的电转染效率,需要共同优化各种实验参数。这些包括细胞类型6、细胞密度、分子浓度7、电穿孔缓冲液特性(例如,分子组成、电导率和渗透压)8、电极尺寸/几何形状9 和电脉冲波形(形状、极性、脉冲数)10 (参见 图 1 进行说明)。尽管这些参数中的每一个都会对电穿孔实验的结果产生重大影响,但脉冲波形已被特别详细地研究,因为所施加脉冲的电能是所得细胞活力和电转染效率之间内在权衡的根源8。
通常,电穿孔实验在宏观尺度上进行,其中细胞悬浮在电穿孔比色皿内的一组大型平行板电极之间的100微升缓冲液中。电极通常由铝制成,电极距离为1-4毫米。一旦通过移液器手动加载细胞,比色皿就会电连接到一个笨重的电脉冲发生器,用户可以在其中设置和应用脉冲波形参数来电穿孔细胞悬液。虽然宏观或体电穿孔可以处理细胞密度>106 个细胞/mL,但在优化电脉冲波形设置时,此功能可能会浪费。在电穿孔原代细胞类型时,这一点尤其值得关注,因为细胞群数量可能有限。此外,由于电极之间的距离很大,脉冲发生器必须能够提供大电压以实现电场强度>1kV/cm11。这些高电压会导致阻性功率耗散通过电解质缓冲器,从而导致焦耳热,这可能不利于由此产生的电池活力12。最后,对密集的细胞悬浮液进行电穿孔将始终伴随着由此产生的电转染效率和细胞活力的先天变化。由于周围的细胞,悬浮中的每个细胞可能会经历不同的电场强度。根据经历的电场强度是增加还是减少,由此产生的细胞活力或电转染效率可能会受到负面影响11。宏观电穿孔的这些缺点导致了对微观尺度操作的替代技术的追求和开发,并允许在单细胞水平上进行更好的控制。
BioMEMS或生物医学微机电系统领域源于微电子行业的技术进步。具体来说,利用微加工工艺开发用于推进生物医学研究的微型设备。这些进步包括开发用于体内电监测的微电极阵列13,用于原位电穿孔的电容式微电极14,小型化器官芯片器件15,微流体即时诊断16,生物传感器17和药物输送系统18,包括纳米和微电穿孔设备19,20,21.由于能够以与生物细胞相同尺寸的规模设计和制造设备,因此与宏观尺度的对应物22,23相比,纳米和微电穿孔技术具有优势。这些电穿孔设备消除了高压脉冲应用的要求,因为通常集成了间距为10s至100s微米的电极组。这一特性大大降低了通过电解质的电流,从而减少了有毒电解产物的积累以及这些系统中焦耳热的影响。微尺度通道还确保在脉冲施加期间将更均匀的电场可靠地施加到电池上,从而产生更一致的结果24。此外,将微电穿孔设备集成到微流体平台中也很常见,该平台有助于将来集成到全自动技术中,这是细胞治疗制造中非常理想的能力25。最后,微尺度电穿孔允许对电穿孔事件进行电询问。例如,可以在单个细胞水平26,27上实时监测细胞膜的透化程度。该方法的目的是描述微流体单细胞微电穿孔装置的微加工、系统操作和分析,该设备能够测量细胞膜透化程度以优化电穿孔方案,同时提高通量超过以前的技术。
进行单细胞水平电穿孔不再是一种新技术,正如Rubinsky等人在2001年通过静态细胞电穿孔技术的发展首次证明的那样28。他们的微型设备是创新的,因为他们是第一个展示电转事件电监测能力的设备。这进一步导致了静态单细胞电穿孔技术的发展,该技术能够以并行方式电检测细胞膜透化程度,以提高设备的通量。然而,即使使用并行化和批处理,这些设备也严重缺乏它们每单位时间可以处理的单元总数29,30。这种限制导致了流通装置的发展,这些装置能够以更高的通量执行单细胞水平的微电穿孔31。该装置从静态环境过渡到流通环境,限制了在应用电穿孔脉冲后电监测细胞膜透化程度的能力。这项工作中描述的方法弥合了这两种技术之间的差距,这是一种微电穿孔技术,能够以连续流动、连续的方式电检测、脉冲和监测单个细胞的细胞膜透化程度。
这项技术最近在Zheng等人中得到了描述。在该工作中,随着参数研究的完成,引入了该技术的功能,其中电穿孔脉冲的振幅和持续时间都发生了变化,并探索了指示细胞膜透化的随后的电信号32。结果表明,电穿孔脉冲强度的增加(即外加电场的增加或脉冲持续时间的增加)导致被测细胞膜透化的增加。为了进一步验证该系统,将成功电穿孔的常用荧光指示剂碘化丙啶33添加到细胞悬液中,并在应用电脉冲后立即捕获荧光图像。光信号,即细胞内碘化丙啶的荧光强度,与细胞膜透化程度的电测量密切相关,验证了该电测量的可靠性。然而,这项工作只考虑了小分子碘化丙啶的递送,这几乎没有可转化的意义。
在这项工作中,引入了该技术的新应用,以提高系统的通量,同时提供生物活性质粒DNA(pDNA)载体并评估电穿孔后重新铺板和培养的细胞的电转染效率。尽管之前的工作优于现有的能够电测量电穿孔事件的微电穿孔技术,但该设备的当前状态仍然需要电极组之间的较长细胞传输时间(~250 ms)才能执行细胞检测、脉冲应用和细胞膜透化测量。对于单通道,这将吞吐量限制在 4 个单元/秒。为了克服这一限制,引入了基于细胞群的反馈控制电穿孔的新概念来进行pDNA电转染。通过使用低生理电导率电穿孔缓冲液,该系统允许在多种电穿孔脉冲应用中对单个细胞进行电询问。根据电响应,然后确定"最佳"电穿孔脉冲。然后实施"高通量"模式,其中细胞膜透化测定无效,流速增加,电穿孔脉冲占空比与细胞传输时间相匹配,以确保每个细胞在电极之间传输一个脉冲。这项工作将为制造微器件的微细加工步骤、执行实验所需的材料/设备及其设置以及器件的操作/分析及其电转染效率(eTE)提供广泛的细节。
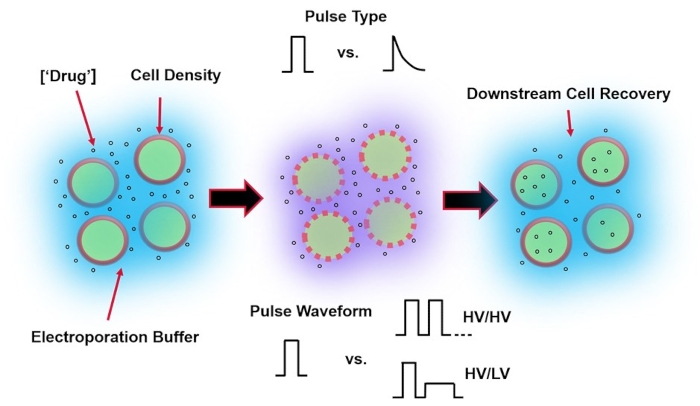
图1:影响电穿孔结果的实验因素 。 (左)细胞悬液-电穿孔开始前要考虑的重要因素包括:有效载荷(在本例中为pDNA)、浓度、细胞密度和电穿孔缓冲液特性。要考虑的电穿孔缓冲液特性是电导率、渗透压和影响这些值的确切分子组成。(中)脉冲应用-必须优化精确的脉冲类型(方波与指数衰减)和脉冲波形(单脉冲与脉冲序列),以最大限度地提高细胞活力和电转染效率。在电穿孔过程中实施的常见脉冲序列通常由一系列高压(HV)脉冲或在高压和低压(LV)脉冲幅度之间旋转的一系列脉冲组成。(右)细胞回收-下游处理步骤,特别是细胞转移到的回收细胞培养基,应进行优化。未显示(最左边),可以实施额外的上游细胞处理步骤,以实现整体电穿孔工艺优化。 请点击此处查看此图的大图。
研究方案
注意:用户应查看所有MSDS以了解本协议中使用的材料和耗材。在每一步都应佩戴适当的PPE,并在实验过程中使用无菌技术。第 1-7 节讨论了器件制造。
1. 器件制造-掩模设计
注意:有关微细加工工艺的说明,请参阅 图 2 。微细加工步骤将在洁净室环境中进行。需要额外的个人防护装备(发网、面部发网、口罩、洁净室服、鞋套)。
- 安装所选的CAD软件,设计微流体通道和电极的二维"掩模",并以所需的文件格式(即.dxf,.dwg)保存设计。
注意:有关二维掩模原理图的示例,请参阅 补充图1 。 - 发送给所选供应商进行打印。确保设计的尺寸在供应商的分辨率范围内。
2. 器件制造-光刻
注意:提供的微细加工配方采用光刻胶制造商的建议,仅应用作起点34。烘烤时间、曝光时间等的精确值需要针对每个制造方案进行优化。建议使用晶圆镊子处理硅片和载玻片。
- 微流控通道制造
- 硅晶圆和钠钙玻璃载玻片清洁:按照步骤2.1.2-2.1.3进行硅晶片和1英寸×3英寸钠钙玻片清洁(均称为"基板")。
- 将底物浸入丙酮浴,异丙醇(IPA)浴和去离子水浴中,每次10分钟。在室温下连续执行此 3 步洗涤。
- 使用加压氮气或过滤空气源去除并干燥表面。将基质放入150°C烘箱中至少30分钟,以使剩余水分蒸发。
- 硅胶片上的SU-8光刻:按照步骤2.1.5-2.1.14在硅片上进行光刻。
注意:为了实现20μm的微流体通道高度,使用了SU-8 2000系列负光刻胶。确切的旋转速率将根据SU-8的配方(即2010年,2015年等)而有所不同;但是,以下条件适用于SU-8 2010配方35。 - 从 150 °C 的烤箱中取出硅片,使其冷却至室温 (RT)。
- 使用旋涂机的真空系统将晶圆固定到晶圆旋涂机的卡盘上。对微调器进行编程。第 1 步 - 以 100 rpm/s 的加速度持续 100 秒,第 2 步 - 以 300 rpm/s 的加速度持续 1000 rpm 持续 30 秒。
- 将 4 mL SU-8 2010 光刻胶分配到硅晶圆的中心。运行程序。系统停止后,关闭真空吸尘器。
- 使用镊子将SU-8涂层硅片转移到95°C的热板上4-5分钟进行软烤。然后从热板上取出晶圆,让它冷却到室温。
注意:请遵循实验室专用光刻掩模对准器的正确启动程序。 - 使用2D微流体通道设计将光掩模固定在掩模支架上。将硅晶圆(SU-8涂层朝上)插入晶圆卡盘上。
- 将曝光设置设置为 150 mJ/cm2 并运行机器。
注意:不要直视紫外线光源,以免对眼睛造成潜在的伤害。 - 将SU-8涂层硅晶片放在95°C的热板上4-5分钟以进行曝光后烘烤。
- 将硅晶圆浸入SU-8显影溶液(见 材料表)中3-4分钟。轻轻搅拌。从溶液中取出晶圆并用 IPA 冲洗表面。
- 使用加压氮气或过滤空气源干燥表面。使用紫外线滤光片在显微镜下检查特征,并确保微流体通道中没有明显的缺陷。
- 将硅晶片放入150°C的烤箱中至少30分钟进行硬烤。
- 允许冷却至室温,并使用测针轮廓测量法测量通道侧壁的确切高度和坡度。
- 载玻片上的光刻
注意:六甲基二硅氮烷(HMDS)用作S1818正性光刻胶36的附着力促进剂。- 从150°C烤箱中取出载玻片,使其冷却至室温。
- 使用真空将载玻片固定到旋转器的卡盘上,并对旋转器进行编程。第 1 步 - 以 100 rpm/s 的加速度行驶 500 rpm,持续 10 秒。第 2 步 - 3000 rpm 持续 30 秒,加速度为 300 rpm/s。
- 在载玻片表面分配3-4滴HMDS。运行程序。
注意:要实现~3μm的表面涂层,应使用S1800正光刻胶系列。确切的旋转速率因配方而异;以下建议适用于S1818配方34。 - 将 1 mL 光刻胶分配到载玻片表面。确保足以覆盖表面积。
- 运行程序。系统停止后,关闭真空,然后取下载玻片。
- 将S1818涂层载玻片放在120°C的热板上4分钟进行软烘烤。移除并允许进入 RT。
- 将带有2D电极设计的光掩模固定在掩模支架上。
- 将载玻片插入并对齐,使 S1818 涂层朝上,到晶圆卡盘上。将曝光设置设置为 250 mJ/cm2 并运行机器。
注意:不同的触点对准器型号可能或多或少地适应非圆形、不同厚度的基板。 - 将载玻片浸入MF-319显影剂溶液中2分钟。轻轻搅拌。用去离子水冲洗载玻片的表面。
- 使用加压氮气或过滤空气源干燥表面,并使用紫外线过滤器在显微镜下观察特征。确保平版印刷图案中没有明显的缺陷。
- 将载玻片放入150°C烘箱中,确保感兴趣的基材表面朝上,至少30分钟进行硬烤。从烤箱中取出并避光保存。
3.器件制造:氢氟酸(HF)刻蚀
注意:此步骤涉及氢氟酸(HF)的处理和处置,氢氟酸可能导致深度,痛苦的化学灼伤。应使用额外的个人防护用品来保护处理人员(面罩、肘部长度的耐化学手套、带套筒的耐化学防护裙)。葡萄糖酸钙中和剂和皮肤凝胶应放在实验室工作台附近。此步骤不应单独执行。HF不应储存在玻璃容器中或分配到玻璃容器中,因为容器会被酸蚀刻。
注意:HF均匀蚀刻暴露的玻璃(即电极设计)以在玻璃中形成凹槽,从而在金属沉积后使电极图案具有更好的边缘分辨率(第4节)。
- 将载玻片浸入聚四氟乙烯容器中的10:1缓冲HF溶液中1分钟。在去离子水中转移并清洗载玻片。重复洗涤步骤3次。
- 使用加压氮气或过滤空气源干燥表面。将玻璃基板放入65°C烤箱中过夜,以去除任何残留的水分。遮住基材免受光线照射。
4. 器件制造:物理气相沉积
注意:此步骤涉及将金属沉积到载玻片基板上以定义电极图案。常用的金属电极是铬/金和钛/铂。金和铂不粘附在玻璃基板上,因此分别需要铬或钛的晶种粘附层来促进附着力37。
- 遵循洁净室特定的协议来操作内部 PVD 系统。这项工作使用直流溅射系统,并在~8 mTorr的压力和200 W功率下使用100 SCCM氩气溅射。
- 以~100Å / min的速度溅射钛8分钟。以~200 Å / min的速度溅射铂金10分钟。从 PVD 腔室中取出基板。
5. 器件制造:光刻胶剥离
注意:此步骤涉及将光刻胶层溶解在丙酮浴中,使粘附的铂电极在载玻片上留下图案。
- 将金属涂层载玻片浸入丙酮浴中~10分钟。
- 超声处理浴液以引入搅拌以分解未粘附的金属膜。如有必要,使用浸有丙酮的湿巾去除任何残留物。
- 去除所有光刻胶/金属后,用去离子水清洗电极图案,并将它们放入65°C烘箱中过夜以去除任何残留的表面水分。
- 使用触针轮廓测量法测量图案电极的轮廓。
6. 器件制造:软光刻
注意:此步骤涉及使用弹性体聚二甲基硅氧烷(PDMS)将微流体通道复制成型到SU-8主浮雕结构上。
- 硅片硅烷化
注意:这是一个可选步骤;但是,它将增加第2.1小节中制造的SU-8浮雕结构的使用寿命。此步骤应在化学通风橱中进行。- 将晶片固定到培养皿的底部,并将培养皿放入干燥器中。
- 用大约 50 μL 三氯(1H,1H,2H,2H-全氟辛基)硅烷包围硅晶片的周边。连接真空(真空泵或室内真空管路)并运行20分钟。
- PDMS 复制成型
- 在一次性容器(例如,称重船、塑料杯)中,在电子天平上以10:1的重量比将PDMS弹性体基料与固化剂混合。将PDMS溶液倒在硅晶片上,并将混合物置于真空下以去除所有气泡。
- 在65°C下固化至少4小时,使PDMS凝固。使用剃须刀片的尖端,切出模制的PDMS并从硅晶片上剥离。
- 使用锋利的活检打孔器,从设备的入口/出口处取出PDMS。对于该设备,入口和出口分别使用0.75 mm和3 mm活检冲头。
注意:使用的活检穿头的直径应略小于互连管的外径,以确保储液槽中的管子紧密密封。
- PDMS的超声清洗
- 将PDMS设备浸入IPA中,并将它们放入超声仪中30-45分钟,以清除入口/出口中的任何PDMS碎片。PDMS 可能会在 IPA 溶液中膨胀。
- 用去离子水冲洗并放入65°C烤箱中过夜,以使PDMS消膨胀回正常大小。
注意:在实验过程中,任何残留的碎屑都会堵塞设备。在超声处理之前,可以使用一块透明胶带从PDMS表面去除大块碎屑。
7. 器件制造:PDMS键合/电线连接
注意:此步骤涉及用氧等离子体处理PDMS和玻璃基板的表面,以在PDMS和玻璃38之间形成不可逆的键。提供的配方可能需要适应实验室中使用的确切系统。
- 根据尺寸切割设备,并确保 PDMS 设备的表面清洁。如果未重新清理,请按照第 6.3 小节中的步骤操作。
- 对等离子发生器进行编程。将 功率 设置为 70 W, 时间 设置为 35 秒, 压力 设置为 325 mTorr,氧气 流量 设置为 60 SCCM。将PDMS和电极载玻片放入系统中,使特征朝上并运行程序。
- 移除设备并使用立体镜快速将通道特征与电极对齐。从PDMS的中心向侧面牢固施加压力,以去除粘合界面处任何不需要的气泡。
- 置于95°C的热处至少2分钟以完成粘合程序,并使设备在室温下冷却。
- 以~6"长度切割22-G实心线,并从两端剥离绝缘体。
- 使用银导电环氧树脂将电线粘合到电极焊盘上。将完成的设备放入65°C的烤箱中过夜。

图 2:微器件制造。 (a)微流体通道制造-关键步骤:硅晶圆清洁(步骤2.1.1-2.1.3),光刻胶涂层和软烘烤(步骤2.1.7-2.1.8),紫外线照射(步骤2.1.10),显影(步骤2.1.12)和PDMS浇注(第6.2小节)。(B)电极制造-关键步骤:载玻片清洁(步骤2.1.1-2.1.3),HMDS涂层和光刻胶涂层(步骤2.2.3-2.2.4),紫外线照射(步骤2.2.8),显影(步骤2.2.9),HF蚀刻(第3部分),物理气相沉积(第4部分)和光刻胶剥离(第5部分)。(c) 设备定稿-关键步骤:入口/出口接入和超声处理(步骤 6.2.3 和第 6.3 节)、PDMS 键合和电线连接(第 7 节)。请点击此处查看此图的大图。
8. 细胞培养和收获
注意:应使用标准细胞培养和无菌处理程序。遵循细胞类型特异性方案进行细胞培养。
- 细胞培养
- 细胞传代:按照步骤8.1.2-8.1.5培养和传代细胞。
- 在完整的DMEM溶液(88%DMEM,10%热灭活胎牛血清,1%L-谷氨酰胺,1%青霉素 - 链霉素)中培养HEK293细胞,在37°C,95%O 2,5%CO 2培养箱中的T25烧瓶中。 达到~80%汇合度时按计划传代细胞。
- 使用移液管或真空系统吸出培养基,并将细胞在0.25%胰蛋白酶-EDTA(2mL-T25烧瓶)中在37°C孵育2分钟。 用两倍体积的培养基中和胰蛋白酶。
- 将细胞悬液转移到 15 mL 锥形管中,并以 770 x g 离心 HEK293 细胞 2 分钟。使用移液器或真空系统吸出上清液
- 将 HEK293 细胞重悬于 1 mL 预热的 DMEM 中。
- 电池电镀:按照步骤8.1.7-8.1.8对电池进行铺板
- 将细胞以 10:1 至 20:1 的稀释度接种在 T25 烧瓶(5 mL DMEM)中以继续培养。
- 将细胞以 5:1 至 20:1 稀释度接种在 6 孔板(每孔 2 mL DMEM)中,收获用于电穿孔实验。
注意:HEK293细胞在电穿孔实验前24小时接种,以在细胞收获时达到~70%的汇合度(小节8.3)。不一致的收获计划会导致电穿孔结果的变化。
- 电穿孔缓冲液
- 制备电穿孔缓冲液
注意:有关电穿孔缓冲液制备的详细信息,请参阅Sherba等人8。缓冲液组成为285 mM蔗糖,0.7 mM MgCl2,1 mM KCl,10 mM HEPES,3 mM NaOH(pH:7.4;渗透压:310 mOsm,电导率:500 μS/cm)。电穿孔缓冲液应以无菌方式配制,并在4°C下储存~1个月的保质期。电穿孔缓冲液配方应根据每种细胞类型进行优化。
- 制备电穿孔缓冲液
- 细胞收获和 pDNA 添加
- 遵循与细胞传代相同的步骤(8.1.2-8.1.4)。
- 在无菌 1x PBS 中洗涤细胞,将细胞悬液转移到 15 mL 锥形管中,并以 770 x g 离心细胞 2 分钟。
- 在电穿孔缓冲液中洗涤HEK293细胞沉淀,并以770× g 离心2分钟。将细胞重悬于电穿孔缓冲液中,浓度为~500万个细胞/mL。
注意:应根据细胞类型优化细胞密度。 - 加入编码绿色荧光蛋白 (GFP) 的 pDNA 至终浓度为 20 μg/mL。轻轻混合pDNA /细胞悬液并将悬浮液转移到1 cc注射器中进行实验。
9. 硬件/实验设置
注意:在收获细胞进行实验之前,请确保完成实验设置,以尽量减少细胞悬浮在电穿孔缓冲液中的时间。在实验前 20-30 分钟打开电子设备进行预热。有关单细胞检测模块操作的实验设置示意图,请参阅 图3 。
注意:开发了一个定制的PA90运算放大器电路,以适应使用锁相放大器进行单电池电平检测所需的灵敏度和施加足够强的电穿孔脉冲所需的高电压。有关推荐电路39 的规格,请参阅 PA90 数据表。
- 使用电流前置放大器设置初始化锁相放大器,并通过算法进行设置。有关锁定设置的详细信息,请参阅Zheng等人32。
- 电源、函数发生器和放大器
- 电源 1:设置为 -15 V 为电路的负端供电。
- 电源 2(函数发生器):设置为输出直流信号并将幅度设置为 2 V。 连接到 50x 放大器输入。
- 为方波编程电穿孔脉冲发生器:设置所需的脉冲宽度(占空比)和所需的脉冲幅度(伏特)。
- 将输出设置为触发模式(1 脉冲)。将输出连接到 50x 放大器的输入。
注意:在对脉冲幅度进行编程时,请记住 50 倍增益。即,要实现 1 kV/cm 的电场强度,总共需要 30 V,30 V/300 μm(电极之间的距离),因此函数发生器输出应设置为 30/50 或 600 mV。 - 使用示波器验证 50x 放大器的输出。从电源 2 (9.2.2) 输出 1-100 V。输出 2 - 电穿孔脉冲的可变振幅 (9.2.4)。
- 在步骤7.6中,将10倍探头连接到示波器通道和完成的微型设备(被测设备,DUT),其中将施加电穿孔脉冲。在实验期间监控系统,以确保应用脉冲。
- 确保锁定 USB 已连接并注册。仔细检查算法代码中的所有锁定设置(最重要的是锁定输出频率)。
- 显微镜/CCD相机
- 通过载玻片支架将微型设备放在显微镜载物台上。打开CCD相机,聚焦微流体通道。使用 4x 或 10x 物镜。
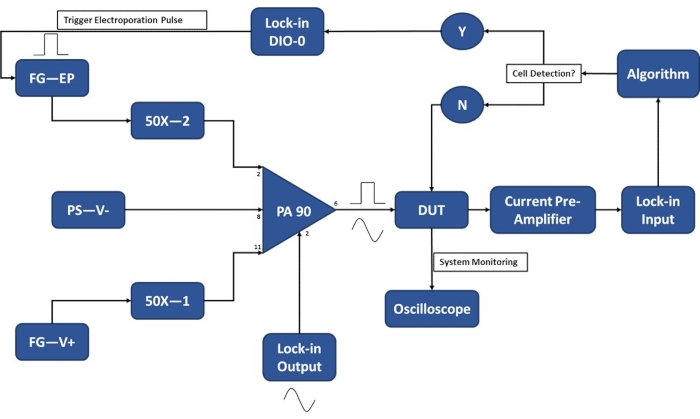
图 3:实验设置原理图-单细胞检测。 高功率运算放大器(PA-90)允许将高压电穿孔脉冲叠加到单电池检测所需的锁相输出交流信号上。该激励信号通过微电穿孔器件(被测器件,DUT),然后电流前置放大器放大电流并馈入算法。系统持续监测细胞检测事件。进入细胞后,锁相放大器产生数字信号,以触发电穿孔脉冲施加到传输中的细胞。图例:PA-90(高功率运算放大器)、DUT(被测器件)、DIO(数字输入/输出)、FG-EP(函数发生器/电穿孔脉冲)、50X(50X 放大器)、PS-V-(PA 90 的电源/负电压)、FG-V+(函数发生器,PA 90 的正电压)。请点击此处查看此图的大图。
10. 实验操作
- 微流体通道启动
- 从装有细胞的注射器中取出所有气泡。将30 G针头连接到细胞加载注射器上。
- 使用镊子将泰贡管沿着针的长度滑动。用回收培养基预填充出口储液槽(与步骤8.1.2相同,不含抗生素),~40-50μL。
- 用拇指轻轻地对柱塞施加压力,使流体慢慢到达管路的末端。
- 将注射器固定到注射泵上。打开注射泵并确保将其设置为向前灌注。
- 对泵进行适当直径的注射器编程,以确保流速准确。有关注射器直径的详细信息,请参阅泵手册。
注意:为防止细胞沉淀在注射器中,请将注射泵固定在夹具支架上,使其可以在垂直位置操作,注射器末端朝下。 - 设置注射泵流速,~10-20μL/min,并允许泵运行,直到流体到达管路末端。将管道固定到微流体装置上。
- 降低注射器泵的流速,~5-10μL/min,并允许泵运行,直到所有空气从微流体装置中排出并且细胞穿过设备出口。
- 通过移液器抽吸从出口取出细胞。用回收培养基重新填充出口储液槽(与步骤8.1.2相同,不使用抗生素),~40-50μL。
- 单细胞电穿孔-细胞膜透化作图
注意:请参阅图 4 和 图5 ,以更好地了解分别指示细胞膜透化的电数据和细胞膜透化映射。- 将注射泵流速设置为 ~0.1-0.3 μL/min,以确保单个细胞流过电极组。电极之间的细胞传输时间应为~250毫秒。
- 通过单击 "运行"启动计算机程序。确保系统正在保存电气数据。
- 确保系统可靠地检测细胞以触发计算机控制的脉冲应用。相应地调整 检测阈值 。
- 设置初始、最低电能电穿孔脉冲的脉冲参数。有关本研究中的电穿孔脉冲参数,请参阅 表1 。
- 打开电穿孔脉冲发生器的输出通道(步骤9.2.3)。
- 遵循预定数量的细胞检测/脉冲应用(n = 100)。在每个测试条件结束时,从微设备出口吸出细胞并用恢复培养基补充出口。
- 迭代到下一个电穿孔脉冲条件。重复直到测试所有电穿孔脉冲条件。
- 确定测试的每个脉冲应用的细胞膜透化程度。(后处理验证在第 11.1 小节中描述)。生成细胞膜透化图(图5)。
- 确定高通量、基于群体的反馈的电穿孔脉冲参数。
- 关闭注射泵,从出口储液器中取出细胞,并用回收介质补充出口。
- 基于群体反馈控制的电穿孔-高通量
注意:有关说明基于群体的反馈过程的示意图,请参阅 图 6 。- 将注射泵流速设置为 ~1-3 μL/min,以确保单个细胞流过电极组。电极之间的电池传输时间应为~25 ms。
- 将脉冲幅度设置为"优化"条件 (10.2.9),关闭触发模式,并设置脉冲宽度以匹配电池传输时间。
- 设置占空比,使脉冲导通时间与"优化"条件匹配。请参阅 表 1。
- 将输出通道函数发生器设置为 ON,打开注射泵,并允许系统运行,直到电穿孔所需的细胞数。
- 完成后,关闭注射泵和函数发生器。
- 将细胞从出口储液槽转移到装有预热回收培养基的适当大小的细胞培养瓶/板中,并将培养瓶/板转移到培养箱中。
11. 分析
- 单细胞水平膜透化检测
注意:为确保在高通量模块期间使用"最佳"脉冲,应进行实验后分析以验证从第10.2小节导出的电气数据。请参考 图4 ,了解电穿孔引起的膜透化的电信号的图形表示。- 将数据加载到分析软件(MATLAB,Python等)中。为每个脉冲条件生成电流与时间的关系图。
- 手动确定细胞膜透化程度(Δ IP / ΔIC)。请参阅图 4。在所有测试的脉冲条件下生成细胞膜透化图(Δ IP / ΔIC 与电能的关系,图 5)。验证"最佳"脉冲条件。
- 电转染效率
- 在24小时孵育期后,从培养箱中取出电穿孔细胞。
- 进行活细胞染色。在细胞培养容器中将DRAQ5 1:1000稀释至终浓度为5μM。轻轻混合细胞/染色溶液,并在37°C孵育5-30分钟。
注意:在此步骤中可以实施不同的染色。确保荧光特性不与指示电转染成功的荧光标记物重叠(即GFP为绿色波长,DRAQ5为远红色波长)。 - 打开落射荧光显微镜、灯和相机(见 材料表)。
- 从培养箱中取出细胞,并将它们聚焦在显微镜上。
- 捕获所选视场的相差图像(明场)。
- 使用FITC(GFP)和远红(DRAQ5)滤光片捕获同一视场的落射荧光图像。手动或通过算法分析图像集。
注:有关代表性图像,请参阅 图 7 。 - 计算所有图像中GFP阳性细胞的总数。计算所有图像中DRAQ5染色细胞的总数。计算eTE(GFP阳性细胞与DRAQ5染色细胞的比率)。
结果
图4突出显示了单脉冲幅度的单细胞级膜透化检测的工作原理。电穿孔实验开始后,细胞检测算法通过逐点、基于斜率的检测方法确定细胞检测的最佳阈值。然后,系统连续监测(1)测量电流的显着负变化,这表明电池进入。这是由于生物细胞膜的绝缘性质,当细胞穿过电极组时,阻抗瞬时增加,导致测量电流急剧下降,从而实现一致的细胞检测(2),最终触发切换到计算机控制的脉冲应用(4)。绝缘电池在电极之间置换一定体积的电解质,导致电流下降,与电池大小成正比。电流的这种变化表示为 ΔIC (3)。在ΔIC计算之后,立即将预定的电脉冲(4)施用于运输中的电池。这种瞬时的能量流入将一个简短的传感伪影引入系统(灰盒)。在重新锁定信号时,即切换回细胞监测,(5)很明显,电穿孔脉冲透化了细胞膜,因为由于电极组之间的细胞存在而导致的电流大小变化在退出时下降(6)。电穿孔脉冲应用前后由于电池阻抗大小引起的两次电流下降的差异称为透化电流,表示为ΔIP。一旦细胞离开电极之间的体积,基线稳定,系统返回细胞检测模式(1)。在电穿孔预定数量的细胞后,测试下一个最高能量的电穿孔脉冲(有关脉冲设置,请参阅表1)。对于测试的每个电穿孔脉冲,确定平均"膜透化程度"。该值计算为 Δ IP/ΔIC。测试每个预定的电穿孔脉冲后,将Δ IP/ΔIC与施加的电能密度(σ x E 2 x t)作图,其中σ是溶液电导率(S/cm),E是电场强度(kV/cm), t是脉冲持续时间(ms)。有关本例中使用的HEK293细胞的细胞膜透化图,请参阅图5。
表1:电穿孔脉冲参数。 在这项研究中,选择电穿孔脉冲使得电荷通量(σ×E×t)保持不变,其中 σ 是溶液电导率(S/cm), E 是电场强度(kV/cm), t 是脉冲持续时间(ms)。结果是施加的脉冲电能的频谱。提供了实现指定脉冲参数所需的占空比(直流)示例,初始(单细胞检测)流速增加 5× 和 10×。 请按此下载此表格。
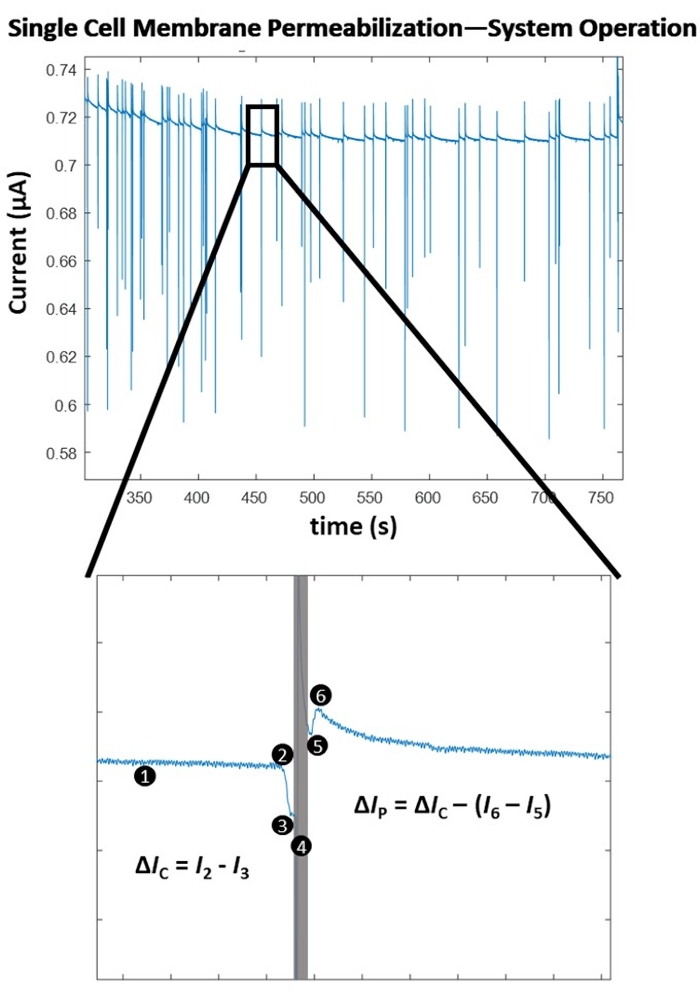
图4:单细胞膜透化-算法操作。 (上)一系列单电池检测/脉冲应用的电记录(由电流的尖峰指示)。(下)用于检测和脉冲单个电池的系统操作。(1) 系统通过逐点斜率计算连续检测电流变化。(2)检测到斜率急剧下降,表明电极之间的电池进入并触发计算机控制的脉冲应用。(3)确定电流降(ΔIC),并与电池的大小成正比。(4)电穿孔脉冲施加到运输中的细胞上,在电信号中引起传感伪影(灰色框)。(5) 锁相放大器在传输过程中重新锁定到电池中时切换回电池监控。(6)电池离开电极组,引起另一个较小幅度的电流尖峰(Δ IC >(I 6 - I5))。阻抗测量的差异是由于通过绝缘细胞膜形成孔。电流的这种变化称为透化电流(ΔIP)。计算细胞膜透化程度(Δ IP / ΔIC)。基线稳定,系统返回检测模式 (1)。请点击此处查看此图的大图。
在施加的电能与细胞膜透化程度之间观察到明显的相关性(图5),存在一个过渡区域,其中细胞膜透化程度显着增加。为此,为微电穿孔过程的高通量阶段选择超过该过渡区域的电能脉冲(图6)。在该实验中,1.8 kV/cm:670 μs脉冲被确定为"最佳"。如协议第10.3小节中详细描述的那样,系统流速增加,函数发生器设置为以设定的脉冲和占空比连续输出脉冲(有关1.5μL/min和3.0μL/min流速的脉冲设置,请参阅表1),以确保向传输中的每个电池施加 1 个脉冲。在这项研究中,流速增加了5倍,因此脉冲宽度设置为50毫秒(与细胞传输时间相匹配),占空比(直流)为2.7%。
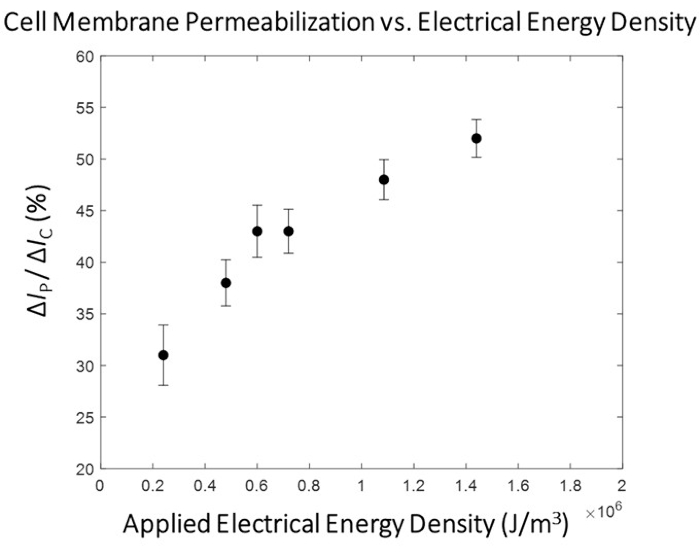
图5:HEK293细胞膜透化映射-Δ Ip/ ΔIc与电能的关系。 电数据(Δ IP/ ΔIC)表示为平均±SEM。 脉冲条件(从左到右)- 0.4 kV/cm : 3 ms, 0.8 kV/cm : 1.5 ms, 1.0 kV/cm : 1.2 ms, 1.2 kV/cm : 1 ms, 1.8 kV/cm : 0.67 ms, 2.4 kV/cm : 0.5 ms.观察到细胞膜透化程度与所施加脉冲的电能密度之间存在明显的相关性。在本轮实验中,选择1.8 kV/cm:0.67 ms脉冲条件作为高通量模块的"最佳"电穿孔脉冲。请点击此处查看此图的大图。
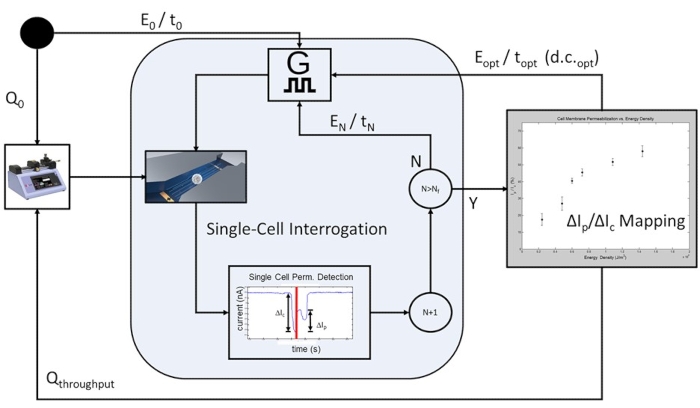
图 6:基于细胞群的反馈控制电穿孔过程工作流程。 首先,对初始流速(Q0)进行编程,以允许单电池级电询问。在每个预定的电穿孔脉冲条件(E 0/t0 至 E N/tN)下,可编程数量的细胞被脉冲,施加的电能随着电穿孔脉冲应用的每次迭代而增加。在完成研究中包含的最高电能脉冲E N / tN之后,绘制细胞膜透化曲线,并确定被测细胞群的最佳电穿孔脉冲。系统进入高通量模式,其中流速增加到Q通量,并且省略了限速单单元询问步骤。最佳脉冲序列将在d.c.opt处连续施加E opt/t opt,使得运输中的每个细胞将根据细胞传输时间和脉冲宽度占空比(d.c.)接收单个电穿孔脉冲。 请点击此处查看此图的大图。
电穿孔后恢复24小时后,对细胞进行成像以确定电转染效率(eTE)。如协议第11.2小节所述,将eTE确定为表达GFP的细胞总数归一化为用DRAQ5染色的细胞总数。1.8 kV/cm:670 μs脉冲的eTE被确定为~70%(图7A)。为了强调系统在过渡到高通量模式时准确绘制细胞膜透化程度并选择足够高的电穿孔脉冲能量的重要性,还根据 eTE 探索了 0.4 kV/cm:3 ms 脉冲条件(图 7B)。在这种情况下,24 小时产生的 eTE 小于 5%。
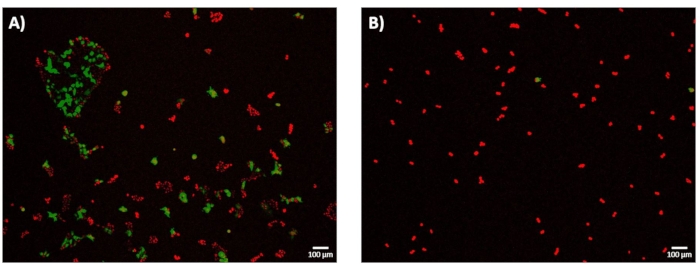
图7:24小时电转染效率-GFP表达。 将HEK293细胞在微电穿孔实验后在37°C下孵育24小时。所有细胞均用DRAQ5(红色)染色,并根据表达GFP(绿色)的细胞与总细胞数(红色)的比率确定电转染效率(eTE)。在这项研究中,细胞活力未被评估为结果指标。(A) 通过 1.8 kV/cm:670 μs 脉冲成功转染的 HEK293 细胞的代表性堆叠 4× 荧光图像,显示 eTE 约为 70%。(B)代表性的,堆叠的4×HEK293细胞的荧光图像,通过0.4 kV / cm:3 ms脉冲转染未成功,显示eTE<<5%。比例尺:100 μm。 请点击这里查看此图的大图。
补充图1:二维CAD原理图。 微电穿孔设备由一个100 μm宽的直微通道组成,入口直径为1 mm,出口直径为3 mm。每条电极迹线宽 100 μm,电极组包含设备的电穿孔区域,该区域长 300 μm。微通道的三维高度由光刻胶的厚度控制。在这项工作中,设备的高度为20μm。 请点击这里下载此文件。
讨论
该协议中提出的方法主要侧重于微流体装置的微加工,然后将其集成到专门的电穿孔实验装置中。术语"配方"通常用于描述微细加工过程的细节,暗示了遵循/优化每个步骤以成功制造功能设备的重要性。然而,工艺中的某些关键步骤,如紫外线照射时间/能量、PVD 溅射速率/持续时间和氧等离子发生器设置,可能会对制造工艺以及电穿孔实验的成功执行造成问题。制造过程的故障排除主要通过反复试验或更可控的实验设计实验设计来完成。此外,还有替代的微细加工技术,例如深反应离子蚀刻(DRIE),可以替代它们来执行协议中的不同步骤(即,使用DRIE蚀刻成型结构来执行软光刻工艺)。此外,对于该领域的新手来说,优化配方和设计/制造设备可能非常耗时。然而,一旦微细加工工艺开发成功,工程师/科学家就可以自由设计适合其特定需求的设备。
为此,开发了该协议中描述的设备,以扩展我们之前的工作32。这需要使用单细胞膜透化电检测,但以更高的通量方式。其中描述的实验设置需要专门的设备,即锁相放大器,这对于标准研究实验室来说可能并不常见,因此限制了该技术的潜在扩展和适应性。然而,"裸骨"微流体电穿孔装置可以按照该协议实现,只需要一个函数发生器和可能的电压放大器来产生电穿孔脉冲。
然而,这种微电穿孔平台与其他单细胞电穿孔技术不同。在连续流动环境中对单细胞悬浮液进行电检测和优化电穿孔参数的能力是真正的创新。未来的工作涉及优化与成功的电穿孔结果相关的其他重要实验参数(见 图1),以进一步提高该平台的整体有效性。将开发和实施额外的活力和代谢测定,以评估与微电穿孔平台相关的任何潜在的负面下游影响。此外,微流体设计可以继续改进以实现更高的细胞通量,正如其他组40所证明的那样。在解决这些问题后,该技术有可能被采用到细胞疗法制造过程中,以执行基因传递和/或基因编辑,因为该方法非常适合封闭和自动化过程。
披露声明
作者没有什么可透露的。
致谢
作者要感谢美国国家科学基金会(NSF CBET 0967598,DBI IDBR 1353918)和美国教育部在新兴精准和个性化医学领域的研究生培训(P200A150131)的财政支持,以资助研究生J.J.S.奖学金。
材料
| Name | Company | Catalog Number | Comments |
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
参考文献
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O'Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053(2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications - An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods - An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU. , Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021).
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU. , Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001).
- Substrate Preparation. MicroChemicals. , Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021).
- Lisinenkova, M., Hahn, L., Schulz, J. 4M 2006 - Second International Conference on Multi-Material Micro Manufacture. , Elsevier. 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive - alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX. , Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021).
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045(2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。