Method Article
유전자 표적화된 망막 세포 집단의 희소 아데노-연관 바이러스 표지를 이용한 뉴런 수목화의 타임랩스 이미징
요약
여기에서, 우리는 시간 경과 공초점 현미경에 의해 산후 마우스 망막 외식편에서 신경돌기 형태 형성을 조사하는 방법을 제시한다. 우리는 Cre 의존성 방식으로 막 표적화된 형광 단백질을 발현하는 재조합 아데노-관련 바이러스 벡터를 사용하는 망막 세포 유형의 희소 표지 및 획득 및 이들의 미세 공정에 대한 접근법을 기술한다.
초록
수지상 arbors를 패턴화하는 메커니즘을 발견하려면 개발 중에 수상 돌기를 시각화, 이미지 및 분석하는 방법이 필요합니다. 마우스 망막은 신경 형태 형성 및 연결성의 세포 유형 특이적 메커니즘의 조사를 위한 강력한 모델 시스템이다. 망막 아형의 조직과 구성은 잘 정의되어 있으며, 유전 도구는 개발 중에 특정 유형에 접근 할 수 있습니다. 많은 망막 세포 유형은 또한 그들의 수상 돌기 및 / 또는 축삭을 좁은 층으로 제한하여 시간 경과 이미징을 용이하게합니다. 마우스 망막 외래 배양물은 공초점 또는 다중 광자 현미경을 사용한 살아있는 세포 이미징에 매우 적합하지만 시간적 및 구조적 해상도로 수상 돌기 역학을 이미징하는 데 최적화 된 방법은 부족합니다. 여기에 제시된 것은 Cre-Lox 시스템에 의해 표시된 특정 망막 집단의 발달을 희박하게 라벨링하고 이미지화하는 방법입니다. 여기에서 사용되는 상업적으로 입수가능한 아데노-관련 바이러스 (AAVs)는 Cre-의존성 방식으로 막 표적화된 형광 단백질을 발현한다. 신생아 마우스에서 AAVs의 안구 내 전달은 주사 후 4-5 일 (dpi)에 의해 표적화 된 세포 유형의 형광 표지를 생성합니다. 막 형광 신호는 공초점 이미징으로 검출 할 수 있으며 미세 분지 구조와 역학을 해결합니다. 2-4 시간에 걸친 고품질 비디오는 산소화 된 인공 뇌척수액 (aCSF)이 관류하는 망막 플랫 마운트를 이미징하여 획득합니다. 또한 디컨볼루션 및 3차원(3D) 드리프트 보정을 위한 이미지 후처리 파이프라인도 제공됩니다. 이 프로토콜은 손상되지 않은 망막에서 여러 세포 행동을 포착하고 신경돌기 형태 형성을 조절하는 새로운 요인을 확인하는 데 사용할 수 있습니다. 망막에서 배운 많은 발달 전략은 중추 신경계의 다른 곳에서 신경 회로의 형성을 이해하는 데 관련이 있습니다.
서문
망막 뉴런의 덴드라이트는 신경 회로 내에서 기능에 영향을 미치는 복잡하지만 구체적인 패턴을 형성합니다. 척추동물 망막에서 다양한 유형의 망막 신경절 세포(RGCs)와 아마크린 세포 인터뉴런은 arbor 크기, 위치, 가지 길이 및 밀도가 다른 독특한 수지상 형태를 띠고 있습니다1. 산후 발달 동안, RGCs와 amacrine 세포는 광수용체 신호를 전달하는 양극성 세포 입력을 수신하는 내부 플렉시폼 층 (IPL)이라고 불리는 뉴로필로 풍성한 수지상 과정을 확장합니다2. 병아리 또는 제브라피쉬 유충에서 형광으로 표지된 망막 개체군의 타임랩스 영상에 의해 포착된 바와 같이, 수상 돌기 형태형성은 매우 역동적이다3,4,5. 며칠 내에 수지상 arbors는 IPL의 좁은 하위 계층으로 확장, 리모델링 및 확대되어 일부 파트너와 시냅스합니다. arbors는 개발에 걸쳐 다른 구조적 역학을 나타내며, 지점 추가, 철회 및 안정화의 상대적 비율의 변화와 함께 나타납니다. Amacrine 및 RGC 수상 돌기는 또한 유형 별 수목을 반영 할 수있는 다른 성장 및 리모델링 동작을 나타냅니다. 그러나 이러한 연구는 광범위한 amacrine 또는 RGC 개체군을 추적하고 형태학의 한 측면 인 층류 타겟팅에 중점을 두었습니다.
망막 아형에서 관찰되는 광대한 형태학적 다양성을 생성하는 메커니즘은 잘 이해되지 않는다. 이 그룹의 목적은 수지상 역학을 포착하고 마우스에서 정의 된 망막 아형의 아형을 리모델링하는 방법을 개발하는 것이 었습니다. 수상 돌기 패터닝의 세포 유형 별 메커니즘을 식별하려면 관심있는 세포의 수상 돌기 행동을 시각화하고 측정하는 방법이 필요합니다. 마우스 망막의 유기형 배양은 공초점 또는 다중 광자 현미경을 사용하는 살아있는 세포 이미징 연구에 매우 적합합니다. 개발 중인 망막은 해부되어 평평한 외래편에 장착되며, 이 외식재는 기록 챔버에서 몇 시간 동안 영상화되거나 회로에 제한된 영향을 미치는 며칠 동안 배양될 수 있습니다6,7. 살아있는 망막 뉴런은 전극에 의한 염료 충전, 전기천공, 형광 단백질을 코딩하는 친유성 염료 또는 플라스미드로 코팅된 입자의 생체목록 전달(예를 들어, 진건) 및 유전적으로 코딩된 세포 표지7,8,9,10을 포함하는 다양한 기술에 의해 표지될 수 있다. . 그러나, 이러한 접근법은 특정 망막 아류형의 수상 돌기 역학을 이미징하는 데 비효율적이다. 예를 들어, 염료 충전 방법은 처리량이 낮으며 관심있는 세포를 안정적으로 타겟팅하기 위해 전기 생리학 장치 및 추가 유전자 표지가 필요합니다. 더욱이, 소마의 강한 형광 신호는 근처의 덴드라이트를 흐리게 할 수 있다.
생체 목록 유전자 전달 방법은 동시에 수십 개의 세포를 표지 할 수 있지만 고압 입자 전달 및 분리 된 망막의 하룻밤 배양과 관련된 단계는 세포 생리학 및 수지상 증식을 손상시킬 수 있습니다. 이 논문은 최근의 유전 도구를 사용하여 다음과 같은 실험 기준을 고려할 때 세포 유형 및 구조적 분해능으로 초기 수상 돌기 역학을 포착 할 수 있다고 제안합니다. 첫째, 발달하는 arbors를 지배하는 미세한 가지와 filopodia를 해결하기 위해이 방법은 전체 arbor의 과정을 채우는 밝고 형광 단백질로 뉴런을 표지해야합니다. 형광 표지는 이미징 기간 동안 광표백으로 인해 퇴색해서는 안됩니다. 다양한 형광 단백질 변이체가 생성되고 밝기 및 광안정성에 기초한 생체내/생체외 영상화11에 대한 적합성에 대해 비교되었다. 둘째, 형광 단백질 (XFPs)은 수상 돌기 형태 형성의 초기 단계에 의해 충분히 높은 수준으로 발현되어야하므로 좁은 발달 창을 놓치지 않아야합니다. 마우스 망막의 정적 시간대 분석에서 수상 돌기 발달은 출생 후 첫 주 동안 발생하며 성장, 리모델링 및 안정화 단계를 포함합니다10,12,13,14,15. 셋째, 상기 방법은 선택적 표지 또는 관심있는 뉴런 하위집단의 표지 가능성 증가로 이어져야 한다. 넷째, 표적 하위집단의 표지는 전체 뉴런 아버가 확인되고 추적될 수 있도록 충분히 희박해야 한다. RGC 및 amacrine 아류형은 성숙한 형태학적 특성 및 IPL 계층화 패턴16,17,18,19,20에 의해 구별될 수 있지만, 과제는 미성숙 구조를 기반으로 개발 중에 아형을 식별하는 것이다. 이 작업은 개발 중에 특정 망막 세포 유형을 표지하는 트랜스제닉 도구의 확장에 의해 촉진됩니다.
형광 단백질 또는 Cre의 세포 및 시간적 발현이 유전자 조절 요소에 의해 결정되는 형질전환 및 녹-인 마우스 라인은 망막 세포 유형13,21,22,23을 연구하는데 널리 사용된다. 수상 돌기 발달의 아형 특이적 패턴에 대한 주요 관찰은 정적 시점 10,14,24,25에서 트랜스제닉 마우스 망막에 대한 연구에서 나왔다. 특히 Cre-Lox 시스템은 다양한 재조합효소 의존성 리포터, 센서 및 광유전학적 활성화제를 사용하여 아형의 절묘한 유전자 조작 및 모니터링을 가능하게 한다. 이러한 도구는 망막 회로 어셈블리의 기초가되는 아형 특정 분자 프로그램 및 기능적 특성의 발견으로 이어졌습니다.26,27,28,29,30. 그러나, 그들은 아직 마우스 망막에서 아형 특이적 수상 돌기 역학을 연구하는 데 활용되지 않았습니다. 저밀도 표지는 Cre 마우스 라인을 전기천공 또는 재조합 AAVs에 의해 도입된 전이유전자와 조합함으로써 달성될 수 있다. 이용 가능한 경우, 타목시펜-유도성 Cre 라인 또는 교차 유전자 전략이 또한 사용될 수 있다. 마지막으로, 세포는 최소 침습적 방식으로 표지되어야 하고, 조직을 손상시키거나 수상 돌기 형태형성에 필요한 세포 기능을 방해하지 않도록 획득 파라미터를 사용하여 영상화되어야 한다.
여기에 제시된 방법은 살아있는 마우스 망막 외식편에서 수상 돌기 역학을 조사하기 위해 트랜스제닉 도구 및 공초점 현미경을 적용하는 방법이다. Cre 트랜스제닉 마우스 라인은 Cre 재조합시 형광 단백질을 발현하는 AAV 벡터와 결합되었으며, 이는 관심있는 망막 세포의 희소 표지를 허용한다. 상업적으로 이용가능한 AAVs는 유리체내 주사에 의해 신생아 망막으로 전달된다. 이 논문은 AAV가 4dpi만큼 상당히 높고 세포 유형 별 형광 발현을 생성하여 출생 후 시점에 액세스 할 수 있음을 보여줍니다. 이러한 접근법을 예시하기 위해, 콜린성 "스타버스트" 아마크린 인터뉴런은 콜린 아세틸트랜스퍼라제 (ChAT)-내부 리보솜 진입 부위 (IRES)-Cre 전이유전자를 발현하는 신생아 마우스에 Brainbow AAV를 전달함으로써 표지되었으며, 이는 산후 망막31,32에서 활성화된다. 스타버스트 아마크린 세포는 군집된 프로토카데린33,34에 의해 매개되는 수상 돌기 자기 회피에 의해 형성되는 고정관념 및 방사형 아버 형태를 개발한다. 이 논문은 Brainbow AAVs31에 사용되는 파네 실화를 겪는 CAAX 모티프를 추가하여 XFPs에 의해 원형질막에 스타 버스트 수상 돌기 및 필로 포디아의 해상도가 크게 향상되었음을 보여줍니다. 마지막으로, 타임랩스 이미징 및 후처리 프로토콜은 수상 돌기 재구성 및 형태 정량화에 적합한 고품질 이미지를 생성하는 것으로 결정되었습니다. 이 프로토콜은 수상 돌기 형태 형성을 조절하는 요인을 확인하고 손상되지 않은 망막에서 여러 세포 행동을 포착하는 데 사용할 수 있습니다.
프로토콜
참고: 이 프로토콜은 실험일 사이의 바이러스 형질도입에 대해 최소 4-5일의 기간으로 2일에 걸쳐 있습니다(그림 1A). 동물 실험은 아픈 어린이를위한 병원 (토론토, 캐나다)의 동물 서비스 동물 사용 및 관리위원회의 실험실에서 승인 한 프로토콜에 따라 연구 및 실험실 동물 관리에서 동물 사용에 대한 캐나다 동물 관리 지침에 따라 수행됩니다.
1. 신생아 AAV 주사 및 영상 실험을위한 준비
- Cre 마우스 라인을 선택하여 관심 있는 망막 세포 집단에 라벨을 붙입니다. AAV 주사시의 Cre 재조합효소 발현을 Cre 트랜스제닉 리포터로 교차시키거나 Cre 항체로 면역염색을 통해 확인하였다.
- Cre 양성 형질전환 마우스(8-16주령)를 번식시켜 Cre 양성 신생아 동물을 생성한다.
참고: 이 데모를 위해, ChAT-IRES-Cre 넉-인 마우스를 콜린성 스타버스트 아마크린 세포를 표적으로 삼기 위해 사용하였다. - 재조합효소-의존성 형광 단백질(들)을 코딩하는 AAV 바이러스를 얻는다. 미세 공정의 최적 라벨링을 위해, 원형질막을 표적화하는 수정된 XFP를 발현하는 벡터를 선택하십시오.
참고: 이 연구에서는 Brainbow 바이러스(BBV), AAV-EF1a-BbTagBY 및 AAV9-EF1a-BbChT(자료표 참조)를 사용하여 다색 라벨링 옵션을 제공했습니다(그림 1B). 파네실화 강화된 황색 형광 단백질(eYFP) 및 단량체성 체리(mCherry) 발현은 라이브 이미징을 위한 가장 강력한 형광 신호를 생성하였다. 단일 BBV를 사용하여 개별 arbors를 이미징 할 수 있으며, BBV의 공동 주입을 사용하여 더 많은 세포 또는 이웃 arbors를 뚜렷한 형광단으로 표지 할 수 있습니다. 여러 형광 단백질을 사용하는 경우 최소 방출 스펙트럼 중첩을 보장하십시오(그림 1C). 현미경 수집 파라미터는 별개의 XFP 신호를 캡처하도록 조정되어야 합니다. - 동결 / 해동 사이클을 피하기 위해 일회용 스톡을 위해 개별 저결합 튜브에 AAV의 ∼3-5 μL 분취량을 준비하십시오. -80°C에서 보관한다.
- 마이크로 피펫 풀러를 사용하여 매우 미세한 팁이있는 붕규산 유리 마이크로 피펫을 준비하십시오.
참고: 풀러 설정은 사용 중인 필라멘트와 풀러에 따라 다릅니다. 최종 팁 크기 및 모양에 대해서는 그림 2A 를 참조하십시오. 전형적인 액적 직경은 600 μm이다. - 미세주입 시스템 및 관련 튜브를 얻는다. 미세 인젝터를 가압 공기 포트에 연결합니다.

그림 1: 실험 개요 . (A) 이 프로토콜은 실험 일 사이에 최소 4-5일의 감염 기간을 갖는 실험 2일에 걸쳐 있다. 안구 내 주사는 산후 3 일째보다 오래되지 않은 신생아 마우스에서 수행됩니다. 그런 다음 망막을 해부하고, 평평하게 장착하고, 원하는 발달 창을 캡처하기 위해 라이브 이미지를 촬영합니다. 라벨링된 세포는 수지상 형태학에 대한 장기간의 AAV 발현의 명백한 효과가 없기 때문에 바이러스 발현에 필요한 4-5일 후에 언제든지 영상화될 수 있다. (b) Cre-의존성 Brainbow AAV 벡터 (BBV)를 Cre31을 발현하는 동물에 주사한다. 이 연구에서, ChAT-Cre 넉-인 마우스는 스타버스트 아마크린 세포에서 Cre 재조합을 유도하기 위해 사용되었다. 두 BBV는 수정된 eYFP 또는 tagBFP 또는 mCherry 및 mTFP를 인코딩하며, 이는 막 국소화를 위해 순차적으로 파네실화되는 CAAX 모티프에서 종료됩니다. Lox 사이트는 삼각형으로 표시됩니다. 벡터는 Cre 재조합에 의존하는 확률적 및 조합적 방식으로 파네실화된 XFP를 발현한다. EF1α 프로모터는 신장인자 1α 유전자로부터의 조절 요소를 포함한다. W는 우드척형 간염 바이러스 전사 후 조절 요소로부터의 요소를 나타내고, pA는 폴리아데닐화 서열을 나타낸다. (c) mCherry 및 eYFP의 여기 및 방출 스펙트럼, BBV 형광단이 본 연구에서 이미지화되었다. 다중 형광 단백질을 생중계할 때, 검출 파라미터는 방출 스펙트럼을 별개의 채널로 적절히 분리하도록 배열되어야 한다. 약어: AAV = 아데노-관련 바이러스; BBV = 브레인보우 AAV; ChAT = 콜린 아세틸트랜스퍼라제; iRES = 내부 리보솜 입력 사이트; eYFP = 강화된 황색 형광 단백질; iTR = 거꾸로 된 단말 반복; tagBP = 태그-블루 형광 단백질; mCherry = 단량체 체리; mTFP = 청록색 형광 단백질; XFP = 임의의 형광 단백질; EF1α= 신장률 1 알파. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 신생아 마우스에서 AAVs의 유리체내 주사
- 얼음 위에서 AAV 분취량을 해동하십시오. 멸균 식염수 또는 인산염 완충 식염수를 사용하여 ∼1:4 AAV 희석액을 준비한다. 마이크로 피펫이 파손되고 새로운 피펫을 채워야 할 경우를 대비하여 동물 당 ~ 0.5 μL (눈 당 ~ 0.25 μL)의 AAV 희석액을 준비하십시오. 나머지 희석되지 않은 AAV를 4°C에서 보관하고, 2주 이내에 사용한다.
참고: 이 실험에서 공급업체 AAV 농도는 1013 게놈 함량(GC)/mL× ~1-2 였으며 최종 농도 4 × 1012 GC/mL로 희석하였다. 원하는 라벨링 밀도를 얻기 위해 바이러스 농도를 최적화한다. - 주사제를 시각화하려면 AAV 희석액 15μL마다 약 1μL의 0.02% Fast Green FCF 염료 용액을 첨가하여 용액을 파란색으로 채색합니다.
- 댐과 신생아 깔짚이있는 마우스 케이지 (출생 후 일 (P) 0.5-3)를 미세 주입 장비가있는 수술실로 옮깁니다. 모성 스트레스와 강아지의 거부를 최소화하기 위해 둥지와 침구가있는 같은 새장에 동물을 보관하십시오.
- 70 % 에탄올로 주사 부위를 살균하고 벤치 표면에 멸균 기저귀 패드를 놓습니다. 저체온증으로 인한 마취로부터의 회복을 위해 따뜻한 플랫폼 (예를 들어, 가열 패드)을 준비하십시오.
- 마이크로사이린지를 사용하여 AAV 희석액으로 마이크로피펫을 백필한다. 입체 현미경으로 마이크로 피펫 팁을 30G 바늘로 부수어 팁을 밀봉 해제하십시오.
참고: 그림 2A는 밀봉된 팁(상단)과 밀봉되지 않은(중간) 백필 팁을 모두 보여줍니다. - 얼음 위에 1-2 마리의 동물을 배치하여 저체온증에 의한 신생아 생쥐를 마취하십시오. 동물을 라텍스 장갑에 올려 놓고 얼음과 직접 접촉하지 않도록 피부를 보호하십시오. 동물이 발 꼬집음 (~ 2 분)에 반응하여 더 이상 움직이지 않으면 동물을 입체 현미경으로 놓습니다. 원하는 경우, 문신 잉크와 30G 바늘이있는 문신 발 패드를 사용하고 DNA 분리를위한 꼬리 클리핑을 수집하여 유전자형으로 동물을 식별합니다.
참고 : 마취 깊이의 적절한 모니터링은 절차 전반에 걸쳐 이루어져야합니다. - 70 % 에탄올로 눈 위에 놓인 피부를 면도합니다. 30G 바늘을 사용하여 융합된 눈꺼풀을 엽니다(그림 2B). 손가락으로 가벼운 압력을 가하여 눈을 뜨고 각막-공막 접합부에서 각막을 통해 작은 구멍을 뚫습니다(그림 2C).
- 유리 마이크로 피펫을 구멍에 넣고 마이크로 인젝터 풋 페달을 2-4 번 눌러 AAV를 유리체내 공간에 주입하십시오. 마이크로피펫을 천천히 제거하고, 동공을 통해 청색 염료를 시각화하여 AAV 주입을 확인하였다(도 2D).
참고: 토출 압력이 6-8psi이고 펄스 시간이 600-800ms인 경우 직경 600μm의 액적이 배출됩니다(그림 2A, 하단). 대략 0.23-0.45 μL의 AAV 용액이 눈 당 주입된다. 눈 밖의 파란 용액은 AAV가 눈에 주입되지 않았음을 나타낸다. 주입 부위로부터 누출된 청색 용액은 AAV가 유출되었을 수 있음을 나타내며, 트랜스펙션 효율을 감소시킨다. - 눈꺼풀을 부드럽게 눌러 다시 밀봉하고 강아지를 가열 된 패드에 놓습니다. 동물들이 분홍빛을 띤 색을 회복하고 반응하면 부드럽게 다시 하우징 케이지로 옮깁니다.
참고 : 강아지의 너무 빠른 재온난화를 피하기 위해 적절한 예방 조치를 취하십시오. - 깔짚에 남아있는 동물에 대해 주사 절차를 반복하십시오. 망막을 영상화하기 전에 바이러스 형질도입을 위해 최소 4-5일을 허용하십시오.
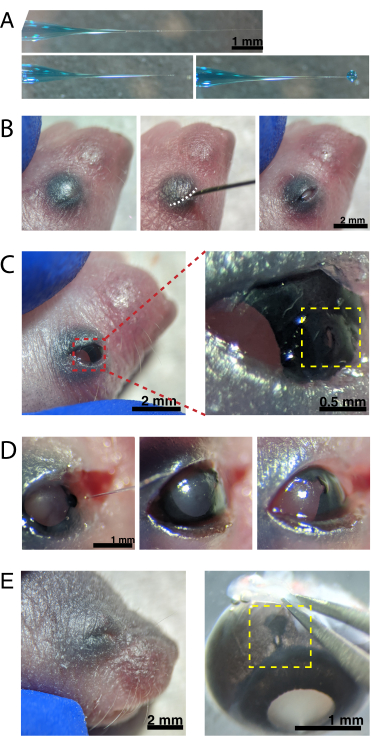
그림 2: 신생아 안구 내 주사 . (A) 백필 마이크로피펫은 밀봉되었을 때(상단) 피펫 팁과 팁이 밀봉되지 않은 후(하단, 왼쪽)의 모양을 보여줍니다. 6-8 psi의 피코 주입 압력 및 600-800 ms의 펄스 시간은 600 μm 직경의 액적(하단, 오른쪽)을 생성한다. 스케일 바 = 1mm.(B) 16x 배율로 마취된 P0 강아지. 융합된 눈꺼풀 접합부(흰색)는 날카로운 30G 바늘을 사용하여 슬릿 개방됩니다. 스케일 바 = 2 mm. (C) 눈에 가해지는 가벼운 압력이 각막을 노출시킨다; 스케일 바 = 2mm. 확대 섹션(적색)은 30 G 바늘로 생성된 각막-공막 접합부(노란색)에서의 작은 구멍을 나타내고; 스케일 바 = 0.5 mm. (D) 주입 후 피펫 팁의 철수 (왼쪽). AAV 용액 중의 빠른 녹색 염료는 주사 전의 밝은 동공 색과 비교하여 동공 (중간)을 통해 청색 회색으로 나타납니다 (오른쪽). 스케일 바 = 1 mm. (E) 4 일 후, 눈꺼풀이 치유되고 융합되어 닫혔습니다 (왼쪽); 스케일 바 = 2mm. enucleation시, 치유 된 주사 부위가 보입니다 (노란색); 스케일 바 = 1mm. 각막과 공막 사이의 경계에있는 주사 부위의 위치를 주목하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 영상화 실험을 위한 망막 박리
- 망막 aCSF (119 mM NaCl, 2.5 mM KCl, 1.3 mM MgCl2·6H2O, 2.5 mM CaCl2·2H2O, 1 mM NaH2PO4, 11 mM 글루코스, 및 20 mM 4-(2-히드록시에틸)-1-피페라진에탄술폰산 (HEPES 유리산)35를 준비한다. 원하는 경우 10x 용액을 준비하고 동결하십시오. 해동하고 필요에 따라 1x로 희석하십시오.
- 최소 15분 동안 카르보겐(95% O2, 5% CO2)으로 버블링하여 망막 aCSF를 산소화합니다. pH를 7.4로 조정한다. aCSF가 산소화된 상태로 유지되도록 사용할 때까지 밀봉된 용기에 보관하십시오.
참고: 망막은 고농도의 O2가 필요합니다. 실험 전반에 걸쳐 aCSF를 산소화시키는 것이 중요하다. - 직경 60mm 페트리 접시를 얼음 쟁반에 넣고(실험실 플라스틱, 예를 들어 피펫 상자 뚜껑과 같은 얼음 트레이를 만들어 내고) 입체 현미경 아래에 놓습니다. 페트리 접시에 산소가 공급된 망막 aCSF를 채우십시오.
- P9 이하의 마우스를 감금으로 안락사시킨다. P10 이상의 마우스를 이소플루란 유도, 또는 동물 프로토콜에 따라 승인된 대체 방법으로 안락사시키고, 이어서 감금시킨다.
- 눈꺼풀이 밀폐 된 경우 눈꺼풀 플랩을 잘라 눈을 노출시킵니다. 포셉을 사용하여 눈을 감싸고 3.3 단계에서 차가운 망막 aCSF로 옮깁니다.
- 망막 컵을 해부하기 위해 입체 현미경 (배율 25x)으로 Dumont # 5 포셉을 사용하여 시신경을 움켜 쥐어 눈을 안정시킵니다 (그림 3A).
- 30G 바늘로 각막 중앙에 구멍을 뚫은 다음 미세 가위의 한쪽 끝을 구멍에 삽입하여 구멍에서 각막 끝까지 절개하십시오. 반복하여 기본 방향으로 4개의 슬라이스를 만들고 4개의 "플랩"을 만듭니다(그림 3A).
- 두 개의 Dumont # 5 포셉으로 인접한 두 개의 플랩을 잡고 당겨 망막에서 공막을 부드럽게 벗겨냅니다. 나머지 각막 플랩을 반복하고 망막에서 공막을 제거합니다 (그림 3B).
- 포셉을 사용하여 망막 컵에서 렌즈를 제거하십시오. 미세가위를 사용하여 망막 가장자리에서 시신경쪽으로 4개의 방사상 절개를 만들어 4개의 동일한 꽃잎을 만듭니다(그림 3B). 두 번째 눈에 대해 3.4-3.7단계를 반복합니다.
4. 망막 플랫 마운트 준비
- 그레이 혼합 셀룰로오스 에스테르(MCE) 멤브레인 필터 디스크를 장착할 준비를 합니다. 직경이 큰 MCE 멤브레인 필터를 사용하는 경우 디스크를 사분면(가로 약 1cm)으로 자릅니다. MCE 디스크를 더 큰 흰색 필터 용지의 중앙에 놓습니다(그림 3D).
참고: MCE 필터는 직경 1cm 디스크로도 제공됩니다. MCE 필터 디스크는 1-2개의 망막에 맞을 만큼 충분히 커야 하지만 이미징 챔버에 들어갈 수 있을 만큼 충분히 작아야 합니다. MCE 멤브레인은 정적 전하를 유지하므로 MCE 멤브레인의 접촉 및 취급을 최소화합니다. - 두 개의 크기 3/0 페인트 브러시를 사용하여 망막을 다루고, 망막 신경절 세포 측면을 아래로 향하게하여 하나의 망막 컵을 페인트 브러시에 뒤집습니다. aCSF에서 망막을 부드럽게 들어올려 물의 장력이 망막을 찢지 않도록 합니다(그림 3C).
- 망막이 있는 페인트브러시를 계속 잡고 있는 상태에서 전사 피펫을 사용하여 MCE 필터 용지의 중앙에 aCSF 방울을 놓습니다(그림 3C, 오른쪽). 망막을 표면 장력에 의해 생성 된 aCSF의 물방울로 띄우십시오. 페인트 브러시를 사용하여 망막 RGC 측면을 물방울 안에 올려 놓고 네 개의 꽃잎을 펼칩니다.
- 일단 위치하면, 물방울의 표면 장력을 깨기 위해 페인트 브러시와 흰색 여과지 사이에 물 다리를 만듭니다.
참고: aCSF가 사악해지면 망막이 MCE 여과지에 부착됩니다(그림 3D,E). 플랫 장착형 망막은 집게로 MCE 디스크를 잡아서 처리할 수 있습니다. aCSF 액적이 워터 브릿지를 형성하기 전에 빠르게 윅 오프되는 경우, 이는 MCE 멤브레인이 충전되지 않았음을 나타낼 수 있다. 신선한 MCE 멤브레인을 사용하고, 망막을 이미징 챔버로 이동시키기 직전에 망막을 해부하고 평평하게 장착하여 응상과 이미징 사이의 시간을 최소화하십시오.

그림 3: 망막 박리 및 혼합 셀룰로오스에스테르 필터 멤브레인 상에 평평하게 장착. (A) 왼쪽, 두몬트 #5 포셉으로 시신경을 움켜쥐면 둘러싸인 눈이 안정화됩니다(왼쪽). 30G 바늘 (중앙)을 사용하여 각막의 중앙에 작은 구멍이 생깁니다. 마이크로 해부 가위는 각막을 4 개의 동일한 플랩으로 자르는 데 사용됩니다 (오른쪽). 스케일 바 = 1mm. (B) 두 개의 Dumont #5 포셉(왼쪽)을 사용하여 공막이 벗겨지고 렌즈를 제거한 상태로 망막을 해부했습니다(가운데). 망막에 4 개의 동일한 절단이있는 망막 (오른쪽). 스케일 바 = 1mm. (C) 두 개의 미세한 페인트 브러시로 망막 처리 (크기 3/0, 왼쪽). 망막은 망막 신경절 세포를 페인트 브러시 (중앙)로 옆으로 뒤집어 aCSF에서 들어 올려 물 긴장이 망막을 찢지 않도록했습니다 (오른쪽). 스케일 바 = 2mm. (D) 회색 MCE 멤브레인 디스크를 흰색 여과지 위에 놓습니다(왼쪽). MCE 디스크의 aCSF 방울(오른쪽). 스케일 바 = 1cm. (E) 망막을 액적 내로 부유시키고 위치시킨 후, aCSF를 윅하기 위해 흰색 여과지로 물 다리를 만들고, 대전된 MCE 종이 위로 망막을 당기는 단계(왼쪽); 스케일 바 = 1cm. MCE 막의 확대/축소된 이미지(적색)는 망막 신경절 세포가 측면 위쪽(오른쪽)으로 장착된 2개의 망막을 보여준다; 스케일 바 = 2mm. 하나의 망막은 흰색으로 윤곽선이 그려져 있습니다. 약어: MCE = 혼합 셀룰로스 에스테르; aCSF = 인공 뇌척수액. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 살아있는 전체 마운트 망막 제제의 타임랩스 공초점 영상
- 도 4에서 볼 수 있는 바와 같이 직립 공초점 현미경을 위한 라이브 이미징 인큐베이션 챔버를 조립한다.
주: 거꾸로 된 공초점 시스템의 경우, 플랫 마운트는 RGC 측면을 인큐베이션 챔버의 유리 바닥 커버슬립에 직접 배치합니다. 망막이 커버 슬립과 접촉하면 움직일 수 없습니다. - 챔버를 산소화 된 aCSF로 채우고 펌프 및 온도 컨트롤러 (온도 32-34 °C, 유량 1 mL / 분)를 켭니다. 온도가 34°C 이상으로 상승하지 않도록 하십시오.
- 망막 플랫 마운트를 관류 챔버로 옮기려면 펌프를 정지시키고 챔버 내에 있는 aCSF를 제거합니다. 망막 플랫 마운트가 있는 MCE 디스크를 (비어있는) 인큐베이션 챔버 내로 놓으십시오.
- 샘플 중량을 플랫 마운트 상에 놓는 단계; 표면 장력을 깨기 위해 무게를 미리 적시십시오. 따뜻하게 된 aCSF로 챔버를 채우고 ~ 1 mL / min에서 aCSF를 순환시킵니다.
- 25x 물 담그기 목표물(숫자 조리개 0.95)이 있는 노즈피스를 이미징 챔버에 놓습니다. 에피형광광을 사용하여 관심있는 표지된 세포를 스크린한다(도 4C).
- 이미징 볼륨을 조정하여 관심 있는 수지상 특징을 캡처합니다.
참고: 이 연구는 프레임당 1024 x 1024 픽셀, z-스텝 1 μm 및 각 z-스택 사이의 프레임 속도 2분으로 전체 수지상 아버를 캡처했습니다. 최종 이미지 크기는 ~100μm x 100μm x 20μm입니다. - 레이저 파워를 최적의 설정으로 조정하려면 과포화 픽셀과 과포화 픽셀을 모두 식별하는 룩업 테이블을 사용하십시오. 스캔하는 동안 픽셀이 과포화되지 않도록 레이저 파워를 조정하십시오 (즉, 255 이상의 강도에서). 필요한 한, 또는 형광 신호의 현저하고 검출 가능한 감소가 있고 잡음이 증가할 때까지(전형적으로 2-4 h) 이미징을 계속한다.
참고: 픽셀이 전체 동적 범위에 분산될 때 디컨볼루션 알고리즘이 최적으로 작동하므로 레이저 전력 감소를 권장합니다. 픽셀 강도는 254를 초과해서는 안됩니다. 신경돌기의 경험적 분석은 170 미만의 픽셀 값이 디컨볼루션에 이상적이라는 것을 밝혀냈다. 라인 평균화(2-3)를 갖는 빠른 스캔 속도(400-600Hz)는 동일한 총 픽셀 체류 시간의 느린 단일 스캔보다 바람직하다. 장기간의 이미징 영역은 종종 광표백제이지만 다른 explant 섹션은 실행 가능한 상태로 남아 있습니다. 플랫 마운트의 여러 영역을 각각 2-4시간 동안 이미지화할 수 있으며, 총 인큐베이션 시간은 6시간입니다. 6 시간 이상의 이미징 세션은 체계적으로 테스트되지 않았습니다. 신경돌기 분해와 출혈은 외래 생존력이 감소하고 있다는 신호입니다. - 이미징 후, 망막 플랫 마운트 및 멤브레인 필터를 차가운 4% 파라포름알데히드로 4°C에서 1-2시간 동안 고정시킨다. 추가 분석을 위해 면역조직화학에 의해 고정된 망막의 형광 표지를 증폭시킨다.
참고: 반전된 공초점 사용 시에는 이미징 후 고정이 불가능합니다. 망막은 조직을 파괴하지 않고 제거 할 수 없습니다.
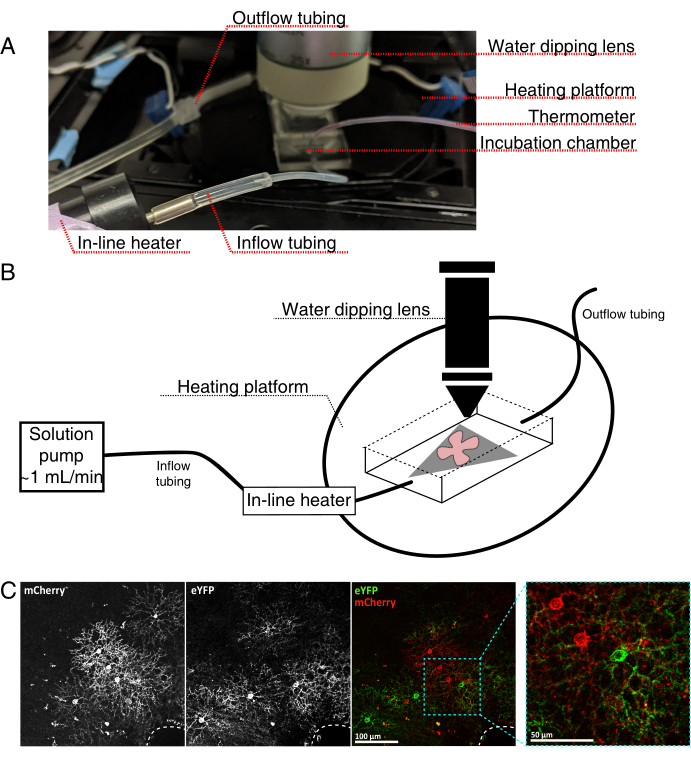
그림 4: 라이브 셀 이미징 인큐베이션 챔버 설정. (A) 가열, 용액 및 이미징 성분을 보여주는 라이브 이미징 인큐베이션 장치. 이중 히터에는 가열 된 인큐베이션 챔버 플랫폼 (파란색 커넥터 전극이있는 백 서클) 및 인라인 솔루션 히터가 포함됩니다. (B) 4A의 개략도. MCE 멤브레인 상의 망막 플랫-마운트(적색)(회색)는 인큐베이션 챔버 내에 배치된다. 인라인 솔루션 히터는 솔루션 펌프에 연결됩니다 (4A에 그림이 없음). 이미징 챔버 치수는 담그기 목표 코에 대한 좋은 작업 영역을 허용합니다. (c) AAV 희석액의 1012 GC/mL의 4 × 0.23-0.45 μL를 주사한 망막 외식편을 25x 뷰; 스케일 바 = 100 μm. 세포의 조밀 한 표지는 종종 시신경 머리 (파선, 오른쪽 하단)를 둘러 쌉니다. 스케일 바 = 50 μm. 약어: MCE = 혼합 셀룰로스 에스테르; GC = 게놈 카피; mCherry = 단량체 체리; eYFP = 강화된 황색 형광 단백질. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. ImageJ의 이미지 디컨볼루션 및 후처리
- 이미지 시리즈를 가져오고, 시리즈를 시간별로 분할하고, 다중 색상 이미지인 경우 색상을 지정합니다. 한 색상에 대한 모든 시점이 동일한 폴더에 포함되어 있는지 확인합니다.
참고: ImageJ를 사용하는 경우 바이오 포맷을 가져옵니다(바이오 포맷은 FIJI에 자동으로 포함됨). - ImageJ 플러그인인 회절 PSF 3D를 사용하여 이론적인 PSF(포인트 확산 함수)를 생성합니다.
참고: 형광 단백질 방출 파장이 PSF에 영향을 미치기 때문에 각 이미징 채널에는 자체 PSF가 필요합니다. - 플러그인 사용 | 매크로 | 제공된 매크로(보충 파일 1)를 사용하여 모든 시간대에 대해 배치 병렬 반복 디컨볼루션을 수행하도록 실행합니다.
참고: 이 매크로는 Wiener 필터 사전 조건화된 Landweber(WPL) 반복 알고리즘의 25회 반복을 실행합니다. 각 색상 채널은 별도로 디컨볼루브해야 합니다. - 색상 채널을 병합하고 모든 시점을 하이퍼스택으로 컴파일합니다(이미지 | 하이퍼스택 | 하이퍼스택에 스택). 플러그인 |를 사용하여 3D 드리프트를 수정하십시오 . 등록 | 3D 드리프트를 수정합니다.
- 이미지를 일반 스택으로 반환합니다 (이미지 | 하이퍼스택 | 하이퍼스택을 스택으로 전환하고 시점을 분할합니다(이미지 | 스택 | 도구 | 스택 분배기). 배치 처리를 사용하여 모든 시점에 대한 최대 투영 생성(프로세스 | 배치 | 매크로 | run("Z 프로젝트...", "투영=[최대 강도]");
- 타임랩스 이미지 시퀀스 가져오기(파일 | 가져오기 | 이미지 시퀀스). 기존 ImageJ 도구를 사용하여 디컨볼브 및 후처리 2차원(2D) 비디오를 원하는 방식으로 분석할 수 있습니다.
참고: 4차원(3D + 시간) 디컨볼브 및 드리프트 보정 비디오는 하이퍼스택으로 볼 수 있습니다. 3D 시점을 유지하기 위해 이전 단계를 생략합니다.
결과
위의 프로토콜을 사용하여 스타버스트 셀 수상 돌기를 개발하는 고해상도 3D 비디오를 획득, 디컨볼브 및 3D 드리프트에 맞게 수정했습니다. Z-평면 최대 프로젝션은 분석을 위한 2D 비디오를 만들기 위해 제작되었다(보충 비디오 1, 도 5A). 각 시점의 3D 디컨볼루션은 미세한 필로포디아 투영의 분해능을 증가시켰다(그림 5B,C). 미세한 필로포디아 돌출부는 망막 덴드라이트36을 개발하는 특징이며 이미징 중에 볼 수 있어야 합니다. AAV 형질감염은 세포 표지 밀도 및 형광 강도에서 가변성을 생성할 것이다. 따라서 표지 된 조직을 선별하여 형광 신호가 높은 세포를 선택하여 이미징하고 고품질 비디오를 제작하십시오. 희미하게 라벨이 붙은 세포를 감지하기 위해 레이저 파워를 증가시키는 것은 빠른 광표백을 유도하고 신호에 비해 높은 잡음을 유발할 수 있으므로 권장하지 않습니다. 충분히 밝은 세포는 5dpi 내에서 볼 수 있습니다. 12 dpi 이상으로, 연장된 AAV 감염 기간이 반드시 표지된 세포의 형광 증가를 유도하지는 않는다(도 5D).
조밀 한 세포 표지로 인한 과도한 형광 및 신경돌기 밀집은 이미지 품질에 영향을 미치고 단일 세포 재구성을 방해 할 수 있습니다. AAV 희석 및 부피의 최적화는 나머지 표적 세포 집단으로부터 분리가능한 단리되고 형광 표지된 arbors의 원하는 정도를 달성하기 위해 요구된다. 여기서, 9.2 × 108-1.8 × 109개의 바이러스 GC를 표적 스타버스트 아마크린 세포에 안구당 주사하였다(0.23-0.45 μL의 AAV와 4× 1012 GC/mL 역가). 형광 신호의 부재는 비효율적인 주입 기술을 반영할 수 있다. 주입하는 동안, 주사 부위로부터 청색 AAV 용액의 누출은 바이러스가 망막으로 전달되지 않거나 주사 부피 또는 압력이 너무 높다는 것을 나타낸다. 과도한 주사 부피 또는 압력은 망막 박리 및/또는 안압의 손실을 야기하여 망막 세포를 손상시키고 세포 표지 효율을 감소시킬 수 있습니다. 두 문제 모두 주입 기술의 연습과 최적화로 해결할 수 있습니다. 신호 결여에 대한 다른 잠재적인 이유는 Cre 이식유전자가 AAV 형질감염 기간 동안 활성화되지 않기 때문에 부적절한 저장 또는 불충분한 Cre 발현으로부터 AAVs의 분해를 포함한다.
비디오가 디컨볼루브되면 분기 추가, 철회 또는 안정화 비율 계산과 같은 동적 분석을 수행할 수 있습니다. 추가적으로, 종래의 정적 분석은 뉴런 재구성 및 총 분지 길이, 분지 각도, 분기 순서 또는 말단 분기점의 수와 같은 형태학적 정량화를 포함하는 각각의 시간대에 수행될 수 있다. 이 프로토콜의 결과는 고해상도 3D 이미지 스택의 시계열입니다. 대부분의 3D 뉴라이트 다이내믹 비디오는 ImageJ37과 같은 오픈 소스 이미지 시각화 소프트웨어를 사용하여 최대 프로젝션으로 수동으로 정량화됩니다. 또 다른 오픈 소스 도구 인 Vaa3D38은 대량의 시각화를 위해 특별히 개발되었습니다. 비디오를 3D로 분석하려면 Vaa3D와 같은 3D + 시간 시각화 도구를 사용하는 것이 좋습니다. ImageJ 및 Vaa3D는 이미지의 픽셀 또는 복셀에 직접 액세스 할 수 있지만 픽셀 데이터를 골격화 된 트리 재구성으로 변환하여 뉴런 재구성을 생성하는 경우가 많습니다. 단일 시점에 대한 자동 또는 반자동 뉴런 재구성은 오픈 소스39,40,41 및 독점 소프트웨어로 수행 할 수 있습니다. 타임랩스 재구성을 분석하려면 재구성의 각 지점을 이전 및 후속 시점과 연결해야 합니다. 500개 이상의 데이터 포인트로 인코딩할 수 있는 복잡한 수지상 형태를 시간이 지남에 따라 정렬하는 것은 여전히 어려운 문제로 남아 있습니다. 다양한 강점과 한계를 가진 많은 도구를 사용할 수 있으며 연구에 필요한 분석에 맞게 선택해야합니다.
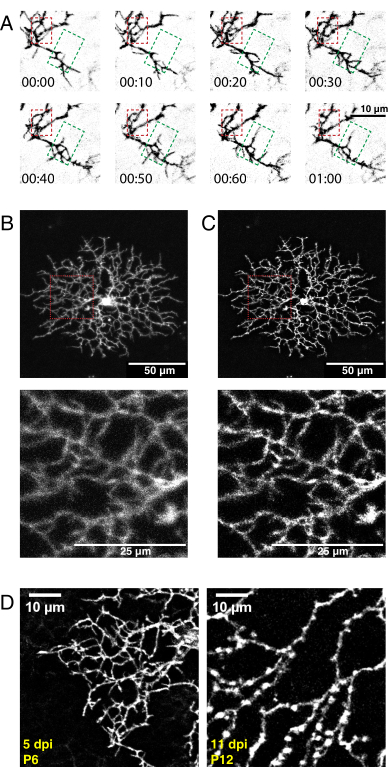
도 5: 신생아 안구 내 주사, 타임랩스 영상화 및 디컨볼루션 후의 대표적인 결과. (A) AAV 주사 후 5일 후 P6 스타버스트 아마크린 세포의 디컨볼브 타임랩스 이미징 시리즈(h:min)의 최대 투사. 미세한 필로포디아 역학은 이제 기존의 ImageJ 도구를 사용하여 분석할 수 있습니다. 수지상 정제 영역 (빨간색 상자)과 수지상 유출 영역 (녹색 상자)이 강조 표시됩니다. (B, C) AAV 주입 후 5일 후에 막 태그된 eYFP로 표지된 단일 P6 스타버스트 아마크린 세포(dpi)는 밝은 단일 세포 표지를 나타낸다. 상부 패널용 스케일 바 = 50 μm; 하부 패널의 스케일 바 = 25 μm. (A) 이전과 (B) 이후 (B) ImageJ와의 디컨볼루션. 인셋(빨간색)은 성공적인 디컨볼루션의 결과로 디블러링을 표시합니다. (d) P6 스타버스트 아마크린 세포 5dpi(왼쪽)는 P12 스타버스트 세포와 비교하여 11 dpi와 유사한 수준의 형광 단백질 발현을 나타낸다. AAV 인큐베이션 시간을 증가시키더라도 형광 신호는 증가하지 않는다. 형광 신호는 AAV 감염 기간이 길어질수록 감소하지 않는다. 동일한 획득 및 후처리 파라미터가 두 이미지 모두에 적용되었다. P12에서 관찰된 증가 된 가지 두께와 다양성은 성숙 된 스타 버스트 세포의 정상적인 특징이며 라벨링 또는 이미징 아티팩트가 아닙니다. 스케일 바 = 10 μm. 약어: AAV = 아데노-관련 바이러스; eYFP = 강화된 황색 형광 단백질; dpi = 감염 후 일수. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
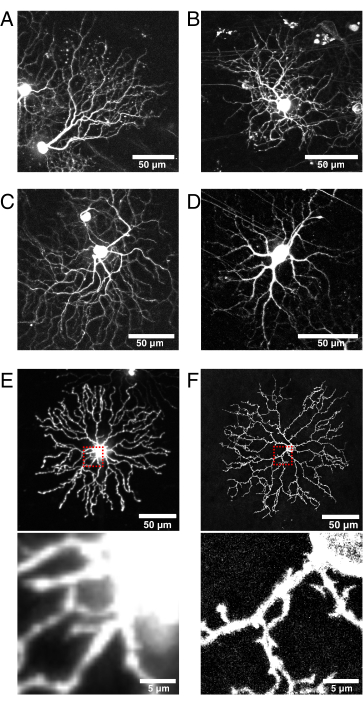
그림 6: Cre 선 선택 및 형광 단백질 국소화에 대한 고려 사항.
(A-D) 살아있는 P11 망막 신경절 세포는 Vglut2-iRES-Cre 녹인 마우스에 주입된 BBV의 9dpi에서 이미지화되었으며, 여기서 Cre는 RGC 집단에서 선택적으로 발현된다. (A) 잼-B RGC는 그것의 특징적인 비대칭 형태학에 의해 확인된다24. (B-D) 그들의 수상 돌기 층화 패턴이 다른 뚜렷한 RGC 아류형. (e) 세포질 mCherry로 생물학적으로 형질감염된 살아있는 P11 스타버스트 아마크린 세포의 이미지, 512 x 512 픽셀에서 회전하는 디스크 공초점으로 캡처. 세포질 XFP는 미세 수지상 돌출부에 비해 소마에서 높은 형광 신호를 유도한다. 소마의 초점이 맞지 않는 빛은 작은 근위 돌출부를 이미징 할 때 높은 배경 형광을 일으 킵니다 (위의 빨간색 상자에 삽입은 아래에 나와 있음). (F) 막 표적화된 eYFP로 형질감염된 살아있는 P11 스타버스트 아마크린 세포의 이미지이며 1024 x 1024 픽셀에서 공초점 레이저 스캐닝에 의해 캡처된다. 소마 주위의 형광막 고리, 개선된 신호-대-잡음비, 및 막 표적화된 형광 단백질에 의해 생성되는 소마에 근접한 미세 돌기의 품질(inset)에 주목한다. 스케일 바 = 50 μm 및 E 및 F = 5 μm의 하부 패널. 약어: IRES = 내부 리보솜 진입 사이트; BBV = 브레인보우 아데노-관련 바이러스; Vglut2 = 수포성 글루타메이트 수송체 2; XFP = 임의의 형광 단백질; eYFP = 강화된 황색 형광 단백질; mCherry = 단량체 체리; RGC = 망막 신경절 세포; JAM-B = 접합 접착 분자 B. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 비디오 1 : P6의 타임 랩스 비디오 스타 버스트 amacrine 덴드라이트를 개발, 주사 후 5 일. 비디오 시간 단계는 2 분입니다. Deconvolution 및 3D 드리프트 보정은 ImageJ를 사용하여 적용되었습니다. 위쪽 노란색 상자는 파생의 영역을 강조 표시하고, 아래쪽 상자는 일시적인 필로포디아 파생, 자기 접촉 및 철회 영역을 윤곽을 그립니다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: 배치 병렬 반복 디컨볼루션을 위한 ImageJ 매크로입니다. 매크로는 Wiener 필터 사전 조건화된 Landweber(WPL) 반복 알고리즘의 25회 반복을 실행합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 비디오는 기존의 유전 도구를 사용하여 공초점 라이브 이미징으로 망막 뉴런을 개발하는 수상 돌기 역학을 이미지화하는 실험 파이프 라인을 보여줍니다. 또한 신생아 마우스에 막 표적화된 형광 단백질을 코딩하는 Cre 의존성 AAVs의 안구 내 주사가 입증되었다. 유전적으로 표적화된 집단의 단일 세포는 4-5 dpi만큼 일찍 밝게 표지된다. 망막 플랫-마운트는 라이브 셀 공초점 이미징을 수행하기 위해 표준 이미징 챔버를 위해 준비되었다. 이 방법은 단일 셀과 미세한 투영에 대한 고해상도 타임랩스 비디오를 생성합니다. 작은 프로젝션은 ImageJ, Vaa3D 및 ShuTu를 포함한 오픈 소스 소프트웨어와 Imaris 및 MBF Bioscience에서 제공하는 라이센스 소프트웨어를 통해 제공되는 디컨볼루션 및 후처리 알고리즘을 사용하여 해결되고 정량화됩니다. 이 파이프라인은 모듈식이므로 각 프로토콜 섹션은 연구 목적에 맞게 변경할 수 있습니다. 이들 모듈화 요소는 아래에서 논의되며, 1) Cre-line 선택, 2) 형광 단백질 및 바이러스 구축물의 선택, 3) 유전자 전달 방법, 및 4) 이미징 방법을 포함한다.
이 기술은 망막 세포 하위집단에 대한 유전적 접근을 위해 Cre 트랜스제닉 라인을 사용한다. Cre는 산후 활성이어야 하며 바이러스 감염 및 세포 표지의 가능성을 높이기 위해 주사 시 세포 집단에 걸쳐 발현되어야 합니다. 이 보고서에서, ChAT-Cre는 스타버스트 아마크린 세포를 표적으로 삼는 데 사용되었고, Vglut2-Cre 라인은 RGCs42,43 개발을 표적으로 하는 데 사용되었다(도 6). Vglut2-IRES-Cre 넉-인 마우스로의 Cre 의존성 AAV 주사는 접합 부착 분자 B 세포 (도 6A) 및 이중층화된 RGC (도 6B, C)를 포함하는 다양한 RGCs를 표지하였다. 대안적으로, 세포 유형 특이적 발현을 유도하는 합성 프로모터를 갖는 AAVs의 새로운 설계는 Cre 트랜스제닉 라인44에 대한 필요성을 제거할 수 있다. 라이브 이미징에 적합한 효율적이고 밝은 라벨링에 대한 또 다른 고려 사항은 형질감염 및 발현에 필요한 최소 시간이며, 이는 AAV 혈청형, 트로피즘 및 titer45에 따라 달라질 수 있습니다. 이들 연구에서, AAV 매개된 라벨링은 XFP 발현을 위해 최소 4-5 dpi를 요구하므로, 이 방법은 산후 초기 시점들에 접근하기에 적합하지 않다. 초기 시점들(예를 들어, P0-P4)을 포획하기 위해, 안구 내 주사는 utero electroporation46에서 행해진 바와 같이, 배아 동물에서 utero에서 수행될 수 있다. 스타버스트 덴드라이트 개발에 대한 이 그룹의 연구에서, ChAT-Cre의 초기 희소 재조합 패턴은 마우스 트랜스제닉 Cre 리포터인 Rosa-mTmG27을 사용하여 P0-P4에서 단일 스타버스트 아마크린 세포를 표지하기 위해 이용되었다. 마지막으로, 이러한 AAV 망막 주사 프로토콜은 스타버스트 세포 형태학에 해로운 영향 없이 주사 3개월 후 형광 표지의 지속성의 확인에 기초하여, 성체 세포 집단을 표지하는데 사용될 수 있다34.
이 파이프 라인은 또한 바이러스 구조체 선택의 유연성을 허용합니다. 덴드라이트 역학을 포획하기 위해, 특정 세포외 구조에 국소화하는 단백질, 관심있는 단백질, 또는 액틴 역학 (예를 들어, LifeAct) 및 칼슘 신호 (예를 들어, GCaMP)와 같은 기능적 변화를 보고하는 단백질을 포함하는 다양한 형광 리포터 단백질이 사용될 수 있다. 상업적으로 입수가능하거나 클로닝된 AAV 벡터를 사용할 수 있으며, fpbase.org 와 같은 온라인 도구는 밝기 및 광안정성을 위해 참조되어야 한다. 여기서, H-Ras 파네실화 CAAX 모티프를 갖는 형광 단백질을 코딩하는 Brainbow 바이러스 벡터를 막 국소화에 사용하였다. 프로토콜 개발 초기에 XPF의 세포질 국소화는 소마로부터의 신호의 과포화와 미세 가지의 불량한 라벨링과 함께 미세 신경돌기 형태를 연구하는 데 이상적이지 않은 것으로 나타났습니다 (그림 6E). 비교하여, 막 표적화된 형광 단백질은 미세 수지상 돌출부를 표지하고 분해하는 것으로 나타났다(도 6E, F). 또 다른 고려사항은 발현 시간에 영향을 미칠 수 있는 바이러스 구축물의 크기, 설계 및 복잡성이다. 예를 들어, AAV-CAG-FLEx-mClover3-CAAX가 생성되었고, 이는 Cre 의존적 방식으로 하나의 XFP를 발현한다. 이 구문은 디자인이 더 간단하며 4dpi로 효율적으로 표현됩니다. 함께, Cre 라인, AAV 설계 및 저장소(예: JAX, Addgene 및 바이러스 벡터 코어)로부터 널리 이용가능한 형광 단백질 리포터에 대한 다양한 옵션들은 망막의 세포 유형 및 발달 현상에 대한 다양한 연구에 적응할 수 있게 한다.
비록 이 프로토콜이 안구 내 AAV 주사를 상세히 기술하고 있지만, 플라스미드 전기천공46 및 생체목록 유전자 전달(예를 들어, 진건)7과 같은 다른 유전자 전달 방법이 이용가능하다. 전기천공은 전기 펄스를 인가해야 하며, 생체 목록 유전자 전달은 망막 외식편의 생체외 배양을 필요로 한다. AAV 라벨링은 이러한 두 방법 모두보다 덜 침습적이며 이미징 직전에 망막 외식편의 급성 제제를 허용합니다. 생체 목록 유전자 전달 (그림 6E, F)과 비교하여 AAV 주사는 신경 돌기 역학을 추적하는 데 필요한 지속적인 획득에 더 적합한 향상된 조직 생존력을 가져 왔습니다. 적절한 기술을 사용하면 AAV 라벨링은 해부시 조직의 건강에 의해 판단 된 바와 같이 망막에 거의 또는 전혀 손상되지 않습니다. 유리체내 주사는 주로 RGCs 및 아마크린 세포와 같은 신경절 세포층과 내부 핵층 내의 세포를 감염시킨다. 수십 개의 스타버스트 아마크린 세포가 일반적으로 표지되어 있으며, 시신경 머리 주위에 라벨이 붙은 세포의 밀도가 증가합니다(그림 4C). 그러나, 세 가지 형질감염 방법 모두에서, 시신경 절단은 망막 외식편을 얻기 위해 불가피하며 RGC 변성으로 이어질 것이다. 시신경 절단에도 불구하고, 연구는 36 시간 및 최대 6 일 동안 다양한 척추 동물 모델에서 실행 가능한 망막 외식편을보고합니다.5,6,7,47,48.
마지막으로, 수상 돌기 역학을 포착하기위한 공초점 현미경의 유용성이 입증되었습니다. 전형적으로, 이미징 세션은 2-4 h에 걸쳐 있으며, 조직 분해 또는 뉴라이트 블링이 관찰되기 전에 종료된다. 최대 6 시간의 이미징 세션이 수행되었습니다. 그러나 상한은 체계적으로 테스트되지 않았습니다. 영역은 장기간의 이미징으로 인해 광표백을 겪을 수 있지만 explant의 다른 시야각에있는 세포는 라이브 이미징을 위해 실행 가능한 상태로 남아 있습니다. 이 방법은 또한 다중 광자 또는 라이트 시트 현미경으로 확장되어 더 깊은 층과 더 큰 부피의 신경 세포 형태를 이미지 할 수 있습니다. 다중 광자 이미징은 마우스 망막에서 신경돌기 역학을 연구하기 위해 수행되었으며 더 깊은 망막 라미나 (예 : 수평 또는 광수용체 세포)49에서 세포를 연구하는 데 더 적합합니다. 최근에, 살아있는 세포 라이트시트 현미경 검사는 망막 혈관신생50을 포획하기 위해 사용되었고, 전체 망막에서 형태형성의 살아있는 이미징을 위한 새로운 방법을 제공하였다. 라이브 셀 라이트시트 현미경 검사는 축삭-수상 돌기 표적화와 같은 더 큰 규모의 신경 회로 어셈블리를 연구하는 데 사용될 수 있습니다. 다색 라이브 이미징은 수상 돌기 발달에 대한 이웃 세포의 영향 또는 RGC 아형1, 미세 아교세포 및 성상 세포를 포함한 망막 세포의 타일링과 같은 기타 발달 현상과 같은 세포 - 세포 상호 작용을 조사하는 데 사용할 수있는이 파이프 라인의 또 다른 응용 프로그램입니다.
결론적으로, 발달 연구의 도전적인 측면은 이러한 중요한 시점에서 접근 할 수 있습니다. 이 프로토콜은 특정 시간 창 동안 발생하는 형태 형성을 시각화하는 방법을 제공합니다. 이 파이프라인은 기존의 도구와 기술을 결합하여 유전적으로 세포 집단을 표적으로 삼고 막 표적화된 형광 단백질을 발현합니다. 급성 망막 플랫 마운트 제제는 몇 시간에 걸쳐 살아있는 세포 공초점 이미징을 위해 생존력과 형광 신호를 유지합니다. 수상 돌기 개발의 일시적이고 역동적 인 측면은 3D 비디오로 캡처되며 오픈 소스 소프트웨어를 사용하여 사후 처리됩니다. 고해상도 3D 비디오를 캡처하는 기능은 동적 개발 프로세스를 조사하는 데 필수적입니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
매디슨 그레이가 내가 아무 것도 가지고 있지 않았을 때 나에게 손을 줘서 고맙다. 이 연구는 NSERC 디스커버리 그랜트 (RGPIN-2016-06128), 신경 과학의 슬론 펠로우십 및 캐나다 연구 위원장 Tier 2 (J.L.L.L)의 지원을 받았습니다. S. Ing-Esteves는 Vision Science Research Program과 NSERC Postgraduate Scholarships-Doctoral의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Addgene viral prep #45185-AAV9 | |||
| Addgene viral prep #45186-AAV9 | |||
| Dissection tools | |||
| Cellulose filter paper | Whatman | 1001-070 | |
| Dumont #5 fine forceps | FST | 11252-20 | Two Dumont #5 forceps are required for retinal micro-dissection |
| Dumont forceps | VWR | 82027-426 | |
| Fine Scissors | FST | 14058-09 | |
| Mixed cellulose ester membrane (MCE) filter papers, hydrophilic, 0.45 µm pore size | Millipore | HABG01 300 | |
| Petri Dish, 50 × 15 mm | VWR | 470313-352 | |
| Polyethylene disposable transfer pipette | VWR | 470225-034 | |
| Round tip paint brush, size 3/0 | Conventional art supply store | Two size 3/0 paint brushes (or smaller) are required for retinal flat-mounting | |
| Surgical Scissors | FST | 14007-14 | |
| Vannas Spring Scissors - 2.5 mm Cutting Edge | FST | 15000-08 | |
| Live-imaging incubation system | |||
| Chamber polyethylene tubing, PE-160 10' | Warner Instruments | 64-0755 | |
| Dual channel heater controller, Model TC-344C | Warner Instruments | 64-2401 | |
| HC FLUOTAR L 25x/0.95 W VISIR dipping objective | Leica | 15506374 | |
| Heater controller cable | Warner Instruments | CC-28 | |
| Large bath incubation chamber with slice support | Warner Instruments | RC-27L | |
| MPII Mini-Peristaltic Pump | Harvard Apparatus | 70-2027 | |
| PM-6D Magnetic Heated Platform (incubation chamber heater) | Warner Instruments | PM-6D | |
| Pump Head Tubing Pieces For MPII Mini-Peristaltic Pump | Harvard Apparatus | 55-4148 | |
| Sample anchor (Harps) | Warner Instruments | 64-0260 | Sample anchor must be compatible with incubation chamber |
| Sloflo In-line Solution Heater | Warner Instruments | SF-28 | |
| Neonatal Injections | |||
| 10 µL Microliter Syringe Series 700, Removable Needle | Hamilton Company | 80314 | |
| 30 G Hypodermic Needles (0.5 inch) | BD PrecisionGlide | 305106 | |
| 4 inch thinwall glass capillary, no filament (1.0 mm outer diameter/0.75 mm) | WPI World Precision Instruments | TW100-4 | |
| Ethanol 99.8% (to dilute to 70% with double-distilled water [ddH2O]) | Sigma-Aldrich | V001229 | |
| AAV9.hEF1a.lox.TagBFP. lox.eYFP.lox.WPRE.hGH-InvBYF | Penn Vector Core | AV-9-PV2453 | Addgene Plasmid #45185 |
| AAV9.hEF1a.lox.mCherry.lox.mTFP 1.lox.WPRE.hGH-InvCheTF | Penn Vector Core | AV-9-PV2454 | Addgene Plasmid #45186 |
| ChAT-IRES-Cre knock-in transgenic mouse line | The Jackson Laboratory | 6410 | |
| Fast Green FCF Dye content ≥85 % | Sigma-Aldrich | F7252-25G | |
| Flaming/Brown Micropipette Puller, model P-97 | Sutter Instrument Co. | P-97 | |
| Green tattoo paste | Ketchum MFG Co | 329A | |
| Phosphate-Buffered Saline, pH 7.4, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | 806552 | |
| Pneumatic PicoPump | WPI World Precision Instruments | PV-820 | |
| Oxygenated artifiial cerebrospinal fluid (aCSF) Reagents | |||
| Calcium chloride dihydrate (CaCl2·2H2O) | Sigma-Aldrich | C7902 | |
| Carbogen (5% CO2, 95% O2) | AirGas | X02OX95C2003102 | Supplier may vary depending on region |
| D-(+)-Glucose | Sigma-Aldrich | G7021 | |
| HEPES, Free Acid | Bio Basic | HB0264 | |
| Hydrochloric acid solution, 1 N | Sigma-Aldrich | H9892 | |
| Magnesium chloride hexahydrate (MgCl2·6H2O) | Sigma-Aldrich | M2670 | |
| pH-Test strips (6.0-7.7) | VWR | BDH35317.604 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| Sodium chloride (NaCl) | Bio Basic | DB0483 | |
| Sodium phosphate monobasic (NaH2PO4) | Sigma-Aldrich | RDD007 | |
| Software | |||
| ImageJ | National Institutes of Health (NIH) | Open source |
참고문헌
- Lefebvre, J. L., Sanes, J. R., Kay, J. N. Development of dendritic form and function. Annual Review of Cell and Developmental Biology. 31, 741-777 (2015).
- Graham, H. K., Duan, X. Molecular mechanisms regulating synaptic specificity and retinal circuit formation. Wiley Interdisciplinary Reviews Developmental biology. 10 (1), 379(2021).
- Godinho, L., et al. Targeting of amacrine cell neurites to appropriate synaptic laminae in the developing zebrafish retina. Development. 132 (22), 5069-5079 (2005).
- Mumm, J. S., et al. In vivo imaging reveals dendritic targeting of laminated afferents by zebrafish retinal ganglion cells. Neuron. 52 (4), 609-621 (2006).
- Wong, W. T., Faulkner-Jones, B. E., Sanes, J. R., Wong, R. O. Rapid dendritic remodeling in the developing retina: dependence on neurotransmission and reciprocal regulation by Rac and Rho. The Journal of Neuroscience. 20 (13), 5024-5036 (2000).
- Wei, W., Elstrott, J., Feller, M. B. Two-photon targeted recording of GFP-expressing neurons for light responses and live-cell imaging in the mouse retina. Nature Protocols. 5 (7), 1347-1352 (2010).
- Morgan, J. L., Wong, R. O. L. Ballistic labeling with fluorescent dyes and indicators. Current Protocols in Neuroscience. 43 (1), 1-10 (2008).
- Nickerson, P. E. B., et al. Live imaging and analysis of postnatal mouse retinal development. BMC Developmental Biology. 13, 24(2013).
- Morgan, J. L., Dhingra, A., Vardi, N., Wong, R. O. L. Axons and dendrites originate from neuroepithelial-like processes of retinal bipolar cells. Nature Neuroscience. 9 (1), 85-92 (2006).
- Coombs, J. L., Van Der List, D., Chalupa, L. M. Morphological properties of mouse retinal ganglion cells during postnatal development. The Journal of Comparative Neurology. 503 (6), 803-814 (2007).
- Cranfill, P. J., et al. Quantitative assessment of fluorescent proteins. Nature Methods. 13 (7), 557-562 (2016).
- Stacy, R. C., Wong, R. O. L. Developmental relationship between cholinergic amacrine cell processes and ganglion cell dendrites of the mouse retina. The Journal of Comparative Neurology. 456 (2), 154-166 (2003).
- Kay, J. N., et al. Retinal ganglion cells with distinct directional preferences differ in molecular identity, structure, and central projections. The Journal of Neuroscience. 31 (21), 7753-7762 (2011).
- Liu, J., Sanes, J. R. Cellular and molecular analysis of dendritic morphogenesis in a retinal cell type that senses color contrast and ventral motion. The Journal of Neuroscience. 37 (50), 12247-12262 (2017).
- Diao, L., Sun, W., Deng, Q., He, S. Development of the mouse retina: emerging morphological diversity of the ganglion cells. Journal of Neurobiology. 61 (2), 236-249 (2004).
- Coombs, J., vander List, D., Wang, G. Y., Chalupa, L. M. Morphological properties of mouse retinal ganglion cells. Neuroscience. 140 (1), 123-136 (2006).
- Sanes, J. R., Masland, R. H. The types of retinal ganglion cells: current status and implications for neuronal classification. Annual Review of Neuroscience. 38, 221-246 (2015).
- Sümbül, U., et al. A genetic and computational approach to structurally classify neuronal types. Nature Communications. 5, 3512(2014).
- Lin, B., Masland, R. H. Populations of wide-field amacrine cells in the mouse retina. The Journal of Comparative Neurology. 499 (5), 797-809 (2006).
- Macneil, M. A., Heussy, J. K., Dacheux, R. F., Raviola, E., Masland, R. H. The shapes and numbers of amacrine cells: Matching of photofilled with Golgi-stained cells in the rabbit retina and comparison with other mammalian species. Journal of Comparative Neurology. 413 (2), 305-326 (1999).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Jo, A., Xu, J., Deniz, S., Cherian, S., DeVries, S. H., Zhu, Y. Intersectional strategies for targeting amacrine and ganglion cell types in the mouse retina. Frontiers in Neural Circuits. 12, 66(2018).
- Siegert, S., et al. Genetic address book for retinal cell types. Nature Neuroscience. 12 (9), 1197-1204 (2009).
- Kim, I. -J., Zhang, Y., Meister, M., Sanes, J. R. Laminar restriction of retinal ganglion cell dendrites and axons: subtype-specific developmental patterns revealed with transgenic markers. The Journal of Neuroscience. 30 (4), 1452-1462 (2010).
- Peng, Y. -R., Tran, N. M., Krishnaswamy, A., Kostadinov, D., Martersteck, E. M., Sanes, J. R. Satb1 regulates contactin 5 to pattern dendrites of a mammalian retinal ganglion cell. Neuron. 95 (4), 869-883 (2017).
- Duan, X., Krishnaswamy, A., Dela Huerta, I., Sanes, J. R. Type II cadherins guide assembly of a direction-selective retinal circuit. Cell. 158 (4), 793-807 (2014).
- Ray, T. A., et al. Formation of retinal direction-selective circuitry initiated by starburst amacrine cell homotypic contact. eLife. 7, 34241(2018).
- Krishnaswamy, A., Yamagata, M., Duan, X., Hong, Y. K., Sanes, J. R. Sidekick 2 directs formation of a retinal circuit that detects differential motion. Nature. 524 (7566), 466-470 (2015).
- Caval-Holme, F., Zhang, Y., Feller, M. B. Gap junction coupling shapes the encoding of light in the developing retina. Current Biology. 29 (23), 4024-4035 (2019).
- Lucas, J. A., Schmidt, T. M. Cellular properties of intrinsically photosensitive retinal ganglion cells during postnatal development. Neural Development. 14 (1), 8(2019).
- Cai, D., Cohen, K. B., Luo, T., Lichtman, J. W., Sanes, J. R. Improved tools for the Brainbow toolbox. Nature Methods. 10 (6), 540-547 (2013).
- Rossi, J., et al. Melanocortin-4 receptors expressed by cholinergic neurons regulate energy balance and glucose homeostasis. Cell Metabolism. 13 (2), 195-204 (2011).
- Lefebvre, J. L., Kostadinov, D., Chen, W. V., Maniatis, T., Sanes, J. R. Protocadherins mediate dendritic self-avoidance in the mammalian nervous system. Nature. 488 (7412), 517-521 (2012).
- Ing-Esteves, S., et al. Combinatorial effects of alpha- and gamma-protocadherins on neuronal survival and dendritic self-avoidance. The Journal of Neuroscience. 38 (11), 2713-2729 (2018).
- Williams, P. R., Morgan, J. L., Kerschensteiner, D., Wong, R. O. L. In vitro imaging of retinal whole mounts. Cold Spring Harbor Protocols. 2013 (1), (2013).
- Ramoa, A. S., Campbell, G., Shatz, C. J. Transient morphological features of identified ganglion cells in living fetal and neonatal retina. Science. 237 (4814), 522-525 (1987).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nature Biotechnology. 28 (4), 348-353 (2010).
- Cuntz, H., Forstner, F., Borst, A., Häusser, M. One rule to grow them all: a general theory of neuronal branching and its practical application. PLoS Computational Biology. 6 (8), 1000877(2010).
- Xiao, H., Peng, H. APP2: automatic tracing of 3D neuron morphology based on hierarchical pruning of a gray-weighted image distance-tree. Bioinformatics. 29 (11), 1448-1454 (2013).
- Nanda, S., et al. Design and implementation of multi-signal and time-varying neural reconstructions. Scientific data. 5, 170207(2018).
- Sherry, D. M., Wang, M. M., Bates, J., Frishman, L. J. Expression of vesicular glutamate transporter 1 in the mouse retina reveals temporal ordering in development of rod vs. cone and ON vs. OFF circuits. The Journal of Comparative Neurology. 465 (4), 480-498 (2003).
- Johnson, J., et al. Vesicular neurotransmitter transporter expression in developing postnatal rodent retina: GABA and glycine precede glutamate. The Journal of Neuroscience. 23 (2), 518-529 (2003).
- Jüttner, J., et al. Targeting neuronal and glial cell types with synthetic promoter AAVs in mice, non-human primates and humans. Nature Neuroscience. 22 (8), 1345-1356 (2019).
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Molecular Therapy. 16 (6), 1073-1080 (2008).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. Journal of Visualized Experiments: JoVE. (31), e1333(2009).
- Lye, M. H., Jakobs, T. C., Masland, R. H., Koizumi, A. Organotypic culture of adult rabbit retina. Journal of Visualized Experiments: JoVE. (3), e190(2007).
- Pignatelli, V., Strettoi, E. Bipolar cells of the mouse retina: a gene gun, morphological study. The Journal of Comparative Neurology. 476 (3), 254-266 (2004).
- Huckfeldt, R. M., et al. Transient neurites of retinal horizontal cells exhibit columnar tiling via homotypic interactions. Nature Neuroscience. 12 (1), 35-43 (2009).
- Prahst, C., et al. Mouse retinal cell behaviour in space and time using light sheet fluorescence microscopy. eLife. 9, 49779(2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유