Method Article
遺伝子標的網膜細胞集団のスパースアデノ随伴ウイルス標識を用いた神経樹木化のタイムラプスイメージング
要約
ここでは、出生後のマウス網膜外植体における神経突起形態形成をタイムラプス共焦点顕微鏡により調べる方法を提示する。我々は、膜標的蛍光タンパク質を Cre依存的に発現する組換えアデノ随伴ウイルスベクターを用いた網膜細胞型の疎標識および取得およびそれらの微細プロセスのためのアプローチを説明する。
要約
樹状樹木をパターン化するメカニズムを発見するには、開発中に樹状突起を視覚化、画像化、解析する方法が必要です。マウス網膜は、ニューロンの形態形成および接続性の細胞型特異的メカニズムの調査のための強力なモデルシステムである。網膜サブタイプの組織と構成は明確に定義されており、遺伝的ツールは開発中に特定のタイプにアクセスするために利用可能です。多くの網膜細胞タイプはまた、樹状突起および/または軸索を狭い層に拘束し、タイムラプスイメージングを容易にする。マウス網膜外植体培養は、共焦点顕微鏡または多光子顕微鏡を用いた生細胞イメージングには適しているが、樹状突起ダイナミクスを時間的および構造的分解能でイメージングするために最適化された方法は欠けている。ここで提示されるのは、Cre-Loxシステムによってマークされた特定の網膜集団の発達をまばらに標識し、画像化する方法です。ここで用いた市販のアデノ随伴ウイルス(AAV)は、膜標的蛍光タンパク質をCre依存的に発現させた。新生児マウスにおけるAAVの眼内送達は、注射後4〜5日(dpi)までに標的細胞型の蛍光標識を生じる。膜蛍光シグナルは共焦点イメージングによって検出可能であり、微細な分岐構造およびダイナミクスを分解する。2~4時間にわたる高品質のビデオは、酸素化人工脳脊髄液(aCSF)を灌流した画像網膜フラットマウントから取得されます。また、デコンボリューションと3次元(3D)ドリフト補正のための画像後処理パイプラインも提供されます。このプロトコルは、無傷の網膜におけるいくつかの細胞挙動を捕捉し、神経突起形態形成を制御する新規因子を同定するために使用することができる。網膜で学んだ多くの発達戦略は、中枢神経系の他の場所にある神経回路の形成を理解するのに適切であろう。
概要
網膜ニューロンの樹状突起は、神経回路内での機能に影響を与える複雑でありながら特異的なパターンを形成する。脊椎動物の網膜では、多様なタイプの網膜神経節細胞(RGC)とアマクリン細胞介在ニューロンが、樹木の大きさ、位置、枝長、密度が異なる独自の樹状突起形態を持っています1。出生後の発達中、RGCとアマクリン細胞は、熱狂的な樹状突起を内側プレキシフォーム層(IPL)と呼ばれるニューロピルに拡張し、そこでバイポーラ細胞入力を受け取り、光受容体シグナルを伝達します2。ヒナまたはゼブラフィッシュの幼虫における蛍光標識網膜集団のタイムラプス画像化によってキャプチャされるように、樹状突起形態形成は非常に動的である3,4,5。数日のうちに、樹状樹木はIPLの狭いサブレイヤーに拡大、改造、および影響し、そこで選択されたパートナーとシナプスします。樹木は、枝の追加、後退、および安定化の相対的な速度の変化を伴う、発達にわたって異なる構造ダイナミクスを示す。アマクリンおよびRGC樹状突起はまた、タイプ特異的樹木化を反映する可能性のある異なる外生およびリモデリング挙動を示す。しかし、これらの研究は、広範なアマクリンまたはRGC集団を追跡し、形態学の1つの側面にすぎない層状標的化に焦点を当てた。
網膜サブタイプ全体で観察された広大な形態学的多様性を生み出すメカニズムは、ほとんど理解されていない。このグループの目的は、マウスにおける定義された網膜サブタイプの樹状突起ダイナミクスおよび樹木リモデリングを捕捉する方法を開発することであった。樹状突起パターニングの細胞型特異的メカニズムを同定するには、目的の細胞の樹状突起挙動を視覚化および測定する方法が必要である。マウス網膜の有機型培養は、共焦点顕微鏡または多光子顕微鏡を用いた生細胞イメージング研究によく適している。発達中の網膜は解剖され、平坦な外植体に装着され、記録チャンバーで数時間画像化することも、回路への影響が限定的な状態で数日間にわたって培養することもできます6,7。生きた網膜ニューロンは、電極による色素充填、エレクトロポレーション、親油性色素でコーティングされた粒子のバイオリスト送達、蛍光タンパク質をコードするプラスミド(例えば、Gene Gun)、ならびに遺伝的にコードされた細胞標識7、8、9、10を含む様々な技術によって標識することができる7、8、9、10.しかし、これらのアプローチは、特定の網膜サブタイプの樹状突起ダイナミクスを画像化するのに非効率的である。例えば、色素充填法はスループットが低く、目的の細胞を確実に標的とするために電気生理学装置と追加の遺伝子標識が必要です。さらに、ソーマの強い蛍光シグナルは、近くの樹状突起を不明瞭にする可能性があります。
バイオリスティック遺伝子送達法は、数十個の細胞を同時に標識することができるが、高圧粒子送達および単離された網膜の一晩インキュベーションを含むステップは、細胞生理機能および樹状突起伸長を損なう可能性がある。本稿では、以下の実験基準により、初期の樹状突起ダイナミクスを細胞型と構造分解能で捉えるために、最近の遺伝的ツールを利用できることを提案している。まず、発達中の樹木園を支配する微細な枝および糸状体を解くために、この方法は、樹木全体のプロセスを満たす明るく蛍光タンパク質でニューロンを標識すべきである。蛍光標識は、イメージング期間中のフォトブリーチングのために退色してはならない。様々な蛍光タンパク質変異体が生成され、輝度と光安定性に基づいて、in vivo/ex vivoイメージング11への適合性について比較されています。第二に、蛍光タンパク質(XFP)は、狭い発生窓が見逃されないように、樹状突起形態形成の初期段階によって十分に高いレベルで発現されなければならない。マウス網膜の静的な時点の分析では、樹状突起の発生は出生後最初の週に起こり、外生、リモデリング、および安定化の段階を含む10,12,13,14,15。第3に、この方法は、選択的標識、または関心のあるニューロン亜集団の標識化の確率の増加につながるはずである。第四に、標的亜集団の標識は、ニューロンアーバー全体を同定および追跡できるように、十分に疎でなければならない。RGCおよびアマクリンサブタイプは、成熟した形態学的特徴およびIPL層別化パターン16,17,18,19,20によって区別することができるが、課題は未成熟構造に基づいて開発中にサブタイプを同定することである。この作業は、発生中に特定の網膜細胞型を標識するためのトランスジェニックツールの拡大によって促進される。
蛍光タンパク質またはCreの細胞的および時間的発現が遺伝子調節要素によって決定されるトランスジェニックおよびノックインマウス系統は、網膜細胞型を研究するために広く使用されている13,21,22,23。樹状突起発生のサブタイプ特異的パターンに関する主要な観察は、静的な時点におけるトランスジェニックマウス網膜の研究から来ている10,14,24,25。特にCre-Loxシステムは、さまざまなリコンビナーゼ依存性レポーター、センサー、および光遺伝学的アクチベーターを使用して、サブタイプの絶妙な遺伝子操作およびモニタリングを可能にします。これらのツールは、網膜回路アセンブリの根底にあるサブタイプ特異的分子プログラムと機能特性の発見をもたらしました26,27,28,29,30。しかし、マウス網膜におけるサブタイプ特異的樹状突起ダイナミクスの研究にはまだ活用されていない。低密度標識は、Creマウス系統とエレクトロポレーションまたは組換えAAVによって導入された導入遺伝子を組み合わせることによって達成することができる。利用可能な場合、タモキシフェン誘導性クレラインまたは交差遺伝子戦略も使用することができる。最後に、細胞は低侵襲の方法で標識され、組織を損なわないように、または樹状突起形態形成に必要な細胞機能を妨げないように、取得パラメータを使用して画像化されるべきである。
ここでは、生きたマウス網膜外植体における樹状突起ダイナミクスを調べるために、トランスジェニックツールおよび共焦点顕微鏡法を適用する方法を提示する。Creトランスジェニックマウス系統は、Cre組換え時に蛍光タンパク質を発現するAAVベクターと組み合わされており、これにより、目的の網膜細胞のまばらな標識が可能になる。市販のAAVは硝子体内注射によって新生児網膜に送達される。この論文は、AAVが4dpiで有意に高い細胞型特異的蛍光発現を産生し、出生後の時点へのアクセスを可能にすることを実証する。このアプローチを説明するために、コリン作動性「スターバースト」アマクリンインターニューロンを、出生後早期網膜で活性であるコリンアセチルトランスフェラーゼ(ChAT)-内部リボソーム侵入部位(IRES)-Cre導入遺伝子を発現する新生児マウスにおいてBrainbow AAVを送達することによって標識した31,32。スターバーストアマクリン細胞は、クラスター化されたプロトカドヘリンによって媒介される樹状突起自己回避によって形作られたステレオタイプ化された放射状のアーバー形態を発達させる33,34。本論文は、Brainbow AAVs31に用いられているように、ファルネシル化を受けるCAAXモチーフを添加することにより、原形質膜にXFPsによってスターバースト樹状突起と糸状体形成の分解能が有意に向上することを示している。最後に、デンドライト再構成および形態測定定量化に適した高品質の画像を生成するタイムラプスイメージングおよび後処理プロトコルが決定された。このプロトコルは、樹状突起の形態形成を制御する因子を同定し、無傷の網膜におけるいくつかの細胞挙動を捕捉するために使用することができる。
プロトコル
注:このプロトコルは2日間にわたり、実験日間のウイルス形質導入の最小期間は4〜5日間です(図1A)。動物実験は、病気の子供のための病院(トロント、カナダ)の動物サービス実験所動物の使用およびケア委員会によって承認されたプロトコルに基づいて、研究および実験動物ケアにおける動物の使用に関するカナダ動物ケアガイドライン評議会に従って行われます。
1. 新生児AAV注射およびイメージング実験のための準備
- Creマウスラインを選択して、目的の網膜細胞集団にラベルを付けます。AAV注射時のCreリコンビナーゼ発現は、Creトランスジェニックレポーターとの交配またはCre抗体による免疫染色によって確認する。
- トランスジェニックCreマウス(8〜16週齢)を繁殖させ、Cre陽性新生児動物を作製した。
注:このデモンストレーションでは、ChAT-IRES-Creノックインマウスを使用して、コリン作動性スターバーストアマクリン細胞を標的とした。 - 蛍光タンパク質をコードするリコンビナーゼ依存性AAVウイルスを取得する。微細プロセスの最適な標識のために、原形質膜を標的とする修飾XFPを発現するベクターを選択する。
注:この研究では、多色ラベリングのオプションを提供するBrainbowウイルス(BBV)、AAV-EF1a-BbTagBY、AAV9-EF1a-BbChT(材料表を参照)を使用しました(図1B)。ファルネシル化増強黄色蛍光タンパク質(eYFP)および単量体チェリー(mCherry)発現は、ライブイメージングにおいて最も強い蛍光シグナルを産生した。単一のBBVを使用して個々の樹木を画像化し、BBVの共注入を使用して、より多くの細胞または隣接する樹木を別個の蛍光色素で標識することができます。複数の蛍光タンパク質を使用する場合は、発光スペクトルの重複を最小限に抑えてください(図1C)。顕微鏡集録パラメータを調整して、個別のXFP信号をキャプチャする必要があります。 - 凍結/融解サイクルを避けるために、使い捨てストック用の個々の低結合チューブに約3〜5μLのAAVアリコートを調製します。-80°Cで保存してください。
- マイクロピペットプーラーを使用して、非常に細かい先端を持つホウケイ酸ガラスマイクロピペットを準備します。
メモ: プーラーの設定は、使用するフィラメントとプーラーによって異なります。最終的な先端のサイズと形状については、 図2A を参照してください。典型的な液滴直径は600μmである。 - マイクロインジェクションシステムおよび関連するチューブを入手します。マイクロインジェクタを加圧エアポートに接続します。

図1:実験の概要 。(A)このプロトコルは、実験期間が2日間に及び、実験日の間に最低4~5日間の感染期間を設けています。眼内注射は、出生後3日目より齢でない新生児マウスに対して行われる。その後、網膜を解剖し、フラットマウントし、ライブイメージングして、所望の発達窓をキャプチャします。標識された細胞は、樹状突起形態に対する長期AAV発現の明らかな影響がないため、ウイルス発現に必要な4〜5日後いつでも画像化することができる。(b)Cre依存性Brainbow AAVベクター(BBV)を、Cre31を発現する動物に注射する。この研究では、ChAT-Creノックインマウスを用いて、スターバーストアマクリン細胞におけるCre組換えを駆動した。2つのBBVは、修飾されたeYFPまたはtagBFP、またはmCherryおよびmTFPをコードし、膜局在化のために順次ファルネシル化された CAAX モチーフで終了する。ロックスのサイトは三角形で描かれています。ベクターは、Cre組換えに依存する確率的および組み合わせ的様式でいずれかのファルネシル化XFPを発現する。 EF1α プロモーターには、伸長因子1α遺伝子由来の調節エレメントが含まれる。Wはウッドチャック肝炎ウイルス転写後調節エレメント由来のエレメントを示し、pAはポリアデニル化配列を示す。(c)mCherryおよびeYFPの励起スペクトルおよび発光スペクトルを、本研究で画像化したBBV蛍光団。複数の蛍光タンパク質をライブイメージングする場合、発光スペクトルを別々のチャネルに適切に分離するように検出パラメータを配置する必要があります。略語: AAV = アデノ随伴ウイルス;BBV = Brainbow AAV;ChAT = コリンアセチルトランスフェラーゼ;iRES = 内部リボソーム侵入部位;eYFP = 増強黄色蛍光タンパク質;iTR = 反転端子リピート;tagBP = タグブルー蛍光タンパク質;mCherry = 単量体チェリー;mTFP = 青緑色蛍光タンパク質;XFP = 任意の蛍光タンパク質;EF1α= 伸び係数 1 アルファ。 この図の拡大版を表示するには、ここをクリックしてください。
2. 新生児マウスにおけるAAVの硝子体内注射
- 氷の上でAAVアリコートを解凍する。滅菌生理食塩水またはリン酸緩衝生理食塩水を使用して〜1:4のAAV希釈液を調製する。マイクロピペットが壊れ、新しいピペットを充填する必要がある場合に備えて、動物あたり約0.5 μL(1眼あたり約0.25 μL)のAAV希釈液を準備します。残りの希釈されていないAAVを4°Cで保存し、2週間以内に使用する。
注:この実験では、供給者AAV濃度は、1013ゲノム含量(GC)/mL×〜1 〜2であり、4×1012GC /mLの最終濃度に希釈した。ウイルス濃度を最適化して、所望の標識密度を得る。 - 注射を視覚化するには、AAV 希釈液 15 μL ごとに約 1 μL の 0.02% ファストグリーン FCF 色素溶液を加え、溶液を青色に着色します。
- ダムと新生児のごみ(出生後(P)0.5-3)を入れたマウスケージをマイクロインジェクション装置を備えた処置室に移す。母親のストレスと子犬の拒絶を最小限に抑えるために、巣と寝具で動物を同じケージに入れてください。
- 注射領域を70%エタノールで滅菌し、ベンチ表面に滅菌おむつパッドを置きます。低体温誘発麻酔からの回復のための暖かいプラットフォーム(例えば、加熱パッド)を準備する。
- マイクロシリンジを用いてAAV希釈液でマイクロピペットをバックフィルする。実体顕微鏡下で、マイクロピペットチップを30G針で破り、チップのシールを解除します。
メモ: 図2A は、密封されたチップ(上部)と非シール(中央)の両方のバックフィルチップを示しています。 - 氷の上に1〜2匹の動物を置くことによって低体温症によって新生児マウスを麻酔する。ラテックス手袋の上に動物を置き、氷との直接接触から皮膚を保護します。足のピンチに反応して動物が動かなくなったら(約2分)、動物を実体顕微鏡の下に置きます。必要に応じて、タトゥーインクと30G針でタトゥー足パッドを入れ、DNA分離のために尾の切り抜きを収集し、ジェノタイピングによって動物を識別します。
注:麻酔の深さの適切なモニタリングは、手順全体を通して行われなければなりません。 - 目の上に覆っている皮膚を70%エタノールで拭きます。30G針を使用して、融合したまぶたを開きます(図2B)。指で軽く圧力をかけて目を開き、角膜と強膜の接合部の角膜に小さな穴を開けます(図2C)。
- ガラス製マイクロピペットを穴に挿入し、マイクロインジェクターフットペダルを2~4回押して、AAVを硝子体内空間に注入します。マイクロピペットをゆっくりと取り出し、瞳孔を通る青色色素を可視化することによってAAV注入を確認した(図2D)。
メモ:噴出圧力が6~8psi、パルス時間が600~800msの場合、直径600μmの液滴が吐出されます(図2A、下段)。1眼あたり約0.23〜0.45μLのAAV溶液を注射する。眼の外側の青色の溶液は、AAVが眼内に注入されなかったことを示す。注射部位から漏れ出した青色の溶液は、AAVが漏れ出し、トランスフェクション効率が低下している可能性があることを示しています。 - まぶたを優しく押して再密封し、子犬を加熱したパッドの上に置きます。動物がピンクがかった色を回復し、反応したら、それらを静かに収容ケージに戻します。
注:子犬の再温が急速すぎるのを避けるために、適切な予防措置が取られていることを確認してください。 - ごみの中の残りの動物に対して注射手順を繰り返します。網膜をイメージングする前に、ウイルスの形質導入に最低4〜5日かかります。
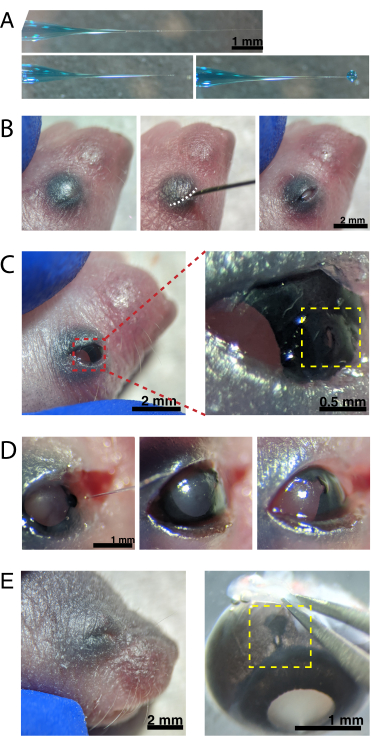
(A)バックフィルドマイクロピペットは、密封時(上)および先端が密封解除された後(下、左)のピペットチップの形状を示す。6-8psiのピコ注入圧力と600-800msのパルス時間は、直径600μmの液滴を生成する(下、右)。スケールバー = 1 mm.(B) 16倍の倍率で麻酔したP0子犬。融合したまぶたの接合部(白色)は、鋭い30G針を使用してスリットオープンされています。スケールバー = 2 mm. (C) 眼に加えられた軽い圧力は角膜を露出させる。スケール バー = 2 mm。ズームされたセクション(赤)は、30G針で作成された角膜 - 強膜接合部(黄色)の小さな穴を示しています。スケールバー = 0.5 mm. (D) 注射後のピペットチップの離脱(左)。AAV溶液中の高速緑色染料は、注射前の明るい瞳孔色(右)と比較して、瞳孔(中央)を通って青灰色として現れる。スケールバー= 1mm(E)4日後、まぶたが治癒し、融合して閉じた(左)。スケール バー = 2 mm。除核すると、治癒した注射部位が見える(黄色)。スケール バー = 1 mm。角膜と強膜の境界における注射部位の位置に注意してください。この図の拡大版を表示するには、ここをクリックしてください。
3. イメージング実験のための網膜解剖
- 網膜aCSF(119 mM NaCl、2.5 mM KCl、1.3 mM MgCl2·6H2O、2.5 mM CaCl2·2H2O、1 mM NaH2PO4、11 mM グルコース、および20 mM 4-(2-ヒドロキシエチル)-1-ピペラジンエタンスルホン酸(HEPES遊離酸)35を調製する。必要に応じて、10倍の溶液を準備して凍結する。解凍し、必要に応じて1xに希釈します。
- 網膜aCSFをカルボゲン(95%O2、5%CO2)で最低15分間バブリングして酸素化します。pHを7.4に調整します。使用時まで密閉容器に保管し、aCSFが酸素化されたままであることを確認する。
注:網膜は高濃度のO2を必要とします。実験全体を通してaCSFを酸素化しておくことが重要です。 - 直径60mmのペトリ皿をアイストレイに埋め込み(実験用プラスチック、例えばピペットボックスの蓋からアイストレイを作ります)、実体顕微鏡の下に置きます。ペトリ皿に酸素化網膜aCSFを充填する。
- マウスP9以下を断頭により安楽死させる。イソフルラン誘導によってマウスP10およびそれより古いマウスを安楽死させ、または動物プロトコールの下で承認された代替方法、続いて断頭する。
- まぶたが密閉されている場合は、まぶたのフラップを切って目を露出させます。鉗子を使用して眼を摘出し、ステップ3.3から冷たい網膜aCSFに移します。
- 網膜カップを解剖するには、実体顕微鏡(倍率25倍)下で、デュモン#5鉗子を用いて視神経を挟持して眼を安定させた(図3A)。
- 角膜中央に30G針で穴をあけ、マイクロハサミの先端を穴に差し込み、穴から角膜の端まで切開します。この手順を繰り返して、基本方向に 4 つのスライスを作成し、4 つの「フラップ」を作成します (図 3A)。
- デュモン #5 鉗子を 2 つ使用して、隣接する 2 つのフラップをつかんで引き離し、強膜を網膜からそっと剥がします。残りの角膜フラップで繰り返し、強膜を網膜から取り除きます(図3B)。
- 鉗子を使用して網膜カップからレンズを取り外します。マイクロハサミでは、網膜の端から視神経に向かって4つの橈骨切開を行い、4つの等しい花弁を作成します(図3B)。第2の目に対して手順3.4~3.7を繰り返します。
4. 網膜フラットマウント製剤
- 取り付け用の灰色の混合セルロースエステル(MCE)メンブレンフィルターディスクを準備します。大口径MCEメンブレンフィルターを使用する場合は、円盤を四分円(直径約1cm)に切断します。MCEディスクを大きな白いろ紙の中央に置きます(図3D)。
メモ: MCE フィルターは、直径 1 cm のディスクでも入手可能です。MCEフィルターディスクは、1〜2個の網膜に収まるほどの大きさでなければならないが、イメージングチャンバに収まるほど小さくなければならない。MCE膜は静電荷を保持するため、MCE膜の接触と取り扱いを最小限に抑えます。 - 2つのサイズ3/0ペイントブラシを使用して網膜を処理し、網膜神経節細胞側を下にして1つの網膜カップをペイントブラシに反転させます。網膜をaCSFから静かに持ち上げ、水張力が網膜を引き裂かないようにします(図3C)。
- 網膜でペイントブラシを保持したまま、トランスファーピペットを使用して、MCEろ紙の中央にaCSFの液滴を置きます(図3C、右)。表面張力によって生成されたaCSFの液滴に網膜を浮かべる。ペイントブラシを使用して、網膜RGC側を液滴内で上向きに配置し、4つの花びらを広げます。
- 配置したら、ペイントブラシと白いろ紙の間に水橋を作り、液滴の表面張力を壊します。
注:aCSFが吸い込まれると、網膜はMCEろ紙に付着します(図3D、E)。フラットマウント網膜は、MCEディスクを鉗子でつかむことで処理できます。aCSF液滴が水架橋を形成する前に素早く吸い取られる場合、これはMCE膜が荷電していないことを示している可能性がある。新鮮なMCE膜を使用し、網膜をイメージングチャンバに移動する直前に網膜を解剖して平らに装着することにより、摘出からイメージングまでの時間を最小限に抑えます。

図3:網膜解剖と混合セルロースエステルフィルター膜への平らな取り付け(A)左、デュモン#5鉗子で視神経をつかむことによって除核された眼が安定する(左)。角膜の中央に30Gの針(中央)を使って小さな穴を開けます。微小解剖ハサミは、角膜を4つの等しいフラップに切断するために使用されます(右)。スケールバー = 1 mm. (B) デュモン#5鉗子2本で強膜を剥がし(左)、レンズを取り外した状態で網膜を解剖(中央)。網膜の途中で4つの等しい切り込みを持つ網膜(右)。スケールバー = 1 mm. (C) 2 本の細いペイントブラシによる網膜の取り扱い (サイズ 3/0、左)。網膜神経節細胞を斜めにして絵筆(中央)にひっくり返し、aCSFから持ち上げて、水の張力が網膜を引き裂かないようにしました(右)。スケールバー=2mm(D)白色のろ紙上に置かれた灰色のMCEメンブレンディスク(左)。MCE ディスク上の aCSF の液滴 (右)。スケールバー = 1 cm. (E) 網膜を液滴に浮かべて位置決めした後、白いろ紙でウォーターブリッジを作成してaCSFを吸い取り、網膜を荷電したMCE紙の上に引っ張ります(左)。スケールバー = 1 cm。MCE膜のズーム画像(赤色)は、網膜神経節細胞を側面上にして取り付けられた2つの網膜を示す(右)。スケール バー = 2 mm。1つの網膜は白で輪郭を描いています。略語:MCE=混合セルロースエステル;aCSF = 人工脳脊髄液。この図の拡大版を表示するには、ここをクリックしてください。
5. 生きた全マウント網膜製剤のタイムラプス共焦点イメージング
- 図4に示すように、直立共焦点顕微鏡用のライブイメージングインキュベーションチャンバーを組み立てます。
メモ:反転共焦点システムの場合、フラットマウントはRGC側を下にしてインキュベーションチャンバのガラス底カバースリップに直接配置されます。網膜がカバースリップと接触すると、それらは動くことができません。 - チャンバーを酸素化aCSFで満たし、ポンプと温度コントローラ(温度32-34°C、流量1mL/min)をオンにします。温度が34°C以上に上昇しないようにしてください。
- 網膜フラットマウントを灌流チャンバに移すには、ポンプを停止し、チャンバ内にあるaCSFを取り外します。網膜フラットマウントを備えたMCEディスクを(空の)インキュベーションチャンバに入れます。
- サンプルウェイトをフラットマウントに置きます。表面張力を壊すために重量を予め濡らしてください。チャンバーに加温したaCSFを補充し、約1mL/minでaCSFを循環させる。
- 25倍の水浸漬対物レンズ(開口数0.95)でノーズピースをイメージングチャンバに入れます。エピ蛍光光を用いて目的の標識細胞をスクリーニングする(図4C)。
- イメージングボリュームを調整して、目的の樹状突起をキャプチャします。
注:この研究は、1フレームあたり1024 x 1024ピクセル、zステップ1μm、および各zスタック間のフレームレート2分で完全な樹状樹木をキャプチャしました。最終的な画像サイズは、約100 μm x 100 μm x 20 μmです。 - レーザー出力を最適な設定に調整するには、過飽和ピクセルと過飽和ピクセルの両方を識別するルックアップテーブルを使用します。スキャン中は、ピクセルが過飽和にならないように(つまり、255以上の強度で)レーザー出力を調整します。必要な限り、または蛍光シグナルの有意かつ検出可能な減少およびノイズの増加があるまで(典型的には2〜4時間)画像化を継続する。
注:ピクセルがフルダイナミックレンジに分布している場合、デコンボリューションアルゴリズムが最適に機能するため、レーザー出力を下げることをお勧めします。ピクセル強度は 254 を超えてはなりません。神経突起の実証分析により、170未満のピクセル値がデコンボリューションに理想的であることが明らかになった。ライン平均化(2-3)を伴う高速スキャン速度(400~600Hz)は、同じ合計ピクセル・ドウェル時間の単一で低速なスキャンよりも好ましい。長時間のイメージングの領域はしばしば光漂白剤であるが、他の外植部切片は生存可能なままである。フラットマウント内の複数の領域を、それぞれ2〜4時間、合計インキュベーション時間で6時間で画像化することができます。6時間を超えるイメージングセッションは体系的にテストされていません。神経突起の劣化およびブレビングは、外植生存率が低下している徴候である。 - イメージング後、網膜フラットマウントとメンブレンフィルターを冷たい4%パラホルムアルデヒドで4°Cで1〜2時間固定します。 さらなる分析のために免疫組織化学によって固定網膜中の蛍光標識を増幅する。
メモ: 反転コンフォカルを使用する場合、画像後の固定は不可能です。網膜は、組織を破壊することなく除去することはできません。
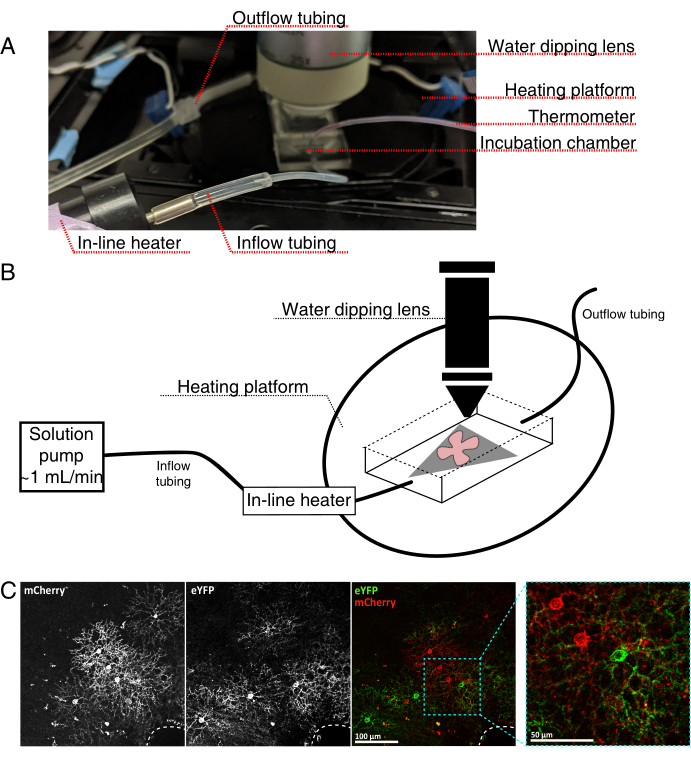
図4:生細胞イメージングインキュベーションチャンバーのセットアップ。(A)加熱、溶液、およびイメージングコンポーネントを示すライブイメージングインキュベーション装置。デュアルヒーターには、加熱されたインキュベーションチャンバープラットフォーム(青色のコネクタ電極を備えた背面円)とインラインソリューションヒーターが含まれています。(b)4Aの模式図。MCE膜上の網膜フラットマウント(赤色)(灰色)をインキュベーションチャンバに配置する。インライン溶液ヒーターは、溶液ポンプ(4Aに描かれていない)に接続されています。イメージングチャンバの寸法は、浸漬対物鼻のための良好な作業領域を可能にする。(c)0.23-0.45 μLの4 × 1012 GC/mLのAAV希釈液を注射した網膜外植体の25x図;スケールバー = 100 μm。細胞の緻密な標識は、しばしば視神経頭を囲む(破線、右下)。スケールバー = 50 μm。略語:MCE=混合セルロースエステル;GC = ゲノムコピー;mCherry = 単量体チェリー;eYFP = 増強された黄色蛍光タンパク質。この図の拡大版を表示するには、ここをクリックしてください。
6. ImageJ での画像のデコンボリューションと後処理
- 画像系列をインポートし、系列を時間で分割し、マルチカラー画像の場合は色を付けます。1 つの色のすべてのタイム ポイントが同じフォルダーに含まれていることを確認します。
注:ImageJを使用している場合は、バイオフォーマットをインポートします(バイオフォーマットは自動的にFIJIに含まれます)。 - ImageJプラグインの 回折PSF 3Dを使用して理論的な点像分布関数(PSF)を作成します。
メモ:蛍光タンパク質の発光波長がPSFに影響を与えるため、各イメージングチャネルには独自のPSFが必要です。 - プラグインの使用 |マクロの|実行して、指定されたマクロ (補足ファイル 1) を使用して、すべてのタイムポイントに対してバッチ並列反復デコンボリューションを実行します。
注: このマクロは、ウィーナー フィルターの事前調整済みランドウェーバー (WPL) 反復アルゴリズムを 25 回繰り返して実行します。各カラーチャンネルは別々にデコンボリューションする必要があります。 - カラーチャンネルをマージし、すべてのタイムポイントをハイパースタックにコンパイルします(画像|ハイパースタックの|スタックからハイパースタックへ)。プラグインを使用して3Dドリフト を修正する |参加登録|3Dドリフトを修正します。
- イメージを通常のスタックに戻す (イメージ |ハイパースタックの|ハイパースタックからスタックへ)、およびタイムポイントを分割します (画像|スタック|ツールの|スタックスプリッタ)。バッチ処理を使用して、すべての時点の最大投影法を作成する (プロセス |バッチ|マクロ|run("Z Project...", "projection=[Max Intensity]");
- タイムラプス画像シーケンスの読み込み (ファイル|インポート|画像シーケンス)。従来のImageJツールを使用して、デコンボリングおよび後処理された2次元(2D)ビデオの望ましい分析を行います。
注: 4 次元 (3D + 時間) のデコンボリューションおよびドリフト補正されたビデオは、ハイパースタックとして表示できます。前の手順を省略して、3D タイムポイントを維持します。
結果
上記のプロトコルを使用して、スターバースト細胞樹状突起を発達させる高解像度の3Dビデオを取得し、デコンボリングし、3Dドリフトについて補正した。Z平面最大投影は、解析用の2Dビデオを作成するために作成されました(補足ビデオ1、 図5A)。各時点の3Dデコンボリューションは、微細な糸状突起の分解能を増加させた(図5B、C)。微細な糸状突起は、網膜樹状突起36 を発達させる特徴であり、画像化中に見えるはずである。AAVトランスフェクションは、細胞標識密度および蛍光強度に変動性をもたらす。したがって、標識された組織をスクリーニングして、イメージングおよび高品質のビデオを生成するための高い蛍光シグナルを有する細胞を選択する。薄暗い標識された細胞を検出するためにレーザー出力を上げることは、急速なフォトブリーチングをもたらし、信号と比較して高いノイズをもたらす可能性があるため、推奨されません。十分に明るい細胞は5dpi以内に見える。12dpi以上では、AAV感染期間が延長されても、標識細胞の蛍光が必ずしも増加するとは限らない(図5D)。
高密度の細胞標識による過剰な蛍光および神経突起の混雑は画質に影響を及ぼし、単一細胞再構成を妨げる可能性がある。AAV希釈および体積の最適化は、標的細胞集団の残りの部分から分離可能な単離および蛍光標識された樹木の所望の程度を達成するために必要である。ここでは、108~109×ウイルスGC×109個を1眼あたり9.2個注入し、スターバーストアマクリン細胞(4×1012GC/mL力価を有するAAVの0.23~0.45μL)を標的とした。蛍光シグナルがないことは、非効率的な注入技術を反映している可能性があります。注射中、注射部位からの青色AAV溶液の漏出は、ウイルスが網膜に送達されないか、または注射量または圧力が高すぎることを示す。過剰な注射量または圧力は、網膜剥離および/または眼圧の損失を引き起こし、網膜細胞を損傷し、細胞標識効率を低下させる可能性がある。両方の問題は、注入技術の練習と最適化で解決できます。シグナルの欠如の他の潜在的な理由には、AAVトランスフェクションの期間中にCre導入遺伝子が活性でないために、不適切な貯蔵または不十分なCre発現によるAAVの分解が含まれる。
ビデオがデコンボリングされると、分岐の追加、後退、安定化の速度の計算などの動的分析を実行できます。さらに、従来の静的分析は、ニューロン再構成や、全分岐長、分岐角度、分岐順序、終端分岐点数などの形態測定定量化を含む、各時間枠に対して実行できます。このプロトコルの結果は、高解像度の 3D 画像スタックの時系列です。ほとんどの3D神経突起動的ビデオは、ImageJ37などのオープンソースの画像視覚化ソフトウェアを使用して、最大投影として手動で定量化されます。もう1つのオープンソースツールであるVaa3D38は、大量の視覚化のために特別に開発されました。ビデオを 3D で解析する場合は、Vaa3D などの 3D + 時間ビジュアライザーを使用することをお勧めします。ImageJ と Vaa3D は、画像内のピクセルまたはボクセルに直接アクセスできるようにしますが、多くの場合、ピクセル データをスケルトン化されたツリー再構成に変換することによってニューロン再構成が作成されます。単一時点の自動または半自動ニューロン再構成は、オープンソース39,40,41および独自のソフトウェアで実行できます。タイムラプス再構成を分析するには、再構成の各ポイントを前のタイム ポイントと後続のタイム ポイントにリンクする必要があります。500以上のデータポイントでエンコードできる複雑な樹状形態を時間の経過とともに整列させることは、依然として困難な問題です。さまざまな長所と限界を持つ多くのツールが利用可能であり、研究に必要な分析に合わせて選択する必要があります。
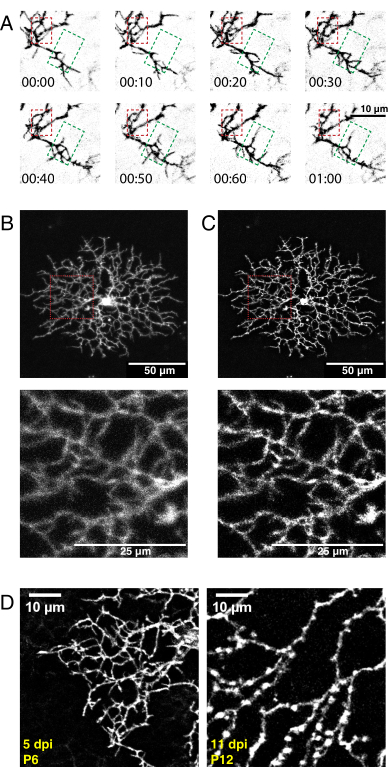
図5:新生児眼内注射、タイムラプスイメージング、およびデコンボリューション後の代表的な結果。 (A)AAV注射後5日目のP6スターバーストアマクリン細胞のデコンボリュードタイムラプスイメージングシリーズ(h:min)の最大投影。微細な糸状体動態は、従来のImageJツールを使用して解析できるようになりました。樹状突起の細分化の領域(赤色のボックス)と樹状突起の伸長の領域(緑色のボックス)が強調表示されます。(B, C)AAV注射後5日目に膜タグ付きeYFPで標識された単一P6スターバーストアマクリン細胞(dpi)は、明るい単一細胞標識を示す。上部パネルのスケールバー = 50 μm;下部パネルのスケールバー = 25 μm。(A)の前と(B)のImageJによるデコンボリューションの後。インセット(赤)は、デコンボリューションが成功した結果、ぼやけが解消されたことを示します。(d)P6スターバーストアマクリン細胞5dpi(左)は、P12スターバースト細胞11dpiと比較して、同様のレベルの蛍光タンパク質発現を示す。AAVインキュベーション時間の増加は、蛍光シグナルを増加させない。蛍光シグナルは、より長いAAV感染期間で低下しない。同一の集録パラメータと後処理パラメータを両方の画像に適用しました。P12で観察された枝の太さと静脈瘤の増加は、成熟したスターバースト細胞の正常な特徴であり、標識やイメージングアーチファクトではない。スケールバー = 10 μm。略語: AAV = アデノ随伴ウイルス;eYFP = 増強黄色蛍光タンパク質;dpi = 感染後日数。 この図の拡大版を表示するには、ここをクリックしてください。
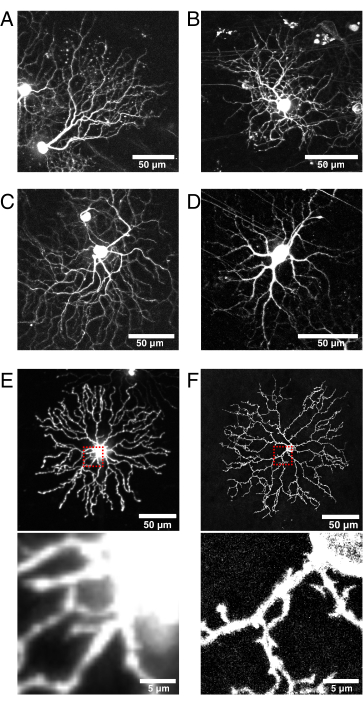
図6:クレライン選択および蛍光タンパク質局在化に関する考慮事項。
(A-D)Vglut2-iRES-Creノックインマウスに注射されたBBVの9dpiで画像化された生きたP11網膜神経節細胞は、CreがRGC集団において選択的に発現されるものである。(A) その特徴的な非対称形態によって同定されるJAM-B RGC24。(B-D)樹状突起層形成パターンが異なる別個のRGCサブタイプ。(E)細胞質ゾルmCherryで生物的にトランスフェクトされ、512 x 512ピクセルで共焦点の回転ディスクでキャプチャされた生きたP11スターバーストアマクリン細胞の画像。細胞質ゾルXFPは、微細な樹状突起に対してソーマにおいて高い蛍光シグナルをもたらす。ソーマからの焦点の合っていない光は、小さな近位突起をイメージングするときに高いバックグラウンド蛍光を引き起こします(上の赤いボックスの差し込み図を以下に示します)。(F)膜標的eYFPをトランスフェクトし、1024 x 1024ピクセルで共焦点レーザースキャンによって捕捉された生きたP11スターバーストアマクリン細胞の画像。ソーマの周囲の蛍光膜リング、改善されたシグナル対ノイズ比、および膜標的蛍光タンパク質によって産生されるソーマに近位にある微細な突起の品質に注意してください(差し込み図)。スケールバー = 50 μm、E および F の下部パネルの場合 = 5 μm。略語: IRES = 内部リボソーム侵入部位;BBV = Brainbow アデノ関連ウイルス;Vglut2 = 小胞グルタミン酸トランスポーター2;XFP = 任意の蛍光タンパク質;eYFP = 増強黄色蛍光タンパク質;mCherry = 単量体チェリー;RGC = 網膜神経節細胞;JAM-B = 接合接着分子 B. この図の拡大版を表示するには、ここをクリックしてください。
補足ビデオ1:スターバーストアマクリン樹状突起を発達させるP6のタイムラプスビデオ、注射後5日。 ビデオの時間ステップは2分です。デコンボリューションと3Dドリフト補正は、ImageJを使用して適用されました。上部の黄色のボックスは外生の領域を強調し、下部のボックスは一時的な糸状体の成長、自己接触、および後退の領域を概説します。 このビデオをダウンロードするには、ここをクリックしてください。
補足ファイル1: バッチ 並列反復デコンボリューション用の ImageJ マクロ。このマクロは、ウィーナー フィルターの事前調整済みランドウェーバー (WPL) 反復アルゴリズムを 25 回繰り返して実行します。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
このビデオは、既存の遺伝的ツールを利用して、共焦点ライブイメージングで網膜ニューロンを発達させる樹状突起ダイナミクスを画像化する実験パイプラインを示しています。また、膜標的蛍光タンパク質をコードするCre依存性AAVの新生児マウスへの眼内注射も実証されている。遺伝的に標的化された集団の単一細胞は、早くも4〜5dpiと明るく標識されている。網膜フラットマウントは、生細胞共焦点イメージングを実行するための標準的なイメージングチャンバー用に準備された。このメソッドは、単一セルとその微細な投影の高解像度タイムラプスビデオを生成します。小さな投影は、ImageJ、Vaa3D、ShuTuなどのオープンソースソフトウェア、およびImarisおよびMBF Bioscienceから入手可能なライセンスソフトウェアを通じて利用可能なデコンボリューションおよび後処理アルゴリズムを使用して解決および定量化されます。このパイプラインはモジュール式であるため、各プロトコルセクションは研究の目的に合わせて変更できます。これらのモジュラー要素は以下で議論され、1)クレライン選択、2)蛍光タンパク質およびウイルス構築物の選択、3)遺伝子送達方法、および4)イメージング法を含む。
この技術は、網膜細胞亜集団への遺伝的アクセスのためにCreトランスジェニック株を使用する。Creは出生後に活性でなければならず、ウイルス感染および細胞標識の可能性を高めるために注射時に細胞集団全体で発現しなければならない。この報告では、スターバーストアマクリン細胞を標的にするためにChAT-Creを使用し、Vglut2-Cre線を使用して、発達中のRGCs42,43を標的とした(図6)。Vglut2-IRES-CreノックインマウスへのCre依存性AAV注射は、接合接着分子B細胞(図6A)および二層化RGC(図6B、C)を含む様々なRGCを標識した。あるいは、細胞型特異的発現を駆動する合成プロモーターを用いたAAVの新しい設計は、Creトランスジェニック株の必要性を排除する可能性がある44。ライブイメージングに適した効率的で明るいラベリングのためのもう1つの考慮事項は、トランスフェクションおよび発現に必要な最小時間であり、これはAAV血清型、トロピズム、および力価45によって異なる可能性がある。これらの研究では、AAV媒介性標識はXFP発現に最低4〜5dpiを必要とするため、この方法は出生後早期時点へのアクセスには適していない。初期の時点(例えば、P0−P4)を捕捉するために、眼内注射は、子宮エレクトロポレーションにおいて行われるように、胚性動物の子宮内で行うことができる46。スターバースト樹状突起発生に関するこのグループの研究では、ChAT-Creの初期スパース組換えパターンを利用して、マウストランスジェニックCreレポーターRosa-mTmG27を用いて、P0-P4で単一のスターバーストアマクリン細胞を標識した。最後に、このAAV網膜注射プロトコルは、スターバースト細胞形態に有害な影響を及ぼすことなく、注射後3ヶ月の蛍光標識の持続性の確認に基づいて、成体細胞集団を標識するために使用することができる34。
このパイプラインはまた、ウイルス構築物の選択における柔軟性を可能にする。樹状突起ダイナミクスを捕捉するために、特定の細胞下構造に局在するタンパク質、目的のタンパク質、またはアクチンダイナミクス(例えば、LifeAct)およびカルシウムシグナル(例えば、GCaMP)などの機能的変化を報告するタンパク質を含む、様々な蛍光レポータータンパク質を使用することができる。任意の市販またはクローニングされたAAVベクターを採用することができ、輝度および光安定性のために fpbase.org などのオンラインツールを参照すべきである。ここで、H-Rasファルネシル化 CAAX モチーフを有する蛍光タンパク質をコードするBrainbowウイルスベクターを膜局在化に使用した。プロトコール開発の初期に、XPFの細胞質ゾル局在化は、ソーマからのシグナルの過飽和と微細枝の標識不良により、微細神経突起形態の研究には理想的ではないことが判明した(図6E)。比較により、膜標的蛍光タンパク質は、微細な樹状突起を標識および分解することが示された(図6E、F)。別の考慮事項は、ウイルス構築物のサイズ、設計、および複雑さであり、これは発現時間に影響を及ぼす可能性がある。例えば、AAV-CAG-FLEx-mClover3-CAAXが生成され、これは1つのXFPをCre依存的に表現する。このコンストラクトは設計が単純で、4 dpi で効率的な表現が得られます。リポジトリ(JAX、Addgene、Viral Vector Coresなど)から広く入手可能なCre lines、AAVデザイン、蛍光タンパク質レポーターの多様なオプションを組み合わせることで、このパイプラインは網膜の細胞型や発生現象のさまざまな研究に適応できます。
このプロトコルは眼内AAV注射を詳述しているが、プラスミドエレクトロポレーション46やバイオリスト遺伝子送達(例えば、Gene Gun)7などの他の遺伝子送達方法が利用可能である。エレクトロポレーションは電気パルスを印加することを必要とし、バイオリスティック遺伝子送達は網膜外植体のエクスビボインキュベーションを必要とする。AAV標識は、これらの両方の方法よりも侵襲性が低く、イメージングの直前に網膜外植体の急性調製を可能にする。バイオリスティック遺伝子送達(図6E、F)と比較して、AAV注射は、神経突起ダイナミクスを追跡するために必要な連続的獲得により適した組織生存率の増強をもたらした。適切な技術では、AAV標識は、解剖時の組織の健康状態によって判断されるように、網膜にほとんどまたはまったく損傷を与えない。硝子体内注射は、RGCsおよびアマクリン細胞などの神経節細胞層および内顆粒層内の細胞に主に感染する。数十個のスターバーストアマクリン細胞が典型的には標識されており、視神経頭部の周りの標識細胞の密度が増大している(図4C)。しかし、3つのトランスフェクション法すべてでは、網膜外植体を得るために視神経切断は避けられず、RGC変性につながる。視神経切断にもかかわらず、研究は、36時間および除核後6日までの様々な脊椎動物モデルからの生存可能な網膜外植を報告している5,6,7,47,48。
最後に、樹状突起ダイナミクスを捕捉するための共焦点顕微鏡の有用性が実証されている。典型的には、画像化セッションは2〜4時間に及び、組織劣化または神経突起のブレビングが観察される前に結論付けられる。最大6時間のイメージングセッションが実施されました。しかし、上限は体系的にテストされていません。領域は長時間のイメージングのためにフォトブリーチングを受けるかもしれないが、外植体の他の視野の細胞はライブイメージングのために生存可能なままである。この方法は、多光子顕微鏡またはライトシート顕微鏡に拡張して、より深い層およびより大きな体積のニューロン形態を画像化することもできる。多光子イメージングは、マウス網膜の神経突起動態を研究するために行われており、より深い網膜薄層の細胞(例えば、水平または光受容体細胞)の研究に適しています49。最近、生細胞ライトシート顕微鏡が網膜血管新生を捕捉するために使用され50、網膜全体の形態形成のライブイメージングのための新しい道を提供しました。生細胞ライトシート顕微鏡は、軸索-樹状突起ターゲティングなど、より大きなスケールで神経回路アセンブリを研究するために使用することができる。多色ライブイメージングは、樹状突起の発生に対する隣接する細胞の影響や、RGCサブタイプ1、ミクログリア、アストロサイトを含む網膜細胞のタイリングなどの他の発生現象など、細胞間相互作用を調査するために使用できるこのパイプラインのもう1つのアプリケーションです。
結論として、開発研究の挑戦的な側面は、これらの重要な時点でアクセスを得ることです。このプロトコルは、特定の時間的ウィンドウの間に起こる形態形成を視覚化する方法を提供する。パイプラインは、細胞集団を遺伝的に標的にし、膜標的蛍光タンパク質を発現させるための既存のツールと技術を組み合わせたものです。急性網膜フラットマウント製剤は、生細胞共焦点イメージングのための生存率および蛍光シグナルを数時間にわたって維持する。樹状突起開発の一時的および動的な側面は、3Dビデオにキャプチャされ、オープンソースソフトウェアを使用して後処理されます。高解像度の3Dビデオをキャプチャする機能は、動的な開発プロセスを調査する上で不可欠です。
開示事項
著者らは開示するものを何も持っていない。
謝辞
マディソン・グレイが、私が何も持っていなかったときに手を差し伸べてくれたことに感謝します。この研究は、NSERCディスカバリーグラント(RGPIN-2016-06128)、神経科学のスローンフェローシップ、カナダ研究委員長ティア2(J.L.L.)の支援を受けました。S. Ing-Estevesは、Vision Science Research ProgramとNSERC Postgraduate Scholarships-Doctoralの支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Addgene viral prep #45185-AAV9 | |||
| Addgene viral prep #45186-AAV9 | |||
| Dissection tools | |||
| Cellulose filter paper | Whatman | 1001-070 | |
| Dumont #5 fine forceps | FST | 11252-20 | Two Dumont #5 forceps are required for retinal micro-dissection |
| Dumont forceps | VWR | 82027-426 | |
| Fine Scissors | FST | 14058-09 | |
| Mixed cellulose ester membrane (MCE) filter papers, hydrophilic, 0.45 µm pore size | Millipore | HABG01 300 | |
| Petri Dish, 50 × 15 mm | VWR | 470313-352 | |
| Polyethylene disposable transfer pipette | VWR | 470225-034 | |
| Round tip paint brush, size 3/0 | Conventional art supply store | Two size 3/0 paint brushes (or smaller) are required for retinal flat-mounting | |
| Surgical Scissors | FST | 14007-14 | |
| Vannas Spring Scissors - 2.5 mm Cutting Edge | FST | 15000-08 | |
| Live-imaging incubation system | |||
| Chamber polyethylene tubing, PE-160 10' | Warner Instruments | 64-0755 | |
| Dual channel heater controller, Model TC-344C | Warner Instruments | 64-2401 | |
| HC FLUOTAR L 25x/0.95 W VISIR dipping objective | Leica | 15506374 | |
| Heater controller cable | Warner Instruments | CC-28 | |
| Large bath incubation chamber with slice support | Warner Instruments | RC-27L | |
| MPII Mini-Peristaltic Pump | Harvard Apparatus | 70-2027 | |
| PM-6D Magnetic Heated Platform (incubation chamber heater) | Warner Instruments | PM-6D | |
| Pump Head Tubing Pieces For MPII Mini-Peristaltic Pump | Harvard Apparatus | 55-4148 | |
| Sample anchor (Harps) | Warner Instruments | 64-0260 | Sample anchor must be compatible with incubation chamber |
| Sloflo In-line Solution Heater | Warner Instruments | SF-28 | |
| Neonatal Injections | |||
| 10 µL Microliter Syringe Series 700, Removable Needle | Hamilton Company | 80314 | |
| 30 G Hypodermic Needles (0.5 inch) | BD PrecisionGlide | 305106 | |
| 4 inch thinwall glass capillary, no filament (1.0 mm outer diameter/0.75 mm) | WPI World Precision Instruments | TW100-4 | |
| Ethanol 99.8% (to dilute to 70% with double-distilled water [ddH2O]) | Sigma-Aldrich | V001229 | |
| AAV9.hEF1a.lox.TagBFP. lox.eYFP.lox.WPRE.hGH-InvBYF | Penn Vector Core | AV-9-PV2453 | Addgene Plasmid #45185 |
| AAV9.hEF1a.lox.mCherry.lox.mTFP 1.lox.WPRE.hGH-InvCheTF | Penn Vector Core | AV-9-PV2454 | Addgene Plasmid #45186 |
| ChAT-IRES-Cre knock-in transgenic mouse line | The Jackson Laboratory | 6410 | |
| Fast Green FCF Dye content ≥85 % | Sigma-Aldrich | F7252-25G | |
| Flaming/Brown Micropipette Puller, model P-97 | Sutter Instrument Co. | P-97 | |
| Green tattoo paste | Ketchum MFG Co | 329A | |
| Phosphate-Buffered Saline, pH 7.4, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | 806552 | |
| Pneumatic PicoPump | WPI World Precision Instruments | PV-820 | |
| Oxygenated artifiial cerebrospinal fluid (aCSF) Reagents | |||
| Calcium chloride dihydrate (CaCl2·2H2O) | Sigma-Aldrich | C7902 | |
| Carbogen (5% CO2, 95% O2) | AirGas | X02OX95C2003102 | Supplier may vary depending on region |
| D-(+)-Glucose | Sigma-Aldrich | G7021 | |
| HEPES, Free Acid | Bio Basic | HB0264 | |
| Hydrochloric acid solution, 1 N | Sigma-Aldrich | H9892 | |
| Magnesium chloride hexahydrate (MgCl2·6H2O) | Sigma-Aldrich | M2670 | |
| pH-Test strips (6.0-7.7) | VWR | BDH35317.604 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | |
| Sodium chloride (NaCl) | Bio Basic | DB0483 | |
| Sodium phosphate monobasic (NaH2PO4) | Sigma-Aldrich | RDD007 | |
| Software | |||
| ImageJ | National Institutes of Health (NIH) | Open source |
参考文献
- Lefebvre, J. L., Sanes, J. R., Kay, J. N. Development of dendritic form and function. Annual Review of Cell and Developmental Biology. 31, 741-777 (2015).
- Graham, H. K., Duan, X. Molecular mechanisms regulating synaptic specificity and retinal circuit formation. Wiley Interdisciplinary Reviews Developmental biology. 10 (1), 379(2021).
- Godinho, L., et al. Targeting of amacrine cell neurites to appropriate synaptic laminae in the developing zebrafish retina. Development. 132 (22), 5069-5079 (2005).
- Mumm, J. S., et al. In vivo imaging reveals dendritic targeting of laminated afferents by zebrafish retinal ganglion cells. Neuron. 52 (4), 609-621 (2006).
- Wong, W. T., Faulkner-Jones, B. E., Sanes, J. R., Wong, R. O. Rapid dendritic remodeling in the developing retina: dependence on neurotransmission and reciprocal regulation by Rac and Rho. The Journal of Neuroscience. 20 (13), 5024-5036 (2000).
- Wei, W., Elstrott, J., Feller, M. B. Two-photon targeted recording of GFP-expressing neurons for light responses and live-cell imaging in the mouse retina. Nature Protocols. 5 (7), 1347-1352 (2010).
- Morgan, J. L., Wong, R. O. L. Ballistic labeling with fluorescent dyes and indicators. Current Protocols in Neuroscience. 43 (1), 1-10 (2008).
- Nickerson, P. E. B., et al. Live imaging and analysis of postnatal mouse retinal development. BMC Developmental Biology. 13, 24(2013).
- Morgan, J. L., Dhingra, A., Vardi, N., Wong, R. O. L. Axons and dendrites originate from neuroepithelial-like processes of retinal bipolar cells. Nature Neuroscience. 9 (1), 85-92 (2006).
- Coombs, J. L., Van Der List, D., Chalupa, L. M. Morphological properties of mouse retinal ganglion cells during postnatal development. The Journal of Comparative Neurology. 503 (6), 803-814 (2007).
- Cranfill, P. J., et al. Quantitative assessment of fluorescent proteins. Nature Methods. 13 (7), 557-562 (2016).
- Stacy, R. C., Wong, R. O. L. Developmental relationship between cholinergic amacrine cell processes and ganglion cell dendrites of the mouse retina. The Journal of Comparative Neurology. 456 (2), 154-166 (2003).
- Kay, J. N., et al. Retinal ganglion cells with distinct directional preferences differ in molecular identity, structure, and central projections. The Journal of Neuroscience. 31 (21), 7753-7762 (2011).
- Liu, J., Sanes, J. R. Cellular and molecular analysis of dendritic morphogenesis in a retinal cell type that senses color contrast and ventral motion. The Journal of Neuroscience. 37 (50), 12247-12262 (2017).
- Diao, L., Sun, W., Deng, Q., He, S. Development of the mouse retina: emerging morphological diversity of the ganglion cells. Journal of Neurobiology. 61 (2), 236-249 (2004).
- Coombs, J., vander List, D., Wang, G. Y., Chalupa, L. M. Morphological properties of mouse retinal ganglion cells. Neuroscience. 140 (1), 123-136 (2006).
- Sanes, J. R., Masland, R. H. The types of retinal ganglion cells: current status and implications for neuronal classification. Annual Review of Neuroscience. 38, 221-246 (2015).
- Sümbül, U., et al. A genetic and computational approach to structurally classify neuronal types. Nature Communications. 5, 3512(2014).
- Lin, B., Masland, R. H. Populations of wide-field amacrine cells in the mouse retina. The Journal of Comparative Neurology. 499 (5), 797-809 (2006).
- Macneil, M. A., Heussy, J. K., Dacheux, R. F., Raviola, E., Masland, R. H. The shapes and numbers of amacrine cells: Matching of photofilled with Golgi-stained cells in the rabbit retina and comparison with other mammalian species. Journal of Comparative Neurology. 413 (2), 305-326 (1999).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Jo, A., Xu, J., Deniz, S., Cherian, S., DeVries, S. H., Zhu, Y. Intersectional strategies for targeting amacrine and ganglion cell types in the mouse retina. Frontiers in Neural Circuits. 12, 66(2018).
- Siegert, S., et al. Genetic address book for retinal cell types. Nature Neuroscience. 12 (9), 1197-1204 (2009).
- Kim, I. -J., Zhang, Y., Meister, M., Sanes, J. R. Laminar restriction of retinal ganglion cell dendrites and axons: subtype-specific developmental patterns revealed with transgenic markers. The Journal of Neuroscience. 30 (4), 1452-1462 (2010).
- Peng, Y. -R., Tran, N. M., Krishnaswamy, A., Kostadinov, D., Martersteck, E. M., Sanes, J. R. Satb1 regulates contactin 5 to pattern dendrites of a mammalian retinal ganglion cell. Neuron. 95 (4), 869-883 (2017).
- Duan, X., Krishnaswamy, A., Dela Huerta, I., Sanes, J. R. Type II cadherins guide assembly of a direction-selective retinal circuit. Cell. 158 (4), 793-807 (2014).
- Ray, T. A., et al. Formation of retinal direction-selective circuitry initiated by starburst amacrine cell homotypic contact. eLife. 7, 34241(2018).
- Krishnaswamy, A., Yamagata, M., Duan, X., Hong, Y. K., Sanes, J. R. Sidekick 2 directs formation of a retinal circuit that detects differential motion. Nature. 524 (7566), 466-470 (2015).
- Caval-Holme, F., Zhang, Y., Feller, M. B. Gap junction coupling shapes the encoding of light in the developing retina. Current Biology. 29 (23), 4024-4035 (2019).
- Lucas, J. A., Schmidt, T. M. Cellular properties of intrinsically photosensitive retinal ganglion cells during postnatal development. Neural Development. 14 (1), 8(2019).
- Cai, D., Cohen, K. B., Luo, T., Lichtman, J. W., Sanes, J. R. Improved tools for the Brainbow toolbox. Nature Methods. 10 (6), 540-547 (2013).
- Rossi, J., et al. Melanocortin-4 receptors expressed by cholinergic neurons regulate energy balance and glucose homeostasis. Cell Metabolism. 13 (2), 195-204 (2011).
- Lefebvre, J. L., Kostadinov, D., Chen, W. V., Maniatis, T., Sanes, J. R. Protocadherins mediate dendritic self-avoidance in the mammalian nervous system. Nature. 488 (7412), 517-521 (2012).
- Ing-Esteves, S., et al. Combinatorial effects of alpha- and gamma-protocadherins on neuronal survival and dendritic self-avoidance. The Journal of Neuroscience. 38 (11), 2713-2729 (2018).
- Williams, P. R., Morgan, J. L., Kerschensteiner, D., Wong, R. O. L. In vitro imaging of retinal whole mounts. Cold Spring Harbor Protocols. 2013 (1), (2013).
- Ramoa, A. S., Campbell, G., Shatz, C. J. Transient morphological features of identified ganglion cells in living fetal and neonatal retina. Science. 237 (4814), 522-525 (1987).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Peng, H., Ruan, Z., Long, F., Simpson, J. H., Myers, E. W. V3D enables real-time 3D visualization and quantitative analysis of large-scale biological image data sets. Nature Biotechnology. 28 (4), 348-353 (2010).
- Cuntz, H., Forstner, F., Borst, A., Häusser, M. One rule to grow them all: a general theory of neuronal branching and its practical application. PLoS Computational Biology. 6 (8), 1000877(2010).
- Xiao, H., Peng, H. APP2: automatic tracing of 3D neuron morphology based on hierarchical pruning of a gray-weighted image distance-tree. Bioinformatics. 29 (11), 1448-1454 (2013).
- Nanda, S., et al. Design and implementation of multi-signal and time-varying neural reconstructions. Scientific data. 5, 170207(2018).
- Sherry, D. M., Wang, M. M., Bates, J., Frishman, L. J. Expression of vesicular glutamate transporter 1 in the mouse retina reveals temporal ordering in development of rod vs. cone and ON vs. OFF circuits. The Journal of Comparative Neurology. 465 (4), 480-498 (2003).
- Johnson, J., et al. Vesicular neurotransmitter transporter expression in developing postnatal rodent retina: GABA and glycine precede glutamate. The Journal of Neuroscience. 23 (2), 518-529 (2003).
- Jüttner, J., et al. Targeting neuronal and glial cell types with synthetic promoter AAVs in mice, non-human primates and humans. Nature Neuroscience. 22 (8), 1345-1356 (2019).
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Molecular Therapy. 16 (6), 1073-1080 (2008).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. Journal of Visualized Experiments: JoVE. (31), e1333(2009).
- Lye, M. H., Jakobs, T. C., Masland, R. H., Koizumi, A. Organotypic culture of adult rabbit retina. Journal of Visualized Experiments: JoVE. (3), e190(2007).
- Pignatelli, V., Strettoi, E. Bipolar cells of the mouse retina: a gene gun, morphological study. The Journal of Comparative Neurology. 476 (3), 254-266 (2004).
- Huckfeldt, R. M., et al. Transient neurites of retinal horizontal cells exhibit columnar tiling via homotypic interactions. Nature Neuroscience. 12 (1), 35-43 (2009).
- Prahst, C., et al. Mouse retinal cell behaviour in space and time using light sheet fluorescence microscopy. eLife. 9, 49779(2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved