Method Article
케노하브디티스 예쁜꼬마선충의 장 내 침투성에 대한 박테리아와 화학물질의 영향 측정
요약
이 프로토콜은 예쁜꼬마선충의장 투과성을 측정하는 방법을 설명합니다. 이 방법은 장 내 박테리아와 숙주 간의 상호 작용과 관련된 장 건강에 대한 기본 생물학적 연구와 새는 장 증후군 및 염증성 장 질환을 치료하는 프로바이오틱 및 화학 약제 식별 스크리닝에 유용합니다.
초록
살아있는 유기체에서 장 과다 투과성은 많은 염증성 장 질환 (IBDs)으로 이어지는 심각한 증상입니다. Caenorhabditis 예쁜꼬마선충은 짧은 수명, 투명성, 비용 효율성 및 동물 윤리 문제의 부족으로 인해 분석 시스템으로 널리 사용되는 비 포유류 동물 모델입니다. 이 연구에서는, 높은 처리량의 심상 분석 시스템을 가진 C. 예쁜꼬마선충의 장 투과성에 다른 박테리아 및 3,3'-diindolylmethane (DIM)의 효력을 조사하기 위하여 개발된 방법. 벌레는 다른 창자 박테리아에 감염되거나 48 시간 동안 DIM으로 공동 처리되었고 플루오레세인 이소티오차네이트 (FITC)-덱스렌을 하룻밤 동안 공급하였다. 이어서, 장 투과성은 웜 체 내부의 형광 이미지와 형광 강도를 비교하여 조사되었다. 이 방법은 또한 동물 모델에서 장 침투성에 영향을 미치는 probiotic 및 병원 성 장 내 박테리아를 식별 하는 잠재력을 가질 수 있습니다 및 장 투과성 및 장 건강에 유해 하거나 건강 증진 화학 물질의 효과 검사에 대 한 효과적. 그러나, 이 프로토콜은 또한 유전 수준에 있는 몇몇 상당한 제한이 있습니다, 특히 이 방법은 주로 현상형 결정에 사용되기 때문에, 질병을 통제하기 위하여 변경되는 유전자를 결정하기위한. 또한,이 방법은 감염 시 염증을 일으키거나 벌레의 침투성을 증가시키는 병원성 기질이 정확히 무엇인지 결정하는 데 국한됩니다. 따라서, 박테리아의 화학 성분 분석 뿐만 아니라 돌연변이 박테리아와 선충을 이용한 분자 유전 적 메커니즘의 조사를 포함하여 추가심도 연구가 필요하며, 장 투과성을 결정하는 박테리아와 화학 물질의 기능을 완전히 평가할 필요가 있다.
서문
장 투과성은 장내 미생물 및 점막 면역과 관련된 주요 장벽 중 하나로 간주되며 장내 미생물 변형, 상피 손상 또는 점액 층 변경과 같은 여러 요인에 의해 영향을 받을 가능성이1. 최근 논문은 장 세포 층2에걸쳐 형광 플럭스 비율을 분석하여 배양 인간 장의 장 투과성을 측정하는 효과적인 프로토콜을보고, 하지만 적은 연구 논문은 선충에서 창자 투과도를 측정하기위한 적절한 절차를 제시, 특히 C. elegans에서,FITC-dextran 염색을 사용하여.
나일 레드3 및 에리오글라우신 디소듐(또는 스머프 분석)을 사용하여 C. 예쁜꼬마선충의 장 투과성을 측정하기 위한 두 가지 대표적인 프로토콜이있다 4,5. 이 프로토콜에서는 나일 레드(MW = 318.37) 및 에리오글라우신 디소듐(MW = 792.85)보다 훨씬 높은 분자량을 가지는 FITC-dextran(평균 분자량 10,000)을 사용했습니다. FITC-dextran은 나일 강색 또는 에리오글라우신 디소듐 염료보다 장층을 통해 흡수되는 탄수화물과 같은 실제 다량 분자 영양소와 더 유사합니다. 에리오글라우신 디소듐(blue Smurf 염료)을 공급받은 C. 예쁜꼬마선충의 장 투과성은 형광 현미경 검사법 없이 쉽게 평가할 수 있습니다. 그러나, 스머프 분석법에서는, 장 투과성의 정량적 분석은 표준화의 부족으로 인해 어렵고 수동으로 평가되어야한다4,5. 나일 붉은 분석의 경우, 나일 레드는 또한 C. elegans6에서창자 투과성의 정확한 결정을 방해할 수 있는 세포에 있는 지질 방울을 얼룩지게 합니다. 본 프로토콜은 비특이적 지질 염색을 피하면서 다양한 장내 세균및 화학물질로 처리된 C. elegans의 장 투과성의 신속하고 정확한 정량적 분석을 가능하게 합니다.
C. 예쁜꼬마선충은 저렴한 가격, 쉬운 조작, 제한된 동물 윤리 문제 및 짧은 수명으로 인해 생물학적 분야에서 전형적인 모델로, 빠른 실험에 도움이 되는7. 특히, 전체 C. elegans 게놈이 발표된 후, C. elegans 게놈에 있는 유전자의 거의 40%는 인간 질병을 일으키는 원인이 되는 유전자에 정형고인 것으로 나타났습니다8. 더욱이, 투명한 체체는 세포 체내 관찰을 가능하게 하며, 이는 세포 체적 사건을 연구하고 세포 생물학에서 형광 적용, 예를 들어, DAPI 또는 면역 조직화학으로 염색하는 줄기 세포 에 유리하다9. C. 예쁜꼬마선충은 종종 장내 미생물과 숙주 간의 상호작용을 연구하기 위해 실험동물로 사용된다. 또한, C. elegans는 장건강을증진시키는 식이 화학물질뿐만 아니라 건강 증진 프로바이오틱박테리아10,11,12를 선별하는데 사용된다.
슈도모나스 녹농균 및 장내 대변은 위장시스템, 특히 장의 대장상피세포(15,16)에부정적인 영향을 미치는 잘 알려진 장내 세균이다. 따라서, 이러한 박테리아에 의해 유발된 장 투과성을 측정하는 것은 세균염증 및 감염으로 인한 손상을 회복및 감소시킬 수 있는 신약의 스크리닝 및 개발에 필요하다. 이 프로토콜에서는 C. elegans의장 투과성에 대한 이러한 장 내 세균의 영향을 테스트했습니다.
우리는 또한 C. elegans의장 투과성에 화학 물질을 테스트하기위한 최적화 된 프로토콜을보고합니다. 이를 위해, 우리는 3,3'-디인돌릴메탄(DIM)을 모델 화학물질로 사용했는데, DIM은 브라시카 식품 식물에 존재하는 인돌-3-카르비놀에서 유래한 생리활성 대사산물 화합물이기 때문에, 마우스17,18에서IBD에 치료 효과가 있는 것으로 보고되었다. 또한, 우리는 최근 DIM이 배양된 인간 장 세포뿐만 아니라 모델 선충 C. elegans19모두에서 장 투과성 기능 장애를 개선한다는 것을 발견했습니다.
이 연구에서는 세 가지 다른 실험 조건을 사용했습니다. 먼저, 우리는 다른 박테리아의 효과를 측정, P. aeruginosa 및 E. 대변, 장 투과성에(그림 1). 둘째, 우리는 장 투과성에 대한 살아있는 및 열 불활성화 P. aeruginosa의 효과를 측정했습니다(그림 2). 셋째, 우리는 Dim (모델 화학 물질)이 P. aeruginosa로 공급된 C. 예쁜꼬마선충의 장 투과성에 미치는 영향을 측정했습니다(그림3).
이 연구의 목적은 화학 물질뿐만 아니라 다양한 장내 박테리아로 치료에 의해 변경되는 C. elegans의장 투과성을 측정하는 최적화 된 프로토콜을 개발하는 것이었습니다.
프로토콜
1. P. aeruginosa PAO1 및 대장균 OP50 배양준비
- 멸균된 루리아-베르타니(LB)배지(표 1)의500 mL를 준비하고 P. aeruginosa의 단일 콜로니를 배지에 접종하였다. 37°C에서 14~15시간 동안 배양하고 150 rpm의 흔들림 속도로 배양한다.
- 세균 배양을 2개의 500 mL 원심분리기 튜브에 균등하게 분배하고 30분 동안 4°C에서 3,220 x g에서 튜브를 원심분리합니다.
- 부피가 50 mL (초기 부피의 1/10)가 될 때까지 상류를 제거하고 세균 펠릿을 다시 일시 중단하십시오.
- 농축된 세균 배양액을 사용 전까지 4°C에서 보관한다. P. aeruginosa 문화의 저장 기간은 최대 1 개월까지 될 수 있습니다., 하지만 신선한 문화 장 손상을 유도 에 대 한 더 나은.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다. 전체 살아있는 박테리아 이외에, 세균 배양의 상상체는 장내세균(19)의효과를 시험하는데 사용될 수 있다. - 대장균 OP50을 준비하기 위해, 배양 대장균 OP50을 DYT배지(표 1)로하고 그 후 상술한 것과 유사한 단계를 적용하되 부피의 1/6로 감소한다. 예를 들어 초기 볼륨이 500mL인 경우 상급체를 제거한 후 나머지 볼륨은 약 83mL입니다.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다.
2. 장구균 Faecalis KCTC 3206 문화의 준비
- 멸균된 뇌 심장 주입(BHI) 국물 500 mL을 준비합니다(표1).
- BHI 국물의 500 mL로 하나의 식민지를 접종하고 37 °C 및 150 rpm에서 흔들리는 인큐베이터에서 14-15 시간 동안 배양합니다.
- 세균 배양을 2개의 500 mL 원심분리기 튜브에 균등하게 분배하고 30분 동안 4°C에서 3,220 x g에서 튜브를 원심분리합니다.
- 부피가 50 mL (초기 볼륨의 1/10)가 될 때까지 상급체를 제거하고 펠릿을 다시 일시 중단하십시오.
- 농축된 세균 배양액을 사용 전까지 4°C에서 보관한다. 신선한 문화는 장 투과성에 미치는 영향을 테스트하는 것이 좋습니다.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다.
3. 열 불활성화 대장균 OP50 및 열 불활성화 P. aeruginosa PAO1 배양물의 준비
- 상기와 같이 박테리아를 배양하고 수확한다(단계 1.1-1.3).
- 열-앞서20,21,22에기재된 바와 같이 대장균 OP50 또는 P. aeruginosa PAO1 배양체를 비활성화한다. 열 불활성화를 위해, 65°C(수조)에서 30분 동안 재중단된 박테리아를 배양한다.
- 농축된 세균 배양을 실온으로 식히고 사용할 때까지 4°C에서 보관하십시오. 저장 기간은 최대 1개월입니다.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다.
4. 선충 성장 매체의 준비 (NGM) C. 예쁜 꼬마의 장 투과성에 다른 박테리아의 효과 테스트 에 대 한 플레이트
- 펩톤 1.25 g, NaCl 1.5 g, 한천 8.5 g, 마그네틱 교반기 및 증류수 487.5 mL을 500 mL 유리 병에 놓습니다(표 1).
- 혼합물을 잘 혼합하고, 121°C에서 15분간 혼합물을 오토클레이브하고, 혼합물을 55°C로 수조에서 30분간 식힌다.
- 수조에서 배지를 제거하고 성분 (0.5 mCl2,콜레스테롤 0.5 mL, MgSO 4 의 0.5 mL, KPO4의12.5 mL)을 추가하고 NGM에 잘 섞습니다.
참고: 콜레스테롤 (절대 에탄올에 용해)을 제외한 모든 개별 구성 요소는 오토 클레이브되어야하며 모든 실험 단계는 깨끗한 벤치에서 수행되어야합니다. - 각 90 x 15 mm 페트리 접시에 20 mL의 NGM을 분배하고 한천이 실온 (약 20 °C)에서 깨끗한 벤치에서 고형화 될 수 있도록하십시오. NGM 플레이트는 4°C에서 최대 1개월 동안 보관할 수 있습니다.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다. FITC-덱스렌 염색에 사용되는 NGM 플레이트는 동일한 절차(4.1-4.3단계)에 의해 제조되었다. NGM의 10 mL을 각 60 x 15 mm 페트리 접시에 분배하고 실온(약 20°C)에서 깨끗한 벤치에서 고형화하도록 하였다. - 4°C 냉장고에서 세균 배양을 제거하고 NGM 플레이트에 배양을 확산시키기 전에 배양을 철저히 소용돌이치게 한다.
- 각 신선한 NGM 플레이트에 총 800 μL의 세균 배양을 첨가하고, 플레이트가 밤새 20°C 인큐베이터에서 건조되도록 한다.
참고: 제1실험(도 1)을위해, 대장균 OP50을 가진 NGM 플레이트 2개, P. aeruginosa PAO1을 가진 NGM 플레이트 1개, E. faecalis KCTC3206을 가진 1개의 NGM 플레이트를 제조하였다. 제2실험(도 2)을위해, 살아있는 대장균 OP50을 가진 NGM 플레이트 2개, 살아있는 P. aeruginosa PAO1을 가진 NGM 플레이트 1개, 열 불활성화 P. aeruginosa PAO1을 가진 1개의 NGM 플레이트를 제조하였다.
5. C. aeruginosa와 공급 C. 예쁜 꼬마의 장 투과성에 화학 (DIM)의 효과를 테스트하기위한 NGM 플레이트의 준비
- 500 mL 유리 병 (NGM 한천)에 펩톤 0.5 g, NaCl 0.6 g, 증류수 195 mL, 자기 교반기 및 6.8 g의 한천을 추가하십시오.
- 펩톤 0.5 g, NaCl 0.6 g, 증류수 195 mL, 한천이없는 자기 교반기를 다른 500 mL 유리 병 (NGM 국물)에 추가하십시오.
- 2개의 병(5.1-5.2단계), 빈 100mL 유리 병 1개, 빈 500 mL 유리 병 1개를 121°C에서 15분 동안 오토클레이브합니다. 이어서, 병을 함유하는 배지를 수조에서 55°C까지 30분 동안 식히고, 한천 배지를 수조에 보관하고 다음 단계(단계 5.2로부터)를 함유한 병을 제거한다.
- NGM 국물에 첨가화학물질을 첨가합니다: 0.4 mL 의 1 M CaCl2,0.4 mL의 콜레스테롤(mL), 0.4 mL의 1 M MgSO4 및 1M KPO4의 10 mL (이러한 모든 성분은 에탄올의 콜레스테롤을 제외하고 멸균되어야 함). 이어서, 55°C에서 마그네틱 교반기를 완전히 저어줍니다.
- 오토클레이브된 빈 500 mL 유리 병에 디메틸 설폭사이드(DMSO)와 DIM이 있는 오토클레이브된 빈 100mL 유리 병에 라벨을 붙입니다.
- 50 mL의 NGM 국물을 DIM 라벨이 붙은 100 mL 병에 옮김을 옮김. 병에 20 mM DIM 스톡 500 μL을 넣고 잘 섞습니다.
참고: DIM은 DMSO (20 mM DIM 스톡)에 용해됩니다. - 수조에서 NGM 한천 배지를 빠르게 제거하고 NGM 한천 배지50 mL을 DIM 라벨이 붙은 병에 넣고 완전히 섞습니다.
- 각 90 mm x 15mm 페트리 접시에 DIM 함유 NGM 배지의 20 mL aliquot를 놓습니다. 이 단계에서 는 약 5개의 DIM 함유 NGM 플레이트를 만들 수 있습니다.
참고: 각 NGM 플레이트에서 DIM의 최종 농도는 100 μM이 될 것이다. - DMSO 함유 NGM 플레이트를 준비하려면 150 mL의 NGM 국물을 DMSO 라벨이 부착된 500 mL 병에 옮김으로 옮김을 옮김을 넣습니다. 병에 1.5 mL의 DMSO를 넣고 잘 섞습니다.
- NgM 한천 배지 150mL를 DMSO 라벨이 붙은 병에 넣고 완전히 섞습니다.
- 각 90 mm x 15mm 페트리 접시에 DMSO 함유 NGM 배지의 20 mL aliquot를 놓습니다. 이 단계에서 는 약 15개의 DMSO 함유 NGM 플레이트를 만들 수 있다.
참고: 각 NGM 플레이트에서 DMSO의 최종 농도는 0.5%가 됩니다. - 플레이트를 실온에서 3시간 이상 고형화하고 사용할 때까지 4°C에서 보관하십시오.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다. - 대장균 OP50 또는 P. aeruginosa PAO1 배양물(단계 1.4로부터)에서 제거하고 NGM 플레이트 에 퍼지기 전에 배양을 적절히 소용돌이치게 한다.
- 대장균 OP50 또는 P. aeruginosa PAO1 세균 배양물의 800 μL을 각각의 신선한 NGM 한천 플레이트에 놓고 플레이트가 밤새 20°C 인큐베이터에서 건조되도록 한다.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다. 제3실험(도 3)을위해, 살아있는 대장균 OP50으로 코팅된 2개의 DMSO 함유 NGM 플레이트, 살아있는 P. aeruginosa PAO1로 코팅된 1개의 DMSO 함유 NGM 플레이트 1개, 및 살아있는 P. aeruginosa PAO1로 코팅된 1개의 DIM 함유 NGM 플레이트를 제조하였다.
6. 나이 동기화 된 C. 예쁜 꼬마의 준비
- 단단한 NGM 접시에 벌레를 성장하고 원하는 인구에 도달 할 때까지 대장균 OP50로 공급.
- 앞서20,23,24에기재된 바와 같이 시간적 계란 누워 방법 또는 표백용액 처리를 이용하여 계란을 동기화한다.
7. 박테리아 또는 희미한 및 FITC-덱스렌 먹이의 치료
- NGM 플레이트에서 64시간 동안 20°C에서 노화 동기화된 계란을 배양하여 살아있는 대장균 OP50을 식품으로 보충하였다.
- 노화 동기화된 L4 유충을 S 버퍼로 세척하고 이를 (약 500개 이상의 웜) 다른 박테리아 및 화학물질을 함유하는 치료 NGM 플레이트로 이송한다(4.6 및 5.14 단계에 기재된 참고). 48 시간 동안 20 °C에서 배양하십시오.
참고: 처리 시간은 사용된 박테리아 및 화학제품에 따라 24에서 72 h까지 다양할 수 있습니다. DIM의 치료 적 또는 예방 효과는 또한 병원균으로 웜을 전처리한 다음 DIM (치료 효과)으로 웜을 치료하거나 웜을 DIM으로 치료한 다음 병원균으로 치료함으로써 평가 될 수 있습니다 (예방 효과)19. - FITC-dextran 보충 플레이트를 준비하려면, 2 mL의 열 불활성화 대장균 OP50과 FITC-dextran 4 mg을 섞으세요. 그런 다음 FITC-dextran 및 대장균 OP50 혼합물의 100 μL을 20 개의 신선한 NGM 한천 플레이트 (60mm x 15mm)로 나누고 깨끗한 벤치에서 접시를 1 시간 동안 건조시십시오.
참고: 각 NGM 플레이트에서 FITC-dextran의 최종 농도는 20 μg/mL입니다. - 차량 제어 처리를 위해 FITC-dextran 없이 대장균 OP50 함유 NGM 플레이트 5개를 준비합니다. 이를 위해 100 μL 의 열 불활성화 대장균 OP50을 각 신선한 NGM 한천 플레이트(60mm x 15mm)에 나누고 깨끗한 벤치에서 플레이트를 1시간 동안 건조시도록 하십시오.
참고: 각 독립적인 실험에 대해 FITC-dextran 보충 NGM 플레이트 15개와 FITC-dextran이 없는 NGM 플레이트 5개가 필요합니다. - 48시간 치료 후(7.2단계에서) 웜을 S 버퍼로 세척하고, FITC-dextran 없이 FITC-dextran 보충 플레이트와 NGM 플레이트로 웜을 옮기고, 밤새 플레이트를 배양합니다(14-15h).
참고: 각 치료 그룹에 대해 FITC-dextran 염색(또는 차량 제어 공급)의 5가지 복제가 필요합니다. - S 버퍼로 벌레를 씻고 신선한 NGM 한천 접시에서 1 시간 동안 크롤링 할 수 있습니다.
참고: 각 독립적인 실험에 대해 총 20개의 신선한 NGM 플레이트가 필요합니다. 이 단계에서는 대장균 OP50 없이 또는 대장균으로 보충된 NGM 플레이트를 사용할 수 있다. - 블랙 96 웰 플랫 바닥 플레이트의 각 웰에 4 % 포름알데히드 용액 50 μL을 추가합니다. 형광 측정을 위해 각 NGM 플레이트에서 약 50개의 웜을 각 우물로 옮김을 옮김을 전달합니다. 1 내지 2 분 후, 각 우물에서 모든 포름 알데히드를 철저히 제거하고 웰을 코팅하기 위해 장착 매체 100 μL을 추가하십시오.
참고: 포름알데히드 용액 (4%) 고정하고 웜을 수정하는 데 사용됩니다. 각 치료 군에 대해 5개의 웰(5개의 복제)이 이미지 분석에 사용됩니다.
8. FITC-dextran 형광 섭취를 측정하여 오페레타 이미징 시스템과 장 투과성 측정을 통해 C. 예쁜꼬마선충
참고: 형광 입체 현미경 검사법은 오페레타 시스템 대신 이미지 분석에 사용할 수 있습니다.
- Operetta 고함량 이미징 시스템을 사용하여 형광 이미지를 캡처하고 형광 강도를 측정하고 하모니 소프트웨어로 이미지를 분석합니다.
- 하모니 소프트웨어에서 아이콘 열기 뚜껑을 눌러 뚜껑을 열고 접시를 기계에 넣습니다.
- 매개 변수를 설정합니다.
- 설정을 클릭하고플레이트 유형(96웰 코닝 플랫 바닥)을 선택하고 채널(밝은 필드 및 EGFP 채널)을 추가합니다.
- 레이아웃을 조정합니다. 레이아웃 선택으로이동한 다음 트랙을 선택하고 매개변수를 조정합니다(첫 번째 그림은 1 μm, 평면 수는 10, 거리는 1 μm).
- 치료 우물 중 하나와 캡처 필드 하나를 선택하고 테스트를 눌러 실행 실험 섹션에서 사진이 만족스러운지 확인합니다.
- 사진이 만족스러운 경우 설정 섹션으로 돌아가화면 끝에 있는 재설정 아이콘을 누릅니다. 그런 다음 모든 대상 웰과 적절한 수의 캡처 필드를 선택합니다.
- 실험을 다시 실행하기 로 이동하여 플레이트 이름을 입력한 다음 시작을 눌러 처리를 시작합니다.
- 형광의 강도를 측정하려면 이미지 분석 섹션으로 이동하여 이미지를 입력합니다. EGFP 채널 및 방법 B를 선택하여 셀을 찾아서 공통 임계값을 0.5로 조정하고, 면적을 >200 μm2로,분할 계수를 3.0으로, 개별 임계값을 0.18로, 대조를 0.18 이상으로 조정합니다. 그런 다음 강도 속성을 계산하고 평균을 출력으로 선택합니다. 적용 아이콘을 눌러 설정을 저장합니다.
- 평가 섹션으로 이동하여 히트맵 및 데이터 테이블을 구하여 강도를 측정합니다. 판독 매개 변수를 셀로 설정 - 강도 셀 EGFP 평균 - 웰당 평균 및 평가를 시작합니다.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다. - 오페레타에서 데이터를 추출하려면 설정 버튼을 클릭하고 데이터 관리를선택합니다.
- 아카이브 쓰기를선택한 다음 찾아보기를 열고 파일을 선택합니다.
- 파일을 선택하려면 왼쪽 모서리에있는 작은 + 신호를 클릭한 다음 측정을 클릭하고 플레이트 이름을선택합니다.
- 파일을 선택하고 확인을클릭합니다.
- 활성 경로에서 찾아보기 신호를 클릭하여 파일을 저장할 경로를 선택합니다.
- 데이터 파일을 저장하려면 시작을 클릭합니다.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다.
9. C. 예쁜꼬마선충의 FITC-덱스렌 형광에 대한 통계분석
- 통계 소프트웨어를 사용하여 데이터를 가져오고 평균 및 표준 편차(SD)를 계산합니다.
- 분산(ANOVA)의 단방향 분석과 Tukey의 다중 비교 테스트를 통해 유의한 차이를 분석합니다.
결과
P. aeruginosa PAO1을 가진 배양 후에, C. 예쁜꼬마선충은 다른 2개의 세균성 긴장으로 배양 후에 도시된 형광에 비해 웜 바디에 있는 FITC-dextran 형광에 있는 유의한 증가를 보여주었습니다(그림 1). 대장균 OP50, P. aeruginosa PAO1 및 E. faecalis KCTC3206을 공급한 벌레의 형광 강도는 각각 100.0±6. 369.7±38.9, 및 105.6±10.6%였다. 데이터는 P. aeruginosa가 상피 창자 장벽에 더 중요한 손상을 일으켰다는 것을 강조하고, 그러므로, 벌레는 그들의 장 투과성에 있는 극적인 증가를 전시했습니다. 이 결과에 기초하여, FITC-dextran은 장층을 통해 쉽게 침투할 수 있으므로 P. aeruginosa는 DIM의 효과를 스크리닝하기 위한 잠재적인 후보 병원체로 선택되었다. E. faecalis는 세포외 과산화수소와 과산화수소를 생성할 수 있는 장내 병원체이지만, 이는 대장 상피 세포 DNA15를손상시키며, 경우에 따라서는, E. faecalis는 또한 일부 병원체에 대하여 박테리아를 생성하는 능력 때문에 잠재적인 probiotic 박테리아로 알려져 있습니다25,26. probiotic의 기능 상피 표면에 준수 포함, 인간의 위장에서 지 속성, 면역 자극 및 장 병원 체에 대 한 길 항 활동26. 따라서 E. faecalis로 배양된 웜의 장 투과성은 차량 제어 웜에 비해 변하지 않았습니다. 이 결과는 감염의 양이 형광 강도의 증가에 의해 연구 될 수 있음을 보여주고, P. aeruginosa는 다른 균주보다 더 많은 장 투과성을 야기한다.
도 2는 웜 체내에서 FITC-덱스트론 형광의 강도에 기초하여 살아있는 및 열 불활성화 된 P. aeruginosa PAO1의 차이를 나타낸다. 형광 이미지와 통계 데이터는 병원체가 열 불활성화 후 선충에 어떤 독성을 유발할 수 없음을 나타냅니다. P. aeruginosa는 많은동물27에치명적인 강력한 세포외 세포 세포 세포 독소를 생산할 수 있습니다. 엑소톡신 A는 45°C ~ 60°C28에서가열하여 신속하게 폐지될 수 있다. 따라서 열 불활성화 P. aeruginosa는 벌레의 장 상피의 투과성을 손상시킬 수 없었습니다. P. aeruginosa PAO1 배양물의 상황은 장 투과성을 현저하게 손상시켰으며, 따라서 전체 P. aeruginosa 세포 대신에 배양 상상이 장 투과성 기능 장애를 유도하는 데 사용될 수있다 19. 상온제는 내독소, 외독소 A 및 리포폴리사카라이드(29)를 함유하며, 이들 성분은 세포 독성을 유도하는 것으로 알려져있다(30,31) 따라서, 상수의 이러한 구성 요소는 장 투과성에 영향을 미칠 수 있습니다, 우리는 C. elegans의장 투과성에 외독소와 리포 폴리 당류의 직접적인 효과를 확인하지 않았지만.
48 h에 대한 DIM 공동 처리는 P. aeruginosa 단일 치료와 비교하여 벌레의 내장 내부FITC-dextran 형광 강도를 현저하게 감소시켰습니다(도3C,D). 단방향 ANOVA 및 Tukey의 다중 비교 시험에 의한 통계 분석은 DIM으로 치료한 후, 평균 형광 강도가 P. aeruginosa-only치료의 형광 강도와 비교하여 유의하게 감소되었다는 것을 보여주었다. P. aeruginosa-만및 P. aeruginosa 플러스 DIM으로 처리된 벌레의 형광 강도는 각각 486.3±41.7 및 414.2±25.0%,이었다(도3E). 이 결과에 따라, DIM 세균 감염에 의해 발생 하는 장 투과성 기능 장애를 치료 하는 좋은 천연 제품으로 간주 될 수 있습니다. 이 결과는 DIM이 창자 세포의 세포 염증을 감쇠시킬 수 있음을 나타내었으며, 이는 장의 투과성을 감소시킵니다19. 이러한 결과는 마우스 모델에서 얻어진 결과와 유사하며, 이 결과 DIM은결장(32)에서염증의 현저한 감소를 보였다.

그림 1: C. 예쁜꼬마선충의 장 투과성에 대한 다른 박테리아의 영향. 밝은 필드, FITC 형광 (녹색 채널) 및 병합된 심상을 포함하여 벌레의 현미경 심상. FITC-dextran 먹이가 없는(A) 대장균 OP50의 현미경 이미지,(B)FITC-dextran 먹이가 있는 대장균, (C) P. aeruginosa PAO1 과 FITC-dextran 먹이, 및(D) E. e. faecalis KCTC3206 FITC-dextra. 배율 막대 = 1mm(흰색) 및 200 μm(검은색)입니다. 연령-동기화된 L4 유충을 대장균(A, B), P. aeruginosa(C) 및 E. 대변(D)으로 시드한 NGM 플레이트에서48시간 동안 배양하였다. 이어서, 웜을 FITC-dextran(B-D)을함유하는 플레이트로 옮겼고, 차량제어(A)를제외한. (E)다른 세균 치료의 FITC 형광 강도. FITC 형광의 높은 비율은 더 높은 창자 투과성을 표시했습니다. 열 및 오차 막대는 평균 ± SD. ***P < 0.001을 나타내며 차량 제어와 유의한 차이를 나타낸다. ###P < 0.001 P. aeruginosa PAO1 (ANOVA, n = 5)으로 공급되는 FITC-dextran 처리 웜과 유의한 차이. 이 그래프는 두 개의 독립적인 실험을 대표합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: C. 예쁜꼬마선충의장 투과성에 대한 살아있는 열 불활성화 P. aeruginosa PAO1의 효과. (A)살아있는 대장균 OP50에서 FITC-dextran 먹이없이,(B)살아있는 대장균과 FITC-dextran 먹이,(C)살아있는 P. aeruginosa PAO1 FITC-dextran 먹이, 및(D)열 불활성화 P. aeruginosa FITC-dextran 공급. 배율 막대 = 1mm(흰색) 및 200 μm(검은색)입니다. 연령-동기화된 L4 유충을 NGM 플레이트에서 48시간 동안 배양하였고, 살아있는 대장균(A, B),살아있는 P. aeruginosa (C),및 열불화 P. aeruginosa (D). 이어서, 웜을 FITC-dextran(B-D)을함유하는 플레이트로 옮겼고, 차량제어(A)를제외한. (E)FITC 형광 강도는 살아있는 열 불활성화 P. aeruginosa PAO1을 비교하였다. 열 및 오차 막대는 평균 ± SD. ***P < 0.001 및 **P < 0.01을 나타내며 차량 제어와 유의한 차이를 나타낸다. ###P < 0.001 라이브 P. aeruginosa PAO1 (ANOVA, n = 5)으로 공급되는 FITC-dextran 처리 웜과 유의한 차이. 이 그래프는 두 개의 독립적인 실험을 대표합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
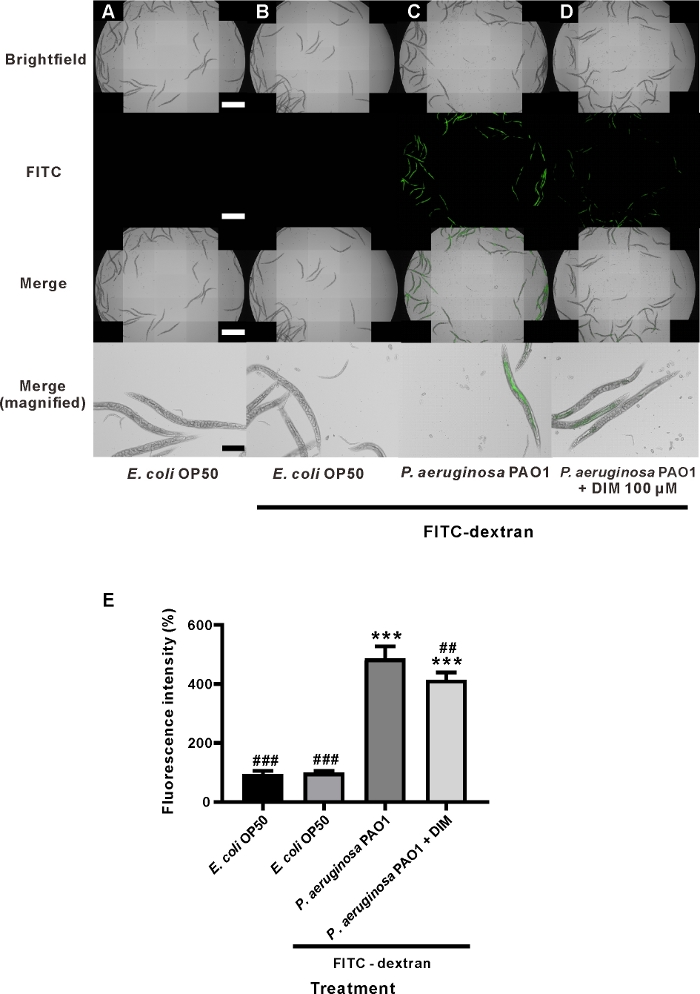
그림 3: C. 예쁜꼬마선충의 장 투과성에 대한 DIM의 영향은 P. aeruginosa에게공급되었다. FITC-dextran 먹이가 없는(A) 대장균 OP50의 현미경 이미지,(B)FITC-dextran 먹이가 있는 대장균, (C) P. aeruginosa PAO1 과 FITC-dextran 급식,(D) Aeruginosa 및 DIM (100 μM) FIT와 의 한 모유 수유. 배율 막대 = 1mm(흰색) 및 200 μm(검은색)입니다. 연령-동기화된 L4 유충은 살아있는 대장균(A, B),살아있는 P. aeruginosa (C),살아있는 P. aeruginosa 및 DIM(D)로시드된 NGM 플레이트에서 48시간 동안 배양하였다. 이어서, 웜을 FITC-dextran(B-D)을함유하는 플레이트로 옮겼고, 차량제어(A)를제외한. (E)FITC 형광 강도는 C. 예쁜꼬마선충의 장 투과성이 DIM에 의해 영향을 받았음을 나타낸다. 열 및 오차 막대는 평균 ± SD. ***P < 0.001을 나타내며 차량 제어와 유의한 차이를 나타낸다. ###P < 0.001 및 ##P < 0.01 P. aeruginosa PAO1 (ANOVA, n = 5)으로 공급되는 FITC-dextran 처리 웜과 유의한 차이. 이 그래프는 두 개의 독립적인 실험을 대표합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
자동 형광 현미경 및 정량적 이미지 분석을 결합한 C. elegans의 창자 투과성을 결정하는 이 새로운 방법을 활용하여 장내 미생물 이나 화학 물질에 의한 차이를 생체 내에서, 특히 C. elegans 장에서 결정할 수 있습니다. 이 프로토콜은 장 투과성 조사에 유용하며 편리하고 쉬운 조작으로 인해 스트레스 조건 및 형태 학적 검사에서 반응성 산소 종 (ROS) 측정과 같은 많은 작업에 적용 할 수 있습니다. 더욱이,이 방법은 C. elegans의 여러 병원체에 대한 치료 및 예방 방법의 효과를 결정하는 데 사용할 수 있습니다. 특히, 유해하고 유용한 박테리아를 모두 포함하는 상이한 세균 균주의 기전을 조사하는 효율적인 프로토콜일 수 있다. 일부 병원체와 유사한 구조를 가진 프로바이오틱 박테리아는 숙주33,34에다른 효과를 발휘한다. 이 절차는 박테리아가 이용하고 있는 어떤 기계장치 및 표적으로 한 기질이 세포외 또는 세포내로 분비될 수 있는 곳에 평가에서 지원할 수 있습니다. 또한,이 방법은 열처리가 병원체 불활성화에 중요한 역할을한다는 가설을 강화하는 데 도움이 될 수 있습니다.
그러나이 절차 중에는 몇 가지 어려움이 있습니다. 첫째, 각 플레이트의 웜 수는 통계적으로 의미 있는 결과와 강력한 웜 탐지에 중요하므로 70-90% 동률(우물당 최소 50개의 웜)을 사용하는 것이 좋습니다. 따라서 적절한 웜을 얻기 위해 시험 실험을 수행해야 합니다. 둘째, 플레이트 특성은 특히 바닥 재질에 대한 이미지 품질 및 강도 결정에 영향을 미치는 중요한 요소 중 하나입니다. 일부 고급 실험에서 유리 바닥은 우수한 광학 품질로 인해 형광을 측정하는 데 가장 적합한 옵션입니다. 품질이 유리 바닥만큼 높지 않지만 높은 가격 때문에 폴리스티렌 바닥이 자주 사용됩니다. 마지막으로, C. 예쁜꼬마선충의 플레이트 코팅 방법은 최적화가 필요합니다. 본 실험에서, 형광 마운팅 배지는 조직 단면의 라벨링을 보존하고 향상시킬 수 있기 때문에 적용되었지만, 플레이트 바닥의 웜을 제대로 고칠 수 없다.
이 프로토콜에는 제한이 있습니다. C. 예쁜꼬마충은 선충이기 때문에 인간의 장세포 단층과 포유류에서의 평가와 같은 추가 실험을 수행해야합니다. 이 방법에서는, C. 예쁜꼬마선충의 자형학적 변화가 병원성 박테리아 및 화학물질을 공급한 것으로 결정되었다. 따라서, 장 내 박테리아의 병원 성 또는 probiotic 효과 기본 분자 및 유전 메커니즘 뿐만 아니라 화학 물질의 치료 효과 더 해명 한다. 병원성 세균 감염 및 화학 물질의 치료 효과에 의해 가해지는 특정 신호 경로는 다양한 돌연변이 박테리아와 돌연변이 웜을 모두 사용하여 평가될 수 있다. 또한, 장 내 박테리아의 병원 성 및 probiotic 효과 담당 하는 화학 구성 요소를 식별 하는 추가 심층 연구 도움이 될 것 이다.
여기에서는 FITC-dextran 공급을 사용하여 다른 박테리아와 화학 물질로 처리된 C. 예쁜꼬마선충의 장 내 침투성을 측정하기 위한 실험 프로토콜을 보고합니다. 우리는 이 프로토콜이 장내 미생물과 장 건강 사이의 상호 작용을 연구하는 것과 같은 기본적인 생물학적 연구에 도움이 될 뿐만 아니라 장 건강 문제의 예방 및 치료를 위한 프로바이오틱스와 건강 기능 식품의 개발에 도움이 될 것이라고 믿습니다.
공개
저자는 공개 할 것이 없다.
감사의 말
본 연구는 한국과학기술원 내연구보조금(2E29563)의 지원을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| 3,3’-diindolylmethane | Sigma | D9568 | |
| 90×15 mm Petri dishes | SPL Life Sciences, South Korea | 10090 | |
| 60×15 mm Petri dishes | SPL Life Sciences, South Korea | 10060 | |
| Bactor Agar | Beckton Dickinson | REF. 214010 | |
| Formaldehyde solution | Sigma | F1635 | |
| Brain Heart Infusion (BHI) | Becton Dickinson | REF. 237500 | |
| Caenorhabditis elegans N2 | Caenorhabditis Genetics Center (CGC) | Wild type | |
| Cholesterol | Sigma | C3045 | |
| Costa Assay Plate, 96 Well Black With Clear Flat Bottom Non-treated, No Lid Polystyrene | Corning Incorporated | REF. 3631 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Enterococcus faecalis KCTC 3206 | Korean Collection for Type Culture | KCTC NO. 3206 | Falcutative anaerobic |
| Escherichia coli OP50 | Caenorhabditis Genetics Center (CGC) | ||
| Fluorescein isothiocyanate - dextran | Sigma | FD10S | |
| Harmony software | PerkinElmer | verson 3.5 | |
| Luria-Bertani LB medium | Merck | VM743185 626 1.10285.5000 | |
| Magnesium sulfate heptahydrate | Fisher Bioreagents | BP2213-1 | |
| Fluoromount aqueous mounting medium | Sigma | F4680 | |
| Operetta CLS High-Content Analysis System | PerkinElmer | HH16000000 | |
| Peptone | Merck | EMD 1.07213.1000 | |
| Pseudomonas aeruginosa PA01 | Korean Collection for Type Culture | KCTC NO. 1637 | |
| Sodium Chloride | Fisher Bioreagents | BP358-1 | |
| Stereo Microscope | Nikon, Japan | SMZ800N | |
| Yeast extract | Becton Dickinson | REF. 212750 |
참고문헌
- Bischoff, S. C., et al. Intestinal permeability–a new target for disease prevention and therapy. BMC Gastroenterology. 14 (1), 189(2014).
- Peng, L., Li, Z. R., Green, R. S., Holzman, I. R., Lin, J. Butyrate enhances the intestinal barrier by facilitating tight junction assembly via activation of AMP-activated protein kinase in Caco-2 cell monolayers. The Journal of Nutrition. 139 (9), 1619-1625 (2009).
- Ren, M., et al. Developmental basis for intestinal barrier against the toxicity of graphene oxide. Particle Fibre Toxicology. 15 (1), 26(2018).
- Kissoyan, K. A. B., et al. Natural C. elegans microbiota protects against infection via production of a cyclic lipopeptide of the viscosin group. Current Biology. 29 (6), 1030-1037 (2019).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS Genetics. 12 (7), 1006135(2016).
- Escorcia, W., Ruter, D. L., Nhan, J., Curran, S. P. Quantification of lipid abundance and evaluation of lipid distribution in Caenorhabditis elegans by Nile red and oil red O staining. Journal of Visualized Experiments. (133), e57352(2018).
- Johnson, T. E. Advantages and disadvantages of Caenorhabditis elegans for aging research. Experimental Gerontology. 38 (11-12), 1329-1332 (2003).
- Culetto, E., Sattelle, D. B. A role for Caenorhabditis elegans in understanding the function and interactions of human disease genes. Human Molecular Genetics. 9 (6), 869-877 (2000).
- Hubbard, E. J. A. Caenorhabditis elegans germ line: A model for stem cell biology. Developmental Dynamics. 236 (12), 3343-3357 (2007).
- Park, M. R., et al. Probiotic Lactobacillus fermentum strain JDFM216 stimulates the longevity and immune response of Caenorhabditis elegans through a nuclear hormone receptor. Scientific Reports. 8, 7441(2018).
- Kim, Y., Mylonakis, E. Caenorhabditis elegans immune conditioning with the probiotic bacterium Lactobacillus acidophilus strain NCFM enhances gram-positive immune responses. Infection and Immunity. 80 (7), 2500-2508 (2012).
- Nakagawa, H., et al. Effects and mechanisms of prolongevity induced by Lactobacillus gasseri SBT2055 in Caenorhabditis elegans. Aging Cell. 15 (2), 227-236 (2016).
- Dinh, J., et al. Cranberry extract standardized for proanthocyanidins promotes the immune response of Caenorhabditis elegans to Vibrio cholerae through the p38 MAPK pathway and HSF-1. PLoS One. 9 (7), 103290(2014).
- Vayndorf, E. M., Lee, S. S., Liu, R. H. Whole apple extracts increase lifespan, healthspan and resistance to stress in Caenorhabditis elegans. Journal of Functional Foods. 5 (3), 1236-1243 (2013).
- Huycke, M. M., Abrams, V., Moore, D. R. Enterococcus faecalis produces extracellular superoxide and hydrogen peroxide that damages colonic epithelial cell DNA. Carcinogenesis. 23 (3), 529-536 (2002).
- Laughlin, R. S., et al. The key role of Pseudomonas aeruginosa PA-I lectin on experimental gut-derived sepsis. Annals of Surgery. 232 (1), 133-142 (2000).
- Huang, Z., et al. 3,3'-Diindolylmethane decreases VCAM-1 expression and alleviates experimental colitis via a BRCA1-dependent antioxidant pathway. Free Radical Biology, Medicine. 50 (2), 228-236 (2011).
- Jeon, E. J., et al. Effect of Oral Administration of 3,3'-Diindolylmethane on Dextran Sodium Sulfate-Induced Acute Colitis in Mice. Journal of Agricultural and Food Chemistry. 64, 7702-7709 (2016).
- Kim, J. Y., et al. 3,3'-Diindolylmethane improves intestinal permeability dysfunction in cultured human intestinal cells and the model animal Caenorhabditis elegans. Journal of Agricultural and Food Chemistry. 67 (33), 9277-9285 (2019).
- Lee, S. Y., Kang, K. Measuring the Effect of Chemicals on the Growth and Reproduction of Caenorhabditis elegans. Journal of Visualized Experiments. (128), e56437(2017).
- Schmeisser, S., et al. Neuronal ROS signaling rather than AMPK/sirtuin-mediated energy sensing links dietary restriction to lifespan extension. Molecular Metabolism. 2 (2), 92-102 (2013).
- Lee, S. Y., Kim, J. Y., Jung, Y. J., Kang, K. Toxicological evaluation of the topoisomerase inhibitor, etoposide, in the model animal Caenorhabditis elegans and 3T3-L1 normal murine cells. Environmental Toxicology. 32 (6), 1836-1843 (2017).
- Sutphin, G. L., Kaeberlein, M. Measuring Caenorhabditis elegans life span on solid media. Journal of Visualized Experiments. (27), e1152(2009).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019(2012).
- Al Atya, A. K., et al. Probiotic potential of Enterococcus faecalis strains isolated from meconium. Frontiers in Microbiology. 6, 227(2015).
- Hanchi, H., Mottawea, W., Sebei, K., Hammami, R. The Genus Enterococcus: Between Probiotic Potential and Safety Concerns-An Update. Frontiers in Microbiology. 9, 1791(2018).
- Pollack, M. The role of exotoxin A in pseudomonas disease and immunity. Reviews of Infectious Diseases. 5, Suppl 5 979-984 (1983).
- Vasil, M. L., Liu, P. V., Iglewski, B. H. Temperature-dependent inactivating factor of Pseudomonas aeruginosa exotoxin A. Infection and Immunity. 13 (5), 1467-1472 (1976).
- Horii, T., Muramatsu, H., Monji, A., Miyagishima, D. Release of exotoxin A, peptidoglycan and endotoxin after exposure of clinical Pseudomonas aeruginosa isolates to carbapenems in vitro. Chemotherapy. 51 (6), 324-331 (2005).
- Kirikae, T., et al. Biological characterization of endotoxins released from antibiotic-treated Pseudomonas aeruginosa and Escherichia coli. Antimicrobial Agents and Chemotherapy. 42 (5), 1015-1021 (1998).
- Morlon-Guyot, J., Mere, J., Bonhoure, A., Beaumelle, B. Processing of Pseudomonas aeruginosa exotoxin A is dispensable for cell intoxication. Infection and Immunity. 77 (7), 3090-3099 (2009).
- Kim, Y. H., et al. 3,3'-diindolylmethane attenuates colonic inflammation and tumorigenesis in mice. Inflammatory Bowel Diseases. 15 (8), 1164-1173 (2009).
- Kanmani, P., et al. Probiotics and its functionally valuable products-a review. Critical Reviews in Food Science and Nutrition. 53 (6), 641-658 (2013).
- Nguyen, M. T., Gotz, F. Lipoproteins of Gram-Positive Bacteria: Key Players in the Immune Response and Virulence. Microbiology and Molecular Biology Reviews. 80 (3), 891-903 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유