Method Article
Mesurer les effets des bactéries et des produits chimiques sur la perméabilité intestinale de Caenorhabditis elegans
Dans cet article
Résumé
Ce protocole décrit comment mesurer la perméabilité intestinale de Caenorhabditis elegans. Cette méthode est utile pour la recherche biologique fondamentale sur la santé intestinale liée à l'interaction entre les bactéries intestinales et leur hôte et pour le dépistage pour identifier les agents probiotiques et chimiques pour guérir le syndrome de l'intestin qui fuit et les maladies inflammatoires de l'intestin.
Résumé
Chez les organismes vivants, l'hyperperméabilité intestinale est un symptôme grave qui conduit à de nombreuses maladies inflammatoires de l'intestin (MII). Caenorhabditis elegans est un modèle animal non-mammalien qui est largement utilisé comme un système d'analyse en raison de sa courte durée de vie, la transparence, la rentabilité, et le manque de questions d'éthique animale. Dans cette étude, une méthode a été développée pour étudier les effets de différentes bactéries et 3,3'-diindolylmethane (DIM) sur la perméabilité intestinale de C. elegans avec un système d'analyse d'image à haut débit. Les vers ont été infectés par différentes bactéries intestinales ou cotraités avec DIM pendant 48 h et nourris avec de la fluorescéine isothiocyanate (FITC)-dextran pendant la nuit. Ensuite, la perméabilité intestinale a été examinée en comparant les images de fluorescence et l'intensité de fluorescence à l'intérieur des corps de ver. Cette méthode peut également avoir le potentiel d'identifier les bactéries intestinales probiotiques et pathogènes qui affectent la perméabilité intestinale dans le modèle animal et est efficace pour examiner les effets des produits chimiques nocifs ou favorisant la santé sur la perméabilité intestinale et la santé intestinale. Cependant, ce protocole a également quelques limitations considérables au niveau génétique, particulièrement pour déterminer quels gènes sont modifiés pour commander la maladie, parce que cette méthode est principalement employée pour la détermination phénotypique. En outre, cette méthode se limite à déterminer exactement quels substrats pathogènes causent l'inflammation ou augmentent la perméabilité des intestins des vers pendant l'infection. Par conséquent, d'autres études approfondies, y compris l'étude du mécanisme génétique moléculaire à l'aide de bactéries mutantes et de nématodes ainsi que l'analyse des composants chimiques des bactéries, sont nécessaires pour évaluer pleinement la fonction des bactéries et des produits chimiques dans la détermination de la perméabilité intestinale.
Introduction
La perméabilité intestinale est considérée comme l'un des principaux obstacles liés au microbiote intestinal et à l'immunité muqueuse et est susceptible d'être affectée par plusieurs facteurs, tels que les modifications du microbiote intestinal, l'affaiblissement épithélial ou les altérations de la couche de muqueuse1. Des articles récents ont rapporté des protocoles efficaces pour mesurer la perméabilité intestinale des cellules intestinales humaines cultivées en analysant les taux de flux de fluorescence à travers la couche de cellules intestinales2, mais moins d'articles de recherche présentent une procédure appropriée pour mesurer la perméabilité intestinale dans les nématodes, en particulier chez C. elegans, en utilisant la coloration FITC-dextran.
Il existe deux protocoles représentatifs pour mesurer la perméabilité intestinale chez C. elegans à l'aide du rouge du Nil3 et de l'erioglaucine disodium (ou de l'assème schtroumpf)4,5. Dans ce protocole, nous avons utilisé FITC-dextran (poids moléculaire moyen 10 000), qui a un poids moléculaire beaucoup plus élevé que le rouge nil (MW 318,37) et le disodium erioglaucine (MW 792,85). FITC-dextran est plus semblable que le rouge du Nil ou les colorants disodium erioglaucine aux nutriments macromoléculaires réels tels que les hydrates de carbone, qui sont absorbés par la couche intestinale. La perméabilité intestinale de C. elegans nourris avec de l'erioglaucine disodium (colorant bleu Schtroumpf) peut être facilement évaluée sans microscopie de fluorescence. Cependant, dans l'analyse schtroumpf, l'analyse quantitative de la perméabilité intestinale est difficile en raison de l'absence de normalisation et doit être évaluée manuellement4,5. Dans le cas de l'assidu rouge du Nil, le rouge du Nil tache également des gouttelettes lipidiques dans les cellules, ce qui peut interférer avec la détermination exacte de la perméabilité intestinale chez C. elegans6. Les protocoles actuels permettent une analyse quantitative rapide et précise de la perméabilité intestinale chez C. elegans traités avec diverses bactéries intestinales et produits chimiques tout en évitant la coloration lipidique non spécifique.
C. elegans est un modèle typique dans les domaines biologiques en raison de son prix abordable, manipulation facile, questions limitées d'éthique animale, et la durée de vie courte, ce qui est bénéfique pour l'expérimentation rapide7. En particulier, après la publication de l'ensemble du génome de C. elegans, près de 40 % des gènes du génome de C. elegans se sont avérés orthologues pour les gènes qui causent des maladies humaines8. En outre, le corps transparent permet l'observation à l'intérieur de l'organisme, ce qui est avantageux pour la recherche d'événements cellulaires et pour les applications de fluorescence en biologie cellulaire, par exemple, la coloration des cellules souches avec DAPI ou immunohistochimie9. C. elegans est souvent utilisé comme animal expérimental pour étudier l'interaction entre le microbiote intestinal et l'hôte; en outre, C. elegans est utilisé pour dépister les bactéries probiotiques favorisant la santé10,11,12 ainsi que des produits chimiques alimentaires favorisant la santé intestinale13,14.
Pseudomonas aeruginosa et Enterococcus faecalis sont des bactéries intestinales bien connues qui affectent négativement le système gastro-intestinal, en particulier les cellules épithéliales du côlon du tractus intestinal15,16. Par conséquent, la mesure de la perméabilité intestinale déclenchée par ces bactéries est nécessaire pour le dépistage et le développement de nouveaux médicaments qui peuvent récupérer et réduire les dommages causés par l'inflammation bactérienne et l'infection. Dans ce protocole, nous avons testé les effets de ces bactéries intestinales sur la perméabilité intestinale de C. elegans.
Nous rapportons également un protocole optimisé pour tester des produits chimiques sur la perméabilité intestinale de C. elegans. À cette fin, nous avons utilisé 3,3'-diindolylméthane (DIM) comme un produit chimique modèle parce que DIM est un composé de métabolite bioactif dérivé de l'indole-3-carbinol, qui est présent dans les usines alimentaires Debrasica, et a été rapporté pour avoir des effets thérapeutiques sur les MII chez les souris17,18. En outre, nous avons récemment découvert que DIM améliore le dysfonctionnement de perméabilité intestinale dans les deux cellules intestinales humaines cultivées ainsi que le modèle nématode C. elegans19.
Dans cette étude, nous avons utilisé trois conditions expérimentales différentes. Tout d'abord, nous avons mesuré les effets des différentes bactéries, P. aeruginosa et E. faecalis, sur la perméabilité intestinale (Figure 1). Deuxièmement, nous avons mesuré les effets de P. aeruginosa vivant et inactivé par la chaleur sur la perméabilité intestinale (Figure 2). Troisièmement, nous avons mesuré les effets du DIM (un modèle chimique) sur la perméabilité intestinale de C. elegans nourris avec P. aeruginosa (Figure 3).
L'objectif de cette étude était de développer des protocoles optimisés qui mesurent la perméabilité intestinale de C. elegans, qui est modifié par le traitement avec diverses bactéries intestinales ainsi qu'avec des produits chimiques.
Protocole
1. Préparation de P. aeruginosa PAO1 et Escherichia coli OP50 Culture
- Préparer 500 ml de luria-Bertani stérilisé (LB) moyen (tableau 1) et inoculer une seule colonie de P. aeruginosa dans le milieu. Incuber la culture de 14 à 15 h à 37 oC avec une vitesse de secousse de 150 tr/min.
- Répartir également la culture bactérienne en deux tubes centrifugeuses de 500 ml et centrifuger les tubes à 3 220 x g à 4 oC pendant 30 min.
- Retirez le supernatant jusqu'à ce que le volume soit de 50 ml (un dixième du volume initial) et suspendez à nouveau la pastille bactérienne.
- Conserver la culture bactérienne concentrée à 4 oC jusqu'à l'utilisation. La période de stockage de la culture P. aeruginosa peut être jusqu'à 1 mois, mais la culture fraîche est meilleure pour induire des dommages intestinaux.
REMARQUE: Le protocole peut être mis en pause ici. En plus de l'ensemble des bactéries vivantes, le supernatant de la culture bactérienne peut être utilisé pour tester les effets de la bactérie intestinale19. - Pour préparer E. coli OP50, culture E. coli OP50 dans le milieu DYT (tableau 1) et appliquez ensuite des étapes similaires à celles décrites ci-dessus, mais diminuez le volume à un sixième du volume initial. Par exemple, si le volume initial est de 500 ml, après avoir enlevé le supernatant, le volume restant est d'environ 83 ml.
REMARQUE: Le protocole peut être mis en pause ici.
2. Préparation de Enterococcus faecalis KCTC 3206 Culture
- Préparer 500 ml de bouillon d'infusion de cœur du cerveau stérilisé (BHI) (tableau 1).
- Inoculer une colonie en 500 ml de bouillon DE BHI et incuber la culture pendant 14 à 15 h dans un incubateur secouant à 37 oC et 150 tr/min.
- Répartir également la culture bactérienne en deux tubes centrifugeuses de 500 ml et centrifuger les tubes à 3 220 x g à 4 oC pendant 30 min.
- Retirez le supernatant jusqu'à ce que le volume soit de 50 ml (un dixième du volume initial) et suspendez la pastille.
- Conserver la culture bactérienne concentrée à 4 oC jusqu'à l'utilisation. La culture fraîche est meilleure pour tester les effets sur la perméabilité intestinale.
REMARQUE: Le protocole peut être mis en pause ici.
3. Préparation des cultures E. coli OP50 et P. aeruginosa PAO1 inactivées par la chaleur
- Culture et récolte des bactéries telles que décrites ci-dessus (étapes 1.1-1.3).
- Inactiver la culture E. coli OP50 ou P. aeruginosa PAO1 comme décrit précédemment20,21,22. Pour l'inactivation de la chaleur, incuber les bactéries en suspension à 65 oC (bain d'eau) pendant 30 min.
- Refroidir la culture bactérienne concentrée à température ambiante et la conserver à 4 oC jusqu'à ce qu'elle soit utilisée. La période de stockage peut aller jusqu'à 1 mois.
REMARQUE: Le protocole peut être mis en pause ici.
4. Préparation des plaques moyennes de croissance de nématode (NGM) pour tester les effets de différentes bactéries sur la perméabilité intestinale de C. elegans
- Déposer 1,25 g de peptone, 1,5 g de NaCl, 8,5 g d'agar, un agitateur magnétique et 487,5 ml d'eau distillée dans une bouteille en verre de 500 ml(tableau 1).
- Bien mélanger le mélange, autoclaver le mélange pendant 15 min à 121 oC et laisser refroidir le mélange à 55 oC dans un bain d'eau pendant 30 min.
- Retirer le milieu du bain d'eau, ajouter les composants (0,5 ml de 1 M CaCl2, 0,5 ml de cholestérol, 0,5 ml de MgSO4, 12,5 mL de KPO4) (tableau 1) au NGM, et bien mélanger.
REMARQUE: Tous les composants individuels doivent être autoclaved excepté le cholestérol (dissous dans l'éthanol absolu), et chaque étape expérimentale doit être effectuée sur un banc propre. - Distribuer 20 ml de NGM à chaque plat Petri de 90 x 15 mm et laisser l'agar se solidifier sur un banc propre à température ambiante (environ 20 oC). Les plaques NGM peuvent être stockées jusqu'à un mois à 4 oC.
REMARQUE: Le protocole peut être mis en pause ici. Les plaques NGM utilisées pour la coloration FITC-dextran ont été préparées par la même procédure (à partir des étapes 4.1-4.3). 10 mL de NGM ont été distribués à chaque plat Petri de 60 x 15 mm et ont pu se solidifier sur un banc propre à température ambiante (environ 20 oC). - Retirez la culture bactérienne du réfrigérateur à 4 oC et vortexz la culture à fond avant de répandre la culture sur les plaques NGM.
- Ajoutez un total de 800 L de la culture bactérienne à chaque plaque NGM fraîche, et laissez les plaques sécher dans un incubateur de 20 oC pendant la nuit.
REMARQUE: Pour la première expérience (Figure 1), deux plaques NGM avec E. coli OP50, une plaque NGM avec P. aeruginosa PAO1, et une plaque NGM avec E. faecalis KCTC3206 ont été préparées. Pour la deuxième expérience (Figure 2), deux plaques NGM avec E. coli OP50 vivant, une plaque NGM avec P. aeruginosa PAO1 vivant, et une plaque NGM avec P. aeruginosa PAO1 inactivé par la chaleur ont été préparées.
5. Préparation des plaques NGM pour tester les effets d'un produit chimique (DIM) sur la perméabilité intestinale de C. elegans Fed avec P. aeruginosa
- Ajouter 0,5 g de peptone, 0,6 g de NaCl, 195 ml d'eau distillée, un agitateur magnétique et 6,8 g d'agar dans une bouteille en verre de 500 ml (ngM agar).
- Ajouter 0,5 g de peptone, 0,6 g de NaCl, 195 ml d'eau distillée et un agitateur magnétique sans agar dans une autre bouteille en verre de 500 ml (bouillon NGM).
- Autoclavez les deux bouteilles (à partir des marches 5.1'5.2), une bouteille en verre vide de 100 ml, et une bouteille en verre vide de 500 ml pendant 15 min à 121 oC. Ensuite, laissez le milieu contenant des bouteilles refroidir jusqu'à 55 oC dans le bain d'eau pendant 30 min. Gardez le milieu de l'agar dans le bain d'eau et retirez la bouteille contenant du bouillon (à partir de l'étape 5.2) pour l'étape suivante.
- Ajouter les produits chimiques additifs au bouillon NGM : 0,4 ml de 1 M CaCl2, 0,4 mL de cholestérol dans l'éthanol (mL), 0,4 mL de 1 M MgSO4 et 10 ml de 1 M KPO4 (tous ces composants doivent être stérilisés en dehors du cholestérol dans l'éthanol). Ensuite, remuer le mélange à fond à l'intiser à 55 oC.
- Étiquetez la bouteille en verre vide autoclaved de 500 mL avec du sulfoxide de diméthyle (DMSO) et la bouteille en verre vide autoclaved de 100 ml avec DIM.
- Transférer 50 ml de bouillon NGM dans la bouteille de 100 ml étiquetée DIM. Ajouter 500 l de bouillon DIM de 20 mM dans la bouteille et bien mélanger.
REMARQUE: DIM est dissous en DMSO (20 mM DIM stock). - Retirez rapidement le milieu d'agar NGM du bain d'eau, ajoutez 50 ml du milieu d'agar NGM dans la bouteille étiquetée DIM et mélangez soigneusement.
- Placer un aliquot de 20 ml de milieu NGM contenant du DIM dans chaque plat Petri de 90 mm x 15 mm. Environ cinq plaques NGM contenant du DIM peuvent être fabriquées à partir de cette étape.
REMARQUE: La concentration finale de DIM dans chaque plaque NGM sera de 100 M. - Pour préparer la plaque NGM contenant du DMSO, transférer 150 mL de bouillon NGM dans la bouteille de 500 mL étiquetée DMSO. Ajouter 1,5 ml de DMSO à la bouteille et bien mélanger.
- Ajouter 150 ml du milieu d'agar NGM à la bouteille étiquetée DMSO et bien mélanger.
- Placer un aliquot de 20 ml de milieu NGM contenant du DMSO dans chaque plat Petri de 90 mm x 15 mm. Une quinzaine de plaques NGM contenant du DMSO peuvent être fabriquées à partir de cette étape.
REMARQUE: La concentration finale de DMSO dans chaque plaque NGM sera de 0,5%. - Solidifiez les assiettes à température ambiante pendant au moins 3 h et conservez-les à 4 oC jusqu'à l'utilisation.
REMARQUE: Le protocole peut être mis en pause ici. - Retirer la culture E. coli OP50 ou P. aeruginosa PAO1 du réfrigérateur à 4 oC (à partir de l'étape 1.4) et vortexer la culture correctement avant de se propager sur les plaques NGM.
- Placez 800 lL de la culture bactérienne E. coli OP50 ou P. aeruginosa PAO1 sur chaque plaque d'agar NGM fraîche et laissez les plaques sécher dans un incubateur de 20 oC pendant la nuit.
REMARQUE: Le protocole peut être mis en pause ici. Pour la troisième expérience (Figure 3), deux plaques NGM contenant du DMSO recouvertes de E. coli OP50 vivant, une plaque NGM contenant du DMSO recouverte de P. aeruginosa PAO1 vivant et une plaque NGM contenant du DIM recouverte de P. aeruginosa PAO1 vivant ont été préparées.
6. Préparation de C. elegans synchronisés par l'âge
- Cultivez des vers sur une plaque NGM solide et nourrissez-les avec E. coli OP50 jusqu'à ce que la population désirée soit atteinte.
- Synchroniser les œufs en utilisant soit la méthode de ponte chronométrée ou le traitement de la solution de blanchiment tel que décrit précédemment20,23,24.
7. Traitement des bactéries ou DIM et FITC-dextran Alimentation
- Incuber les œufs synchronisés selon l'âge à 20 oC pendant 64 h sur des plaques NGM complétées par des E. coli OP50 vivants comme nourriture.
- Laver la larve L4 synchronisée par l'âge avec un tampon S et les transférer (plus de 500 vers) dans les plaques NGM de traitement contenant différentes bactéries et produits chimiques (décrites dans NOTE après l'étape 4.6 et 5.14,). Incuber à 20 oC pendant 48 h.
REMARQUE: Le temps de traitement peut varier de 24 à 72 h, selon les bactéries et les produits chimiques utilisés. L'effet thérapeutique ou préventif du DIM peut également être évalué en prétraitant les vers avec des agents pathogènes, puis en traitant les vers avec dim (l'effet thérapeutique) ou en prétraitant les vers avec dim et en traitant ensuite avec des agents pathogènes (l'effet préventif)19. - Pour préparer les plaques complétées par le FITC-dextran, mélangez 2 mL d'E. coli OP50 inactivé par la chaleur avec 4 mg de FITC-dextran. Ensuite, diviser 100 l du mélange FITC-dextran et E. coli OP50 en vingt plaques d'agar NGM fraîches (60 mm x 15 mm) et laisser sécher les plaques pendant 1 h sur un banc propre.
REMARQUE: La concentration finale de FITC-dextran dans chaque plaque NGM sera de 20 g/mL. - Préparer cinq plaques NGM contenant e. coli OP50 sans FITC-dextran pour le traitement de contrôle du véhicule. À cette fin, répartir de 100 L d'E. coli OP50 inactivé par la chaleur à chaque plaque d'agar NGM fraîche (60 mm x 15 mm) et laisser sécher les plaques pendant 1 h sur un banc propre.
REMARQUE: Pour chaque expérience indépendante, quinze plaques NGM complétées par FITC-dextran et cinq plaques NGM sans FITC-dextran sont nécessaires. - Après 48 h de traitement (à partir de l'étape 7.2), lavez les vers avec S-buffer, transférez les vers dans les plaques complétées FITC-dextran et les plaques NGM sans FITC-dextran, et incubez les plaques pendant la nuit (14 à 15 h).
REMARQUE: Pour chaque groupe de traitement, 5 répliques de coloration FITC-dextran (ou alimentation de contrôle de véhicule) sont nécessaires. - Laver les vers avec S-buffer et leur permettre de ramper dans la plaque d'agar NGM frais pendant 1 h.
REMARQUE: Pour chaque expérience indépendante, un total de 20 plaques NGM fraîches sont nécessaires. Dans cette étape, vous pouvez utiliser la plaque NGM complétée sans ou avec E. coli OP50. - Ajouter 50 ll de solution de formaldéhyde de 4 % à chaque puits d'une plaque noire à fond plat de 96 puits. Transférer environ 50 vers de chaque plaque NGM dans chaque puits pour des mesures de fluorescence. Après 1 à 2 min, retirer soigneusement tout le formaldéhyde de chaque puits et ajouter 100 l de milieu de montage pour enrober les puits.
REMARQUE: Solution de formaldéhyde (4%) est utilisé pour immobiliser et fixer les vers. Pour chaque groupe de traitement, 5 puits (5 répliques) sont utilisés pour l'analyse d'images.
8. Imagerie C. elegans avec le système d'imagerie Operetta et la détermination de la perméabilité intestinale en mesurant la prise de fluorescence FITC-dextran
REMARQUE: La stéréomicroscopie fluorescente peut être utilisée pour l'analyse d'images au lieu du système Operetta.
- Capturez des images de fluorescence et mesurez l'intensité de la fluorescence à l'aide du système d'imagerie à contenu élevé opérette et analysez les images avec le logiciel Harmony.
- Dans le logiciel Harmony, appuyez sur l'icône Ouvrez le couvercle pour ouvrir le couvercle et mettre la plaque dans la machine.
- Configurez les paramètres.
- Cliquez sur Configurer, sélectionnez le type de plaque (96-bien corning à fond plat) et ajoutez les canaux (canaux de champ lumineux et EGFP).
- Ajuster la mise en page. Aller à la sélection Layout, puis sélectionnez Piste et ajuster les paramètres (première image à 1 m, nombre d'avions sont de 10, la distance est de 1 m).
- Sélectionnez l'un des puits de traitement et un champ de capture et appuyez sur Test pour vérifier si les images sont satisfaisantes dans la section expérience Run.
- Si les images sont satisfaisantes, retournez à la section Set up et appuyez sur l'icône Reset à la fin de l'écran. Ensuite, sélectionnez tous les puits cibles et un nombre approprié de champs de capture.
- Allez exécuter l'expérience à nouveau et entrez le nom de la plaque, puis appuyez sur Commencer à commencer le traitement.
- Pour mesurer l'intensité de la fluorescence, rendez-vous dans la section analyse d'image et saisisz l'image. Trouvez la cellule en choisissant le canal EGFP et la méthode B. Ajustez le seuil commun à 0,5, zone à 'gt;200 'm2, facteur de fractionnement à 3.0, seuil individuel à 0.18 et contraste à plus de 0.18. Ensuite, calculez les propriétés d'intensité et choisissez la moyenne comme sortie. Appuyez sur l'icône Appliquer pour enregistrer la configuration.
- Rendez-vous à la section Évaluation pour mesurer l'intensité en obtenant une carte thermique et une table de données. Définiz le paramètre de lecture sur les cellules — Cellule d'intensité EGFP Moyenne — Moyenne par Puits et commencez l'évaluation.
REMARQUE: Le protocole peut être mis en pause ici. - Pour extraire les données d'Operetta, cliquez sur le bouton Réglage et choisissez la gestion des données.
- Choisissez écrire l'archive, puis ouvrez la navigation et sélectionnez le fichier.
- Pour sélectionner le fichier, cliquez sur le petit signal au coin gauche, puis cliquez sur Mesure et choisissez le nom de l'assiette.
- Sélectionnez le fichier et cliquez sur OK.
- Sélectionnez le chemin pour enregistrer le fichier en cliquant sur le signal Parcourir sur le chemin actif.
- Cliquez sur Démarrer pour enregistrer le fichier de données.
REMARQUE: Le protocole peut être mis en pause ici.
9. Analyse statistique de la fluorescence du FITC-dextran de C. elegans
- Importer les données et calculer l'écart moyen et standard (SD) à l'aide d'un logiciel de statistiques.
- Analyser la différence significative avec l'analyse à sens unique de la variance (ANOVA) suivie du test de comparaison multiple de Tukey.
Résultats
Après l'incubation avec P. aeruginosa PAO1, C. elegans a montré une augmentation significative de la fluorescence FITC-dextran dans le corps de ver comparée à la fluorescence montrée après l'incubation avec les deux autres souches bactériennes (figure 1). Les intensités de fluorescence des vers nourris avec E. coli OP50, P. aeruginosa PAO1 et E. faecalis KCTC3206 étaient respectivement de 100,0 à 6,6, 369,7 et 105,6 à 10,6 %. Les données soulignent que P. aeruginosa a causé des dommages plus vitaux à la barrière intestinale épithéliale, et par conséquent, les vers ont montré une augmentation spectaculaire de leur perméabilité intestinale. Sur la base de ce résultat, FITC-dextran peut facilement pénétrer à travers la couche intestinale, de sorte que P. aeruginosa a été sélectionné comme un agent pathogène candidat potentiel pour le dépistage des effets de DIM. Bien que E. faecalis est un agent pathogène de l'intestin qui peut produire du superoxyde extracellulaire et du peroxyde d'hydrogène, qui endommagent l'ADN épithélial des cellules du côlon15, dans certains cas, E. faecalis est également connu comme une bactérie probiotique potentielle en raison de sa capacité à produire des bactériocines contre certains agents pathogènes25,26. Les fonctions d'un probiotique incluent l'adhérence aux surfaces épithéliales, la persistance dans le tractus gastro-intestinal humain, la stimulation immunitaire et l'activité antagoniste contre les pathogènes intestinaux26. Par conséquent, la perméabilité intestinale des vers incubés avec E. faecalis est demeurée inchangée par rapport à celle des vers de contrôle du véhicule. Ce résultat montre que la quantité de l'infection peut être étudiée par l'augmentation de l'intensité de fluorescence, et P. aeruginosa provoque plus de perméabilité intestinale que d'autres souches.
La figure 2 montre la différence entre P. aeruginosa PAO1 vivant et inactivé par la chaleur en fonction de l'intensité de la fluorescence du VER-dextran dans le corps des vers. Les images de fluorescence et les données statistiques indiquent que l'agent pathogène ne pouvait pas déclencher de toxicité aux nématodes après l'inactivation de la chaleur. P. aeruginosa peut produire de l'exotoxine A — une cytotoxine extracellulaire puissante qui est mortelle pour de nombreux animaux27. L'exotoxine A peut être rapidement abolie par le chauffage à 45 oC à 60 oC28. Par conséquent, P. aeruginosa inactivé par la chaleur n'a pas été en mesure d'endommager la perméabilité de l'épithélie intestinale des vers. Le supernatant de la culture P. aeruginosa PAO1 a considérablement endommagé la perméabilité intestinale, et donc, le supernatant de culture au lieu des cellules entières de P. aeruginosa peut être employé pour induire le dysfonctionnement de perméabilitéintestinal19. Le supernatant contient des endotoxines, exotoxineA, et lipopolysaccharides29, et ces composants sont connus pour induire la toxicité cellulaire30,31. Par conséquent, ces composants du supernatant peuvent affecter la perméabilité intestinale, bien que nous n'ayons pas vérifié l'effet direct des exotoxines et des lipopolysaccharides sur la perméabilité intestinale dans C. elegans.
Le cotraitement DIM de 48 h a considérablement diminué l'intensité de fluorescence FITC-dextran à l'intérieur des entrailles des vers par rapport au traitement unique de P. aeruginosa (Figure 3C,D). L'analyse statistique par ANOVA à sens unique et le test de comparaison multiple de Tukey ont montré qu'après traitement avec DIM, l'intensité moyenne de fluorescence a été significativement diminuée par rapport à l'intensité de fluorescence du traitement P. aeruginosa-seulement. Les intensités de fluorescence des vers traités par P. aeruginosa-seulement et P. aeruginosa plus DIM étaient de 486,3 à 41,7 et 414,2 à 25,0 %, respectivement (figure 3E). Sur la base de ce résultat, DIM peut être considéré comme un bon produit naturel pour guérir le dysfonctionnement de perméabilité intestinale causée par des infections bactériennes. Ce résultat a indiqué que DIM peut atténuer l'inflammation de cellules dans les cellules d'intestin, qui réduit la perméabilité de l'intestin19. Ce résultat est similaire aux résultats obtenus dans un modèle de souris, dans lequel DIM a montré une réduction significative de l'inflammation dans le côlon32.

Figure 1 : Les effets de différentes bactéries sur la perméabilité intestinale de C. elegans. Microscopie des images des vers, y compris le champ lumineux, la fluorescence FITC (canal vert), et les images fusionnées. Images de microscopie de vers de (A) E. coli OP50 sans alimentation FITC-dextran, (B) E. coli avec l'alimentation FITC-dextran, (C) P. aeruginosa PAO1 avec tITC-dextran feeding, et (D) E. faecalis KCTC3206 avec FITC-dextran feeding. Barre d'échelle de 1 mm (blanc) et de 200 m (noir). Les larves de L4 synchronisées selon l'âge ont été incubées pendant 48 h dans des plaques NGM ensemables d'E. coli (A, B), P. aeruginosa (C), et E. faecalis (D). Ensuite, les vers ont été transférés sur des plaques contenant FITC-dextran (B-D), à l'exception du contrôle du véhicule (A). (E) L'intensité de fluorescence FITC des différents traitements bactériens. Un pourcentage plus élevé de fluorescence FITC a indiqué une perméabilité intestinale plus élevée. Les colonnes et les barres d'erreur indiquent la moyenne de la dis . 'P 'lt; 0.001 pour une différence significative par rapport au contrôle du véhicule. P 'lt; 0.001 pour la différence significative des vers traités par FITC-dextran alimentés avec P. aeruginosa PAO1 (ANOVA, n ' 5). Ce graphique est représentatif de deux expériences indépendantes. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Les effets de P. aeruginosa PAO1 vivant et inactivé par la chaleur sur la perméabilité intestinale de C. elegans. Images de microscopie de vers de (A) vivant E. coli OP50 sans alimentation FITC-dextran, (B) ecoli vivant avec l'alimentation FITC-dextran, (C) vivant P. aeruginosa PAO1 avec l'alimentation FITC-dextran, et (D) p. aeruginosa inactivé par la chaleur avec FITC-dextran alimentation. Barre d'échelle de 1 mm (blanc) et de 200 m (noir). Les larves de L4 synchronisées selon l'âge ont été incubées pendant 48 h dans des plaques NGM ensemues d'E. coli vivants (A, B), de P. aeruginosa vivant (C), et de P. aeruginosa inactivé par la chaleur (D). Ensuite, les vers ont été transférés sur des plaques contenant FITC-dextran (B-D), à l'exception du contrôle du véhicule (A). (E) Intensité de fluorescence FITC comparant P. aeruginosa PAO1 vivant et inactivé par la chaleur. Les colonnes et les barres d'erreur indiquent la moyenne de la moyenne de la dis . P 'lt; 0.001 pour la différence significative des vers traités par FITC-dextran nourris avec p. aeruginosa PAO1 (ANOVA, n ' 5). Ce graphique est représentatif de deux expériences indépendantes. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
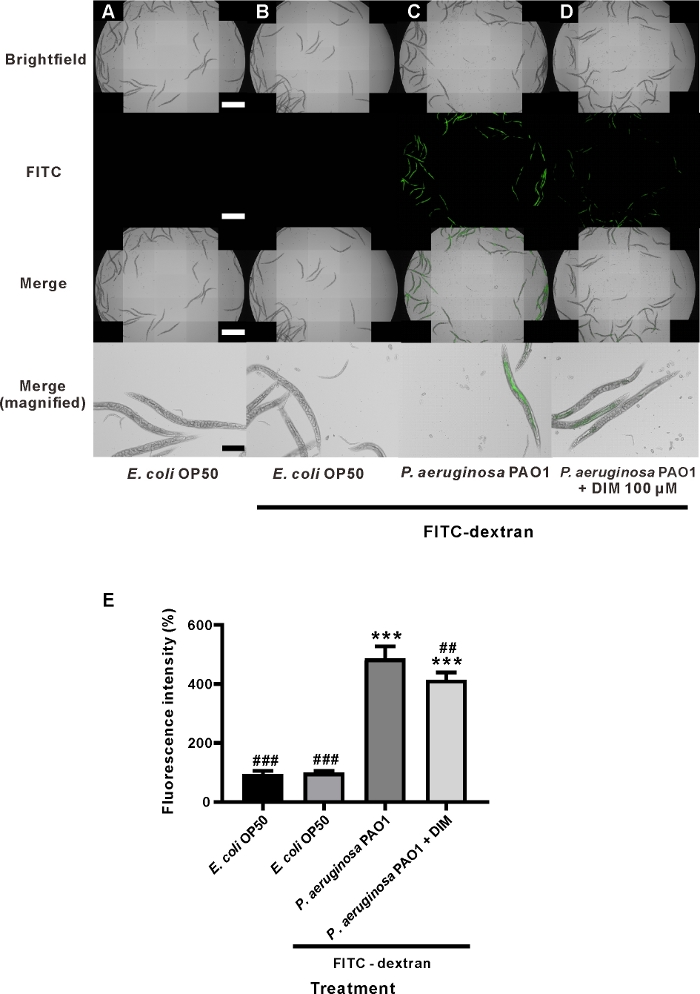
Figure 3 : L'effet du DIM sur la perméabilité intestinale de C. elegans a alimenté P. aeruginosa. Images de microscopie de vers de (A) E. coli OP50 sans alimentation FITC-dextran, (B) E. coli avec l'alimentation FITC-dextran, (C) P. aeruginosa PAO1 avec l'alimentation FITC-dextran, et (D) P. aeruginosa et DIM (100 M) cotraitement avec FITC-dextran alimentation. Barre d'échelle de 1 mm (blanc) et de 200 m (noir). Les larves de L4 synchronisées selon l'âge ont été incubées pendant 48 h dans des plaques NGM ensemues d'E. coli vivants (A, B), vivants P. aeruginosa (C), vivants P. aeruginosa et DIM (D). Ensuite, les vers ont été transférés sur des plaques contenant FITC-dextran (B-D), à l'exception du contrôle du véhicule (A). (E) L'intensité de fluorescence FITC indique que la perméabilité intestinale de C. elegans a été affectée par dim. Les colonnes et les barres d'erreur indiquent la moyenne de la dis . 'P 'lt; 0.001 pour une différence significative par rapport au contrôle du véhicule. P 'lt; 0.001 et 'P 'lt; 0.01 pour la différence significative des vers traités par FITC-dextran nourris avec P. aeruginosa PAO1 (ANOVA, n ' 5). Ce graphique est représentatif de deux expériences indépendantes. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
En utilisant cette nouvelle méthode pour déterminer la perméabilité intestinale chez C. elegans, qui combine la microscopie automatisée de fluorescence et l'analyse quantitative d'image, les différences causées par les micro-organismes ou les produits chimiques intestinaux peuvent être déterminées in vivo, spécifiquement dans l'intestin de C. elegans. Ce protocole est utile pour les études de perméabilité intestinale et applicable à de nombreuses tâches, telles que la détermination des espèces réactives d'oxygène (ROS) dans des conditions de stress et des examens morphologiques, en raison de sa commodité et de sa manipulation facile. En outre, cette méthode peut être utilisée pour déterminer les effets des méthodes thérapeutiques et préventives contre les pathogènes multiples chez C. elegans. En particulier, il peut s'agit d'un protocole efficace pour étudier les mécanismes de différentes souches bactériennes, y compris les bactéries nocives et utiles. Certains agents pathogènes et bactéries probiotiques avec des structures similaires exercent des effets différents sur l'hôte33,34. Cette procédure peut aider à évaluer quel mécanisme les bactéries utilisent et où les substrats ciblés peuvent être sécrétés extracellulairement ou intracellulairement. En outre, cette méthode peut également aider à renforcer l'hypothèse que le traitement thermique joue un rôle vital dans l'inactivation des agents pathogènes.
Cependant, il y a aussi quelques difficultés au cours de cette procédure. Tout d'abord, le nombre de vers dans chaque plaque est important pour des résultats statistiquement significatifs et une détection robuste des vers, de sorte que 70 à 90 % de la confluence (au moins 50 vers par puits) sont recommandées. Par conséquent, des expériences d'essai devraient être effectuées pour obtenir des vers appropriés. Deuxièmement, les propriétés de la plaque sont l'un des facteurs importants qui affectent la qualité des images et la détermination de l'intensité, en particulier pour le matériau inférieur. Dans certaines expériences avancées, un fond de verre est la meilleure option pour la mesure de la fluorescence en raison de son excellente qualité optique. Cependant, en raison du prix élevé, un fond de polystyrène est souvent utilisé, bien que la qualité n'est pas aussi élevé que celui du fond de verre. Enfin, les méthodes de revêtement de plaque pour C. elegans nécessitent une optimisation. Dans cette expérience, le milieu de montage fluorescent a été appliqué parce qu'il peut préserver et améliorer l'étiquetage des sections de tissu, mais il est incapable de fixer les vers sur le fond de la plaque correctement.
Ce protocole a des limites; comme C. elegans est un nématode, d'autres expériences, telles que l'évaluation dans les monocouches de cellules intestinales humaines et chez les mammifères, devraient être effectuées. Dans cette méthode, les changements phénotypiques dans C. elegans ont alimenté des bactéries pathogènes et des produits chimiques ont été déterminés. Par conséquent, les mécanismes moléculaires et génétiques sous-jacents aux effets pathogènes ou probiotiques des bactéries intestinales ainsi que les effets thérapeutiques des produits chimiques devraient être encore élucidés. Les voies de signalisation spécifiques exercées par l'infection bactérienne pathogène et les effets thérapeutiques des produits chimiques peuvent être évaluées à l'aide de diverses bactéries mutantes et de vers mutants. En outre, d'autres études approfondies identifiant les composants chimiques responsables des effets pathogènes et probiotiques des bactéries intestinales seraient bénéfiques.
Ici, nous rapportons un protocole expérimental pour mesurer la perméabilité intestinale dans C. elegans traités avec différentes bactéries et produits chimiques en utilisant l'alimentation FITC-dextran. Nous croyons que ces protocoles seront utiles pour la recherche biologique fondamentale, comme l'étude de l'interaction entre le microbiote intestinal et la santé intestinale, ainsi que pour le développement de probiotiques et de nutraceutiques pour la prévention et le traitement des problèmes de santé intestinale.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Cette étude a été soutenue par une subvention de recherche intra-muros de l'Institut coréen des sciences et de la technologie (2E29563).
matériels
| Name | Company | Catalog Number | Comments |
| 3,3’-diindolylmethane | Sigma | D9568 | |
| 90×15 mm Petri dishes | SPL Life Sciences, South Korea | 10090 | |
| 60×15 mm Petri dishes | SPL Life Sciences, South Korea | 10060 | |
| Bactor Agar | Beckton Dickinson | REF. 214010 | |
| Formaldehyde solution | Sigma | F1635 | |
| Brain Heart Infusion (BHI) | Becton Dickinson | REF. 237500 | |
| Caenorhabditis elegans N2 | Caenorhabditis Genetics Center (CGC) | Wild type | |
| Cholesterol | Sigma | C3045 | |
| Costa Assay Plate, 96 Well Black With Clear Flat Bottom Non-treated, No Lid Polystyrene | Corning Incorporated | REF. 3631 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Enterococcus faecalis KCTC 3206 | Korean Collection for Type Culture | KCTC NO. 3206 | Falcutative anaerobic |
| Escherichia coli OP50 | Caenorhabditis Genetics Center (CGC) | ||
| Fluorescein isothiocyanate - dextran | Sigma | FD10S | |
| Harmony software | PerkinElmer | verson 3.5 | |
| Luria-Bertani LB medium | Merck | VM743185 626 1.10285.5000 | |
| Magnesium sulfate heptahydrate | Fisher Bioreagents | BP2213-1 | |
| Fluoromount aqueous mounting medium | Sigma | F4680 | |
| Operetta CLS High-Content Analysis System | PerkinElmer | HH16000000 | |
| Peptone | Merck | EMD 1.07213.1000 | |
| Pseudomonas aeruginosa PA01 | Korean Collection for Type Culture | KCTC NO. 1637 | |
| Sodium Chloride | Fisher Bioreagents | BP358-1 | |
| Stereo Microscope | Nikon, Japan | SMZ800N | |
| Yeast extract | Becton Dickinson | REF. 212750 |
Références
- Bischoff, S. C., et al. Intestinal permeability–a new target for disease prevention and therapy. BMC Gastroenterology. 14 (1), 189(2014).
- Peng, L., Li, Z. R., Green, R. S., Holzman, I. R., Lin, J. Butyrate enhances the intestinal barrier by facilitating tight junction assembly via activation of AMP-activated protein kinase in Caco-2 cell monolayers. The Journal of Nutrition. 139 (9), 1619-1625 (2009).
- Ren, M., et al. Developmental basis for intestinal barrier against the toxicity of graphene oxide. Particle Fibre Toxicology. 15 (1), 26(2018).
- Kissoyan, K. A. B., et al. Natural C. elegans microbiota protects against infection via production of a cyclic lipopeptide of the viscosin group. Current Biology. 29 (6), 1030-1037 (2019).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS Genetics. 12 (7), 1006135(2016).
- Escorcia, W., Ruter, D. L., Nhan, J., Curran, S. P. Quantification of lipid abundance and evaluation of lipid distribution in Caenorhabditis elegans by Nile red and oil red O staining. Journal of Visualized Experiments. (133), e57352(2018).
- Johnson, T. E. Advantages and disadvantages of Caenorhabditis elegans for aging research. Experimental Gerontology. 38 (11-12), 1329-1332 (2003).
- Culetto, E., Sattelle, D. B. A role for Caenorhabditis elegans in understanding the function and interactions of human disease genes. Human Molecular Genetics. 9 (6), 869-877 (2000).
- Hubbard, E. J. A. Caenorhabditis elegans germ line: A model for stem cell biology. Developmental Dynamics. 236 (12), 3343-3357 (2007).
- Park, M. R., et al. Probiotic Lactobacillus fermentum strain JDFM216 stimulates the longevity and immune response of Caenorhabditis elegans through a nuclear hormone receptor. Scientific Reports. 8, 7441(2018).
- Kim, Y., Mylonakis, E. Caenorhabditis elegans immune conditioning with the probiotic bacterium Lactobacillus acidophilus strain NCFM enhances gram-positive immune responses. Infection and Immunity. 80 (7), 2500-2508 (2012).
- Nakagawa, H., et al. Effects and mechanisms of prolongevity induced by Lactobacillus gasseri SBT2055 in Caenorhabditis elegans. Aging Cell. 15 (2), 227-236 (2016).
- Dinh, J., et al. Cranberry extract standardized for proanthocyanidins promotes the immune response of Caenorhabditis elegans to Vibrio cholerae through the p38 MAPK pathway and HSF-1. PLoS One. 9 (7), 103290(2014).
- Vayndorf, E. M., Lee, S. S., Liu, R. H. Whole apple extracts increase lifespan, healthspan and resistance to stress in Caenorhabditis elegans. Journal of Functional Foods. 5 (3), 1236-1243 (2013).
- Huycke, M. M., Abrams, V., Moore, D. R. Enterococcus faecalis produces extracellular superoxide and hydrogen peroxide that damages colonic epithelial cell DNA. Carcinogenesis. 23 (3), 529-536 (2002).
- Laughlin, R. S., et al. The key role of Pseudomonas aeruginosa PA-I lectin on experimental gut-derived sepsis. Annals of Surgery. 232 (1), 133-142 (2000).
- Huang, Z., et al. 3,3'-Diindolylmethane decreases VCAM-1 expression and alleviates experimental colitis via a BRCA1-dependent antioxidant pathway. Free Radical Biology, Medicine. 50 (2), 228-236 (2011).
- Jeon, E. J., et al. Effect of Oral Administration of 3,3'-Diindolylmethane on Dextran Sodium Sulfate-Induced Acute Colitis in Mice. Journal of Agricultural and Food Chemistry. 64, 7702-7709 (2016).
- Kim, J. Y., et al. 3,3'-Diindolylmethane improves intestinal permeability dysfunction in cultured human intestinal cells and the model animal Caenorhabditis elegans. Journal of Agricultural and Food Chemistry. 67 (33), 9277-9285 (2019).
- Lee, S. Y., Kang, K. Measuring the Effect of Chemicals on the Growth and Reproduction of Caenorhabditis elegans. Journal of Visualized Experiments. (128), e56437(2017).
- Schmeisser, S., et al. Neuronal ROS signaling rather than AMPK/sirtuin-mediated energy sensing links dietary restriction to lifespan extension. Molecular Metabolism. 2 (2), 92-102 (2013).
- Lee, S. Y., Kim, J. Y., Jung, Y. J., Kang, K. Toxicological evaluation of the topoisomerase inhibitor, etoposide, in the model animal Caenorhabditis elegans and 3T3-L1 normal murine cells. Environmental Toxicology. 32 (6), 1836-1843 (2017).
- Sutphin, G. L., Kaeberlein, M. Measuring Caenorhabditis elegans life span on solid media. Journal of Visualized Experiments. (27), e1152(2009).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019(2012).
- Al Atya, A. K., et al. Probiotic potential of Enterococcus faecalis strains isolated from meconium. Frontiers in Microbiology. 6, 227(2015).
- Hanchi, H., Mottawea, W., Sebei, K., Hammami, R. The Genus Enterococcus: Between Probiotic Potential and Safety Concerns-An Update. Frontiers in Microbiology. 9, 1791(2018).
- Pollack, M. The role of exotoxin A in pseudomonas disease and immunity. Reviews of Infectious Diseases. 5, Suppl 5 979-984 (1983).
- Vasil, M. L., Liu, P. V., Iglewski, B. H. Temperature-dependent inactivating factor of Pseudomonas aeruginosa exotoxin A. Infection and Immunity. 13 (5), 1467-1472 (1976).
- Horii, T., Muramatsu, H., Monji, A., Miyagishima, D. Release of exotoxin A, peptidoglycan and endotoxin after exposure of clinical Pseudomonas aeruginosa isolates to carbapenems in vitro. Chemotherapy. 51 (6), 324-331 (2005).
- Kirikae, T., et al. Biological characterization of endotoxins released from antibiotic-treated Pseudomonas aeruginosa and Escherichia coli. Antimicrobial Agents and Chemotherapy. 42 (5), 1015-1021 (1998).
- Morlon-Guyot, J., Mere, J., Bonhoure, A., Beaumelle, B. Processing of Pseudomonas aeruginosa exotoxin A is dispensable for cell intoxication. Infection and Immunity. 77 (7), 3090-3099 (2009).
- Kim, Y. H., et al. 3,3'-diindolylmethane attenuates colonic inflammation and tumorigenesis in mice. Inflammatory Bowel Diseases. 15 (8), 1164-1173 (2009).
- Kanmani, P., et al. Probiotics and its functionally valuable products-a review. Critical Reviews in Food Science and Nutrition. 53 (6), 641-658 (2013).
- Nguyen, M. T., Gotz, F. Lipoproteins of Gram-Positive Bacteria: Key Players in the Immune Response and Virulence. Microbiology and Molecular Biology Reviews. 80 (3), 891-903 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon