Method Article
ケネラブディティス・エレガンスの腸透過性に及ぼす細菌および化学物質の影響の測定
要約
このプロトコルは、カエネラブディティスエレガンスの腸透過性を測定する方法を記述します。この方法は、腸内細菌とその宿主との相互作用に関連する腸の健康に関する基礎生物学的研究や、漏出性腸症候群および炎症性腸疾患を治癒するためのプロバイオティクスおよび化学薬品を同定するためのスクリーニングに役立ちます。
要約
生体では、腸の透過性が多くの炎症性腸疾患(IBD)につながる深刻な症状です。カエノラブディティス・エレガンスは、寿命が短く、透明性、費用対効果、動物倫理の問題がないため、アッセイシステムとして広く使用されている非哺乳動物モデルです。本研究では、高スループット画像解析システムを用いたC.エレガンスの腸透過性に対する異なる細菌および3,3'-ジインドリルメタン(DIM)の影響を調べる方法を開発した。ワームは異なる腸内細菌に感染するか、DIMで48時間治療し、一晩フッ素セインイソチオシアネート(FITC)-デキストランを供給した。次いで、虫体内部の蛍光画像と蛍光強度を比較して腸透過性を調べた。この方法はまた、動物モデルの腸透過性に影響を与えるプロバイオティクスおよび病原性腸細菌を同定する可能性があり、腸の透過性および腸の健康に有害または健康増進化学物質の影響を調べるのに有効である。しかし、このプロトコルはまた、この方法は主にフェトチピック決定に使用されるため、特に病気を制御するために変更される遺伝子を決定するために、遺伝的レベルでいくつかのかなりの制限を有する。さらに、この方法は、どの病原性基質が炎症を引き起こすか、感染中にワームの腸の透過性を高めるかを正確に決定することに限定される。そこで、変異型細菌や線虫を用いた分子遺伝機構の調査や細菌の化学成分分析など、さらに詳細な研究が必要であり、腸透過性を決定する上で細菌や化学物質の機能を十分に評価することが求められている。
概要
腸透過性は、腸内微生物叢および粘膜免疫に関連する主要な障壁の1つと考えられており、腸内微生物叢修飾、上皮障害、または粘液層変化1などのいくつかの要因によって影響を受ける可能性がある。最近の論文では、腸細胞層2全体の蛍光フラックス率を分析して培養したヒト腸細胞の腸透過性を測定する有効なプロトコルが報告されているが、FITC-dextran染色を用いて、特にC.エレガンスにおいて線虫の腸透過率を測定するのに適した手順を提示する研究論文は少ない。
ナイル赤3とエリオグラウシン二ナトリウム(またはスマーフアッセイ)4、5を用いてC.エレガンスにおける腸透過性を測定するための代表的なプロトコルが2つあります。このプロトコルでは、ナイル赤(MW = 318.37)およびエリオグラウシン二ナトリウム(MW = 792.85)よりもはるかに高い分子量を有するFITC-dextran(平均分子量10,000)を使用しました。FITC-デキストランは、ナイル赤やエリオグラシン二ナトリウム染料よりも、腸層を通して吸収される炭水化物などの実際の高分子栄養素に似ています。エリオグラウシン二ナトリウム(青スマーフ色素)を供給するC.エレガンスの腸透過性は、蛍光顕微鏡なしで容易に評価することができる。しかしながら、スマーフアッセイでは、標準化の欠如により腸透過性の定量分析が困難であり、手動で評価されるべきである4、5。ナイル赤アッセイの場合、ナイル赤色はまた、細胞内の脂質液滴を染色し、C.エレガンス6における腸透過性の正確な決定を妨げる可能性がある。本プロトコルは、非特異的脂質染色を回避しながら、様々な腸内細菌および化学物質で処理されたC.エレガンスにおける腸透過性の迅速かつ正確な定量分析を可能にする。
C.エレガンスは、その手頃な価格、簡単な操作、限られた動物倫理の問題、および迅速な実験7のために有益である短寿命のために生物学的分野の典型的なモデルです。特に、C.エレガンスゲノム全体が公表された後、C.エレガンスゲノム中の遺伝子の40%近くがヒト疾患を引き起こす遺伝子に対して正交的であることが判明した8.さらに、透明体は、細胞イベントの研究や細胞生物学における蛍光用途、例えばDAPIまたは免疫組織化学9による幹細胞染色に有利である生物内部の観察を可能にする。C.エレガンスは、腸内微生物叢と宿主との相互作用を研究するための実験動物としてしばしば使用される。加えて、C.エレガnsは、腸の健康を促進する食物化学物質10、11、12ならびに腸の健康を促進する食事化学物質をスクリーニングするために使用される。
緑膿菌および腸球菌は、消化管系に悪影響を及ぼすよく知られた腸内細菌であり、特に腸管15、16の大腸上皮細胞である。したがって、これらの細菌によって引き起こされる腸透過性を測定することは、細菌の炎症や感染によって引き起こされる損傷を回復し、軽減することができる新薬のスクリーニングおよび開発のために必要である。このプロトコルでは、これらの腸内細菌がC.エレガンスの腸透過性に及ぼす影響を試験した。
我々はまた、C.エレガンスの腸透過性に関する化学物質をテストするための最適化されたプロトコルを報告する。この目的のために、DIMはブラッシカ食品植物に存在するインドール-3-カルビノール由来の生理活性代謝産物化合物であり、マウス17、18におけるIBDに対する治療効果を有することが報告されているため、モデル化学薬品として3,3'-ジインドリルメタン(DIM)を使用した。また、最近、DIMが培養したヒト腸細胞およびモデル線虫C.エレガンス19の両方において腸透過性機能障害を改善することを発見した。
本研究では、3つの異なる実験条件を用いった。まず、異なる細菌、P.エルギノーサおよびE.フェカリスが腸透過性に及ぼす影響を測定した(図1)。次に、生きた熱不活性化P.エルギノーサが腸透過性に及ぼす影響を測定した(図2)。第3に、P.エルギノーサを与えたC.エレガンスの腸透過性に対するDIM(モデル化学物質)の影響を測定した(図3)。
本研究の目的は、様々な腸内細菌や化学物質による治療によって変化するC.エレガンスの腸透過性を測定する最適化されたプロトコルを開発することであった。
プロトコル
1. P.アルギノーサPAO1および大腸菌OP50培養の調製
- 500mLの殺菌ルリア・ベルタニ(LB)培地(表1)を調製し、P.エルギノーサの単一コロニーを培地に接種する。150 rpmの振とう速度で37°Cで14~15時間培養します。
- 細菌培養を2本の500mL遠心管に均等に分配し、30分間4°Cで3,220 x gでチューブを遠心分離します。
- 体積が50mL(初期体積の10分の1)になるまで上清を取り除き、細菌ペレットを再懸濁します。
- 濃縮した細菌培養物を4°Cで保存し、使用するまで保存する。P.エルギノーサ培養の貯蔵期間は最大1ヶ月ですが、新鮮な培養は腸の損傷を誘発するのに適しています。
注:プロトコルはここで一時停止できます。生菌全体に加えて、細菌培養の上清を用い、腸内細菌19の効果を試験することができる。 - 大腸菌OP50を調製するために、DYT培地(表1)で大腸菌OP50を培養し、上述したものと同様のステップを適用するが、ボリュームを元のボリュームの6分の1に減少させる。例えば、初期体積が500mLの場合、上清を除去した後、残りの体積は約83mLである。
注:プロトコルはここで一時停止できます。
2.腸球菌フェカリスKCTC 3206培養の調製
- 殺菌脳心臓注入(BHI)ブロスの500mLを調製する(表1)。
- 1つのコロニーをBHIスープの500 mLに接種し、37°Cおよび150 rpmで振るインキュベーターで14〜15時間培養します。
- 細菌培養を2本の500mL遠心管に均等に分配し、30分間4°Cで3,220 x gでチューブを遠心分離します。
- 体積が50mL(初期体積の10分の1)になるまで上清を取り除き、ペレットを再サスペンドします。
- 濃縮した細菌培養物を4°Cで保存し、使用するまで保存する。新鮮な文化は、腸の透過性に及ぼす影響をテストするための方が良いです。
注:プロトコルはここで一時停止できます。
3. 熱不活性化大腸菌OP50及び熱不活性化P.緑膿菌PAO1培養物の調製
- 上記のように細菌を培養し、収穫する(ステップ1.1~1.3)。
- 前に説明したように大腸菌OP50またはP.アルギノサPAO1培養物を熱不活性化する。熱不活化の場合は、再懸濁した細菌を65°C(水浴)で30分間インキュベートします。
- 濃縮した細菌培養物を室温まで冷やし、使用するまで4°Cで保存します。保存期間は最大 1 か月です。
注:プロトコルはここで一時停止できます。
4. C.エレガンスの腸透過性に対する異なる細菌の影響を試験するための線虫増殖培地(NGM)プレートの調製
- 1.25gのペプトン、1.5gのNaCl、寒天8.5g、磁気攪拌機、蒸留水487.5mLを500mLガラス瓶に入れます(表1)。
- 混合物をよく混ぜ、121°Cで15分間オートクレーブし、30分間水浴中で55°Cに冷却する。
- 水浴から培地を取り出し、成分(1 M CaCl2の0.5 mL、コレステロール0.5mL、MgSO4の0.5 mL、KPO4の12.5 mL)(表1)をNGMに加え、よく混ぜます。
注:コレステロール(絶対エタノールに溶解)を除くすべての個々の成分をオートクレーブする必要があり、すべての実験ステップはクリーンベンチで行う必要があります。 - 各90 x 15 mmのペトリ皿に20 mLのNGMを配布し、寒天が室温(約20°C)できれいなベンチで固できるようにします。NGM版は4 °Cで1ヶ月まで貯えることができる。
注:プロトコルはここで一時停止できます。FITC-デキストラン染色に使用されるNGMプレートは、同じ手順(ステップ4.1~4.3から)で調製した。10mLのNGMを各60×15mmペトリ皿に分配し、室温(約20°C)でクリーンベンチで固化させた。 - 4°Cの冷蔵庫から細菌培養物を取り除き、培養物をNGMプレートに広げる前に培養を徹底的にボルテックスします。
- 各新鮮なNGMプレートに合計800°Lの細菌培養物を加え、プレートを20°Cのインキュベーターで一晩乾燥させます。
注:最初の実験(図1)では、大腸菌OP50を有する2枚のNGMプレート、P.エルギノーサPAO1を有するNGMプレート1枚、およびE.フェカリスKCTC3206を有するNGMプレートを1枚調製した。2回目の実験(図2)では、生きた大腸菌OP50を有する2枚のNGMプレート、ライブP.エルギノーサPAO1を有するNGMプレート1枚、熱不活性化P.エルギノーサPAO1を有するNGMプレートを1枚調製した。
5. P.エルギノーサを用いったC.エレガンスFRBの腸透過性に対する化学物質(DIM)の影響を試験するためのNGMプレートの調製
- 0.5 gのペプトン、0.6 gのNaCl、蒸留水195mL、磁気攪拌機、および6.8gの寒天を500mLガラスボトル(NGM寒天)に加えます。
- 0.5 gのペプトン、0.6 gのNaCl、195 mLの蒸留水、寒天のない磁気攪拌機を別の500mLガラスボトル(NGMブロス)に加えます。
- 2本のボトル(ステップ5.1~5.2から)、空の100 mLガラスボトル1本、空の500mLガラスボトル1本を121°Cで15分間オートクレーブします。次に、ボトルを含む培地を水浴中で55°Cまで冷却し、寒天培地を水浴に入れ、次のステップのためにスープを含むボトル(ステップ5.2から)を取り除きます。
- NGMブロスに添加化学物質を加える:1 M CaCl2の0.4 mL、エタノール中のコレステロール0.4 mL(mL)、1 M MgSO4の0.4 mL、1M KPO4の10 mL(これらの成分はすべてエタノール中のコレステロールとは別に殺菌する必要があります)。次いで、55°Cで磁気攪拌機で混合物を十分に撹拌する。
- オートクレーブされた空の500 mLガラスボトルにジメチルスルホキシド(DMSO)と、AUTOclaved空の100 mLガラスボトルにDIMでラベルを付けます。
- 50 mL の NGM スープを DIM ラベル付きの 100 mL ボトルに転送します。ボトルに20mM DIMストックの500 μLを追加し、よく混ぜます。
注:DIM は DMSO (20 mM DIM ストック) に溶解します。 - 水浴からNGM寒天培地を素早く取り出し、50mLのNGM寒天培地をDIM標識ボトルに加え、十分に混ぜます。
- DIM含有NGM培地の20mLアリコートを各90mm×15mmペトリ皿に入れます。このステップから約5枚のDIM含有NGMプレートを作ることができます。
注:各NGMプレートのDIMの最終濃度は100μMになります。 - DMSO含有NGMプレートを調製するには、150mLのNGMブロスをDMSO標識500mLボトルに移します。ボトルに1.5 mLのDMSOを追加し、よく混ぜます。
- DMSOラベルのボトルにNGM寒天培地を150mL加え、よく混ぜます。
- DMSO含有NGM培地の20mLアリコートを各90mm×15mmペトリ皿に入れます。このステップから約15個のDMSO含有NGMプレートを作ることができます。
注:各NGMプレートのDMSOの最終濃度は0.5%となります。 - プレートを室温で固め、使用するまで4°Cで保存します。
注:プロトコルはここで一時停止できます。 - 大腸菌OP50またはP.エルギノーサPAO1培養物を4°C冷蔵庫(ステップ1.4から)から取り出し、培養物を適切にボルテックスしてからNGMプレートに広がります。
- 大腸菌OP50またはP.エルギノーサPAO1細菌培養物の800μLを各新鮮なNGM寒天プレートに入れ、プレートを20°Cのインキュベーターで一晩乾燥させます。
注:プロトコルはここで一時停止できます。第3の実験(図3)では、生きた大腸菌OP50で被覆された2枚のDMSO含有NGMプレート、ライブP.エルギノーサPAO1で被覆されたDMSO含有NGMプレート1枚、および1枚のDIM含有NGMプレートをライブP.エルギノーサPAO1で被覆して調製した。
6. 年齢同期C.エレガンスの調製
- 固体NGMプレート上でワームを成長させ、所望の集団に達するまで大腸菌OP50でそれらを供給します。
- 前に説明したように、時限の産卵方法または漂白溶液処理のいずれかを用いて卵を同期させる。
7. 細菌またはDIMおよびFITC-デキストラン供給の治療
- 生きた大腸菌OP50を食品として補充したNGMプレートに64時間、20°Cで年齢同期卵をインキュベートする。
- 年齢同期L4幼虫をS緩衝液で洗浄し、異なる細菌および化学物質を含む治療NGMプレートに(約500以上のワーム)移します(ステップ4.6および5.14に続く注を参照)。48時間20°Cでインキュベートします。
注:使用される細菌および化学物質によると、治療時間は24〜72時間の範囲であり得る。DIMの治療または予防効果は、ワームを病原体で前処理し、その後DIM(治療効果)でワームを治療するか、またはDIMでワームを前処理し、次いで病原体(予防効果)19で治療することによっても評価することができる。 - FITC-デキストラン補充プレートを調製するには、熱不活性化大腸菌OP50をFITC-デキストラン4mgで2mL混合します。次に、FITC-dextranと大腸菌OP50混合物の100μLを20個の新鮮なNGM寒天プレート(60mm x 15mm)に分割し、プレートをクリーンベンチで1時間乾燥させます。
注:各NGMプレートのFITC-デキストランの最終濃度は20μg/mLとなります。 - 車両制御処理のためにFITC-デキストランなしで5枚の大腸菌OP50含有NGMプレートを準備します。この目的のために、100°Lの熱不活性化大腸菌OP50を各新鮮なNGM寒天プレート(60 mm x 15 mm)に分割し、プレートをクリーンベンチで1時間乾燥させます。
注:各独立した実験のために、15のFITCデキストラン補足NGMプレートとFITC-デキストランなしで5つのNGMプレートが必要です。 - 48時間の治療後(ステップ7.2から)、ワームをSバッファで洗浄し、FITC-デキストランを含まないFITC-デキストラン補充プレートとNGMプレートにワームを移し、プレートを一晩インキュベートします(14~15時間)。
注:各治療群について、FITC-デキストラン染色(または車両制御供給)の5つの反復が必要です。 - Sバッファでワームを洗浄し、新鮮なNGM寒天プレートを1時間クロールできるようにします。
注:独立した実験ごとに、合計20枚の新鮮なNGMプレートが必要です。このステップでは、大腸菌OP50を含まない、または大腸菌OP50で補充されたNGMプレートを使用することができます。 - 黒い96ウェルフラットボトムプレートの各ウェルに4%ホルムアルデヒド溶液の50°Lを追加します。蛍光測定のために、各NGMプレートから約50個のワームを各ウェルに転送します。1~2分後、各ウェルからすべてのホルムアルデヒドを完全に取り除き、100μLの取り付け媒体を加えて井戸をコーティングします。
注:ホルムアルデヒド溶液 (4%)ワームを固定化して修正するために使用されます。各治療群について、画像解析に5つのウェル(5個の反復)が使用されます。
8. オペレッタイメージングシステムによるイメージングC.エレガンスとFITC-デキストラン蛍光取り込みによる腸透過性の測定
注:蛍光ステレオ顕微鏡は、オペレッタシステムの代わりに画像解析に使用できます。
- 蛍光画像をキャプチャし、オペレッタ高コンテンツイメージングシステムを使用して蛍光強度を測定し、Harmonyソフトウェアで画像を分析します。
- Harmonyソフトウェアで、アイコンの[蓋を開く]を押して蓋を開き、プレートを機械に入れます。
- パラメーターを設定します。
- [設定]をクリックし、プレートタイプ(96ウェルコーニングフラットボトム)を選択し、チャンネル(明視野およびEGFPチャンネル)を追加します。
- レイアウトを調整します。[レイアウトの選択]に移動し、[トラック]を選択してパラメータを調整します (最初の画像は 1 μm、平面の数は 10、距離は 1 μm)。
- いずれかの治療井戸と 1 つのキャプチャ フィールドを選択し、[テスト]を押して、[実験の実行]セクションで画像が満足できるかどうかを確認します。
- 画像に問題がなければ、[設定]セクションに戻り、画面の最後にある[リセット]アイコンを押します。次に、すべてのターゲット ウェルと適切な数のキャプチャ フィールドを選択します。
- [実験の実行]に再度移動し、プレート名を入力し、[開始]を押して処理を開始します。
- 蛍光の強度を測定するには、画像解析セクションに移動し、画像を入力します。EGFP チャンネルと方法 B を選択してセルを検索します。次に、強度プロパティを計算し、出力として平均を選択します。[適用]アイコンを押して、セットアップを保存します。
- ヒートマップとデータテーブルを取得して強度を測定するには、[評価]セクションに移動します。[読み出し] パラメーターを[セル — 強度セル EGFP 平均 ] — ウェルあたりの平均値に設定し、評価を開始します。
注:プロトコルはここで一時停止できます。 - オペレッタからデータを抽出するには、[設定]ボタンをクリックし、[データ管理] を選択します。
- [アーカイブの書き込み]を選択し、参照を開いてファイルを選択します。
- ファイルを選択するには、左隅にある小さな+信号をクリックし、[計測]をクリックして [プレート名]を選択します。
- ファイルを選択し、[OK]をクリックします。
- アクティブなパスで参照シグナルをクリックして、ファイルを保存するパスを選択します。
- [開始]をクリックしてデータ ファイルを保存します。
注:プロトコルはここで一時停止できます。
9. C.エレガンスのFITC-デキストラン蛍光の統計的解析
- データをインポートし、統計ソフトウェアを使用して平均と標準偏差(SD)を計算します。
- 分散(ANOVA)の一方向分析と有意差を分析し、Tukeyの多重比較検定を続けます。
結果
P.アルギノーサPAO1でインキュベーションした後、C.エレガンスは、他の2つの細菌株とインキュベーションした後に示された蛍光と比較して、ワーム体内におけるFITC-デキストラン蛍光の有意な増加を示した(図1)。大腸菌OP50、P.アルギノーサPAO1、およびE.ファカリスKCTC3206を供給したワームの蛍光強度は、それぞれ100.0±6.6、369.7±38.9、および105.6±10.6%であった。このデータは、P.エルギノーサが上皮腸関門により重要な損傷を引き起こしたことを強調し、従って、ワームは腸の透過性の劇的な増加を示した。この結果に基づいて、FITC-dextranは腸層を容易に貫通することができるので、P.エルギノーサはDIMの効果をスクリーニングするための潜在的な病原体として選ばれた。E.faecalisは、大腸上皮細胞DNA15に損傷を与える細胞外スーパーオキシドおよび過酸化水素を産生することができる腸病原体であるが、場合によっては、E.faecalisは、いくつかの病原体25、26に対してバクテリオシンを産生する能力による潜在的なプロバイオティクス細菌としても知られている。プロバイオティクスの機能は、上皮表面への付着、ヒト消化管における持続性、腸病原体26に対する免疫刺激および拮抗活性を含む。したがって、E.フェカリスでインキュベートされたワームの腸透過性は、車両制御ワームのそれと比較して変わらなかった。この結果は、蛍光強度の増加によって感染量を研究できることを示し、そしてP.エルギノーサは、他の株よりも腸透過性が高いことを引き起こす。
図2は、ワーム体内におけるFITC-デキストラン蛍光の強度に基づく生きたP.エルギノーサPAO1との違いを示す。蛍光画像と統計データの両方は、病原体が熱不活性化後に線虫に対する毒性を引き起こさなかったことを示しています。P. 緑膿性は、エキソトキシンAを産生することができる — 多くの動物のために致死的である強力な細胞外細胞毒素27.エキソトキシンAは、45°C〜60°28で加熱することにより急速に廃止することができる。したがって、熱不活性化P.エルギノーサは、ワームの腸上皮の透過性を損なうことができなかった。P.エルギノーサPAO1培養の上清は腸透過性に著しく損傷を与え、従って、P.エルギノーサ細胞全体の代わりに培養上清を使用して腸透過性機能障害19を誘導することができる。上清には、内毒素、エキソトキシンA、およびリポ多糖類29が含まれており、これらの成分は細胞毒性30、31を誘導することが知られている。従って、上清のこれらの成分は腸透過性に影響を及ぼす可能性があり、C.エレガンスにおける腸透過性に対するエキソトキシン及びリポ多糖類の直接的な影響は確認しなかった。
48時間のDIM共処理は、P.アルギノーサ単一治療と比較して、ワームの腸内のFITC-デキストラン蛍光強度を有意に減少させた(図3C,D)。一方向ANOVAとTukeyの多重比較試験による統計分析は、DIMで処理した後、P.アルギノーサの蛍光強度と比較して平均蛍光強度が有意に減少したことを示した。P.アルギノーサ-のみ、P.アルギノーサプラスDIMで処理したワームの蛍光強度は、それぞれ486.3±41.7および414.2±25.0%であった(図3E)。この結果に基づいて、DIMは細菌感染によって引き起こされる腸透過性機能障害を治癒するための良好な天然物と考えることができる。この結果は、DIMが腸細胞における細胞炎症を減衰させることができ、腸19の透過性を低下させることを示した。この結果は、マウスモデルで得られた結果と同様であり、DIMは結腸32における炎症の有意な減少を示した。

図1:C.エレガンスの腸透過性に対する異なる細菌の影響明視野、FITC蛍光(緑チャネル)、およびマージされた画像を含むワームの顕微鏡画像。FITC-デキストラン供給を伴わない(A)大腸菌OP50からのワームの顕微鏡画像、(B)FITC-デキストラン供給を伴う大腸菌、(C)P.P.セルギノサPAO1、FITC-デキストラン供給を有する(D)E.フェカリスKCTC3206。 スケール バー = 1 mm (白)、および 200 μm (黒) です。年齢同期L4幼虫を大腸菌(A,B)、P.エルギノーサ(C)、およびE.フェカリス(D)で播種したNGMプレートで48時間インキュベートした。次いで、車両制御(A)を除き、FITC-デキストラン(B-D)を含むプレートにワームを移した。(E)異なる細菌処理のFITC蛍光強度。FITC蛍光の割合が高いほど、腸透過性が高いことを示した。列と誤差範囲は、車両制御との有意差の平均 ± SD. ***P < 0.001 を示します。###P < 0.001 P. アルギノーサPAO1 (ANOVA, n = 5) を与えられた FITC デキストラン処理ワームとの有意差。このグラフは、2つの独立した実験を表しています。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:C.エレガンスの腸透過性に対する生熱および熱不活性化P.エルギノーサPAO1の影響(A)FITC-デキストラン供給なしの生きた大腸菌OP50からのワームの顕微鏡画像、(B)FITC-デキストラン供給を伴うライブ大腸菌、(C)FITC-デキストラン供給を伴うライブP.アルギノーサPAO1、および(D)熱不活性化P.アルギノーザとFITC-デキステロスキナ供給。スケール バー = 1 mm (白)、および 200 μm (黒) です。年齢同期L4幼虫を、生きた大腸菌(A、B)、生きたP.エルギノーサ(C)、熱不活性化P.エルギノーサ(D)で播種したNGMプレートで48時間インキュベートした。次いで、車両制御(A)を除き、FITC-デキストラン(B-D)を含むプレートにワームを移した。(E)FITC蛍光強度は、生と熱不活性化P.アルギノーサPAO1を比較する。列と誤差範囲は、車両制御との有意差を示す平均 ± SD. ***P < 0.001 および **P < 0.01 を示します。###P < 0.001 生きたP. アルギノーサPAO1 (ANOVA, n = 5) を与えられた FITC デキストラン処理ワームとの有意差。このグラフは、2つの独立した実験を表しています。この図の大きなバージョンを表示するには、ここをクリックしてください。
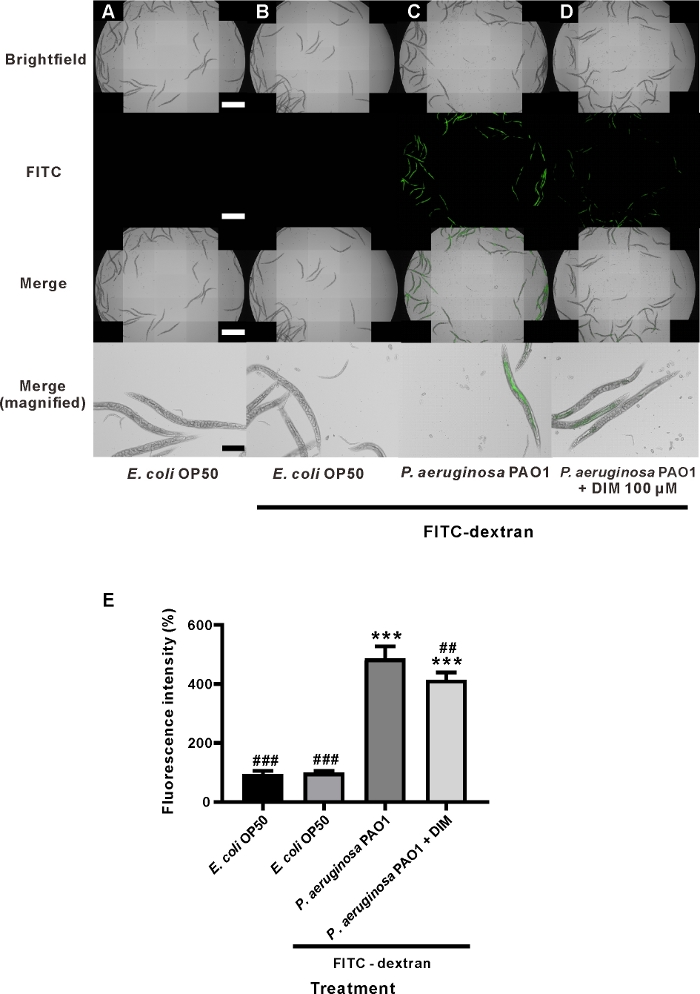
図3:C.エレガンス供給P.エルギノーサの腸透過性に対するDIMの影響FITC-デキストラン供給を伴わない(A)大腸菌OP50からのワームの顕微鏡画像、(B)FITC-デキストラン供給を伴う大腸菌、(C)P.P.アルギノーサPAO1(FITC-デキストラン供給)、および(D)P.アルギノーザおよびDIM(100μM)をFITC-デキストラン供給によるコトリートメント。スケール バー = 1 mm (白)、および 200 μm (黒) です。年齢同期L4幼虫は、生きた大腸菌(A、B)、ライブP.エルギノーサ(C)、ライブP.エルギノーザおよびDIM(D)で播種されたNGMプレートで48時間インキュベートされた。次いで、車両制御(A)を除き、FITC-デキストラン(B-D)を含むプレートにワームを移した。(E)FITC蛍光強度は、C.エレガンスの腸透過性がDIMの影響を受けたことを示す。列と誤差範囲は、車両制御との有意差の平均 ± SD. ***P < 0.001 を示します。###P < 0.001 および##P < 0.01 P.アルギノーサPAO1 (ANOVA, n = 5) を与えられた FITC デキストラン処理ワームとの有意差。このグラフは、2つの独立した実験を表しています。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
自動化された蛍光顕微鏡と定量画像分析を組み合わせたC.エレガンスにおける腸透過性を決定するこの新しい方法を利用することにより、腸内微生物または化学物質によって引き起こされる差異を、特にC.エレガンス腸で生体内で決定することができます。このプロトコルは、腸の透過性の調査に役立ち、その利便性と操作が容易なため、ストレス条件下での活性酸素種(ROS)決定や形態検査など、多くのタスクに適用できます。さらに、この方法は、C.エレガンスにおける複数の病原体に対する治療および予防方法の効果を決定するために使用することができる。特に、有害な細菌および有用な細菌の両方を含む異なる細菌株のメカニズムを調査するための効率的なプロトコルであり得る。類似した構造を有するいくつかの病原体およびプロバイオティクス細菌は、宿主33、34に異なる効果を発揮する。この手順は、細菌が利用しているメカニズムと、標的となる基質が細胞外または細胞内に分泌できる場所を評価する際に役立つ。さらに、この方法は、熱処理が病原体不活性化に重要な役割を果たすという仮説を強化するのにも役立ちます。
ただし、この手順ではいくつかの問題もあります。まず、各プレート内のワームの数は、統計的に意味のある結果と堅牢なワーム検出に重要であるため、70 ~ 90% のコンフルエンシー (ウェルあたり少なくとも 50 個のワーム) をお勧めします。したがって、適切なワームを得るために試験実験を行う必要があります。第二に、プレート特性は、特に底部材料の画像および強度決定の品質に影響を与える重要な要因の1つである。いくつかの高度な実験では、ガラス底は、その優れた光学品質のために蛍光の測定のための最良のオプションです。しかし、価格が高いため、ガラス底ほど品質は高くはありませんが、ポリスチレンボトムがよく使用されます。最後に、C.エレガンスのプレートコーティング方法は最適化を必要とします。この実験では、蛍光取り付け媒体は、組織切片の標識を保存・増強することができるが、板底部のワームを適切に固定することはできないため、塗布した。
このプロトコルには制限があります。C.エレガンスは線虫であるため、ヒト腸細胞単層および哺乳動物における評価などのさらなる実験を行うべきである。この方法では、C.エレガンスのフェチピック変化が病原性細菌および化学物質を供給して決定した。したがって、腸内細菌の病原性またはプロバイオティクス効果の基礎となる分子および遺伝的メカニズムならびに化学物質の治療効果をさらに解明すべきである。病原性細菌感染および化学物質の治療効果によって発揮される特異的シグナル伝達経路は、種々の変異細菌および変異型ワームの両方を用いて評価することができる。さらに、腸内細菌の病原性およびプロバイオティクス効果を担う化学成分を同定するさらなる詳細な研究が有益であろう。
ここでは、FITC-デキストラン摂食を用いて異なる細菌や化学物質で処理されたC.エレガンスにおける腸透過性を測定するための実験プロトコルを報告する。これらのプロトコルは、腸内微生物叢と腸の健康との相互作用を研究するなどの基礎生物学的研究や、腸の健康問題の予防・治療のためのプロバイオティクスや栄養補助食品の開発に役立つと考えています。
開示事項
著者たちは何も開示する必要はない。
謝辞
この研究は、韓国科学技術大学院大学の壁内研究助成金(2E29563)によって支援された。
資料
| Name | Company | Catalog Number | Comments |
| 3,3’-diindolylmethane | Sigma | D9568 | |
| 90×15 mm Petri dishes | SPL Life Sciences, South Korea | 10090 | |
| 60×15 mm Petri dishes | SPL Life Sciences, South Korea | 10060 | |
| Bactor Agar | Beckton Dickinson | REF. 214010 | |
| Formaldehyde solution | Sigma | F1635 | |
| Brain Heart Infusion (BHI) | Becton Dickinson | REF. 237500 | |
| Caenorhabditis elegans N2 | Caenorhabditis Genetics Center (CGC) | Wild type | |
| Cholesterol | Sigma | C3045 | |
| Costa Assay Plate, 96 Well Black With Clear Flat Bottom Non-treated, No Lid Polystyrene | Corning Incorporated | REF. 3631 | |
| Dimethyl sulfoxide | Sigma | D2650 | |
| Enterococcus faecalis KCTC 3206 | Korean Collection for Type Culture | KCTC NO. 3206 | Falcutative anaerobic |
| Escherichia coli OP50 | Caenorhabditis Genetics Center (CGC) | ||
| Fluorescein isothiocyanate - dextran | Sigma | FD10S | |
| Harmony software | PerkinElmer | verson 3.5 | |
| Luria-Bertani LB medium | Merck | VM743185 626 1.10285.5000 | |
| Magnesium sulfate heptahydrate | Fisher Bioreagents | BP2213-1 | |
| Fluoromount aqueous mounting medium | Sigma | F4680 | |
| Operetta CLS High-Content Analysis System | PerkinElmer | HH16000000 | |
| Peptone | Merck | EMD 1.07213.1000 | |
| Pseudomonas aeruginosa PA01 | Korean Collection for Type Culture | KCTC NO. 1637 | |
| Sodium Chloride | Fisher Bioreagents | BP358-1 | |
| Stereo Microscope | Nikon, Japan | SMZ800N | |
| Yeast extract | Becton Dickinson | REF. 212750 |
参考文献
- Bischoff, S. C., et al. Intestinal permeability–a new target for disease prevention and therapy. BMC Gastroenterology. 14 (1), 189(2014).
- Peng, L., Li, Z. R., Green, R. S., Holzman, I. R., Lin, J. Butyrate enhances the intestinal barrier by facilitating tight junction assembly via activation of AMP-activated protein kinase in Caco-2 cell monolayers. The Journal of Nutrition. 139 (9), 1619-1625 (2009).
- Ren, M., et al. Developmental basis for intestinal barrier against the toxicity of graphene oxide. Particle Fibre Toxicology. 15 (1), 26(2018).
- Kissoyan, K. A. B., et al. Natural C. elegans microbiota protects against infection via production of a cyclic lipopeptide of the viscosin group. Current Biology. 29 (6), 1030-1037 (2019).
- Gelino, S., et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction. PLoS Genetics. 12 (7), 1006135(2016).
- Escorcia, W., Ruter, D. L., Nhan, J., Curran, S. P. Quantification of lipid abundance and evaluation of lipid distribution in Caenorhabditis elegans by Nile red and oil red O staining. Journal of Visualized Experiments. (133), e57352(2018).
- Johnson, T. E. Advantages and disadvantages of Caenorhabditis elegans for aging research. Experimental Gerontology. 38 (11-12), 1329-1332 (2003).
- Culetto, E., Sattelle, D. B. A role for Caenorhabditis elegans in understanding the function and interactions of human disease genes. Human Molecular Genetics. 9 (6), 869-877 (2000).
- Hubbard, E. J. A. Caenorhabditis elegans germ line: A model for stem cell biology. Developmental Dynamics. 236 (12), 3343-3357 (2007).
- Park, M. R., et al. Probiotic Lactobacillus fermentum strain JDFM216 stimulates the longevity and immune response of Caenorhabditis elegans through a nuclear hormone receptor. Scientific Reports. 8, 7441(2018).
- Kim, Y., Mylonakis, E. Caenorhabditis elegans immune conditioning with the probiotic bacterium Lactobacillus acidophilus strain NCFM enhances gram-positive immune responses. Infection and Immunity. 80 (7), 2500-2508 (2012).
- Nakagawa, H., et al. Effects and mechanisms of prolongevity induced by Lactobacillus gasseri SBT2055 in Caenorhabditis elegans. Aging Cell. 15 (2), 227-236 (2016).
- Dinh, J., et al. Cranberry extract standardized for proanthocyanidins promotes the immune response of Caenorhabditis elegans to Vibrio cholerae through the p38 MAPK pathway and HSF-1. PLoS One. 9 (7), 103290(2014).
- Vayndorf, E. M., Lee, S. S., Liu, R. H. Whole apple extracts increase lifespan, healthspan and resistance to stress in Caenorhabditis elegans. Journal of Functional Foods. 5 (3), 1236-1243 (2013).
- Huycke, M. M., Abrams, V., Moore, D. R. Enterococcus faecalis produces extracellular superoxide and hydrogen peroxide that damages colonic epithelial cell DNA. Carcinogenesis. 23 (3), 529-536 (2002).
- Laughlin, R. S., et al. The key role of Pseudomonas aeruginosa PA-I lectin on experimental gut-derived sepsis. Annals of Surgery. 232 (1), 133-142 (2000).
- Huang, Z., et al. 3,3'-Diindolylmethane decreases VCAM-1 expression and alleviates experimental colitis via a BRCA1-dependent antioxidant pathway. Free Radical Biology, Medicine. 50 (2), 228-236 (2011).
- Jeon, E. J., et al. Effect of Oral Administration of 3,3'-Diindolylmethane on Dextran Sodium Sulfate-Induced Acute Colitis in Mice. Journal of Agricultural and Food Chemistry. 64, 7702-7709 (2016).
- Kim, J. Y., et al. 3,3'-Diindolylmethane improves intestinal permeability dysfunction in cultured human intestinal cells and the model animal Caenorhabditis elegans. Journal of Agricultural and Food Chemistry. 67 (33), 9277-9285 (2019).
- Lee, S. Y., Kang, K. Measuring the Effect of Chemicals on the Growth and Reproduction of Caenorhabditis elegans. Journal of Visualized Experiments. (128), e56437(2017).
- Schmeisser, S., et al. Neuronal ROS signaling rather than AMPK/sirtuin-mediated energy sensing links dietary restriction to lifespan extension. Molecular Metabolism. 2 (2), 92-102 (2013).
- Lee, S. Y., Kim, J. Y., Jung, Y. J., Kang, K. Toxicological evaluation of the topoisomerase inhibitor, etoposide, in the model animal Caenorhabditis elegans and 3T3-L1 normal murine cells. Environmental Toxicology. 32 (6), 1836-1843 (2017).
- Sutphin, G. L., Kaeberlein, M. Measuring Caenorhabditis elegans life span on solid media. Journal of Visualized Experiments. (27), e1152(2009).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019(2012).
- Al Atya, A. K., et al. Probiotic potential of Enterococcus faecalis strains isolated from meconium. Frontiers in Microbiology. 6, 227(2015).
- Hanchi, H., Mottawea, W., Sebei, K., Hammami, R. The Genus Enterococcus: Between Probiotic Potential and Safety Concerns-An Update. Frontiers in Microbiology. 9, 1791(2018).
- Pollack, M. The role of exotoxin A in pseudomonas disease and immunity. Reviews of Infectious Diseases. 5, Suppl 5 979-984 (1983).
- Vasil, M. L., Liu, P. V., Iglewski, B. H. Temperature-dependent inactivating factor of Pseudomonas aeruginosa exotoxin A. Infection and Immunity. 13 (5), 1467-1472 (1976).
- Horii, T., Muramatsu, H., Monji, A., Miyagishima, D. Release of exotoxin A, peptidoglycan and endotoxin after exposure of clinical Pseudomonas aeruginosa isolates to carbapenems in vitro. Chemotherapy. 51 (6), 324-331 (2005).
- Kirikae, T., et al. Biological characterization of endotoxins released from antibiotic-treated Pseudomonas aeruginosa and Escherichia coli. Antimicrobial Agents and Chemotherapy. 42 (5), 1015-1021 (1998).
- Morlon-Guyot, J., Mere, J., Bonhoure, A., Beaumelle, B. Processing of Pseudomonas aeruginosa exotoxin A is dispensable for cell intoxication. Infection and Immunity. 77 (7), 3090-3099 (2009).
- Kim, Y. H., et al. 3,3'-diindolylmethane attenuates colonic inflammation and tumorigenesis in mice. Inflammatory Bowel Diseases. 15 (8), 1164-1173 (2009).
- Kanmani, P., et al. Probiotics and its functionally valuable products-a review. Critical Reviews in Food Science and Nutrition. 53 (6), 641-658 (2013).
- Nguyen, M. T., Gotz, F. Lipoproteins of Gram-Positive Bacteria: Key Players in the Immune Response and Virulence. Microbiology and Molecular Biology Reviews. 80 (3), 891-903 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved