Method Article
인트스타스타스테어링 전달을 통해 마우스에서 수막구균 수막염 혈청계S C유도
요약
여기에서, 우리는 성인 마우스에 있는 감염의 내성인종 경로를 통해 수막구균 뇌막염을 유도하는 방법을 기술합니다. 우리는 접종의 준비에서 내질 감염에 수막 구균 감염의 단계 프로토콜에 의해 단계를 제시; 그런 다음 동물의 생존을 기록하고 뮤린 조직에서 세균 부하를 평가합니다.
초록
Neisseria 수막염 (meningococcus)는 세균성 뇌막염의 주요 원인으로 세계적으로 인식되는 좁은 호스트 범위 미생물입니다. 수막구균은 건강한 대상체의 약 10%의 인간 비인두의 일시적인 식민지입니다. 특히 상황에서, 그것은 점 막 장벽을 관통 하 고 패 혈 증을 일으키는 혈 류를 침공 하는 침략 능력을 취득. 최신 케이스에서는, 완충 패혈증은 뇌막염의 결과적인 발달 없이조차 생길 수 있었습니다. 반대로, 박테리아는 혈 류에서 제대로 증식 수 있습니다., 혈액 뇌 장벽을 교차, 중앙 신 경계에 도달, 충만 뇌 막염으로 이어지는. 세균성 뇌막염의 murine 모형은 호스트 병원체 상호 작용을 조사하고 이 치명적인 질병에 책임 있는 병원유전적 기계장치를 분석하기 위하여 유용한 공구를 나타냅니다. 비록, 몇몇 실험적인 모형 시스템은 지난 십년간 에 걸쳐 평가되었더라도, 이들 중 어느 것도 수막구균 질병의 특징적인 병리학 적인 사건을 재현할 수 없었습니다. 이 실험 프로토콜에서, 우리는 박테리아의 내성 계발성 접종에 근거를 둔 마우스 모형에 있는 수막구균 뇌막염의 유도를 위한 상세한 절차를 기술합니다. 인간 뇌막염의 특이한 징후는 임상 매개 변수 (예를 들어, 온도, 체중), 생존율 평가, 미생물 학적 분석 및 뇌 손상의 조직 학적 검사의 평가를 통해 뮤린 호스트에 기록되었다. intracisternal를 사용하는 경우 (i.cist.) 접종, 수막 구균은 시스터나마그나로 직접 전달, 뇌 조직에서 매우 효율적인 수막 구균 복제로 이어지는. 박테리아의 실행 가능한 수의 1,000 배 증가는 대략 18 시간에서 관찰됩니다. 더욱이, 수막구균은 또한 감염된 마우스의 비장, 및 간에서 발견되며, 이는 간이 수막구균 복제를 위한 표적 기관을 나타낼 수 있음을 시사한다.
서문
Neisseria 뇌막염은 인간 호스트에 국한된 그람 음성 β-proteobacterium, 잘 전 세계에 걸쳐 인간 인구에 있는 뇌막염 그리고 패혈증의 일반적인 원인의 한개인 것으로 잘 알려져 있습니다. 그것은 건강하고 무증상 운반대의 상부 호흡기 (코와 목)를 식민지화합니다 (인구의 2-30%), 그러나 박테리아는 때때로 각종 호스트 면역 방어를 회피하고 통제되지 않는 현지를 일으키는 원인이 되는 두뇌에 혈류량에서 퍼집니다 염증, 수막 구균 수막염으로 알려진. 숙주와 세균계수의 조합은 공생에서 침습적행동으로의전환에 기여하는 것으로 보인다 1 .
N. 뇌막염은 인간 식민지화 및 감염에 독점적으로 전문화됩니다. 그것은 좁은 숙주 범위를 가지고 있고, 따라서, 인간 수막구균 질병을 재생하는 적당한 동물 모형의 부족 때문에 생체 내 병인 성 연구에서 제한되었습니다. 그 결과, 수막구균에 의한 패혈증과 뇌막염의 병인에 관한 이해의 근본적인 간격으로 이어졌습니다. 지난 수십 년 동안, 많은 시험관 내 시스템의 발달은 여러 수막 구균 독성 인자2,3,4의식별을 허용했다. 이러한 귀중한 연구는 성공적인 수막 구균 감염을 위한 이 요인의 역할을 이해하기 위하여 중요한 통찰력을 제공했더라도, 이 모형은 체액성 및 세포와 세균성 상호 작용의 결과의 평가를 허용하지 않았습니다 면역 체계와 전체 조직도 적습니다. 감염의 생체 내 동물 모델은 백신 제형에 의해 부여된 보호 정도의 평가뿐만 아니라 큰 관련성을 가지고 있다. 인간 열대 병원체로서, 수막구균은 표면 구조 (즉, 타입 IV 필리 및 불투명도 단백질) 및 인간 수용체 및 수송 단백질을 위한 철 섭취 시스템 (즉, 및 수송 단백질)과 같은 성공적인 감염에 필요한 적절한 결정요인을 가지고 있습니다. transferrin 및 락토페린)5,6,7을 올바르게 부착하고 생존하고 인간 숙주에게 침입합니다. 마지막으로, 인간의 면역 반응을 회피 및/또는 차단하는 병원체의 유전적 변이 능력은 고종 트로피즘8,9에더욱 기여한다. 따라서, 상호 작용에 관여하는 특정 숙주 인자의 부재는 병원체의 수명 주기의 단계를 차단할 수 있으며, 수막 구균 수명 주기를 요약하는 작은 동물 모델의 개발에 상당한 어려움을 확립 할 수 있습니다.
지난 수십 년 동안, 수막구균 전염주기의 우리의 이해를 향상시키기 위하여 몇몇 접근은 개발되었습니다. 두 동물 모델, 마우스와 쥐의 감염, 복강 내 (i.p.) 또는 intranasally (i.n.), 수막 구균 질환을 재현하기 위해 개발되었다10,11,12,13,14 ,15,16,17. 실험실 마우스는 아마 실험적인 수막구균 감염을 유도하기 위한 더 다재다능한 동물의 한개입니다.
그러나, i.p. 감염의 방법은 감염의 자연적인 경로를 모방하지 않더라도 가혹한 패혈증의 발달로 이끌어 냅니다, 반면 감염의 i.n. 경로는 폐 감염을 유도할 수 있더라도 수막구균 병인증을 평가하기 위하여 유용했습니다 패혈증10,11,12, 13,14,15,16,17.
i.p. 마우스 모델은 수막구균 도전10,11,12로부터의보호를 평가하는 데 중요한 역할을 했다. 감염의 i.n. 경로에 기초한 수막구균 식민지화의 마우스 모형은 인간에 있는 수막구균 질병의 과정을 모방하는 침략적인 감염을 재생하기 위하여, 수막구균에 더 영향을 받기 쉽기 때문에, 유아 마우스로 개발되었습니다 13,14,15,16,17. 더욱이, 뮤린 숙주에서 수막구균 복제를 촉진하기 위해, 감염을 개선하기 위해 동물에게 철분 투여, 높은 세균접종의 사용, 마우스-통로 세균성 균주뿐만 아니라 유아 또는 면역 손상된 동물의고용은 10,13,15,18,19. CD4620 또는 트랜스퍼린21과 같은 특정 인간 요인의 발현은 이 인간-열대 박테리아에 대한 마우스의 감수성을 증가시켰습니다. 감염의 인간 피부 이종이식 모델의 고용은 또한 인간내피(22,23)에대한 수막구균의 부착 능력을 평가하는 데 유용하였다. 종합적으로, 인간화형 형질전환 마우스의 최근 발달은 수막구균 병인 및 숙주 상호작용의 이해를 향상시켰다.
이전에는 쥐계세균24를 이용한 성인마우스의 시스터나 마그나로 세균의 접종을 수행한 수막구균 수막염의뮤린 모델을 개발하였다. 임상 적 매개 변수 및 감염된 마우스의 생존율은 인간 숙주에서 볼 수있는 것과 유사한 특성을 가진 뇌막염의 확립뿐만 아니라 뇌의 미생물 및 조직학적 분석을 입증했습니다. 이 감염된 마우스로부터, 박테리아는 또한 혈액, 간 및 비장으로부터 회복되었고, 말초 장기로부터의 세균 부하가 감염성 투여량과 상관되었다. 특히, 이 모델은 L-글루타메이트 수송기GltT 24에서결함이 있는 이소제성 돌연변이균의 독성을 평가하기 위해 사용되었다. 최근, i.cist에 근거를 둔 수막구균 뇌막염의 우리의 마우스 모형을 이용하. 혈청군 C균93/42862,24 및 UDP-N-아세틸루코민 2-에피메라제2-에피메라아제2에 대한 cssA 유전자 인코딩에 결함이 있는 이소제돌연변이결함25를 가진 경로, 우리는 설립시 에피메라제(25)에 노출된 시알산의 역할을 분석하였다. 쥐의 질병.
이 프로토콜에서, 우리는 i.cist에 근거를 둔 실험적인 수막구균 뇌막염을 유도하는 간단한 방법을 기술합니다. Balb/c 성인 마우스에서 감염 경로. 이 방법은 특히 뮤린 숙주에서 수막구균 감염의 특성화뿐만 아니라 야생형 참조 균주 및 동인 성 돌연변이체 사이의 독성의 평가에 유용하다. 감염의 내부 -cisternal 경로는 차례로 뇌척수액 (CSF)에서 세균 복제를 용이하게하고 그 모방 기능을 가진 뇌막염을 유도 하는 시스터나 마그나에 직접 수막 구균의 완전한 전달을 보장 인간에 존재하는2,24,25,26.
프로토콜
이 프로토콜은 1986년 11월 24일(86/609/EEC)의 유럽 공동체 이사회 지침에 따라 동물의 고통을 최소화하고 마우스 수를 줄이기 위해 수행되었습니다. 이 연구에서 보고된 생체 내 실험은 윤리적 동물 관리 및 사용 위원회(Prot. Number. 2, 14 12월 2012)와 이탈리아 보건부(Prot. number 0000094-A-03/01/2013)에 의해 승인되었습니다. 모든 절차는 BSL2 룸의 생물 안전 캐비닛 2 (BSC2) 내부에서 수행되어야하며, 잠재적 인 감염된 폐기물은 전용 용기에 폐기해야합니다.
1. N. 수막염 혈청 그룹 C 균주를 가진 마우스의 감염
주의: N. 뇌막염은 잠재적으로 유해한 병원체이며이 미생물을 처리 할 때 필요한 모든 예방 조치를 취해야합니다. 전체 실험에는 생물 안전 성 수준 2 (BSL2) 봉쇄가 필요합니다. 동물 연구에 관여하는 연구원은 실험 기간 동안 일회용 개인 보호 장비(PPE)를 착용해야 합니다.
- 생체 내 감염 연구를 위한 박테리아의 준비
- GC (Gonococcal) 한천 플레이트에 신선한 Neisseria 수막염 배양물에서 1% (vol/vol) 폴리비톡스 보충제를 보충하고 GC 국물의 10 mL에서 접종한 단일 식민지를 선택하십시오.
- 220 rpm의 속도로 궤도 셰이커 인큐베이터에서 37 °C에서 박테리아를 성장시킵니다. 분광광도계로 배양물의 O.D.를 계속 확인하십시오. 0.7의 광학 밀도 OD600nm에서 초기 지수 단계까지 배양, ° 7 x 108 CFU/mL에 해당한다.
- 필요한 O.D.를 얻으면 10 % 글리세롤을 추가하여 냉동 주식을 만듭니다. 저온에서 배양 1 mL을 분배합니다. 사용할 때까지 바이알을 -80°C에서 보관하십시오.
참고: 신선한 세균 배양을 사용하는 것이 더 낫지만, 냉동 된 주식은 생체 내 실험을 단순화하고 표준화하는 데 사용되었습니다. 일반적으로 냉동 주식은 준비후 약 6개월 이내에 사용되었습니다. - 감염 전에, 실온에서 냉동 박테리아를 해동.
- 1,500 x g에서 15 분 동안 원심 분리로 세균 세포를 수확하고 철 덱스렌 (5 mg / kg)을 함유 한 신선한 GC 국물 1 mL에서 다시 중단하십시오.
참고: GC 국물은 숙주조직14,18,27에서수막구균의 복제를 선호하기 위해 철 덱스트란(5 mg/kg)을 첨가하여 제조된다. - 사용 하기 전에, 감염에 대 한 CFU의 정확한 수를 확인 하려면 박테리아의 가능한 수를 수행. 이렇게하려면, 세균 현탁액의 10 μL을 선택하고 직렬 희석을 진행하고 GC 한천 플레이트에 각 희석을 확산하고 18-24 시간 동안 5 %CO2로37 °C에서 배양하십시오.
- 쥐의 인트라 -시스테나 주사제
참고:전체 절차는 무균 조건을 유지하기 위해 층류 캐비닛에서 수행됩니다.- 집 실험실 마우스 (8 주 오래 된, 여성 Balb/c) 특정 병원 체 무료 조건 에서. 음식 펠릿 및 물 광고 리비텀을 제공합니다.
- 실험을 시작하기 전에 1 주일 동안 새로운 환경에서 동물을 정착시키자.
- 실험을 시작하기 전에 체온을 측정하고 평가하십시오.
참고: 8주령의 근친 봉제발/c 암컷 마우스의 무게는 평균 약 19g이다. 실험실 마우스의 평균 온도 는 36-38 °C24에서생리적으로 배열. - 목에서 동물을 스크럽하고, 70% 에탄올로 복부 부위를 청소하고, 25 G 바늘 0.5 mm x 16 mm를 사용하여 뮤린 복부의 오른쪽 아래 사분면에 철 덱스터n (1 % 인산염 염수 완충액, 250 mg / kg)을 주입합니다. , 감염 전에 약 2-3 시간.
참고: 복강 내 주사는 요로 방광, 장골 등과 같은 복부 장기손상을 피하기 위해 뮤린 복부의 오른쪽 사분면에서 수행되었습니다. 외인성 철공급원을 투여한 것은, 철의 형태로 덱스렌의 형태로, 감염 이전에 동물에게 숙주14,18,27에서세균 증식을 선호한다. - 2-3 시간 후 케타민 (50 mg / kg)과 자일라진 (3 mg / kg) 및 안과 윤활유로 동물 마취를 하십시오.
- 발가락을 꼬집어 때 통증 반응이 없는지 확인하여 마취의 깊이를 확인하십시오.
- 마우스를 흉골 용이한 상태로 놓고 사지와 자궁 경부를 조심스럽게 스트레칭하여 척추 기둥을 직선 위치에 유지하십시오.
- 30G 바늘 x 8mm의 주사기를 적재하기 전에 일관된 서스펜션을 유지하기 위해 세균 현탁액을 부드럽게 혼합합니다.
참고: 세균 현탁액을 주사 시간에 가능한 한 가깝게 준비; 한편, 실온에서 보관하십시오. - 포스트 해동 세균 성가자(CFU/mL)에 기초하여, 감염될 동물의 총 수에 대하여 사용될 총 CFU의 계산을 진행한다(동물 수당 CFU 세균 투여량). 유리병으로부터 취해질 정확한 부피의 계산을 진행하여 포스트 해동 세균 역가(CFU/mL)와 n 마우스의 감염에 유용한 총 CFU(포스트 해동 세균 역가 CFU) 사이의 비율을 적용하는 총 CFU를 획득합니다. : ml = 총 CFU : x). 감염될 동물의 총 수에 대하여 최종 부피를 설정한다.
참고: 이러한 실험에서, 동물당 10 4~109의 광범위한 적시가 사용되었다. - 70% 에탄올로 수술 부위를 청소하십시오.
- 바늘의 도움으로 주사 점을 확인하고 수막구균 (야생 형 균주 및 등소 생성 돌연변이 균주) 또는 GC 국물을 대조군으로 철 덱스트란 (5 mg / kg)으로 보충 한 확립 된 CFU를 쥐의 시스터나 마그나에 총 부피 10 μL로 주입하십시오. 후두 버 구멍을 통해 30 G 바늘 x 8 mm를 사용 한다.
- 특히 등지주지압 공간에서 두개내 각체 접합부에 바늘을 배치하여 시스터내 접종을 수행합니다. 벤트로 플렉스이 공간에 액세스 할 수 있도록 머리28.
- 간단히, 측면 recumbency에 동물을 배치, 길에서 귀를 잡고 적당히 목을 구부리다 (90 에 100 °). 목과 머리의 중간선이 (코에서 occiput까지)가 탁상과 완벽하게 평행한 위치에 있는지 확인하십시오.
- 아틀라스 날개를 터치하고 축 회전을 제거하여 겹치는지 확인하십시오. 자연적인 들여쓰기는 일반적으로 바늘이 후두 구멍에 들어가기 위하여 확률이 높은 중간선에 만질 수 있습니다.
- Neisseria와마우스의 주입 후 안전하게 주사기와 바늘을 폐기.
- 케이지에 동물을 놓고 각성과 움직임의 완전한 회복을 기다립니다.
- 감염된 마우스가 있는 케이지를 층류 캐비닛 아래에 보관하십시오.
- 모니터 마우스, 24 시간 포스트 감염, 혼수 상태에 따른 혼수 상태에 대한 임상 징후29. 혼수 상태에 : 1 = 혼수 상태에, 2 = 뒤로 설정 된 후 똑바로 서 있지 않습니다, 3 = 3초 이내에 똑바로 서, 4 = 5 초 이내에 똑바로 서, 최소 외래 활동, 5 = 정상.
참고: 동물에서 통증을 기록 했을 때, 멜 록 시 캄과 진통 (5 mg/kg i.p. 연구 기간 동안) 관리 되었다. - 2단계에서 상세히 설명한 바와 같이 감염된 동물에 대한 동물 생존 또는 CFU 카운트 분석기를 진행한다.
- 자궁 경부 탈구에 의해 2의 점수로 마우스의 안락사를 수행하고 통계 분석을 위해 죽은 것으로 기록.
2. 동물 생존 및 CFU 카운트
-
동물 생존
- 다른 복용량에서 세균 성 inocula준비 (에 이르기까지 104 받는 사람 109 마우스 당 CFU) i.cist에 의해 동물을 감염. 경로(1.2단계 참조).
- GC 국물로 대조군 마우스를 접종하고 철 분 덱스렌 (5 mg/kg)을 동일한 방식으로 보충하십시오.
- 임상 증상에 대 한 동물을 모니터링: 주름 모피, 구부러진 된 외관, 저체온증, 체중 감소, 혼 수, 또는 moribund24,25,26,30,매일 에 대 한 전체 실험에 걸쳐 168 시간 (7일) 실험 기간 동안 적어도 하루에 두 번.
- 매일 디지털 저울과 직장 온도계를 사용하여 체중과 온도를 측정합니다.
- 일주일 동안 마우스의 생존을 기록합니다.
참고: 관찰의 168 시간 이상 살아남는 동물이 2의 혼수 상태에 도달하는 동안 동물 포스트 감염의 자연적인 죽음을 기록합니다 안락사될 것입니다. - 혼수 상태에 2의 마우스를 마취하거나 케타민 (50 mg / kg)과 자일라진 (3 mg / kg)으로 관찰 시간 동안 생존하고 안과 연고를 적용하십시오.
- 발가락 핀치로 통증 반응이 없는지 확인합니다.
- 자궁 경부 탈구에 의해 마우스의 안락사를 수행하고 통계 분석을 위해 죽은 것으로 기록.
-
말초 기관에서 콜로니 형성 단위 (CFU) 카운트의 평가
- i.cist에 의해 동물을 접종하는 동물 생존 결과에 기초하여 서브 치명적인 세균 투여량 (5 x 105CFU / 마우스)을 사용하십시오. 경로(하위 섹션 1.2 참조).
- 감염 동안 매일 직장 온도를 모니터링하고 2 단계에서 언급 한 바와 같이 48 시간 후 감염에서 동물의 마취를 수행합니다.
- 가슴의 70% 에탄올 소독을 진행하고 25 G 바늘 0.5 mm x 16 mm를 사용하여 흉강의 심장 천자에 의해 혈액의 600-700 μL을 인출한다.
- 3.8% 구연산나트륨을 함유하는 튜브에서 혈액을 수집하고 나중에 실행 가능한 세균 세포 수를 위해 -80°C에서 저장한다.
- 동물을 희생하기 위해 자궁 경부 탈구를 수행합니다. 모든 관련 기관 및 윤리 지침에 따라 마우스를 희생 한 후 심장 박동이 없는 죽음을 확인하십시오.
- 마우스를 척추 위치에 놓고 가위와 집게를 사용하여 신체의 시상 면을 따라 모피의 절단을 진행합니다. 핀으로 몸의 측면에 모피로 피부를 고정합니다.
- 날카로운 가위를 사용하여 막막을 잘라냅니다. 가위와 일회용 집게를 사용하여 장기(예: 비장및 간)를 절제하고 10% (vol/vol) 글리세롤로 보충한 GC 국물 1 mL로 멸균 페트리 접시에 각각 넣습니다.
- IACUC 지침에 따라 마우스 본문을 안전하게 폐기합니다.
- 단일 세포 현탁액이 형성될 때까지 약 2-3 분 동안 5 mL 주사기의 플런저로 실온에서 기계적으로 기관을 균질화하고 튜브로 옮김을 옮김으로 옮김을 옮김을 전달합니다.
- 균질화된 조직 샘플로 튜브를 드라이 아이스에 즉시 넣습니다.
참고: 시료는 2 mL 멸균 튜브에 -80°C에서 저장되어 나중에 가능한 세균 세포 수 계산 평가를 수행할 수 있다. - 필요한 경우 항생제로 GC 한천 접시를 만드십시오. 사용 전에 플레이트를 37°C에서 2-3시간 동안 사전 배양한다.
- 각 균질화된 조직및 플레이트에서 GC 국물에서 샘플의 10배 직렬 희석을 GC 한천 플레이트에 준비합니다. 37 °C에서 5 %CO2로밤새 배양하십시오.
3. CFU 카운트에 대 한 뇌 조직의 준비
- i.cist에 의해 동물을 접종하는 동물 생존 결과에 기초하여 서브 치명적인 세균 투여량 (5 x 105 CFU / 마우스)을 사용하십시오. 경로(하위 섹션 1.2 참조).
- 2단계에서 언급한 바와 같이 확립된 감염 시간에 동물의 마취를 수행한다.
- 자궁 경부 탈구에 의해 동물의 안락사를 수행합니다.
- 70% 에탄올로 수술 부위를 청소하십시오.
- 큰 가위를 사용하여 마우스의 머리를 잘라.
- 작은 수술 가위와 미세 한 기울어진 강철 집게의 도움으로 모피와 피부를 절제하여 두개골 꼭대기쪽으로 진행하여 봉합사를 명확하게 보고 두개골의 개구부를 안내하십시오.
- 작은 가위 끝을 두개골을 열기 위해 포라멘 매그넘을 통해 삽입합니다.
- 두개골의 중심을 향해 두개골의 반대쪽에 정수리 뼈의 중간선을 가로 질러 잘라. 양두 봉합사의 측면 가장자리를 따라 부드럽게 자릅니다.
- 후방 정수리 코너에서 시작하여 두개골을 들어 올리고 미세한 기울어진 집게를 사용하여 뇌를 발견하기 위해 대각선으로 위로 당깁니다.
- 두개골이 들어 올릴 때 뇌 조직이 머리의 뼈에 부착되지 않았는지 확인하십시오.
- 일회용 집게를 사용하여 두개골과 뇌 사이의 결합 조직을 제거하여 두개골과 함께 뇌 조직이 제거되도록하십시오.
- 뇌 조직이 너무 많이 마르지 않도록하십시오. 일회용 집게를 사용하여 1 mL의 GC 국물을 10 % (vol / vol) 글리세롤로 보충 한 페트리 접시에 뇌를 놓습니다.
- 5 mL 주사기의 플런저로 뇌를 기계적으로 균질화하십시오 (단계 2.2.9 참조). 2mL 멸균 튜브로 샘플을 옮기고 2.2단계에서 논의된 바와 같이 나중에 실행 가능한 세균 세포 카운트 평가를 위해 -80°C를 저장한다.
결과
N. 수막염 야생 유형 및 등소생성 돌연변이 균주에 감염된 마우스의 생존.
이러한 대표적인 결과에 사용되는 Neisseria 수막염 균주는 혈청 그룹 C 기준 균주 93/4286 (ET-37) 및 cssA 유전자의 삽입 불활성화에 의해 얻어진 동위 생성 돌연변이 체93/4286ΩcssA, 코딩 상기 UDP-N-아세틸루카민 2-에피메라아제라아제는 캡슐 합성 궤적25에지도한다. 본 뮤린 모델에서 cssA-결함균의독성 정도를 평가하기 위해, 감염된 동물(LD50)의50%의 사망을 결정할 수 있는 치명적인 용량을 평가하였다. 이 목적을 위해 동물의 세 그룹은 야생 형 변형 93/4286의 104 ~ 106 CFU에 이르기까지 용량으로 감염되었고 돌연변이 균주 93/4286ΩcssA 107 에서 109 CFU 사이 . 일반적으로, 임상 파라미터의 감소(예를 들어, 체중 및 온도) 및 사망률의 증가는 감염 후 처음 72시간 이내에 일어났다. 야생형 균주에 대한 LD50은 104 CFU의 수막구균 도전과 일치하였고, 반면 105 CFU의 투여량으로 사망률은 83.4%와 100%의 CFU 100%(도 1A)와동일하였다. 반대로, 돌연변이 균주 93/4286ΩcssA에대한 LD50을 얻기 위해서는, 야생형 균주에 비해 108 CFU(도1B)의투여량이 더 많이 필요하였다.
마우스 뇌 조직에서 N. 뇌막염 실행 가능한 CFU의 평가.
감염된 동물의 뇌 조직에서 감염의 역학을 따르기 위해, 시간 과정 분석법야생형 또는 cssA 돌연변이 균주25로수행하였다. i.cist 후. 주사 5x105 CFU 의 93/4286 또는 93/4286ΩcssA 균주, 약 24 시간 후 감염에서 가장 높은 숫자에 도달 하는 뇌 조직에 야생 형 박테리아의 급속 한 증가 했다(그림 2A); 반대로 이원성 cssA-결함있는 돌연변이체에 도전한 마우스의 뇌에서, 실행 가능한 카운트는 2.026 로그 CFU± 1.774 72 h 포스트 감염까지 시간이 지남에 따라 점진적으로 떨어졌다(도 2A). 실험은 돌연변이 도전 마우스의 33.3%가 감염 부위에서 세균 클리어런스를 보였다는 것을 보여주었습니다, 야생 형 긴장을 가진 감염은 동물의 두뇌에서 결코 근절되지 않은 반면.
비장과 간 48h 후 도전에서 수막 구균 부하의 평가.
본 실험은 말초 장기에서 감염된 마우스 48시간 후 도전으로부터 박테리아의 클리어런스를 평가하기 위해 수행되었다. 이 목적을 위해, 2개의 마우스 그룹이 93/4286 또는 93/4286ΩcssA 균주 중 5 x 105 CFU로 감염되었고, 세균성 실용성 계수는 감염된 마우스25의 비장 및 간에서 평가되었다(도2B). 수막구균 주사로부터 48시간 후, cssA-결함있는돌연변이체는 비장 및 간에서 완전히 제거되었고, 야생형 균주에 감염된 동물은 지속적인 전신 감염 프레임워크를 나타냈다. 48시간 이후의 CFU의 평균 값은 실제로 각각 비장 및 간에서 3.212 로그 CFU±3.354 및 6.949 로그 CFU±1.37이었다. 2개의 동물 군의 간 조직에서 세균 하중의 차이는 통계적으로 유의하였다(P < 0.001).
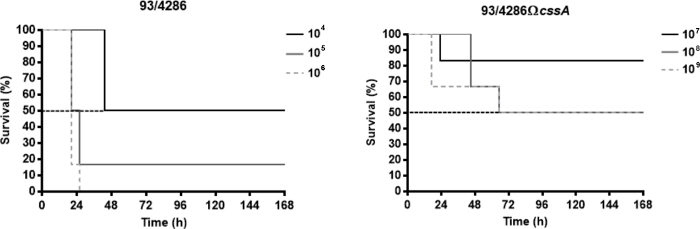
그림 1: 93/4286 야생형 또는 cssA-결함이있는 N. 뇌막염 균주에 감염된 마우스의 생존. (A)Balb/c 마우스의 3개 그룹(n=6/투여량)을 감염시켰다. 와 104,105,그리고 106 6 CFU/마우스 야생 형 변형 93/4286 및(B)와 107,108,109 CFU/마우스 의 이소제닉 cssA-결함 돌연변이. 마우스를 1주일 동안 모니터링하고 생존을 기록하였다. 결과는 시간이 지남에 따라 상이한 투여량에서 퍼센트 생존률로 발현되고, 로그 랭크 p 값은 야생형 균주에 감염된 마우스에 대해 < 0.05였다. 이 수치는 Colicchio 외25에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
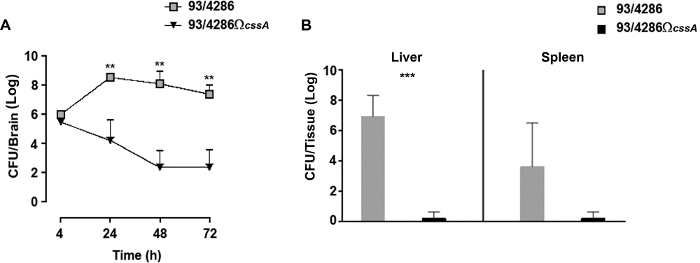
그림 2: 93/4286 또는 93/4286ΩcssA 균주로 접종된 마우스에서 시간이 지남에 따라 세균 부하를 평가합니다. (A)i.cist 다음 뇌 조직에 세균 부하의 시간 과정. 감염. Balb/c 마우스의 2개 그룹(n=20/그룹)은 i.cist에 의해 감염되었다. 야생 형 변형 93 /4286 또는 cssA-결함있는 돌연변이의 5 x 105 CFU가있는 경로. 동물은 감염 후 4, 24, 48 및 72 시간 희생되었다. 뇌를 수확하고, GC 배지에서 기계적으로 균질화하고, 실행 가능한 수를 결정하였다. 결과는 접종 후 상이한 시점에서 기관당 CFU 번호의 평균 ±SD 로그로 표현된다. 별표는 통계적 유의성(**, P< 0.01)을 나타낸다. (B)비장과 간에서 시간이 지남에 따라 세균부하가 됩니다. Balb/c 마우스의 2군(n=5/군)을 감염시켰다. 5 x 105 CFU 중 하나 와일드 타입 변형 93/4286 또는 cssA-결함 돌연변이. 동물은 감염 후 48시간 동안 안락사시켰다. 비장과 간을 수확하고 기계적으로 균질화했으며 실행 가능한 수를 결정했습니다. 결과는 기관당 로그 CFU 번호로 표시됩니다. 가로 막대는 세균 성기의 평균 로그를 나타냅니다. 별표는 통계적 유의성(***, P< 0.001)을 나타낸다. 이 수치는 Colicchio 외25에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 연구에서는, 우리는 i.cist에 의해 성인 마우스에 있는 수막구균 뇌막염을 유도하는 실험적인 프로토콜을 기술합니다. 수막 구균 박테리아의 접종. 우리의 지식에, 수막 구균 뇌막염의 다른 모델은 i.cist에 의해 감염된 실험실 마우스에서 개발되지 않았습니다. 경로; 과거에는, 이 쪽은 쥐(31)와 토끼(32)둘 다에 있는 수막구균 뇌막염의 모형을 제공하기 위하여 탐구되었습니다. 수막구균 질환의 가장 높은 비율이 어린 아이들, 청소년 및 젊은 성인33,34,35사이에서 발견되는 것으로 잘 알려져 있습니다. 이러한 이유로, 우리의 뇌막염 마우스 모형에서는, 신생아 또는 유아 동물에 집중하는 대신에, 8 주 된 면역 적격 동물이 채택되었습니다.
실험 모델에서 i.cist를 사용하기로 결정했습니다. 그것은 CSF에 있는 세균성 복제를 촉진하기 위하여 cisterna magna로 직접 수막구균의 방출을 지키기 때문에 접종. 접종의이 경로는 생리적으로 더 접근28 및 이미 연쇄상 구균 종으로 인해 뇌막염의 개발에 사용되는 두개내 지주 종 경로보다 덜 외상성이다. 36,37. 그것은 meningococcus의 감염의 자연적인 방법을 나타내지 않더라도, 이 지역에 있는 박테리아의 주입은 마우스 생존, 박테리아 부중, 임상 매개변수에 의해 도시된 것과 같이 수막구균 뇌막염의 유도를 위한 중요한 것이었습니다, 또한에 의해 조직학적 분석24,25,26. 흥미롭게도, 기준균주 93/4286은 인간 질병24,25,26에서관찰된 것을 모방한 조직병리학적 특징을 가진 뇌막염을 유도하였다.
표준화된 뮤린 감염을 확립하고 연구자의 안전성보장을 위해, 신선한 세균 성장보다는 박테리아의 적정 냉동 재고로부터 시작하는 것이 바람직했다24,25,30, 38, 또한, 우리는 빠른 치명적인 결과를 제한하고 뇌 손상의 개발을 허용하는 것을 목표로 살아있는 수막 구균의 하위 치명적인 용량을 사용하기로 결정2,24,25,26. 그럼에도 불구하고, 다른 균주에 대한 적절한 전염성 복용량을 결정하기 위해 예비 실험을 수행해야합니다. 본 연구에서, 우리는 혈청그룹 C 기준 균주 93/4286 및 동위 원성 돌연변이 균주 93/4286ΩcssA를 5 x 105 CFU/마우스의 용량으로 테스트하였다.
이 모형은 식민지의 처음 단계 및 meningococcus의 침략을 모방하지 않더라도, 세균성 격리는 CSF에서 뿐만 아니라 잘 자랍니다, 그러나 또한 비장과 간 구획에 남아 있을 수 있습니다. neisserial 감염의 hypoferremic 단계 도중, 헴 유래 철의 대부분은 간 페리틴과 결합된 남아 있습니다. 페리틴은철분(39)을얻기 위해 수막구균을 사용할 수 있기 때문에, 간은 세균 복제를 위한 표적 기관을 구성한다.
이러한 실험 절차에서, 근친봉 Balb/c 마우스 스트레인은 원래 수막구균 수막염 모델24를개발하기 위해 사용되었던 근친 CD-1 균주의 대체에 사용되었다. 아웃브레드 마우스는 인간 인구40,41과같은 가변 코호트에서 여러 가지 효과를 밝히는 것이 더 적절할 수 있는 광범위한 유전적 가변성을 특징으로 하였다. 그러나, 이 가변성은 충분한 통계적 유의성을 얻기 위하여 더 높은 견본 크기를 필요로 하고 절차 및 표적으로 한 연구 결과의 표준화를 방해할 수 있습니다.
수막구균의 좁은 숙주 범위에도 불구하고, 뮤린 숙주에서 박테리아의 복제를 보장하고 수막구균의 독성을 향상시키기 위해, 철 덱스트론은 감염 전 동물에게 투여되었다6,14. 마지막으로, 뇌막염의 다른 실험 모델과 비교하여, 동물은 어떤 항생제로 치료되지 않았고, 염증 반응의 과정 및/또는 프로필에 영향을 미치지않았다(26).
현재까지, 우리의 연구는 i.cist를 강조했다. 모델은 수막염이 확립되기 전에 패혈증과 균혈증의 발생을 특징으로 하는 감염의 i.p. 또는 i.n. 모델에 비해 수막염 및 침습성 수막구균 질환을 모두 유도하는 기능성10,11 ,12,13,14,15,16,17. 따라서, 뮤린 숙주에서 뇌막염의 유도에 기초한 이 감염 모델은, CSF로 직접 세균 복제를 방지하기 위한 혁신적인 치료 전략을 평가할 뿐만 아니라 가능한 수동 면역의 효능을 분석하는 데에도 유용할 수 있습니다. 인간 병원체에 대한 치료.
그러나 수막구균 감염은 비 인두 식민지화, 혈류에 대한 접근, 혈액 뇌 장벽의 교차 및 CSF에서 마지막으로 통제되지 않은 증식을 포함하는 다단계 과정이며, 우리의 모델은 수막구균 감염은, 부분적으로 전복하기 위해 이러한 한계형 형질전환 동물 모델은 수막구균 질환의 인간 병인을 모방하는 데 유용할 수 있다.
공개
저자는 공개 할 것이 없다.
감사의 말
연구는 PRIN 2012 [부여 번호 2012WJSX8K]에 의해 부분적으로 지원되었다: "점막 감염에 있는 호스트 미생물 상호 작용 모형: 새로운 치료 전략의 발달" 및 PRIN 2017 [2017SFBFER]에 의해: "상호 작용을 해결하기 위한 통합된 접근법 적응, 스트레스 조건 및 도전 병원 체의 항균 저항".
자료
| Name | Company | Catalog Number | Comments |
| 1,8 Skirted Cryovial With external thread | Starlab | E3090-6222 | |
| 50 mL Polypropylene Conical Tube | Falcon | 352070 | 30 mm x 115 mm |
| Adson Forceps | F.S.T. | 11006-12 | Stainless Steel |
| Alarm-Thermometer | TESTO | 9000530 | |
| BactoTM Proteose Peptone | BD | 211693 | |
| BD Micro Fine syringe | BD | 320837 | U-100 Insulin |
| BD Plastipak syringe 1 mL 25 G 5/8 inch | BD | 300014 | 05 mm x 16 mm |
| BD Plastipak syringe 5 mL | BD | 308062 | 07 mm x 30 mm |
| BIOHAZARD AURA B VERTICAL LAMINAR FLOW CABINET | Bio Air s.c.r.l. | Aura B3 | |
| BioPhotometer | Eppendorf | Model #6131 | |
| Bottle D | Tecniplast | D | Graduated up to: 400 mL, Total Volume 450 mL, 72 mm x 72 mm x 122 mm |
| C150 CO2 Incubator | Binder | 9040-0078 | |
| Cage Body Eurostandard Type II | Tecniplast | 1264C | 267 x 207 x 140 mm3, Floor area 370 cm2 |
| Cell Culture Petri Dish With Lid | Thermo Scientific | 150288 | Working Volume: 5 mL |
| Centrifuge | Eppendorf | Microcentrifuge 5415R | |
| Cuvetta semi-micro L. Form | Kartell S.p.A. | 01938-00 | |
| di-Potassium hydrogen phosphate trihydrate | Carlo erba | 471767 | |
| di-Sodium hydrogen phosphate anhydrous ACS-for analysis | Carlo Erba | 480141 | g1000 |
| Diete Standard Certificate | Mucedola s.r.l. | 4RF21 | Food pellet for animal |
| Dumont Hp Tweezers 5 Stainless Steel | F.S.T. by DUMONT | AGT5034 | 0.10 x 0.06 mm2 tip |
| Electronic Balance | Gibertini | EU-C1200 | Max 1200 g, d = 0.01 g, T = -1200 g |
| Eppendorf Microcentrifuge tube safe-lock | Eppendorf | T3545-1000EA | |
| Erythromycin | Sigma-Aldrich | E-6376 | 25 g |
| Extra Fine Bonn Scissors | F.S.T. | 14084-08 | Stainless Steel |
| Filter Top (mini- Isolator), H-Temp with lock clamps | Tecniplast | 1264C400SUC | |
| GC agar base | OXOID | CM0367 | |
| Gillies Forceps 1 x2 teeth | F.S.T. | 11028-15 | Stainless Steel |
| Glicerin RPE | Carlo Erba | 453752 | 1 L |
| Graefe Forceps | F.S.T. | 11052-10 | Serrated Tip Width: 0.8 mm |
| Inner lid | Tecniplast | 1264C116 | |
| Iron dextran solution | Sigma-Aldrich | D8517-25ML | |
| Ketamine | Intervet | ||
| Microbiological Safety Cabinet BH-EN and BHG Class II | Faster | BH-EN 2004 | |
| Microcentrifuge tubes 1.5 mL | BRAND | PP780751 | screw cap PP, grad |
| Mouse Handling Forceps | F.S.T. | 11035-20 | Serrated rubber; Gripping surface: 15 mm x 20 mm |
| Mucotit-F2000 | MERZ | 61846 | 2000 mL |
| Natural Latex Gloves | Medica | M101 | |
| New Brunswick Classic C24 Incubator Shaker | PBI international | C-24 Classic Benchtop Incubator Shaker | |
| Petri PS Dishes | VWR | 391-0453 | 90 x 14.2 mm2 |
| Pipetman Classic P20 | Gilson | F123600 | 2-20 μL |
| Pipetman Classic P200 | Gilson | F123601 | 20-200 μLL |
| Pipetman Classim P1000 | Gilson | F123602 | 200-1,000 μL |
| Polyvitox | OXOID | SR0090A | |
| Potassium Chloride | J.T. Baker Chemicals B.V. | 0208 | 250 g |
| Potassium Dihydrogen Phosphate | J.T. Baker Chemicals B.V. | 0240 | 1 kg |
| PS Disposible forceps | VWR | 232-0191 | |
| Removable Divider | Tecniplast | 1264C812 | |
| Round-Bottom Polypropylene Tubes | Falcon | 352063 | 5 mL |
| Sodium Chloride | MOLEKULA | 41272436 | |
| SS retainer and Polyester FilterSheet | Tecniplast | 1264C | |
| Standard Pattern Forceps | F.S.T. | 11000-12 | Stainless |
| Stevens Tenotomy Scissors | F.S.T. | 14066-11 | Stainless Steel |
| Surgical Scissor - ToughCut | F.S.T. | 14130-17 | Stainless |
| Touch N Tuff disposible nitrile gloves | Ansell | 92-500 | |
| Ultra Low Temperature (ULT) Freezer | Haier | DW-86L288 | Volume = 288 L |
| Wagner Scissors | F.S.T. | 14070-12 | Stainless Steel |
| Xylazine | Intervet |
참고문헌
- van Deuren, M., Brandtzaeg, P., van der Meer, J. W. Update on meningococcal disease with emphasis on pathogenesis and clinical management. Clinical Microbiology Reviews. 13, 144-166 (2000).
- Colicchio, R., et al. Fitness Cost of Rifampin Resistance in Neisseria meningitidis: In vitro Study of Mechanisms Associated with rpoB H553Y Mutation. Antimicrobial Agents and Chemotherapy. 59 (12), 7637-7649 (2015).
- Talà, A., et al. Serogroup-specific interaction of Neisseria meningitidis capsular polysaccharide with host cell microtubules and effects on tubulin polymerization. Infection and Immunity. 82, 265-274 (2014).
- Pagliarulo, C., et al. Regulation and differential expression of gdhA encoding NADP-specific glutamate dehydrogenase in Neisseria meningitidis clinical isolates. Molecular Microbiology. 51, 1757-1772 (2004).
- Plant, L., Jonsson, A. B. Contacting the host: insights and implications of pathogenic Neisseria cell interactions. Scandinavian Journal of Infectious Diseases. 35, 608-613 (2003).
- Schryvers, A. B., Stojiljkovic, I. Iron acquisition systems in the pathogenic Neisseria. Molecular Microbiology. 32, 1117-1123 (1999).
- Virji, M., Makepeace, K., Ferguson, D. J., Watt, S. M. Carcinoembryonic antigens (CD66) on epithelial cells and neutrophils are receptors for Opa proteins of pathogenic neisseriae. Molecular Microbiology. 22, 941-950 (1996).
- de Vries, F. P., van Der Ende, A., van Putten, J. P., Dankert, J. Invasion of primary nasopharyngeal epithelial cells by Neisseria meningitidis is controlled by phase variation of multiple surface antigens. Infection and Immunity. 64, 2998-3006 (1996).
- Tinsley, C. R., Heckels, J. E. Variation in the expression of pili and outer membrane protein by Neisseria meningitidis during the course of the meningococcal infection. Journal of General Microbiology. 132, 2483-2490 (1986).
- Gorringe, A. R., et al. Experimental disease models for the assessment of meningococcal vaccines. Vaccine. 23, 2214-2217 (2005).
- Newcombe, J., et al. Infection with an avirulent phoP mutant of Neisseria meningitidis confers broad cross-reactive immunity. Infection and Immunity. 72, 338-344 (2004).
- Oftung, F., Lovik, M., Andersen, S. R., Froholm, L. O., Bjune, G. A mouse model utilising human transferrin to study protection against Neisseria meningitidis serogroup B induced by outer membrane vesicle vaccination. FEMS Immunology and Medical Microbiology. 26, 75-82 (1999).
- Salit, I. E., Tomalty, L. Experimental meningococcal infection in neonatal mice: differences in virulence between strains isolated from human cases and carriers. Canadian Journal of Microbiology. 30, 1042-1045 (1984).
- Salit, I. E., Tomalty, L. A neonatal mouse model of meningococcal disease. Clinical and Investigative Medicine. 9, 119-123 (1986).
- Mackinnon, F. G., Gorringe, A. R., Funnell, S. G., Robinson, A. Intranasal infection of infant mice with Neisseria meningitidis. Microbial Pathogenesis. 12, 415-420 (1992).
- Mackinnon, F. G., et al. Demonstration of lipooligosaccharide immunotype and cap- sule as virulence factors for Neisseria meningitidis using an infant mouse intranasal infection model. Microbial Pathogenesis. 15, 359-366 (1993).
- Yi, K., Stephens, D. S., Stojiljkovic, I. Development and evaluation of an improved mouse model of meningococcal colonization. Infection and Immunity. 71 (4), 1849-1855 (2003).
- Holbein, B. E., Jericho, K. W. F., Likes, G. C. Neisseria meningitidis infection in mice: influence of iron, variations in virulence among strains, and pathology. Infection and Immunity. 24, 545-551 (1979).
- Saukkonen, K. Experimental meningococcal meningitis in the infant rat. Microbial Pathogenesis. 4, 203-211 (1988).
- Johansson, L., et al. CD46 in meningococcal disease. Science. 301, 373-375 (2003).
- Zarantonelli, M. L., et al. Transgenic mice expressing human transferrin as a model for meningococcal infection. Infection and Immunity. 75, 5609-5614 (2007).
- Join-Lambert, O., et al. Meningococcal interaction to microvasculature triggers the tissular lesions of purpura fulminans. Journal of Infection Disease. 208, 1590-1597 (2013).
- Melican, K., Michea Veloso, P., Martin, T., Bruneval, P., Duménil, G. Adhesion of Neisseria meningitidis to dermal vessels leads to local vascular damage and purpura in a humanized mouse model. PLoS Pathogen. 9, 1003139 (2013).
- Colicchio, R., et al. The meningococcal ABC-Type L-glutamate transporter GltT is necessary for the development of experimental meningitis in mice. Infection and Immunity. 77, 3578-3587 (2009).
- Colicchio, R., et al. Virulence traits of serogroup C meningococcus and isogenic cssA mutant, defective in surface-exposed sialic acid, in a murine model of meningitis. Infection and Immunity. , 00688-00718 (2019).
- Ricci, S., et al. Inhibition of matrix metalloproteinases attenuates brain damage in experimental meningococcal meningitis. BMC Infectious Diseases. 14, 726 (2014).
- Schryvers, A. B., Gonzalez, G. C. Comparison of the abilities of different protein sources of iron to enhance Neisseria meningitidis infection in mice. Infection and Immunity. 57, 2425-2429 (1989).
- Beverly, K. S. Chapter 105 - Cerebrospinal Fluid Sampling Small Animal. Critical Care Medicine. , 448-452 (2009).
- Liechti, F. D., Grandgirard, D., Leppert, D., Leib, S. L. Matrix metalloproteinase inhibition lowers mortality and brain injury in experimental pneumococcal meningitis. Infection and Immunity. 82, 1710-1718 (2014).
- Pagliuca, C., et al. Novel Approach for Evaluation of Bacteroides fragilis Protective Role against Bartonella henselae Liver Damage in Immunocompromised Murine Model. Frontiers in Microbiology. 7, 1750 (2016).
- Trampuz, A., Steinhuber, A., Wittwer, M., Leib, S. L. Rapid diagnosis of experimental meningitis by bacterial heat production in cerebrospi- nal fluid. BMC Infectious Diseases. 7, 116 (2007).
- Tuomanen, E. I., Saukkonen, K., Sande, S., Cioffe, C., Wright, S. D. Reduction of inflammation, tissue damage, and mortality in bacterial meningitis in rabbits treated with monoclonal antibodies against adhesion-promoting receptors of leukocytes. Journal of Experimental Medicine. 170, 959-969 (1989).
- Goldschneider, I., Gotschlich, E. C., Artenstein, M. S. Human immunity to the meningococcus. I. The role of humoral antibodies. Journal of Experimental Medicine. 129, 1307-1326 (1969).
- Goldschneider, I., Gotschlich, E. C., Artenstein, M. S. Human immunity to the meningococcus. II. Development of natural immunity. Journal of Experimental Medicine. 129, 1327-1348 (1969).
- World Health Organization. Laboratory methods for the diagnosis of meningitis caused by Neisseria meningitidis, Streptococcus pneumoniae, and Haemophilus influenzae: WHO manual, 2nd Edition. World Health Organization. , (2011).
- Chiavolini, D., et al. Method for inducing experimental pneumococcal meningitis in outbred mice. BMC Microbiolology. 4, 36 (2004).
- Zhang, S., et al. Intracranial Subarachnoidal Route of Infection for Investigating Roles of Streptococcus suis Biofilms in Meningitis in a Mouse Infection Model. Journal of Visualized Experiments. (1), e137 (2018).
- Pagliuca, C., et al. Evidence of Bacteroides fragilis protection from Bartonella henselae-induced damage. PLoS One. 7, 49653 (2012).
- Larson, J. A., Howie, H. L., So, M. Neisseria meningitidis accelerates ferritin degradation in host epithelial cells to yield an essential iron source. Molecular Microbiology. 53, 807-820 (2004).
- Festing, M. F. W. Phenotypic variability of inbred and outbred mice. Nature. 263, 230-232 (1976).
- Festing, M. F. W. Warning: the use of heterogeneous mice may seriously damage your research. Neurobiology of Aging. 20, 237-244 (1999).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유