Method Article
Indurre Meningococcal Meningitis Serogroup C in Topi tramite consegna intracisternale
In questo articolo
Riepilogo
Qui, descriviamo un metodo per indurre la meningite meningococcica attraverso una via intracisternale di infezione nei topi adulti. Vi presentiamo un protocollo passo dopo passo dell'infezione da meningococco dalla preparazione dell'inoculum all'infezione intracisternale; quindi registrare la sopravvivenza animale e valutare i carichi batterici nei tessuti murini.
Abstract
Neisseria meningitidis (meningococcus) è un microrganismo a portata stretta di ospite, riconosciuto a livello globale come la principale causa di meningite batterica. Il meningococco è un colonizzatore transitorio di nasofaringe nona l'uomo di circa il 10% del soggetto sano. In circostanze particolari, acquisisce una capacità invasiva di penetrare la barriera mucosale e invade il flusso sanguigno causando setticemia. Nell'ultimo caso, la sepsi fulminante potrebbe sorgere anche senza il conseguente sviluppo della meningite. Al contrario, i batteri potrebbero non moltiplicarsi male nel flusso sanguigno, attraversare la barriera ematoencefalica, raggiungere il sistema nervoso centrale, portando alla meningite fulminante. I modelli murini della meningite batterica rappresentano uno strumento utile per studiare le interazioni ospite-patogeno e per analizzare i meccanismi patogeni responsabili di questa malattia letale. Anche se, diversi sistemi di modelli sperimentali sono stati valutati nel corso degli ultimi decenni, nessuno di questi è stato in grado di riprodurre gli eventi patologici caratteristici della malattia meningococcica. In questo protocollo sperimentale, descriviamo una procedura dettagliata per l'induzione della meningite meningococco in un modello murino basato sull'inoculazione intracisternale dei batteri. I segni peculiari della meningite umana sono stati registrati nell'ospite murino attraverso la valutazione dei parametri clinici (ad esempio, temperatura, peso corporeo), la valutazione del tasso di sopravvivenza, l'analisi microbiologica e l'esame istologico della lesione cerebrale. Quando si utilizza l'inoculto intracisternale (i.cist.), le meningococci consegna completa direttamente in cisterna magna, portando ad una replica meningococcica molto efficiente nel tessuto cerebrale. Un aumento di 1.000 volte di conteggio praticabile di batteri è osservato in circa 18 h. Inoltre, le meningococchi si trovano anche nella milza e nel fegato dei topi infetti, suggerendo che il fegato può rappresentare un organo bersaglio per la replicazione meningococcica.
Introduzione
Neisseria meningitidis è un Gram negativo - proteobacterium limitato all'ospite umano, ben noto per essere una delle cause più comuni di meningite e sepsi nella popolazione umana in tutto il mondo. Colonizza il tratto respiratorio superiore (naso e gola) di portatori sani e asintomatici (2-30% della popolazione), ma il batterio a volte elude varie difese immunitarie dell'ospite e si diffonde dal flusso sanguigno al cervello causando un locale incontrollato infiammazione, conosciuta come meningite meningococcale. Una combinazione di fattori ospiti e batterici sembra contribuire alla transizione dal comportamento commensale al comportamento invasivo1.
N. meningitidis è specializzata esclusivamente nella colonizzazione umana e nell'infezione. Ha una gamma di ospiti ristretta e, quindi, ha limitato gli studi di patogenesi in vivo a causa della mancanza di modelli animali adatti che riproducono la malattia meningococcale umana. Di conseguenza, aveva portato a lacune fondamentali nella comprensione per quanto riguarda la patogenesi della setticemia e meningite causata dal meningococco. Negli ultimi decenni, lo sviluppo di molti sistemi in vitro ha permesso l'identificazione di diversi fattori di virulenza meningococcica2,3,4. Sebbene questi preziosi studi abbiano fornito importanti informazioni per comprendere il ruolo di questi fattori per un'infezione meningococcica di successo, questi modelli non hanno permesso di valutare le conseguenze delle interazioni batteriche con l'ortore e il cellulare sistema immunitario e ancor meno con l'intero tessuto. I modelli animali in vivo di infezione sono di grande rilevanza anche per la valutazione del grado di protezione conferito dalle formulazioni del vaccino. Come patogeno umano-tropico, il meningococco possiede determinanti appropriati necessari per un'infezione di successo come le strutture superficiali (cioè, i pili di tipo IV e le proteine di opacità) e i sistemi di assorbimento del ferro per i recettori umani e le proteine di trasporto (ad es. transferrin e lattoferina)5,6,7 per aderire correttamente, sopravvivere e invadere l'ospite umano. Infine, le capacità di variazione genetica del patogeno per eludere e/o bloccare la risposta immunitaria umana contribuiscono ulteriormente al tropismo ad alta specie8,9. Pertanto, l'assenza di specifici fattori ospiti, coinvolti nell'interazione, può bloccare i passi del ciclo di vita dell'agente patogeno, stabilendo notevoli difficoltà nello sviluppo di piccoli modelli animali che riassumono il ciclo di vita meningococcico.
Negli ultimi decenni, sono stati sviluppati diversi approcci per migliorare la nostra comprensione del ciclo infettivo meningococcico. Le infezioni di due modelli animali, topo e ratto, sia per via intraperitonelale (i.p.) o per intranasale (i.n.), sono state sviluppate per riprodurre la malattia meningococcica10,11,12,13,14 ,15,16,17. Il topo da laboratorio è probabilmente uno degli animali più versatili per indurre l'infezione da meningococco sperimentale.
Tuttavia, il modo di infezione i.p. porta allo sviluppo di sepsi grave anche se non imita la via naturale dell'infezione, mentre la via dell'infezione i.n. è stata utile per valutare la patogenesi meningococcica, anche se può indurre l'infezione polmonare prima della sepsi10,11,12,13,14,15,16,17.
Il modello di mouse i.p. è stato strumentale per valutare la protezione dalla sfida meningococcico10,11,12. Il modello murino della colonizzazione meningococcica basata sulla via dell'infezione i.n. è stato sviluppato con topi infantili, in quanto sono più suscettibili alle meningococchi, per riprodurre un'infezione invasiva che imita il decorso della malattia meningococcica nell'uomo 13,14,15,16,17. Inoltre, per promuovere la replicazione meningococcica nell'ospite murino, sono state applicate anche un numero crescente di strategie tecniche tra cui la somministrazione del ferro agli animali per migliorare l'infezione, l'uso di inoculumbatterico elevato , ceppo batterico del passaggio di topo e l'impiego di ospiti animali infantili o immunocompromessi10,13,15,18,19. L'espressione di fattori umani specifici come CD4620 o transferrin21 ha aumentato la suscettibilità dei topi a questo batterio umano-tropico; l'impiego del modello xenotrapianto della pelle umana è stato utile anche per valutare la capacità di adesione di meningococci all'endotelio umano22,23. Collettivamente, il recente sviluppo di topi transgenici umanizzati ha migliorato la comprensione della patogenesi meningococcica e delle sue interazioni con l'ospite.
In precedenza, abbiamo sviluppato un modello murino di meningite meningococco dove l'inoculazione dei batteri è stata eseguita nella cisterna magna di topi adulti con batteri passati daitopi 24. I parametri clinici e il tasso di sopravvivenza dei topi infetti hanno dimostrato la creazione di meningite con caratteristiche paragonabili a quelle osservate nell'ospite umano, nonché le analisi microbiologiche e istologiche del cervello. Da questi topi infetti, i batteri sono stati, anche, recuperati dal sangue, fegato, e milza, e carichi batterici da organi periferici correlati con la dose infettiva. In particolare, questo modello è stato impiegato per valutare la virulenza di un ceppo mutante isogenico difettoso nel trasportatore L-glutammato GltT24. Recentemente, utilizzando il nostro modello murino di meningite meningococcica basata su i.cist. percorso con ceppo C sierogruppo C 93/42862,24 e un mutante isogenico difettoso nella codifica genica cssA per UDP-N-acetylglucosamine 2-epimerase2,abbiamo analizzato il ruolo dell'acido sialico esposto nello stabilimento della malattia nei topi.
In questo protocollo, descriviamo un metodo semplice per indurre meningite sperimentale meningococcica basata sull'i.cist. dell'infezione nei topi adulti balb/c. Questo metodo è particolarmente utile per la caratterizzazione dell'infezione da meningococco in un ospite murino, nonché per la valutazione della virulenza tra ceppi di riferimento di tipo selvaggio e mutanti isogenici. La via intra-cisternale dell'infezione garantisce la consegna completa delle meningocci direttamente nella cisterna magna, che a sua volta facilita la replica batterica nel liquido cerebrospinale (CSF) e induce la meningite con caratteristiche che imitano quelle presentesull'uomo 2,24,25,26.
Protocollo
Questo protocollo è stato condotto per ridurre al minimo la sofferenza degli animali e il numero di topi in conformità con la direttiva del Consiglio delle Comunità europee del 24 novembre 1986 (86/609/CEE). Gli esperimenti in vivo riportati in questo studio sono stati approvati dall'Ethical Animal Care and Use Committee (Prot. numero 2, 14 dicembre 2012) e dal Ministero della Salute italiano (Prot. numero 0000094-A-03/01/2013). Tutte le procedure devono essere eseguite all'interno del Gabinetto per la biosicurezza 2 (BSC2) in una stanza BSL2 e i potenziali rifiuti infetti devono essere smaltiti in contenitori dedicati.
1. Infezione dei topi con N. meningitidis Serogroup C Strain
AVVISO: N. meningitidis è potenzialmente un agente patogeno dannoso e tutte le precauzioni necessarie devono essere prese quando si maneggia questo microrganismo. L'intera sperimentazione richiede il contenimento del livello di biosicurezza 2 (BSL2). Il ricercatore coinvolto negli studi sugli animali deve indossare dispositivi di protezione personale usa e getta (PPE) per tutta la durata dell'esperimento.
- Preparazione di batteri per studi di infezione in vivo
- Scegli una singola colonia da una nuova cultura Meningitidis Neisseria su piastra di agar GC (Gonococcal) integrata con supplemento Polyvitox dell'1% (vol/vol) e inoculato in 10 mL di brodo GC.
- Far crescere i batteri a 37 gradi centigradi in un incubatore di shaker orbitale con una velocità di 220 giri/min. Continua a controllare l'O.D. della cultura con uno spettrometro. Far crescere la coltura fino alla fase esponenziale iniziale a una densità ottica OD600nm di 0,7, corrispondente a 7 x 108 CFU/mL.
- Una volta ottenuta la causa del sistema operativo richiesto, effettuare le scorte congelate aggiungendo il 10% di glicerolo. Distribuisci 1 mL della cultura nei crioviali. Conservare le fiale a -80 gradi centigradi fino all'uso.
NOT: Anche se è meglio usare la coltura batterica fresca, gli stock surgelati sono stati utilizzati per semplificare e standardizzare l'esperimento in vivo. Di solito le scorte congelate sono state impiegate entro circa 6 mesi dalla preparazione. - Prima dell'infezione, scongelare i batteri congelati a temperatura ambiente.
- Raccogliere le cellule batteriche per centrifugazione per 15 min a 1.500 x g e rimovicare in 1 mL di brodo fresco GC contenente dextran di ferro (5 mg/kg).
NOT: Il brodo GC viene preparato con l'aggiunta di dextran di ferro (5 mg/kg) al fine di favorire la replicazione delle meningocci nel tessuto ospite14,18,27. - Prima dell'uso, eseguire conteggi vitali di batteri per determinare il numero esatto di CFU per l'infezione. Per farlo, raccogliere 10 oL di sospensione batterica e procedere con diluizioni seriali e stendere ogni diluizione sulle piastre di agar GC e incubare a 37 gradi centigradi con 5% di CO2, per 18-24 h.
- Iniezione intra-cisternale di topi
nota:L'intera procedura viene eseguita nell'armadio del flusso laminare per mantenere le condizioni asettiche.- Topi da laboratorio di casa (8 settimane, balb/c femminili) in condizioni specifiche prive di agenti patogeni. Fornire pellet alimentari e acqua al libitum.
- Sistemare gli animali nel nuovo ambiente per 1 settimana prima di iniziare l'esperimento.
- Prima di iniziare l'esperimento, pesare e valutare la loro temperatura corporea.
NOT: I topi femmina di Balb/c inbred di otto settimane pesano in media circa 19 g. La temperatura media dei topi di laboratorio è fisiologicamente variabile dai 36-38 gradicentigradi. - Scruff l'animale dal collo, pulire l'area dell'addome con il 70% di etanolo e iniettare i.p. dextran di ferro (sciolto in 1 % fosfato tampone salina, 250 mg/kg) nel quadrante inferiore destro dell'addome murino utilizzando un ago da 25 G 0,5 mm x 16 mm circa 2-3 h prima dell'infezione.
NOT: L'iniezione intraperitoneale è stata eseguita nel quadrante inferiore destro dell'addome murino per evitare di danneggiare gli organi addominali come vescica urinaria, cecum, ecc. La somministrazione di sorgente di ferro esogena, sotto forma di dextran di ferro, agli animali prima dell'infezione favorisce la moltiplicazione batterica nell'ospite14,18,27. - Dopo 2-3 h, eseguire l'anestesia animale con chetamina (50 mg/kg) e xilizina (3 mg/kg) e lubrificante oftalmico.
- Controllare la profondità dell'anestesia assicurando l'assenza di risposta al dolore dopo aver pizzicando il dito del dito del dito del tutto.
- Posizionare il mouse in decubito sternale e allungare con attenzione gli arti e la colonna vertebrale cervicale per mantenere la colonna vertebrale in posizione dritta.
- Mescolare delicatamente le sospensioni batteriche per mantenere una sospensione costante prima di caricare una siringa di 30 G ago x 8 mm.
NOT: Preparare la sospensione batterica il più vicino possibile al tempo di iniezione; nel frattempo, conservarlo a temperatura ambiente. - Sulla base del titro batterico post scongelamento (CFU/mL), procedere con il calcolo della CFU totale da utilizzare, rispetto al numero totale di animali da infettare (dose batterica CFU per numero di animali). Procedere con il calcolo del volume esatto da prelevato dalla fiala per ottenere la CFU totale applicando una proporzione tra il titro batterico post scongelato (CFU/mL) e la CFU totale utile per l'infezione di n topi (CFU titro batterico post scongelato : ml : CFU totale : x). Stabilire il volume finale rispetto al numero totale di animali da infettare.
NOT: In questi esperimenti, è stata utilizzata una vasta gamma di titro da 104 a 109 per animale. - Pulire l'area chirurgica con il 70% di etanolo.
- Identificare il punto di iniezione con l'aiuto di un ago e iniettare la CFU stabilita di meningococci (ceppo di tipo selvaggio e ceppo mutante isogenico), o brodo GC integrato con dextran di ferro (5 mg/kg) come controllo, in un volume totale di 10 l nella cisterna magna dei topi attraverso un foro di bava occipitale utilizzando un ago 30 G x 8 mm.
- Eseguire l'inoculo cisternale posizionando l'ago alla giunzione craniocervica, in particolare nello spazio subaracnoideo dorsale. Ventroflex la testa per rendere questo spazio accessibile28.
- In breve, mettere l'animale in recumbency laterale, tenere le orecchie fuori strada e flettere il collo moderatamente (da 90 a 100 gradi). Assicurarsi che la linea mediana del collo e della testa (dal naso all'occipite) siano perfettamente in posizione parallela rispetto al tavolo.
- Toccare le ali dell'atlante e assicurarsi che si sovrappongano, eliminando la rotazione assiale. Un'indentazione naturale di solito può essere toccata sulla linea mediana dove l'ago è più probabile che entri nel foro occipitale.
- Scartare la siringa e l'ago in modo sicuro dopo l'iniezione di topi con Neisseria.
- Mettere l'animale nella gabbia e attendere il risveglio e il pieno recupero del movimento.
- Tenere le gabbie con topi infetti sotto un armadio a flusso laminare.
- Monitorare i topi, 24 h dopo l'infezione, per i segni clinici di coma secondo la scala del coma29. Scala del coma: 1 coma, 2 - non sta in piedi dopo essere stato acceso sul retro, 3 - si erge entro 30 s, 4 - si erge entro 5 s, attività ambulatoriali minime, 5 - normale.
NOT: Quando negli animali è stato registrato dolore, è stata somministrata analgesia con melossicam (5 mg/kg i.p. per la durata dello studio). - Procedere per la sopravvivenza degli animali o la CFU conta il saggio sugli animali infetti come descritto al punto 2.
- Eseguire l'eutanasia dei topi con un punteggio di 2 dalla lussazione cervicale e registrare come morto per l'analisi statistica.
2. La sopravvivenza animale e i conteggi della CFU
-
Sopravvivenza animale
- Preparare l'inocula batterica a diverse dosi (che vanno da 104 a 109 CFU per topo) per infettare gli animali dall'i.cist. percorso (vedere il punto 1.2).
- Topi da controllo inoculare con brodo GC, integrati con dextran di ferro (5 mg/kg), nello stesso modo.
- Monitorare gli animali per i sintomi clinici: pelliccia arruffata, aspetto curvo, ipotermia, perdita di peso, letargia, omoribondo 24,25,26,30, ogni giorno per tutto l'esperimento per 168 h (7 giorni) almeno due volte al giorno per tutta la durata dell'esperimento.
- Misurare il peso corporeo e la temperatura utilizzando un equilibrio digitale e un termometro rettale, rispettivamente ogni giorno.
- Registrare la sopravvivenza dei topi per una settimana.
NOT: Registrare la morte naturale dell'infezione post animale, mentre gli animali che raggiungono un valore di coma di 2 o che sopravvivono oltre 168 h di osservazione saranno eutanasia. - Anestesizza i topi con un valore coma di 2 o che sopravvivono nel corso del tempo di osservazione con ketamina (50 mg/kg) e xilazina (3 mg/kg) e applica unguento oftalmico.
- Controllare che la risposta al dolore sia assente dal pizzico del dito del dito del dito.
- Eseguire l'eutanasia dei topi per lussazione cervicale e registrare come morto per l'analisi statistica.
-
Valutazione dei conteggi delle unità formanti di colonia (CFU) negli organi periferici
- Utilizzare una dose batterica subletale (5 x 105CFU/topi) sulla base dei risultati di sopravvivenza degli animali per inoculare gli animali da parte dell'i.cist. percorso (cfr. sottosezione 1.2).
- Monitorare la temperatura rettale ogni giorno durante l'infezione ed eseguire l'anestesia degli animali a 48 h post infezione, come indicato nel passaggio 2.
- Procedere con la disinfezione del 70% di etanolo del torace e prelevare 600-700 - l'l di sangue per foratura cardiaca della cavità toracica utilizzando un ago da 25 G 0,5 mm x 16 mm.
- Raccogliere il sangue in un tubo contenente il 3,8% di citrato di sodio e conservarlo a -80 gradi centigradi per i successivi conteggi di cellule batteriche vitali.
- Eseguire lussazione cervicale per sacrificare gli animali. Confermare la morte registrando l'assenza di battito cardiaco, dopo aver sacrificato il mouse secondo tutte le linee guida istituzionali ed etiche pertinenti.
- Posare il topo in posizione supina e utilizzare forbici e pinze per procedere con il taglio della pelliccia lungo il piano sagittale del corpo. Fissare la pelle con la pelliccia sui lati del corpo con spilli.
- Tagliare la membrana peritoneale con forbici affilate. Utilizzare forbici e pinze monouso per accise gli organi (ad esempio, milza e fegato) e mettere ciascuno in parabola Petri sterile con 1 mL di brodo GC integrato con 10% (vol/vol) glicerolo.
- Smaltire in modo sicuro il corpo del topo in base alle linee guida IACUC.
- Omogeneizzare gli organi meccanicamente a temperatura ambiente con lo stantuffo di una siringa 5 mL per circa 2-3 min fino a quando non si forma una sospensione a cella singola e trasferirlo in un tubo.
- Mettere immediatamente il tubo con il campione di tessuto omogeneizzato sul ghiaccio secco.
NOT: I campioni possono essere conservati a -80 gradi centigradi in un tubo sterile da 2 mL per eseguire la valutazione del numero di cellule batteriche vitali nei punti successivi. - Fare piatti di agar GC con antibiotici quando necessario. Asciugare le piastre prima dell'uso pre-incubazione a 37 gradi centigradi per 2-3 h.
- Preparare diluizioni seriali di 10 volte dei campioni in brodo GC da ogni tessuto omogeneizzato e piastra su piastre di agar GC. Incubare pernottamento a 37 gradi centigradi con il 5% di CO2.
3. Preparazione dei tessuti cerebrali per il conteggio CFU
- Utilizzare una dose batterica subletale (5 x 105 CFU/topi) sulla base dei risultati di sopravvivenza degli animali per inoculare gli animali da parte dell'i.cist. percorso (cfr. sottosezione 1.2).
- Eseguire l'anestesia degli animali al momento dell'infezione stabilito, come indicato nel passaggio 2.
- Eseguire l'eutanasia degli animali con lussazione cervicale.
- Pulire l'area chirurgica con il 70% di etanolo.
- Tagliare la testa del mouse con una grande forbice.
- Resect la pelliccia e la pelle con l'aiuto di piccole forbici chirurgiche e una sottile punta pinza d'acciaio, procedendo verso la parte superiore del cranio per essere in grado di vedere chiaramente le suture e di guidare l'apertura del cranio.
- Inserire la punta di una piccola forbice attraverso il forame magnum per aprire il cranio.
- Tagliare verso il centro del cranio e attraverso la linea mediana dell'osso parietale sul lato opposto del cranio. Tagliare delicatamente lungo il bordo laterale della sutura lambdoid.
- Sollevare il cranio partendo dall'angolo parietale posteriore e tirarlo in diagonale verso l'alto per scoprire il cervello, utilizzando pinze sottili ribaltate.
- Assicurati che il tessuto cerebrale non sia attaccato ad alcun osso della testa, quando il cranio viene sollevato.
- Utilizzare pinze usa e getta per rimuovere qualsiasi tessuto connettivo tra il cranio e il cervello, per garantire che il tessuto cerebrale venga rimosso insieme al cranio.
- Non permettere che il tessuto cerebrale si asciughi troppo. Posizionare il cervello, usando pinze usa e getta, in un piatto Petri con 1 mL di brodo GC integrato con 10% (vol/vol) glicerolo.
- Omogeneizzare il cervello meccanicamente con lo stantuffo di una siringa da 5 mL (vedi passo 2.2.9). Trasferire i campioni in un tubo sterile da 2 mL e conservarli a -80 gradi centigradi per la successiva valutazione dei conteggi delle cellule batteriche vitali, come discusso al punto 2.2.
Risultati
Sopravvivenza di topi infettati da N. meningitidis tipo selvaggio e ceppi mutanti isogenici.
I ceppi di meningitidis Neisseria utilizzati in questi risultati rappresentativi sono il ceppo di riferimento C sierogruppo C 93/4286 (ET-37) e il suo mutante isogenico 93/4286,xx ottenuto mediante inattivazione adinsertionale del gene cssA, codifica per l'UDP-N-acetylglucosamina 2-epimerasi, che mappa nel locus di sintesi della capsula25. Per valutare il grado di virulenza del ceppo cssA-difettosonell'attuale modello murino, è stata valutata la dose letale in grado di determinare la morte del 50% degli animali infetti (LD50). A questo scopo tre gruppi di animali sono stati infettati intracis eternamente con dosi che vanno da 104 a 106 CFU del ceppo di tipo selvaggio 93/4286 e con dosi di ceppo mutante 93/4286cssA tra 107 a 109 CFU . In generale, la riduzione dei parametri clinici (ad esempio, il peso corporeo e la temperatura) e l'aumento del tasso di mortalità si è verificato entro i primi 72 h dopo l'infezione. L'LD50 per il ceppo di tipo selvaggio corrispondeva alla sfida meningococcica di 104 CFU, mentre il tasso di mortalità con la dose di 105 CFU era pari all'83,4% e con 106 CFU del 100% (Figura 1A). Al contrario, per ottenere l'LD50 per il ceppo mutante 93/4286,è stata necessaria una dose di 108 CFU (Figura 1B), una quantità di 10.000 pieghe superiore rispetto al ceppo di tipo selvaggio.
Valutazione di N. meningitidis valida CFU nei tessuti cerebrali del topo.
Per seguire la cinetica dell'infezione nel tessuto cerebrale degli animali infetti, è stato eseguito un saggio di percorso temporale con tipo selvaggio o ceppo mutante cssA 25. Dopo l'i.cist. iniezione con 5x105 CFU di 93/4286 o 93/4286 ceppicssA, c'è stato un rapido aumento dei batteri di tipo selvatico nel tessuto cerebrale raggiungendo il numero più alto a circa 24 h post infezione (Figura 2A); al contrario, nel cervello dei topi contestato con il mutante isogenico cssA-difettoso,i conteggi vitali sono scesi progressivamente nel tempo fino a 2.026 log CFU - 1.774 72 h post infezione ( Figura2A). L'esperimento ha dimostrato che il 33,3% dei topi mutanti sfidati ha mostrato l'autorizzazione batterica dal sito di infezione, mentre l'infezione da ceppo di tipo selvatico non è mai stata sradicata dal cervello degli animali.
Valutazione del carico meningococcale nella milza e nel fegato 48h post-sfida.
Questo esperimento è stato eseguito per valutare la rimozione dei batteri dai topi infetti 48 h post-sfida negli organi periferici. A questo scopo, due gruppi di topi sono stati infettati con 5 x 105 CFU di 93/4286 o 93/4286 ceppidi cssA, e conteggi batterici vitali sono stati valutati nella milza e fegato di topi infetti25 (Figura 2B). Dopo 48 h dall'iniezione di meningococco, il mutante cssA-difettoso è stato completamente eliminato nella milza e nel fegato, mentre gli animali infettati da ceppo di tipo selvaggio mostravano un quadro di infezione sistemica persistente. I valori medi di CFU dopo 48 h erano infatti ancora 3.212 log CFU - 3.354 e 6.949 log CFU - 1.37 nella milza e fegato, rispettivamente. La differenza nei carichi batterici nel tessuto epatico di due gruppi animali era statisticamente significativa (con un P < 0,001).
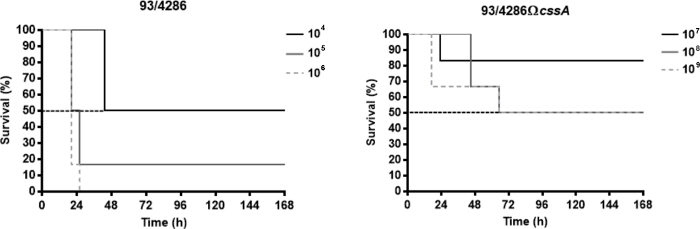
Figura 1: Sopravvivenza di topi infettati con tipo selvatico 93/4286 oceppi di N. meningitidis cssA. (A) Tre gruppi di topi di balb/c (n. 6/dose) sono stati infettati i.cist. con 104, 105e 106 CFU/mouse del ceppo di tipo selvaggio 93/4286 e (B) con 107, 108e 109 CFU/topo del mutante isogenico cssA-difettoso. I topi sono stati monitorati per una settimana, e la sopravvivenza è stata registrata. I risultati sono espressi come sopravvivenza percentuale a diverse dosi nel tempo, il valore di grado p di registro è stato < 0.05 per i topi infettati con il ceppo di tipo selvaggio. Questa cifra è stata modificata da Colicchio et al.25. Fare clic qui per visualizzare una versione più grande di questa figura.
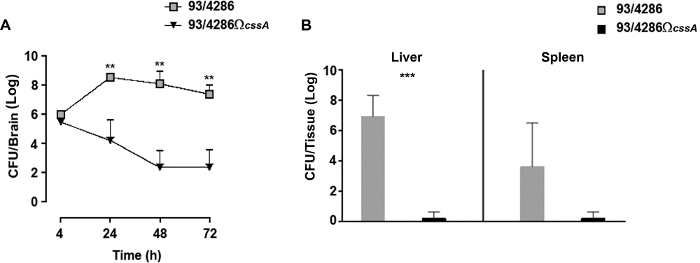
Figura 2: Valutazione dei carichi batterici nel tempo nei topi inoculati con i ceppicssA 93/4286 o 93/4286. (A) Corso temporale dei carichi batterici nei tessuti cerebrali che seguono i.cist. infezione. Due gruppi di topi di balsamo/c (n - 20/gruppo) sono stati infettati dall'i.cist. percorso con 5 x 105 CFU sia del ceppo di tipo selvaggio 93/4286 o il mutante cssA-difettoso. Gli animali sono stati sacrificati 4, 24, 48 e 72 h dopo l'infezione. I cervelli sono stati raccolti, omogeneizzati meccanicamente nel mezzo GC, e sono stati determinati i conteggi vitali. I risultati sono espressi come media : registro SD dei numeri CFU per organo in diversi momenti dopo l'inoculazione. Gli asterischi indicano la significatività statistica (Sezione , P < 0,01). (B) Carichi batterici nel tempo nella milza e nel fegato. Due gruppi di topi di balsamo/c (n - 5/gruppo) sono stati infettati i.cist. con 5 x 105 CFU del ceppo di tipo selvaggio 93/4286 o del mutante difettoso della cssA. Gli animali sono stati eutanasia 48 h dopo l'infezione. Spleens e fegati sono stati raccolti, omogeneizzato meccanicamente, e sono stati determinati i conteggi vitali. I risultati sono espressi come numeri CFU log per organo. Le barre orizzontali indicano i registri medi delle titole batteriche. Gli asterischi indicano la significatività statistica (Sezione ,, P < 0,001). Questa cifra è stata modificata da Colicchio et al.25. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
In questo studio, descriviamo un protocollo sperimentale per indurre la meningite meningococcica nei topi adulti da i.cist. inoculazione di batteri meningococcici. A nostra conoscenza, nessun altro modello di meningite meningococcica è stato sviluppato in topi di laboratorio infettati da i.cist. percorso; in passato, in questo modo è stato esplorato per fornire modelli di meningite meningococcale sia in ratto31 che in coniglio32. È noto che il più alto tasso di malattia meningococcale si trova tra bambini piccoli, adolescenti e giovani adulti33,34,35; per questo motivo, nel nostro modello murino da meningite, invece di concentrarsi su animali neonazionali o infantili, sono stati impiegati animali immunocompetenti di 8 settimane.
Nel nostro modello sperimentale, abbiamo deciso di utilizzare i.cist. inoculum in quanto assicura il rilascio dei meningococci direttamente nella cisterna magna, facilitando così la replica batterica nel CSF. Questo percorso di inoculazione è fisiologicamente più accessibile28 e meno traumatico del percorso subaracnodale intracranico, già utilizzato per lo sviluppo della meningite a causa di Streptococcus spp. 36,37. Sebbene non rappresenti il modo naturale di infezione del meningococco, l'iniezione di batteri in quest'area è stata determinante per l'induzione della meningite meningococcica, come dimostrato dalla sopravvivenza dei topi, dai carichi di batteri, dai parametri clinici e anche analisi istologica24,25,26. È interessante notare che il ceppo di riferimento 93/4286 ha indotto meningite con caratteristiche istopatologiche che imitano quelli osservati nella malattia umana24,25,26.
Per stabilire un'infezione murina standardizzata e per garantire la sicurezza dei ricercatori, è stato preferito partire da uno stock congelato titolato di batteri piuttosto che una crescita batterica fresca24,25,30, 38, inoltre, abbiamo deciso di utilizzare una dose subletale di meningocci vivi con l'obiettivo di limitare un rapido esito fatale e consentire lo sviluppo di danni cerebrali2,24,25,26. Tuttavia, per determinare una dose infettiva appropriata per diversi ceppi, devono essere eseguiti esperimenti preliminari. Nel presente studio, abbiamo testato un ceppo di riferimento C sierogruppo 93/4286 e un ceppo mutante isogenico 93/4286cssA con una dose di 5 x 105 CFU / topi.
Anche se questo modello non imita le fasi iniziali della colonizzazione e dell'invasione del meningococco, l'isolato batterico cresce bene non solo nel CSF, ma è anche in grado di rimanere nei compartimenti della milza e del fegato. Durante la fase ipoferremica dell'infezione neisserial, la maggior parte del ferro derivato da eme rimane combinato con la ferritina epatica. Come la ferritina può essere utilizzato meningococci per ottenere ferro39, il fegato costituisce un organo bersaglio per la replicazione batterica.
In questa procedura sperimentale, il ceppo di topo inbred Balb/c è stato utilizzato in sostituzione del ceppo outbred CD-1 che è stato originariamente impiegato per sviluppare il modello di meningite meningococcica24. I topi di razza erano caratterizzati da un'ampia variabilità genetica che può essere più appropriata per rivelare diversi effetti in una coorte variabile come la popolazione umana40,41. Tuttavia, questa variabilità ha bisogno di un campione di dimensioni superiori per ottenere un significato statistico sufficiente e può interferire con la standardizzazione delle procedure e degli studi mirati.
Nonostante la stretta gamma ospite di meningococco, per garantire la replicazione dei batteri nell'ospite murino e migliorare la virulenza del meningococci, dextran di ferro è stato somministrato agli animali prima dell'infezione6,14. Infine, rispetto ad altri modelli sperimentali di meningite, gli animali non sono stati trattati con antibiotici, per non influenzare il decorso della malattia e/o il profilo della risposta infiammatoria26.
Ad oggi, i nostri studi hanno evidenziato che l'i.cist. modello è funzionale per indurre sia meningite e malattia meningococcica invasiva rispetto ai modelli di infezione i.p. o i.n., che sono caratterizzati dalla comparsa di sepsi e batterimia prima che la meningite sia stabilita10,11 ,12,13,14,15,16,17. Pertanto, questo modello di infezione basato sull'induzione della meningite nell'ospite murino, potrebbe essere utile non solo per valutare una strategia terapeutica innovativa per prevenire la replicazione batterica direttamente nel CSF, ma anche per analizzare l'efficacia di possibili terapia contro i patogeni umani.
Tuttavia l'infezione da meningococco è un processo multifase, che include la colonizzazione nasofaringa, l'accesso al flusso sanguigno, l'attraversamento della barriera ematoencefalica e infine la proliferazione incontrollata nel CSF, il nostro modello riproduce solo alcuni aspetti del infezione da meningococco, al fine di sovvertire in parte queste limitazioni modello animale transgenico può essere utile per imitare la patogenesi umana della malattia meningococcica.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli studi sono stati sostenuti in parte da PRIN 2012 [grant number 2012WJSX8K]: "Modelli di interazione host-microbe nelle infezioni mucosali: sviluppo di nuove strategie terapeutiche" e da PRIN 2017 [2017SFBFER]: "Un approccio integrato per affrontare l'interazione tra adattamento, condizioni stressanti e resistenza antimicrobica di agenti patogeni impegnativi".
Materiali
| Name | Company | Catalog Number | Comments |
| 1,8 Skirted Cryovial With external thread | Starlab | E3090-6222 | |
| 50 mL Polypropylene Conical Tube | Falcon | 352070 | 30 mm x 115 mm |
| Adson Forceps | F.S.T. | 11006-12 | Stainless Steel |
| Alarm-Thermometer | TESTO | 9000530 | |
| BactoTM Proteose Peptone | BD | 211693 | |
| BD Micro Fine syringe | BD | 320837 | U-100 Insulin |
| BD Plastipak syringe 1 mL 25 G 5/8 inch | BD | 300014 | 05 mm x 16 mm |
| BD Plastipak syringe 5 mL | BD | 308062 | 07 mm x 30 mm |
| BIOHAZARD AURA B VERTICAL LAMINAR FLOW CABINET | Bio Air s.c.r.l. | Aura B3 | |
| BioPhotometer | Eppendorf | Model #6131 | |
| Bottle D | Tecniplast | D | Graduated up to: 400 mL, Total Volume 450 mL, 72 mm x 72 mm x 122 mm |
| C150 CO2 Incubator | Binder | 9040-0078 | |
| Cage Body Eurostandard Type II | Tecniplast | 1264C | 267 x 207 x 140 mm3, Floor area 370 cm2 |
| Cell Culture Petri Dish With Lid | Thermo Scientific | 150288 | Working Volume: 5 mL |
| Centrifuge | Eppendorf | Microcentrifuge 5415R | |
| Cuvetta semi-micro L. Form | Kartell S.p.A. | 01938-00 | |
| di-Potassium hydrogen phosphate trihydrate | Carlo erba | 471767 | |
| di-Sodium hydrogen phosphate anhydrous ACS-for analysis | Carlo Erba | 480141 | g1000 |
| Diete Standard Certificate | Mucedola s.r.l. | 4RF21 | Food pellet for animal |
| Dumont Hp Tweezers 5 Stainless Steel | F.S.T. by DUMONT | AGT5034 | 0.10 x 0.06 mm2 tip |
| Electronic Balance | Gibertini | EU-C1200 | Max 1200 g, d = 0.01 g, T = -1200 g |
| Eppendorf Microcentrifuge tube safe-lock | Eppendorf | T3545-1000EA | |
| Erythromycin | Sigma-Aldrich | E-6376 | 25 g |
| Extra Fine Bonn Scissors | F.S.T. | 14084-08 | Stainless Steel |
| Filter Top (mini- Isolator), H-Temp with lock clamps | Tecniplast | 1264C400SUC | |
| GC agar base | OXOID | CM0367 | |
| Gillies Forceps 1 x2 teeth | F.S.T. | 11028-15 | Stainless Steel |
| Glicerin RPE | Carlo Erba | 453752 | 1 L |
| Graefe Forceps | F.S.T. | 11052-10 | Serrated Tip Width: 0.8 mm |
| Inner lid | Tecniplast | 1264C116 | |
| Iron dextran solution | Sigma-Aldrich | D8517-25ML | |
| Ketamine | Intervet | ||
| Microbiological Safety Cabinet BH-EN and BHG Class II | Faster | BH-EN 2004 | |
| Microcentrifuge tubes 1.5 mL | BRAND | PP780751 | screw cap PP, grad |
| Mouse Handling Forceps | F.S.T. | 11035-20 | Serrated rubber; Gripping surface: 15 mm x 20 mm |
| Mucotit-F2000 | MERZ | 61846 | 2000 mL |
| Natural Latex Gloves | Medica | M101 | |
| New Brunswick Classic C24 Incubator Shaker | PBI international | C-24 Classic Benchtop Incubator Shaker | |
| Petri PS Dishes | VWR | 391-0453 | 90 x 14.2 mm2 |
| Pipetman Classic P20 | Gilson | F123600 | 2-20 μL |
| Pipetman Classic P200 | Gilson | F123601 | 20-200 μLL |
| Pipetman Classim P1000 | Gilson | F123602 | 200-1,000 μL |
| Polyvitox | OXOID | SR0090A | |
| Potassium Chloride | J.T. Baker Chemicals B.V. | 0208 | 250 g |
| Potassium Dihydrogen Phosphate | J.T. Baker Chemicals B.V. | 0240 | 1 kg |
| PS Disposible forceps | VWR | 232-0191 | |
| Removable Divider | Tecniplast | 1264C812 | |
| Round-Bottom Polypropylene Tubes | Falcon | 352063 | 5 mL |
| Sodium Chloride | MOLEKULA | 41272436 | |
| SS retainer and Polyester FilterSheet | Tecniplast | 1264C | |
| Standard Pattern Forceps | F.S.T. | 11000-12 | Stainless |
| Stevens Tenotomy Scissors | F.S.T. | 14066-11 | Stainless Steel |
| Surgical Scissor - ToughCut | F.S.T. | 14130-17 | Stainless |
| Touch N Tuff disposible nitrile gloves | Ansell | 92-500 | |
| Ultra Low Temperature (ULT) Freezer | Haier | DW-86L288 | Volume = 288 L |
| Wagner Scissors | F.S.T. | 14070-12 | Stainless Steel |
| Xylazine | Intervet |
Riferimenti
- van Deuren, M., Brandtzaeg, P., van der Meer, J. W. Update on meningococcal disease with emphasis on pathogenesis and clinical management. Clinical Microbiology Reviews. 13, 144-166 (2000).
- Colicchio, R., et al. Fitness Cost of Rifampin Resistance in Neisseria meningitidis: In vitro Study of Mechanisms Associated with rpoB H553Y Mutation. Antimicrobial Agents and Chemotherapy. 59 (12), 7637-7649 (2015).
- Talà, A., et al. Serogroup-specific interaction of Neisseria meningitidis capsular polysaccharide with host cell microtubules and effects on tubulin polymerization. Infection and Immunity. 82, 265-274 (2014).
- Pagliarulo, C., et al. Regulation and differential expression of gdhA encoding NADP-specific glutamate dehydrogenase in Neisseria meningitidis clinical isolates. Molecular Microbiology. 51, 1757-1772 (2004).
- Plant, L., Jonsson, A. B. Contacting the host: insights and implications of pathogenic Neisseria cell interactions. Scandinavian Journal of Infectious Diseases. 35, 608-613 (2003).
- Schryvers, A. B., Stojiljkovic, I. Iron acquisition systems in the pathogenic Neisseria. Molecular Microbiology. 32, 1117-1123 (1999).
- Virji, M., Makepeace, K., Ferguson, D. J., Watt, S. M. Carcinoembryonic antigens (CD66) on epithelial cells and neutrophils are receptors for Opa proteins of pathogenic neisseriae. Molecular Microbiology. 22, 941-950 (1996).
- de Vries, F. P., van Der Ende, A., van Putten, J. P., Dankert, J. Invasion of primary nasopharyngeal epithelial cells by Neisseria meningitidis is controlled by phase variation of multiple surface antigens. Infection and Immunity. 64, 2998-3006 (1996).
- Tinsley, C. R., Heckels, J. E. Variation in the expression of pili and outer membrane protein by Neisseria meningitidis during the course of the meningococcal infection. Journal of General Microbiology. 132, 2483-2490 (1986).
- Gorringe, A. R., et al. Experimental disease models for the assessment of meningococcal vaccines. Vaccine. 23, 2214-2217 (2005).
- Newcombe, J., et al. Infection with an avirulent phoP mutant of Neisseria meningitidis confers broad cross-reactive immunity. Infection and Immunity. 72, 338-344 (2004).
- Oftung, F., Lovik, M., Andersen, S. R., Froholm, L. O., Bjune, G. A mouse model utilising human transferrin to study protection against Neisseria meningitidis serogroup B induced by outer membrane vesicle vaccination. FEMS Immunology and Medical Microbiology. 26, 75-82 (1999).
- Salit, I. E., Tomalty, L. Experimental meningococcal infection in neonatal mice: differences in virulence between strains isolated from human cases and carriers. Canadian Journal of Microbiology. 30, 1042-1045 (1984).
- Salit, I. E., Tomalty, L. A neonatal mouse model of meningococcal disease. Clinical and Investigative Medicine. 9, 119-123 (1986).
- Mackinnon, F. G., Gorringe, A. R., Funnell, S. G., Robinson, A. Intranasal infection of infant mice with Neisseria meningitidis. Microbial Pathogenesis. 12, 415-420 (1992).
- Mackinnon, F. G., et al. Demonstration of lipooligosaccharide immunotype and cap- sule as virulence factors for Neisseria meningitidis using an infant mouse intranasal infection model. Microbial Pathogenesis. 15, 359-366 (1993).
- Yi, K., Stephens, D. S., Stojiljkovic, I. Development and evaluation of an improved mouse model of meningococcal colonization. Infection and Immunity. 71 (4), 1849-1855 (2003).
- Holbein, B. E., Jericho, K. W. F., Likes, G. C. Neisseria meningitidis infection in mice: influence of iron, variations in virulence among strains, and pathology. Infection and Immunity. 24, 545-551 (1979).
- Saukkonen, K. Experimental meningococcal meningitis in the infant rat. Microbial Pathogenesis. 4, 203-211 (1988).
- Johansson, L., et al. CD46 in meningococcal disease. Science. 301, 373-375 (2003).
- Zarantonelli, M. L., et al. Transgenic mice expressing human transferrin as a model for meningococcal infection. Infection and Immunity. 75, 5609-5614 (2007).
- Join-Lambert, O., et al. Meningococcal interaction to microvasculature triggers the tissular lesions of purpura fulminans. Journal of Infection Disease. 208, 1590-1597 (2013).
- Melican, K., Michea Veloso, P., Martin, T., Bruneval, P., Duménil, G. Adhesion of Neisseria meningitidis to dermal vessels leads to local vascular damage and purpura in a humanized mouse model. PLoS Pathogen. 9, 1003139 (2013).
- Colicchio, R., et al. The meningococcal ABC-Type L-glutamate transporter GltT is necessary for the development of experimental meningitis in mice. Infection and Immunity. 77, 3578-3587 (2009).
- Colicchio, R., et al. Virulence traits of serogroup C meningococcus and isogenic cssA mutant, defective in surface-exposed sialic acid, in a murine model of meningitis. Infection and Immunity. , 00688-00718 (2019).
- Ricci, S., et al. Inhibition of matrix metalloproteinases attenuates brain damage in experimental meningococcal meningitis. BMC Infectious Diseases. 14, 726 (2014).
- Schryvers, A. B., Gonzalez, G. C. Comparison of the abilities of different protein sources of iron to enhance Neisseria meningitidis infection in mice. Infection and Immunity. 57, 2425-2429 (1989).
- Beverly, K. S. Chapter 105 - Cerebrospinal Fluid Sampling Small Animal. Critical Care Medicine. , 448-452 (2009).
- Liechti, F. D., Grandgirard, D., Leppert, D., Leib, S. L. Matrix metalloproteinase inhibition lowers mortality and brain injury in experimental pneumococcal meningitis. Infection and Immunity. 82, 1710-1718 (2014).
- Pagliuca, C., et al. Novel Approach for Evaluation of Bacteroides fragilis Protective Role against Bartonella henselae Liver Damage in Immunocompromised Murine Model. Frontiers in Microbiology. 7, 1750 (2016).
- Trampuz, A., Steinhuber, A., Wittwer, M., Leib, S. L. Rapid diagnosis of experimental meningitis by bacterial heat production in cerebrospi- nal fluid. BMC Infectious Diseases. 7, 116 (2007).
- Tuomanen, E. I., Saukkonen, K., Sande, S., Cioffe, C., Wright, S. D. Reduction of inflammation, tissue damage, and mortality in bacterial meningitis in rabbits treated with monoclonal antibodies against adhesion-promoting receptors of leukocytes. Journal of Experimental Medicine. 170, 959-969 (1989).
- Goldschneider, I., Gotschlich, E. C., Artenstein, M. S. Human immunity to the meningococcus. I. The role of humoral antibodies. Journal of Experimental Medicine. 129, 1307-1326 (1969).
- Goldschneider, I., Gotschlich, E. C., Artenstein, M. S. Human immunity to the meningococcus. II. Development of natural immunity. Journal of Experimental Medicine. 129, 1327-1348 (1969).
- World Health Organization. Laboratory methods for the diagnosis of meningitis caused by Neisseria meningitidis, Streptococcus pneumoniae, and Haemophilus influenzae: WHO manual, 2nd Edition. World Health Organization. , (2011).
- Chiavolini, D., et al. Method for inducing experimental pneumococcal meningitis in outbred mice. BMC Microbiolology. 4, 36 (2004).
- Zhang, S., et al. Intracranial Subarachnoidal Route of Infection for Investigating Roles of Streptococcus suis Biofilms in Meningitis in a Mouse Infection Model. Journal of Visualized Experiments. (1), e137 (2018).
- Pagliuca, C., et al. Evidence of Bacteroides fragilis protection from Bartonella henselae-induced damage. PLoS One. 7, 49653 (2012).
- Larson, J. A., Howie, H. L., So, M. Neisseria meningitidis accelerates ferritin degradation in host epithelial cells to yield an essential iron source. Molecular Microbiology. 53, 807-820 (2004).
- Festing, M. F. W. Phenotypic variability of inbred and outbred mice. Nature. 263, 230-232 (1976).
- Festing, M. F. W. Warning: the use of heterogeneous mice may seriously damage your research. Neurobiology of Aging. 20, 237-244 (1999).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon