Method Article
Induire la méningite méningococcique Sérogroupe C chez les souris par l'intermédiaire de la livraison intracisternal
Dans cet article
Résumé
Ici, nous décrivons une méthode pour induire la méningite méningococcique par une voie intracisternal d'infection chez les souris adultes. Nous présentons un protocole étape par étape de l'infection méningococcique de la préparation de l'inoculum à l'infection intracisternal ; enregistrez ensuite la survie animale et évaluez les charges bactériennes dans les tissus murines.
Résumé
Neisseria meningitidis (méningocoque) est un micro-organisme à portée étroite, mondialement reconnu comme la principale cause de méningite bactérienne. Le méningocoque est un colonisateur transitoire du nasopharynx humain d'environ 10% de sujet sain. Dans des circonstances particulières, il acquiert une capacité invasive de pénétrer la barrière muqueuse et envahit la circulation sanguine causant la septicémie. Dans le dernier cas, la septicémie fulminante pourrait survenir même sans le développement conséquent de la méningite. Inversement, les bactéries pourraient mal se multiplier dans la circulation sanguine, traverser la barrière hémato-encéphalique, atteindre le système nerveux central, conduisant à une méningite fulminante. Les modèles murins de la méningite bactérienne représentent un outil utile pour étudier les interactions hôte-pathogène et pour analyser les mécanismes pathogétiques responsables de cette maladie mortelle. Bien que plusieurs systèmes modèles expérimentaux aient été évalués au cours des dernières décennies, aucun d'entre eux n'a été en mesure de reproduire les événements pathologiques caractéristiques de la méningococcie. Dans ce protocole expérimental, nous décrivons une procédure détaillée pour l'induction de la méningite méningococcique dans un modèle de souris basé sur l'inoculation intracisternal des bactéries. Les signes particuliers de la méningite humaine ont été enregistrés dans l'hôte murine par l'évaluation des paramètres cliniques (par exemple, température, poids corporel), évaluation du taux de survie, analyse microbiologique et examen histologique des lésions cérébrales. Lors de l'utilisation de l'inoculum intracisternal (i.cist.), les méningocoques complètent la livraison directement dans la cisternamagna, conduisant à une réplication méningococcique très efficace dans le tissu cérébral. Une augmentation de 1 000 fois du nombre viable de bactéries est observée dans environ 18 h. En outre, les méningocoques sont également trouvés dans la rate, et le foie des souris infectées, suggérant que le foie peut représenter un organe cible pour la réplication du méningocoque.
Introduction
Neisseria meningitidis est un Gram négatif - proteobacterium limité à l'hôte humain, bien connu pour être l'une des causes les plus courantes de méningite et de septicémie dans la population humaine à travers le monde. Il colonise les voies respiratoires supérieures (nez et gorge) des porteurs sains et asymptomatiques (2-30% de la population), mais la bactérie échappe parfois à diverses défenses immunitaires de l'hôte et se propage de la circulation sanguine au cerveau provoquant un local incontrôlé l'inflammation, connue sous le nom de méningite à méningocoques. Une combinaison de facteurs d'hôte et de bactéries semble contribuer à la transition du comportement commensal au comportement invasif1.
N. meningitidis est spécialisé exclusivement dans la colonisation et l'infection humaines. Il a une gamme étroite d'hôte et, par conséquent, a des études in vivo limitées de pathogénie due à l'absence de modèles animaux appropriés qui reproduisent la maladie méningococcique humaine. En conséquence, il avait mené aux lacunes fondamentales dans la compréhension concernant la pathogénie de la septicémie et de la méningite provoquées par le méningocoque. Au cours des dernières décennies, le développement de nombreux systèmes in vitro a permis d'identifier plusieurs facteurs de virulence méningococciques2,3,4. Bien que ces études précieuses aient fourni des idées importantes pour comprendre le rôle de ces facteurs pour une infection à méningocoque réussie, ces modèles n'ont pas permis d'évaluer les conséquences des interactions bactériennes avec l'humour et le cellulaire système immunitaire et encore moins avec l'ensemble du tissu. Les modèles animaux in vivo d'infection sont également d'une grande pertinence pour l'évaluation du degré de protection conféré par les formulations de vaccins. En tant qu'agent pathogène humain-tropique, le méningocoque possède les déterminants appropriés nécessaires au succès de l'infection, comme les structures de surface (c.-à-d. les protéines de type IV pili et d'opacité) et l'utilisation du fer pour les récepteurs humains et les protéines de transport (c.-à-d. transferin et lactoferrine)5,6,7 pour bien adhérer, survivre et envahir l'hôte humain. Enfin, les capacités de variation génétique de l'agent pathogène pour échapper et/ou bloquer la réponse immunitaire humaine contribuent encore au tropisme élevé des espèces8,9. Par conséquent, l'absence de facteurs spécifiques de l'hôte, impliqués dans l'interaction, peut bloquer les étapes du cycle de vie de l'agent pathogène, établissant des difficultés importantes dans le développement de modèles de petits animaux résumant le cycle de vie méningococcique.
Au cours des dernières décennies, plusieurs approches ont été développées pour améliorer notre compréhension du cycle infectieux du méningocoque. Les infections de deux modèles animaux, la souris et le rat, soit intrapéritone (i.p.) ou intranasally (i.n.), ont été développées pour reproduire la méningococcie10,11,12,13,14 ,15,16,17. La souris de laboratoire est probablement l'un des animaux les plus polyvalents pour induire une infection à méningocoque expérimentale.
Cependant, le mode d'infection i.p. conduit au développement de la septicémie grave bien qu'il n'imite pas la voie naturelle de l'infection, tandis que la voie i.n. de l'infection a été utile pour évaluer la pathogénie méningococcique, même si elle peut induire l'infection pulmonaire avant la septicémie10,11,12,13,14,15,16,17.
Le modèle de souris i.p. a joué un rôle déterminant dans l'évaluation de la protection contre le défi du méningocoque10,11,12. Le modèle de souris de la colonisation méningococcique basé sur la voie i.n. de l'infection a été développé avec des souris infantiles, car elles sont plus sensibles aux méningocoques, pour reproduire une infection invasive imitant le cours de la maladie méningococcique chez l'homme 13,14,15,16,17. En outre, pour promouvoir la réplication du méningocoque dans l'hôte murine, un nombre croissant de stratégies techniques ont également été appliquées, y compris l'administration du fer aux animaux pour améliorer l'infection, l'utilisation d'inoculumbactérien élevé , souche bactérienne à passage de souris ainsi que l'emploi d'hôtes animaux infantiles ou immunocompromis10,13,15,18,19. L'expression de facteurs humains spécifiques comme CD4620 ou transferin21 a augmenté la susceptibilité des souris à cette bactérie humaine-tropique ; l'emploi du modèle humain de xénogreffe de peau de l'infection a également été utile pour évaluer la capacité d'adhérence des méningocoques à l'endothélium humain22,23. Collectivement, le développement récent de souris transgéniques humanisées a amélioré la compréhension de la pathogénie méningococcique et de ses interactions hôtes.
Auparavant, nous avons développé un modèle murin de méningite à méningocoques où l'inoculation des bactéries a été réalisée dans la magna de la citerne des souris adultes avec des bactéries à passage de souris24. Les paramètres cliniques et le taux de survie des souris infectées ont démontré l'établissement de la méningite avec des caractéristiques comparables à celles observées dans l'hôte humain, ainsi que les analyses microbiologiques et histologiques du cerveau. De ces souris infectées, les bactéries ont été, également, récupérées du sang, du foie, et de la rate, et des charges bactériennes des organes périphériques se sont corrélées avec la dose infectieuse. En particulier, ce modèle a été utilisé pour évaluer la virulence d'une souche mutante isogénique défectueuse dans le transporteur L-glutamate GltT24. Récemment, en utilisant notre modèle de souris de méningite à méningocoques à base de i.cist. route avec la souche de sérogroupe C 93/42862,24 et un mutant isogénique défectueux dans l'encodage de gène cssA pour UDP-N-acetylglucosamine 2-epimerase25, nous avons analysé le rôle de l'acide sialique exposé dans l'établissement de la maladie chez la souris.
Dans ce protocole, nous décrivons une méthode simple pour induire la méningite expérimentale de méningocoque basée sur l'i.cist. voie d'infection chez les souris adultes De Balb/c. Cette méthode est particulièrement utile pour la caractérisation de l'infection à méningocoque s'est alignée sur un hôte murine, ainsi que pour l'évaluation de la virulence entre les souches de référence de type sauvage et les mutants isogéniques. La voie intra-cisternale de l'infection assure la livraison complète des méningocoques directement dans la magna de cisterna, qui facilite à son tour la réplication bactérienne dans le fluide céphalo-rachidien (CSF) et induit la méningite avec des dispositifs qui imitent ceux présent chez l'homme2,24,25,26.
Protocole
Ce protocole a été mis en œ]s pour minimiser la souffrance animale et réduire le nombre de souris conformément à la directive du Conseil des Communautés européennes du 24 novembre 1986 (86/609/CEE). Les expériences in vivo rapportées dans cette étude ont été approuvées par le Comité d'éthique des soins et de l'utilisation des animaux (Prot. numéro 2, 14 décembre 2012) et le ministère italien de la Santé (numéro 0000094-A-03/01/2013). Toutes les procédures doivent être effectuées à l'intérieur du Cabinet de biosécurité 2 (BSC2) dans une pièce BSL2, et les déchets infectés potentiels doivent être éliminés dans des conteneurs dédiés.
1. Infection de souris avec N. meningitidis Serogroup C Strain
CAUTION: N. meningitidis est potentiellement un agent pathogène nocif et toutes les précautions nécessaires doivent être prises lors de la manipulation de ce micro-organisme. L'ensemble de l'expérimentation nécessite un confinement de niveau de biosécurité 2 (BSL2). Le chercheur impliqué dans les études sur les animaux devrait porter de l'équipement de protection individuelle (EPI) jetable pendant toute la durée de l'expérience.
- Préparation de bactéries pour des études sur l'infection in vivo
- Choisissez une seule colonie à partir d'une culture fraîche Neisseria meningitidis sur GC (Gonococcal) plaque d'agar complétée avec 1% (vol / vol) supplément polyvitox et inoculer dans 10 ml de bouillon GC.
- Cultivez les bactéries à 37 oC dans un incubateur de shaker orbital à la vitesse de 220 tr/min. Continuez à vérifier l'O.D. de la culture avec un spectrophotomètre. Cultivez la culture jusqu'à la phase exponentielle précoce à une densité optique OD600nm de 0,7, correspondant à 7 x 108 CFU/mL.
- Une fois que l'O.D. requis est obtenu, faites des stocks congelés en ajoutant 10% de glycérol. Dispense 1 mL de la culture dans les cryovials. Conserver les flacons à -80 oC jusqu'à l'utilisation.
REMARQUE: Bien qu'il soit préférable d'utiliser la culture bactérienne fraîche, les stocks congelés ont été utilisés pour simplifier et normaliser l'expérience in vivo. Habituellement, les stocks congelés ont été utilisés dans les environ 6 mois suivant la préparation. - Avant l'infection, décongeler les bactéries congelées à température ambiante.
- Récoltez les cellules bactériennes par centrifugation pendant 15 min à 1 500 x g et suspendez-les dans 1 ml de bouillon GC frais contenant du dextran de fer (5 mg/kg).
REMARQUE: Le bouillon GC est préparé avec l'ajout de dextran de fer (5 mg/kg) afin de favoriser la réplication des méningocoques dans le tissu hôte14,18,27. - Avant d'utiliser, effectuer des comptes viables de bactéries pour déterminer le nombre exact de CFU pour l'infection. Pour ce faire, prenez 10 l de suspension bactérienne et procéder à des dilutions en série et étendre chaque dilution sur les plaques d'agar GC et incuber à 37 oC avec 5% co2, pour 18-24 h.
- Injection intra-cisternale de souris
note:L'ensemble de la procédure est effectuée dans l'armoire à débit laminaire pour maintenir des conditions aseptiques.- Maison des souris de laboratoire (8 semaines, femelle Balb/c) dans des conditions spécifiques sans pathogènes. Fournir des granulés de nourriture et de l'eau ad libitum.
- Installez les animaux dans le nouvel environnement pendant 1 semaine avant de commencer l'expérience.
- Avant de commencer l'expérience, peser et évaluer leur température corporelle.
REMARQUE: Les souris femelles de Balb/c consanguines de huit semaines pèsent en moyenne environ 19 g. La température moyenne des souris de laboratoire physiologiquement allant de 36-38 oC24. - Égorgez l'animal du cou, nettoyez la zone de l'abdomen avec l'éthanol de 70% et injectez i.p. dextran de fer (dissous dans un tampon salin de phosphate de 1 %, 250 mg/kg) dans le quadrant inférieur droit de l'abdomen murine en utilisant une aiguille de 25 G 0,5 mm x 16 mm , environ 2-3 h avant l'infection.
REMARQUE: L'injection intrapéritonéale a été effectuée dans le quadrant inférieur droit de l'abdomen murine pour éviter d'endommager les organes abdominaux tels que la vessie, le cecum, etc. L'administration de la source de fer exogène, sous forme de dextran de fer, aux animaux avant l'infection favorise la multiplication bactérienne dans l'hôte14,18,27. - Après 2-3 h, effectuer l'anesthésie animale avec la kétamine (50 mg/kg) et la xylazine (3 mg/kg) et le lubrifiant ophtalmique.
- Vérifiez la profondeur de l'anesthésie en veillant à l'absence de réponse à la douleur lors du pincement de l'orteil.
- Placez la souris dans un decubitus sternal et étirez soigneusement les membres et la colonne cervicale pour maintenir la colonne vertébrale en position droite.
- Mélanger délicatement la suspension bactérienne pour maintenir une suspension uniforme avant de charger une seringue de 30 G aiguille x 8 mm.
REMARQUE: Préparer la suspension bactérienne aussi près que possible du temps d'injection; pendant ce temps, le conserver à température ambiante. - Sur la base du tiseur bactérien post-dégel (CFU/mL), procéder au calcul du total de l'UFC à utiliser, en ce qui concerne le nombre total d'animaux à infecter (dose bactérienne de l'UFC par nombre d'animaux). Procéder au calcul du volume exact à retirer du flacon pour obtenir le total de l'UFC en appliquant une proportion entre le tter bactérien après la décongélation (CFU/mL) et le CFU total utile pour l'infection des souris n (cFU de titer bactérien après la décongélation : ml - CFU total : x). Établir le volume final par rapport au nombre total d'animaux à infecter.
REMARQUE: Dans ces expériences, un large éventail de titer de 104 à 109 par animal a été utilisé. - Nettoyer la zone chirurgicale avec 70% d'éthanol.
- Identifiez le point d'injection à l'aide d'une aiguille et injectez l'UFC établie de méningocoques (souche de type sauvage et souche mutante isogénique), ou le bouillon DE GC complété par du dextran de fer (5 mg/kg) comme contrôle, dans un volume total de 10 l dans la magna de la cisterna des souris à travers un trou de bavure occipital à l'aide d'une aiguille de 30 G x 8 mm.
- Effectuer l'inoculum cisternal en plaçant l'aiguille à la jonction craniocervical, en particulier dans l'espace sous-arachnoïdien dorsal. Ventroflex la tête pour rendre cet espace accessible28.
- En bref, placez l'animal dans la tubency latérale, tenez les oreilles hors de la voie et fléchissez le cou modérément (90 à 100 degrés). Assurez-vous que la ligne médiane du cou et de la tête (du nez à l'occiput) sont parfaitement en position parallèle à la table.
- Touchez les ailes de l'atlas et assurez-vous qu'elles se chevauchent, éliminant ainsi la rotation axiale. Une indentation naturelle peut généralement être touchée sur la ligne médiane où l'aiguille est la plus susceptible d'entrer dans le trou occipital.
- Jeter la seringue et l'aiguille en toute sécurité après l'injection de souris avec Neisseria.
- Placez l'animal dans la cage et attendez le réveil et la récupération complète du mouvement.
- Gardez les cages avec des souris infectées sous une armoire à débit laminaire.
- Surveiller les souris, 24 h après l'infection, pour les signes cliniques de coma selon l'échelle du coma29. Échelle de Coma : 1 coma, 2 - ne se tient pas debout après avoir été tourné sur le dos, 3 - se tient debout dans 30 s, 4 - se tient debout dans 5 s, activités ambulatoires minimales, 5 - normal.
REMARQUE: Quand chez les animaux a été enregistré douleur, analgésie avec méloxicam (5 mg/kg i.p. pour la durée de l'étude) a été administré. - Procédez pour la survie animale ou CFU compte l'analyse sur les animaux infectés comme détaillé à l'étape 2.
- Effectuer l'euthanasie des souris avec un score de 2 par luxation cervicale et enregistrer comme morts pour l'analyse statistique.
2. La survie des animaux et le compte de l'UFC
-
Survie animale
- Préparer l'inocula bactérienne à différentes doses (allant de 104 à 109 CFU par souris) pour infecter les animaux par l'i.cist. (voir l'étape 1.2).
- Inoculer les souris témoins avec du bouillon GC, complété avec du dextran de fer (5 mg/kg), de la même manière.
- Surveiller les animaux pour les symptômes cliniques: fourrure ébouriffée, apparence voûtée, hypothermie, perte de poids, léthargie, ou moribond24,25,26,30, tous les jours tout au long de l'expérience pendant 168 h (7 jours) au moins deux fois par jour pendant la durée de l'expérience.
- Mesurez le poids corporel et la température à l'aide d'un équilibre numérique et d'un thermomètre rectal, respectivement tous les jours.
- Enregistrez la survie des souris pendant une semaine.
REMARQUE: Enregistrez la mort naturelle de l'animal après l'infection tandis que les animaux qui atteignent une valeur coma de 2 ou qui survivent plus de 168 h d'observation seront euthanasiés. - Anesthésiez les souris d'une valeur coma de 2 ou qui survivent pendant le temps d'observation avec la kétamine (50 mg/kg) et la xylazine (3 mg/kg) et appliquent un onuleur ophtalmique.
- Vérifiez que la réponse de douleur est absente par pincement d'orteil.
- Effectuer l'euthanasie des souris par luxation cervicale et enregistrer comme morts pour l'analyse statistique.
-
Évaluation des dénombrements des unités de formation de colonies (UFCC) dans les organes périphériques
- Utilisez une dose bactérienne sous-létale (5 x 105CFU/souris) sur la base des résultats de survie animale pour inoculer les animaux par l'i.cist. (voir l'alinéa 1.2).
- Surveillez la température rectale tous les jours pendant l'infection et effectuez l'anesthésie des animaux à 48 h après l'infection comme mentionné à l'étape 2.
- Procéder à la désinfection à l'éthanol de 70 % de la poitrine et retirer 600-700 l de sang par perforation cardiaque de la cavité thoracique à l'aide d'une aiguille de 25 G 0,5 mm x 16 mm.
- Recueillir le sang dans un tube contenant 3,8 % de citrate de sodium et le stocker à -80 oC pour les numérations cellulaires bactériennes viables ultérieures.
- Effectuer la dislocation cervicale pour sacrifier les animaux. Confirmer la mort en registrant l'absence de battements de cœur, après avoir sacrifié la souris selon toutes les directives institutionnelles et éthiques pertinentes.
- Placez la souris en position de supine et utilisez des ciseaux et des forceps pour procéder à la coupe de la fourrure le long du plan sagittal du corps. Fixer la peau avec la fourrure sur les côtés du corps avec des épingles.
- Couper la membrane péritonéale à l'aide de ciseaux tranchants. Utilisez des ciseaux et des forceps jetables pour exciser les organes (p. ex., la rate et le foie) et mettez chacun dans un plat stérile Petri avec 1 ml de bouillon GC complété de 10 % (vol/vol) de glycérol.
- Disposer en toute sécurité le corps de la souris selon les directives de l'IACUC.
- Homogériser mécaniquement les organes à température ambiante avec le piston d'une seringue de 5 ml pendant environ 2-3 min jusqu'à ce qu'une suspension à cellule unique soit formée et la transférer dans un tube.
- Placez le tube avec l'échantillon de tissu homogénéisé immédiatement sur la glace sèche.
REMARQUE: Les échantillons peuvent être stockés à -80 oC dans un tube stérile de 2 ml pour effectuer l'évaluation viable du nombre de cellules bactériennes à des points ultérieurs. - Faire des plaques d'agar GC avec des antibiotiques au besoin. Séchez les plaques avant l'utilisation avant l'incubation préalable à 37 oC pendant 2 à 3 h.
- Préparer 10 dilutions en série des échantillons dans le bouillon GC de chaque tissu homogénéisé et la plaque sur les plaques d'agar GC. Incuber toute la nuit à 37 oC avec 5 % de CO2.
3. Préparation des tissus cérébraux pour le compte de CFU
- Utilisez une dose bactérienne sous-létale (5 x 105 CFU/souris) sur la base des résultats de survie animale pour inoculer les animaux par l'i.cist. (voir l'alinéa 1.2).
- Effectuer l'anesthésie des animaux au moment de l'infection établie comme mentionné à l'étape 2.
- Effectuer l'euthanasie des animaux par luxation cervicale.
- Nettoyer la zone chirurgicale avec 70% d'éthanol.
- Couper la tête de souris à l'aide d'un grand ciseau.
- Reséquez la fourrure et la peau à l'aide de petits ciseaux chirurgicaux et d'un fine placage d'acier incliné, en se dirigeant vers le haut du crâne pour être en mesure de voir clairement les sutures et de guider l'ouverture du crâne.
- Insérez la pointe d'un minuscule ciseaux à travers le magnum foramen pour ouvrir le crâne.
- Couper vers le centre du crâne et à travers la ligne médiane de l'os pariétal à l'autre côté du crâne. Couper délicatement le long du bord latéral de la suture lambdoid.
- Soulevez le crâne à partir du coin pariétal postérieur et tirez-le en diagonale vers le haut pour découvrir le cerveau, en utilisant de fines pointes.
- Assurez-vous que le tissu cérébral n'est pas attaché à un os de la tête, lorsque le crâne est soulevé.
- Utilisez des forceps jetables pour enlever tout tissu conjonctif entre le crâne et le cerveau, pour s'assurer que le tissu cérébral étant enlevé avec le crâne.
- Ne laissez pas le tissu cérébral sécher trop. Placer le cerveau, à l'aide de forceps jetables, dans un plat Petri avec 1 ml de bouillon GC complété par 10% (vol/vol) de glycérol.
- Homogénéiser le cerveau mécaniquement avec le piston d'une seringue de 5 ml (voir l'étape 2.2.9). Transférer les échantillons dans un tube stérile de 2 ml et stocker -80 oC pour l'évaluation ultérieure viable du nombre de cellules bactériennes, comme il est discuté à l'étape 2.2.
Résultats
Survie des souris infectées par n. meningitidis de type sauvage et souches mutantes isogéniques.
Les souches Neisseria meningitidis utilisées dans ces résultats représentatifs sont la souche de référence du sérogroupe C 93/4286 (ET-37) et son mutant isogénique 93/4286CssA obtenu par inactivation insertionnelle du gène cssA, codage pour l'UDP-N-acetylglucosamine 2-epimerase, qui cartographie dans la synthèse capsule locus25. Pour évaluer le degré de virulence de la souche cssA-défectueusedans le modèle murine actuel, la dose mortelle capable de déterminer la mort de 50% des animaux infectés (LD50) a été évaluée. À cette fin, trois groupes d'animaux ont été infectés par voie intracite avec des doses allant de 104 à 106 CFU de la souche de type sauvage 93/4286 et avec des doses de souche mutante 93/4286CssA entre 107 à 109 CFU . En général, la réduction des paramètres cliniques (p. ex., le poids corporel et la température) et l'augmentation du taux de mortalité se sont produites dans les 72 premiers h après l'infection. Le LD50 pour la souche de type sauvage correspondait au défi méningococcique de 104 CFU, tandis que le taux de mortalité avec la dose de 105 CFU était égal à 83,4% et avec 106 CFU de 100% (figure 1A). Inversement, pour obtenir le LD50 pour la souche mutante 93/4286CssA, il a fallu une dose de 108 CFU (Figure 1B), une quantité de 10.000 fois plus élevé par rapport à la souche de type sauvage.
Évaluation de N. meningitidis CFU viable dans les tissus de cerveau de souris.
Pour suivre la cinétique de l'infection dans le tissu cérébral des animaux infectés, un test de cours de temps a été effectué avec le type sauvage ou cssA souche mutante25. Après le i.cist. injection avec 5x105 CFU de 93/4286 ou 93/4286CssA souches, il y avait une augmentation rapide des bactéries de type sauvage dans le tissu cérébral atteignant les plus grands nombres à environ 24 h après l'infection (Figure 2A); inversement dans le cerveau des souris contestées avec le mutant isogénique cssA-défectueux,les comptes viables ont diminué progressivement au fil du temps jusqu'à 2.026 bûches CFU - 1.774 72 h après l'infection (Figure 2A). L'expérience a montré que 33,3% des souris mutantes contestées ont montré le dégagement bactérien du site d'infection, tandis que l'infection par la souche de type sauvage n'a jamais été éradiquée du cerveau des animaux.
Évaluation de la charge méningococcique dans la rate et le foie 48h post-défi.
Cette expérience a été réalisée pour évaluer le dégagement des bactéries des souris infectées 48 h post-défi dans les organes périphériques. À cet effet, deux groupes de souris ont été infectés par 5 x 105 CFU de 93/4286 ou 93/4286 SouchescssA, et des comptes bactériens viables ont été évalués dans la rate et le foie des souris infectées25 (Figure 2B). Après 48 h de l'injection de méningocoque, le mutant cssA-défectueuxa été complètement dégagé dans la rate et le foie, tandis que les animaux infectés par la souche sauvage de type ont montré un cadre d'infection systémique persistant. Les valeurs moyennes de CFU après 48 h étaient en effet encore 3.212 cFU de journal - 3.354 et 6.949 cFU de journal - 1.37 dans la rate et le foie, respectivement. La différence dans les charges bactériennes dans le tissu hépatique de deux groupes d'animaux était statistiquement significative (avec un P et lt ; 0,001).
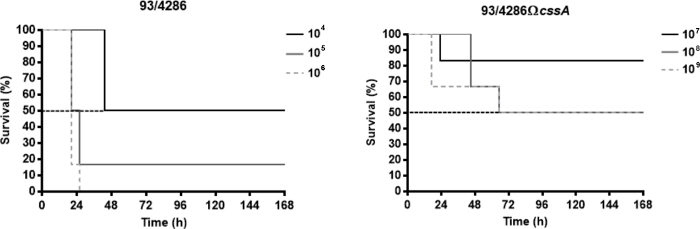
Figure 1 : Survie des souris infectées par des souches de type sauvage 93/4286 ou cssA-défectueusesde N. meningitidis. (A) Trois groupes de souris Balb/c (n ' 6/dose) ont été infectés i.cist. avec 104, 105, et 106 CFU/souris de la souche de type sauvage 93/4286 et (B) avec 107, 108, et 109 CFU/souris de l'isogène cssA-mutant défectueux. Les souris ont été surveillées pendant une semaine, et la survie a été enregistrée. Les résultats sont exprimés comme la survie en pourcentage à différentes doses au fil du temps, la valeur de rang de journal p était 'lt; 0.05 pour les souris infectées par la souche de type sauvage. Ce chiffre a été modifié à partir de Colicchio et al.25. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
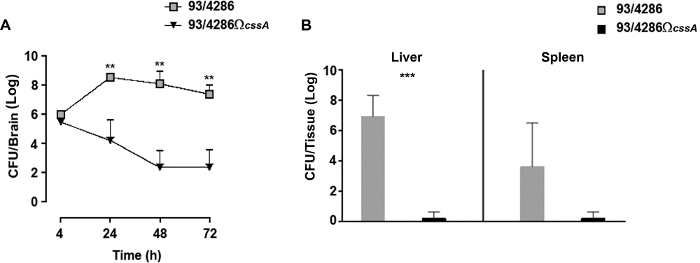
Figure 2 : Évaluation des charges bactériennes au fil du temps chez les souris inoculées avec les souches 93/4286 ou 93/4286CssA. (A) Cours de temps de charges bactériennes dans les tissus cérébraux suivant i.cist. infection. Deux groupes de souris De Balb/c (n et 20/groupe) ont été infectés par l'i.cist. avec 5 x 105 CFU de la souche de type sauvage 93/4286 ou du mutant cssA-défectueux. Les animaux ont été sacrifiés 4, 24, 48, et 72 h après l'infection. Les cerveaux ont été récoltés, homogénéisés mécaniquement dans le milieu de GC, et des comptes viables ont été déterminés. Les résultats sont exprimés comme étant le journal Moyen de La DS des nombres de CFU par organe à différents moments après l'inoculation. Les astérisques indiquent la signification statistique (en p, P et lt; 0,01). (B) Charges bactériennes au fil du temps dans la rate et le foie. Deux groupes de souris De balb/c (n 5/groupe) ont été infectés i.cist. avec 5 x 105 CFU de la souche de type sauvage 93/4286 ou du mutant cssA-défectueux. Les animaux ont été euthanasiés 48 h après l'infection. Des rates et des foies ont été moisis, mécaniquement homogénéisés, et des comptes viables ont été déterminés. Les résultats sont exprimés sous forme de numéros de cFU journal par organe. Les barres horizontales indiquent les journaux de tess/ tordes de bactéries. Les astérisques indiquent la signification statistique (md, P et lt; 0,001). Ce chiffre a été modifié à partir de Colicchio et al.25. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Dans cette étude, nous décrivons un protocole expérimental pour induire la méningite méningococcique chez les souris adultes par i.cist. l'inoculation des bactéries méningococciques. À notre connaissance, aucun autre modèle de méningite à méningocoque n'a été développé chez des souris de laboratoire infectées par i.cist. itinéraire; dans le passé, cette façon a été explorée pour fournir des modèles de méningite à méningocoques chez le rat31 et le lapin32. Il est bien connu que le taux le plus élevé de méningococcie se trouve chez les jeunes enfants, les adolescents et les jeunes adultes33,34,35; pour cette raison, dans notre modèle de souris de méningite, au lieu de se concentrer sur les animaux néonatals ou infantiles, des animaux immunocompétents de 8 semaines ont été employés.
Dans notre modèle expérimental, nous avons décidé d'utiliser i.cist. inoculum car il assure la libération des méningocoques directement dans la cisterna magna facilitant ainsi la réplication bactérienne dans le CSF. Cette voie d'inoculation est physiologiquement plus accessible28 et moins traumatisante que la voie subarachnoïdale intracrânienne, déjà utilisée pour le développement de la méningite due au Streptococcus spp. 36,37. Bien qu'il ne représente pas le mode naturel d'infection du méningocoque, l'injection de bactéries dans ce domaine a été instrumentale pour l'induction de la méningite à méningocoques, comme le montre la survie de la souris, les charges des bactéries, les paramètres cliniques, et aussi par analyse histologique24,25,26. Intéressant, la souche de référence 93/4286 a induit la méningite avec des dispositifs histopathologiques imitant ceux observés dans la maladie humaine24,25,26.
Pour établir une infection murine normalisée et pour garantir la sécurité des chercheurs, il a été préféré de commencer à partir d'un stock congelé titrated de bactéries plutôt que d'une croissance bactérienne fraîche24,25,30, 38, en outre, nous avons décidé d'utiliser une dose sublétale de méningocoques vivants dans le but de limiter un résultat rapide mortel et permettre le développement de lésions cérébrales2,24,25,26. Néanmoins, pour déterminer une dose infectieuse appropriée pour différentes souches, des expériences préliminaires doivent être effectuées. Dans la présente étude, nous avons testé une souche de référence du sérogroupe C 93/4286 et une souche mutante isogénique 93/4286CssA avec une dose de 5 x 105 CFU/ souris.
Bien que ce modèle n'imite pas les phases initiales de la colonisation et de l'invasion du méningocoque, l'isolat bactérien se développe bien non seulement dans le CSF, mais il est également capable de rester dans la rate et les compartiments du foie. Pendant la phase hypoferremic de l'infection de neisserial, la plupart du fer heme-dérivé reste combiné avec la ferritine de foie. Comme la ferritine peut être utilisé des méningocoques pour obtenir le fer39, le foie constitue un organe cible pour la réplication bactérienne.
Dans cette procédure expérimentale, la souche de souris consanguine De nauséabonde Balb/c a été utilisée pour remplacer la souche CD-1 qui a été utilisée à l'origine pour développer le modèle de méningite à méningocoque24. Les souris surélevées ont été caractérisées par une grande variabilité génétique qui peut être plus appropriée pour révéler plusieurs effets dans une cohorte variable telle que la population humaine40,41. Toutefois, cette variabilité nécessite une taille d'échantillon plus élevée pour obtenir une signification statistique suffisante et peut interférer avec la normalisation des procédures et des études ciblées.
Malgré l'étroite gamme d'hôtes de méningocoque, pour assurer la réplication des bactéries dans l'hôte murine et d'améliorer la virulence des méningocoques, dextran de fer a été administré aux animaux avant l'infection6,14. Enfin, par rapport à d'autres modèles expérimentaux de méningite, les animaux n'ont pas été traités avec des antibiotiques, de ne pas affecter le cours de la maladie et / ou le profil de la réponse inflammatoire26.
Jusqu'à présent, nos études ont mis en évidence que le i.cist. est fonctionnel pour induire à la fois la méningite et la méningococcie invasive par rapport aux modèles d'infection i.p. ou i.n., qui se caractérisent par l'apparition de septicémie et de bactériémie avant l'établissement de la méningite10,11 ,12,13,14,15,16,17. Par conséquent, ce modèle d'infection basé sur l'induction de la méningite dans l'hôte murine, pourrait être utile non seulement pour évaluer la stratégie thérapeutique innovante pour empêcher la réplication bactérienne directement dans CSF mais également pour analyser l'efficacité du système immunitaire passif possible contre les agents pathogènes humains.
Cependant l'infection à méningocoque est un processus en plusieurs étapes, qui comprend la colonisation du nasopharynx, l'accès à la circulation sanguine, le croisement de la barrière hémato-encéphalique et enfin la prolifération incontrôlée dans le CSF, notre modèle ne reproduit que certains aspects de la l'infection méningococcique, afin de subvertir en partie ces limitations modèle animal transgénique peut être utile pour imiter la pathogénie humaine de la maladie méningococcique.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les études ont été soutenues en partie par PRIN 2012 [numéro de subvention 2012WJSX8K]: "Host-microbe interaction models in mucosal infections: development of new therapeutic strategies" et par PRIN 2017 [2017SFBFER]: "Une approche intégrée pour lutter contre l'interaction entre les l'adaptation, les conditions stressantes et la résistance aux antimicrobiens des pathogènes difficiles ».
matériels
| Name | Company | Catalog Number | Comments |
| 1,8 Skirted Cryovial With external thread | Starlab | E3090-6222 | |
| 50 mL Polypropylene Conical Tube | Falcon | 352070 | 30 mm x 115 mm |
| Adson Forceps | F.S.T. | 11006-12 | Stainless Steel |
| Alarm-Thermometer | TESTO | 9000530 | |
| BactoTM Proteose Peptone | BD | 211693 | |
| BD Micro Fine syringe | BD | 320837 | U-100 Insulin |
| BD Plastipak syringe 1 mL 25 G 5/8 inch | BD | 300014 | 05 mm x 16 mm |
| BD Plastipak syringe 5 mL | BD | 308062 | 07 mm x 30 mm |
| BIOHAZARD AURA B VERTICAL LAMINAR FLOW CABINET | Bio Air s.c.r.l. | Aura B3 | |
| BioPhotometer | Eppendorf | Model #6131 | |
| Bottle D | Tecniplast | D | Graduated up to: 400 mL, Total Volume 450 mL, 72 mm x 72 mm x 122 mm |
| C150 CO2 Incubator | Binder | 9040-0078 | |
| Cage Body Eurostandard Type II | Tecniplast | 1264C | 267 x 207 x 140 mm3, Floor area 370 cm2 |
| Cell Culture Petri Dish With Lid | Thermo Scientific | 150288 | Working Volume: 5 mL |
| Centrifuge | Eppendorf | Microcentrifuge 5415R | |
| Cuvetta semi-micro L. Form | Kartell S.p.A. | 01938-00 | |
| di-Potassium hydrogen phosphate trihydrate | Carlo erba | 471767 | |
| di-Sodium hydrogen phosphate anhydrous ACS-for analysis | Carlo Erba | 480141 | g1000 |
| Diete Standard Certificate | Mucedola s.r.l. | 4RF21 | Food pellet for animal |
| Dumont Hp Tweezers 5 Stainless Steel | F.S.T. by DUMONT | AGT5034 | 0.10 x 0.06 mm2 tip |
| Electronic Balance | Gibertini | EU-C1200 | Max 1200 g, d = 0.01 g, T = -1200 g |
| Eppendorf Microcentrifuge tube safe-lock | Eppendorf | T3545-1000EA | |
| Erythromycin | Sigma-Aldrich | E-6376 | 25 g |
| Extra Fine Bonn Scissors | F.S.T. | 14084-08 | Stainless Steel |
| Filter Top (mini- Isolator), H-Temp with lock clamps | Tecniplast | 1264C400SUC | |
| GC agar base | OXOID | CM0367 | |
| Gillies Forceps 1 x2 teeth | F.S.T. | 11028-15 | Stainless Steel |
| Glicerin RPE | Carlo Erba | 453752 | 1 L |
| Graefe Forceps | F.S.T. | 11052-10 | Serrated Tip Width: 0.8 mm |
| Inner lid | Tecniplast | 1264C116 | |
| Iron dextran solution | Sigma-Aldrich | D8517-25ML | |
| Ketamine | Intervet | ||
| Microbiological Safety Cabinet BH-EN and BHG Class II | Faster | BH-EN 2004 | |
| Microcentrifuge tubes 1.5 mL | BRAND | PP780751 | screw cap PP, grad |
| Mouse Handling Forceps | F.S.T. | 11035-20 | Serrated rubber; Gripping surface: 15 mm x 20 mm |
| Mucotit-F2000 | MERZ | 61846 | 2000 mL |
| Natural Latex Gloves | Medica | M101 | |
| New Brunswick Classic C24 Incubator Shaker | PBI international | C-24 Classic Benchtop Incubator Shaker | |
| Petri PS Dishes | VWR | 391-0453 | 90 x 14.2 mm2 |
| Pipetman Classic P20 | Gilson | F123600 | 2-20 μL |
| Pipetman Classic P200 | Gilson | F123601 | 20-200 μLL |
| Pipetman Classim P1000 | Gilson | F123602 | 200-1,000 μL |
| Polyvitox | OXOID | SR0090A | |
| Potassium Chloride | J.T. Baker Chemicals B.V. | 0208 | 250 g |
| Potassium Dihydrogen Phosphate | J.T. Baker Chemicals B.V. | 0240 | 1 kg |
| PS Disposible forceps | VWR | 232-0191 | |
| Removable Divider | Tecniplast | 1264C812 | |
| Round-Bottom Polypropylene Tubes | Falcon | 352063 | 5 mL |
| Sodium Chloride | MOLEKULA | 41272436 | |
| SS retainer and Polyester FilterSheet | Tecniplast | 1264C | |
| Standard Pattern Forceps | F.S.T. | 11000-12 | Stainless |
| Stevens Tenotomy Scissors | F.S.T. | 14066-11 | Stainless Steel |
| Surgical Scissor - ToughCut | F.S.T. | 14130-17 | Stainless |
| Touch N Tuff disposible nitrile gloves | Ansell | 92-500 | |
| Ultra Low Temperature (ULT) Freezer | Haier | DW-86L288 | Volume = 288 L |
| Wagner Scissors | F.S.T. | 14070-12 | Stainless Steel |
| Xylazine | Intervet |
Références
- van Deuren, M., Brandtzaeg, P., van der Meer, J. W. Update on meningococcal disease with emphasis on pathogenesis and clinical management. Clinical Microbiology Reviews. 13, 144-166 (2000).
- Colicchio, R., et al. Fitness Cost of Rifampin Resistance in Neisseria meningitidis: In vitro Study of Mechanisms Associated with rpoB H553Y Mutation. Antimicrobial Agents and Chemotherapy. 59 (12), 7637-7649 (2015).
- Talà, A., et al. Serogroup-specific interaction of Neisseria meningitidis capsular polysaccharide with host cell microtubules and effects on tubulin polymerization. Infection and Immunity. 82, 265-274 (2014).
- Pagliarulo, C., et al. Regulation and differential expression of gdhA encoding NADP-specific glutamate dehydrogenase in Neisseria meningitidis clinical isolates. Molecular Microbiology. 51, 1757-1772 (2004).
- Plant, L., Jonsson, A. B. Contacting the host: insights and implications of pathogenic Neisseria cell interactions. Scandinavian Journal of Infectious Diseases. 35, 608-613 (2003).
- Schryvers, A. B., Stojiljkovic, I. Iron acquisition systems in the pathogenic Neisseria. Molecular Microbiology. 32, 1117-1123 (1999).
- Virji, M., Makepeace, K., Ferguson, D. J., Watt, S. M. Carcinoembryonic antigens (CD66) on epithelial cells and neutrophils are receptors for Opa proteins of pathogenic neisseriae. Molecular Microbiology. 22, 941-950 (1996).
- de Vries, F. P., van Der Ende, A., van Putten, J. P., Dankert, J. Invasion of primary nasopharyngeal epithelial cells by Neisseria meningitidis is controlled by phase variation of multiple surface antigens. Infection and Immunity. 64, 2998-3006 (1996).
- Tinsley, C. R., Heckels, J. E. Variation in the expression of pili and outer membrane protein by Neisseria meningitidis during the course of the meningococcal infection. Journal of General Microbiology. 132, 2483-2490 (1986).
- Gorringe, A. R., et al. Experimental disease models for the assessment of meningococcal vaccines. Vaccine. 23, 2214-2217 (2005).
- Newcombe, J., et al. Infection with an avirulent phoP mutant of Neisseria meningitidis confers broad cross-reactive immunity. Infection and Immunity. 72, 338-344 (2004).
- Oftung, F., Lovik, M., Andersen, S. R., Froholm, L. O., Bjune, G. A mouse model utilising human transferrin to study protection against Neisseria meningitidis serogroup B induced by outer membrane vesicle vaccination. FEMS Immunology and Medical Microbiology. 26, 75-82 (1999).
- Salit, I. E., Tomalty, L. Experimental meningococcal infection in neonatal mice: differences in virulence between strains isolated from human cases and carriers. Canadian Journal of Microbiology. 30, 1042-1045 (1984).
- Salit, I. E., Tomalty, L. A neonatal mouse model of meningococcal disease. Clinical and Investigative Medicine. 9, 119-123 (1986).
- Mackinnon, F. G., Gorringe, A. R., Funnell, S. G., Robinson, A. Intranasal infection of infant mice with Neisseria meningitidis. Microbial Pathogenesis. 12, 415-420 (1992).
- Mackinnon, F. G., et al. Demonstration of lipooligosaccharide immunotype and cap- sule as virulence factors for Neisseria meningitidis using an infant mouse intranasal infection model. Microbial Pathogenesis. 15, 359-366 (1993).
- Yi, K., Stephens, D. S., Stojiljkovic, I. Development and evaluation of an improved mouse model of meningococcal colonization. Infection and Immunity. 71 (4), 1849-1855 (2003).
- Holbein, B. E., Jericho, K. W. F., Likes, G. C. Neisseria meningitidis infection in mice: influence of iron, variations in virulence among strains, and pathology. Infection and Immunity. 24, 545-551 (1979).
- Saukkonen, K. Experimental meningococcal meningitis in the infant rat. Microbial Pathogenesis. 4, 203-211 (1988).
- Johansson, L., et al. CD46 in meningococcal disease. Science. 301, 373-375 (2003).
- Zarantonelli, M. L., et al. Transgenic mice expressing human transferrin as a model for meningococcal infection. Infection and Immunity. 75, 5609-5614 (2007).
- Join-Lambert, O., et al. Meningococcal interaction to microvasculature triggers the tissular lesions of purpura fulminans. Journal of Infection Disease. 208, 1590-1597 (2013).
- Melican, K., Michea Veloso, P., Martin, T., Bruneval, P., Duménil, G. Adhesion of Neisseria meningitidis to dermal vessels leads to local vascular damage and purpura in a humanized mouse model. PLoS Pathogen. 9, 1003139 (2013).
- Colicchio, R., et al. The meningococcal ABC-Type L-glutamate transporter GltT is necessary for the development of experimental meningitis in mice. Infection and Immunity. 77, 3578-3587 (2009).
- Colicchio, R., et al. Virulence traits of serogroup C meningococcus and isogenic cssA mutant, defective in surface-exposed sialic acid, in a murine model of meningitis. Infection and Immunity. , 00688-00718 (2019).
- Ricci, S., et al. Inhibition of matrix metalloproteinases attenuates brain damage in experimental meningococcal meningitis. BMC Infectious Diseases. 14, 726 (2014).
- Schryvers, A. B., Gonzalez, G. C. Comparison of the abilities of different protein sources of iron to enhance Neisseria meningitidis infection in mice. Infection and Immunity. 57, 2425-2429 (1989).
- Beverly, K. S. Chapter 105 - Cerebrospinal Fluid Sampling Small Animal. Critical Care Medicine. , 448-452 (2009).
- Liechti, F. D., Grandgirard, D., Leppert, D., Leib, S. L. Matrix metalloproteinase inhibition lowers mortality and brain injury in experimental pneumococcal meningitis. Infection and Immunity. 82, 1710-1718 (2014).
- Pagliuca, C., et al. Novel Approach for Evaluation of Bacteroides fragilis Protective Role against Bartonella henselae Liver Damage in Immunocompromised Murine Model. Frontiers in Microbiology. 7, 1750 (2016).
- Trampuz, A., Steinhuber, A., Wittwer, M., Leib, S. L. Rapid diagnosis of experimental meningitis by bacterial heat production in cerebrospi- nal fluid. BMC Infectious Diseases. 7, 116 (2007).
- Tuomanen, E. I., Saukkonen, K., Sande, S., Cioffe, C., Wright, S. D. Reduction of inflammation, tissue damage, and mortality in bacterial meningitis in rabbits treated with monoclonal antibodies against adhesion-promoting receptors of leukocytes. Journal of Experimental Medicine. 170, 959-969 (1989).
- Goldschneider, I., Gotschlich, E. C., Artenstein, M. S. Human immunity to the meningococcus. I. The role of humoral antibodies. Journal of Experimental Medicine. 129, 1307-1326 (1969).
- Goldschneider, I., Gotschlich, E. C., Artenstein, M. S. Human immunity to the meningococcus. II. Development of natural immunity. Journal of Experimental Medicine. 129, 1327-1348 (1969).
- World Health Organization. Laboratory methods for the diagnosis of meningitis caused by Neisseria meningitidis, Streptococcus pneumoniae, and Haemophilus influenzae: WHO manual, 2nd Edition. World Health Organization. , (2011).
- Chiavolini, D., et al. Method for inducing experimental pneumococcal meningitis in outbred mice. BMC Microbiolology. 4, 36 (2004).
- Zhang, S., et al. Intracranial Subarachnoidal Route of Infection for Investigating Roles of Streptococcus suis Biofilms in Meningitis in a Mouse Infection Model. Journal of Visualized Experiments. (1), e137 (2018).
- Pagliuca, C., et al. Evidence of Bacteroides fragilis protection from Bartonella henselae-induced damage. PLoS One. 7, 49653 (2012).
- Larson, J. A., Howie, H. L., So, M. Neisseria meningitidis accelerates ferritin degradation in host epithelial cells to yield an essential iron source. Molecular Microbiology. 53, 807-820 (2004).
- Festing, M. F. W. Phenotypic variability of inbred and outbred mice. Nature. 263, 230-232 (1976).
- Festing, M. F. W. Warning: the use of heterogeneous mice may seriously damage your research. Neurobiology of Aging. 20, 237-244 (1999).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon