Method Article
Ribonucleotides 효 모 게놈에 Ribonucleotide 유도 된 Mutagenesis 측정의 공부 Ribonucleotide 법인: 물가 관련 검색
요약
Ribonucleotides는 가장 풍부한 비정규 뉴클레오티드 핵 핵 DNA 복제 중 게놈으로 통합 중 이다. 제대로 제거, DNA 손상과 mutagenesis ribonucleotides 발생할 수 있습니다. 여기, 우리가 DNA와 그 변이 원 성 영향으로 ribonucleotide 설립의 풍부를 평가 하는 데 사용 되는 두 가지 실험 방법을 제시.
초록
핵 DNA에 ribonucleotides의 존재 genomic 불안정성의 원천 수를 보였다. Ribonucleotide 법인의 알칼리 가수분해에 의해 평가 될 수 있다 젤 전기 이동 법으로 RNA는 알칼리 조건에서 가수분해에 매우 취약 하며 이, 남쪽 오 점 분석에와 함께 사용할 수 있습니다 위치를 결정 하는 ribonucleotides 통합 되었습니다으로 물가 하. 그러나,이 절차만 반 정량적 이며 비록 감도 향상 가닥 특정 남쪽 오 점 프로 빙 충분히 ribonucleotide 콘텐츠에 작은 변화를 감지 하는 민감한 되지 않을 수 있습니다. 하나는 DNA에 ribonucleotides의 가장 눈에 띄는 생물 학적 결과의 측정으로 자발적인 mutagenesis 앞으로 돌연변이 분석 결과 사용 하 여 분석 수 있습니다. 적절 한 리포터 유전자를 사용 하 여 선택 되 고 전체 기능의 손실 귀착되는 희소 한 일 수 있다 그리고 취재 원 유전자의 DNA 시퀀싱 변동 실험에서 데이터를 결합 하 여 특정 돌연변이 속도 측정할 수 있다. 변동 분석 결과 특정 유전 배경이 나 성장 조건에서 변이 원 성 프로세스의 다양 한 검사에 적용 됩니다.
서문
진 핵 DNA 복제 하는 동안 ribonucleotides 모든 3 개의 주요 DNA replicases와 DNA polymerases (Pols) α, ε, δ1,2게놈에 통합 됩니다. RNase h 2 종속 ribonucleotide 절단 복구 (RER3)이 포함 된 ribonucleotides의 대부분을 제거합니다.
2' 수 산 기 그룹 설탕 moiety의 인접 한 phosphodiester 본드, 2'-3' 순환 인산 및 5'-오4다른 한쪽 끝을 풀어 공격 수로 DNA에 ribonucleotide 가수분해을 받기 쉽습니다. 알칼리 조건 크게이 반응을 가속화할 수 있습니다. 따라서, 기본 솔루션에서 부 화 하는 동안 포함 된 ribonucleotides의 가수분해 agarose 알칼리 성 전기 이동 법5에 의해 구상 될 수 있다 게놈 DNA의 분열을 발생 합니다. 이 DNA는 막 전송 및 남쪽 오 점 분석 알칼리에 민감한 사이트 ribonucleotides에 초기 선도-또는 지체-가닥 DNA, 통합으로 인 한 식별 수 있도록 물가 관련 프로브를 사용 하 여 탐색할 수 있습니다. 각각.
효 모 세포 RNase h 2 활동 부족, ribonucleotides의 제거 topoisomerase 나 (Top1) 임베디드 ribonucleotide6,7에서 DNA 흠 때 시작할 수 있습니다. 그러나, Top1 3'의는 ribonucleotide 앞, 이것 생성 5'-아와 2'-3' 주기적인 인산 염 DNA religation 내 화물을 합니다. 수리, 또는이 '더러운 끝'의 탈 선 처리 실패는 게놈 불안정성으로 이어질 수 있습니다. 또한, 절 개 반복 DNA 시퀀스 내에서 발생 하는 경우 복구 프로세스 삭제 돌연변이 발생할 수 있습니다. 이것은 특히 문제가 있는 탠덤 반복, 어디 삭제를 짧은 (의 2 개의 그리고 5 개의 기본적인 쌍 사이) RNase h 2-불충분 한 세포에서 일반적으로 관찰 된다. 효 모 활동 ribonucleotide 설립 초기 선도 가닥 종합 동안에 대 한 무차별 DNA 중 합 효소 ε 돌연변이 (pol2 M644G)에서 악화는 RNase h 2의 부재에 Top1 종속 해로운 효과.
DNA에는 ribonucleotides의 처리 자연 스러운 돌연변이에 지도 하 고이 mutagenesis 적절 한 리포터 유전자를 사용 하 고 동반 phenotypic 변화에 대 한 선택 하 여 검출 될 수 있다. 변동 테스트 또는 Luria 그리고 델 브 룩 실험 자발적인 돌연변이 속도 선택 가능한 기자 유전자8,9를 사용 하 여 측정을 가장 일반적으로 사용 되는 방법 중 하나입니다. 효 모, URA3 및 CAN1 유전자 유전자 기능의 손실 모든 돌연변이 유형의 탐지에 대 한 수 있는 앞으로 돌연변이 분석 결과에 기자로 사용할 수 있습니다. 자발적인 돌연변이 속도 여러 병렬 문화 대상 취재 원 유전자에 돌연변이 없이 단일 식민지에서 시작에 대 한 관찰의 중간값으로 추정 된다. RNase h 2 불충분 한 변형 rnh201Δ는 적당히 높은 전반적인 자발적인 돌연변이 속도에 2-5 bp 삭제의 높은 부각으로 인해 크게와 같은 효 모 시퀀스를 반복 합니다. 따라서, 완전히 게놈에 있는 ribonucleotides의 변이 원 성 영향 특성, 특정 돌연변이 속도 결정 될 필요가 있다. 이 경우에, URA3 또는 CAN1 리포터 유전자 증폭 될 수 있으며 시퀀스 유형, 돌연변이의 위치를 결정 하 고 특정 돌연변이 속도 계산할 수 있다. 여러 명의 독립적인 URA3 또는 CAN1 돌연변이에서 확인 된 돌연변이 컴파일 다음 돌연변이 스펙트럼을 생성 하기 위해 사용할 수 있습니다.
프로토콜
1. 알칼리 가수분해 하 고 물가 관련 남쪽 오 점 (그림 1)
- 세포 성장 및 genomic DNA 분리
- 효 모 제조업체의 지침에 따라 DNA 정제 키트를 사용 하 여 효 모 게놈 DNA를 격리 합니다. 사용 하 여 (0.5의 광학 밀도)과 1 사이 성장의 지 수 단계에 있는 문화. 35 ml 테 버퍼 (10 mM Tris HCl, pH 7.5, 1 mM ethylenediaminetetraacetic 산 (EDTA)) x 1의 최종 DNA 펠 릿을 resuspend.
- DNA에 5 mg/mL RNase A의 1 mL을 추가 하 고 37 ° c.에 30 분 동안 품 어
- 3 M 나트륨 아세테이트 (pH 5.2)의 0.1 볼륨을 사용 하 여 DNA를 침전 물 및 얼음에 20 분에 대 한 100% 에탄올의 2.5 볼륨.
- 4 ° c.에 20 분 16000 x g에서 원심 분리기 상쾌한 한 피 펫을 사용 하 여 제거 합니다.
- 펠 릿의 70% 에탄올 500 mL로 두 번 씻는 다. 상쾌한 한 피 펫을 사용 하 여 제거 합니다.
- 벤치에 펠 릿을 건조 하 고 테 버퍼 x 1의 35 ml에서 resuspend.
- Fluorimeter (테이블의 재료)를 사용 하 여 dsDNA BR 분석 결과 키트와 DNA quantitate
- 3 M 나트륨 아세테이트, 100%의 pH 5.2와 2.5 볼륨의 0.1 볼륨을 사용 하 여 각 샘플에서 DNA의 5 mg을 침전 EtOH 200 mL의 총 볼륨 (DNA의 필요, 추가 5 mg 중립 젤 컨트롤이 필요한 경우 필요한 경우 추가 H2O). 20 분 동안 얼음에 품 어.
- 4 ° c.에 20 분 16000 x g에서 원심 분리기 상쾌한 한 피 펫을 사용 하 여 제거 합니다.
- 벤치에 펠 릿을 건조. H2o.의 14 ml에서 DNA resuspend
- 알칼리 성가 수 분해와 젤 전기 이동 법
- 1 M 코의 6 mL을 추가 하 고 2 h 55 ° C에서 품 어.
- 5 분 동안 얼음에 샘플을 품 어.
- 알칼리 성 DNA 로딩 버퍼 x 6의 4 개 mL를 추가: 300 mM 코, 6 m m EDTA, pH 8.0, 18 %polysucrose (테이블의 자료), 0.15 %bromocresol 녹색, 및 0.25% 자일 렌 cyanol FF.
- 1 %agarose, 50 m NaOH, m 1 m m EDTA, pH 8.0 이루어진 알칼리 젤을 캐스팅. DNA 샘플의 24 mL 레인 당 로드 하도록 허용 하는 빗을 사용 합니다.
- 알칼리 성 전기 이동 법 버퍼 x 1에 실 온에서 젤 실행: 50 m m NaOH, 1 m EDTA, pH 8.0 m. 적절 한 DNA 크기 마커를 포함 합니다.
- 짧게 튜브 아래로 회전 시키십시오 고 알칼리 agarose 젤으로 전체 24 mL 샘플을 로드 합니다. 30 V, V 10에 18-20 h 뒤에 30 분 동안 electrophorese.
- 2 외피의 부드러운 동요 HCl-중화 버퍼 i: 1 M Tris, 1.5 M NaCl와 실 온에서 각 45 분에 대 한 젤을 무력화.
- 부드러운 진동으로 실 온에서 2 h SYBR 골드 얼룩의 1/10000 희석을 포함 하는 물 200 mL에 무력화 젤을 몸을 담글 하 여 DNA를 얼룩.
- UV transilluminator를 사용 하 여 DNA를 시각화 합니다. 알칼리 감도 증가 DNA5배달된 ribonucleotides의 높은 밀도 나타내는 작은 DNA 파편의 모양을 발생 합니다.
- 남부 전송
- 10모 세관 작용 의해 알칼리 젤에서 충전 된 나일론 막 DNA을 전송. 어떻게이 전송 설정할 수 있습니다 예 Sambrook와 러셀의 수동10에서 제공 됩니다.
- 알칼리 성 전송 버퍼에 실 온에서 15 분 알칼리 젤을 담근 다: 0.4 M NaOH, 1 M NaCl.
- 물, 나일론 막 (젤의 크기로 잘라)를 짧게 습식 및 다음 알칼리 전송 버퍼에 5 분 동안 담근 다.
- 3 유리 비 커 (100 mL)을 반전 하 여 유리 베이킹 접시에에서 전송 플랫폼을 설정 합니다. 이 접시는 agarose 젤의 크기 보다 약간 더 큰 해야 합니다. 그들의 정상 유리 접시를 설정 합니다.
- 유리 접시 위에 (젤 플러스 버퍼 저수지로 가장자리를 통해 드러 워 진 수 있는 더 긴 측의 폭의 크기로 잘라) 3MM CHR 크로마토그래피 종이의 2 큰 조각을 드러 워 진.
- 크로마토그래피 종이 절반 채우기 유리 접시 이상의 알칼리 전송 버퍼를 붓는 다. 5 mL 유리 피 펫을 사용 하 여 거품이 부드럽게.
- Agarose 젤을 거품으로 부드럽게 다시 위에 놓습니다. Parafilm으로 젤의 모든 가장자리를 둘러싸고 있습니다. 젤에 소량의 알칼리 전송 버퍼를 붓는 다.
- 젤 위에 미리 젖된 나일론 막 장소. 부드럽게 거품.
- 종이의 젖은 2 조각 agarose 젤의 크기로 잘라. 그들은 막 위에 놓고 모든 거품을 밖으로 부드럽게 합니다.
- 전송 샌드위치 위에 종이 타 올 (agarose 젤 보다 약간 큰 크기로 컷)의 대형 스택에 배치 합니다. 신중 하 게 유리 접시를 종이 타월 위에 놓습니다. 상단 (잘 400 g의 질량을 가진도 서)를 가중치 개체를 추가 합니다.
- 하룻밤 실 온에서 진행 하는 전송 하자.
- 신중 하 게 전송 스택을 분해 하 고 중화 버퍼 2에서 실 온에서 15 분 동안 막 흡수: 0.5 M Tris HCl, pH 7.2, 1 M NaCl.
- Crosslink UV crosslinker를 사용 하 여 충전된 나일론 막에 DNA. cross-linker에 막 놓고 autocrosslink 설정을 사용 합니다.
- 남부 조사 준비
참고: 여기에 초기 선도 뒤지는 가닥 DNA 물가의 대 알칼리에 민감한 사이트는 프로토콜 기반 감지 설명 접근11이전 게시. 우리의 실험에 대 한 조사는 두 방향 (OR1 또는 OR2) 염색체 III (그림 3A)에 ARS306 복제 원점에 인접 한 중 하나에 삽입 된 URA3 취재 원 유전자에서 수행 됩니다. 효 모 게놈 DNA에 알칼리에 민감한 사이트의 존재는 ribonucleotide 관, DNA 중 합 효소 활동12,,1314의 biomarkers로 ribonucleotides 사용할 수 있습니다. 대상 복제의 효율적인 ARS306 근원에 인접 한 DNA 순서를 사용 하 여이 접근 다른 genomic 위치 및 대상 유전자도 순종 해야 합니다.- 다음 뇌관 쌍을 사용 하 여 URA3 취재 원 유전자의 PCR 증폭 520 기반 쌍 세그먼트: URA3 F1 (5´-GCTACATATAAGGAACGTGCTGC)와 URA3-R1 (5´-CTTTGTCGCTCTTCGCAATGTC).
- 템플릿으로 효 모 게놈 DNA의 10-20, 각 뇌관 (10 μ M 주식) Taq 버퍼 (Mg2 + 플러스) 예, dNTP 혼합물 (2.5 m m 각)의 8 μ, 0.5 μ의 전 Taq DNA 중 합 효소 x 10의 10 μ의 4 μ를 사용 하 여 PCR 반응을 수행 (5 U/μ) 100 μ H2o.를 최종 볼륨을 조정
- 다음 PCR 프로그램 실행: 95 ° C 5 분; 1 분, 1 분, 2 분; 72 ° C에 55 ° C 95 ° C의 30 주기 72 ° C 10 분 및 4 ° c.에서 개최
- PCR 정화 키트를 사용 하 여 PCR 제품을 정화 하 고 H2o.의 50 mL를 사용 하 여 DNA elute 이것은 지금 radiolabeling 반응에서 템플릿으로 사용할 수 있습니다.
- 물가 관련 radiolabeling에 대 한 다음 뇌관을 사용 하 여: DNA 프로브 A. anneals는 시각화 사용 URA3-A (5´-CTCATCCTAGTCCTGTTGCTGCC) 이 때 URA3 OR2와 tnascent URA3 OR1 때 가닥 DNA를 후행 초기 선도 가닥 DNA에 해당 합니다. URA3-B (5´-CAGTACCCTTAGTATATTCTCCAG)를 사용 하 여 초기 DNA 프로브 B. anneals는 시각화에 대 한 이 때 URA3 OR1 및 초기 뒤지는 가닥 DNA URA3 OR2 때 초기 선도 가닥 DNA에 해당 (그림 3).
- URA3 조각 ng 증폭에 10-20을 사용 하 여 템플릿으로 DNA, 뇌관 (10 μ M 주식), Taq 버퍼 (Mg2 + 플러스) 전 10 x 5 μ, 4 μ (마이너스 dCTP), 2.5 m m dNTPs의 2 μ radiolabeling 반응 수행 5 μ (50 μCi)는-32P dCTP의 0.5 μ ExTaq DNA 중 합 효소의 (5 U/μ) H2o. 실행 다음 프로그램 radiolabeling 50 μ를 최종 볼륨을 조정: 94 ° C 5 분; 25 주기 94 ° C의 1 분, 55 ° C 30 초, 1 분; 72 ° C 72 ° C 5 분 및 4 ° c.에서 개최
- 비법 인된 방사성 라벨을 제거 하려면 G-25 스핀 열을 사용 합니다. 방사선된 샘플을 추가 하기 전에 pipetting으로 g와 removethe 버퍼 x 720에서 1 분 동안 열을 원심. 방사선된 반응 제품 및 elute 레이블이 프로브를 720 x g에서 2 분 동안 원심 분리기를 로드 합니다.
- 교 잡 직전 프로브 변성을 5 분 동안 95 ° C에서 품 어. 차가운 얼음에 잠시입니다.
- 남부 교 잡
- 교 잡 관으로 유체 막 구르 고 갓된 교 잡 버퍼의 25 mL를 추가: 0.5 M 나트륨 인산 염 버퍼, pH 7.2, 7% 나트륨 라우릴 황산 염 (SDS), 1% 소 혈 청 알 부 민 (BSA). 교 잡 오븐에 회전 1-2 h 65 ° C에서 품 어.
- 신중 하 게는 솔루션을 부 어 하 고 교 잡 버퍼 플러스 radiolabelled 프로브 25 mL를 추가 합니다. 65 ° C 16-18 h 회전에서 품 어.
- 방사성 폐기물 컨테이너에 솔루션을 붓는 다. 수행 하는 각 인산 염-SDS 세척 솔루션 i: 40 mM 나트륨 인산 염 버퍼, pH 7.2, 실 온에서 5 분의 5 세척 5 %SDS, 0.5 %BSA, 1 mM EDTA, pH 8.0.
- 2 세척 각 인산 염-SDS 세척 솔루션 ii 65 ° C에서 15 분의 수행: 40mm 나트륨 인산 염 버퍼, pH 7.2, 1 %SDS, 1 m EDTA, pH 8.0 m.
- 핀셋을 사용 하 여 교 잡 튜브에서 멤브레인을 제거 하 고 열린된 플라스틱 슬리브 보호에. 표지 및 이미징 접시에 노출. 4 d 4 h에서까지 시간 다른 노출의 수를 보십시오.
- 필요한 경우 제거 하 고 다시 프로브 다른 프로브를 사용 하 여 약 3-4 회 오. 스트립, 50% formamide 2 x SSPE 솔루션의 25 mL에 65 ° C에서 2 시간에 대 한 멤브레인을 품 어.
참고: 20 x SSPE 재고 솔루션: 3 M NaCl, 0.2 M NaH2포4, 0.02 M EDTA, pH 7.4. - 방사성 폐기물 컨테이너에 솔루션을 붓는 다. 인산-SDS 세척 솔루션 II에 65 ° C에서 15 분 각 2 세척을 수행 합니다.
- 가 거 카운터로 막 확인 하 고 신호 유지 하는 경우 스트립 프로토콜을 반복.
- 위에서 설명한 사전 교 잡 및 교 잡을 수행 합니다.
2. 측정 변이 속도 S. cerevisiae 긴장에 특이성
- 세포 배양 준비
- 단일 식민지 (건강 한 효 모 세포 걸립니다 크기의 적절 한 형태를 30 ° C에서 2-3 일 식민지) YPDA 국물 (아데닌의 보충은 유일한 필요한 경우 250 mg/mL 아데닌으로 보충의 5 mL로 100 mg/mL 아데닌으로 보충 하는 YPD agar에 접종 사용 하는 긴장은 아데닌 주별)입니다. 성장 통 보육 또는 30 ° C에서 회전자에 문화 채도 (심각한 성장 결함 없이 긴장을 위한 36-48 h)를 도달할 때까지.
- 5 분 ~ 2000 x g에서 셀 아래로 회전 합니다.
- 삭제는 상쾌한 고 메 마른 물 5 mL로 세포를 씻어.
- 메 마른 물 500 mL에 셀 resuspend
- 세포 배양 및 도금의 희석
- 비 선택 컨트롤에 대 한 1,600,000 및 격판덮개의 완전 한 (COM) 접시에 각 문화 100 mL의 요인에 의해 96 잘 접시의 세포를 희석.
- Ura3 돌연변이 선택 하려면 100 mL 야생-타입 (WT) 긴장에 대 한 5-FOA 접시에 undiluted 셀의 접시. 관심의 긴장의 돌연변이 속도 WT 피로 보다 높을 것으로 예상 된다 하는 경우 그에 따라 셀을 희석.
- Can1 돌연변이 대 한 선택, 5-fold 셀을 희석 하 고 WT 스트레인에 대 한 포함 하는 canavanine 접시 (수)에 100 mL 접시. 희석 비율 0.5입니다.
- 효 모 식민지 양식까지 30 ° C에서 번호판을 품 어. 성장 결함 없이 긴장에 대 한 2-3 일 일반적으로 COM에 대 한 충분 한 이며 접시와 5 FOA 번호판에 대 한 3-5 일 수 있습니다. 다른 긴장 사이 변이 속도 비교를 식민지를 성장의 같은 날 선택 최상 이다. 콜드 룸 (~ 4 ° C)에 포함 될 준비가 접시를 저장.
- 자연 돌연변이 율의 계산
- 각 접시에 보이는 식민지 고 식민지 숫자의 메모
- 드레이 크의 수식을 사용 하 여 돌연변이 율 계산: μ = f ÷ ln (μNt). f 마지막 문화에 있는 셀의 수로 나눈 돌연변이의 수로 계산 하는 돌연변이 주파수 이다. Nt는 최종 문화에는 셀의 수 이며 μ 돌연변이 비율. 이 방정식은 뉴 톤 Raphson 메서드와 같은 반복 방법으로 해결할 수 있습니다. 레 아와 Coulson 테스트 돌연변이 속도15계산 하을 포함 하 여 다른 견적 방법 있다.
- 개별 격리의 utation 비율의 신뢰 구간 가정 로그 정규 분포를 계산 합니다. 95% 신뢰 구간 가장 자주 사용 됩니다.
- 돌연변이 스펙트럼의 분석
- 각 5 FOA에서 단일 식민지 나 판 수 YPDA 접시에 새로 고칩니다.
- 식민지 다음 프라이 머를 사용 하 여 돌연변이 탐지 하기 위해 URA3 또는 CAN1 유전자와 순서를 증폭 하는 PCR을 수행: URA3 F (5'-CGCATATGTGGTGTTGAAGAA-3')와 URA3-R (5'-TGTGAGTTTAGTATACATGCA-3') 두 PCR 증폭에 대 한 고 800 bp URA3 유전자;의 시퀀싱 CAN1 F (5'-CTTCTACTCCGTCTGCTTTC-3')와 CAN1 R (5'-CAGAGTTCTTCAGACTTC-3') 증폭 및 CAN1 아칸소 (5'-TGAAATGTGAAGGCAGCGTT-3'), CAN1 9R (5'-CCTGCAACACCAGTGATA-3'), CAN1 10R (5'-GAGGATGTAACAGGGATGAAT-3')와 CAN1 BR ( 5'-CGGTGTATGACTTATGAGGG-3') 1800 bp CAN1 취재 원 유전자의 시퀀싱에 대 한.
- 식민지 PCR을 수행 하려면 resuspend H2O의 5 μ에서 단일 식민지 하 고 템플릿으로 1 μ를 사용 합니다. 뇌관 (5 μ M 주식), 5 x KAPA2G 버퍼 (Mg2 + 플러스)의 2 μ의 각각의 1 μ, dNTP (2.5 m m)의 0.5 μ, 0.5 μ의 KAPA2G 빠른 DNA 중 합 효소, 12 μ H2o.의 추가
- URA3 유전자의 증폭에 대 한 다음 PCR 프로그램 실행: 95 ° C 5 분; 10 95 ° C의 5 주기 s, 61 ° C 15에 대 한 s, 72 ° C 30에 대 한 s; 10 95 ° C의 35 주기 s, 61 ° C 15에 대 한 s, 72 ° C 30에 대 한 s; 72 ° C 2 분 및 4 ° c.에서 개최 CAN1 유전자의 증폭에 대 한 다음 PCR 프로그램 실행: 95 ° C 5 분; 10 95 ° C의 5 주기 s, 61 ° C 15에 대 한 s, 45 72 ° C s; 10 95 ° C의 35 주기 s, 61 ° C 15에 대 한 s, 45 72 ° C s; 72 ° C 2 분 및 4 ° c.에서 개최
- 시퀀싱 결과 돌연변이 식별 하기 위해 DNASTAR Seqman 프로 또는 Sequencher 같은 프로그램을 사용 하 여 참조 시퀀스를 정렬 합니다.
- (그림 4) 돌연변이 유형 또는 돌연변이 위치 (그림 5) 변이 데이터를 컴파일하십시오. (관찰 하는 이벤트 수는 시퀀싱 하는 돌연변이의 수로 나눈) 돌연변이의 주파수에 의해 특정 돌연변이 속도 전체 돌연변이 율을 곱한 계산 합니다.
결과
치료 알칼리 알칼리 젤 전기 이동 법 뒤 genomic DNA의 안정적으로 통합된 ribonucleotides의 풍부 때문에 DNA 파편의 반 정량적 검출 할 수 있습니다. 그림 2 는 효 모의 게놈 DNA 치료 또는 코5없이 젤 이미지를 보여준다. Pol2, Polε의 촉매 소 단위의 M644L 변종 M644G 돌연변이 WT 중 합 효소 보다 더 ribonucleotides를 통합 하는 동안 ribonucleotides를 통합 하는 능력을 감소 했다. 에 설명된대로 프로토콜, 알칼리 젤 더 스트랜드 특정 남쪽 오 점 분석에 의해 조사 될 수 있습니다. 인접 한 기원 상대적인 시험된 게놈 사이트의 위치에의 지식, 우리 ribonucleotides는 초기에 통합을 프로브 수 있습니다 선택적으로 선행 또는 후행 가닥. 그림 3 초기 발사 복제 원점, ARS30616가까이 두 반대 방향에서 삽입 URA3 취재 원 유전자를 조사 하는 남쪽 오 점 결과 보여 줍니다. 선도 가닥 전용 프로브를 사용 하 여 우리가 알칼리-분열 초기 선도 가닥 DNA WT 긴장 및 긴장에 대 한 무차별은 polymerases α, δ, ε의 변종 표현에 ribonucleotides에 기인한 다 DNA 조각 패턴 관찰 ribonucleotide 설립입니다.
변동 실험에 사용 하 여, 우리 리포터 유전자를 포함 하는 효 모 종자의 변이 속도 측정할 수 있습니다. 그림 4 는 우 라3 WT 중 합 효소 기능 RNase h 2의 유무에 관계 없이 pol2 M644G 돌연변이 표현 하는 긴장의 CAN1 loci에서 돌연변이 비율. RNase h 2의 부족 모두 배경에서 전체 돌연변이 비율에 있는 온건한 증가 발생합니다. 그러나, 돌연변이 특이성의 가까이 시험 긴장 부족 RNase h 2 보여준다 (그림 5), 특히 탠덤 반복 시퀀스에서에서 짧은 삭제에 대 한 돌연변이 비율에 있는 강한 증가. WT 및 rnh201Δ 긴장에 돌연변이 특이성 비교 그림 5A와 그림 5B 폴에 의해 초기 선도 DNA 가닥으로 더 높은 ribonucleotide 정관의 mutational 효과 표시 ε.
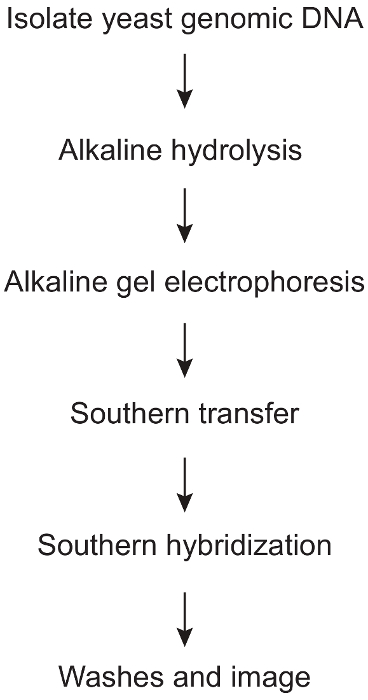
그림 1: 단계 ribonucleotide 법인 효 모 게놈 DNA에 의해 발생 하는 알칼리에 민감한 사이트의 물가 관련 검색을 프로토콜. 이 절차, 효 모 게놈 DNA 격리로 시작 하 고 마지막 남쪽 오 점 분석을 통해 진행에 관련 된 다양 한 주요 단계의 개요입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2: 알칼리 agarose 젤 전기 이동 법에 의해 얻은 결과의 대표 이미지. 이 그림에서 닉 McElhinny, S. A. 외 적응 되었습니다. 5. 다른 genotypes의 긴장에서 효 모 게놈 DNA KCl (중립) 또는 코 (알칼리 성) 처리 했다 중립 또는 알칼리 agarose 젤에 그 때 분리 하 고. 폴 포트의 상태를 표시 하는 "WT"와 "M644G" ε. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3: 스트랜드 특정 남쪽 오 점 하 여 알칼리 agarose 젤의 프로 빙. 이 그림에서 적응 되었습니다 윌리엄스, J. S. 외. 13. (A) 방사선된 조사 anneal ARS306 가까운 두 반대 방향 (OR1, OR2)에 삽입 된 URA3 취재 원 유전자 내에서 초기 선도 DNA 물가에. (B) 초기 선도 가닥 전용 프로브를 사용 하 여 남부 럽의 대표적인 결과. 변종 또는 RNase h 2 없이 WT DNA polymerases, pol1 L868M, pol2 M644G 또는 pol3 L612M 스트레인에 초기 선도 가닥에 대 한 검색 결과 표시 됩니다. POL1, POL2, 및 POL3 유전자 각각 Pols α, δ, ε의 촉매 소 단위를 인코딩합니다. 이체는 더 ribonucleotide 법인5,,1217에 대 한 무차별. (C) (B)에서 각 차선에 총의 의해 방사성 신호의 정량화. 값 합계의 백분율로 표현 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4: 효 모 종자에 자발적인 돌연변이 요금. 이 그림에서 닉 McElhinny, S. A. 외 적응 되었습니다. 5. URA3 와 CAN1 리포터 유전자 표시 된 긴장의 변이 속도 측정 하 앞으로 돌연변이 시험에서 사용 되었다. URA3 기자는 "방향 2" (OR2, 그림 3A). 95% 신뢰 구간 (CI) 각 측정에 대 한 포함 되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 5: URA3 OR2 취재 원 유전자에 대 한 돌연변이 스펙트럼. 이 그림은 이전 간행물5,18,,1920에서 적응 되었습니다. 앞으로 돌연변이 분석 결과에서 선택한 각 독립 5 FOA 저항 식민지에서 관찰 하는 돌연변이 형식과 위치는 804에서 묘사 된다 bp URA3 코딩 시퀀스. 문자 자료를 나타냅니다 대체, 오픈 삼각형 단일 기본 삭제 표시 하 고 닫힌된 삼각형 표시 단일 기본 삽입 하 고 실선 표시 짧은 삭제. (A) 돌연변이 스펙트럼 WT 및 rnh201Δ 변종에. 시퀀스 위에 빨간 레이블은 돌연변이 시퀀스 아래 블루 라벨 rnh201Δ 긴장에서 관찰은 WT에 관찰 됩니다. (B) pol2 M644G 와 pol2-M644G rnh201Δ 긴장에 돌연변이 스펙트럼. 시퀀스 위에 빨간 상표는 pol2-M644G pol2-M644G rnh201Δ 변종에 대 한 시퀀스 아래 파란색 하는 동안에 관찰 하는 돌연변이. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
여기, 우리는 ribonucleotides 동안에 DNA 복제 및 배달된 ribonucleotides의 변이 원 성 영향 통합 반 정량적 분석에 자주 사용 되는 실험의 두 집합에 대 한 프로토콜을 설명 합니다. 비록 이러한 접근 모델 진핵생물 S. cerevisiae를 포함, 이러한 기술은 다른 미생물과 더 높은 진핵생물에 쉽게 적응 될 수 있다.
남부 럽과 함께 agarose 알칼리 성 전기 이동 법을 사용 하 여 DNA에 배달된 ribonucleotides에 대 한 현재 ribonucleotides의 수는 그들이 통합 되어 물가 관한 중요 한 정보를 제공 합니다. 그러나, 그것은 중요 그 알칼리 감도 다른 DNA 병 변, abasic 사이트에 의해 발생할 수 있습니다. DNA에 ribonucleotides를 감지의 다른 수단은 순화 RNase h 2 효소 처리에 의해 포유류 세포21에 완료 되었습니다. 우리의 접근 방식은 우리의 mutational 분석 실험에 사용 된 URA3 취재 원 유전자에 물가 보 온 재 대 초기 선도에 알칼리에 민감한 사이트에 대 한 포함, 하지만 순서로 다른 위치에서 anneal 프로브 디자인 수는 다른 게놈 사이트에서 ribonucleotide 밀도 관한 중요 한 정보를 얻을. 절차의 남쪽 오 점 부분 또한 다른 일반적인 DNA 검색 실험에 대 한 참조로 사용할 수 있습니다.
돌연변이 율 변동 테스트를 사용 하 여 측정 미생물에 다양 한 돌연변이 이벤트의 분석을 위해 널리 이용 되는 고 따라서 DNA에 ribonucleotides의 돌연변이 결과의 분석에 국한 되지 않습니다. 이 실험에 대 한 독립적인 문화 수 측정의 정확도 크게 강화할 수 있습니다. 독립적인 식민지 독립 포자 식민지 2 중 효 모 얼룩의 tetrad 절 개 하 여 얻은 분석 하거나 YPDA 매체에 대 한 관심의 부담을 줄이 여에 얻어질 수 있다. 이상적으로, 여러 개의 독립적인 단일 효 모 종자의 사용 (예., tetrad 절 개에서)은 스트레인 스트레인 변화의 영향을 최소화 하는 것이 좋습니다. 이것은 특히 중요 한 자발적인 돌연변이 속도가 높은 때 또는 때 긴장은 성장 결함입니다. 자발적인 측정에 사용할 수 있는 추가 메서드 돌연변이 속도가 돌연변이 축적 실험22입니다. 이 분석에서 돌연변이 주파수는 광범위 한 성장 후 셀에 대 한 결정 되 고 돌연변이 비율 계산을 사용할 수 있습니다. 깊은 시퀀싱 기술을 돌연변이 축적 실험의 커플링 게놈에서 돌연변이 속도 특이성을 분석 하는 강력한 도구가 될 수 입증 되었습니다.
공개
저자는 공개 없다.
감사의 말
우리는 그들의 작품에 대 한 모든 현재 및 이전 Kunkel 연구소 회원 감사 토론 프로토콜에 관련 된 하 고 여기에 제공 된 데이터를 다시. 이 작품은 국립 보건원 (NIH), 국립 환경 보건 과학 연구소 (NIEHS)의 교내 연구 부문에서에서 T.A.K.를 프로젝트 Z01 ES065070에 의해 지원 되었다.
자료
| Name | Company | Catalog Number | Comments |
| YPD media | 20 g dextrose, 20 g peptone, 10g yeast extract, in deionized H2O up to 1 L, add 20 g Bacto agar for solid media, autoclave. | ||
| COM plates | 1.3 g SC dropout mix, 1.7 g yeast nitrogen base without amino acids or (NH4)2SO4, 5 g (NH4)2SO4, 20 g dextrose, 20 g Bacto agar deionized H2O up to 1 L. Adjust pH to 5.8. Autoclave and 30 – 35 ml per plate. | ||
| CAN plates | 1.3 g SC-Ura dropout powder, 1.7 g yeast nitrogen base without amino acids or (NH4)2SO4, 5 g (NH4)2SO4, 20 g dextrose, 20 g Bacto agar, 25 mg uracil and H2O up to 1 L. Autoclave for 15 mins at 121 °C and cool down to 56 °C. Add 6 mL of filter-sterilized 1% canavanine sulfate solution. | ||
| 5-FOA plates | 1.3 g SC-Ura dropout powder, 1.7 g yeast nitrogen base without amino acids or (NH4)2SO4, 5 g (NH4)2SO4, 20 g dextrose, 20 g Bacto agar, 25 mg uracil and H2O up to 800 mL. Autoclave for 15 mins at 121 °C and cool down to 60 °C. Add 200 mL of filter-sterilized 0.5% 5-FOA solution. | ||
| L-Canavanine sulfate | US Biological | C1050 | |
| 5-FOA | US Biological | F5050 | |
| 20 mL glass culture tube | Any brand | ||
| Culture rotator in 30 °C incubator | Shaker incubator can be used instead | ||
| 96 well round bottom plates | Sterile, any brand | ||
| 3 mm glass beads | Fisher Scientific | 11-312A | Autoclave before use |
| 12-channel pipettes | Any brand | ||
| Ex Taq DNA Polymerase | TaKaRa | RR001 | |
| Epicentre MasterPure Yeast DNA Purification Kit | Epicenter | MPY80200 | |
| 3 M sodium acetate | Sigma-Aldrich | S7899 | |
| 100% ethanol | |||
| Qubit 2.0 Fluorometer | Invitrogen | Q32866 | Newer model available |
| dsDNA BR Assay kit | Invitrogen | Q32850 | |
| KOH | Sigma-Aldrich | 221473 | |
| EDTA | Sigma-Aldrich | E7889 | |
| Ficoll 400 | Dot Scientific Inc. | DSF10400 | |
| Bromocresol green | Eastman | 6356 | |
| Xylene cyanol FF | International Technologies Inc. | 72120 | |
| NaOH | Sigma-Aldrich | S8045 | |
| 1 M Tris-HCl (pH 8.0) | Teknova | T5080 | |
| SYBR Gold Nucleic Acid Gel Stain | Invitrogen | S11494 | |
| UV transilluminator | |||
| Amersham Nylon membrane Hybond-N+ | GE Healthcare | RPN303B | |
| 3 MM CHR Chromotography paper | Whatman | 3030-392 | |
| NaCl | Caledon | 7560-1 | |
| Stratalinker 1800 | Stratagene | ||
| QIAquick PCR Purification Kit | Qiagen | 28106 | |
| G-25 spin column | GE Healthcare | 27-5325-01 | |
| 1 M Sodium phosphate buffer (pH 7.2) | Sigma-Aldrich | NaH2PO4 (S9638); Na2HPO4 (S9390) | |
| SDS | Sigma-Aldrich | L4522 | |
| BSA | Sigma-Aldrich | A3059 | |
| Formamide | Sigma-Aldrich | 47671 | |
| Geiger counter |
참고문헌
- Joyce, C. M. Choosing the right sugar: how polymerases select a nucleotide substrate. Proceedings of the National Acaddemy of Sciences U S A. 94 (5), 1619-1622 (1997).
- Nick McElhinny, S. A., et al. Abundant ribonucleotide incorporation into DNA by yeast replicative polymerases. Proceedings of the National Acaddemy of Sciences U S A. 107 (11), 4949-4954 (2010).
- Sparks, J. L., et al. RNase H2-initiated ribonucleotide excision repair. Molecular Cell. 47 (6), 980-986 (2012).
- Li, Y., Breaker, R. R. Kinetics of RNA Degradation by Specific Base Catalysis of Transesterification Involving the 2'-Hydroxyl Group. Journal of the American Chemical Society. 121 (23), 5364-5372 (1999).
- Nick McElhinny, S. A., et al. Genome instability due to ribonucleotide incorporation into DNA. Nature Chemical Biology. 6 (10), 774-781 (2010).
- Williams, J. S., Kunkel, T. A. Ribonucleotides in DNA: origins, repair and consequences. DNA Repair (Amst). 19, 27-37 (2014).
- Williams, J. S., Lujan, S. A., Kunkel, T. A. Processing ribonucleotides incorporated during eukaryotic DNA replication. Nature Reviews Molecular Cell Biology. 17 (6), 350-363 (2016).
- Jones, M. E., Thomas, S. M., Rogers, A. Luria-Delbruck fluctuation experiments: design and analysis. Genetics. 136 (3), 1209-1216 (1994).
- Zheng, Q. A new practical guide to the Luria-Delbruck protocol. Mutat Research. 781, 7-13 (2015).
- Sambrook, J. Molecular Cloning: a Laboratory Manual. , Cold Spring Harbor Laboratory Press. (2001).
- Miyabe, I., Kunkel, T. A., Carr, A. M. The major roles of DNA polymerases epsilon and delta at the eukaryotic replication fork are evolutionarily conserved. PLoS Genetics. 7 (12), e1002407(2011).
- Lujan, S. A., Williams, J. S., Clausen, A. R., Clark, A. B., Kunkel, T. A. Ribonucleotides are signals for mismatch repair of leading-strand replication errors. Molecular Cell. 50 (3), 437-443 (2013).
- Williams, J. S., et al. Topoisomerase 1-mediated removal of ribonucleotides from nascent leading-strand DNA. Molecular Cell. 49 (5), 1010-1015 (2013).
- Clausen, A. R., et al. Tracking replication enzymology in vivo by genome-wide mapping of ribonucleotide incorporation. Nature Structural & Molecular Biology. 22 (3), 185-191 (2015).
- Foster, P. L. Methods for determining spontaneous mutation rates. Methods Enzymology. 409, 195-213 (2006).
- Williams, J. S., et al. Evidence that processing of ribonucleotides in DNA by topoisomerase 1 is leading-strand specific. Nature Structural & Molecular Biology. 22 (4), 291-297 (2015).
- Pavlov, Y. I., Shcherbakova, P. V., Kunkel, T. A. In vivo consequences of putative active site mutations in yeast DNA polymerases alpha, epsilon, delta, and zeta. Genetics. 159 (1), 47-64 (2001).
- Nick McElhinny, S. A., Kissling, G. E., Kunkel, T. A. Differential correction of lagging-strand replication errors made by DNA polymerases {alpha} and {delta}. Proceedings of the National Acaddemy of Sciences U S A. 107 (49), 21070-21075 (2010).
- Clark, A. B., Lujan, S. A., Kissling, G. E., Kunkel, T. A. Mismatch repair-independent tandem repeat sequence instability resulting from ribonucleotide incorporation by DNA polymerase epsilon. DNA Repair (Amst). 10 (5), 476-482 (2011).
- Lujan, S. A., et al. Mismatch repair balances leading and lagging strand DNA replication fidelity. PLoS Genetics. 8 (10), e1003016(2012).
- Reijns, M. A., et al. Enzymatic removal of ribonucleotides from DNA is essential for mammalian genome integrity and development. Cell. 149 (5), 1008-1022 (2012).
- Lujan, S. A., et al. Heterogeneous polymerase fidelity and mismatch repair bias genome variation and composition. Genome Research. 24 (11), 1751-1764 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유