Method Article
말라와 자극된 방출 소모 (호텔 위치) 현미경을 사용 하 여 B 세포 면역 냅에 Microtubule Cytoskeletons 시각화
요약
Coverslips B 세포 수용 체에 항 체, 초기 단계에 대 한 모델 코팅에 확산 하는 B 세포에서 동시에 이미지 걸 구조, microtubules, 및 microtubule 플러스-엔드 바인딩 단백질에 호텔 위치 현미경 검사 법을 사용 하기 위한 프로토콜 소개 면역 시 냅 스 형성.
초록
막 도약 항 원 (예, 항 원 제시 세포의 표면에)에 바인딩되는 B 세포 면역 시 냅 스, B 세포 수용 체 (BCR) 신호 최적화 전문된 세포 구조 및 BCR 중재 항 원 수집을 형성 한다. 모두 말라 골격 및 항 원 연락처 사이트 향해 microtubule 네트워크의 재교육의 개장 면역 시 냅 스 형성에 필수적입니다. F-말라의 조밀한 주변 반지로 걸 골격의 개장 면역 시 냅 스는 microtubule 조직 센터의 양극 화 현상이 동반 된다. 대뇌 피 질의 플러스-엔드 캡처 단백질 뿐만 아니라 microtubule 플러스-엔드 바인딩 단백질, 조정 방식으로 재구성 하는 말라와 microtubule cytoskeletons 간의 실제 상호 작용을 중재. 이러한 cytoskeletal 구조 이해 뿐만 아니라이 cytoskeletal 개편 모양 면역 시 냅 스 대형과 BCR 신호, 제어 B 세포 활성화에 새로운 통찰력을 제공할 수 있습니다 메커니즘 elucidating 이것은 cytoskeletal 네트워크의 새로운 세부 공개 슈퍼 해상도 현미경 방식의 개발에 의해 주 었 되었습니다. 여기 B 셀에 동시에 이미지 걸 구조, microtubules, transfected GFP 태그 microtubule 플러스-엔드 바인딩 단백질을 자극된 방출 소모 (호텔 위치) 현미경을 사용 하는 방법을 설명 합니다. 면역 시 냅 스 형성에서 초기 이벤트를, 우리는 반대로 면역 글로불린 (안티-Ig) 항 체, BCR 신호 및 골격 개장을 시작으로 coverslips에 B 세포 허용. 우리 A20 B-림프 종 세포에서 GFP 융해 단백질을 표현 하기 위한, 안티 Ig 유도 세포 확산 및 후속 셀 고정, Immunostaining, 이미지 수집 및 이미지 deconvolution 단계 단계별 프로토콜을 제공 합니다. 이 절차를 사용 하 여 얻은 고해상도 이미지 하나 동시에 말라 구조, microtubules, 및 이러한 두 개의 cytoskeletal 네트워크를 연결할 수 있습니다 microtubule 플러스-엔드 바인딩 단백질을 시각화 수 있습니다.
서문
B 세포 바인딩할 때 편광 항의 배열 (예, 항 원 제시의 표면에 표시 세포 (Apc)), 결과 B 세포 수용 체 (BCR) 신호 드라이브에 설명 된 처음 고전 면역 시 냅 스 구조 형성 T 세포1,2,3,,45,6,7,8,9,10, 11,,1213. 처음에, B 세포: APC의 주변에서 항 원 바인딩 BCRs 폼의 microclusters 사이트 문의. 이 microclusters는 다음 항 원 연락처 사이트, 그들은 면역 시 냅 스의 핵심을 형성 하는 중앙 supramolecular 활성화 클러스터 (cSMAC)으로 합체의 중심을 향해 이동 합니다. 면역 시 냅 스 형성 BCR 신호 최적화 하 고 APC 막14BCR 중재 항 원 추출 용이 하 게 한다. BCR 중재 항 원 국제화 및 후속 항 원 처리 뒤,이 항 원 인수, 펩 티 드: MHC II 단지 T 세포 및 T 세포 도움14유도 B 세포 수 있습니다. 면역 시 냅 스 형성이 기능 패턴 수용 체 조직의 새로운 제공할 수 있는 설정 하는 메커니즘을 elucidating B 세포 활성화를 촉진 하기 때문에 어떻게 체액 면역 반응에 시작 하 고 통제.
말라와 microtubule cytoskeletons의 개편은 면역 시 냅 스 형성에 필수적입니다. 지역화 된 BCR 공간 편광 항 배열에 의해 자극 신호 급속 하 고 극적인 걸 골격1,15의 리 모델링을 유도 합니다. B 세포의 주변에서 수지상 말라 구조의 형성 원형질 막에 추진 세력을 미치는 및 B 세포 확산을 촉진. 이 B 세포 항 원-베어링 표면의 큰 영역을 스캔을 허용 하 고는 항 원 바인딩 및 활성화 경로 신호 BCR BCRs의 수를 증가. 같은 시간에는 MTOC 및 microtubule 네트워크 항 원 접촉의 사이트 쪽으로 방향도 있습니다. MTOC 항 원 연락처 사이트 접근, B 세포 및 항 원-베어링 표면16,17사이의 인터페이스에서 원형질 막의 내부 얼굴 따라는 MTOC에서 유출 하는 microtubules 확장. 이러한 juxtamembrane microtubules 다음 항 원 바인딩 BCR microclusters18, 선도 cSMAC의 대형에 다 중재 구심 운동에 대 한 트랙으로 작동할 수 있습니다.
재교육 및 면역 시 냅 스를 향해 MTOC의 분극 그대로 말라와 microtubule cytoskeletons를 요구 하 고 종종 피 질 말라 네트워크 및 microtubules16,17, 사이 상호 작용에 따라 달라 집니다. 19,20. IQGAP1, 같은 대뇌 피 질의 말라-바인딩 단백질21microtubule 플러스 끝 장식 하는 단백질 복합물 상호 작용에 의해 microtubules를 캡처할 수 있습니다. 플러스-엔드 바인딩 단백질의이 동적 단지 등이 EB1 클립-170, microtubule로 플러스-엔드 단백질 (+ 팁) 추적21,22이라고 통칭 되는 있습니다. + 팁 microtubules의 끝에는 원형질 막 또는 피 질 말라 골격에 연관 된 단백질에 바인딩할 수 있습니다. 힘 생성 메커니즘 수 있습니다 (예를 들어, 빼기-엔드 감독 microtubules 따라 cortically 고정 다의 움직임) microtubules에 당기 힘을 발휘 하는 MTOC 함으로써 위치. 클립-170 말라 관련 비 계 단백질 IQGAP123, 바인딩할 수 있는 그리고 우리가 이러한 단백질의 모두 면역 시 냅 스17향해 MTOC BCR 유도 분극에 필요한 것으로 나타났습니다. 이 IQGAP1-클립-170 상호 작용 B 세포 면역 시 냅 스에 microtubule 네트워크의 재배치로 말라 골격의 개장 조정에 중요 한 역할을 재생할 수 있습니다.
기존의 형광 현미경 검사 법 B 세포 면역 시 냅 스 형성2동안 말라와 microtubule cytoskeletons의 극적인 개편을 발표 했다. 그러나,이 방법은 자세히는, Abbe의 법, 샘플 및 객관적인24의 조리개를 밝게 하는 데 사용 하는 빛의 파장에 따라 빛의 회절 한계 때문에 작은 세포 구조를 해결할 수 없습니다. 이 회절 제한 200-300 nm 측면 방향에서 및 축 방향25에서 500-700 nm에 기존의 가벼운 현미경의 해상도 제한합니다. 따라서, 말라와 microtubule cytoskeletons의 정밀한 세부 사항 뿐 아니라 작은 subcellular 구조만 관찰 될 수 있었다 전자 현미경을 사용 하 여. 골격의 전자 현미경 영상 시간이 소요, 가혹한 샘플 고정 및 준비 프로토콜 생물학 구조를 변경할 수 있습니다 하 고 중재 하는 항 체 탐지에 제한 됩니다 필요 합니다. Immunostain 하 고 동시에 이미지 여러 단백질 또는 세포질 구조는 형광 현미경 검사 법의 상당한 장점. 또한, 실시간 이미징 수 있도록 셀에 형광 성 융해 단백질을 표현 그리고 immunostaining 관심사의 단백질에 대 한 효과적인 항 체 사용할 수 없을 때 유용.
슈퍼 해상도 현미경에 최근의 기술 진보 빛의 회절 한계를 극복 하 고 나노 세포 구조24의 시각화를 허용. 같은 1 개의 슈퍼 해상도 현미경 검사 법 기술은 자극된 방출 소모 (호텔 위치) 현미경을 이라고 합니다. 호텔 위치는 두 레이저, 어디 한 레이저 fluorophore는 흥분 하 고 도넛 모양의 패턴으로 두 번째 레이저는 선택적으로 주위에 fluorophore 형광 방출 억제를 사용 합니다. 이 단 하나 형광 입자의 포인트 확산 기능 (명백한 지역)을 감소 하 고 하위 회절 제한 형광 이미지25,26를 제공 한다. 바닥 상태 고갈 현미경 또한 슈퍼 해상도 이미지 형광 기반 기술을 사용 합니다. 그러나, 이미지 수집 및 재구성 시간 긴, 거기만 제한 된 수의 사용할 수 있는 fluorophores 고 여러 cytoskeletal 컴포넌트의 동시 고해상도 이미징은 유지 하기 때문에 기술적으로 도전 말라와 microtubule 구조는 다른 고정 절차를 요구 한다. 따라서, 호텔 위치는 전자 현미경에 비해 여러 장점 및 다른 슈퍼 해상도 현미경에 그로 제공 하는 빠른 이미지 수집, 최소한의 후 처리 요구 사항, 같은 fluorophores 및 얼룩 기법을 사용 하 여 접근 그 고정된 샘플26의 전통적인 형광 현미경 검사 법 사용 됩니다.
슈퍼 해상도 현미경 지금 자연적인 살인자 (NK) 세포 및 T 세포26,,2728,29,30, 면역 시 냅 스에서 말라 구조를 시각화 하는 데 사용 되었습니다. 그러나 31., microtubule 골격의 슈퍼 해상도 영상 뿐만 아니라 면역 시 냅 스 형성, 동안 말라와 microtubule cytoskeletons의 조정된 개편 최근 되었습니다 보고17. 우리는 coverslips (안티-Ig) 반대로 면역 글로불린 항 체, BCR 신호 자극 하 고 골격 개편을 시작으로 허용 했다 이미지 B 셀에 호텔 위치 현미경을 사용 합니다. 고정된 안티-Ig 항 체에 도금 할 때 B 세포 받을 극적인 걸 종속 확산, 어떤 면역 시 냅 스 형성 동안 초기 이벤트를이. 중요 한 것은, 호텔 위치 현미경 검사 법 공개 하는 면역의 주변에 양식 냅 뿐만 아니라 그것에 연결 하는 microtubules MTOC, 항 원 연락처 사이트17가까이 이동 했다 보여주었다 F 걸의 수지상 링의 세밀. 이러한 microtubules F 걸의 주변 링 쪽으로 밖으로 확장. 또한, F 걸, tubulin, IQGAP1, 그리고 GFP 태그 클립-170 + 팁의 다양 한 조합의 멀티 컬러 호텔 위치 이미징 나타났다는 microtubule 플러스-끝 클립-170-GFP에 의해 표시 주변 말라 채널와 IQGAP1, 밀접 하 게 관련 된 대뇌 피 질의 캡처 단백질17.
여기, 우리는 호텔 위치 현미경을 사용 하 여 면역 시 냅 스에서 말라와 microtubule cytoskeletons 이미징에 대 한 상세한 프로토콜을 제시. 이러한 방법은 널리 BCR 신호 및 면역 시 냅 스 형성17,,3233,,3435 공부에 대 한 고용 된 A20 murine B 세포 라인을 사용 하 여 최적화 된 , 36 , 37 , 38 , 39. 클립-170에 상업 항 체 이전 실험에서 immunostaining를 위해 잘 작동 하지 않았다, 왜냐하면 우리가 자세하게에서 설명 GFP 태그 클립-170까지 동시에 시각화에 대 한 프로토콜을 얼룩이 지 함께 A20 셀에서의 표현 3 cytoskeletal 구성 요소 또는 골격 관련 단백질입니다. NK 세포 면역 시 냅 스에서 이미지 걸을 호텔 위치 현미경을 사용 하는 방법 되었습니다40위에서 설명한. 여기, 우리는 B 세포에서 말라와 microtubule cytoskeletons의 멀티 컬러 슈퍼 해상도 이미지 획득을이 확장.
슈퍼 해상도 현미경에 대 한 중요 한 고려 세포 구조를 유지 하 고 형광 단백질에 손상을 방지에 대 한 적절 한 고정 절차를 사용 하는. 고정 하 고 여기에 소개 하는 방법 얼룩 GFP 형광을 유지 하 고 말라와 microtubule 네트워크의 고해상도 이미지 제공에 최적화 되었습니다. 형광 단백질을 표현 하는 때 B 세포는 보통 transfect 어렵다 주목 해야한다. 이 프로토콜, 20-50%를 사용 하 여 A20의 세포는 일반적으로 transfected GFP 융해 단백질 표현 되며이 인구 중 단백질 표정 수준 변수. 그럼에도 불구 하 고, 말라와 우리 설명 하는 절차를 사용 하 여 microtubules의 슈퍼 해상도 이미징 매우 강력한 이며 높은 품질 이미지 쉽게 얻을 수 있습니다. A20 셀 기준으로 그들의 작은 크기에도 불구 하 고 우리는 이러한 절차 또한 microtubule 네트워크 짧게 lipopolysaccharide (LPS)와 활성화 된 기본 B 셀에 이미지를 사용할 수 있습니다 보여줍니다. 우리가 (즉, 같은 단백질 소모 immunoblotting에 의해 검출 될 수 있다), 상대적으로 높은 효율에서 siRNAs와 LPS 활성화 기본 B 세포를 페 수 것으로 나타났습니다 일부 연구에 대 한 B 세포의 사용에 대 한 좋은 대안 들을 만들고 17.
프로토콜
모든 동물 절차는 브리티시 컬럼비아 동물 관리 위원회의 대학에 의해 승인 되었다.
1. A20 B-림프 종 세포에서 GFP 융해 단백질을 표현
- 문화 A20 셀 5 조직 문화 인큐베이터에서 37 ° C에서 RPMI 매체 (RPMI-1640와 10% 열 비활성화 태아 둔감 한 혈 청 (FBS), 50 µ M 2-mercaptoethanol, 글루타민 2 mM, 1 mM pyruvate, 50 U/mL 페니실린, 50 µ g/mL 스 보충) 완료 % CO2.
- Transfection 시 약 준비 ( 재료의 표참조) 제조업체의 지침에 따라.
참고:이 프로토콜 특정 시 약에 대 한 최적화 된 및 transfection 프로토콜에서 설명 자료 테이블. 우리는 시도 하는 다른 transfection 시 약 충분 한 transfection 효율 굴복 하지는. - hemocytometer를 사용 하 여 셀을 계산 합니다. 분리기 2.5 x 106 A20 셀 (각 transfection) 525 x g.에서 5 분 동안 Resuspend transfection 시 약 포함 하는 플라스 미드 DNA의 1-2.5 µ g의 100 µ L에 셀. DNA 클립-170-GFP23인코딩, transfection 당 2.5 µ g 사용 하 여. 부드럽게 혼합.
- 6 잘 플레이트의 셀 전송 고 미리 예 열 완료 RPMI 매체 2 mL를 볼륨을 조정 합니다. 단백질 표정 있도록 37 ° C에 18 h에 대 한 셀을 문화.
2. 기본 마우스 B 세포를 분리 하 고 LPS로 활성화
- 멸 균된 수술 도구를 사용 하 여 프로토콜 기관의 동물 관리 위원회에 의해 승인에 따라, 마우스에서 비장을 제거.
- 조직 문화 후드에서 실내 온도 살 균 PBS의 3 mL를 포함 하는 35 m m 조직 문화 접시에 멸 균 70 µ m 셀 여과기를 놓습니다. 5 ml 주사기에서 플런저의 고무 부분을 사용 하 여 셀 스 트레이너를 통해 비장 호감.
- 피펫으로 멸 균 15 mL 튜브와 5 분 525 x g에서 원심 분리기로 splenoctyes의 단일 세포 현 탁 액.
- 마그네틱 비드 기반 B 세포 격리 키트 ( 재료의 표참조) B 세포의 매우 풍부한 인구를 사용 합니다.
- B 세포 2.5 µ g/mL LPS 플러스 5 ng/mL B 세포 활성화 요인 (BAFF, 생존 cytokine) 보완 하는 완전 한 RPMI 매체에 3 x 106/mL resuspend
- 37 ° c.에 6 시간에 대 한 셀 문화
3. 코팅 유리 Coverslips 안티 Ig 항 체와
- 코팅은 coverslips 항 체 솔루션을 준비 합니다. 12.5 µ g/mL 솔루션; 실 온 살 균 PBS에 염소 반대로 마우스 Ig 항 체의 재고 솔루션을 희석 항 체 해결책의 400 µ L가 각 coverslip 필요 합니다.
참고: 사용 하 여 염소 반대로 마우스 IgG A20 셀; 염소 반대로 마우스 IgM를 사용 하 여 기본 B 세포에 대 한. 염소 IgG 항 체 할 하지 바인딩할 잘 마우스 Fc 수용 체. 그러나, 어떤 잠재적인 Fc 수용 체 바인딩을 피하기 위해, 하나 반대로 마우스 IgG의 F(ab) 또는 F(ab')2 조각 또는 반대로 마우스 IgM 항 체를 사용할 수 있습니다. - 100% 메탄올에서 #1.5 18 m m 둥근 유리 coverslip 찍어 하 고 완전히 말리 (~ 10 분).
- 집게를 사용 하 여 넣으십시오 말린된 coverslip는 12 음 조직 문화 접시와 피펫으로 400 µ L는 coverslip에 12.5 µ g/mL 항 체 솔루션 (5 µ g 총, 2 µ g/c m2)의 coverslip의 중심에 거품을 형성 하 고 가장자리에 확산 되도록.
- 커버 전체 coverslip 조심 하지만 항 체 솔루션 조직 문화 플라스틱에 유리 coverslip 가장자리 확장을 허용 하지 마십시오. 30 분 동안 실 온에서 품 어.
- 솔루션에 밖으로 잘 그리고 연속적으로 발음으로 coverslips pipetting 1 mL의 멸 균 PBS에 의해 세척. 언바운드 항 체를 제거를 두 번 더 반복 합니다.
- 잘 포함 된 항 체-코팅 coverslip 셀 추가 될 준비가 될 때까지 무 균 PBS의 1 mL를 추가 합니다.
참고: 있는 coverslips 덮여 PBS, 같은 날에 사용 하기 위해 상 온에서 보관할 수 있습니다.
4. B 셀 안티 Ig 코팅 Coverslips에 확산
- 준비 HEPES 버퍼링 수정 염 분 (mHBS): 25mm HEPES, pH 7.2, 125 mM NaCl, KCl, 1mm CaCl25mm, 1mm 나2HPO4, 0.5 m m MgSO4, 1 mg/mL 포도 당, 2 mM 글루타민, 1mm 나트륨 pyruvate 그리고 50 µ M 2-mercaptoethanol). 필터가이 솔루션 소독 및 4 ° c.에 저장
- 실험 당일 확인 2% mHBS 50 mL 50 mL mHBS에 열 비활성화 FBS의 1 mL을 추가 하 여 FBS (mHBS FBS). 사용 하기 전에 37 ° C에 mHBS FBS 따뜻한.
- 원심 transfected A20 셀 또는 5 분 525 x g에 BAFF 플러스 LPS 경작 했다 기본 B 세포.
- Resuspend mHBS FBS의 1 mL에 셀, hemocytometer를 사용 하 여 셀 그리고 2 x 105 셀/ml mHBS FBS에 셀을 희석.
- 집게를 사용 하 여 조직 배양 접시에서 파라핀 영화의 조각에는 coverslip 전송.
- 각 coverslip에 B 세포 (5 x 104 의 세포)의 250 µ L를 추가 합니다.
- 안티 IgG-입히는 표면에 걸쳐 B 세포 수 있도록 어둠 속에서 15 분 동안 37 ° C에서 coverslips를 품 어.
5. 고정 및 Immunostaining 셀
- 16 %paraformaldehyde 재고 솔루션을 diluting 하 여 고정 솔루션 및 3 %paraformaldehyde 및 0.1% 글의 최종 농도를 실 온 소 주 물에 50%도 재고 솔루션을 준비 합니다. 사용 하 고 초과 삭제 하는 날에 고정 솔루션을 준비 합니다.
주의: paraformaldehyde도 재고 솔루션 화학 증기 두건만 사용 해야 합니다. 물질 안전 데이터 시트 (MSDS)에 지시를 따릅니다. - Permeabilization/차단 버퍼를 준비 (3 %BSA 0.1% 트라이 톤 X-100 희석 PBS에). 필터가이 솔루션 소독 및 4 ° c.에 저장 실험의 날, 따뜻한 실내 온도에 필요한 금액.
- (1% 및 0.1 %BSA 사포닌 PBS에) 얼룩 버퍼를 준비 합니다. 0.2 µ m 필터를 사용 하 여이 솔루션을 소독 및 4 ° c.에 저장 실험의 날, 따뜻한 실내 온도에 필요한 금액.
- 피펫으로 350 µ L 표면 완전히 덮여 보장 각 coverslip에 고정 솔루션의. 어둠 속에서 10 분 동안 실내 온도에 품 어.
- 신중 하 게는 micropipet를 사용 하 여 하는 coverslip의 가장자리에서 발음으로 coverslip에서 고정 솔루션을 제거 합니다.
주의: 고정 솔루션 유해 화학 폐기물로 폐기 해야한다. - Coverslips permeabilization/차단 버퍼의 500 µ L로 한 번 씻는 다. 피펫으로 액체에서.
- Permeabilize 고 각 coverslip를 permeabilization/차단 버퍼의 250 µ L을 추가 하 고 어둠 속에서 실 온에서 10 분 동안 배양 하 여 세포를 차단 합니다.
- 버퍼를 얼룩이 지기에서 토끼 방지 tubulin 항 체 1: 100 희석.
- Aspirate는 coverslips에서 permeabilization/차단 버퍼에서 고 각 coverslip 50 µ L 희석된 방지 tubulin 항 체 솔루션의 추가. 어둠 속에서 30 분 동안 실 온에서 품 어.
- 알 렉 사 Fluor 532 활용 된 염소-토끼 IgG 이차 항 체와 버퍼를 얼룩이 지기에서 phalloidin 알 렉 사 Fluor 568 활용 1: 100 희석 하 여 2 차 항 체/말라 얼룩이 솔루션을 준비 합니다.
- 버퍼를 얼룩이 지 고 다음 그것을 발음의 500 µ L을 추가 하 여 초과 1 차적인 항 체를 제거 하는 coverslips 3 번을 씻어.
- 각 coverslip을 이차 항 체/말라 얼룩 솔루션의 50 µ L을 추가 하 고 어둠 속에서 실 온에서 30 분 동안 품 어.
- 버퍼를 얼룩이 지 고 다음 그것을 발음의 500 µ L을 추가 하 여 초과 이차 항 체를 제거 하는 coverslips 3 번을 씻어.
- 현미경 슬라이드를 장착 시 약의 10 µ L를 추가 합니다. 아래 셀 쪽으로 현미경 슬라이드에 coverslip를 탑재 합니다.
참고: "반대로 페이드" 장착 매체 ( 재료의 표참조)이 좋습니다 GFP 융해 단백질의 형광 강도 유지 하기 위해. DAPI는 fluorophores의 이미징 호텔 위치 레이저를 사용 하 여 때을 방해할 수 있는 포함 된 시 약을 장착 하는 사용을 하지 않습니다. - 어둠 속에서 하룻밤 건조를 슬라이드 수 있습니다. 이미지 슬라이드 다음 날.
참고:는 coverslip 건조 자 마자 슬라이드 이미징이 좋습니다로 GFP 형광 시간이 지남에 저하 됩니다.
6. 호텔 위치 현미경을 사용 하 여 이미징
참고: 아래 설명 하는 모든 소프트웨어 단계는 현미경 및 소프트웨어 사용에 유의 하시기 바랍니다 ( 재료의 표참조). 단계 및 설정이 이미징 다른 현미경/소프트웨어를 사용 하 여 수행 되는 경우 조정 해야 합니다.
- 호텔 위치 현미경, 레이저 및 epifluorescence 조명 램프, 활성화 켜고 현미경 소프트웨어를 시작.
- 호텔 위치 고갈 레이저에 대 한 매개 변수를 설정 합니다.
참고:이 사용 되 고 특정 현미경에 장착 된 레이저 따라 달라 집니다. 권장 되는 일부 설정은 흰색 빛 (WLL) 70%; 592 nm 레이저 80%; 660 nm 레이저 80 %입니다. - 호텔 위치 설정을 활성화 하 고 호텔 위치 레이저 빔 100 X 목표를 사용 하 여 정렬.
- 접 안 렌즈를 사용 하 여 샘플을 집중 하 고 온건한 GFP 식 셀을 선택 합니다.
참고: 낮은 GFP 표현 하지 표시 됩니다 호텔 위치 방출 강도 줄일 수 있기 때문에. 반대로, 클립-170-GFP의 높은 식 일반 microtubule 플러스-엔드 단백질 복잡 한 형태와 분포 반영 하지 않는 큰 클러스터의 자연 형성을 유도 합니다. 온건한 GFP 식이 있는 셀을 선택 하면 정확 하 게 항 원 연락처 사이트에서 cytoskeletal 구조 이미징을 위한 필수적 이다. - 선택한 셀에 zoom 하 고 이미지 수를 관심 영역을 선택 합니다. B 세포는 coverslip 가장 가까운의 x y 평면 초점에는 초점을 조정 한다.
- 이렇게 하려면 이동 목표를 점차적으로 더 가까이 coverslip에 B 세포 cytoskeletal 구조와 초점으로 서 다음 초점 이동 합니다. 그런 다음 점차적으로 이동 목표 반대 방향으로 B 세포 cytoskeletal 구조 처음 초점으로 다시 올 때까지.
- 레이저 파워, 여기 빔 및 검출기 범위 설정을 최적화. 제조업체의 지침에서 권장 하는 설정으로 시작 합니다. 다음에 샘플에 대 한 신호를 최적화 하는 데 필요한 조정 확인 합니다. 동일한 설정으로 서로 비교 하기 모든 샘플 이미지.
- 소프트웨어의 "취득" 탭에서 "프레임" 사이의 옵션을 선택 하 여 사용 하단 왼쪽된 "순차 스캔" 패널에서 순차적 프레임 수집 이미지 수집을 설정 합니다.
- 수집 시퀀스를 설정 합니다.
참고: 인수 GFP 형광 먼저 GFP 신호 저하를 방지 하기 위해 합니다.
GFP 이외에 사용 되는 fluorophores의 조합에 따라 더 긴 파장 형광 신호를 이미징 먼저 얻을 수 있습니다 더 나은 결과. 그러나, 순서는 fluorophores 또는 형광 단백질 자극된 방출 소모를 받게 되며 몇 군데 강한 형광 신호 및 최고의 해상도를 최적화 합니다. - 및 호텔 위치 레이저 전원을 각 fluorophore는 소프트웨어의 "인식" 탭에 대 한 설정 선택한 592-nm 또는 660 nm 호텔 위치 레이저의 슬라이더 막대를 사용 하 여 레이저 파워를 조정 합니다. GFP와 알 렉 사 Fluor 532 592-nm 고갈 레이저에 대 한 파워를 조정 합니다. 알 렉 사 Fluor 568 660 nm 고갈 레이저에 대 한 파워를 조정 합니다.
- 해상도 증가 하 고 배경 신호 감소를 하는 소프트웨어의 "취득" 탭에서 "인수" 설정으로 이동, 선 또는 각 옵션에 대 한 드롭 다운 메뉴를 사용 하 여 1 보다 큰 값을 선택 하 여 평균 프레임 증가.
- 또한, fluorophore "취득" 탭 아래에 대 한 제어 옵션을 선택 하 고 시간 게이팅에 대 한 값을 지정 하 여 시간 문이 호텔 위치를 사용 하 여 형광 신호를 취득 (아래 참고 참조). 이 fluorophores의 photobleaching 증가 하지만 해상도 향상 시키기 위해 호텔 위치 레이저 파워를 증가.
참고: 제어 시간 현미경, 샘플 및 fluorophores 사용 되 고 최적화가 필요 합니다. 한 시간 게이팅의 0.3 ~ 6 ns는 것이 좋습니다. 고정, 후 GFP는 높은 레이저 전원에 특히 민감합니다. 적용 되어야 시간 게이팅 GFP의 photobleaching를 줄이기 위해, 그리고 호텔 위치 레이저 파워를 감소 한다. - 3D 호텔 위치 이미지를 캡처, 포인트를 변경 하려면 슬라이더를 사용 하 여 "3D 호텔 위치" 기능 (PSF) 확산.
- 수동으로 재현성을 보장 하기 위해 여러 개의 이미지를 취득 합니다. ( 그림 1참조) 이미지를 deconvolve deconvolution 소프트웨어를 사용 하 여 패키지41( 재료의 표참조).
결과
B 셀 고정된 안티-Ig에 확산, deconvolution 소프트웨어와 함께 사용 하는 호텔 위치 현미경 confocal 현미경 검사 법 보다 cytoskeletal 구조의 높은 해상도 이미지를 제공 합니다. 이것은 그림 1에서 분명 하다 어디 F 말라 네트워크 위에서 설명한 프로토콜을 사용 하 여 가시화 했다. 공초점 레이저의 비교 및 호텔 위치 슈퍼 해상도 같은 호텔 위치 이미지의 높은 해상도 보여주는 샘플 영상과 자세한 걸 골격 (그림 1)의 구조를 공개. 이 그림은 또한 그 deconvolution 고품질 호텔 위치 이미지는 걸 필 라 멘 트 더 명확 하 게 정의 얻기 위해 필수적입니다 보여줍니다. Deconvolution 공초점 이미지의 이미지의 해상도에 상당한 뛰어납니다, deconvolved 호텔 위치 이미지 deconvolved confocal 이미지 보다 자세한 구조 정보를 제공 합니다. 특히, 호텔 위치 현미경 검사 법 (그림 1 및 그림 2)에 의해 자세히 주변 F 걸 링의 돌기 구조가 드러났습니다. 항 문의 사이트에 microtubule 네트워크는 또한 샘플 준비를 사용 하 여 및 이미징 프로토콜 (그림 3) 위에서 설명한 몇 군데. Microtubules는 MTOC는 중앙 지점에서 발생 하 고 셀의 주변을 향해 바깥쪽으로 나 다. 이 실험에서 B 세포 확산 15 분 (그림 3), 시간 포인트 되는 MTOC 항 원 연락처 사이트17쪽으로 이동에 대 한 안티 Ig 코팅 coverslips에 허용 되었다. 클립-170-GFP 클러스터 microtubules의 더하기 끝을 표시 하는 그림 3과 같이 microtubules의 끝에서 볼 수 있습니다. 샘플 준비 및 호텔 위치 이미징 microtubule 네트워크의 최적, 지속적이 고 독특한 때 클립-170-GFP는 microtubules에 따라서 또는 더하기-끝 (그림 3A)에 지역화와 microtubules 관찰 된다. 항 체 또는 α-tubulin 항 체 이상 1 세를 제대로 해결 하는 불연속 섹션으로 나타나는 microtubules에 결과의 배치를 얼룩이 지기의 낮은 농도 사용 하 여 관찰 되었다 얼룩, 최적의 microtubule deconvolution 시 (그림 3B; 참고 그림 5C). 모든 이러한 이미지에 클립-170-GFP 형광은 α-tubulin-immunostained 구조와 관련, 하나 클립-170-GFP 플러스 끝 또는 불완전 한 얼룩 때문 microtubules의 길이 따라 위치 인지를 구별할 수 없다 microtubules의. 따라서 그것은 중요 한 α-tubulin 항 체 제조업체 권장 보관 조건 하 고 1 년 이내 사용 아래에 저장 됩니다.
이 프로토콜, 조직 및 말라 골격 및 microtubule 네트워크, 뿐만 아니라 이러한 두 cytoskeletons17, 연관 클립-170와 IQGAP1 단백질의 구조를 보여 주는 고품질 멀티 컬러 호텔 위치 이미지를 사용 하 여 취득 될 수 있었다. 그림 4 에 호텔 위치 이미지 수지상 말라 말라 얼룩은 훨씬 밀도 셀에 중앙 위치에서 쏘아 microtubules의 주변 링을 표시 합니다. 클립-170-GFP 이러한 microtubules의 끝에 주변 F 말라와 밀접 하 게 연결 됩니다. 이 프로토콜 하나 단색 호텔 위치 (그림 2) 이미징 또는 이미징 (그림 3 과 그림 4) 다 색 호텔 위치 중 하나를 사용 하 여 면역 시 냅 스에서 cytoskeletal 구조를 시각화 수 있습니다. 그러나, 그것은 단일 색상 호텔 위치 영상 (그림 2) 멀티 컬러 호텔 위치 (그림 4) 보다 말라 구조와 B 셀에 microtubules의 더 나은 해상도 얻을 수 있습니다 주목 해야한다. 이 photobleaching 다른 fluorophores에 대 한 순차적 호텔 위치 이미지 수집으로 인 한 원인일 수 있습니다. 최고의 슈퍼 해상도 이미지, fluorophores 및 형광 단백질을 선택의 조합으로 그들은 흥분 및 고갈 레이저를 사용 하 여 군데는 있는 시퀀스를 샘플에 대 한 최적화 되어야 합니다. 그럼에도 불구 하 고, 다 색 호텔 위치 이미징 전통적인 confocal 현미경 검사 법 보다 이러한 cytoskeletal 구조의 높은 해상도 이미지를 제공합니다. 또한, 전체 B 세포 말라 또는 microtubule 네트워크 (영화 1)의 3 차원 슈퍼 해상도 이미지 단색 호텔 위치를 사용할 수 있습니다.
형광 성 융해 단백질 transfected 세포를 사용 하 여 때 최적의 식 레벨을 달성 하 고 overexpression 인해 아티팩트를 피하 중요 한 고려 사항이 있습니다. 클립-170-GFP overexpressed입니다 셀에 클립-170-GFP의 큰 집계 형성 된다 (그림 5A). 클립-170-GFP의이 mislocalization 이외에이 셀에 microtubule 네트워크의 일부만 coverslip (그림 5B)에 가장 가까운 초점 비행기 내에서 했다. 이 클립-170 overexpression MTOC BCR 유도 분극 저하도 될 수 있습니다 제안 합니다. 반대로, 강한 형광 신호 취득 고품질 호텔 위치 이미지에 대 한 일반적으로 필요 하기 때문에, 클립-170-GFP (그림 5C) 같은 형광 성 융해 단백질의 낮은 식 품질 이미지 결과입니다. 따라서, 형광 단백질 페 된 셀을 사용할 때만 퓨전 단백질 식의 최적의 수준으로 셀을 이미지를 중요 하다. 그것은 또한 그 transfection 프로토콜 A20에 사용 된 세포 ( 재료의 표참조) 일반적으로 20-50%에서 transfected 단백질을 표현 하는 셀의 결과 주의 하는 것이 중요. 플라스 미드 DNA (반대로 siRNAs)에 대 한 기본 B 세포의 transfection 주파수 들은 종종 훨씬 A20 셀, B 세포의 사용을 필요로 대 한 보다 낮은. 그럼에도 불구 하 고, 높은 품질의 호텔 위치 이미지 untransfected 기본 B 세포에서 cytoskeletal 요소 (그림 6)이이 프로토콜을 사용 하 여 얻을 수 있습니다.
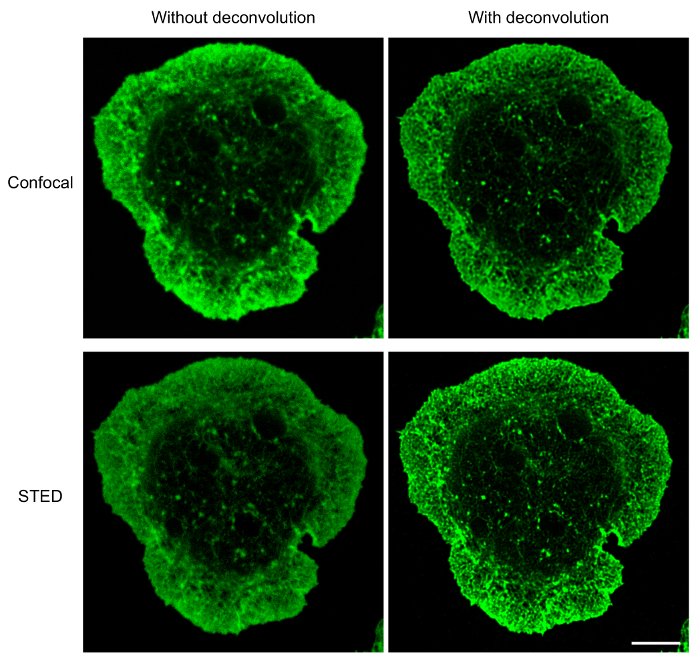
그림 1: 공초점 레이저의 비교 및 F-말라의 호텔 위치 이미징. 공초점 이미지 (위) 및 호텔 위치 이미지 (아래)의 알 렉 사 Fluor 532 활용 된 phalloidin으로 얼룩이 되 고 전에 15 분 동안 안티 IgG-입히는 coverslips에 확산 했다 A20 셀. 호텔 위치 confocal 현미경을 사용 하 여, 같은 셀은 몇 군데 먼저 confocal 현미경 검사 법에 의해 그리고 호텔 위치. 와 같은 confocal deconvolution 후 호텔 위치 이미지 confocal 초기와 호텔 위치 이미지 표시 됩니다. 눈금 막대: 5 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2: 항 원 연락처 사이트에서 말라 골격. 15 분에 대 한 안티 IgG-입히는 coverslips에 허용 했다 A20 셀 렉 형 석 568 활용 된 phalloidin로 얼룩진 고 호텔 위치 현미경 검사 법에 의해 몇 군데. 초기 호텔 위치 이미지 deconvolved 했다. 패널 A-B 및 C-E 패널 두 개의 서로 다른 셀의 대표 이미지를 표시합니다. 패널 전자 패널 C에서 흰색 상자에 영역의 3 X 확대를 보여줍니다. 눈금 막대 패널 A-D: 5 µ m. 눈금 막대 패널 E: 1 µ m입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
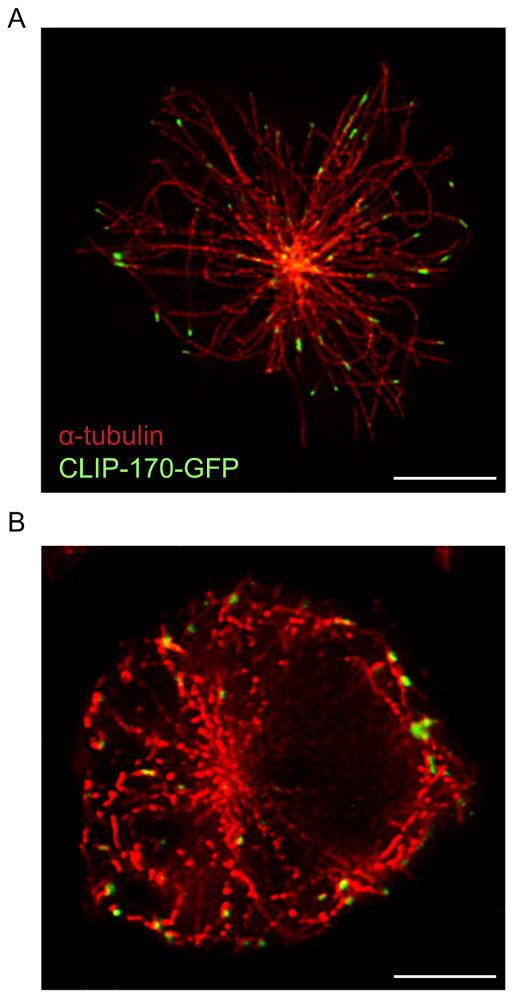
그림 3: microtubule 네트워크 및 클립-170-GFP의 호텔 위치 이미지. 클립-170-GFP를 표현 하는 A20 셀 고정 되 고 전에 15 분 동안 안티 IgG-입히는 coverslips와 immunostained 항 체를 α-tubulin 플러스 알 렉 사 Fluor 532 활용 된 이차 항 체에 허용 되었다. (A) 대표 이미지 클립-170-GFP microtubules의 플러스 끝에 주로 위치와 microtubule 네트워크의 immunostaining를 보여주는. (B) 최적의 얼룩 그리고 α-tubulin 항 체의 오래 된 재고의 사용으로 인해 microtubules의 해상도. 스케일 바: 5 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
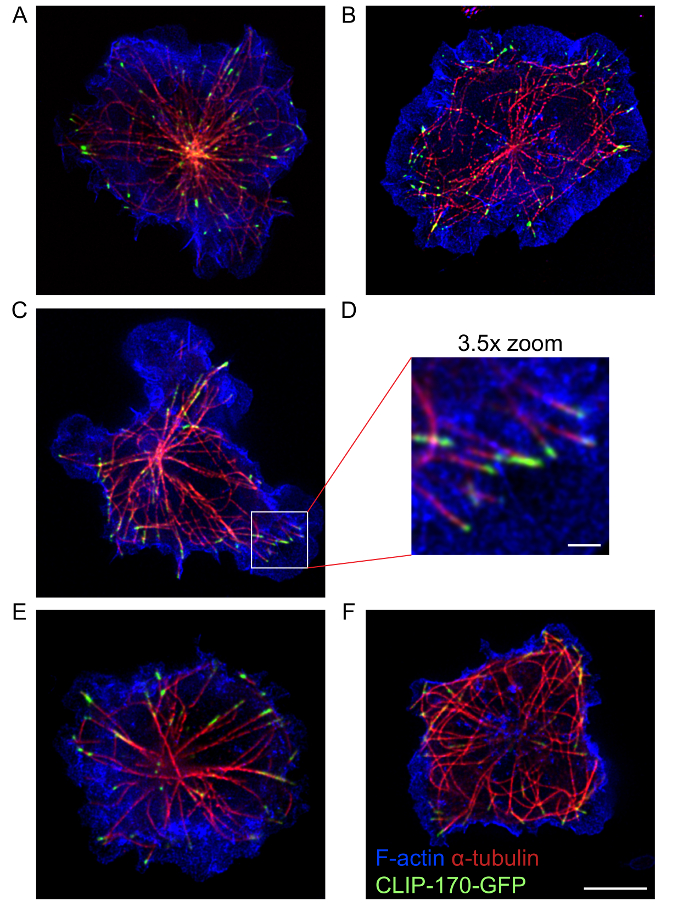
그림 4: 말라와 microtubule cytoskeletons의 호텔 위치 이미지. A20 셀 클립-170-GFP 표현 안티 IgG-입히는 coverslips 고정 되 고 알 렉 사 Fluor 568 활용 된 phalloidin F-말라, 시각화와 α-tubulin 항 체와 알 렉 사 Fluor 532 활용 스테인드 전에 15 분에 전파를 허용 되었다 microtubules 시각화 하 항 하 체 2 차 항 패널 A-D 와 E F 패널 두 개의 서로 다른 셀의 대표 이미지를 표시합니다. 패널 D C패널의 흰색 상자에 영역의 3.5 X 확대 이다. 스케일 바: 패널 A-C 와 E-F; 5 µ m 패널 Dµ 하 m 1 이다 패널 A 에서 이미지 그림 3A 에서 사용 하는 동일한 이미지 이지만 F-말라 채널의 오버레이 포함 한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 5: overexpression 또는 GFP 융해 단백질의 부족 한 표현 가난한 품질 호텔 위치 이미지의 예. A20 셀 클립-170-GFP 표현 안티 IgG-입히는 coverslips 고정 되 고 그림 4처럼 스테인드 전에 15 분 동안에 허용 되었다. (A, B) 클립-170-GFP (A) 와 항 원 접촉으로 장애인된 MTOC 분극의 큰, 비정상적인 집계에서 클립-170-GFP overexpression 결과 (B)사이트. (C) 품질 호텔 위치 이미지에서 레이저 전원 결과 증가 하 여 클립-170-GFP의 부족 한 식에 대 한 보상. 스케일 바: 5 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 6: 기본 B 셀에 microtubule 골격의 호텔 위치 이미지. 기본 비장 B 세포 6 h 5 ng / µ L BAFF 플러스 2.5 µ g/mL LPS, 경작 되었고 안티 IgM 항 체로 코팅 된 했다 coverslips에 15 분에 대 한 확산을 허용. 셀 다음 고정 되었고 α-tubulin 항 체 플러스 microtubules 시각화 하 알 렉 사 Fluor 568 활용 된 이차 항 체와 스테인드. 대표 이미지 표시 됩니다. 눈금 막대: 5 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

영화 1: B 세포 microtubule 네트워크의 3 차원 재구성. A20 셀 고정 되 고 전에 15 분 동안 안티 IgG-입히는 coverslips와 immunostained 항 체를 α-tubulin 플러스 알 렉 사 Fluor 488 활용 된 이차 항 체에 허용 되었다. Z 슬라이스 0.2 µ m 단계 크기 37 프레임의 총에 대 한 점령 했다. 3 차원 재구성 이루어졌다 이미징 소프트웨어의 호텔 위치 현미경을 사용 하 여. 이 비디오를 보려면 여기 클릭 하십시오 (다운로드 오른쪽 클릭.)
토론
이론적으로 50의 해상도 달성할 수 있는 호텔 위치 슈퍼 해상도 현미경을 사용 하 여 cytoskeletal 구조의 상세한 이미지를 얻을 수 있는 회절 제한 된 해상도 200 ~ 기존의 confocal 현미경 검사 법에 비해 nm nm 24. 미세한 구조를 해결 하는 능력 관찰된 "흐리게" 형광 신호에서 원래 광원의 가능성이 가장 높은 위치를 계산할 deconvolution 소프트웨어를 사용 하 여 더 강화 된다. 이 프로토콜에는 호텔 위치는 말라와 microtubule cytoskeletons로 골격 관련 단백질의 이미지를 사용 하 여 방법을 설명 합니다.
B 세포 활성화 면역 시 냅 스 형성17,42에 대 한 중요 한 두 개의 cytoskeletons의 조정 레 걸 골격 및 microtubule 네트워크의 리 모델링을 유도 합니다. 우리가 제시 하는 방법은 동시에 멀티 컬러 호텔 위치를 사용 하 여 항 원 연락처 사이트에서 말라와 microtubule cytoskeletons 이미징에 대 한 최적화 된 하지만 단색 호텔 위치에 대 한 동등 하 게 적용 됩니다. 우리 호텔 위치 어떻게 세포 구조에 새로운 통찰력을 제공할 수 있다 B 세포 골격 하이라이트에 이전 연구 구성 하 고 서로 상호 작용 하는 방법. Confocal 및 총 내부 형광 (TIRF) 현미경을 사용 하 여, 우리 microtubules F-17의 항 원 연락처 사이트 주변에 말라 반지 문의 관찰 했다. 호텔 위치 현미경을 사용 하 여, 우리는 의해 표시 된 microtubules의 더하기 끝 표시 수 있었다는 + 팁 클립-170 수지상 말라 네트워크 셀 주변에 밀접 하 게 연관 ( 그림 4참조).
어떤 이미징 기술을 하나의 특정 응용 프로그램에 가장 적합 한는 다중 요인 영향. 이 필요한 해상도, 이미지 수를 구조, 라벨 기술 및 신호 대 잡음 비율 (즉, 대비), 수집 시간, 샘플 준비, 및 재현성의 용이성을 포함 합니다. 호텔 위치에 대 한 샘플 준비 confocal 현미경 검사 법에 대 한 보다 크게 다른 이며 그것은 결합 하 여 고해상도 고속 이미지 수집. 호텔 위치의 주요 이점은 이다 광학 프로세스는 이미지는 샘플에서 직접 취득 및 해상도24호텔 위치 레이저 파워를 변경 하 여 조정할 수 있습니다. 바닥 상태 고갈 슈퍼 해상도 현미경, 달리는 수천 개의 연속 이미지에서에서 이미지를 재구성, 광범위 한 전산 처리 호텔 위치, 필요 하지 않습니다 캡처하고 이미지 재건의 유물 소개 피할 수 그러나 24., 호텔 위치 이미지에서 대비는 종종 낮은24ImageJ 대비를 향상 시킬 필요가 있을 수 있습니다와 같은 소프트웨어를 사용 하는 경우 후 이미지 처리에서. 이 수지상 말라 네트워크 같은 조밀한 구조, 이미지에 대 한 특히 중요 하다. 이미지 수집 동안 이미지 대비를 개선 하기 위해 한 수 고갈 레이저 전원 줄이거나 선 또는 프레임 평균을 적용 합니다. 시간 문이 호텔 위치, 사용자 설정 시간 지연 후 광자를 캡처, 영역에서 광자 수집된24,43를 감소 하 여 해상도 높일 수 있습니다. 명암비와 해상도 개선 하기 위해 이러한 방법의 조합을 사용 하 여 면역 시 냅 스에서 cytoskeletal 구조의 호텔 위치 이미지를 최적화 하는 것이 좋습니다.
현재, 모든 fluorophores 호텔 위치와 이미징에 대 한 최적의 있으며 모든 fluorophore 조합 다 색 호텔 위치 이미지를 얻기 위해 적당 하다. 감지 범위 조절에 주의 인접 채널에 최소한의 출혈-통해 fluorophores의 보장에 대 한 중요 하다. Fluorophores이 프로토콜 (즉, GFP, 알 렉 사 Fluor 532, 그리고 알 렉 사 Fluor 568) 사용의 조합 다 색 호텔 위치 슈퍼 해상도 이미징에 대 한 최적입니다. 구조화 조명 현미경 (SIM)를 비교 하 고 단일 분자 지역화 방법 (SMLM), 사진 활성화 지역화 현미경 (팜), 호텔 위치 등 일반적으로 멀티 컬러 이미지에 적합 하지 않습니다. 그러나, 우리가 여기에 fluorophore 검출, 그 약간의-채도 표시 간단한 이미지 처리 도구와 결합 하 여 제공할 수 있습니다 말라와 microtubule cytoskeletons의 고해상도 멀티 컬러 이미지.
Cytoskeletal 구조의 호텔 위치 이미징이 프로토콜 B 세포 면역 시 냅 스에서 cytoskeletal 건축의 새로운 세부 사항을 밝혔다. 우리 B 세포에 항 원 접촉 사이트에서 말라와 microtubule cytoskeletons 이미징이 프로토콜 최적화, 비록 이러한 방법 다른 세포 유형, 특히 면역 세포 (T 세포, NK 세포, 돛대 세포, 등)를 형성에 적용 되어야 합니다. 면역 시 냅 스입니다. 또한,이 프로토콜의 유틸리티 다른 ligands 또는 접착 기판 coverslips 코팅을 연장 될 수 있습니다. 그러나, 그것은 프로토콜 및 셀 종류와 실험 설정에 대 한 이미지 수집 설정을 최적화 하는 것이 중요입니다.
공개
저자는 공개 없다.
감사의 말
우리는 UBC 생명과학 연구소 (LSI) 이미징 시설 지원 및 호텔 위치 현미경을 유지에 대 한 감사 합니다. 이 작품에서에서 권한을 부여 #68865 건강 연구의 캐나다 학회 (M.R.G.)에 의해 투자 되었다. 클립-170-GFP 플라스 미드에 감사 박사 고조 Kaibuchi (나고야 대학, 나고야, 일본) 하 고.
자료
| Name | Company | Catalog Number | Comments |
| Cell culture | |||
| A20 mouse B-lymphoma cells | ATCC | TIB-208 | Murine B-cell lymphoma of Balb/c origin that expresses an IgG-containing BCR on its surface |
| RPMI-1640 | Thermo Fisher Scientific | R0883 | |
| Fetal bovine serum | Thermo Fisher Scientific | 12483020 | Heat inactivate at 56 oC for 30 min |
| 2-mercaptoethanol | Millipore Sigma | M3148 | |
| Glutamine | Millipore Sigma | G5763 | |
| Sodium pyruvate | Millipore Sigma | P5280 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | Liquid, 10,000 units |
| Additional materials for primary B cells | |||
| 70-µm cell strainer | Corning | 352350 | |
| Magnetic bead-based B cell isolation kit | Stemcell Technologies | 19854 | EasySep Mouse B cell Isolation kit |
| Lipopolysaccharide (LPS) | Millipore Sigma | L4391 | LPS from E. coli 0111:B4 |
| B cell-activating factor (BAFF) | R&D Systems | 2106-BF-010 | |
| Name | Company | Catalog Number | Comments |
| Transfection | |||
| Plasmid encoding CLIP-170-GFP | Gift from Dr. Kozo Kaibuchi (Nagoya Univ., Nagoya, Japan); described in Fukata et al. Cell 109:873-885, 2002 | ||
| Recommended transfection reagents and equipment | |||
| Amaxa Nucleofection kit V | Lonza | VCA-1003 | Follow the manufacturer's directions for mixing the transfection reagents with the DNA |
| Amaxa Nucleofector model 2b | Lonza | AAB-1001 | Program L-013 used |
| Falcon 6-well plates, TC treated, sterile | Corning | 353046 | |
| Name | Company | Catalog Number | Comments |
| Coating coverslips | |||
| 18-mm diameter round #1.5 cover glasses | Thomas Scientific | 1217N81 | Similar product: Marienfield-Superior catalogue #117580 |
| Forceps | Fisher Scientific | 1381242 | Dissecting extra fine splinter forceps |
| Falcon 12-well sterile tissue polystyrene tissue culture plate | Corning | 353043 | |
| 100% methanol | Fisher Scientific | A412-4 | |
| Sterile phosphate buffered saline (PBS) without calcium or magnesium | Thermo Fisher Scientific | 10010049 | |
| Goat-anti-mouse IgG antibody | Jackson ImmunoResearch | 115-005-008 | For A20 cells |
| Goat-anti-mouse IgM antibody | Jackson ImmunoResearch | 115-005-020 | For primary mouse B cells |
| Name | Company | Catalog Number | Comments |
| Staining | |||
| Paraformaldehyde (16% stock solution) | Electron Microscopy Sciences | 15710 | Dilute with PBS to working concentration |
| Glutaraldehyde (50% stock solution) | Millipore Sigma | 340855 | Dilute with PBS to working concentration |
| Triton X-100 | Fisher Scientific | BP151-500 | |
| Saponin | Millipore Sigma | S2149 | |
| Bovine serum albumin (BSA), Fraction V | Millipore Sigma | 10735094001 | |
| Rabbit anti-tubulin antibody | Abcam | ab52866 | 1:250 dilution recommended but should be optimized |
| Alexa Fluor 532-conjugated goat anti-rabbit IgG | Thermo Fisher Scientific | A11009 | 1:100 dilution recommended but should be optimized |
| Alexa Fluor 568-conjugated phalloidin | Thermo Fisher Scientific | A12380 | 1:100 dilution recommneded but should be optimized |
| Prolong Diamond Antifade Mountant | Thermo Fisher Scientific | P36970 | Without DAPI |
| Fisherbrand Superfrost Plus Microscope Slides | Fisher Scientific | 12-550-15 | |
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Parafilm | VWR | P1150-2 | |
| HEPES | Millipore Sigma | H3375 | |
| NaCl | Fisher Scientific | BP358 | |
| KCl | Millipore Sigma | P9333 | |
| CaCl2 | Millipore Sigma | C1016 | |
| Na2HPO4 | Fisher Scientific | S374-500 | |
| MgSO4 | Fisher Scientific | M63 | |
| Dextrose | Fisher Scientific | D16-500 | |
| Name | Company | Catalog Number | Comments |
| Microscopy | |||
| Leica SP8 TCS STED microscope | Leica | ||
| Huygens deconvolution software | Scientific Voume Imaging | See https://svi.nl/HuygensProducts |
참고문헌
- Harwood, N. E., Batista, F. D. The cytoskeleton coordinates the early events of B-cell activation. Cold Spring Harb Perspect Biol. 3 (2), a002360 (2011).
- Batista, F. D., Treanor, B., Harwood, N. E. Visualizing a role for the actin cytoskeleton in the regulation of B-cell activation. Immunol Rev. 237 (1), 191-204 (2010).
- Harwood, N. E., Batista, F. D. Early events in B cell activation. Annu Rev Immunol. 28, 185-210 (2010).
- Batista, F. D., Harwood, N. E. The who, how and where of antigen presentation to B cells. Nat Rev Immunol. 9 (1), 15-27 (2009).
- Kumari, S., et al. T cell antigen receptor activation and actin cytoskeleton remodeling. Biochim Biophys Acta. 1838 (2), 546-556 (2014).
- Dustin, M. L. Visualization of Cell-Cell Interaction Contacts: Synapses and Kinapses. Self Nonself. 2 (2), 85-97 (2011).
- Dustin, M. L., Chakraborty, A. K., Shaw, A. S. Understanding the Structure and Function of the Immunological Synapse. Cold Spring Harb Perspect Biol. 2 (10), a002311 (2010).
- Dustin, M. L. Modular design of immunological synapses and kinapses. Cold Spring Harb Perspect Biol. 1 (1), a002873 (2009).
- Dustin, M. L. Visualization of cell-cell interaction contacts-synapses and kinapses. Adv Exp Med Biol. 640, 164-182 (2008).
- Dustin, M. L. Hunter to gatherer and back: immunological synapses and kinapses as variations on the theme of amoeboid locomotion. Annu Rev Cell Dev Biol. 24, 577-596 (2008).
- Dustin, M. L. T-cell activation through immunological synapses and kinapses. Immunol Rev. 221, 77-89 (2008).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Monks, C. R., et al. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Yuseff, M. I., et al. How B cells capture, process and present antigens: a crucial role for cell polarity. Nat Rev Immunol. 13 (7), 475-486 (2013).
- Mattila, P. K., Batista, F. D., Treanor, B. Dynamics of the actin cytoskeleton mediates receptor cross talk: An emerging concept in tuning receptor signaling. J Cell Biol. 212 (3), 267-280 (2016).
- Kuhn, J. R., Poenie, M. Dynamic polarization of the microtubule cytoskeleton during CTL-mediated killing. Immunity. 16 (1), 111-121 (2002).
- Wang, J. C., et al. The Rap1-cofilin-1 pathway coordinates actin reorganization and MTOC polarization at the B cell immune synapse. J Cell Sci. 130 (6), 1094-1109 (2017).
- Schnyder, T., et al. B cell receptor-mediated antigen gathering requires ubiquitin ligase Cbl and adaptors Grb2 and Dok-3 to recruit dynein to the signaling microcluster. Immunity. 34 (6), 905-918 (2011).
- Nath, S., et al. Dynein Separately Partners with NDE1 and Dynactin To Orchestrate T Cell Focused Secretion. J Immunol. 197 (6), 2090-2101 (2016).
- Combs, J., et al. Recruitment of dynein to the Jurkat immunological synapse. Proc Natl Acad Sci U S A. 103 (40), 14883-14888 (2006).
- Akhmanova, A., Steinmetz, M. O. Control of microtubule organization and dynamics: two ends in the limelight. Nat Rev Mol Cell Biol. 16 (12), 711-726 (2015).
- Akhmanova, A., Steinmetz, M. O. Microtubule +TIPs at a glance. J Cell Sci. 123 (20), 3415-3419 (2010).
- Fukata, M., et al. Rac1 and Cdc42 capture microtubules through IQGAP1 and CLIP-170. Cell. 109 (7), 873-885 (2002).
- Wegel, E., et al. Imaging cellular structures in super-resolution with SIM, STED and Localisation Microscopy: A practical comparison. Sci Rep. 6, 27290 (2016).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu Rev Biochem. 78, 993-1016 (2009).
- Mace, E. M., Orange, J. S. Dual channel STED nanoscopy of lytic granules on actin filaments in natural killer cells. Commun Integr Biol. 5 (2), 184-186 (2012).
- Ritter, A. T., et al. Actin depletion initiates events leading to granule secretion at the immunological synapse. Immunity. 42 (5), 864-876 (2015).
- Tamarit, B., et al. Membrane microdomains and cytoskeleton organization shape and regulate the IL-7 receptor signalosome in human CD4 T-cells. J Biol Chem. 288 (12), 8691-8701 (2013).
- Brown, A. C., et al. Super-resolution imaging of remodeled synaptic actin reveals different synergies between NK cell receptors and integrins. Blood. 120 (18), 3729-3740 (2012).
- Dupre, L., et al. T Lymphocyte Migration: An Action Movie Starring the Actin and Associated Actors. Front Immunol. 6, 586 (2015).
- Rak, G. D., et al. Natural killer cell lytic granule secretion occurs through a pervasive actin network at the immune synapse. PLoS Biol. 9 (9), e1001151 (2011).
- Lin, K. B., et al. The Rap GTPases regulate the migration, invasiveness and in vivo dissemination of B-cell lymphomas. Oncogene. 29 (4), 608-615 (2010).
- Lin, K. B., et al. The rap GTPases regulate B cell morphology, immune-synapse formation, and signaling by particulate B cell receptor ligands. Immunity. 28 (1), 75-87 (2008).
- McLeod, S. J., et al. The Rap GTPases regulate integrin-mediated adhesion, cell spreading, actin polymerization, and Pyk2 tyrosine phosphorylation in B lymphocytes. J. Biol. Chem. 279 (13), 12009-12019 (2004).
- Christian, S. L., et al. Activation of the Rap GTPases in B lymphocytes modulates B cell antigen receptor-induced activation of Akt but has no effect on MAPK activation. J Biol Chem. 278 (43), 41756-41767 (2003).
- Batista, F. D., Iber, D., Neuberger, M. S. B cells acquire antigen from target cells after synapse formation. Nature. 411 (6836), 489-494 (2001).
- Treanor, B., et al. Dynamic cortical actin remodeling by ERM proteins controls BCR microcluster organization and integrity. J Exp Med. 208 (5), 1055-1068 (2011).
- Mattila, P. K., et al. The actin and tetraspanin networks organize receptor nanoclusters to regulate B cell receptor-mediated signaling. Immunity. 38 (3), 461-474 (2013).
- Yuseff, M. -. I., et al. Polarized Secretion of Lysosomes at the B Cell Synapse Couples Antigen Extraction to Processing and Presentation. Immunity. 35 (3), 361-374 (2011).
- Mace, E. M., Orange, J. S. Visualization of the immunological synapse by dual color time-gated stimulated emission depletion (STED) nanoscopy. J Vis Exp. (85), (2014).
- Russ, J. C. . The Image Processing Handbook, Sixth Edition. , (2011).
- Stinchcombe, J. C., et al. Centrosome polarization delivers secretory granules to the immunological synapse. Nature. 443 (7110), 462-465 (2006).
- Vicidomini, G., et al. Sharper low-power STED nanoscopy by time gating. Nat Methods. 8 (7), 571-573 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유