Method Article
להמחיש את אקטין ואת Microtubule Cytoskeletons על הסינפסה B-cell המערכת החיסונית באמצעות מיקרוסקופ דלדול (STED) פליטה מאולצת
In This Article
Summary
אנו מציגים פרוטוקול להצפנה באמצעות מיקרוסקופ STED בו-זמנית תמונה אקטין מבנים, microtubules של microtubule פלוס-end מחייב חלבונים בתאי B שהופצו על coverslips מצופה נוגדנים לקולטן B-cell, מודל עבור השלב הראשוני היווצרות מערכת החיסון סינפסה.
Abstract
תאי B לאגד ממברנה מכורך אנטיגנים (למשל, על פני השטח של תא אנטיגן) יוצרים סינפסה על המערכת החיסונית, מבנה הסלולר מיוחדים אשר מייעל B-cell קולטן (BCR) איתות ורכישה בתיווך BCR אנטיגן. שני את הבנייה מחדש של שלד התא של אקטין, את ולהתפכחות של הרשת microtubule כלפי האתר קשר אנטיגן חיוניים עבור המערכת החיסונית סינפסה היווצרות. שיפוץ של שלד התא אקטין לתוך טבעת היקפית צפופה של F-אקטין מלווה קיטוב של מרכז ארגון microtubule לכיוון הסינפסה המערכת החיסונית. Microtubule פלוס-end מחייב חלבונים, וכן לכידת פלוס-end קורטיקלית חלבונים מתווכים האינטראקציות פיזי בין cytoskeletons אקטין, microtubule, המאפשרים להם יהיו מאורגנות באופן מתואם. שחקרתי את מנגנוני הבקרה הארגון מחדש cytoskeletal, כמו גם הבנה איך אלה מבנים cytoskeletal לעצב מערכת החיסון סינפסה היווצרות והאיתות BCR, יכול לספק תובנות חדשות תא B הפעלה. זה נעזר בגילויים הפיתוח של גישות מיקרוסקופ ברזולוציה סופר חושפים פרטים חדשים cytoskeletal רשת הארגון. נתאר כאן שיטה באמצעות פליטה מאולצת מיקרוסקופ דלדול (STED) בו זמנית תמונה אקטין מבנים, microtubules של transfected microtubule מתויג GFP פלוס-end מחייב חלבונים בתאי B. המודל האירועים בתחילת במבנה המערכת החיסונית סינפסה, אנו מאפשרים בתאי B למרוח אותו על coverslips מצופים נוגדן אנטי (anti-Ig) נוגדנים, ליזום BCR איתות ובניה שלד התא. אנו מספקים פרוטוקולים צעד אחר צעד לביטוי GFP פיוז'ן חלבונים בתאים A20 B-לימפומה, להפצת תא אנטי-Ig-induced, קיבוע תא עוקבות, Immunostaining, ייבוא תמונות של התמונה deconvolution צעדים. התמונות ברזולוציה גבוהה מושגת באמצעות הליכים אלה מאפשרים אחד בו זמנית להמחיש אקטין מבנים microtubules, החלבונים פלוס-קצה הכריכה microtubule עשויים לקשר אלה שתי רשתות cytoskeletal.
Introduction
כאשר תאים B לאגד מקוטב מערכים של אנטיגנים (למשל, המוצג על פני השטח של אנטיגן תאים (נגמ שים)), וכתוצאה מכך B-cell הקולטן (BCR) איתות כוננים היווצרות של מבנה קלאסי סינפסה המערכת החיסונית, אשר היה הראשון המתואר T תאים1,2,3,4,5,6,7,8,9,10, 11,12,13. בתחילה, microclusters בצורה BCRs אנטיגן מכורך בפריפריה של התא B: APC פנה אל האתר. אלה microclusters לאחר מכן להזיז לכיוון המרכז של האתר קשר אנטיגן, איפה הם מזג לתוך אשכול מרכזי ההפעלה סופרא מולקולרית (cSMAC) המהווה הליבה של הסינפסה המערכת החיסונית. סינפסה המערכת החיסונית היווצרות מייעל BCR איתות ומקל אנטיגן בתיווך BCR החילוץ של קרום APC14. רכישה זו אנטיגן, שבעקבותיה באה אנטיגן בתיווך BCR הפנמה ועיבוד אנטיגן עוקבות, מאפשר תאי B להציג פפטיד: MHC II מתחמי לתאי T וירתקו את תא T עזרה14. כי המערכת החיסונית סינפסה היווצרות מקדם תא B הפעלה, שחקרתי את המנגנונים המקימים שזה דפוס פונקציונלי של קולטן הארגון יכול לספק חדש תובנות תגובות חיסוניות ההורמונאלית איך יזם, מוסדר.
ארגון מחדש של אקטין והן microtubule cytoskeletons חיוני עבור המערכת החיסונית סינפסה היווצרות. BCR מקומי איתות מגורה על ידי מערך מקוטב במרחב של אנטיגנים גורם מהירה ודרמטית שיפוץ של אקטין שלד התא1,15. היווצרות של אקטין דנדריטים מבנים בפריפריה של תא B מפעילה כוחות לדחוף על קרום פלזמה ומקדם תא B הפצת. זה מאפשר התא B לסרוק אזור רחב יותר מניבי אנטיגן פני השטח, מגדילה את מספר BCRs אשר מאגד אנטיגן ולהפעיל BCR מסלולי איתות. במקביל, MTOC את הרשת microtubule הם reoriented כלפי האתר של אנטיגן קשר. MTOC מתקרב האתר קשר אנטיגן, microtubules שמקורם MTOC להאריך לאורך הפנים הפנימי של קרום פלזמה על הממשק בין התא B לבין משטח אנטיגן מניבי16,ה-17. Microtubules juxtamembrane אלה יכולים לשמש ואז רצועות עבור תנועת צנטריפטלי בתיווך דינאין של אנטיגן מכורך BCR microclusters18, שמוביל היווצרות cSMAC.
ולהתפכחות קיטוב של MTOC לכיוון הסינפסה המערכת החיסונית דורש אקטין שלם microtubule cytoskeletons ואת תלויים אינטראקציות בין אקטין קורטיקלית microtubules ורשת16,17, 19,20. החלבונים אקטין-איגוד בקליפת המוח, כגון IQGAP1, באפשרותך ללכוד microtubules על ידי אינטראקציה עם מתחמי חלבון המעטרים את קצות פלוס microtubule21. אלה מתחמי דינמי של פלוס-end מחייב חלבונים כוללים EB1, סרטון-170, אשר מתייחסים באופן קולקטיבי בתור microtubule פלוס-סוף מעקב חלבונים (+ טיפים)21,22. + טיפים בקצות microtubules ניתן לאגד חלבונים המקושרים עם קרום פלזמה או את שלד התא אקטין קורטיקלית. זה מאפשר מנגנונים ליצירת כוח (למשלהמינוס-הסוף ביים תנועת מעוגן cortically דינאין לאורך microtubules) כדי להפעיל כוחות מושך-microtubules, ובכך למקם מחדש את MTOC. קליפ-170 ניתן לאגד החלבון אקטין-הקשורים פיגומים IQGAP123, הראינו כי שני חלבונים אלה נדרשים עבור MTOC BCR-induced קיטוב לכיוון ה17-סינפסה המערכת החיסונית. אינטראקציה זו IQGAP1-קליפ-170 עשוי לשחק תפקיד מפתח בתיאום את הבנייה מחדש של שלד התא אקטין עם מיקום מחדש של הרשת microtubule על הסינפסה המערכת החיסונית B-cell.
קרינה פלואורסצנטית קונבנציונאלי מיקרוסקופ חשף דרמטי לארגונו מחדש של cytoskeletons אקטין, microtubule במהלך B-cell סינפסה המערכת החיסונית היווצרות2. עם זאת, גישה זו אין אפשרות לפענח קטן מבנים הסלולר בפירוט עקב המגבלה עקיפה של אור, אשר, על פי החוק של אבה, היא תלויה אורך הגל של האור בשימוש כדי להאיר את הדגימה, את הצמצם של אובייקטיביות24. מגבלה זו עקיפה מאלץ את הרזולוציה של מיקרוסקופ אור קונבנציונלי 200-300 ננומטר בכיוון לרוחב, 500-700 nm, כיוון צירית25. לכן, subcellular מבנים קטנים יותר, כמו גם את הפרטים הקטנים של אקטין, microtubule cytoskeletons, יכול רק להיות שנצפו באמצעות מיקרוסקופיית אלקטרונים. מיקרוסקופ אלקטרונים הדמיה של שלד התא הוא זמן רב, דורש דגימה קשים קיבוע והכנות פרוטוקולים יכול לשנות מבנים ביולוגיים, ולא מוגבל לאיתור בתיווך נוגדנים. היכולת immunostain, בו זמנית תמונה מספר חלבונים או מבנים הסלולר הוא יתרון משמעותי של קרינה פלואורסצנטית מיקרוסקופ. יתר על כן, ביטוי פיוז'ן פלורסנט חלבונים בתאים מאפשר הדמיה בזמן אמת והוא שימושי כאשר נוגדנים יעילים עבור immunostaining החלבון עניין אינם זמינים.
ההתקדמות הטכנולוגית האחרונות במיקרוסקופ ברזולוציה סופר יש להתגבר על המגבלות עקיפה של אור והתירו את החזיית ננו-מבנים הסלולר24. אחד טכניקה מיקרוסקופית רזולוציה סופר כזה נקרא פליטה מאולצת מיקרוסקופ דלדול (STED). STED מעסיקה שני לייזרים, לייזר אחד מגרה את fluorophore ואיפה לייזר השני עם תבנית בצורת סופגנייה מעלימה באופן סלקטיבי את פליטת קרינה פלואורסצנטית סביב fluorophore. זה מפחית את פונקציית נקודת-התפשטות (אזור לכאורה) של חלקיק בודד פלורסנט ומספק25,26תמונות פלורסנט מגבלת עקיפה המשנה. מיקרוסקופ דלדול הקרקע-המדינה מעסיקה גם טכניקות מבוססות קרינה פלואורסצנטית לרכוש תמונות ברזולוציה-העל. עם זאת, התמונה רכישה ושחזור הפעמים ארוכות ישנם רק מספר מוגבל של fluorophores יכול לשמש, ההדמיה ברזולוציה גבוהה בו זמנית של מספר רכיבים cytoskeletal הוא טכנית מאתגר כי שמירה אקטין ומבני microtubule דורש הליכים קיבוע שונות. לכן, STED יש מספר יתרונות על פני מיקרוסקופ אלקטרונים, אחרים מיקרוסקופ סופר-ברזולוציה גישות בכך שזה מציע ייבוא תמונות מהיר, יש דרישות מינימליות עיבוד דפוס, מעסיקה את fluorophores אותו והוא מכתים טכניקות זה משמשים פלורסצנטיות קונבנציונאלי מיקרוסקופיה של דגימות קבוע26.
מיקרוסקופ ברזולוציה סופר עכשיו נעשה שימוש כדי להמחיש אקטין מבנים ב הסינפסה מחוסן טבעית תאים (NK) רוצח ו T תאים26,27,28,29,30, 31. אולם, הדמיה ברזולוציה-העל של שלד התא microtubule, כמו גם מתואמת לארגונו מחדש של cytoskeletons אקטין, microtubule במהלך היווצרות סינפסה המערכת החיסונית, רק באחרונה דווח על17. השתמשנו STED במיקרוסקופ בתאים תמונה B שלא היו נותנים למרוח אותו על coverslips מצופים נוגדן אנטי (anti-Ig) נוגדנים, BCR איתות וליזום רה-ארגון שלד התא. כאשר מצופה על קיבוע נוגדנים anti-Ig, בתאי B עוברים דרמטי תלויי-אקטין המריחה, אשר recapitulates את האירועים הראשונית במהלך היווצרות מערכת החיסון סינפסה. חשוב לציין, מיקרוסקופ STED חשף את הפרטים הקטנים של הטבעת דנדריטים של F-אקטין סינפסה צורות בפריפריה של מערכת החיסון, הראה כי את MTOC, כמו גם את microtubules המצורף אליו, עברה ליד האתר קשר אנטיגן17. אלה microtubules מורחב החוצה לכיוון הטבעת ההיקפית של F-אקטין. יתר על כן, ההדמיה STED צבע רב של שילובים שונים של F-אקטין, טובולין, IQGAP1, ו מתויג GFP קליפ-170 + טיפים הראתה כי microtubule פלוס-מסתיים בסימן קליפ-170-GFP היו קשורים באופן הדוק meshwork של אקטין היקפיים, עם IQGAP1, לכידת קורטיקלית חלבון17.
כאן, אנו מציגים פרוטוקול מפורט הדמיה cytoskeletons אקטין, microtubule על הסינפסה המערכת החיסונית באמצעות מיקרוסקופ STED. שיטות אלה מוטבו באמצעות קו תא B מאתר A20, אשר ננקטה נרחב ללמוד BCR איתות, סינפסה המערכת החיסונית היווצרות17,32,33,34,35 , 36 , 37 , 38 , 39. בגלל נוגדנים מסחרי קליפ-170 לא פעלה היטב עבור immunostaining בניסויים הקודמים, נתאר בפירוט את הביטוי של מתויג GFP קליפ-170 בתאים A20, יחד עם צביעת פרוטוקולים להמחשת בו זמנית עד ל שלושה מרכיבים cytoskeletal או חלבונים הקשורים שלד התא. שיטות לשימוש STED מיקרוסקופ כדי התמונה אקטין-NK תאים חיסוניים הסינפסות היה שתואר לעיל40. כאן, אנו להרחיב זה רכישת תמונות ברזולוציה סופר צבע רב של אקטין והן microtubule cytoskeletons בתאי B.
שיקול מכריע עבור סופר-רזולוציה מיקרוסקופיה היא באמצעות ההליכים קיבוע מתאים לשמירה על מבנים הסלולר ולמניעת נזק חלבונים פלורסנט. את הקיבעון, צביעת שיטות שהוצגו במסמך זה מוטבו שומרים על ידי קרינה פלואורסצנטית GFP ולספק דימות ברזולוציה של הרשתות אקטין, microtubule. כאשר המבטאים חלבונים פלורסנט, יצוין כי בתאי B הם בדרך כלל קשה transfect. באמצעות פרוטוקול זה, 20-50% של A20 תאים בדרך כלל לבטא את חלבון כימרי transfected GFP, בקרב אוכלוסייה זו רמות החלבון הביטוי משתנה. למרות זאת, הדמיה ברזולוציה-העל של אקטין, microtubules באמצעות ההליכים שנתאר די חזקים, תמונות באיכות גבוהה מתקבלים בקלות. למרות גודלם הזעיר יחסית בתאים A20, אנו מראים כי הליכים אלה גם יכול לשמש כדי תמונה ברשת microtubule בתאי B הראשי הופעלו בקצרה עם ליפופוליסכריד (LPS). הראינו כי מופעל LPS בתאי B ראשי יכול להיות transfected עם siRNAs יעילות גבוהה יחסית (כלומר, כאלה כי חלבון דלדול ניתן להבחין באמצעות immunoblotting), גורמים להם אלטרנטיבה טובה לשימוש של שורות תאים B עבור מחקרים 17.
Protocol
כל ההליכים בבעלי חיים אושרו על ידי אוניברסיטת קולומביה הבריטית חיה טיפול הוועדה.
1. הבעת GFP-fusion חלבונים בתאים A20 B-לימפומה
- התרבות התאים A20 ב להשלים RPMI בינוני (RPMI-1640 בתוספת 10% לא פעיל חום העובר שור סרום (FBS), 50 מיקרומטר מרקפטואתנול, גלוטמין 2 מ מ, פירובט 1 מ מ, 50 פניצילין U/mL ו- 50 סטרפטומיצין µg/mL)-37 מעלות צלזיוס חממה תרביות רקמה עם 5 % CO2.
- הכנת תקנים הכימית (ראה את הטבלה של חומרים) על פי הוראות היצרן.
הערה: פרוטוקול זה הותאם מבחינת ריאגנטים ספציפיים, תרביות תאים פרוטוקול המתוארות בטבלה של חומרים. אחרים ריאגנטים תרביות תאים זה ניסינו לא הניבו מספיק תקנים יעילות. - לספור את התאים באמצעות hemocytometer. צנטריפוגה 2.5 x 10 תאים6 A20 (עבור כל תרביות תאים) עבור 5 דקות ב 525 x g... Resuspend תאי µL 100 של ריאגנט תרביות תאים המכיל 1-2.5 µg של פלסמיד ה-DNA. ה-dna קידוד הסרטון-170-GFP23להשתמש µg 2.5 לפי תקנים. מערבבים בעדינות.
- להעביר את התאים טוב של צלחת 6-ובכן, לכוונן את עוצמת הקול עד 2 מ"ל מראש ומחוממת בינונית RPMI מלאה. התרבות התאים עבור 18 h ב 37 ° C כדי לאפשר ביטוי חלבון.
2. בידוד העכבר הראשי B תאים והפעלת אותם עם LPS
- להשתמש בכלים סטיריליים כירורגי להסיר את הטחול עכבר, בעקבות פרוטוקולים אושרו על ידי ועדת אכפת לי חיה של המוסד.
- בשכונה תרביות רקמה, מניחים מסננת תא 70 סטרילי-מיקרומטר לתוך תבשיל תרביות רקמה 35 מ מ המכיל 3 מ"ל של PBS סטרילי בטמפרטורת החדר. להשתמש בחלק גומי הבוכנה של מזרק 5-ml לרסק את הטחול דרך מסננת התא.
- Pipet התליה תא בודד של splenoctyes לתוך צינור 15-mL סטרילי צנטריפוגה ב 525 x g במשך 5 דקות.
- שימוש בידוד תא B מגנטיים מבוססי חרוז קיט (ראה טבלה של חומרים) כדי לקבל אוכלוסייה מועשר של תאי B.
- Resuspend תאי B כדי 3 x 106/mL בינוני RPMI מלאה בתוספת 2.5 µg/mL LPS פלוס 5 ng/mL תא B הפעלת פקטור (BAFF; של ציטוקין הישרדות).
- התרבות התאים במשך 6 שעות ב 37 º C.
3. ציפוי coverslips זכוכית דקה עם נוגדנים Anti-Ig
- היכונו ציפוי coverslips את הפתרון נוגדן. לדלל את הפתרון מניות של עז-נגד-עכבר נוגדנים Ig לתוך בטמפרטורת החדר PBS סטרילי כדי להפוך את פתרון µg/mL 12.5; µL 400 של נוגדן פתרון נדרש עבור כל coverslip.
הערה: השתמש בעכבר נגד עז IgG על תאים A20; השתמש בעכבר נגד עז IgM על ראשי B תאים. נוגדנים עז אג מאגד טוב לקולטנים Fc העכבר. עם זאת, כדי למנוע כל איגוד קולטן Fc פוטנציאליים, אחד ניתן להשתמש F(ab) או F(ab')2 שברי העכבר אנטי איג או נוגדנים IgM anti-עכבר. - לטבול coverslip 18 מ מ זכוכית עגול #1.5 ב- 100% מתנול והנח לו להתייבש לגמרי (~ 10 דקות).
- באמצעות מלקחיים, המקום של coverslip מיובשים לתוך תרביות רקמה 12-ובכן צלחת, pipet 400 µL של 12.5 µg/mL נוגדן הפתרון (סה כ µg 5; µg/cm 22) על גבי coverslip כך זה טפסים בועה במרכז coverslip ומשרת את הקצוות.
- להקפיד לכסות את coverslip כולו, אך אינם מאפשרים את הפתרון נוגדן להרחיב מעבר לקצה של coverslip של זכוכית, על גבי הפלסטיק תרביות רקמה. דגירה בטמפרטורת החדר למשך 30 דקות.
- לשטוף את coverslips מאת pipetting 1 מ"ל של PBS סטרילי לתוך טוב ובעקבות כך כ רפה בעברית את הפתרון. חזור עוד פעמיים כדי להסיר נוגדנים לא מאוגד.
- להוסיף טוב המכיל את coverslip מצופים נוגדן עד תאים מוכן להוסיף 1 מ"ל של PBS סטרילי.
הערה: coverslips ניתן לשמור בטמפרטורת החדר, מכוסה PBS, לשימוש באותו יום.
4. תא B הפצת על Coverslips אנטי איג-מצופים
- להכין ששינה באגירה HEPES מלוחים (mHBS): 25 מ מ HEPES, pH 7.2, 125 מ מ NaCl, 5 מ מ אשלגן כלורי, 1 מ"מ CaCl2, 1 מ מ נה2HPO4, MgSO 0.5 מ מ4, 1 מ"ג/מ"ל דקסטרוז, גלוטמין 2 מ מ, 1 מ מ נתרן פירובט, ו- 50 מיקרומטר מרקפטואתנול). מסנן לעקר את פתרון זה ולאחסן ב 4 º C.
- ביום של הניסוי, להפוך 50 מ של mHBS עם 2% FBS (mHBS-FBS) על-ידי הוספת 1 מ"ל של חום-לא פעיל FBS mHBS 50 מ ל. לחמם את mHBS-FBS עד 37 ° C לפני השימוש.
- Centrifuge בתאים A20 transfected או בתאים B העיקרי היה כבר תרבותי BAFF בתוספת LPS ב 525 g x במשך 5 דקות.
- Resuspend תאי 1 מ"ל של mHBS-FBS, לספור את התאים באמצעות hemocytometer ו לדלל את התאים 2 x 105 תאים/מ ב- mHBS-FBS.
- באמצעות מלקחיים, להעביר את coverslip מהצלחת תרביות רקמה חתיכת סרט פרפין.
- להוסיף 250 µL של תאים B (5 x 104 תאים) כל coverslip.
- דגירה על coverslips ב 37 מעלות צלזיוס למשך 15 דקות בחושך כדי לאפשר בתאי B להתפשט על-פני השטח נגד אג-מצופים.
5. תיקון, Immunostaining התאים
- להכין את הפתרון קיבעון על ידי דילול הפתרון מניות 16% paraformaldehyde הפתרון גלוטראלדהיד 50% מניות במים מזוקקים בטמפרטורת החדר להניב הסופי ריכוזי גלוטראלדהיד 3% paraformaldehyde ו- 0.1%. הכינו את הפתרון קיבוע ביום שזה כדי לשמש ולמחוק כל עודף.
התראה: paraformaldehyde ופתרונות מניות גלוטראלדהיד אמורה לשמש רק בשכונה fume כימי. בצע את ההוראות על גיליון נתוני בטיחות חומרים (MSDS). - הכנת המאגר חוסם/permeabilization (BSA 3% ו- 0.1% טריטון X-100 מדולל ב- PBS). מסנן לעקר את פתרון זה ולאחסן ב 4 º C. ביום של הניסוי, לחמם את הסכום הנדרש לטמפרטורת החדר.
- הכנת המאגר מכתימים (1% BSA ו- 0.1% סאפונין ב- PBS). לעקר את הפתרון הזה באמצעות מסנן 0.2 µm ולאחסן ב 4 º C. ביום של הניסוי, לחמם את הסכום הנדרש לטמפרטורת החדר.
- Pipet 350 µL של הפתרון קיבעון על כל coverslip, המבטיח כי השטח מכוסה לגמרי. דגירה בטמפרטורת החדר במשך 10 דקות בחושך.
- הסר הפתרון קיבוע coverslip על ידי בקפידה כ רפה בעברית מקצה coverslip באמצעות micropipet.
התראה: הפתרון קיבוע צריכים להיות מושלך כפסולת כימיים מסוכנים. - לשטוף את coverslips פעם אחת עם 500 µL permeabilization/חסימת המאגר. Pipet את הנוזל.
- Permeabilize וחסום את התאים על ידי הוספת µL 250 permeabilization/חסימת מאגר כל coverslip, המקננת 10 דקות בטמפרטורת החדר בחושך.
- לדלל את בטחונות נוגדן אנטי-טובולין ארנב ב מכתים מאגר.
- וארוקן את המאגר חוסם/permeabilization מ coverslips, ולהוסיף 50 µL של הפתרון מדולל נוגדן אנטי-טובולין כל coverslip. דגירה בטמפרטורת החדר למשך 30 דקות בחושך.
- הכן הפתרון הכתם נוגדנים משניים/אקטין על ידי דילול עז מצומדת אלקסה עבור חיל הים 532 ארנב אנטי איג נוגדן משני והן phalloidin מצומדת אלקסה עבור חיל הים 568 בטחונות ב מכתים מאגר.
- לשטוף את coverslips 3 פעמים כדי להסיר את עודף נוגדן ראשוני על-ידי הוספת µL 500 של צביעת מאגר, ואז כ רפה בעברית.
- הוסף µL 50 של הפתרון הכתם נוגדנים משניים/אקטין coverslip כל ולאחר תקופת דגירה של 30 דקות בטמפרטורת החדר בחושך.
- לשטוף את coverslips 3 פעמים כדי להסיר עודפי נוגדנים משניים על-ידי הוספת µL 500 של צביעת מאגר, ואז כ רפה בעברית.
- להוסיף 10 µL של ריאגנט הרכבה שקופית מיקרוסקופ. לטעון את coverslip על גבי השקופית מיקרוסקופ עם הצד תא למטה.
הערה: בינוני "אנטי לדעוך" הרכבה (ראה טבלה של חומרים) מומלץ מאוד כדי לשמר את עוצמת קרינה פלואורסצנטית GFP פיוז'ן חלבונים. הימנע משימוש גובר ריאגנטים המכיל דאפי, אשר עלולים להפריע ההדמיה של fluorophores כאשר באמצעות הלייזר STED. - לאפשר שהשקופיות לילה יבש בחושך. תמונה של השקופיות למחרת.
הערה: הדמיה של השקופיות, ברגע coverslip זה יבש מומלץ מאוד, כמו ידי קרינה פלואורסצנטית GFP יתמעטו עם הזמן.
6. הדמיה באמצעות המיקרוסקופ STED
הערה: אנא שימו לב כי כל תוכנה השלבים המתוארים להלן ספיציפית המיקרוסקופ והתוכנה השתמשנו (ראה את הטבלה של חומרים). הצעדים ואת הגדרות יהיה עליך לכוונן אם דימות מתבצעת באמצעות מיקרוסקופ/תוכנות שונות.
- הפעל המיקרוסקופ STED, להפעיל את לייזרים, מנורה של תאורה epifluorescence, ולאחר הפעלת התוכנה מיקרוסקופ.
- להגדיר את הפרמטרים עבור לייזרים דלדול STED.
הערה: זה תלוי המיקרוסקופ ספציפי בשימוש, לייזרים כי הוא מצויד. כמה מומלץ הגדרות הן אור לבן (יקלו) 70%; 592 ננומטר לייזר 80%; 660 ננומטר לייזר 80%. - להפעיל את ההגדרות STED ויישר את STED של קרני לייזר באמצעות המטרה X 100.
- באמצעות העיינית של המצלמה, למקד את הדגימה ובחר תא עם ביטוי GFP מתונה.
הערה: הביטוי GFP נמוך לא יהיו גלויים כי STED מקטין את עוצמת הפליטה. לעומת זאת, ביטוי גבוהה של קליפ-170-GFP גורם היווצרות ספונטנית של אשכולות גדולים, אשר אינה משקפת את microtubule נורמלי פלוס-end חלבונים מורכבים מורפולוגיה והפצה. בחירת תא עם ביטוי GFP מתונה חיוני במדויק הדמיה המבנים cytoskeletal באתר קשר אנטיגן. - זום לתוך התא שנבחר ובחרו את האזור עניין לדימות. להתאים את המוקד כך מישור x-y של תא B הקרובה ביותר coverslip נמצא בפוקוס.
- כדי לעשות זאת, להעביר המטרה בהדרגתיות קרוב יותר coverslip כך המבנים cytoskeletal תא B להתמקד ולאחר מכן לצאת משליטה. לאחר מכן בהדרגה להזיז המטרה בכיוון ההפוך עד המבנים cytoskeletal תא B קודם לחזור להתמקד.
- למטב את ההגדרות כולל את עוצמת הלייזר, עירור קרן טווח הגלאי. להתחיל עם ההגדרות המומלצת לפי הוראות היצרן. ואז לבצע התאמות לפי הצורך כדי למטב את האות על הדגימות. תמונה כל דוגמאות לצורך השוואה אחד לשני את אותן הגדרות.
- תחת הלשונית "לרכוש" של התוכנה, להגדיר את רכישת התמונה רכישת מסגרת רציפים בחלונית התחתונה השמאלית "סרוק סדרתית" על ידי סימון האפשרות "בין מסגרות".
- להגדיר את רצף רכישה.
הערה: אנו רוכשים את פלורסצנטיות GFP קודם כדי למנוע השפלה של אות ה-GFP.
בהתאם לשילוב של fluorophores המשמשים בנוסף GFP, הדמיה האות פלורסצנטיות אורך גל ארוך יותר קודם, תניב תוצאות טובות יותר. עם זאת, הסדר בו fluorophores או חלבונים פלורסנט הם נתון דלדול פליטה מאולצת, עם תמונה צריך להיות מוטבת כדי לקבל את החזקה פלורסצנטיות אותות והרזולוציה הטובה ביותר. - בחר, להגדיר את עוצמת הלייזר STED עבור כל fluorophore תחת הלשונית "רכוש" של התוכנה, והשתמש את פס המחוון עבור-592-nm או STED 660 ננומטר לייזר כדי לכוונן את עוצמת הלייזר. להתאים את הכוח הלייזר 592-nm דלדול עבור ה-GFP, אלקסה עבור חיל הים 532. להתאים את הכוח הלייזר דלדול 660 ננומטר על אלקסה עבור חיל הים 568.
- כדי להגדיל את הרזולוציה ולצמצם את האות רקע, עבור אל ההגדרות של "רכישת" תחת הלשונית "רכוש" של התוכנה, להגדיל את קו ו/או מסגרת בממוצע על-ידי בחירת ערך הגדול מ- 1 שימוש בתפריט הנפתח עבור כל אופציה.
- בנוסף, רוכשים את האות פלורסנט באמצעות ממותגת הזמן STED על-ידי בדיקת האפשרות של המגביל fluorophore תחת הלשונית "רכוש", תוך ציון ערכים עבור זמן-gating (ראה הערה להלן). להגביר את עוצמת הלייזר STED כדי לשפר את הפתרון, אבל זה יהיה גם להגדיל את photobleaching של fluorophores.
הערה: הזמן המגביל יהיה צורך ניתן למטב את המיקרוסקופ, מדגם של fluorophores בשימוש. הזמן gating של 0.3 עד 6 ns מומלץ. לאחר קיבוע, GFP הוא רגישות גבוהה במיוחד עוצמת הלייזר גבוהה. כדי להפחית את photobleaching של ה-GFP, זמן gating צריך להיות מיושם, עוצמת הלייזר STED צריך להיות מופחת. - כדי ללכוד תמונות STED תלת-ממד, השתמש במחוון כדי לשנות את הנקודה התפשט פונקציה (PSF) "3D STED".
- באופן ידני לרכוש תמונות מרובות כדי להבטיח הפארמצבטית. Deconvolve את התמונות (ראה איור 1) באמצעות תוכנה deconvolution חבילת41(ראה טבלה של חומרים).
תוצאות
עבור תאים B הפצת על קיבוע אנטי-Ig, מיקרוסקופ STED בשילוב עם תוכנת deconvolution מספק תמונות ברזולוציה גבוהה של מבנים cytoskeletal מאשר מיקרוסקופיה קונפוקלית. זה מתבטא, איור 1, שם הרשת F-אקטין היה visualized באמצעות הפרוטוקול המתואר לעיל. השוואה של קונאפוקלית ו STED תמונות ברזולוציה-העל של אותו לטעום מראה התמונות STED בעלי רזולוציה גבוהה יותר ולחשוף מפורט יותר מבנים של שלד התא אקטין (איור 1). איור זה מציג גם deconvolution הזה חיוני להשגת תמונות STED באיכות גבוהה באקטין אילו חוטים מוגדרים באופן ברור יותר. למרות deconvolution של תמונות קונאפוקלית התשואות לשיפור משמעותי ברמת הרזולוציה של התמונה, תמונות STED deconvolved מספקים מידע מבני מפורט יותר מאשר תמונות וידאו deconvolved. בפרט, המבנה הדנדריטי של הטבעת F-אקטין היקפיים מתגלה ביתר פירוט על ידי מיקרוסקופ STED (איור 1 ואיור 2). הרשת microtubule באתר קשר אנטיגן גם צולמה באמצעות הכנת המדגם והדמיה פרוטוקול המתואר לעיל (איור 3). Microtubules מקורן נקודה מרכזית, המהווה MTOC, לנבוע מסובבת כלפי חוץ כלפי הפריפריה של התא. בניסוי זה, בתאי B הורשו למרוח אותו על coverslips אנטי איג-מצופים למשך 15 דקות (איור 3), נקודת זמן שבה עברה MTOC כלפי האתר קשר אנטיגן17. ניתן לראות קליפ-170-GFP אשכולות לסמן הפלוס-סוף microtubules בקצות microtubules המוצגת באיור3. בעת הכנת הדוגמא והדמיה STED של הרשת microtubule הוא אופטימלי, רציף ומובחנת microtubules שנצפו, עם קליפ-170-GFP לשפות אחרות לאורך microtubules או בקצוות הפלוס-(איור 3 א). תת אופטימלית microtubule מכתים, אשר נצפתה כאשר באמצעות ריכוז נמוך יותר של צביעת נוגדנים או קבוצות של α-טובולין נוגדנים כי הם יותר בגיל שנה תוצאות microtubules המופיעים מקטעים מקוטע נפתרות לקוי על deconvolution (איור 3B; ראה גם איור 5C). למרות כל קרינה פלואורסצנטית הקליפ-170-GFP בתמונות האלה משויך מבנים α-טובולין-immunostained, אחד אינו מסוגל להבחין בין אם הסרטון-170-GFP ממוקם בקצוות פלוס, או לאורכו של microtubules, עקב ההכתמה לא שלם של microtubules. לכן חשוב כי הנוגדן α-טובולין אחסנה היצרן מומלץ תנאי אחסון ומשמש תוך שנה אחת.
באמצעות פרוטוקול זה, תמונות STED צבע רב באיכות גבוהה שמראים את הארגון ואת המבנה של שלד התא של אקטין microtubule רשת, וכן חלבונים כגון IQGAP1 וקליפ-170 לשייך אלה שני cytoskeletons17, יכול להיות רכש. תמונות STED באיור 4 הצג את הטבעת ההיקפית של אקטין דנדריטים, כמו גם microtubules הבוקעות במיקום מרכזי בתא שבו ההכתמה אקטין הוא הרבה פחות צפוף. קליפ-170-GFP בקצות microtubules אלה קשורה מאוד היקפי של F-אקטין. פרוטוקול זה מאפשר להמחיש מבנים cytoskeletal ב הסינפסה המערכת החיסונית באמצעות צבע יחיד STED הדמיה (איור 2) או STED ססגוניות הדמיה (איור 3 ו- 4 באיור). עם זאת, יש לציין כי צבע בודד STED הדמיה (איור 2), תניב רזולוציה טובה יותר של מבנים אקטין, microtubules בתאי B מאשר צבע רב STED (איור 4). זה יכול להיות בגלל photobleaching נגרם על-ידי ייבוא תמונות STED רציפים עבור fluorophores שונים. כדי לקבל את התמונות הטובות ביותר של סופר רזולוציה, השילוב של fluorophores וחלבונים פלורסנט נבחר, כמו גם את הרצף שבו הם נמצאים עם תמונה באמצעות עירור, דלדול הלייזרים, צריך להיות אופטימיזציה עבור המדגם. ובכל זאת, צבע רב STED הדמיה מספקת תמונות ברזולוציה גבוהה של המבנים cytoskeletal מאשר קונפוקלית קונבנציונלי. בנוסף, אחת בעלת צבע אחד STED ניתן לרכוש תמונות סופר-ברזולוציה תלת-ממדי של כל התא B אקטין או microtubule הרשת (1 סרטים).
כאשר באמצעות תאים transfected עם חלבונים פיוז'ן פלורסנט, להשגת רמות הביטוי אופטימלית והימנעות חפצים בשל ביטוי הם שיקולים משמעותית. בתאים שבהם הוא overexpressed קליפ-170-GFP, נוצרים אגרגטים גדולים של קליפ-170-GFP (איור 5A). בנוסף זה mislocalization של קליפ-170-GFP, רק חלק מהרשת microtubule בתא זה היה בתוך המטוס מוקד הקרוב ביותר coverslip (איור 5B). הדבר מצביע על כי ביטוי קליפ-170 עלולה גם לפגוע MTOC BCR-induced קיטוב. לעומת זאת, כי אותות חזקים פלורסצנטיות נדרשים בדרך כלל עבור רכישת תמונות STED באיכות גבוהה, ביטוי נמוך של פיוז'ן פלורסנט חלבונים כגון קליפ-170-GFP (איור 5C) תוצאות תמונות באיכות ירודה. לפיכך, בעת שימוש בתאים יש כבר transfected עם חלבונים פלורסנט, חשוב לשיקוף תאים המכילים רמות אופטימלית ביטוי חלבון פיוז'ן בלבד. חשוב גם לציין כי הפרוטוקול תרביות תאים שבו נעשה שימוש עבור A20 תאים (ראה טבלה של חומרים) בדרך כלל תוצאות 20-50% של תאים המבטאים החלבון transfected. על פלסמיד ה-DNA (בניגוד siRNAs), תרביות תאים תדרי תאים B הראשי הם לעתים קרובות הרבה נמוך יותר עבור תאים A20, הדרישה לשימוש של תא B קווים. עם זאת, תמונות באיכות גבוהה STED של אלמנטים cytoskeletal בתאי B הראשי untransfected ניתן להשיג באמצעות פרוטוקול זה (איור 6).
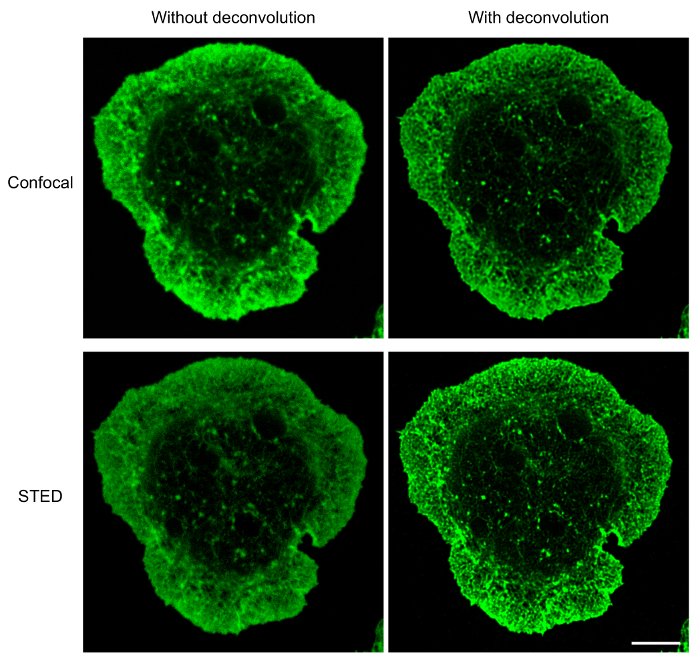
איור 1: השוואה בין קונאפוקלית והדימות STED של F-אקטין. קונאפוקלית תמונות (למעלה) ותמונות STED (התחתון) של תא A20 זה התפשט על coverslips נגד אג-מצופים למשך 15 דקות לפני להיות מוכתם phalloidin מצומדת אלקסה עבור חיל הים 532. באמצעות מיקרוסקופ קונפוקלי STED, באותו התא צולמה לראשונה לפי מיקרוסקופיה קונפוקלית ולאחר מכן לפי STED. אות וידאו ותמונות STED מוצגים, יחד עם אותו קונאפוקלית ו STED תמונות לאחר deconvolution. סרגל קנה מידה: 5 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2: שלד התא אקטין באתר קשר אנטיגן. בתאים A20 היו נותנים למרוח אותו על coverslips נגד אג-מצופים למשך 15 דקות היו מוכתמים phalloidin מצומדת אלקסה עבור חיל הים 568, עם תמונה על ידי מיקרוסקופ STED. הדימויים STED הראשוני היו deconvolved. לוחות A-B ולוחות C-E להראות להחליפן בתמונות של שני תאים שונים. פאנל E מראה של הגדלה X 3 של האזור בתיבת הלבנים בחלונית C. סולם בר עבור לוחות A-D: 5 מיקרומטר. סולם בר עבור לוח אלקטרוני: 1 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
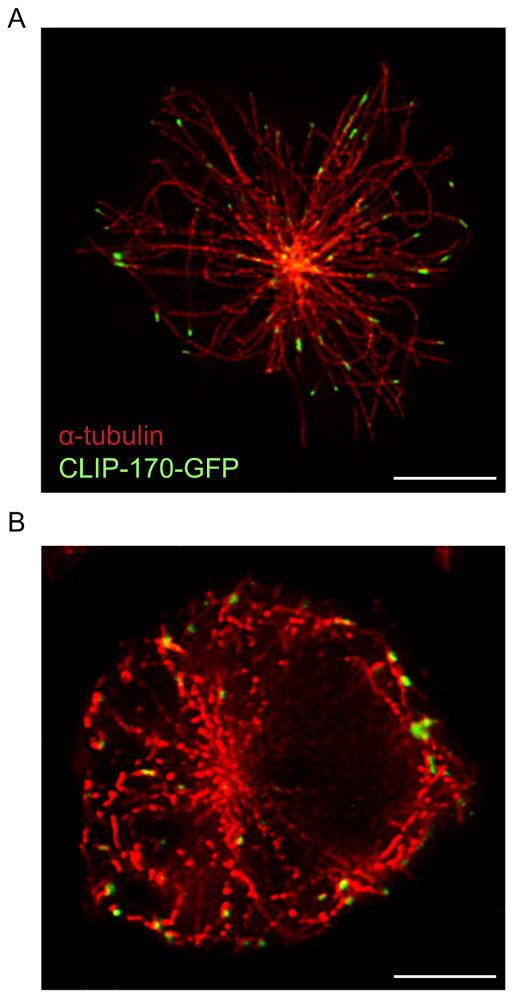
איור 3: STED תמונות של רשת microtubule וקליפ-170-GFP. בתאים A20 לבטא סרטון-170-GFP הורשו להתפשט על coverslips נגד אג-מצופים למשך 15 דקות לפני להיות קבוע, immunostained עם נוגדן α-טובולין בתוספת נוגדן משני מצומדת אלקסה עבור חיל הים 532. (א) תמונת הנציגה מציג immunostaining של הרשת microtubule, עם קליפ-170-GFP הממוקמים בעיקר בקצות הפלוס-microtubules. צביעת תת אופטימלית (B) והרזולוציה של microtubules עקב השימוש מלאי מיושן של נוגדן α-טובולין. גודל ברים: 5 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
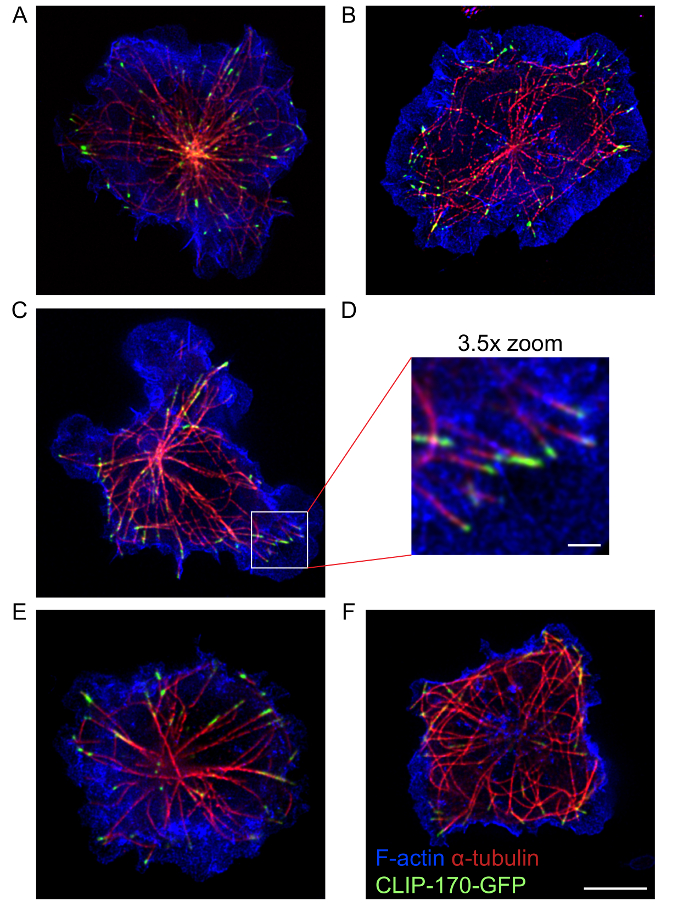
איור 4: תמונות STED של cytoskeletons אקטין, microtubule. בתאים A20 לבטא סרטון-170-GFP הורשו למרוח אותו על coverslips נגד אג-מצופים למשך 15 דקות לפני להיות קבוע, צבעונית עם phalloidin מצומדת אלקסה עבור חיל הים 568 להמחיש F-אקטין, ועם נוגדן α-טובולין בתוספת של אלקסה עבור חיל הים 532-מצומדת נוגדנים משניים להמחיש microtubules. לוחות A-D ולוחות E-F מראים להחליפן בתמונות של שני תאים שונים. לוח ד הוא הגדלה X 3.5 של האזור בתיבת הלבנים בחלונית C. גודל ברים: 5 מיקרומטר לפאנלים A-C ו- E-F; 1 מיקרומטר לחלונית D. התמונה בפאנל A באותה התמונה בשימוש איור 3A אך כוללת הכיסוי של הערוץ F-אקטין. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 5: דוגמאות של תמונות STED באיכות ירודה בשל ביטוי או ביטוי לא מספיקות של החלבון פיוז'ן GFP. בתאים A20 לבטא סרטון-170-GFP הורשו למרוח אותו על coverslips נגד אג-מצופים למשך 15 דקות לפני להיות קבוע והמוכתמות כמו באיור 4. (A, B) קליפ-170-GFP ביטוי בתוצאות אגרגטים גדולים, חריג של קליפ-170-GFP (א) וקיטוב MTOC לקוי כלפי הקשר אנטיגן באתר (B). (ג) מפצה על ביטוי לא מספיק קליפ-170-GFP על ידי הגדלת כוח לייזר התוצאות בתמונות STED באיכות ירודה. גודל ברים: 5 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 6: STED דימוי שלד התא microtubule בתאי B הראשי. בתאי B הטחול העיקרי היו תרבותי 6 שעות עם 5 ng/µL BAFF בתוספת 2.5 µg/mL LPS, אז מותר להפיץ למשך 15 דקות על coverslips זה היה כבר מצופה נוגדנים anti-IgM. התאים ולאחר מכן קבועה, צבעונית עם נוגדן α-טובולין בתוספת נוגדן משני מצומדת אלקסה עבור חיל הים 568 להמחיש microtubules. תמונת הנציגה מוצג. סרגל קנה מידה: 5 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

סרט 1: שחזור תלת-ממד של הרשת microtubule תא B. בתאים A20 הורשו להתפשט על אנטי-אג-מצופה coverslips למשך 15 דקות לפני להיות קבוע, immunostained עם נוגדן α-טובולין בתוספת נוגדן משני מצומדת אלקסה 488 עבור חיל הים. Z-פרוסות נלכדו בגדלים שלב מיקרומטר 0.2 סה"כ 37 מסגרות. שחזור תלת-ממדית נעשתה באמצעות המיקרוסקופ STED של הדמיה בתוכנה. אנא לחץ כאן כדי לצפות בסרטון. (לחיצה ימנית כדי להוריד.)
Discussion
תמונות מפורט של מבנים cytoskeletal יכולה להיות מושגת באמצעות מיקרוסקופ סופר רזולוציה STED, אשר באופן תיאורטי ניתן להשיג רזולוציה של 50 ננומטר, בהשוואה קונפוקלית קונבנציונאלי, אשר הינו הפתרון עקיפה-מוגבלת ~ 200 ננומטר 24. היכולת לפתור מבנים עדינה יותר בהמשך משופרת באמצעות deconvolution תוכנה לחישוב המיקום סביר של מקור האור המקורי האות שנצפה זריחה "מטושטש". פרוטוקול זה מתאר שיטות לשימוש STED תמונה של אקטין, microtubule cytoskeletons, וכן חלבונים הקשורים שלד התא.
תא b הפעלה גורם שיפוץ של שלד התא של אקטין והן הרשת microtubule, עם ויסות מתואם cytoskeletons שני להיות חשוב עבור המערכת החיסונית סינפסה היווצרות17,42. השיטה שאנו מציגים מוטבה בו-זמנית הדמיה cytoskeletons אקטין, microtubule אנטיגן באתר קשר באמצעות צבע רב STED, אבל הוא ישים באותה מידה עבור צבע יחיד STED. מחקרים קודמים שערכנו על גולת שלד התא B cell STED יכולה לספק תובנות חדשות מבנים הסלולר כיצד מאורגנים, איך הם לתקשר אחד עם השני. באמצעות מיקרוסקופ קונפוקלי והמוחלט פלורסצנטיות פנימית (TIRF), היה הבחנו microtubules קשר עם הטבעת של F-אקטין בפריפריה של האתר קשר אנטיגן17. באמצעות מיקרוסקופ STED, הצלחנו להראות כי קצות פלוס microtubules כי סומנו על ידי + טיפ קליפ-170 מקרוב לשייך הרשת אקטין דנדריטים בפריפריה התא (ראה איור 4).
גורמים רבים משפיעים על איזה טכניקת דימות מתאימה ביותר עבור יישומים ספציפיים של אחד. אלה כוללים את הרזולוציה הדרושה, המבנים לדימות, הטכניקה תיוג ו שלו יחס אות לרעש (קרי, חדות), רכישת זמן, להקל על הכנת הדוגמא ולאחר הפארמצבטית. הכנת הדוגמא על STED אינה שונה באופן משמעותי מאשר עבור מיקרוסקופיה קונפוקלית, היא משלבת רזולוציה גבוהה עם ייבוא תמונות מהירה. היתרון העיקרי של STED הוא זה תהליך אופטי שבו התמונה נרכשת ישירות מן המדגם, ניתן להתאים את הרזולוציה על-ידי שינוי עוצמת לייזר STED24. בניגוד בקרקע דלדול סופר-רזולוציה מיקרוסקופ, אשר משחזר תמונות מתוך אלפי תמונות רצופות לוכדת, עיבוד חישובית מקיף אינה נדרשת STED, נמנעת כניסתה של תמונת שחזור פריטים 24. עם זאת, הניגוד בתמונות STED הוא לעתים קרובות נמוכה24, בעיבוד תמונה שלאחר המקרה אשר באמצעות תוכנה כגון ImageJ עשוי להיות נחוץ כדי לשפר את הניגודיות. זה חשוב במיוחד עבור תמונות במבנים צפופים, כגון רשת אקטין דנדריטים. כדי לשפר את הניגוד בתמונה במהלך ייבוא תמונות, אחד יכול להפחית את עוצמת הלייזר דלדול ו/או להחיל קו או מסגרת בממוצע. ממותגת זמן STED, אשר לוכדת פוטונים לאחר השהיית זמן מערכת-המשתמש, באפשרותך להגדיל את הרזולוציה על ידי הפחתת האזור שממנו פוטונים נמצאים שנאספו24,43. אנו ממליצים שתמטב ההדמיה STED של מבנים cytoskeletal על הסינפסה המערכת החיסונית באמצעות שילוב של שיטות אלה כדי לשפר את הניגודיות והרזולוציה.
כיום, לא כל fluorophores הן אופטימלית עבור הדמיה עם STED, לא כל השילובים fluorophore מתאימים להשגת צבע רב STED תמונות. ההתאמה זהיר של טווחים זיהוי חשוב להבטחת מינימלי בליד-דרך של fluorophores לתוך ערוצי סמוכים. השילוב של fluorophores בשימוש פרוטוקול זה (כלומר, ה-GFP, אלקסה עבור חיל הים 532 ו אלקסה עבור חיל הים 568) הוא אופטימלי הדמיה ברזולוציה סופר STED ססגוניות. לעומת תאורה מובנית מיקרוסקופ (SIM), שיטות לוקליזציה מולקולה בודדת (SMLM), כמו הסבת מופעל צילום מיקרוסקופ (דקל), STED אינו בדרך כלל אידיאלי עבור צבע רב הדמיה. עם זאת, אנו מראים כאן את רוויית יתר קלה של זיהוי fluorophore, מזווג עם עיבוד כלי תמונה פשוטה, יכולים לספק תמונות ברזולוציה גבוהה צבע רב של cytoskeletons אקטין, microtubule.
פרוטוקול זה עבור STED הדמיה של מבנים cytoskeletal חשף פרטים חדשים לאדריכלות cytoskeletal על הסינפסה המערכת החיסונית תא B. למרות שאנחנו אופטימיזציה פרוטוקול זה הדמיה cytoskeletons אקטין, microtubule אנטיגן-צור קשר באתר בתאי B, שיטות אלה צריך להיות החלים על סוגי תאים אחרים, במיוחד תאי המערכת החיסונית (תאי T, תאי NK, תאי פיטום, וכו ') כי הטופס הסינפסות המערכת החיסונית. יתר על כן, אפשרות להאריך את התועלת של פרוטוקול זה כדי ציפוי על coverslips ליגנדים או דבק מצעים אחרים. עם זאת, חשוב למטב את הפרוטוקול ואת ההגדרות רכישת התמונה עבור סוג התא ואת את הסידור ניסיוני.
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו מודים המתקן הדמיה מכון מדעי החיים UBC (LSI) תמיכה ולשמירה על המיקרוסקופ STED. עבודה זו מומן על ידי מענק #68865 מן המכון הקנדי של בריאות המחקר (M.R.G.). אנו מודים Kozo Kaibuchi ד ר (אוניברסיטת נאגויה, נגויה, יפן) על פלסמיד הקליפ-170-GFP.
Materials
| Name | Company | Catalog Number | Comments |
| Cell culture | |||
| A20 mouse B-lymphoma cells | ATCC | TIB-208 | Murine B-cell lymphoma of Balb/c origin that expresses an IgG-containing BCR on its surface |
| RPMI-1640 | Thermo Fisher Scientific | R0883 | |
| Fetal bovine serum | Thermo Fisher Scientific | 12483020 | Heat inactivate at 56 oC for 30 min |
| 2-mercaptoethanol | Millipore Sigma | M3148 | |
| Glutamine | Millipore Sigma | G5763 | |
| Sodium pyruvate | Millipore Sigma | P5280 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | Liquid, 10,000 units |
| Additional materials for primary B cells | |||
| 70-µm cell strainer | Corning | 352350 | |
| Magnetic bead-based B cell isolation kit | Stemcell Technologies | 19854 | EasySep Mouse B cell Isolation kit |
| Lipopolysaccharide (LPS) | Millipore Sigma | L4391 | LPS from E. coli 0111:B4 |
| B cell-activating factor (BAFF) | R&D Systems | 2106-BF-010 | |
| Name | Company | Catalog Number | Comments |
| Transfection | |||
| Plasmid encoding CLIP-170-GFP | Gift from Dr. Kozo Kaibuchi (Nagoya Univ., Nagoya, Japan); described in Fukata et al. Cell 109:873-885, 2002 | ||
| Recommended transfection reagents and equipment | |||
| Amaxa Nucleofection kit V | Lonza | VCA-1003 | Follow the manufacturer's directions for mixing the transfection reagents with the DNA |
| Amaxa Nucleofector model 2b | Lonza | AAB-1001 | Program L-013 used |
| Falcon 6-well plates, TC treated, sterile | Corning | 353046 | |
| Name | Company | Catalog Number | Comments |
| Coating coverslips | |||
| 18-mm diameter round #1.5 cover glasses | Thomas Scientific | 1217N81 | Similar product: Marienfield-Superior catalogue #117580 |
| Forceps | Fisher Scientific | 1381242 | Dissecting extra fine splinter forceps |
| Falcon 12-well sterile tissue polystyrene tissue culture plate | Corning | 353043 | |
| 100% methanol | Fisher Scientific | A412-4 | |
| Sterile phosphate buffered saline (PBS) without calcium or magnesium | Thermo Fisher Scientific | 10010049 | |
| Goat-anti-mouse IgG antibody | Jackson ImmunoResearch | 115-005-008 | For A20 cells |
| Goat-anti-mouse IgM antibody | Jackson ImmunoResearch | 115-005-020 | For primary mouse B cells |
| Name | Company | Catalog Number | Comments |
| Staining | |||
| Paraformaldehyde (16% stock solution) | Electron Microscopy Sciences | 15710 | Dilute with PBS to working concentration |
| Glutaraldehyde (50% stock solution) | Millipore Sigma | 340855 | Dilute with PBS to working concentration |
| Triton X-100 | Fisher Scientific | BP151-500 | |
| Saponin | Millipore Sigma | S2149 | |
| Bovine serum albumin (BSA), Fraction V | Millipore Sigma | 10735094001 | |
| Rabbit anti-tubulin antibody | Abcam | ab52866 | 1:250 dilution recommended but should be optimized |
| Alexa Fluor 532-conjugated goat anti-rabbit IgG | Thermo Fisher Scientific | A11009 | 1:100 dilution recommended but should be optimized |
| Alexa Fluor 568-conjugated phalloidin | Thermo Fisher Scientific | A12380 | 1:100 dilution recommneded but should be optimized |
| Prolong Diamond Antifade Mountant | Thermo Fisher Scientific | P36970 | Without DAPI |
| Fisherbrand Superfrost Plus Microscope Slides | Fisher Scientific | 12-550-15 | |
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Parafilm | VWR | P1150-2 | |
| HEPES | Millipore Sigma | H3375 | |
| NaCl | Fisher Scientific | BP358 | |
| KCl | Millipore Sigma | P9333 | |
| CaCl2 | Millipore Sigma | C1016 | |
| Na2HPO4 | Fisher Scientific | S374-500 | |
| MgSO4 | Fisher Scientific | M63 | |
| Dextrose | Fisher Scientific | D16-500 | |
| Name | Company | Catalog Number | Comments |
| Microscopy | |||
| Leica SP8 TCS STED microscope | Leica | ||
| Huygens deconvolution software | Scientific Voume Imaging | See https://svi.nl/HuygensProducts |
References
- Harwood, N. E., Batista, F. D. The cytoskeleton coordinates the early events of B-cell activation. Cold Spring Harb Perspect Biol. 3 (2), a002360 (2011).
- Batista, F. D., Treanor, B., Harwood, N. E. Visualizing a role for the actin cytoskeleton in the regulation of B-cell activation. Immunol Rev. 237 (1), 191-204 (2010).
- Harwood, N. E., Batista, F. D. Early events in B cell activation. Annu Rev Immunol. 28, 185-210 (2010).
- Batista, F. D., Harwood, N. E. The who, how and where of antigen presentation to B cells. Nat Rev Immunol. 9 (1), 15-27 (2009).
- Kumari, S., et al. T cell antigen receptor activation and actin cytoskeleton remodeling. Biochim Biophys Acta. 1838 (2), 546-556 (2014).
- Dustin, M. L. Visualization of Cell-Cell Interaction Contacts: Synapses and Kinapses. Self Nonself. 2 (2), 85-97 (2011).
- Dustin, M. L., Chakraborty, A. K., Shaw, A. S. Understanding the Structure and Function of the Immunological Synapse. Cold Spring Harb Perspect Biol. 2 (10), a002311 (2010).
- Dustin, M. L. Modular design of immunological synapses and kinapses. Cold Spring Harb Perspect Biol. 1 (1), a002873 (2009).
- Dustin, M. L. Visualization of cell-cell interaction contacts-synapses and kinapses. Adv Exp Med Biol. 640, 164-182 (2008).
- Dustin, M. L. Hunter to gatherer and back: immunological synapses and kinapses as variations on the theme of amoeboid locomotion. Annu Rev Cell Dev Biol. 24, 577-596 (2008).
- Dustin, M. L. T-cell activation through immunological synapses and kinapses. Immunol Rev. 221, 77-89 (2008).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Monks, C. R., et al. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Yuseff, M. I., et al. How B cells capture, process and present antigens: a crucial role for cell polarity. Nat Rev Immunol. 13 (7), 475-486 (2013).
- Mattila, P. K., Batista, F. D., Treanor, B. Dynamics of the actin cytoskeleton mediates receptor cross talk: An emerging concept in tuning receptor signaling. J Cell Biol. 212 (3), 267-280 (2016).
- Kuhn, J. R., Poenie, M. Dynamic polarization of the microtubule cytoskeleton during CTL-mediated killing. Immunity. 16 (1), 111-121 (2002).
- Wang, J. C., et al. The Rap1-cofilin-1 pathway coordinates actin reorganization and MTOC polarization at the B cell immune synapse. J Cell Sci. 130 (6), 1094-1109 (2017).
- Schnyder, T., et al. B cell receptor-mediated antigen gathering requires ubiquitin ligase Cbl and adaptors Grb2 and Dok-3 to recruit dynein to the signaling microcluster. Immunity. 34 (6), 905-918 (2011).
- Nath, S., et al. Dynein Separately Partners with NDE1 and Dynactin To Orchestrate T Cell Focused Secretion. J Immunol. 197 (6), 2090-2101 (2016).
- Combs, J., et al. Recruitment of dynein to the Jurkat immunological synapse. Proc Natl Acad Sci U S A. 103 (40), 14883-14888 (2006).
- Akhmanova, A., Steinmetz, M. O. Control of microtubule organization and dynamics: two ends in the limelight. Nat Rev Mol Cell Biol. 16 (12), 711-726 (2015).
- Akhmanova, A., Steinmetz, M. O. Microtubule +TIPs at a glance. J Cell Sci. 123 (20), 3415-3419 (2010).
- Fukata, M., et al. Rac1 and Cdc42 capture microtubules through IQGAP1 and CLIP-170. Cell. 109 (7), 873-885 (2002).
- Wegel, E., et al. Imaging cellular structures in super-resolution with SIM, STED and Localisation Microscopy: A practical comparison. Sci Rep. 6, 27290 (2016).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu Rev Biochem. 78, 993-1016 (2009).
- Mace, E. M., Orange, J. S. Dual channel STED nanoscopy of lytic granules on actin filaments in natural killer cells. Commun Integr Biol. 5 (2), 184-186 (2012).
- Ritter, A. T., et al. Actin depletion initiates events leading to granule secretion at the immunological synapse. Immunity. 42 (5), 864-876 (2015).
- Tamarit, B., et al. Membrane microdomains and cytoskeleton organization shape and regulate the IL-7 receptor signalosome in human CD4 T-cells. J Biol Chem. 288 (12), 8691-8701 (2013).
- Brown, A. C., et al. Super-resolution imaging of remodeled synaptic actin reveals different synergies between NK cell receptors and integrins. Blood. 120 (18), 3729-3740 (2012).
- Dupre, L., et al. T Lymphocyte Migration: An Action Movie Starring the Actin and Associated Actors. Front Immunol. 6, 586 (2015).
- Rak, G. D., et al. Natural killer cell lytic granule secretion occurs through a pervasive actin network at the immune synapse. PLoS Biol. 9 (9), e1001151 (2011).
- Lin, K. B., et al. The Rap GTPases regulate the migration, invasiveness and in vivo dissemination of B-cell lymphomas. Oncogene. 29 (4), 608-615 (2010).
- Lin, K. B., et al. The rap GTPases regulate B cell morphology, immune-synapse formation, and signaling by particulate B cell receptor ligands. Immunity. 28 (1), 75-87 (2008).
- McLeod, S. J., et al. The Rap GTPases regulate integrin-mediated adhesion, cell spreading, actin polymerization, and Pyk2 tyrosine phosphorylation in B lymphocytes. J. Biol. Chem. 279 (13), 12009-12019 (2004).
- Christian, S. L., et al. Activation of the Rap GTPases in B lymphocytes modulates B cell antigen receptor-induced activation of Akt but has no effect on MAPK activation. J Biol Chem. 278 (43), 41756-41767 (2003).
- Batista, F. D., Iber, D., Neuberger, M. S. B cells acquire antigen from target cells after synapse formation. Nature. 411 (6836), 489-494 (2001).
- Treanor, B., et al. Dynamic cortical actin remodeling by ERM proteins controls BCR microcluster organization and integrity. J Exp Med. 208 (5), 1055-1068 (2011).
- Mattila, P. K., et al. The actin and tetraspanin networks organize receptor nanoclusters to regulate B cell receptor-mediated signaling. Immunity. 38 (3), 461-474 (2013).
- Yuseff, M. -. I., et al. Polarized Secretion of Lysosomes at the B Cell Synapse Couples Antigen Extraction to Processing and Presentation. Immunity. 35 (3), 361-374 (2011).
- Mace, E. M., Orange, J. S. Visualization of the immunological synapse by dual color time-gated stimulated emission depletion (STED) nanoscopy. J Vis Exp. (85), (2014).
- Russ, J. C. . The Image Processing Handbook, Sixth Edition. , (2011).
- Stinchcombe, J. C., et al. Centrosome polarization delivers secretory granules to the immunological synapse. Nature. 443 (7110), 462-465 (2006).
- Vicidomini, G., et al. Sharper low-power STED nanoscopy by time gating. Nat Methods. 8 (7), 571-573 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved