Method Article
Visualización de la actina y los microtúbulos citoesqueletos en la sinapsis inmune de células B mediante microscopía de emisión (STED) el agotamiento
En este artículo
Resumen
Presentamos un protocolo para el uso de microscopia de STED simultáneamente las estructuras de actina imagen, microtúbulos y proteínas microtubule plus final en las células de B que se han diseminado en cubreobjetos recubierto con anticuerpos contra el receptor de células B, un modelo para la fase inicial de formación de la sinapsis inmune.
Resumen
Las células de B que se unen a los antígenos de membrana (p. ej., en la superficie de una célula presentadora de antígeno) forman una sinapsis inmune, una estructura celular especializada que optimiza la señalización de receptores (BCR) de células B y adquisición de antígeno mediada por BCR. La remodelación del citoesqueleto de la actinia y la reorientación de la red de microtúbulos hacia el sitio de contacto del antígeno son esenciales para la formación de la sinapsis inmune. Remodelación del citoesqueleto de actina en un anillo denso periférico de la F-actina se acompaña de polarización del centro organizador de microtúbulos hacia la sinapsis inmune. Proteínas de microtúbulos plus final, así como proteínas cortical final plus captura median interacciones físicas entre los citoesqueletos de actina y microtúbulos, que permitan reorganizar de manera coordinada. Elucidar los mecanismos que esta reorganización del citoesqueleto, así como entender cómo estas estructuras citoesqueléticas forma formación de sinapsis inmune BCR de señalización, de control pueden proporcionar nuevas visiones en la activación de la célula de B. Esto ha sido ayudado por el desarrollo de enfoques de microscopía de superresolución que revelan nuevos detalles de organización en red citoesquelética. Aquí describimos un método para el uso de microscopia de agotamiento (STED) emisión estimulada simultáneamente las estructuras de actina imagen, microtúbulos y transfected microtúbulos tagged GFP plus final proteínas en las células de B. Para modelar los acontecimientos tempranos en la formación de sinapsis inmune, permitimos que las células de B untar en cubreobjetos recubierto con anticuerpos de anti-inmunoglobulinas (anti-Ig), que inician BCR señalización y remodelación del citoesqueleto. Ofrecemos protocolos paso a paso para expresar proteínas de la fusión de GFP en células de linfoma B de A20, para la difusión de anti-Ig-inducida de la célula y para la fijación posterior de la célula, Immunostaining, adquisición de imágenes y pasos de deconvolución de imagen. Las imágenes de alta resolución obtenidas mediante estos procedimientos permiten visualizar simultáneamente estructuras de actina, microtúbulos y las microtúbulos plus final proteínas que pueden vincular estas dos redes citoesqueléticas.
Introducción
Cuando las células B se unen a polarizado matrices de antígenos (por ejemplo, aparece en la superficie del antígeno que presenta las células (APCs)), el resultante receptor de células B (BCR) la formación de una estructura de la sinapsis inmune clásico, que era el primer descrita en las unidades de señalización T las células1,2,3,4,5,6,7,8,9,10, 11,12,13. Inicialmente, micromasas de forma de BCR antígeno-limita en la periferia del sitio contacto B celular: APC. Estas micromasas luego moverse hacia el centro del sitio contacto antígeno, donde ellos se fusionan en un grupo central de activación supramolecular (cSMAC) que forma la base de la sinapsis inmune. Formación de sinapsis inmune optimiza el BCR señalización y facilita la extracción de antígeno mediada por BCR de membrana APC14. Esta adquisición de antígeno, que es seguida por internalización mediada por BCR antígeno y el antígeno subsecuente procesamiento, permite a las células B presentan péptido: MHC complejos II a las células T y obtener ayuda de la célula de T14. Porque promueve la formación de sinapsis inmune activación de células B, elucidar los mecanismos que establecen que este patrón funcional de la organización del receptor puede proporcionar nuevas penetraciones en la respuesta inmune humoral cómo se inició y regulados.
Reorganización de la actina y los microtúbulos citoesqueletos es esencial para la formación de la sinapsis inmune. BCR localizado señalización estimulada por una variedad espacial polarizado de antígenos induce la rápida y espectacular remodelación del citoesqueleto actina1,15. La formación de estructuras dendríticas de la actina en la periferia de la célula de B ejerce fuerzas de empuje en la membrana plasmática y promueve la difusión de la célula de B. Esto permite a la célula de B explorar un área mayor de la superficie de cojinete de antígeno y aumenta el número de BCR que se unen antígeno y activar vías de señalización del BCR. Al mismo tiempo, la COMT y la red de microtúbulos son reorientados hacia el sitio de contacto del antígeno. Como el MTOC aproxima el sitio de contacto del antígeno, los microtúbulos que emanan de la COMT se extienden a lo largo de la cara interna de la membrana plasmática en la interfase entre la célula de B y la superficie de cojinete de antígeno16,17. Estos microtúbulos juxtamembrane pueden entonces actuar como vías para el movimiento centrípeto de antígeno-limita BCR micromasas18, conduciendo a la formación de un cSMAC mediado por dineína.
La reorientación y la polarización de la COMT hacia la sinapsis inmune requiere actina intacto y citoesqueletos de microtúbulos y a menudo depende de las interacciones entre la actina cortical red y microtúbulos16,17, 19,20. Proteínas de unión a actina corticales, como IQGAP1, pueden capturar microtúbulos interactúan con complejos proteínicos que decoran los microtúbulos más extremos21. Estos dinámicos complejos de proteínas final plus incluyen EB1 y CLIP-170, que se refieren colectivamente como microtúbulos plus-final seguimiento de proteínas (+ consejos)21,22. + Puntas en los extremos de los microtúbulos pueden atar a las proteínas que están asociadas con la membrana plasmática o con el citoesqueleto de actina cortical. Esto permite mecanismos de generación de fuerza (p. ej., al final menos dirigió movimiento de dineína cortical anclados a lo largo de los microtúbulos) ejercen fuerzas de tracción en microtúbulos, y así reposicionar el MTOC. CLIP-170 puede unir a la proteína de andamiaje de actina asociados IQGAP123, y hemos demostrado que ambas de estas proteínas son necesarios para la polarización inducida por el BCR MTOC hacia la sinapsis inmune17. Esta interacción IQGAP1-CLIP-170 puede jugar un papel clave en la coordinación de la remodelación del citoesqueleto de actina con la reposición de la red de microtúbulos en la sinapsis inmune de células B.
Microscopía de fluorescencia convencional ha puesto de manifiesto la dramática reorganización de los citoesqueletos de actina y microtúbulos en células B sinapsis inmune formación2. Sin embargo, este enfoque no puede resolver estructuras celulares pequeños detalles debido al límite de difracción de la luz, que, conforme a la ley de Abbe, depende de la longitud de onda de la luz utilizada para iluminar la muestra y la abertura del objetivo24. Este límite de difracción limita la resolución de los microscopios de luz convencionales a 200-300 nm en la dirección lateral y 500-700 nm en la dirección axial25. Por lo tanto, pequeñas estructuras subcelulares, así como los detalles de los citoesqueletos de actina y microtúbulos, sólo se pudieran observar mediante microscopía electrónica. Proyección de imagen de microscopia electrónica del citoesqueleto es lento, requiere protocolos de fijación y preparación muestra áspero que pueden alterar las estructuras biológicas y se limita a la detección de anticuerpo-mediada. La habilidad de immunostain y simultáneamente imagen múltiples proteínas o estructuras celulares es una ventaja sustancial de microscopía de fluorescencia. Además, la expresión de proteínas fluorescentes de fusión en las células permite la proyección de imagen en tiempo real y es útil cuando no hay anticuerpos efectivos para la inmunotinción de la proteína de interés.
Recientes avances tecnológicos en microscopía de superresolución superar los límites de la difracción de la luz y permite la visualización de las estructuras celulares de nanoescala24. Una tal técnica de microscopía de resolución súper se llama estimulante de la emisión (STED) agotamiento de la microscopia. STED utiliza dos rayos láser, donde un láser excita el fluoróforo y un segundo láser con un patrón en forma de dona suprime selectivamente la emisión de fluorescencia en el fluoróforo. Esto reduce la función de punto de extensión (área aparente) de una sola partícula fluorescente y proporciona una secundario-difracción límite imagen fluorescente25,26. Microscopía-estado de agotamiento también emplea técnicas basadas en fluorescencia para adquirir imágenes de súper resolución. Sin embargo, los tiempos de adquisición y reconstrucción de imágenes largos, hay sólo un número limitado de fluoróforos que pueden utilizarse y la proyección de imagen alta resolución simultánea de múltiples componentes citoesqueléticos técnicamente es difícil porque mantener estructuras de actina y microtúbulos requiere fijación diferentes procedimientos. Por lo tanto, STED tiene múltiples ventajas sobre la microscopía electrónica y otra microscopía de superresolución enfoques que ofrece la adquisición de imágenes rápido, tiene requisitos mínimos del post-processing y emplea el mismo fluoróforos y técnicas de tinción se utilizan para microscopía de fluorescencia convencional de muestras fijadas26.
Microscopia de la estupendo-resolución ya ha sido utilizada para visualizar estructuras de actina en la sinapsis inmune en células de naturales del asesinas (NK) y26,de las células de T27,de29,de28,30, 31. sin embargo, la proyección de imagen de súper-resolución del citoesqueleto de microtúbulos, así como la reorganización coordinada de los citoesqueletos de actina y microtúbulos durante la formación de la sinapsis inmune, sólo recientemente ha sido reportado17. Se utilizó la microscopia de STED a imagen B células que habían sido autorizadas a difundir en cubreobjetos recubierto con anticuerpos de anti-inmunoglobulinas (anti-Ig), que estimulan el BCR señalización e inician la reorganización del citoesqueleto. Cuando plateado en anticuerpos anti-Ig inmovilizados, las células de B se someten a dramático dependiente de actina que se separa, que recapitula los acontecimientos iniciales durante la formación de la sinapsis inmune. Lo importante, microscopia de STED reveló los detalles del anillo dendrítico de la F-actina que forma en la periferia de la inmune sinapsis y demostró que la COMT, como los microtúbulos Unidos a él, se habían movido cerca el contacto antígeno del17. Estos microtúbulos se extendieron hacia fuera hacia el anillo periférico de la F-actina. Por otra parte, la proyección de imagen de STED multicolor de varias combinaciones de F-actina, tubulina, IQGAP1 y GFP-tagged CLIP-170 + consejos demostraron que microtúbulos plus-extremos marcados por CLIP-170-GFP eran estrechamente relacionados con la red de actina periférica y IQGAP1, un captura de cortical proteína17.
Aquí, presentamos un protocolo detallado para la proyección de imagen los citoesqueletos de actina y microtúbulos en la sinapsis inmune usando microscopia de STED. Estos métodos han sido optimizados utilizando la línea A20 de células B murinas, que ha sido ampliamente empleada para el estudio de BCR señalización y formación de sinapsis inmune17,32,33,34,35 , 36 , 37 , 38 , 39. porque anticuerpos comerciales para CLIP-170 no funcionó bien para la inmunotinción en experimentos anteriores, describimos en detalle la expresión de GFP-tagged CLIP-170 en celdas A20, junto con protocolos para visualizar simultáneamente hasta la coloración tres componentes citoesqueléticos o proteínas citoesqueleto asociadas. Métodos para el uso de microscopia de STED a actina imagen en sinapsis inmunes de la célula NK han sido descritos40. Aquí, nosotros extendemos esta adquisición de imágenes de múltiples colores súper resolución de citoesqueletos la actina y los microtúbulos en las células de B.
Una consideración crítica para microscopía de superresolución está utilizando los procedimientos de fijación adecuado para mantener las estructuras celulares y prevenir el daño a las proteínas fluorescentes. La fijación y tinción métodos presentados en este documento han sido optimizados para retener la fluorescencia de GFP y proporcionar imágenes de alta resolución de las redes de actina y microtúbulos. Cuando la expresión de proteínas fluorescentes, debe señalarse que las células B son generalmente difíciles de transfectar. Mediante este protocolo, 20-50% de A20 células típicamente expresan la proteína de la fusión de GFP transfected, y entre esta población los niveles de expresión de la proteína son variables. Sin embargo, la proyección de imagen de súper-resolución de actina y microtúbulos mediante los procedimientos que describimos es bastante robusta y fácilmente se obtienen imágenes de alta calidad. A pesar de su pequeño tamaño en relación con las células de la A20, nos muestran que estos procedimientos también pueden utilizarse para la red de microtúbulos en las células B primarias que han sido activados brevemente con lipopolisacárido (LPS) de la imagen. Hemos demostrado que las células primarias de LPS activa B pueden ser transfectadas con siRNAs con relativamente alta eficiencia (es decir, tal que agotamiento de proteínas se puede detectar por immunoblotting), haciendo que una buena alternativa a la utilización de líneas de células B para algunos estudios 17.
Protocolo
Todos los procedimientos animales fueron aprobados por la Universidad de Columbia Británica Comité de cuidado de animales.
1. expresión de proteínas de la fusión de GFP en células de linfoma B de A20
- Células en cultivo A20 en completan Medio RPMI (RPMI-1640 suplementado con 10% inactivado con calor suero bovino fetal (FBS), 50 μm 2-Mercaptoetanol, glutamina 2 mM, piruvato de 1 mM, 50 U/mL de penicilina y estreptomicina 50 de μg/mL) a 37 ° C en una incubadora de cultivo de tejidos con 5 % CO2.
- Preparar el reactivo de transfección (véase la Tabla de materiales) según las instrucciones del fabricante.
Nota: Este protocolo ha sido optimizado para los reactivos específicos y Protocolo de la transfección se describe en la Tabla de materiales. Otros reactivos de transfección que hemos intentado no han producido suficiente eficacia de transfección. - Contar las células usando un hemocitómetro. Células de6 A20 centrífuga 2,5 x 10 (para cada transfección) por 5 min a x 525 g. resuspender las células en 100 μl de reactivo de transfección que contienen 1-2,5 μg de ADN plásmido. Para el ADN codificación CLIP-170-GFP23, utilizar 2,5 μg por transfección. Mezclar suavemente.
- Transferir las células a un pozo de una placa de 6 pozos y ajustar el volumen de 2 ml con el Medio RPMI completo precalentado. Las células de 18 h a 37 ° C para permitir la expresión de la proteína de la cultura.
2. aislamiento de células primario de ratón B y activación con LPS
- Uso de herramientas quirúrgicas esterilizadas para extirpar el bazo de un ratón, siguiendo protocolos de actuación aprobados por el Comité de cuidado de animales de la institución.
- En la campana de cultivo de tejidos, coloque un filtro de célula estéril 70 μm en un plato de cultivo de tejidos de 35 mm que contiene 3 mL de PBS estéril temperatura ambiente. Use la parte de goma del émbolo de una jeringa de 5 ml para triturar el bazo a través de la coladera de la célula.
- Pipetear la suspensión unicelular de splenoctyes en un tubo de 15 mL estéril y centrifugar a 525 x g durante 5 minutos.
- Uso un aislamiento magnético basado en el grano de la célula de B kit (véase Tabla de materiales) para obtener una población altamente enriquecida de las células de B.
- Resuspender las células B a 3 x 106/ml de Medio RPMI completo suplementado con 2,5 μg/mL LPS más factor (BAFF, una citoquina de supervivencia) de activación de células B de 5 ng/mL.
- Las células de la cultura durante 6 h a 37 ° C.
3. capa de vidrio cubreobjetos con anticuerpos Anti-Ig
- Preparar la solución de anticuerpo para el revestimiento de los cubreobjetos. Diluir la solución madre de anticuerpos de cabra anti-mouse Ig en PBS estéril temperatura para hacer un 12,5 μg/mL de solución; 400 μL de solución de anticuerpo se requiere para cada cubreobjetos.
Nota: Uso cabra anti-ratón IgG para las celdas A20; Utilice cabra anti-ratón IgM de las células B primarias. Anticuerpos de cabra IgG no se unen a receptores de Fc de ratón. Sin embargo, para evitar cualquier posible atascamiento del receptor de Fc, se puede utilizar F(ab) o F(ab')2 fragmentos de anti-ratón IgG o anticuerpos de anti-ratón IgM. - Sumerja un cubreobjetos de vidrio redondo de 18 mm #1.5 en metanol al 100% y dejar secar completamente (~ 10 min).
- Utilizando pinzas, coloque un cubreobjetos seco un cultivo de tejidos 12-bien placa y pipetee 400 μL de la 12.5 μg/mL anticuerpos solución (5 total μg, 2 μg/cm2) sobre el cubreobjetos para que forma una burbuja en el centro del cubreobjetos y se extiende a los bordes.
- Tenga cuidado de cubrir el cubreobjetos todo, pero no permita que la solución de anticuerpo extender más allá del borde del cubreobjetos de vidrio y el plástico de cultivo de tejidos. Incubar a temperatura ambiente durante 30 minutos.
- Lavar los cubreobjetos por Pipetear 1 mL de PBS estéril en el bien y, posteriormente, aspirando la solución. Repetir dos veces más para eliminar los anticuerpos no Unidos.
- Añadir 1 mL de PBS estéril para el bien que contienen cubreobjetos recubiertos de anticuerpos hasta que las células están listas para añadirse.
Nota: El cubreobjetos pueden conservarse a temperatura ambiente, cubierta con PBS, para su uso en el mismo día.
4. la célula de B que se separa en cubreobjetos recubierto de Ig Anti
- Preparar modificado tamponado con HEPES salina (mHBS): 25 mM HEPES, pH 7.2, 125 mM NaCl, KCl, 1 mM CaCl2de 5 mM, 1 mM de Na2HPO4, 0,5 mM MgSO4, dextrosa de 1 mg/mL, glutamina 2 mM, piruvato de sodio 1 mM y 50 μm 2-Mercaptoetanol). Filtro esta solución de esterilizar y almacenar a 4 ° C.
- En el día del experimento, hacer 50 mL de mHBS con 2% FBS (mHBS-FBS) añadiendo 1 mL de SFB inactivado con calor a 50 mL mHBS. Caliente la mHBS SBF a 37 ° C antes de usar.
- Centrifugar las células transfected A20 o a las células B primarias que habían sido cultivadas con BAFF más LPS 525 x g durante 5 minutos.
- Resuspender las células en 1 mL de SBF mHBS, contar las células usando un hemocitómetro y diluir las células a 2 x 105 células/mL en mHBS FBS.
- Usando pinzas transfiera el cubreobjetos de la placa de cultivo de tejidos a un pedazo de la película de parafina.
- Añadir 250 μl de células de B (5 x 104 células) a cada cubreobjetos.
- Incubar el cubreobjetos a 37 ° C durante 15 min en la oscuridad para permitir que las células B para extender por la superficie anti-IgG-revestida.
5. la fijación y el Immunostaining, las células
- Preparar la solución de fijación diluyendo la solución madre de paraformaldehído al 16% y la solución glutaraldehído al 50% en agua a temperatura ambiente agua destilada para obtener concentraciones finales de glutaraldehido paraformaldehido y 0.1% de 3%. Preparar la solución de fijación en el día es para ser utilizado y desechar cualquier exceso.
PRECAUCIÓN: Las soluciones stock paraformaldehido y glutaraldehído deben ser utilizadas en una campana de humos químicos. Siga las instrucciones en la hoja de datos de seguridad del material (MSDS). - Preparar el buffer de permeabilización/bloqueo (BSA 3% y 0,1% Tritón X-100 diluido en PBS). Filtro esta solución de esterilizar y almacenar a 4 ° C. En el día del experimento, calentar la cantidad necesaria a la temperatura ambiente.
- Preparar el tampón de tinción (saponina 1% de BSA y un 0.1% en PBS). Esta solución utiliza un filtro μm 0.2 de esterilizar y almacenar a 4 ° C. En el día del experimento, calentar la cantidad necesaria a la temperatura ambiente.
- Pipetear 350 μl de la solución de fijación en cada cubreobjetos, asegurando que la superficie está totalmente cubierta. Incubar a temperatura ambiente durante 10 min en la oscuridad.
- Retire la solución de fijación el cubreobjetos aspirando cuidadosamente desde el borde del cubreobjetos con una micropipeta.
PRECAUCIÓN: La solución de fijación debe ser desechada como residuos químicos peligrosos. - Lavar los cubreobjetos una vez con 500 μl de buffer de permeabilización/bloqueo. Pipeta el líquido.
- Permeabilizar y bloquear las células añadiendo 250 μl de buffer de permeabilización/bloqueo a cada cubreobjetos y incubando durante 10 min a temperatura ambiente en la oscuridad.
- Diluir el anticuerpo anti-tubulina de conejo 1: 100 en tampón de tinción.
- Aspirar apagado el buffer de permeabilización/bloqueo del cubreobjetos y añadir 50 μl de la solución diluida del anticuerpo anti-tubulina a cada cubreobjetos. Incubar a temperatura ambiente durante 30 min en la oscuridad.
- Preparar la solución de tinción de anticuerpo secundario/actina mediante la dilución del anticuerpo secundario de cabra Alexa Fluor 532-conjugado anti-conejo IgG y phalloidin Alexa Fluor 568 conjugado 1: 100 en tampón de tinción.
- Lavar los cubreobjetos 3 veces para quitar exceso de anticuerpo primario por agregar 500 μl de tampón de tinción y luego de aspiración.
- Añadir 50 μl de la solución de tinción de anticuerpo secundario/actina a cada cubreobjetos e incubar durante 30 min a temperatura ambiente en la oscuridad.
- Lavar los cubreobjetos 3 veces para quitar exceso de anticuerpo secundario agregar 500 μl de tampón de tinción y luego de aspiración.
- Añadir 10 μl de reactivo de montaje a un portaobjetos de microscopio. Monte el cubreobjetos sobre el portaobjetos con el lado de la celda hacia abajo.
Nota: Un medio de montaje de "anti-fade" (véase Tabla de materiales) se recomienda para preservar la intensidad de fluorescencia de proteínas de la fusión de GFP. Evitar el uso de reactivos que contiene DAPI, que puede interferir con la proyección de imagen de los fluoróforos cuando se utiliza el láser STED de montaje. - Deje que los portaobjetos se seque durante la noche en la oscuridad. Imágenes de las diapositivas el día siguiente.
Nota: Las diapositivas de imágenes tan pronto como el cubreobjetos esté seco se recomiendan, como la fluorescencia de GFP disminuirá con el tiempo.
6. proyección de imagen usando el microscopio STED
Nota: Tenga en cuenta que todos los pasos de software se describen a continuación son específicos para el microscopio y el software que utilizamos (véase la Tabla de materiales). Los pasos y configuración necesitará ajustarse si la proyección de imagen se realiza utilizando un microscopio y software diferentes.
- En el microscopio STED, activar el láser y lámpara de iluminación epifluorescente y el software del microscopio.
- Establecer los parámetros para los lasers de agotamiento de STED.
Nota: Esto dependerá del microscopio específico se utiliza y los láseres que se equipa. Algunas recomendaciones de configuración es de luz blanca (WLL) 70%; 592 nm láser 80%; 660 nm láser 80%. - Activar los ajustes de STED y alinear los rayos de láser STED usando el objetivo X 100.
- Utilizando el ocular, enfoque la muestra y seleccionar una celda con moderada expresión de GFP.
Nota: Expresión de GFP bajo no aparecerán ya que STED reduce la intensidad de emisión. Por el contrario, la alta expresión de CLIP-170-GFP induce la formación espontánea de grandes grupos, que no reflejan la normal microtubule final plus proteína compleja morfología y distribución. Seleccionando una celda con moderada expresión de GFP es esencial para la proyección de imagen con precisión las estructuras citoesqueléticas en el sitio de contacto del antígeno. - Zoom en la celda seleccionada y elija la región de interés a ser reflejada. Ajustar el enfoque para que el plano x-y de la célula de B que está más cerca el cubreobjetos está en foco.
- Para ello, hacia el objetivo progresivamente más cerca el cubreobjetos para que las estructuras citoesqueléticas de células B entran en foco y luego ir fuera de foco. Entonces mueva gradualmente el objetivo en la dirección opuesta hasta que las estructuras citoesqueléticas de células B en primer lugar volver en foco.
- Optimizar la configuración, incluida la potencia del láser, haz de excitación y detector gama. Comenzar con la configuración recomendada por el fabricante. Luego hacer los ajustes necesarios para optimizar la señal de las muestras. Todas las muestras a comparar entre sí con la misma configuración de la imagen.
- En la pestaña de "adquirir" del software, establece la adquisición de la imagen en adquisición secuencial del marco en el panel inferior izquierdo de "Análisis secuencial" marcando la opción "entre bastidores".
- Establecer la secuencia de adquisición.
Nota: Adquirimos la fluorescencia de GFP en primer lugar con el fin de evitar la degradación de la señal de la GFP.
Dependiendo de la combinación de fluoróforos que sirven además de GFP, la señal de fluorescencia de longitud de onda más larga de la proyección de imagen primero puede obtenerse mejores resultados. Sin embargo, el orden en que los fluoróforos o proteínas fluorescentes están sujetos a agotamiento de la emisión estimulada y reflejadas debe ser optimizado para obtener las señales de fluorescencia más fuertes y mejor resolución. - Seleccionar y ajustar la potencia del láser STED para cada fluoróforo en la pestaña de "Adquisición" del software y utilice la barra deslizante para 592-nm o el láser 660 STED para ajustar la potencia del láser. Ajustar la potencia para el agotamiento de 592 nm láser para GFP y Alexa Fluor 532. Ajustar la potencia para el láser 660 nm agotamiento para Alexa Fluor 568.
- Para aumentar la resolución y reducir la señal de fondo, vaya a la configuración de "Adquisición" en la pestaña de "Adquisición" del software, aumentar la línea marco un promedio mediante la selección de un valor mayor que 1 se puede usar el menú desplegable para cada opción.
- También, adquirir la señal fluorescente con STED tiempo cerrada la opción bloquea para el fluoróforo en la pestaña de "Adquirir", y especificando valores para sincronización de tiempo (ver nota más abajo). Aumentar la potencia del láser STED para mejorar la resolución, aunque esto también aumentará el fotoblanqueo de los fluoróforos.
Nota: El tiempo bloquea necesitará optimizarse para el microscopio, la muestra y fluoróforos se utiliza. Una vez que bloquean de 0.3 a 6 ns se recomienda. Después de la fijación, GFP es particularmente sensible a la energía láser de alta. Para reducir el fotoblanqueo de GFP, sincronización de tiempo se debe aplicar y debe reducirse la potencia del láser STED. - Para capturar imágenes 3D de STED, utilice el control deslizante para cambiar el punto extendido función (PSF) a "STED 3D".
- Manualmente adquirir múltiples imágenes para asegurar reproducibilidad. Deconvolve las imágenes (ver figura 1) utilizando un software de deconvolución paquete41(véase Tabla de materiales).
Resultados
Para las células B separarse en inmovilizado anti-Ig, microscopia de STED utilizada en conjunción con el software de deconvolución proporciona imágenes de resolución más alta de estructuras citoesqueléticas de microscopía confocal. Esto es evidente en la figura 1, donde la red de F-actina se visualizó utilizando el protocolo descrito anteriormente. Una comparación de confocal y STED super-resolución imágenes de la misma muestra demuestra que las imágenes STED son de mayor resolución y revelan más detallan de las estructuras del citoesqueleto de actina (figura 1). Esta figura también muestra que deconvolución es esencial para obtener imágenes de alta calidad STED en que actinia filamentos están más claramente definidos. Aunque deconvolución de imágenes confocales produce una mejora sustancial en la resolución de la imagen, deconvolución STED imágenes proporcionan información estructural detallada de imágenes confocales deconvolución. En particular, la estructura dendrítica del anillo periférico de la F-actina se revela en detalle por microscopia de STED (figura 1 y figura 2). La red de microtúbulos en el sitio de contacto del antígeno también fue fotografiada usando la preparación de la muestra y proyección de imagen protocolo descrito anteriormente (figura 3). Microtúbulos se originan desde un punto central, que es el MTOC, y emanan hacia afuera hacia la periferia de la célula. En este experimento, las células de B se permitieron difundir en cubreobjetos recubierto de Ig anti durante 15 min (figura 3), un momento en el que la COMT ha avanzado hacia el antígeno contacto17. En los extremos de los microtúbulos que se muestra en la figura 3se observan racimos de CLIP-170-GFP que marcan los más extremos de los microtúbulos. Cuando la preparación de la muestra y proyección de imagen de la red de microtúbulos de STED es óptima, continua y distintos microtúbulos se observan, con CLIP-170-GFP localizada a lo largo de los microtúbulos o en los extremos de la plus (Figura 3A). Microtúbulos óptima coloración, que se observaron al utilizar concentraciones más bajas de la tinción de anticuerpos o lotes de α-tubulina anticuerpos específicos que son más de un años de edad, resultados de microtúbulos que aparecen como secciones discontinuas que están mal resueltas sobre deconvolución (figura 3B; también ver figura 5). Aunque todos la fluorescencia CLIP-170-GFP en estas imágenes se asocia con estructuras α-tubulina-immunostained, uno no puede distinguir si CLIP-170-GFP se encuentra en los más extremos, o a lo largo de la longitud de los microtúbulos, debido a la tinción incompleta de los microtúbulos. Por lo tanto, es importante que el anticuerpo de la α-tubulina se almacene bajo el fabricante recomienda las condiciones de almacenamiento y utilizar dentro de un año.
Usando este protocolo, imágenes de alta calidad varios colores STED que muestran la organización y estructura del citoesqueleto de actina y la red de microtúbulos, así como proteínas como IQGAP1 y CLIP-170 que asocia estos dos PtK217, podía ser adquirido. Las imágenes STED en la figura 4 muestran el anillo periférico de dendrítica actina y los microtúbulos que emanan desde una ubicación central en la célula donde la tinción de la actinia es mucho menos densa. CLIP-170-GFP en los extremos de estos microtúbulos está estrechamente relacionado con la F-actina periférica. Este protocolo permite visualizar estructuras citoesqueléticas en la sinapsis inmunológica con STED del solo-color (figura 2) la proyección de imagen o STED multicolor de imágenes (figura 3 y figura 4). Sin embargo, cabe señalar que la proyección de imagen de STED solo color (figura 2) puede producir mejor resolución de las estructuras de actina y los microtúbulos en las células de B que STED multicolor (figura 4). Esto puede ser debido a fotoblanqueo causada por la adquisición de imágenes STED secuencial de los fluoróforos diferentes. Para obtener las mejores imágenes de super-resolución, la combinación de fluoróforos y proteínas fluorescentes seleccionadas, así como la secuencia en que son imágenes utilizando los láseres de excitación y el agotamiento, debe ser optimizado para la muestra. Sin embargo, la proyección de imagen de STED multicolor proporciona imágenes de resolución superiores de estas estructuras citoesqueléticas de microscopía confocal convencional. Además, solo color STED puede utilizarse para la adquisición de imágenes de resolución súper 3-dimensional de la red de actina o los microtúbulos de toda la célula de B (película 1).
Cuando usando las células transfected con proteínas fluorescentes de fusión, logrando niveles de expresión óptimo y evitar artefactos debido a sobreexpresión son consideraciones importantes. En las células donde es overexpressed CLIP-170-GFP, se forman grandes agregados de CLIP-170-GFP (figura 5A). Además de este mislocalization de CLIP-170-GFP, sólo una parte de la red de microtúbulos en este celular fue en el plano focal más cercano al cubreobjetos (figura 5B). Esto sugiere que sobreexpresión de CLIP-170 también puede perjudicar la polarización inducida por el BCR MTOC. Por el contrario, porque las señales de fluorescencia fuerte son típicamente necesarias para la adquisición de imágenes de alta calidad STED, baja expresión de proteínas fluorescentes de fusión como CLIP-170-GFP (figura 5) produce imágenes de baja calidad. Por lo tanto, al utilizar células que han sido transfectadas con proteínas fluorescentes, es importante solamente esas células con óptimos niveles de expresión de la proteína de fusión de la imagen. También es importante tener en cuenta que el protocolo de la transfección que fue utilizado para A20 células (véase Tabla de materiales) típicamente resultados en 20-50% de las células expresando la proteína transfected. Para ADN de plásmido (a diferencia de siRNAs), frecuencias de transfección de células B primarias son a menudo mucho más bajo que para las celdas A20, que requieren el uso de líneas de células B. Sin embargo, pueden obtenerse imágenes de alta calidad STED de elementos citoesqueléticos en untransfected de células B primario mediante este protocolo (figura 6).
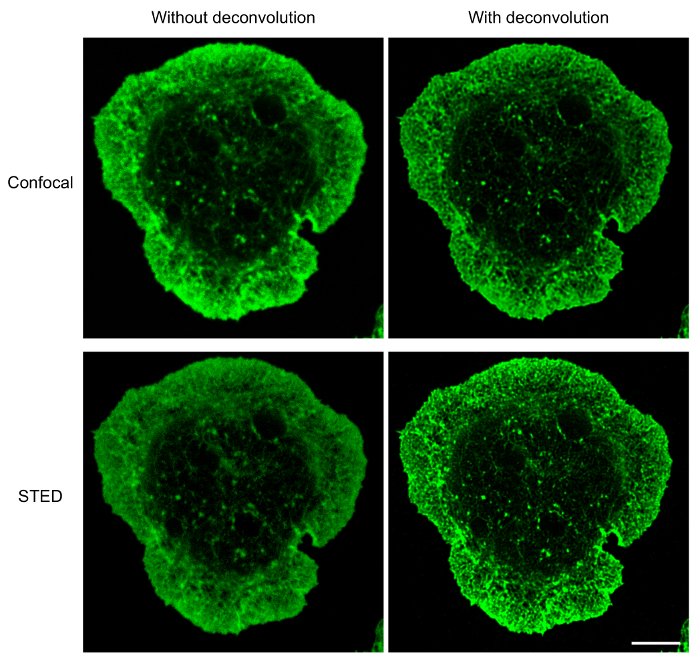
Figura 1: comparación de confocal y la proyección de imagen de la F-actina STED. Imágenes confocales (arriba) e imágenes STED (abajo) de una celda A20 que había difundido sobre cubreobjetos de anti-IgG-cubierto durante 15 minutos antes de ser teñidos con phalloidin Alexa Fluor 532-conjugado. Con el microscopio confocal de STED, la misma célula era reflejada primero por microscopia confocal y luego por STED. La inicial confocal e imágenes STED se muestran, junto con el mismo confocal e STED imágenes después de deconvolución. Barra de escala: 5 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 2: el citoesqueleto de actina en el sitio de contacto antígeno. Las celdas A20 que habían sido autorizadas a difundir sobre cubreobjetos de anti-IgG-cubierto durante 15 min fueron teñidas con phalloidin Alexa Fluor 568-conjugados y reflejadas por microscopia de STED. Las imágenes iniciales de STED se deconvolución. Paneles A-B y C E los paneles muestran imágenes representativas de dos células diferentes. El panel E muestra una ampliación X 3 de la región en el cuadro blanco en el panel C. Barra de escala para los paneles A-D: 5 μm. escala bar panel E: 1 μm. haga clic aquí para ver una versión más grande de esta figura.
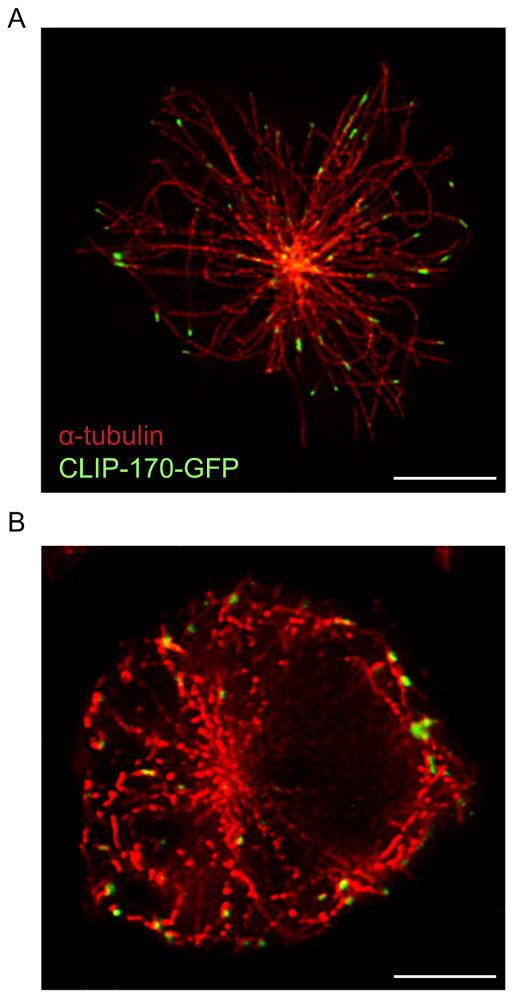
Figura 3: imágenes de la red de microtúbulos y CLIP-170-GFP de STED. A20 las células con CLIP-170-GFP se permitieron difundir en cubreobjetos anti-IgG-cubierto durante 15 minutos antes de ser fijo y immunostained con un anticuerpo de α-tubulina y un anticuerpo secundario conjugado con Alexa Fluor 532. (A) imagen representativa mostrando inmunotinción de la red de microtúbulos, con CLIP-170-GFP localizada principalmente en los más extremos de los microtúbulos. (B) la coloración óptima y la resolución de microtúbulos debido al uso de un anticuado stock de anticuerpo de α-tubulina. Barras de escala: 5 μm. haga clic aquí para ver una versión más grande de esta figura.
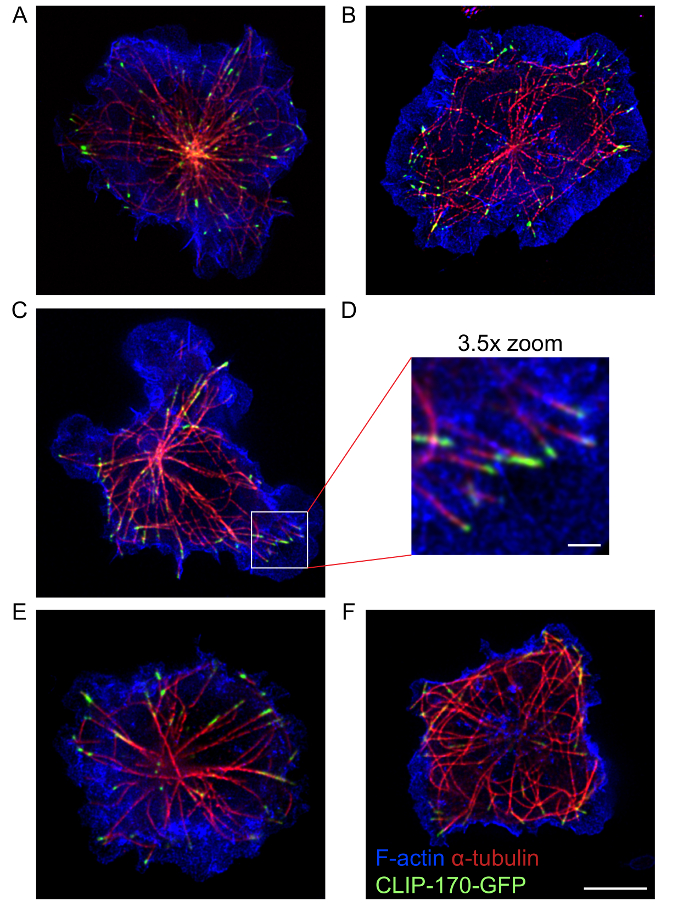
Figura 4: imágenes STED de los citoesqueletos de actina y microtúbulos. A20 las células con CLIP-170-GFP se permitieron difundir en cubreobjetos anti-IgG-cubierto durante 15 minutos antes de ser fijados y teñidos con Alexa Fluor 568 conjugado phalloidin visualizar F-actina y con un anticuerpo de α-tubulina y un conjugado con Alexa Fluor 532 anticuerpo secundario para visualizar los microtúbulos. Paneles A, D y paneles E-F muestran imágenes representativas de dos células diferentes. Panel D es una ampliación X 3,5 de la región en el cuadro blanco en el panel C. Barras de escala: 5 μm para los paneles A-C y E-F; 1 μm para el panel D. La imagen en el panel A es la misma imagen utilizada en la Figura 3A , pero incluye el recubrimiento de los canales de la F-actina. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: ejemplos de imágenes STED de mala calidad debido a la sobreexpresión o la expresión insuficiente de la proteína de la fusión de GFP. A20 las células con CLIP-170-GFP se permitieron difundir en cubreobjetos anti-IgG-cubierto durante 15 minutos antes de ser fijados y teñidos como en la figura 4. (A, B) Resultados de la sobreexpresión de CLIP-170-GFP en agregados grandes, anormales de CLIP-170-GFP (A) y polarización de MTOC deteriorado hacia el contacto del antígeno del sitio (B). (C) compensar la insuficiente expresión de CLIP-170-GFP incrementando los resultados de energía láser en imágenes de mala calidad STED. Barras de escala: 5 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 6: imagen STED del citoesqueleto microtúbulos en las células primarias de B. Esplénico primario de células B fueron cultivadas durante 6 h con 5 ng/μl BAFF plus 2,5 μg/mL de LPS y luego permitio difundir durante 15 min en cubre-objetos que habían sido recubiertos con anticuerpos anti-IgM. Las células fueron entonces fijaron y teñidas con un anticuerpo de α-tubulina y un anticuerpo secundario conjugado con Alexa Fluor 568 visualizar microtúbulos. Se muestra una imagen representativa. Barra de escala: 5 μm. haga clic aquí para ver una versión más grande de esta figura.

Película 1: reconstrucción 3D de la red de microtúbulos de la célula de B. A20 células podían difundir en cubreobjetos anti-IgG-cubierto durante 15 minutos antes de ser fijo y immunostained con un anticuerpo de α-tubulina y un anticuerpo secundario conjugado con Alexa Fluor 488. Rodajas Z fueron capturados en tamaños de paso de 0,2 μm para un total de 37 Marcos. Reconstrucción 3D se realizó utilizando el microscopio STED de software de imágenes. Por favor haga clic aquí para ver este video. (Clic derecho para descargar)
Discusión
Imágenes detalladas de estructuras citoesqueléticas pueden obtenerse usando microscopia de STED súper resolución, que teóricamente puede alcanzar una resolución de 50 nm, en comparación con microscopia confocal convencional, para que la resolución de la difracción limitada es de ~ 200 nm 24. la capacidad para resolver las estructuras más finas es aún mayor utilizando software de deconvolución para calcular la posición más probable de la fuente de luz original de la señal observada fluorescencia "borrosa". Este protocolo describe métodos para usar STED a la imagen de los citoesqueletos de actina y microtúbulos, así como proteínas citoesqueleto asociadas.
Activación de la célula de b induce la remodelación de la red de microtúbulos y el citoesqueleto de actina con la regulación coordinada de los dos citoesqueletos importantes para la formación de sinapsis inmune17,42. El método que presentamos ha sido optimizado para la proyección de imagen simultáneamente los citoesqueletos de actina y microtúbulos en el lugar de contacto del antígeno con STED multicolor, pero es igualmente aplicable para STED del solo-color. Estudios previos que se realizaron en el resaltado de citoesqueleto de la célula de B que STED puede proporcionar nuevas penetraciones en las estructuras celulares cómo están organizados y cómo interactúan entre sí. Utilizando microscopía de fluorescencia interna total y confocal (TIRF), habíamos observado que los microtúbulos en contacto con el anillo de la F-actina en la periferia del antígeno contacto17. Usando microscopia de STED, fuimos capaces de demostrar que los más extremos de los microtúbulos que se caracterizaron por la + punta CLIP-170 asociado estrechamente con la red de actina dendrítica en la periferia de la célula (ver figura 4).
Múltiples factores influyen en que técnica es más adecuada para su aplicación específica. Se trata de la resolución que se requiere, las estructuras a ser fotografiada, la técnica de etiquetado y su relación señal a ruido (es decir, contraste), tiempo de la adquisición, facilidad de preparación de la muestra y la reproducibilidad. Preparación de muestras para STED no es significativamente diferente para microscopía confocal, y combina alta resolución con la adquisición de la imagen rápida. Una ventaja importante de STED es que es un proceso óptico en el que la imagen se adquiere directamente de la muestra y la resolución se puede ajustar cambiando la potencia del láser STED24. A diferencia de la microscopía de superresolución agotamiento estado que reconstruye imágenes de miles de imágenes sucesivas capturas, procesamiento computacional amplia no es necesario para STED y se evita la introducción de artefactos de reconstrucción de imagen 24. sin embargo, el contraste en imágenes STED es a menudo baja24, en que caso procesamiento de la imagen mediante software como el ImageJ puede ser necesaria para mejorar el contraste. Esto es particularmente importante para imágenes con estructuras densas, como una red dendrítica de la actina. Para mejorar el contraste de la imagen durante la adquisición de la imagen, uno puede reducir la potencia del láser agotamiento o aplicar línea o marco un promedio de. STED tiempo cerrada, que capta fotones después de un intervalo de tiempo definidos por el usuario, puede aumentar la resolución disminuyendo el área de la que fotones son recopilados24,43. Se recomienda optimizar la proyección de imagen de STED de estructuras citoesqueléticas en la sinapsis inmune mediante una combinación de estos métodos para mejorar el contraste y resolución.
Actualmente, no todos fluoróforos son óptimas para la proyección de imagen con STED y fluoróforo no todas las combinaciones son adecuadas para la obtención de imágenes de múltiples colores STED. Ajuste cuidadoso de las gamas de detección es importante para asegurar un mínimo sangrado a través de fluoróforos en canales adyacentes. La combinación de fluoróforos utilizado en este protocolo (es decir, GFP, Alexa Fluor 532 y Alexa Fluor 568) es óptima para la proyección de imagen de súper-resolución STED multicolor. Respecto a la microscopía de iluminación estructurada (SIM) y métodos de localización de una sola molécula (SMLM), tales como microscopía de localización foto-activado (PALM), STED no es típicamente ideal para la proyección de imagen de varios color. Sin embargo, aquí mostramos esa ligera sobresaturación de fluoróforo detección, junto con herramientas de procesamiento de imágenes simple, puede ofrecer imágenes de alta resolución multicolores de los citoesqueletos de actina y microtúbulos.
Este protocolo para la proyección de imagen de estructuras citoesqueléticas STED ha revelado nuevos detalles de la arquitectura citoesquelética en la sinapsis inmune de la célula de B. Aunque hemos optimizado este protocolo para la proyección de imagen los citoesqueletos de actina y microtúbulos en el sitio de contacto del antígeno en las células de B, estos métodos deben ser aplicables a otros tipos de células, especialmente células inmunes (linfocitos T, células NK, mastocitos, etc.) que forman sinapsis inmunológicas. Por otra parte, la utilidad de este protocolo podría extenderse a la capa el cubreobjetos con otros ligandos o sustratos adhesivos. Sin embargo, es importante optimizar el protocolo y los valores de adquisición de imagen para el tipo de célula y el montaje experimental.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a las instalaciones de proyección de imagen del Instituto de Ciencias de la vida de UBC (LSI) para apoyar y mantener el microscopio STED. Este trabajo fue financiado por beca #68865 de los institutos canadienses de investigación en salud (a M.R.G.). Agradecemos al Dr. Kozo Kaibuchi (Universidad de Nagoya, Nagoya, Japón) el plásmido CLIP-170-GFP.
Materiales
| Name | Company | Catalog Number | Comments |
| Cell culture | |||
| A20 mouse B-lymphoma cells | ATCC | TIB-208 | Murine B-cell lymphoma of Balb/c origin that expresses an IgG-containing BCR on its surface |
| RPMI-1640 | Thermo Fisher Scientific | R0883 | |
| Fetal bovine serum | Thermo Fisher Scientific | 12483020 | Heat inactivate at 56 oC for 30 min |
| 2-mercaptoethanol | Millipore Sigma | M3148 | |
| Glutamine | Millipore Sigma | G5763 | |
| Sodium pyruvate | Millipore Sigma | P5280 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | Liquid, 10,000 units |
| Additional materials for primary B cells | |||
| 70-µm cell strainer | Corning | 352350 | |
| Magnetic bead-based B cell isolation kit | Stemcell Technologies | 19854 | EasySep Mouse B cell Isolation kit |
| Lipopolysaccharide (LPS) | Millipore Sigma | L4391 | LPS from E. coli 0111:B4 |
| B cell-activating factor (BAFF) | R&D Systems | 2106-BF-010 | |
| Name | Company | Catalog Number | Comments |
| Transfection | |||
| Plasmid encoding CLIP-170-GFP | Gift from Dr. Kozo Kaibuchi (Nagoya Univ., Nagoya, Japan); described in Fukata et al. Cell 109:873-885, 2002 | ||
| Recommended transfection reagents and equipment | |||
| Amaxa Nucleofection kit V | Lonza | VCA-1003 | Follow the manufacturer's directions for mixing the transfection reagents with the DNA |
| Amaxa Nucleofector model 2b | Lonza | AAB-1001 | Program L-013 used |
| Falcon 6-well plates, TC treated, sterile | Corning | 353046 | |
| Name | Company | Catalog Number | Comments |
| Coating coverslips | |||
| 18-mm diameter round #1.5 cover glasses | Thomas Scientific | 1217N81 | Similar product: Marienfield-Superior catalogue #117580 |
| Forceps | Fisher Scientific | 1381242 | Dissecting extra fine splinter forceps |
| Falcon 12-well sterile tissue polystyrene tissue culture plate | Corning | 353043 | |
| 100% methanol | Fisher Scientific | A412-4 | |
| Sterile phosphate buffered saline (PBS) without calcium or magnesium | Thermo Fisher Scientific | 10010049 | |
| Goat-anti-mouse IgG antibody | Jackson ImmunoResearch | 115-005-008 | For A20 cells |
| Goat-anti-mouse IgM antibody | Jackson ImmunoResearch | 115-005-020 | For primary mouse B cells |
| Name | Company | Catalog Number | Comments |
| Staining | |||
| Paraformaldehyde (16% stock solution) | Electron Microscopy Sciences | 15710 | Dilute with PBS to working concentration |
| Glutaraldehyde (50% stock solution) | Millipore Sigma | 340855 | Dilute with PBS to working concentration |
| Triton X-100 | Fisher Scientific | BP151-500 | |
| Saponin | Millipore Sigma | S2149 | |
| Bovine serum albumin (BSA), Fraction V | Millipore Sigma | 10735094001 | |
| Rabbit anti-tubulin antibody | Abcam | ab52866 | 1:250 dilution recommended but should be optimized |
| Alexa Fluor 532-conjugated goat anti-rabbit IgG | Thermo Fisher Scientific | A11009 | 1:100 dilution recommended but should be optimized |
| Alexa Fluor 568-conjugated phalloidin | Thermo Fisher Scientific | A12380 | 1:100 dilution recommneded but should be optimized |
| Prolong Diamond Antifade Mountant | Thermo Fisher Scientific | P36970 | Without DAPI |
| Fisherbrand Superfrost Plus Microscope Slides | Fisher Scientific | 12-550-15 | |
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Parafilm | VWR | P1150-2 | |
| HEPES | Millipore Sigma | H3375 | |
| NaCl | Fisher Scientific | BP358 | |
| KCl | Millipore Sigma | P9333 | |
| CaCl2 | Millipore Sigma | C1016 | |
| Na2HPO4 | Fisher Scientific | S374-500 | |
| MgSO4 | Fisher Scientific | M63 | |
| Dextrose | Fisher Scientific | D16-500 | |
| Name | Company | Catalog Number | Comments |
| Microscopy | |||
| Leica SP8 TCS STED microscope | Leica | ||
| Huygens deconvolution software | Scientific Voume Imaging | See https://svi.nl/HuygensProducts |
Referencias
- Harwood, N. E., Batista, F. D. The cytoskeleton coordinates the early events of B-cell activation. Cold Spring Harb Perspect Biol. 3 (2), a002360 (2011).
- Batista, F. D., Treanor, B., Harwood, N. E. Visualizing a role for the actin cytoskeleton in the regulation of B-cell activation. Immunol Rev. 237 (1), 191-204 (2010).
- Harwood, N. E., Batista, F. D. Early events in B cell activation. Annu Rev Immunol. 28, 185-210 (2010).
- Batista, F. D., Harwood, N. E. The who, how and where of antigen presentation to B cells. Nat Rev Immunol. 9 (1), 15-27 (2009).
- Kumari, S., et al. T cell antigen receptor activation and actin cytoskeleton remodeling. Biochim Biophys Acta. 1838 (2), 546-556 (2014).
- Dustin, M. L. Visualization of Cell-Cell Interaction Contacts: Synapses and Kinapses. Self Nonself. 2 (2), 85-97 (2011).
- Dustin, M. L., Chakraborty, A. K., Shaw, A. S. Understanding the Structure and Function of the Immunological Synapse. Cold Spring Harb Perspect Biol. 2 (10), a002311 (2010).
- Dustin, M. L. Modular design of immunological synapses and kinapses. Cold Spring Harb Perspect Biol. 1 (1), a002873 (2009).
- Dustin, M. L. Visualization of cell-cell interaction contacts-synapses and kinapses. Adv Exp Med Biol. 640, 164-182 (2008).
- Dustin, M. L. Hunter to gatherer and back: immunological synapses and kinapses as variations on the theme of amoeboid locomotion. Annu Rev Cell Dev Biol. 24, 577-596 (2008).
- Dustin, M. L. T-cell activation through immunological synapses and kinapses. Immunol Rev. 221, 77-89 (2008).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Monks, C. R., et al. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Yuseff, M. I., et al. How B cells capture, process and present antigens: a crucial role for cell polarity. Nat Rev Immunol. 13 (7), 475-486 (2013).
- Mattila, P. K., Batista, F. D., Treanor, B. Dynamics of the actin cytoskeleton mediates receptor cross talk: An emerging concept in tuning receptor signaling. J Cell Biol. 212 (3), 267-280 (2016).
- Kuhn, J. R., Poenie, M. Dynamic polarization of the microtubule cytoskeleton during CTL-mediated killing. Immunity. 16 (1), 111-121 (2002).
- Wang, J. C., et al. The Rap1-cofilin-1 pathway coordinates actin reorganization and MTOC polarization at the B cell immune synapse. J Cell Sci. 130 (6), 1094-1109 (2017).
- Schnyder, T., et al. B cell receptor-mediated antigen gathering requires ubiquitin ligase Cbl and adaptors Grb2 and Dok-3 to recruit dynein to the signaling microcluster. Immunity. 34 (6), 905-918 (2011).
- Nath, S., et al. Dynein Separately Partners with NDE1 and Dynactin To Orchestrate T Cell Focused Secretion. J Immunol. 197 (6), 2090-2101 (2016).
- Combs, J., et al. Recruitment of dynein to the Jurkat immunological synapse. Proc Natl Acad Sci U S A. 103 (40), 14883-14888 (2006).
- Akhmanova, A., Steinmetz, M. O. Control of microtubule organization and dynamics: two ends in the limelight. Nat Rev Mol Cell Biol. 16 (12), 711-726 (2015).
- Akhmanova, A., Steinmetz, M. O. Microtubule +TIPs at a glance. J Cell Sci. 123 (20), 3415-3419 (2010).
- Fukata, M., et al. Rac1 and Cdc42 capture microtubules through IQGAP1 and CLIP-170. Cell. 109 (7), 873-885 (2002).
- Wegel, E., et al. Imaging cellular structures in super-resolution with SIM, STED and Localisation Microscopy: A practical comparison. Sci Rep. 6, 27290 (2016).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu Rev Biochem. 78, 993-1016 (2009).
- Mace, E. M., Orange, J. S. Dual channel STED nanoscopy of lytic granules on actin filaments in natural killer cells. Commun Integr Biol. 5 (2), 184-186 (2012).
- Ritter, A. T., et al. Actin depletion initiates events leading to granule secretion at the immunological synapse. Immunity. 42 (5), 864-876 (2015).
- Tamarit, B., et al. Membrane microdomains and cytoskeleton organization shape and regulate the IL-7 receptor signalosome in human CD4 T-cells. J Biol Chem. 288 (12), 8691-8701 (2013).
- Brown, A. C., et al. Super-resolution imaging of remodeled synaptic actin reveals different synergies between NK cell receptors and integrins. Blood. 120 (18), 3729-3740 (2012).
- Dupre, L., et al. T Lymphocyte Migration: An Action Movie Starring the Actin and Associated Actors. Front Immunol. 6, 586 (2015).
- Rak, G. D., et al. Natural killer cell lytic granule secretion occurs through a pervasive actin network at the immune synapse. PLoS Biol. 9 (9), e1001151 (2011).
- Lin, K. B., et al. The Rap GTPases regulate the migration, invasiveness and in vivo dissemination of B-cell lymphomas. Oncogene. 29 (4), 608-615 (2010).
- Lin, K. B., et al. The rap GTPases regulate B cell morphology, immune-synapse formation, and signaling by particulate B cell receptor ligands. Immunity. 28 (1), 75-87 (2008).
- McLeod, S. J., et al. The Rap GTPases regulate integrin-mediated adhesion, cell spreading, actin polymerization, and Pyk2 tyrosine phosphorylation in B lymphocytes. J. Biol. Chem. 279 (13), 12009-12019 (2004).
- Christian, S. L., et al. Activation of the Rap GTPases in B lymphocytes modulates B cell antigen receptor-induced activation of Akt but has no effect on MAPK activation. J Biol Chem. 278 (43), 41756-41767 (2003).
- Batista, F. D., Iber, D., Neuberger, M. S. B cells acquire antigen from target cells after synapse formation. Nature. 411 (6836), 489-494 (2001).
- Treanor, B., et al. Dynamic cortical actin remodeling by ERM proteins controls BCR microcluster organization and integrity. J Exp Med. 208 (5), 1055-1068 (2011).
- Mattila, P. K., et al. The actin and tetraspanin networks organize receptor nanoclusters to regulate B cell receptor-mediated signaling. Immunity. 38 (3), 461-474 (2013).
- Yuseff, M. -. I., et al. Polarized Secretion of Lysosomes at the B Cell Synapse Couples Antigen Extraction to Processing and Presentation. Immunity. 35 (3), 361-374 (2011).
- Mace, E. M., Orange, J. S. Visualization of the immunological synapse by dual color time-gated stimulated emission depletion (STED) nanoscopy. J Vis Exp. (85), (2014).
- Russ, J. C. . The Image Processing Handbook, Sixth Edition. , (2011).
- Stinchcombe, J. C., et al. Centrosome polarization delivers secretory granules to the immunological synapse. Nature. 443 (7110), 462-465 (2006).
- Vicidomini, G., et al. Sharper low-power STED nanoscopy by time gating. Nat Methods. 8 (7), 571-573 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados