Method Article
アクチンおよび誘導放出の枯渇 (STED) 顕微鏡を用いた B 細胞免疫シナプスにおける微小管細胞骨格の可視化
要約
B 細胞受容体に対する抗体、初期段階のモデルをコーティングした coverslips に拡がっている B 細胞で同時にイメージ アクチン構造、微小管と微小管プラス端結合蛋白質に STED 顕微鏡を使用するためのプロトコルを提案します。免疫シナプス形成。
要約
膜結合の抗原 (例えば、抗原提示細胞の表面に) に結合する B 細胞は免疫シナプス、B 細胞の受容器 (BCR) シグナリングを最適化する特殊な細胞構造と BCR を介した抗原獲得を形成します。両方アクチン細胞骨格および抗原のお問い合わせサイトへ微小管ネットワークの再方向付けの改造は、免疫シナプス形成に不可欠です。免疫シナプスの方の微小管重合中心の偏波と一緒に伴われるアクチン細胞骨格のアクチンの高密度周辺リングに改造します。皮質のプラス端キャプチャ蛋白質と同様、微小管プラス端結合蛋白質アクチンと微小管細胞骨格は、協調的に再編成することができます間の物理的な相互作用を仲介します。この細胞骨格の再編だけでなく、どのようにこれらの細胞骨格構造の理解図形免疫シナプス形成と BCR がシグナル伝達制御が B 細胞の活性化に新しい洞察力を提供できるメカニズムを解明します。これは、骨格のネットワーク組織の新たな詳細を明らかにする超解像顕微鏡手法の開発に助けられたが。我々 はここで B 細胞で transfected GFP 付けられた微小管プラス端結合蛋白質、微小管、同時にイメージ アクチン構造誘導放出の枯渇 (STED) 顕微鏡を使用する方法について説明します。免疫シナプス形成における初期のイベントをモデル化するには、B 細胞の BCR のシグナル伝達と細胞骨格の改造を開始する反免疫グロブリン (抗 Ig) 抗体でコーティング coverslips に広がりを許可します。A20 B リンパ腫細胞での GFP の融合蛋白質を表現するため、抗 Ig による細胞の拡散、および後続のセル固定、染色、画像取得と画像デコンボリューション手順のステップバイ ステップのプロトコルをいたします。これらの手順を使用して得られる高分解能画像アクチン構造、微小管、およびこれらの 2 つの細胞骨格ネットワークのリンクが微小管プラス端結合蛋白質を同時に可視化すること。
概要
抗原の配列にバインドするときに B 細胞偏極 (例えば、抗原提示の表面に表示される細胞 (APCs))、初めてクラシック免疫シナプス構造の形成に記載されているドライブをシグナル結果 B 細胞受容器 (BCR)T 細胞1,2,3,4,5,6,7,8,9,10、 11,12,13。当初は、B 細胞: APC の周囲に抗原区切 BCRs フォームのマイクロクラ スターは、サイトを問い合わせてください。これらのマイクロクラ スターは、どこ彼らは免疫シナプスの中核をなす中心的超分子活性化クラスター (cSMAC) に結合抗原接触部位の中心に向かって移動します。免疫シナプス形成は BCR シグナリングを最適化し、APC 膜14から BCR を介した抗原の抽出が容易になります。BCR を介した抗原内面と後続の抗原処理が続いて、この抗原の買収では、B 細胞を T 細胞に II 複合体のペプチド: MHC を示し、T 細胞の助け14を引き出すことができます。免疫シナプス形成確立新しい受容体組織のこの機能のパターンを提供できるメカニズムを解明、B 細胞の活性化を促進するため、どの液性免疫応答への洞察が開始され、規制。
アクチンと微小管細胞骨格の再編は、免疫シナプス形成に不可欠です。ローカライズされた BCR 刺激抗原の空間-偏波アレーによるシグナル伝達は、迅速かつ劇的なアクチン細胞骨格1,15の改造を誘導します。B 細胞の周囲に樹枝状アクチン構造の形成膜上の推進力を発揮し、B 細胞の拡散を促進する.これは B 細胞抗原の表面のより大きい区域をスキャンすることができます、BCRs 抗原を結合し、BCR のシグナル伝達経路をアクティブ化の数が増えます。同時に、脂質や微小管ネットワークは、抗原接触のサイトへ向きを変える。近づくにつれ、脂質抗原接触部位、B 細胞と抗原表面16,17界面膜の内側面に沿って、脂質から発せられる微小管を拡張します。これらの細胞の微小管は、抗原区切 BCR マイクロクラ スター18、cSMAC の形成につながるのダイニンを介する求心性運動のトラックとして動作できます。
向きかえおよび免疫シナプスに向かって脂質の偏波そのままアクチンと微小管細胞骨格が必要し、皮質アクチン ネットワークと微小管16,17、間の相互作用が多い 19,20。IQGAP1 などの皮質のアクチン結合蛋白質は微小管プラス端21を飾るタンパク質複合体との相互作用による微小管をキャプチャできます。プラス端結合タンパク質の動的複合体は、EB1 とクリップ-170、総称として微小管プラス端蛋白 (+ ヒント) を追跡21,22に含まれます。+ 微小管の両端のヒントは、細胞膜や大脳皮質のアクチン細胞骨格に関連付けられている蛋白質にバインドできます。こうと力発生機構 (例えばマイナス端監督皮質固定ダイニンの微小管の運動) により、脂質を配置し、微小管の引っ張る力を発揮します。足場のアクチン関連タンパク質 IQGAP123、連結クリップ 170 と我々 は免疫シナプス17に向かって BCR 誘導脂質分極に必要なこれらのタンパク質の両方が示されています。この IQGAP1 クリップ 170 の相互作用は、B 細胞の免疫シナプスにおける微小管ネットワークの再配置のアクチン細胞骨格の改造調整に重要な役割を再生可能性があります。
従来の蛍光顕微鏡は、B 細胞免疫シナプス形成2中にアクチンと微小管細胞骨格の劇的な再編を明らかにしました。しかし、このアプローチは、アッベの法律によると、サンプルと客観的24の開口部を照らすに使用されるライトの波長に依存する光の回折限界のために細部の小さなセル構造を解決できません。この回折限界には、横方向に 200-300 nm と軸方向25で 500 ~ 700 nm に従来の光顕微鏡の解像度が制限されます。したがって、微小管とアクチン細胞骨格の細部と同様、小さい細胞内構造のみ観察できる電子顕微鏡を用いたします。細胞骨格の電子顕微鏡画像は時間がかかる、生物学的構造を変更することができますし、抗体の検出に限定されます試料の固定そして準備プロトコルが必要です。能力 immunostain と同時にイメージの複数のタンパク質や細胞構造は蛍光顕微鏡の相当な利点。さらに、細胞の蛍光融合蛋白質を表現するリアルタイム イメージングを有効に、免疫染色興味の蛋白質のための効果的な抗体が利用できない場合に便利です。
超解像顕微鏡法における最近の技術の進歩が光の回折限界を克服し、ナノスケール細胞構造24の視覚化を許可しました。このような 1 つの超解像顕微法を誘導放出の枯渇 (STED) 顕微鏡と呼びます。STED では、2 つのレーザーは、1 つのレーザー励起蛍光体、ドーナツ状のパターンを持つ 2 番目のレーザーが蛍光発光蛍光体の周りを選択的に抑制を採用しています。これは単一の蛍光粒子の点広がり関数 (見かけの面積) を減らし、サブの回折限界の蛍光画像25,26を提供します。地上州枯渇顕微鏡も超解像度の画像を取得する蛍光ベースの技術を採用しています。ただし、画像取得と再構築の時間がかかります、fluorophores が付いて使用できる数が限られているがある、維持するために複数の骨格成分の同時の高分解能イメージングは技術的に難しくアクチンと微小管の構造には、異なる固定の手順が必要です。したがって、STED 電子顕微鏡上の複数の利点があるし、他の超解像顕微鏡法アプローチ最小限の後処理要件は、高速画像取り込みを提供しています、同じ fluorophores と染色技術を採用し、固定サンプル26の従来の蛍光顕微鏡に使用されています。
超解像顕微鏡法は、免疫シナプス ナチュラル キラー (NK) 細胞や T 細胞26,27,28,29,30,におけるアクチン構造を可視化する今使用されています31します。 ただし、微小管細胞骨格の超解像イメージングだけでなく、免疫シナプス形成過程における微小管とアクチン細胞骨格の調整の再編だけは近年報告されている17。BCR のシグナルを刺激し、細胞骨格の再編成を開始する反免疫グロブリン (抗 Ig) 抗体でコーティング coverslips に広めるために許可されていた画像 B 細胞使って STED 顕微鏡です。固定化抗 Ig 抗体のメッキ、時 B 細胞は劇的なアクチンに依存した拡散を受ける免疫シナプス形成過程における最初のイベントを繰り返すが。重要なは、STED 顕微鏡樹状免疫の周囲にフォーム シナプスし、それに接続されている微小管と同様に、脂質が抗原お問い合わせサイト17の近くに移動していた示した F アクチン リングの細部を明らかにしました。これらの微小管は F-アクチンの周辺のリングに向かって外側に延長。また、F-アクチン、チューブリン、IQGAP1、および GFP 付けられたクリップ 170 + のヒントのさまざまな組み合わせのマルチ イメージング STED を示した微小管プラス端クリップ-170-GFP でマークされた末梢アクチン網目と IQGAP1、密接に関連付けられている、皮質キャプチャ タンパク質17。
STED 顕微鏡による免疫シナプスにおける微小管とアクチン細胞骨格のイメージングのための詳しいプロトコルを紹介します。これらのメソッドは、広く BCR シグナルと免疫シナプス形成17,32,33,34,35を勉強するために雇われている A20 B 細胞ラインを使用して最適化されています。,36,37,38,39. クリップ 170 商業抗体が免疫染色前の実験のためによく働かなかったので述べる GFP 付けられたクリップ-170 A20 のセル、および同時に可視化するためのプロトコルを汚すで発現3 つの細胞骨格分子や細胞骨格関連タンパク質。NK 細胞免疫シナプスでイメージ アクチン STED 顕微鏡を使用する方法をされている40前に説明しました。ここでは、我々 は B 細胞におけるアクチンと微小管細胞骨格のマルチ色超解像画像を取得するこれを拡張します。
超解像顕微鏡検査のための重要な考慮事項は、細胞構造を維持し、蛍光タンパク質への損傷を防ぐのため、適切な固定法を使用しています。固定と染色方法の記載は、GFP 蛍光を保持し、アクチンと微小管ネットワークの高分解能イメージングを提供する最適化されています。蛍光蛋白質を表現するときは、B 細胞は transfect に困難注意必要があります。このプロトコルは、20-50% を使用 A20 のセルは通常 transfected GFP の融合蛋白質を表現、この人口の中で蛋白質の表現のレベル変数。それにもかかわらず、述べるプロシージャを使用して微小管とアクチンの超解像イメージングは非常に堅牢な高品質の画像が容易に得られます。A20 のセルと相対的サイズが小さいにもかかわらずを示すこれらのプロシージャはリポ多糖 (LPS) を簡単に活性化されているプライマリの B 細胞における微小管ネットワークの画像にも使用できます。我々 は主要な B 細胞の LPS 活性化は、(すなわち、イムノブロット タンパク質枯渇を検出できることそのような物)、比較的高い効率で Sirna 発現することができます示されているそれらに B 細胞のいくつかの研究用には良い選択肢を作る17。
プロトコル
動物のすべてのプロシージャは、ブリティッシュ コロンビア州動物ケア委員会の大学によって承認されました。
1. A20 B リンパ腫細胞における GFP 融合蛋白質を表現します。
- A20 細胞が 5 と組織文化のインキュベーターで 37 ° C で RPMI 培地 (10% 熱不活化ウシ胎児血清 (FBS)、50 μ M 2-メルカプトエタノール、グルタミン 2 mM、1 mM ピルビン酸、50 U/mL ペニシリン、50 μ g/mL ストレプトマイシンと添加 RPMI 1640) を完了します。% CO2。
- トランスフェクション試薬の準備 (材料表参照) 製造元の指示に従って。
注: このプロトコルは、特定の試薬のために最適化されています、トランスフェクション プロトコルで説明テーブルの材料。我々 は試みた他のトランスフェクション試薬がない十分な遺伝子導入効率が得られました。 - 診断を使用してセルをカウントします。525 x g に 5 分 (各トランスフェクション) の遠心分離機 2.5 x 106 A20 セルでは、1 〜 2.5 μ g のプラスミド DNA を含む遺伝子導入試薬を 100 μ l 添加の細胞を再懸濁します。クリップ-170-GFP23をエンコード、DNA トランスフェクションあたり 2.5 μ g を使用します。優しく混ぜます。
- 6 ウェル プレートのウェルにセルを転送し、予め温めておいた完全 RPMI 培地 2 mL にボリュームを調整します。蛋白質の表現を許可する 37 ° C で 18 h の細胞を培養します。
2. プライマリ マウス B 細胞を分離し、組合でそれらをアクティブ化します。
- 滅菌手術用ツールを使用して、次の機関の動物ケア委員会によって承認されたプロトコル、マウスから脾臓を削除します。
- ティッシュ文化フードの室温滅菌 PBS の 3 mL を含む 35 mm の培養皿に滅菌 70 μ m の細胞ストレーナーを配置します。セル ストレーナーを介して脾臓を粉砕するのに 5 ml シリンジのプランジャーのゴムの部分を使用します。
- 滅菌 15 mL チューブに 525 x g で 5 分間遠心 splenoctyes 単一細胞懸濁液をピペットで移しなさい。
- 磁気ビーズを用いた B 細胞分離キット B 細胞の高濃縮人口を取得する (材料の表を参照) を使用します。
- 2.5 μ g/mL LP プラス 5 ng/mL B 細胞活性化因子 (BAFF; 生存サイトカイン) を添加した完全 RPMI 培地で 3 × 106/mL に B 細胞を再懸濁します。
- 37 ° C で 6 時間、細胞を培養します。
3. コーティング ガラス Coverslips 抗 Ig 抗体を
- コーティング、coverslips 抗体溶液を準備します。12.5 μ g/mL の溶液; ように部屋の温度滅菌 PBS にヤギ抗マウス免疫グロブリン抗体の原液を希釈します。抗体溶液を 400 μ l 添加が各 coverslip のため必要です。
注: は、A20 のセル; ヤギ抗マウス igg 抗体を使用します。主な B 細胞のヤギ抗マウス igm 抗体を使用します。ヤギ IgG 抗体は、マウスの Fc 受容体にはバインドしません。ただし、任意の潜在的な Fc 受容体の結合を避けるためには、1 つは、抗マウス IgG の F(ab) または F(ab') の2フラグメントまたは抗マウス IgM 抗体を使用できます。 - 100% メタノールで #1.5 18 mm ラウンド ガラス基盤を浸し、それは完全に乾燥させて (~ 10 分)。
- 鉗子を使用して、乾燥 coverslip、12 ウェル培養プレートをピペットで移し 400 μ L、coverslip に 12.5 の μ G/ml 抗体溶液 (5 μ g 合計; 2 μ g/cm2) の端に広がる、coverslip の中心にバブルを形成できるように。
- 全体の観察をカバーするため注意してくださいが、組織培養プラスチックにガラス基板の端を越えて拡張する抗体溶液を許可しません。30 分間室温でインキュベートします。
- よく、その後の解決策を吸引にピペット 1 mL の滅菌 PBS によって、coverslips を洗います。非連結の抗体を削除を 2 回を繰り返します。
- 含まれている抗体をコーティングした coverslip セルが追加できるようになるまでに 1 mL の滅菌 PBS を追加します。
注: coverslips 覆われて PBS、同じ日に使用するため、室温で保存できます。
4 B 細胞抗 Ig コーティング Coverslips に広がって
- 準備 HEPES バッファーを変更生理食塩水 (mHBS): 25 mM HEPES、pH 7.2、125 mM の NaCl、KCl、1 mM CaCl25 mM、1 mM の Na2HPO4、0.5 mM MgSO4、1 mg/mL のブドウ糖、2 mM グルタミン、1 mM ピルビン酸ナトリウム、および 50 μ M 2-メルカプトエタノール)。フィルターは、このソリューションを殺菌し、4 ° C で保存
- 2% と mHBS の 50 mL を作る実験の日、FBS (mHBS-FBS) FBS の熱不活化の 1 mL を 50 mL の mHBS に追加することによって。使用する前に 37 ° c mHBS FBS を温めます。
- Transfected A20 のセルまたは BAFF と LP 5 分 525 x g で培養した主な B 細胞を遠心します。
- MHBS FBS の 1 mL の細胞を再懸濁します、診断、セルをカウント、2 x 105セル/ml mHBS FBS に細胞を希釈します。
- 鉗子を使用すると、パラフィンの膜の部分に組織培養プレートから、coverslip を転送します。
- 各 coverslip に 5 × 104 (B 細胞) の 250 μ L を追加します。
- B 細胞は、抗 IgG コーティング表面を普及するために暗闇の中で 15 分間 37 ° C で coverslips を孵化させなさい。
5. 固定と免疫細胞
- 16% パラホルムアルデヒド原液を希釈することによって固定の解決と最終濃度 3% パラホルムアルデヒドと 0.1% のグルタールアルデヒドを屈する常温蒸留水に 50% グルタルアルデヒド ストック溶液を準備します。使用すると任意の過剰を破棄だ日固定の解決を準備します。
注意: パラホルムアルデヒドとグルタルアルデヒド溶液は、化学の発煙のフードのみ使用する必要があります。化学物質安全性データ シート (MSDS) の指示に従います。 - 透過/ブロック バッファーを準備 (3 %bsa と 0.1% トリトン X-100 で希釈した PBS)。フィルターは、このソリューションを殺菌し、4 ° C で保存実験の日、部屋の温度に必要量を温めます。
- 染色バッファー (PBS で 1 %bsa と 0.1% サポニン) を準備します。0.2 μ m フィルターを使用してこのソリューションを殺菌し、4 ° C で保存実験の日、部屋の温度に必要量を温めます。
- ピペット 350 μ L の表面が完全に覆われていることを確認、各 coverslip に固定液。暗闇の中で 10 分間室温でインキュベートします。
- 慎重に、micropipet を使用してカバーガラスの端から吸引、coverslip から固定・ ソリューションを取り外します。
注意: 固定の解決は、有害な化学廃棄物として破棄しなければなりません。 - 透過/ブロック バッファーの 500 μ L で一度 coverslips を洗います。液体をピペットで移しなさい。
- Permeabilize し、各 coverslip に透過/ブロック バッファーの 250 μ L を追加し、暗闇の中で部屋の温度で 10 分間インキュベート細胞をブロックします。
- バッファーを染色にウサギ抗チューブリン抗体 1: 100 を希釈します。
- Coverslips から透過/ブロック バッファーを離れて吸い出しなさい、希釈の抗チューブリン抗体溶液 50 μ L を各 coverslip に追加します。暗闇の中で 30 分間室温でインキュベートします。
- Alexa Fluor 532 共役ヤギ抗うさぎ igg 抗体二次抗体と染色バッファーで Alexa Fluor 568 共役ファロイジンを 1: 100 希釈することによって二次抗体/アクチン染色ソリューションを準備します。
- 3 回の coverslips を洗浄すると、バッファーを染色し、それを吸引の 500 μ L を追加することによって余分な一次抗体を削除します。
- 各 coverslip に二次抗体/アクチン染色溶液 50 μ L を追加し、暗闇の中で室温で 30 分間インキュベートします。
- 3 回の coverslips を洗浄すると、バッファーを染色し、それを吸引の 500 μ L を追加することによって余分な二次抗体を削除します。
- 顕微鏡のスライドに取り付け試薬の 10 μ L を追加します。ダウン細胞側の顕微鏡スライド上に coverslip をマウントします。
注: GFP の融合蛋白質の蛍光強度を維持するために「耐フェード"マウント媒体が強くお勧めします (材料表を参照) です。DAPI、STED レーザーを使用する場合、fluorophores のイメージングを妨げることができますを含む試薬をマウントの使用を避けます。 - 暗闇の中で一晩乾燥してスライドを許可します。画像スライドの次の日。
注意: は強く推奨は、coverslip が乾燥するとすぐにスライドを画像として GFP の蛍光が時間とともに減少します。
6. STED 顕微鏡を用いたイメージング
: 注すべてのソフトウェアの手順に従って、顕微鏡と我々 が使用するソフトウェアに固有 (材料の表を参照してください)。手順と設定は、別の顕微鏡/ソフトウェアを使用してイメージングを実行される場合に調整する必要があります。
- STED 顕微鏡、レーザーと落射蛍光照明ランプをアクティブ化および顕微鏡ソフトを起動します。
- STED 枯渇レーザーのパラメーターを設定します。
注: これは使用されている特定の顕微鏡とレーザーが装備されているに依存されます。いくつかの設定は、白色光 (WLL) 70% 推奨592 nm レーザー 80%;660 nm レーザーの 80%。 - STED 設定をアクティブにする、100 × 対物を使って STED レーザービームを合わせます。
- 接眼レンズを使用して、サンプルを集中し、GFP 発現を持つセルを選択します。
STED 発光強度が少なくなるので注: 低 GFP 発現は見えません。逆に、クリップ-170-GFP の高発現は、通常微小管プラス端蛋白質複雑な形態と分布を反映しない大規模なクラスターの自発の形成を誘導します。GFP 発現とセルを選択正確に抗原接触部位に細胞骨格構造をイメージングに不可欠です。 - 選択したセルにズーム、イメージを作成する関心の領域を選択します。Coverslip に最も近い B 細胞のx-y平面は、フォーカス、フォーカスを調整します。
- これを行うには、B 細胞の細胞骨格構造にフォーカスし、行ったり来たりピント、徐々 に近い目的を coverslip に移動します。その後、徐々 に移動目的反対方向に B 細胞の細胞骨格構造が最初に帰ってくるまで。
- レーザー パワー、励起光検出器範囲などの設定を最適化します。製造元が推奨する設定を開始します。サンプルの信号を最適化するために必要に応じて調整を行います。お互いに同じ設定で比較するすべてのサンプルをイメージします。
- ソフトウェアの「取得」タブの下"の間にフレーム」オプションをチェックして、左下の「シーケンシャル スキャン」パネルで順次フレーム集録画像の取得を設定します。
- アクイジション ・ シーケンスを設定します。
注: 取得 GFP 蛍光最初 GFP 信号の劣化を避けるためにします。
GFP に加えて使用されている蛍光物質の組み合わせによってより長い波長の蛍光信号のイメージング最初が良い結果をもたらします。ただし、最強の蛍光シグナルと最高の解像度を取得する蛍光物質または蛍光タンパク質が誘導放出の枯渇を受けるおよびイメージ順序を最適化する必要があります。 - 選択ソフトウェアの「獲得」タブで各 fluorophore の STED レーザー パワーを設定およびレーザー パワーを調整する 592 nm または 660 nm STED レーザーのスライダー バーを使用。GFP および Alexa Fluor 532 枯渇 592 nm レーザーのパワーを調整します。Alexa Fluor 568 の 660 nm 枯渇レーザー パワーを調整します。
- 解像度を上げるとバック グラウンド信号を削減、ソフトウェアの「獲得」タブの下の「取得」設定に移動、行またはドロップ ダウン メニューを使用して、各オプションの 1 より大きい値を選択することにより平均フレームを増加します。
- また、「獲得」タブ fluorophore のゲート チェック時間ゲートの値を指定することによって時間ゲート STED を用いた蛍光信号を取得 (下のメモを参照してください).Fluorophores の退色も向上しますが、精度を高めるため STED レーザー電力を増加します。
注: ゲートの開閉時間は、顕微鏡、サンプルでは、使用されている蛍光物質に最適化する必要があります。0.3 に 6 ns お勧めの時間ゲートの場合。固定後、GFP は高いレーザー パワーに特に敏感です。適用されるべき時間ゲート GFP の退色を抑えると STED のレーザー出力を削減する必要があります。 - ポイントを変更するスライダーを使用して、STED の 3 D 画像をキャプチャするには、関数 (PSF) を「3 d STED」に広がった。
- 手動で再現性を確保するための複数の画像を取得します。(図 1参照) の画像を deconvolve41デコンボリューション ソフトウェアを使用してパッケージ化 (材料の表を参照してください)。
結果
B 細胞固定化抗 Ig に広がり、デコンボリューション ソフトウェアと組み合わせて使用 STED 顕微鏡共焦点顕微鏡より骨格構造の高解像度の画像を提供します。これは明らかに図 1、F アクチン ネットワークは上記で説明したプロトコルを使用して可視化したところ。共焦点の比較同じ STED 超解像画像 STED 画像は、高解像度番組のサンプルし、アクチン細胞骨格 (図 1) の構造の詳細を明らかにします。この図はまた、デコンボリューションは、アクチン フィラメントがより明確に定義されている高品質 STED 画像を得るために不可欠を示します。共焦点画像のデコンボリューションに画像の解像度の大幅な改善が得られますが逆算 STED 画像は逆算の共焦点画像より詳細な構造情報を提供します。特に、詳しく周辺 F アクチン リングの樹状構造を解明して、STED 顕微鏡 (図 1および図 2)。抗原接触部位に微小管ネットワークはまたサンプル準備を行い (図 3) 上記プロトコルをイメージングをイメージしました。微小管は、脂質である中心点に属し、セルの外周に向かって外側に発散します。この実験では、B 細胞は 15 分 (図 3) で、脂質が抗原お問い合わせサイト17に向かって移動時点抗 Ig コーティング coverslips に普及し許されました。微小管プラス端をマーク クリップ-170-GFP クラスターは、図 3に示すように微小管の端に見ることができます。サンプル準備および微小管ネットワークの STED イメージ投射は最適、連続および異なるクリップ-170-GFP 微小管に沿ってまたはプラス端 (図 3 a) にローカライズで微小管が観察します。染色、染色抗体または α-チューブリン抗体は 1 歳以上、微小管が悪い解決不連続セクションとして表示される結果のバッチの低濃度を使用するときに観測された準最適の微小管デコンボリューションに (図 3 b; も図 5を参照)。すべてのこれらのイメージのクリップ-170-GFP 蛍光は α-チューブリン-immunostained 構造に関連付けられているが、1 つのクリップ-170-GFP は、プラス端にまたは不完全な染色のため、微小管の長さに沿って配置するかどうかを区別できません。微小管。したがって α-チューブリン抗体がメーカー推奨保管条件、1 年以内使用の下で保存することが重要です。
このプロトコルは、組織とアクチン細胞骨格と微小管ネットワークと同様、これらの 2 つの細胞骨格の17、関連付ける IQGAP1 などクリップ 170 蛋白質の構造を示す高品質多色 STED 画像を使用してください。取得でした。図4 STED 画像は、アクチン染色は大いにより少なく密なセルの中央の場所から発する微小管と同様に、樹枝状アクチンの周辺のリングを示しています。これらの微小管の両端にクリップ-170-GFP は周辺 F-アクチンと密接に関連します。このプロトコルでは、単色 STED (図 2) をイメージングまたは多色 STED (図 3および図 4) をイメージングを使用して免疫シナプスにおける細胞骨格の構造を視覚化することができます。ただし、単色 STED イメージング (図 2) がマルチカラー STED (図 4) よりも B 細胞における微小管とアクチン構造の良好な分解能をもたらす可能性があります。これは異なった fluorophores のシーケンシャル STED 画像集録によるフォトブリーチングによる可能性があります。最高の超解像画像 fluorophores の蛍光蛋白質の選択、組み合わせ、励起と枯渇のレーザーを使用して作成されます、シーケンスを取得するには、サンプルを最適化する必要があります。それにもかかわらず、マルチカラー STED イメージングは、従来の共焦点顕微鏡よりもこれらの細胞骨格構造の高解像度の画像を提供します。また、単色・ スティードは、全体の B 細胞のアクチンまたは微小管ネットワーク (映画 1) の三次元超解像画像を取得する使用できます。
蛍光融合タンパク質発現細胞を用いた、最適な表現のレベルを達成して過剰発現による成果物の回避が重要な考慮事項です。クリップ-170-GFP を過剰発現細胞でクリップ-170-GFP の大きな凝集体が形成される (図 5 a)。この、クリップ-170-GFP のサッカード定位誤り、に加えてこのセル内微小管ネットワークの部分だけは coverslip (図 5 b) に最も近い焦点平面内だった。これはクリップ 170 過剰発現では脂質の BCR 誘起分極を損なう可能性がありますも示唆しています。逆に、強い蛍光信号は通常高品質 STED の画像を取得するために必要なのでクリップ-170-GFP (図 5) などの蛍光融合タンパク質の発現は低下の質の悪い画像の結果します。したがって、蛍光タンパク質のトランスフェクションした細胞を使用する場合、融合タンパク質発現の最適なレベルを持つセルだけをイメージすることが重要です。また、A20 の使用されたトランスフェクション プロトコル細胞 (材料表参照) 通常 transfected たんぱく質を発現している細胞の 20-50% の結果に注意してくださいすることが重要です。プラスミド DNA (Sirna) ではなくの主な B 細胞のトランスフェクション頻度が多いくらい A20 のセルに B 細胞株の使用を要求するより低い。それにもかかわらず、このプロトコル (図 6) を使用して融合の主な B 細胞の細胞骨格要素の高品質 STED の画像が得られます。
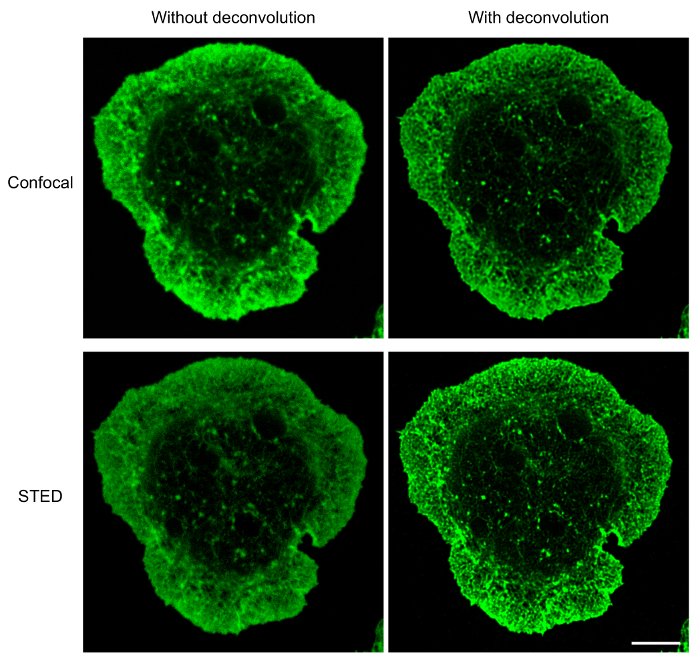
図 1: 共焦点の比較と F-アクチンの STED イメージングします。共焦点画像 (top) と Alexa Fluor 532 共役ファロイジンで染色される前に 15 分間抗 IgG コーティング coverslips に広がっていた A20 のセルの STED 画像 (下)。共焦点顕微鏡による放置、STED STED 顕微鏡を使用して、同じセルをまずイメージしました。同じ共焦点と STED 画像デコンボリューション後と共に、初期共焦点、STED の画像が表示されます。スケール バー: 5 μ m.この図の拡大版を表示するのにはここをクリックしてください。

図 2: 抗原接触部位にアクチン細胞骨格。15 分の抗 IgG コーティング coverslips に広めるために許可されていた A20 のセル Alexa Fluor 568 共役ファロイジンで染色、STED 顕微鏡によるイメージングします。初期の STED 画像を逆算しました。パネルA BおよびC Eのパネルは、2 つのセルの代表的な画像を表示します。Eパネルは、パネルCの白いボックスの地域の 3 倍の拡大を示しています。パネルA ~ Dのスケール バー: パネルEの 5 μ m スケール バー: 1 μ m.この図の拡大版を表示するのにはここをクリックしてください。
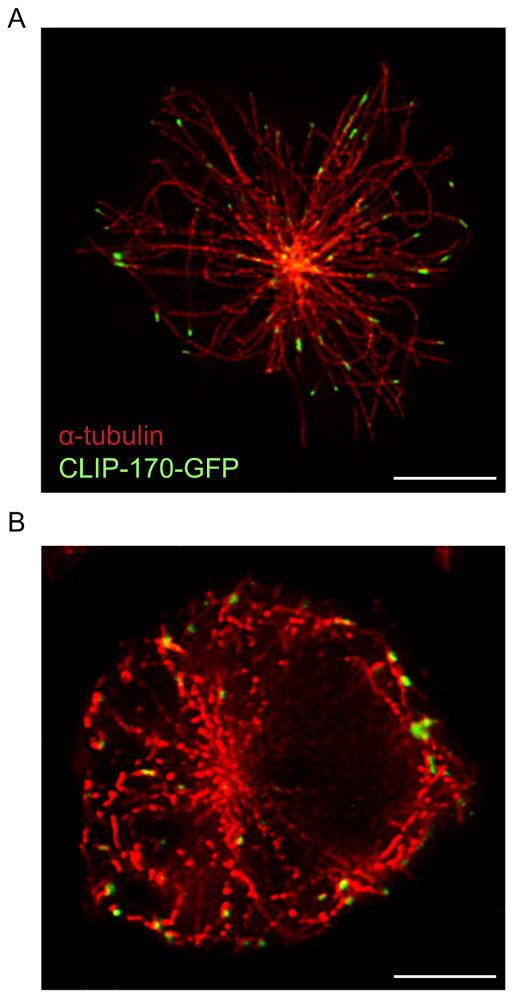
図 3: 微小管ネットワークとクリップ-170-GFP の STED イメージ。クリップ-170-GFP を発現する A20 細胞は抗 IgG コーティング coverslips 固定される前に 15 分間の α-チューブリン抗体プラス Alexa Fluor 532 共役二次抗体と immunostained 広がりを許されました。(A) 代表的な画像にクリップ-170-GFP 微小管プラス端に主にある微小管ネットワークの染色を示します。(B) のサブ最適な染色と α-チューブリン抗体の古い在庫の使用による微小管の解像度。スケール バー: 5 μ m.この図の拡大版を表示するのにはここをクリックしてください。
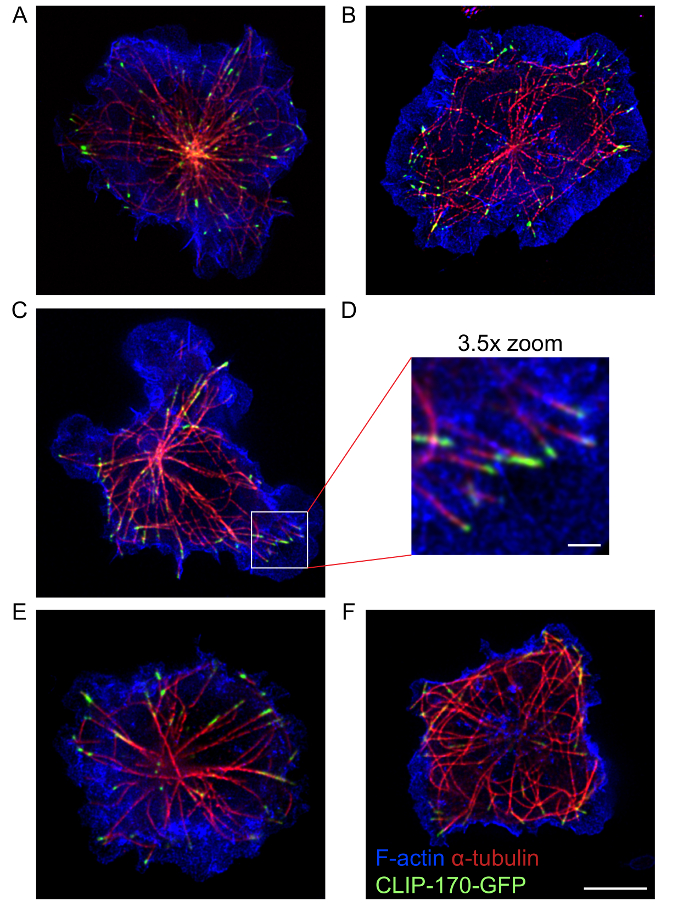
図 4: アクチンと微小管細胞骨格の STED イメージ。クリップ-170-GFP を発現する A20 細胞が固定され、F-アクチンを視覚化する Alexa Fluor 568 共役ファロイジンと α-チューブリン抗体プラス Alexa Fluor 532 共役を染色する前に 15 分間抗 IgG コーティング coverslips に普及し許可されました。微小管を視覚化する二次抗体は。パネルA DとE Fのパネルは、2 つのセルの代表的な画像を表示します。パネルDはパネルCの白いボックスの領域の 3.5 倍の拡大です。スケール バー: A CとE ・ Fパネルの 5 μ mパネルDの 1 μ m。パネルAのイメージ図 3 aで使用される同じイメージですが、F アクチン チャネルのオーバーレイが含まれます。この図の拡大版を表示するのにはここをクリックしてください。

図 5: 過剰発現または GFP 融合タンパク質発現が不足しているため、質の悪い STED 映像例です。クリップ-170-GFP を発現する A20 細胞は固定され、図 4のように染色する前に 15 分間抗 IgG コーティング coverslips に普及し許されました。(A B)クリップ-170-GFP (A)と抗原接触に向けて障害者の脂質分極の大きい、異常総計でクリップ-170-GFP 発現結果(B)のサイトします。(C)補償が不足しているクリップ-170-GFP 発現 STED 画像の品質が低いレーザー力結果を増やすことによって。スケール バー: 5 μ m.この図の拡大版を表示するのにはここをクリックしてください。

図 6: プライマリの B 細胞の微小管細胞骨格の STED イメージ。プライマリ splenic B セルは 5 ng/μ L BAFF で 6 h プラス 2.5 μ g/mL LP、培養され、抗 IgM 抗体コーティングされていた coverslips 上で 15 分間広めるために許可し。セルが固定し、α-チューブリン抗体に加えて、微小管を視覚化する Alexa Fluor 568 共役二次抗体で染色します。代表的な画像が表示されます。スケール バー: 5 μ m.この図の拡大版を表示するのにはここをクリックしてください。

映画 1: B 細胞微小管ネットワークの 3次元復元します。A20 のセルは固定される前に 15 分間抗 IgG コーティング coverslips と α-チューブリン抗体プラス Alexa Fluor 488 標識二次抗体と immunostained 広がりを許されました。Z スライスは、合計 37 フレームの 0.2 μ m ステップ サイズで捕獲されました。3 D の再建が行われた STED 顕微鏡を用いたイメージング ソフトウェア。してくださいここをクリックしてこのビデオを表示します。(右クリックしてダウンロード)
ディスカッション
50 の解像度を理論的に達成できる STED 超解像顕微鏡を用いた細胞骨格構造の詳細な画像を得ることが回折限界解像度が 200 〜 と、従来の共焦点顕微鏡と比較して nm nm24. デコンボリューション ソフトウェアを使用して「ぼやけ」蛍光の観測信号から元の光源の可能性が最も高い位置を計算するにより細かい構造を解決する機能をさらに拡張します。このプロトコルでは、細胞骨格関連タンパク質と同様、微小管とアクチン細胞骨格のイメージを STED を使用する方法について説明します。
B 細胞の活性化は、免疫シナプス形成17,42にとって重要である 2 つの細胞骨格の調整規則とアクチン細胞骨格の微小管ネットワークの改造を誘導します。提案法はマルチカラー STED を用いた抗原接触部位に微小管とアクチン細胞骨格を同時にイメージングに最適化されていますが単色 STED の両方を対象。STED がどのように細胞構造に新たな洞察を提供できる B 細胞骨格の強調表示で行った先行研究の整理し、彼らの対話します。共焦点および総内部蛍光 (TIRF) 顕微鏡を使用して、我々 は F アクチン抗原お問い合わせサイト17の周囲にリングを微小管に連絡を観察していた。STED 顕微鏡を使用して、マークされていた微小管プラス端を示すことが、先端クリップ-170 は細胞周囲で樹枝状アクチン ネットワーク密接に関連付ける + (図 4を参照)。
複数の要因が、1 つの特定のアプリケーションに最も適したイメージング技法に影響を与えます。必要な解像度、イメージを作成する構造、ラベル技術と信号対雑音比 (すなわちコントラスト)、アクイジション時間, 試料調製及び再現性のしやすさが挙げられます。STED のサンプル準備は共焦点の顕微鏡検査のため大幅に異なるではなく、迅速な画像の取得と高解像度を兼ね備えています。STED の主な利点は、それはサンプルからの画像を直接取得光プロセス STED レーザー24の力を変更することによって解像度を調整できます。地上州枯渇超解像顕微鏡とは異なりのキャプチャの連続画像の何千もからの画像を再構築する、広範な計算処理は不要、STED および画像再構成アーチファクトの導入は避け24します。 しかし、STED 画像のコントラストはしばしば低24、ケース後画像処理 ImageJ がコントラストを高めるために必要であるようなソフトウェアを使用します。これは、樹枝状アクチン ネットワークなどの密な構造を持つ画像のため特に重要です。画像取り込み中に画像のコントラストを向上させるため、1 つ枯渇レーザー電力を削減したり、行またはフレームの平均を適用します。時間ゲート ・ スティード、ユーザー セット時間の遅延の後、光子をキャプチャ、光子が収集した24,43となる領域を減少させることによって、解像度を増やすことができます。コントラストと解像度を改善するためにこれらのメソッドの組み合わせを使用して免疫シナプス細胞骨格構造の STED 画像を最適化することをお勧めします。
現在、すべて fluorophores が付いている STED、イメージングに最適なすべての蛍光体の組み合わせは多色 STED の画像を取得するために適しています。検出範囲を慎重に調整は隣接チャンネルに fluorophores のブリードを最小限確保するため重要です。(すなわちGFP、Alexa Fluor 532、Alexa Fluor 568) このプロトコルで使われる蛍光物質の組み合わせは、多色 STED 超解像イメージングに最適です。構造化照明顕微鏡を用いて (SIM) と比較して、単一分子のローカライズ方法 (SMLM)、光重合のローカリゼーション顕微鏡 (ヤシ)、STED などは通常マルチカラー イメージングに最適ではありません。ただし、蛍光検出のわずかな白とびを紹介簡単な画像処理ツールと組み合わせると、提供できる微小管とアクチン細胞骨格の高解像度のカラー画像。
STED イメージング細胞骨格構造のためこのプロトコルは、B 細胞の免疫シナプスにおける細胞骨格のアーキテクチャの新たな詳細を明らかにしました。B 細胞の抗原接触サイトでアクチンと微小管細胞骨格のイメージングのためのこのプロトコルを最適化したこれらの方法他のセルのタイプ、特に免疫細胞(T 細胞、NK 細胞、肥満細胞等)を形成するに適用する必要があります。免疫シナプス。さらに、このプロトコルのユーティリティは他の配位子と接着基板 coverslips をコーティングしたり拡張できます。ただし、プロトコルとセルの種類の実験のセットアップ画像集録設定を最適化することが重要です。
開示事項
著者が明らかに何もありません。
謝辞
UBC ライフ サイエンス研究所 (LSI) イメージング施設を支援し、STED 顕微鏡を維持するために感謝いたします。この作品から健康の研究のカナダの協会 (M.R.G.) の #68865 助成金によって資金を供給されました。クリップ-170-GFP プラスミドありがとう貝淵弘三博士 (名古屋大学, 名古屋市)。
資料
| Name | Company | Catalog Number | Comments |
| Cell culture | |||
| A20 mouse B-lymphoma cells | ATCC | TIB-208 | Murine B-cell lymphoma of Balb/c origin that expresses an IgG-containing BCR on its surface |
| RPMI-1640 | Thermo Fisher Scientific | R0883 | |
| Fetal bovine serum | Thermo Fisher Scientific | 12483020 | Heat inactivate at 56 oC for 30 min |
| 2-mercaptoethanol | Millipore Sigma | M3148 | |
| Glutamine | Millipore Sigma | G5763 | |
| Sodium pyruvate | Millipore Sigma | P5280 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | Liquid, 10,000 units |
| Additional materials for primary B cells | |||
| 70-µm cell strainer | Corning | 352350 | |
| Magnetic bead-based B cell isolation kit | Stemcell Technologies | 19854 | EasySep Mouse B cell Isolation kit |
| Lipopolysaccharide (LPS) | Millipore Sigma | L4391 | LPS from E. coli 0111:B4 |
| B cell-activating factor (BAFF) | R&D Systems | 2106-BF-010 | |
| Name | Company | Catalog Number | Comments |
| Transfection | |||
| Plasmid encoding CLIP-170-GFP | Gift from Dr. Kozo Kaibuchi (Nagoya Univ., Nagoya, Japan); described in Fukata et al. Cell 109:873-885, 2002 | ||
| Recommended transfection reagents and equipment | |||
| Amaxa Nucleofection kit V | Lonza | VCA-1003 | Follow the manufacturer's directions for mixing the transfection reagents with the DNA |
| Amaxa Nucleofector model 2b | Lonza | AAB-1001 | Program L-013 used |
| Falcon 6-well plates, TC treated, sterile | Corning | 353046 | |
| Name | Company | Catalog Number | Comments |
| Coating coverslips | |||
| 18-mm diameter round #1.5 cover glasses | Thomas Scientific | 1217N81 | Similar product: Marienfield-Superior catalogue #117580 |
| Forceps | Fisher Scientific | 1381242 | Dissecting extra fine splinter forceps |
| Falcon 12-well sterile tissue polystyrene tissue culture plate | Corning | 353043 | |
| 100% methanol | Fisher Scientific | A412-4 | |
| Sterile phosphate buffered saline (PBS) without calcium or magnesium | Thermo Fisher Scientific | 10010049 | |
| Goat-anti-mouse IgG antibody | Jackson ImmunoResearch | 115-005-008 | For A20 cells |
| Goat-anti-mouse IgM antibody | Jackson ImmunoResearch | 115-005-020 | For primary mouse B cells |
| Name | Company | Catalog Number | Comments |
| Staining | |||
| Paraformaldehyde (16% stock solution) | Electron Microscopy Sciences | 15710 | Dilute with PBS to working concentration |
| Glutaraldehyde (50% stock solution) | Millipore Sigma | 340855 | Dilute with PBS to working concentration |
| Triton X-100 | Fisher Scientific | BP151-500 | |
| Saponin | Millipore Sigma | S2149 | |
| Bovine serum albumin (BSA), Fraction V | Millipore Sigma | 10735094001 | |
| Rabbit anti-tubulin antibody | Abcam | ab52866 | 1:250 dilution recommended but should be optimized |
| Alexa Fluor 532-conjugated goat anti-rabbit IgG | Thermo Fisher Scientific | A11009 | 1:100 dilution recommended but should be optimized |
| Alexa Fluor 568-conjugated phalloidin | Thermo Fisher Scientific | A12380 | 1:100 dilution recommneded but should be optimized |
| Prolong Diamond Antifade Mountant | Thermo Fisher Scientific | P36970 | Without DAPI |
| Fisherbrand Superfrost Plus Microscope Slides | Fisher Scientific | 12-550-15 | |
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Parafilm | VWR | P1150-2 | |
| HEPES | Millipore Sigma | H3375 | |
| NaCl | Fisher Scientific | BP358 | |
| KCl | Millipore Sigma | P9333 | |
| CaCl2 | Millipore Sigma | C1016 | |
| Na2HPO4 | Fisher Scientific | S374-500 | |
| MgSO4 | Fisher Scientific | M63 | |
| Dextrose | Fisher Scientific | D16-500 | |
| Name | Company | Catalog Number | Comments |
| Microscopy | |||
| Leica SP8 TCS STED microscope | Leica | ||
| Huygens deconvolution software | Scientific Voume Imaging | See https://svi.nl/HuygensProducts |
参考文献
- Harwood, N. E., Batista, F. D. The cytoskeleton coordinates the early events of B-cell activation. Cold Spring Harb Perspect Biol. 3 (2), a002360 (2011).
- Batista, F. D., Treanor, B., Harwood, N. E. Visualizing a role for the actin cytoskeleton in the regulation of B-cell activation. Immunol Rev. 237 (1), 191-204 (2010).
- Harwood, N. E., Batista, F. D. Early events in B cell activation. Annu Rev Immunol. 28, 185-210 (2010).
- Batista, F. D., Harwood, N. E. The who, how and where of antigen presentation to B cells. Nat Rev Immunol. 9 (1), 15-27 (2009).
- Kumari, S., et al. T cell antigen receptor activation and actin cytoskeleton remodeling. Biochim Biophys Acta. 1838 (2), 546-556 (2014).
- Dustin, M. L. Visualization of Cell-Cell Interaction Contacts: Synapses and Kinapses. Self Nonself. 2 (2), 85-97 (2011).
- Dustin, M. L., Chakraborty, A. K., Shaw, A. S. Understanding the Structure and Function of the Immunological Synapse. Cold Spring Harb Perspect Biol. 2 (10), a002311 (2010).
- Dustin, M. L. Modular design of immunological synapses and kinapses. Cold Spring Harb Perspect Biol. 1 (1), a002873 (2009).
- Dustin, M. L. Visualization of cell-cell interaction contacts-synapses and kinapses. Adv Exp Med Biol. 640, 164-182 (2008).
- Dustin, M. L. Hunter to gatherer and back: immunological synapses and kinapses as variations on the theme of amoeboid locomotion. Annu Rev Cell Dev Biol. 24, 577-596 (2008).
- Dustin, M. L. T-cell activation through immunological synapses and kinapses. Immunol Rev. 221, 77-89 (2008).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Monks, C. R., et al. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Yuseff, M. I., et al. How B cells capture, process and present antigens: a crucial role for cell polarity. Nat Rev Immunol. 13 (7), 475-486 (2013).
- Mattila, P. K., Batista, F. D., Treanor, B. Dynamics of the actin cytoskeleton mediates receptor cross talk: An emerging concept in tuning receptor signaling. J Cell Biol. 212 (3), 267-280 (2016).
- Kuhn, J. R., Poenie, M. Dynamic polarization of the microtubule cytoskeleton during CTL-mediated killing. Immunity. 16 (1), 111-121 (2002).
- Wang, J. C., et al. The Rap1-cofilin-1 pathway coordinates actin reorganization and MTOC polarization at the B cell immune synapse. J Cell Sci. 130 (6), 1094-1109 (2017).
- Schnyder, T., et al. B cell receptor-mediated antigen gathering requires ubiquitin ligase Cbl and adaptors Grb2 and Dok-3 to recruit dynein to the signaling microcluster. Immunity. 34 (6), 905-918 (2011).
- Nath, S., et al. Dynein Separately Partners with NDE1 and Dynactin To Orchestrate T Cell Focused Secretion. J Immunol. 197 (6), 2090-2101 (2016).
- Combs, J., et al. Recruitment of dynein to the Jurkat immunological synapse. Proc Natl Acad Sci U S A. 103 (40), 14883-14888 (2006).
- Akhmanova, A., Steinmetz, M. O. Control of microtubule organization and dynamics: two ends in the limelight. Nat Rev Mol Cell Biol. 16 (12), 711-726 (2015).
- Akhmanova, A., Steinmetz, M. O. Microtubule +TIPs at a glance. J Cell Sci. 123 (20), 3415-3419 (2010).
- Fukata, M., et al. Rac1 and Cdc42 capture microtubules through IQGAP1 and CLIP-170. Cell. 109 (7), 873-885 (2002).
- Wegel, E., et al. Imaging cellular structures in super-resolution with SIM, STED and Localisation Microscopy: A practical comparison. Sci Rep. 6, 27290 (2016).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu Rev Biochem. 78, 993-1016 (2009).
- Mace, E. M., Orange, J. S. Dual channel STED nanoscopy of lytic granules on actin filaments in natural killer cells. Commun Integr Biol. 5 (2), 184-186 (2012).
- Ritter, A. T., et al. Actin depletion initiates events leading to granule secretion at the immunological synapse. Immunity. 42 (5), 864-876 (2015).
- Tamarit, B., et al. Membrane microdomains and cytoskeleton organization shape and regulate the IL-7 receptor signalosome in human CD4 T-cells. J Biol Chem. 288 (12), 8691-8701 (2013).
- Brown, A. C., et al. Super-resolution imaging of remodeled synaptic actin reveals different synergies between NK cell receptors and integrins. Blood. 120 (18), 3729-3740 (2012).
- Dupre, L., et al. T Lymphocyte Migration: An Action Movie Starring the Actin and Associated Actors. Front Immunol. 6, 586 (2015).
- Rak, G. D., et al. Natural killer cell lytic granule secretion occurs through a pervasive actin network at the immune synapse. PLoS Biol. 9 (9), e1001151 (2011).
- Lin, K. B., et al. The Rap GTPases regulate the migration, invasiveness and in vivo dissemination of B-cell lymphomas. Oncogene. 29 (4), 608-615 (2010).
- Lin, K. B., et al. The rap GTPases regulate B cell morphology, immune-synapse formation, and signaling by particulate B cell receptor ligands. Immunity. 28 (1), 75-87 (2008).
- McLeod, S. J., et al. The Rap GTPases regulate integrin-mediated adhesion, cell spreading, actin polymerization, and Pyk2 tyrosine phosphorylation in B lymphocytes. J. Biol. Chem. 279 (13), 12009-12019 (2004).
- Christian, S. L., et al. Activation of the Rap GTPases in B lymphocytes modulates B cell antigen receptor-induced activation of Akt but has no effect on MAPK activation. J Biol Chem. 278 (43), 41756-41767 (2003).
- Batista, F. D., Iber, D., Neuberger, M. S. B cells acquire antigen from target cells after synapse formation. Nature. 411 (6836), 489-494 (2001).
- Treanor, B., et al. Dynamic cortical actin remodeling by ERM proteins controls BCR microcluster organization and integrity. J Exp Med. 208 (5), 1055-1068 (2011).
- Mattila, P. K., et al. The actin and tetraspanin networks organize receptor nanoclusters to regulate B cell receptor-mediated signaling. Immunity. 38 (3), 461-474 (2013).
- Yuseff, M. -. I., et al. Polarized Secretion of Lysosomes at the B Cell Synapse Couples Antigen Extraction to Processing and Presentation. Immunity. 35 (3), 361-374 (2011).
- Mace, E. M., Orange, J. S. Visualization of the immunological synapse by dual color time-gated stimulated emission depletion (STED) nanoscopy. J Vis Exp. (85), (2014).
- Russ, J. C. . The Image Processing Handbook, Sixth Edition. , (2011).
- Stinchcombe, J. C., et al. Centrosome polarization delivers secretory granules to the immunological synapse. Nature. 443 (7110), 462-465 (2006).
- Vicidomini, G., et al. Sharper low-power STED nanoscopy by time gating. Nat Methods. 8 (7), 571-573 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved