Method Article
유전자 발현 및 조직 학적 분석을위한 단일 마우스 골격근의 연속 지역의 냉동 절편
요약
연속 크라이 섹션은 단일 마우스 골격근에서 인접 영역을 이용한 유전자 발현 측정 학적 어플리케이션 및 RNA의 농축을 가능하게 수집된다. 직접 애플리케이션에서 비교 풀링 저온부 및 측정 30mg을 - 고품질 RNA를 (20)로부터 얻어진다.
초록
이 방법으로, 연속 저온부는 하나의 마우스 골격 근육에서 인접 영역을 사용하여 유전자 발현을위한 조직 조직학 및 RNA의 농축 모두 현미경 응용 프로그램을 사용하기 위해 수집됩니다. 전형적으로, 그것은, 버퍼 볼륨이 효율적으로 연마 애플리케이션 너무 낮을 수 있기 때문에 아직 충분한 기계적 중단없이 작은 골격근 샘플의 적절한 균질화를 달성하는 도전 버퍼 시약 근육 제한 침투 치밀한 조직 구조는 궁극적으로 저 RNA 수율을 야기. 여기에보고 된 프로토콜에 따라 30 ㎛의 섹션을 수집하고 버퍼 침투 노출 표면적을 증가 저온 절편 이후 니들 균질화가 근육을 방해 기계적하게 풀링. 이 기술의 주요 제한은 저온 유지가 필요하다고하고, 이는 상대적으로 낮은 스루풋이다. 그러나, 고품질의 RNA를 풀링 m 작은 샘플로부터 얻을 수있다uscle 저온부는 여러 가지 골격 근육과 다른 조직이 방법은 액세스 할 수 있도록. 또한,이 기술은 유사한 가능 분석 (예, 조직 병리학 및 유전자 발현) 측정치가 직접 실험 불확실성을 감소시키고위한 작은 조직 소스 필요 복제 성 동물 실험을 감소시키는 애플리케이션에서 비교 될 수 있도록 하나의 골격근의 인접 영역에서 여러 응용 프로그램.
서문
이 기술의 목적은 하나의 작은 골격근 조직 소스로부터 액세스 같은 조직 학적 및 유전자 발현과 같은 다른 양상, 여러 실험을 분석하는 것이다. 현미경 애플리케이션 신중 동결 동안 얼음 결정 생성물의 형성을 제한하도록 제어 되어야만 보존 방법을 시료에 가장 민감하다. 따라서, 분석법 개발을 경골근에 기초한다 (TA) 근 부분적으로 면역 형광 현미경 유전자 발현 양 분석을위한 원료로서 -140 ° C 액체 질소 냉각 -2- 메틸 부탄 욕에서 수지 매립 덮여 냉동.
다양한 기술적 접근법 동일한 원료를 사용할 필요가 좌우 근육 상이한 조건 실험 하나는 제어를 나타내는 근육 주사 기반 실험을 위해 특히 중요하다. 예를 들어, 근육의 재생 과정에서, 하나의 MUscle는 반대측 근육 차량 주입 제어 한 역할을하면서 광범위한 조직 손상을 유발하는 독소를 주사한다. 마찬가지로, 근육 질환에 대한 유전자 치료 연구는 일반적으로 반대쪽이 빈 벡터, 벡터 또는 비 관련 차량 제어와 비교되는 근육 내 주사에 의한 유전자 치료 벡터의 유효성 시작한다. 따라서, 다른 어플리케이션에 각각 TA 근육을 소싱 할 수 없다.
이러한 문제점을 해결하기위한 일반적인 전략은 : ⅰ) ⅱ) 추가 마우스를 사용하거나, ⅲ) 각각의 애플리케이션에 대한 근육의 일부를 잘라, 어플리케이션마다 다른 근육 그룹을 사용. 그러나, 근육 그룹간에 상당한 차이가 어려운 개별 애플리케이션으로부터 데이터를 비교할 수 있도록, 추가 동물 비용을 증가시키고, 다른 대안이있을 경우 제대로 정렬된다. 다른 응용 프로그램을 소스로 절개 한 후 근육을 나누는 것은 최선의 선택의 난입니다n은 많은 경우. 단, 근육의 조각들은 균질화 2-5 액체 질소 또는 기계적 연마 기술에 따라 분쇄를 사용하기에는 너무 작다. 근육 세포 외 매트릭스 단백질과 수축 포장 높은 조직 구조이기 때문에, 불충분 한 기계적 균질화 이후 DNA, RNA 또는 단백질의 낮은 수율로 이끈다. 여기에 자세한 방법은 여러 응용 프로그램에서 사용하기위한 하나의 소스 근육에서 조직의 소량을 허용하고, 냉동 절편 바늘 분쇄의 포함은 더 나은 RNA 수율 기계적 균질화을 향상시킨다.
프로토콜
모든 동물의 절차는 동물 사용 프로토콜 A2013 07-016 (비들)에서 조지아 기관 동물 관리 및 사용위원회의 대학에 의해 승인되었다.
미 정착 골격근 1. 냉동 보존
- 예비
- 약 (작은 사각형 면도날과 (약 1cm X 1cm)에 코르크를 잘라 소스 마우스와 근육을 식별하고, 매우 얕은 컷을 만들기 위해 2 메틸 부탄에 내성이 좋은 팁 마커 코르크에 쓰기 상면 전역 1mm). 조직을 배향에 사용할 컷에 플라스틱 커버 슬립을 삽입합니다. 모든 조직이 동결 보존 될 수 있도록 코르크가 준비 될 때까지 반복합니다.
- 액체 질소, 2- 메틸 부탄, 삽입 수지, 저온 온도계, 코르크, 해부 도구 및 연구 마우스를 얻습니다.
주의 : 액체 질소가 가열되면 폭발 할 수 있습니다 압축 된 가스이다. NI 액체 처리 할 때 실험실 코트, 저온 장갑 및 안면 보호구를 착용트로겐; 피부 접촉 또는 눈 화상이나 동상의 원인이 될 수 있습니다. 2- 메틸 부탄은 가연성, 독성, 건강과 환경에 위험이 있습니다. , 개인 보호 장비 (실험실 코트, 장갑, 보호 안경)을 착용 흄 후드에서 주식 컨테이너를 열고, 밀폐 할 수있는 별도의 용기에 (일반적으로 200 ~ 400 ml)에 동결에 필요한 작은 금액을 전송하고 흡입을 방지 . - 마취하에 안락사의 승인 된 방법으로 쥐를 안락사. 간단히, 이소 플루 란 기화기에서 산소 2.5 %의 이소 플루 란과 흡입 챔버에 마우스를 삽입, 마우스 후 20 초는 페달 반사를 확인하기 위해 이동 멈출 때까지 기다립니다. 페달 반사가 음수 인 경우, 자궁 경부 전위 (6)에 의해 연구 마우스를 안락사.
참고 : 안락사의 방법은 기관 윤리위원회의 승인을 필요로합니다. - 피부 말단 사지 위에 놓인를 제거하고 잘 포인트 disse와 발목 위의 말단 앞쪽에 힘줄을 잘라ction 위. 미세 집게로 말초 힘줄을 잡고 근육을 풀어 측면의 밴드를 절단하면서 부드럽게 당겨 무릎을 향해. 무릎에서 수직 근육을 당겨 TA 근육 7을 절제하는 최종 컷을합니다.
주 : TA 근육은 예를 들어 여기에 사용되지만, 사용자의 실험 목적에 적합한 경우, 임의의 마우스 골격근이나 심장이 프로토콜에서 TA로 대체 될 수있다. 유일한 제한은 조직이 그 깊이에 걸쳐 급속 냉동 보존을 달성하기 위해 충분히 작아야한다는 것이다; 1cm × 1 cm의 최대 조직의 크기를 권장합니다. - 반대 다리에 반복 수집 할 다른 조직을 해부하다. 동결 전에 조직 분해를 제한하기 위해 가능한 한 빨리 절개를 수행한다.
- 동양의 미리 라벨링 코르크에 가로 섹션에 대한 각각의 근육. 코르크 및 근육 내선의 상단을 터치 말단 건과 코르크에 근육을 수직 스탠드멀리 끝나는 coverslip에 의해 수직으로 개최했다.
- 바람직하게는 소스 동물의 euthanization 경과 5 분 만 확실히 이상 15 분의 시간 내에, 절개 후 가능한 한 빨리 조직 학적 분석을 위해 모든 조직을 Cryopreserve.
- 냉동 보존
- 해부의 종료 전에 동결 목욕 다섯 분을 냉각 시작합니다. 약 3 cm의 깊이로 열린 금속 비커에 2 메틸 부탄을 따르십시오. 2-4 cm의 깊이로 절연 용기에 액체 질소를 부어. 액체 질소에 2- 메틸 부탄의 비커를 설정; 질소는 비등하기 시작합니다. 2 메틸 부탄 비커에 질소 튀는을 피하십시오.
주의 : 흄 후드 또는 환기가 잘되는 곳에서 목욕을 동결 준비합니다. - 온도를 모니터링 및 냉각도 보장하기 위해 포크로 자주 저어 2 메틸 부탄에 저온 온도계를 삽입합니다. 교반을 계속하고 시원한까지 2 나thylbutane는 필요에 따라 외부 조에 새로운 액체 질소를 추가 -140 ° C에 도달한다.
참고 : -140 ° C가 가로 무늬 근육에 얼음 결정 아티팩트를 최소화하기 위해 최적의 온도가; 다른 조직은 다른 온도에서 가장 cryopreserve있다 (예를 들면, 뇌, -90 ° C). - 이 코르크을 충족하고 즉시 -140 ° C에서 2 메틸 부탄에 코르크를 드롭 근육의 50 % - 만 하부 (35)에 삽입 수지를 적용합니다. 급속 동결 배치 당 최대 8 개의 조직에 대해 반복합니다. 조직을 응고 -2- 메틸 부탄에 동결되지 않도록 비커의 바닥을 긁어, 30 초 동안 교반한다.
- 포크를 사용, 2 메틸 부탄에서 각 조직 코르크를 끌어 숟가락 또는 큰 집게를 슬롯. 신속하게 커버 슬립을 제거 비커에 초과 2 메틸 부탄을 가볍게 두 드리, 다음 외부 질소 욕조에 조직 코르크를 놓습니다. 비커에 남아있는 모든 코르크에 대해 반복합니다.
- 액체 질소 나에 드라이 아이스에 전송 샘플저장을 위해 -80 ° C 냉장고.
- 어떤 조직을 냉동 보존을 위해 남아있는 경우, 반복 1.2.4에 1.2.3 단계를 반복합니다. -140 ° C에 필요하고 다시 차가운 외부 화장실에 비커 또는 액체 질소에 추가로 2 메틸 부탄을 추가합니다. 유해 폐기물 등의 사용이 메틸 부탄 폐기하십시오.
- 해부의 종료 전에 동결 목욕 다섯 분을 냉각 시작합니다. 약 3 cm의 깊이로 열린 금속 비커에 2 메틸 부탄을 따르십시오. 2-4 cm의 깊이로 절연 용기에 액체 질소를 부어. 액체 질소에 2- 메틸 부탄의 비커를 설정; 질소는 비등하기 시작합니다. 2 메틸 부탄 비커에 질소 튀는을 피하십시오.
2. 조직학 및 RNA 응용 프로그램에 대한 저온부를 수집
- 예비.
- 분석 균형에 DNase의 /의 RNase없는 멸균 튜브를 미리 무게. 그런 다음, 사전 냉각하기 위해 저온 유지 챔버로 이동합니다. 모든 풀링을 동결 절단 (Cryosections) 샘플을 수집하는 튜브가 준비가 될 때까지 반복합니다.
- 골격 근육 절편의 경우, 저온 유지 챔버 온도가 내부 온도에 의해 -21 -22 ° C가 있는지 확인합니다. 챔버 내로 절단 조직과 어떤 콘테이너를 전송하고 상기 용기 (들)이 개방 전에 최소 15 분 동안 저온 유지 온도로 평형을 허용한다.
- 새로운 일회용 저온 유지 장치 블레이드를 삽입. 대안으로,의 RNase의 오염 제거 용액 스프레이, 기존의 블레이드를 제거 DDH 2 O 씻어하고 냉각하는 저온 유지 장치에 다시 삽입합니다. 70 % 에탄올로 깨끗한 조직 스프레이 조심스럽게 블레이드와 블레이드 클램핑 플랫폼을 닦으십시오.
- 의 RNase의 오염 제거 용액 깨끗한 조직 스프레이 및 저온 유지 브러쉬를 닦습니다. , DDH 2 O와 조직 스프레이 다시 브러쉬를 닦아 깨끗한 표면에 저온 유지 장치 실에서 그들을 설정합니다.
주의 : 저온 유지 장치 블레이드를 사용하지 않을 때는 칼 가드에 포함되어야한다. 또한 RNA 분해 효소 염액은 독성 냉 저온 유지 챔버에서 침전물을 형성하도록 고정된다. 따라서, 취급에주의하고 저온 유지 장치 실에서의 사용을 피하십시오.
- 의 RNase의 오염 제거 용액 깨끗한 조직 스프레이 및 저온 유지 브러쉬를 닦습니다. , DDH 2 O와 조직 스프레이 다시 브러쉬를 닦아 깨끗한 표면에 저온 유지 장치 실에서 그들을 설정합니다.
- 그라 이오 스탯 챔버 내에서 한 푼도 크기 드롭 따뜻한 시편 척에 수지를 매립 (약 300 μl를) 배치, 아래로 수지의 상단을 눌러에 조직 코르크를 설정 한 다음 FR에 척을 설정레일 또는 가능한 경우 빠른 동결 요소에를 eezing.
- 매립 수지 응고 (흰색) 한 후, 조직의 하위 35 %의 주위에, 코르크의 상단에 추가 매립 수지를 추가하고 더 나은 조직을 안정화하는 빠르고 동결에 대한 매립 수지에 열 추출기를 누릅니다. 수지가 완전히 경화 할 수 있도록 절편 전에 5 분을 기다립니다.
- 시편 클램프가 가장 후퇴 위치 블레이드에서 가장 멀리에 있는지 확인합니다. 시편 클램프로 조직 표본 척을 삽입합니다.
- 동결 절단 (Cryosections) 준비.
- 블레이드 캐리어 홀더를 풀고 10 ° (또는 사용되는 블레이드 캐리어에 적합한 각도)에 블레이드의 여유 각을 설정하고 다시 조입니다. 브레이크를 해제하고 블레이드쪽으로 근육을 낮추기 위해 핸드 휠을 돌립니다. 조직과 블레이드 사이의 가장 가까운 거리를 추정하고 멀리 블레이드에서 조직을 이동하고 핸드 휠 브레이크를 작동시킵니다.
- 높이 조정 LEVE를 풀고티슈의 단부는 블레이드 더 이상 약 2 mm 인 경우, R은 각각 앞뒤로 블레이드 캐리어 이동 또는 블레이드가 조직에 충돌하는 경우. 조 및 블레이드에서 거리를 확인하기 위해 다시 조직을 낮 춥니 다. 블레이드의 시각적 평가에 의한 조직의 단부로부터 1 내지 2 mm가 될 때까지 조정을 반복한다.
- 블레이드 향해 조직을 내리고 횡단면에 대한 조직의 각도를 평가합니다. 핸드 휠 잠금 및 표본 클램프 레버를 놓습니다. 시편 클램프가 왼쪽 또는 오른쪽으로 조직의 수평 방향이 블레이드에 수직이 될 때까지 밀어 넣습니다.
- 그 조직 절편은 근육의 장축에 수직 한 것 때문에 "Y"방향을 조정 다운 시료가 밀거나 클램프. 시편 클램프 레버를 조입니다.
- 그냥 블레이드에 닿을 때까지 시편을 사전에 코스 및 미세 앞으로 피드를 사용합니다. 특정 조직 깊이에서 섹션을 추구하는 경우 (제로 섹션 두께의 합을 재설정조직의 맨 위).
- 30 μm의에서 섹션 두께 트림 기능에 저온 유지 장치를 설정합니다. 잘라 내기 및 조직 모음의 미리 선택된 깊이에 도달 할 때까지 섹션을 폐기 (예를 들어, 위에서 400 μm의).
- RNA 추출을위한 저온부를 수집합니다.
- 수집 섹션의 관을 열고 블레이드 캐리어 근처에 배치합니다. 이 블레이드에서 절단 각 섹션을 선택하고 튜브로 동결 절단 (Cryosections)를 전송하기 위해 사전 냉각, 깨끗한 브러쉬를 사용합니다. 풀링 된 부분이 30 mg의 무게 또는 원하는 조직의 깊이에 도달 할 때까지 반복합니다.
참고 : - 40 mg의 성인 마우스 경골근의 경우, 약 400 μm의 4,000의 조직 깊이에서 수집은 일반적으로 25을 산출한다. 섹션 스틱과 금속 표면에 응집하는 경향이 금속 집게를 사용하는 것은 권장되지 않습니다 포집 관에 섹션을 전송합니다. - 수지를 포함하는 근육을 동결 절단 (Cryosections)을 둘러싸는 경우, 핸드 브레이크를 잠그고에 면도날을 사용하여근육의 상단 주위에만 얇은 층이있을 때까지 수지의 작은 조각을 면도. 블레이드와 항상 절단 수지가 떨어져 근육에서 각도.
NOTE 실질적 하류 RNA 제제를 손상하지 않는 수지를 포함하는 박막. 두꺼운 포함 수지가 존재하는 경우, 포집 관에 동결 절단 (Cryosections)를 이동하기 전에 떨어져 근육에서 그것을 애타게 브러쉬를 사용합니다. - 또한, 포집 관에 대량의 블레이드 캐리어 및 전송에 풀 섹션.
주 : 그러나,이 방법은 느린 경향이 있고, 절 스틱 이후 단계에서 바늘 균질화 효율을 감소시킬 수있는, 서로 응집 가능성이 높다. - 신속하게 분석 균형과 기록 튜브 무게로 풀링을 동결 절단 (Cryosections) 튜브를 배치합니다. 즉시 -20 ° C에 가까운 부분의 온도를 유지하도록 냉각 저온 유지 챔버로 튜브를 반환한다. 풀링 된 부분의 중량을 계산한다.
참고 : RNA 분리가 광고에서 발생하는 경우ifferent 일, -80 ° C에서 사용할 때까지 풀링을 동결 절단 (Cryosections) 튜브를 저장합니다.
- 수집 섹션의 관을 열고 블레이드 캐리어 근처에 배치합니다. 이 블레이드에서 절단 각 섹션을 선택하고 튜브로 동결 절단 (Cryosections)를 전송하기 위해 사전 냉각, 깨끗한 브러쉬를 사용합니다. 풀링 된 부분이 30 mg의 무게 또는 원하는 조직의 깊이에 도달 할 때까지 반복합니다.
- 조직학에 대한 저온부를 수집합니다.
- 미세 절편 및 사용 화살표가 7 μm의 (또는 다른 적절한 섹션 두께, 일반적으로 6 μm의 10)에 저온 유지 장치 섹션의 두께를 설정하는 부분 두께 버튼을 누릅니다.
주 : 얇은 부분 (6 ~ 10 ㎛) 조직 절편의 깊이 침투 할 수있는 염색 시약을 보장하기 학적 용도에 사용한다. 얇은 부분은 저온 절편 중에 깊이에서 채취 할 수 있지만 조직 깊이 증가 수지를 매립하여 조직 학적 염색을 방해하지 않기 때문에보다 깊은 부분이 바람직하다. - 잘라 내기 및 일관성, 심지어 조직 표면을 얻기 위해 4 ~ 7 절을 폐기합니다. 조직의 깊이를 기록합니다.
- 단면을 잘라내어이를 블레이드 담체의 표면 상에 배향. 신속하고 부드럽게 따뜻한 (실온) 현미경 슬라이드를 터치하여 섹션을 선택블레이드 캐리어의 섹션. 실온에 슬라이드를 돌려줍니다. 원하는 슬라이드 수를 얻을 때까지 계속합니다. 최종 조직 깊이를 기록합니다.
참고 : 각 조직에 대한 두 번째 (중복) 섹션을 수집하는 것이 좋습니다. - 전체 절편으로, 핸드 휠 브레이크를 후면 대부분의 위치로 표본을 반환하고, 조직 척을 제거합니다. 시편 척에 조직 코르크를 들고 삽입 수지를 용융하기 위해 저온 유지 장치 열 요소를 사용합니다. 조직 코르크를 제거 티슈로 건조 및 저장으로 돌아갑니다.
- 나머지 각 조직에 대한 단계 2.1.2에서 반복합니다. 마지막으로 조직을 설치 한 후 슬라이드를 20 분 동안 건조하도록 허용합니다. 필요한 때까지, 슬라이드 상자에 -80 ° C에서 조직 학적 또는 면역 염색 또는 동결에 대한 슬라이드를 사용합니다.
- 미세 절편 및 사용 화살표가 7 μm의 (또는 다른 적절한 섹션 두께, 일반적으로 6 μm의 10)에 저온 유지 장치 섹션의 두께를 설정하는 부분 두께 버튼을 누릅니다.
풀링 저온부 3. RNA 분리
- RNA 추출
- 얼음에 풀 저온부의 이동 튜브 (들). 즉시 추가50 mg의 동결 절단 (Cryosections)의 중량 당 약 1 ml의 시약, 통상적으로 튜브 당 600 μL의 비율로 유기 RNA 추출 시약.
주의 : RNA 분리 시약은 독성, 부식성, 자극적이다. 안전 취급에 대한 제조업체의 지침을 따르십시오. - 18 게이지 바늘로 1 mL를 주사기를 사용하여 RNA를 추출 액체를 위로 당기고 모든 조직이 용액에 현탁 될 때까지, 튜브 벽을 헹군다. 바늘 균질화하는 동안 공기 방울을 최소화하려고합니다.
- 튜브 벽에 부착하는 덩어리 진 저온부와 조각 매쉬와 분산 바늘의 끝 부분을 사용합니다. 씹다 다섯 스트로크 바늘을 통해 아래 샘플을 전달하여 균질화 한 다음 얼음에 샘플을 반환합니다. 덩어리 전부를 중단하고 바늘을 쉽게 통과 할 샘플을 필요로 모두 3 ~ 5 번 또는 여러 번 단계를 반복한다.
- 18 게이지 바늘을 제거하고 22 게이지 바늘로 교체합니다. 조심스럽게 TR다섯 스트로크 샘플을 iturate 한 다음 얼음에 샘플을 반환합니다. 매우 미세하게 분산 된 조직 파쇄을 달성하기 위해 분쇄를 서너 번 반복.
참고 : 조직 입자가 샘플을 그릴 때 바늘을 차단하기 시작하면, 주사기에서 모든 샘플을 추방하고 다시 더 균질화를위한 18 게이지 바늘로 전환합니다. 25 또는 26 게이지 바늘로 추가 분쇄 공정을 최대 수율로 수득하기 위해 추가 될 수있다. 샘플 유출의 우려가 있으므로 그러나 바늘이 막힐 수있다. - 얼음 상온에 샘플을 이동합니다. 분자 복합체를 방해하기 위해 5 분 동안 품어.
- 흄 후드에서, 튜브 당 사용 RNA 분리 시약 1 ㎖ 당 1- 브로 모 -3- 클로로 펜탄 (BCP) (단계 3.1.1) 0.1 ㎖, 통상 60 μL를 추가한다. (하지 소용돌이을) 15 초 동안 손으로 적극적으로 튜브를 흔들어. 2 ~ 3 분 동안 실온에서 샘플을 인큐베이션. 그런 다음, 12,000 XG에 15 분, 4 ° C에 대한 원심 분리기.
주의: BCP는 가연성 및 독성. 흄 후드 취급와 장갑, 실험실 코트 및 보호 안경을 착용하십시오. - 조심스럽게 상 수상 (무색)를 포함하는 RNA를 수집하고 깨끗한 튜브로 전송할 수 있습니다. 70 % (DEPC 물) 에탄올과 혼합하는 소용돌이의 동일한 볼륨을 추가합니다. 최대 10 분 동안 실온에서 인큐베이션.
참고 : 중간 계면 낮은 페놀 BCP 단계는 제조업체의 지침에 또는 적절한 폐기 페놀 BCP 유해 폐기물 용기에 수집 따르면, 각각의 게놈 DNA 및 단백질에 대한 처리 할 수 있습니다.
- 얼음에 풀 저온부의 이동 튜브 (들). 즉시 추가50 mg의 동결 절단 (Cryosections)의 중량 당 약 1 ml의 시약, 통상적으로 튜브 당 600 μL의 비율로 유기 RNA 추출 시약.
- RNA 정화.
- 8 작은 변화와 바인딩 샘플, 세척 및 용출에 대한 제조업체의 지침을 따르십시오. 예를 들면 :
- 단계 3.2.4를위한 따뜻한 사전 37 ° C 형 목욕이나 인큐베이터에 DNase의 /의 RNase가없는 물을 나누어 놓습니다.
- 정제 컬럼 위 3.1.8에서 RNA 샘플을 추가하고 15 초 동안 샘플을 원심 분리실온에서 12,000 XG에. 동일한 열하고 다시 원심 분리기에 다시 통해 흐름을 따르십시오. RNA 바인딩 극대화, 다음을 통해 최종 흐름을 폐기하는 하나의 추가 시간을 반복합니다.
- 제조업체의 지침 8 항에 세척 단계를 수행합니다. 12,000 XG에 15 초 동안 열을 세척 버퍼 700 μL (아무 에탄올), 스핀을 적용을 통해 흐름을 폐기하십시오.
- 12,000 XG에 15 초 동안 컬럼 (에탄올) 세척 완충액 500 μL, 스핀을 추가를 통해 흐름을 폐기하십시오. 이 단계를 한 번 반복합니다.
- 막을 건조 12,000 XG에서 1 분 동안 빈 컬럼 스핀.
- 깨끗한 RNA 분해 효소, DNase의 무료 관에 스핀 컬럼을 전송합니다. 열 멤브레인의 중심 (3.2.1)에서 미리 예열 DNase의 /의 RNA 분해 효소가없는 물을 40 μl를 추가합니다. 실온에서 2 분 동안 배양 한 후 12,000 x g에서 2 분간 원심 분리.
참고 : 40 μL 용출 볼륨은 원래의 밀리그램 당 약 1.3 μL입니다풀 저온부 30 mg을위한 조직. 다른 시작 조직 무게에 대한 적절한 용출 볼륨을 조절하지만, 32 μL 이하로 감소하지 않습니다. 원 조직의 밀리그램 당 약 0.7 μL를 사용하여 두 번째 용출은, 총 RNA 수율을 증가시키기 위해 첨가 될 수있다. - 분광 광도계, 전기 및 / 또는 bioanalyzer하여 농도 및 순도에 대한 RNA (컬럼 용출)을 분석. 이러한 정량적 PCR 4 역전사 같은 다운 스트림 애플리케이션에 필요할 때까지 -80 ° C에서 RNA를 저장합니다.
참고 : DNase를 처리 다운 스트림 응용 프로그램에서 RNA를 사용하기 전에 권장합니다. 이 처리는 다음 칼럼 용출이 특정한 지점에서의 세척 단계 전에 일부 RNA 정제 컬럼에서 수행 또는 하류 어플리케이션의 첫 단계로 RNA의 분취 액에있을 수있다. RNA를 몇 년 동안 안정해야한다.
면역 형광 Stainin 4. 조직 학적 분석근육 저온부의 g
- 간단한 면역 프로토콜입니다.
- 각 슬라이드에 섹션의 그룹을 서클에 소수성 펜을 사용합니다. 조심스럽게 조직을 만지지 않도록 조심하면서, 동그라미 영역에 (큰 표면적을 500 μL까지 작은 면적 약 80 μl를) PBS를 놓습니다. 실온에서 5 분 동안 인큐베이션.
참고 : 냉동 슬라이드를 사용하는 경우, -80 ° C의 냉동고에서 슬라이드를 제거하고 20 ~ 30 분 해동 건조 후 위와 같이 진행 상온에서 부화. 두 개 이상의 슬라이드가 필요하다 : 하나의 실험 슬라이드 일차 및 이차 항체 배양 할; 일차 항체에 대한 하나의 제어 슬라이드는 "차 전용"제어를 제외됩니다. - PBS를 부어 슬라이드 팁. 원 지역 PBS (차단 솔루션)에 5 % 당나귀 혈청을 추가; 근육 부분이 건조하지 않도록주의해야합니다. 습도 챔버 내에서 몇 시간까지 30 분 동안 실온에서 인큐베이션 (또는).
- 근육 재생을 분석하는 일차 항체 솔루션을 준비합니다. eMHC 항체 (1시 40분)와 ColVI 항체 (1,000 일)와 솔루션을 차단 섞는다. 각각 소형, 중형, 또는 대형 슬라이드 영역에 대한 300 ㎕를 500 μl를 약 150 μl를 준비합니다. 소용돌이 5 초 후 어떤 침전물을 펠렛 15,000 XG에서 2 분 동안 원심 분리.
- 실험 슬라이드를 들어, 솔루션을 차단 부어 다음 4.1.3에서 일차 항체 솔루션을 추가 할 슬라이드를 팁. 보조 제어 슬라이드, 솔루션을 차단 부어하고 신선한 차단 솔루션 (아무 항체)를 추가 할 슬라이드를 팁. 4 ° C에서 하룻밤 습도 챔버에서 슬라이드를 품어.
주 : 슬라이드에 항체 용액을 피펫 팅 할 때, 항상 관의 바닥에서 임의의 침전물을 방해하지 않는 차 항체 용액 튜브의 상부로부터 액체를 당긴다. - 팁 솔루션을 부어 슬라이드. 씻어 각 슬라이드의 동그라미 영역에 PBS의 적하 추가 팁 부어오프 후 더 PBS를 추가하고 3 ~ 5 분 동안 품어. 세 세척의 총 반복합니다.
주 : 세척 시간은 매우 유연하고 원하는 경우 20 분까지 연장 할 수 있습니다. 일반적으로, 용액 수가 변경 시간보다 더 중요하다. - DAPI 핵 10,000 희석 : 마우스의 IgG1 (eMHC)와 토끼의 IgG (ColVI) 1을 검출하는 빨간색과 녹색 형광 결합 된 이차 항체의 500 희석 : 1을 사용 (보조 제어 슬라이드를 포함하여) 모든 슬라이드에 대한 이차 항체 솔루션을 준비 얼룩.
- 예를 들어, DAPI의 1:10 희석을 만들기 위해 DDH 2 O 9 μL와 DAPI의 1 μl를 섞는다. 그런 다음, 500 μl의 최종 볼륨, 솔루션을 차단 447.5 μL 1:10 DAPI의 1.0 μl를 1.0 + 항 - 마우스의 IgG1 붉은 ㎕의 항 - 토끼 IgG의 녹색 + 0.5 μl를 추가합니다. 소용돌이는 침전물을 펠렛 15,000 XG에서 2 분 동안 혼합하고 원심 분리한다.
참고 : 이상적으로, 모든 보조 항체는 동일한 호스트 종에서해야한다.
- 예를 들어, DAPI의 1:10 희석을 만들기 위해 DDH 2 O 9 μL와 DAPI의 1 μl를 섞는다. 그런 다음, 500 μl의 최종 볼륨, 솔루션을 차단 447.5 μL 1:10 DAPI의 1.0 μl를 1.0 + 항 - 마우스의 IgG1 붉은 ㎕의 항 - 토끼 IgG의 녹색 + 0.5 μl를 추가합니다. 소용돌이는 침전물을 펠렛 15,000 XG에서 2 분 동안 혼합하고 원심 분리한다.
- 마지막 PBS 세척을 부어 슬라이드 팁. 모든 조직을 포함하는 이차 항체 솔루션을 추가합니다. 빛으로부터 보호하고, 실온에서 30 분 동안 배양 슬라이드 커버.
참고 : 모든 이차 항체가 이중 라벨 실험에서 다른 종과 최소한의 교차 반응성을 가지고 확인해야합니다. - 4.1.5에 설명 된대로 슬라이드를 씻으십시오. 마지막 세척 후, PBS를 붓고 조직에 슬라이드를 설정하는 슬라이드 팁. 하나의 측면을 따라 수성 장착 미디어의 3 ~ 4 방울을 추가합니다.
- 단지 실장 매체의 외주에 유리 커버 슬립의 가장자리를 설정한다. 집게 사용, 천천히, 다음, 조직을 향해 커버 슬립을 낮추는 커버 슬립을 해제하고 부드럽게 위치로를 누릅니다. 마지막으로, 부드럽게 안정을 위해 커버 슬립의 각 모서리를 누르십시오.
- 사용까지 4 ° C에서 빛과 가게에서 슬라이드를 보호합니다.
주 : 장기 저장을 위해, 일의 가장자리 매니큐어의 박층을 적용전자 coverslip에 건조에서 슬라이드를 방지합니다.
- 각 슬라이드에 섹션의 그룹을 서클에 소수성 펜을 사용합니다. 조심스럽게 조직을 만지지 않도록 조심하면서, 동그라미 영역에 (큰 표면적을 500 μL까지 작은 면적 약 80 μl를) PBS를 놓습니다. 실온에서 5 분 동안 인큐베이션.
- 조직 학적 평가.
- 이미지 적절한 필터와 함께 epifluorescent 또는 공 초점 현미경을 사용하여 슬라이드 eMHC (빨간색)를 검출하는 단계; ColVI (녹색); 그리고 일반적으로 20 배 목표 1,5를 사용하여, 핵 (파란색) DAPI 염색.
- 실험 슬라이드에서 형광 신호가 eMHC 및 ColVI 검출 4의 특이성을 보여주기 위해 이차 제어 슬라이드 다르다는 것을 확인합니다.
참고 : eMHC 긍정적 인 재생 섬유가 근육 부상 후 가변 근이영양증 생쥐에 약 2 ~ 7 일에서 볼 수 있어야합니다. 콜라겐 VI 근육 섬유 혈관 및 신경 주변 세포 외 기질 및 수술 주변과 epimysium의 더 큰 결합 조직 번들로 존재한다. DAPI 핵 얼룩은 근육 섬유의 재생을 나타내는 주변 핵 대 중앙 핵와 섬유, 그리고 난의 존재를 식별하는 데 유용합니다세포를 nfiltrating. 괴사 또는 부상 섬유로 인해 손상된 근육 세포막을 통해 섬유를 관통 내생의 IgG의 검출에 마우스 IgG 이차 항체로 약하게 염색 할 수 있습니다. - 재생을 정량화하기 위해, 화상 전체에 걸쳐 각각의 형광 필터를 중첩 현미경 사진을 촬영. 전체 섹션 1.5의지도를 재구성하는 사진을 정렬 한 후 각 위치에 대한 eMHC, ColVI 및 DAPI 이미지를 병합합니다.
- 분석 소프트웨어를 사용하여, 포지티브 eMHC 섬유의 수가 최근 재생 (100 * (# eMHC + 섬유 / # 총 섬유))를 계산하는 전체 섬유의 개수를 카운트. 또한, (100 * (# CN + 섬유 / # 총 섬유)) -1,5- 긴 기간 동안 재생을 측정하기 위해 총 섬유의 중앙에서 핵 섬유의 개수를 카운트.
결과
근육을 동결 절단 (Cryosections)의 RNA는 품질이 높고, 대부분의 응용 프로그램에 충분한 수율을 제공합니다
여섯 골격근 RNA 제제의 분석은 8 대조군 마우스로부터 풀링 경골근 (TA) 근 19.4 41 mg의 사용 표 1에 나타낸다. 모두 좌측 (L) 및 우측 (R) TA 근육이 방법을 이용하여 근육 손상을 일으킬 삼일 식염수 또는 10 μM의 cardiotoxin 25 μL의 길이 근육 주사 후 채취 근육 재생 실험에서 제조 된 이전에 1을보고 하였다. 표 1에 나타낸 바와 같이, 근육 동결 절단 (Cryosections)의 RNA에 대해 A260 / 280 비를 대표 샘플이 전형적으로 가깝거나 더 높다. "순수한"RNA는 2.2 / 2.0 및 A260 280 / 1.8 280 A260 것으로 간주되는 바와 같이, 동결 절단 (Cryosections)의 RNA 시료의 순도는 9 우수하다. 총 RNA 복구는 일반적으로 비켜했다대부분의 다운 스트림 응용 프로그램에 대한 충분한 자료를 제공하고, 조직을 시작 mg의 당 총 RNA의 μg의 1 이상에 0.18의 수율 샘플 당 R 10 μg의. 특히, RNA 농도, 추출 된 총 RNA, 3 일 후 독소 부상 TA 근육에서 시작하여 조직의 밀리그램 당 RNA 수율은 식염수 주입 조교에서보다 유의하게 높았다. 이것은 근육 구조 삼일 재생 근육 유전자 전사 및 / 또는 RNA의 안정성의 증가가 및 / 또는 광범위한 손상에 의해 파괴되는 경우 균일화가 향상된다 나왔다. 샘플 18 달 동안 -20 ℃에서 저장 하였다 후 RNA 품질의 지속성 간단한 1X TAE / 근육 동결 절단 (Cryosections)의 RNA 1 μl의 1.5 % 아가로 오스 겔 전기 영동으로 평가 하였다. 눈에 띄는 18S와 28S rRNA의 밴드에도 최적 보관 조건 (그림 1A)에서, 여전히 높은 RNA의 품질을 보여주는 샘플에서 분명하다.
근육을 동결 절단 (Cryosections)의 RNA다운 스트림 응용 프로그램을 지원합니다
풀링을 동결 절단 (Cryosections) 샘플 당 RNA 중 하나 마이크로 그램은 DNase를 처리하고, 올리고 DT 프라이머로부터 역전사. 된 RNase 처리 후, cDNA를 전사 역의 총 부피는 30 μL이었다. 초과 증폭 간단한 비 정량적 PCR은 cDNA를의 가능성을 확인하기 위해 실행되었습니다. 근원 성 조절 인자 4 (Mrf4), 근육 분화와 상향 조절 전사 인자는 표준 PCR을 이용하여 템플릿 2 μL에서, 5'- CTGAAGACTGCTGGAGGCTG 10 5'- CTACATTGAGCGTCTACAGGACC를 센스 및 안티센스, 이전에보고 된 마우스 프라이머를 사용하여 증폭 하였다. RT DDH 2 O (아무 RNA 템플릿 전사를 역), 또는 DDH, (RNA가 포함되어 있지만 역전사 효소를)이 왼쪽과 오른쪽 TA의 cDNA 샘플 모두에서 234 bp의 Mrf4 단편의 강력한 특정 증폭했지만, RT-하지 이 PCR O 컨트롤 (도 1b).동일한 샘플 및 Mrf4 mOaz1 기준 제어 중으로 실시간 PCR 시스템에 대하여, 증폭 및 수동 형광 기준을 사용하여 4 정량을 실행 하였다. Mrf4 ΔΔCt는 방법 (4)에 의해 산출 된 식염수 주입 왼쪽 TA에 비해 독소 주입 오른쪽 TA에서 0.097 배로 발현되었다. 이는 성숙한 근육 섬유 (11)의 손실 삼일 독소 손상 후 낮은 Mrf4 발현 이전보고와 유사하다. 정량적 PCR을위한 RNA를 동결 절단 (Cryosections)의 농도를 비교하는 코네티컷 값은 mOaz1 참조 유전자 비교 하였다. 여섯 샘플에서 mOaz1 성적 증명서는 코네티컷는 RT-제어 샘플에서 36.332 ± 3.61 SD이었다 평균 반면, 17.242 ± 1.483 SD의 평균 코네티컷 검출되었다 (N = 4). 샘플에서 mOaz1 코네티컷 신호의 꽉 그룹은 TA 근육 저온부에서 분리 된 RNA는 다운 스트림 RNA 발현 분석에서 예상대로 수행하는 것이 좋습니다.
조직 학적 평가를.
삼일 독소 주사 후 한배 새끼의 대조군 마우스가 7 ㎛의 경골근 근육 부의 간접 면역 형광 염색법의 예 (도 2), 재생 섬유를 검출하기 위해 도시된다. 두 부분의 영역에서보다 150 ㎛의 근위 근육의 표면으로부터 4.6 mm 4.5 깊이 RNA 분석에 사용되는 근육에서 수집 하였다. 배아 미오신 중쇄 (eMHC, 적색)의 재생 섬유, 콜라겐 VI를 검출 (녹색 ColVI)가 근섬유를 설명하고 DAPI 얼룩 농축 핵 침윤 (청색 신호) 4. 지역 독소 손상의 부위를 나타내는 프로토콜에 따라, 블루 핵 , eMHC 긍정적 새롭게 재생 근육 세포의 활성화에 의해 명백한 바와 같이. 이 예와 같이 전체 섹션지도 embryoni의 비율을 계산하여 재생의 정량에 사용됩니다ㄴ 마이 오신 중쇄 발현 섬유 (새로 재생 빨간색) 또는 중앙 핵 섬유는 이전에 한보고. 특히,도 2a에서 TA 근육에 놀라 울 정도로 약간의 손상이 있습니다. 주사 사이의 변동이 있지만도 2b에 도시 된 바와 같이, 일반적인 독소 주사, 근육 칸 (1)의 더 큰 비율에 영향을 미친다. 따라서,이 조직 학적 분석은도 2a에 독소 손상을 최소화 것을 시사하고 인접한 근육 동결 절단 (Cryosections)의 RNA 시료에서의 유전자 발현 데이터를 해석하기위한 중요한 도구를 제공한다. 전체 근육이 표준 연마 방법에 의해 RNA의 제조에 사용 되었다면,이 샘플의 예기치 않게 작은 부상 영역은 다운 스트림 분석을 왜곡 것이 특이 할 것입니다. 대신, 같은 근육의 조직 학적 정량 페어링 인접한 부분에서 손상의 정도를 직접 측정 할 수있다. 이것의 inclu의 사용을 가능하게시온 / 제외 기준은 부상 크기에 따라 분석 최소 부상 임계 값 또는 RNA의 정상화를 충족 분석의 모든 샘플을 다운 스트림 RNA에 포함되어 있는지 확인합니다.

그림 1 : 풀링 근육 저온부에서 RNA의 품질 평가. A) 18S와 28S 리보솜 RNA 밴드 18 개월 RNA 준비 후 풀링 근육 저온부에서 RNA에서 눈에 띄는 있습니다. B) 역전사 다음 PCR Mrf4에 대한 비 정량적. 하는 DNA 사다리의 200, 300 bp의 밴드가 표시됩니다. RT-는 RNA 템플릿 있지만 역전사 효소와 전사 반응을 역. RT-H 2 O는 DDH 2 O, 아니 RNA 템플릿과 전사 역. H 2 O,이 실험에서 DDH 2 O. 아무 템플릿 PCR 제어, 독소 오른쪽 전 경골근 (RTA) 및 염분 워싱턴에 주입되지 않았다의 왼쪽 (LTA)에 주입. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2 : 근육 재생 연구에 대한 조직 학적지도 샘플. A, B) 삼일 가난한 (A의 예를 나타내는 독소 주입)과 일반 (B) 독소에 의한 손상 후 하나의 정강 뼈 앞쪽에 근육 부분의 컴파일 된지도. 각 섹션 맵의 화이트 박스 영역은 높은 배율보기, 레드, 배아 마이 오신 중쇄에 대한 삽입 된 이미지로 표시됩니다; 녹색 콜라겐 VI 외 기질 단백질; 블루, DAPI 핵 얼룩. 스케일 바, 100 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
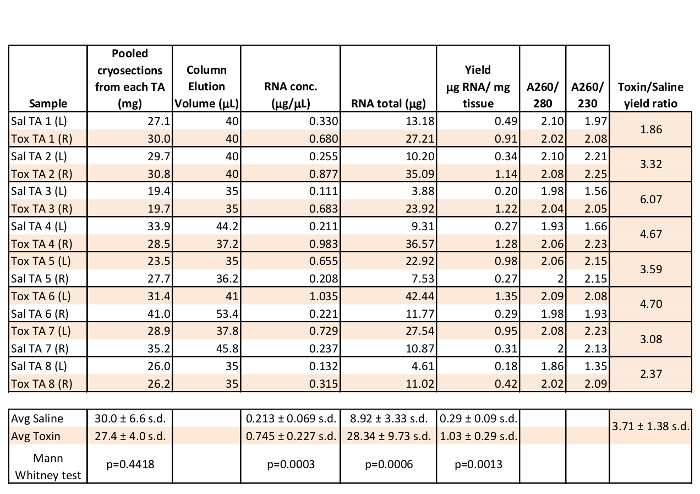
표 1 : 풀링 근육 저온부에서 대표 RNA 수율 및 순도 측정. 여섯 전 경골근 (TA) 근육을 절단하고 풀링을 동결 절단 (Cryosections) 샘플은 RNA에 대해 처리 하였다. 정제 된 RNA (1 μL)을 nanospectrophotometer 분석 하였다. 열 통계가 스프레드 시트에서 수행 하였다, 그룹 비교는 통계 소프트웨어를 사용하여 수행 하였다.
토론
과잉 수지가 풀 저온부의 수집 속도가 느려집니다 및 RNA 분리에 수지 오염을 포함 증가시킬 수 있기 때문에이 방법으로 최상의 결과를 얻으려면, 조직 냉동 보존하는 동안 근육의 낮은 세 번째 또는 절반으로 제한 수지를 포함 유지. 또한, 바늘 균질화 동안 세심한주의 수율을 최대화하고, 바늘 막힘 가능성을 최소화하는 것이 중요하다. 프로토콜은 니들이 차단 방해물을 제거하기 위해 높은 압력이 필요로 될 경우의 샘플 손상을 방지하기 위하여 루어 코리아 주사기를 사용하여 변형 될 수있다. 25 또는 26 게이지 바늘과 바늘 추가적인 균질화 단계는 상기 RNA 수율을 향상 할 수있는 미세 조직 현탁액을 생성하기 위해 첨가 될 수있다. 클로로포름은 BCP 대체 할 수 있지만 BCP 덜 독성 및 RNA (12)의 유기 추출 동안 수성 단계에서 게놈 DNA 오염의 낮은 수준의 결과로,이 권장되지 않습니다. 증가균질화 덜 효율적입니다으로 풀링 저온부 μm의 30의 단면 두께는 사용하지 않는 것이 좋습니다.
RNA 수율 원하는 레벨 이하이면, 다양한 전략과 같은 복구 증가하기 위해 이용 될 수있다 : i)가 가능한 수율을 증가시키기 위해 출발 물질 밀리그램 양을 증가하는 단계; ii) 상기 조직을 기계적으로 균질화를 개선하기 위해 30 μm의 아래 부분의 두께를 감소; ⅲ) 기계적 및 화학적 분열 조직을 향상시키기 위해 유기 추출 시약에 샘플 배양 및 바늘 균질화의 지속 기간을 증가; 조직 덩어리가 남아있는 경우 ⅳ),보다 엄격한 바늘 균질화와 제 2 추출 단계를 수행합니다. 또는, 높은 프로테오글리칸 함량 13 샘플에 대한 추가 상 분리 및 침전 단계로 조직 특이 적 고려 사항이있을 수 있습니다. RNA를 칼럼 정제 중에 큰 용출 부피는 수 mA의 사용 및 제 용출을 수행 할 수있다총 RNA 회복 ximize하지만 RNA 농도의 비용. 포스트 칼럼 알콜 침전 저농도이 변형 우려가있는 경우 RNA를 농축하기 위해 사용될 수있다. RNA 분해가 박리시에 냉동 보존 시간을 감소시키는 문제가있는 경우, 저온 유지 표면과 도구보다 엄격한 세척 바늘 균질화 냉장실 단계의 저온부 (14)로 된 RNase 억제제 시약을 첨가하고, 빈번한 수행 된 RNase 노출을 최소화하기 무료의 RNase 용액 여분 각각 방지하거나 RNases 노출을 최소화하고 절단 활성을 줄일 수있다. 간단히 박리 후 된 RNase 억제제 시약의 조직 입욕하지만 냉동 보존하기 전에, 상기 시료의 열화를 줄일 수있다. 그러나, 예비 실험은 그러한 치료 동안 동결 얼음 결정 또는 다른 아티팩트를 증가하지 않도록 수행되어야한다.
배아 동안미오신 중쇄 / 콜라겐 VI 간접 면역 형광 부상 근육 분석을위한 예로서 여기에서 사용되는 얇은 저온부가 현미경에 장착 포스트와 면역 기술을 비롯한 동결 절편에서 수행 될 수있는 중요한 조직 학적 염색에 사용할 수있는 이들 실험에서 미끄러 -fixation 및 헤 마톡 실린 / 에오신 염색. 사실, 여기에 제공된 간단한 면역 프로토콜에 대한 적응이 필요할 수 있습니다. 예를 들어, 항 - 마우스 이차 항체는 표적 조직에서 내인성 마우스 면역 글로불린을 검출 할 수있는 마우스 차 항체 (예 eMHC)을 검출하도록 사용된다. 이러한 내생 항체는 일반적으로 배경 면역 염색을 일으키는 부상 또는 이영양증 근육의 손상 또는 괴사 근육 섬유에 축적. (생략 차 항체)와 보조 제어 슬라이드는 항상 염색의 특이성을 평가하기 위해 검사해야합니다. 내인성 항체 배경에 문제가 있다면, 프리 블록 단계되어야방지 또는 내인성 마우스 면역 글로불린 (15)의 검출을 최소화하기 위해 프로토콜에 추가됩니다.
상기 방법의 주요 한계는 저온 유지가 필요하다고하고 그것이 상대적으로 낮은 스루풋을 만드는 시간이 소요된다. 예를 들어, 기술 전문가는 약 9 ~ 10 시간에 풀 저온부와 현미경 슬라이드 16 근육 (16 조직의 중복 섹션 8 슬라이드)까지 처리 할 수 있었다. 초보자 냉동 절편하려면 2 ~ 4 샘플에서 풀링 저온부의 컬렉션 합리적 대신, 조직학에 대한 취득 품질 저온부가 더 많은 경험을했다, 저온 유지 장치 훈련과 하나 또는 두 개의 연습 세션 후 마스터 할 수 있습니다. 따라서, 장비, 시간, 교육 요소는 수동 유 봉 균질 잘 균질화 될 수 있습니다 부드러운 조직이 방법은 덜 유용 할 수 있습니다.
비 저온 유지 균질화 방법과 비교하여, 횡문근의 RNA 제제의 0.7 μg의 RNA 전 근육 16 mg의 근육 17 mg의 당, 최근 0.27 μg의 1.08에 RNA 0.05 RNA 수율과 근육 생검에서보고되었다. 따라서, 여기에 설명 된 기술은 한 쌍의 조직 학적을 가능하게하는 동일한 샘플의 인접 영역에서 분석의 추가 장점과 비 저온 유지 방법보다만큼 좋은 또는 더 나은 RNA 수율을 제공한다. 특히, 이전의 연구는 척추 조직의 균질화를 위해 냉동 절편 사용과 마찬가지로 냉동 절편 조직이 RNA 분리 13 균질화 효율을 향상 것으로 나타났습니다. 이 기술은 소 골격 근육 샘플에서 테스트 한 결과, 시료 전처리 당 평균 RNA 수율은 여기에 13보고 정상 범위의 로우 엔드에서 ± 0.36 μg의 4.09이었다. 레이저 캡처 미세 절제는 동결 절단 (Cryosections)로부터 RNA 추출을위한 조직의 컬렉션에 대한 또 다른 대안이다. 레이저 캡처이 모아 동결 절단 (Cryosections) 방법에서보다 우수한이 허용하는 특이 부분에서 셀의 원하는 서브 세트를 수집하고, 50 μm의 두께 (18)까지 단일의 조직 절편에서 수행 될 수있다. 그러나, 마이크로 해부 샘플을 수집 할 수 있습니다 어렵고 적합한 장비는 연구자 풀링을 동결 절단 (Cryosections) 균질화 더 접근 할 수 있도록 널리 사용할 수 없습니다. 두 방법 모두 사용할 수있는 경우, 기본 설정은 응용 프로그램이 하위 지역 분석 덜 중요하고 RNA의 높은 수량이 필요할 때 풀링을 동결 절단 (Cryosections) 균질화 가장 동안 레이저 캡처 미세 절제를 선호 할 만 작은 RNA 수량을 필요로하기위한 조직의 하위 영역을 분석합니다.
조직학 및 RNA 분리 방법은 여기에 집중하는 동안 풀링 동결 절단 (Cryosections) 방법 용이 웨스턴 블롯 분석 또는 효소 활성 측정을 위해 단백질 용 해물을 준비하도록 구성된다. 예를 들어, 마음에서 풀 저온부는 웨스턴 블롯에 대한 용해 된 4를 분석차 조교에서 풀링 저온부는 미토콘드리아 기능 5 숙신산 탈수소 효소 활성 분석을 위해 균질화 하였다. 대안 적으로, 게놈 DNA 및 단백질 분획 한 저온 유지 세션 후 단일 조직으로부터 게놈 DNA, 단백질, RNA 및 조직학 측정을 유도 할 가능성을 제공하고, RNA를 분리 한 후, 유기 추출시 다른 단계에서 분리 될 수있다.
전반적으로,이 방법의 주된 장점은 단일의 조직에서 다른 시료 전처리를 요구하는 다수의 분석 방법을 가능하게하여 실험 유연성을 증가시키는 것이다. 상기 방법은 근육과 유봉 기반 조직 균질화 효율을 감소 광범위한 인트라 또는 외 다른 조직 구조에 가장 적합하다.
공개
The author declares that she has no competing financial interests.
감사의 말
Madison Grant, Steven Foltz, Halie Zastre and Junna Luan provided technical assistance. Research reported in this publication was supported by the National Institute of Arthritis and Musculoskeletal and Skin Diseases of the National Institutes of Health under award number AR065077. The content is solely the responsibility of the author and does not necessarily represent the official views of the National Institutes of Health.
자료
| Name | Company | Catalog Number | Comments |
| Cork | VWR Scientific | 23420-708 | Cut into small squares with a sharp blade. |
| Plastic coverslip | Fisher Scientific | 12-547 | Used to orient the muscle during freezing. |
| Low temperature thermometer | VWR Scientific | 89370-158 | |
| 2-methylbutane | Sigma | M32631-4L | Caution: hazardous chemical. Store in flammable cabinet. |
| Embedding resin: "cryomatrix" | Thermo Fisher Scientific | 6769006 | Other embedding resins can be substituted for cryomatrix. |
| Cryostat | Thermo Fisher Scientific | microm HM550 with disposable blade carrier | Any working cryostat should be sufficient for the protocol. |
| Disposable cryostat blade | Thermo Fisher Scientific | 3052835 | Use an appropriate blade or knife for the cryostat to be used. |
| RNAse decontamination solution: "RNase Zap" | Thermo Fisher Scientific | AM9780 | |
| Analytical balance | Mettler Toledo | XS64 | |
| Paint brush | Daler Rowney | 214900920 | Use to handle cryosections. Can be found with in stores with simple art supplies. |
| Razor blade | VWR Scientific | 55411-050 | |
| Microscope slide | VWR Scientific | 48311600 | |
| RNA organic extraction reagent: TRIzol | Thermo Fisher Scientific | 15596026 | Caution: TRIzol is a hazardous chemical. Note: Only organic extraction reagents are recommended for RNA extraction from skeletal muscle. |
| 18 gauge needle | VWR Scientific | BD305185 | |
| 22 gauge needle | VWR Scientific | BD305155 | |
| 26 gauge needle | VWR Scientific | BD305115 | Optional. Can be used for a third round of sample trituration in the RNA extraction protocol. |
| 1 ml syringe | VWR Scientific | BD309659 | For very high value samples, a Luer-Lok syringe is recommended (e.g., VWR BD309628). |
| 1-bromo-3-chloropentane (BCP) | Sigma | B9673 | |
| For 70% ethanol in DEPC water: 200 proof alcohol | Decon Laboratories, Inc. | +M18027161M | Mix 35 ml 200 proof alcohol + 15 ml DEPC water. |
| For 70% ethanol in DEPC water: DEPC-treated water | Thermo Fisher Scientific | AM9922 | Mix 35 ml 200 proof alcohol + 15 ml DEPC water. |
| RNA purification kit: PureLink RNA minikit | Thermo Fisher Scientific | 12183018A | Final steps of RNA preparation. |
| DNase/Rnase-free water | Gibco | 10977 | DEPC-treated water can also be used. |
| Spectrophotometer: Nanodrop 2000 | Thermo Fisher Scientific | NanoDrop 2000 | |
| Dnase I | Thermo Fisher Scientific | AM2222 | Treat purified RNA to remove any DNA contamination before downstream appications. |
| Hydrophobic pen | Thermo Fisher Scientific | 8899 | |
| Dulbecco's PBS | Gibco | 14190 | PBS for immunofluorescence protocol. |
| Donkey serum | Jackson ImmunoResearch Laoratories, Inc | 017-000-121 | Rehydrate normal donkey serum stock according to the manufacturer's instructions, then dilute an aliquot to 5% for immunofluorescence. Normal goat serum can also be used. |
| eMHC antibody | University of Iowa Developmental Studies Hybridoma Bank | F1.652 | |
| Collagen VI antibody | Fitzgerald Industries | #70R-CR009x | |
| Donkey anti-rabbit AlexaFluor488 | Thermo Fisher Scientific | A21206 | |
| Goat anti-mouse IgG1 AlexaFluor546 | Thermo Fisher Scientific | A21123 | |
| DAPI (4',6-diamidino-2-phenylindole) | Thermo Fisher Scientific | D1306 | |
| Aqueous mounting media: Permafluor | Thermo Fisher Scientific | TA-030-FM | Only use mounting media designed for fluorescent applications with anti-fade properties. |
| Glass coverslip | VWR Scientific | 16004-314 | Use for mounting slides at the end of immunofluorescence protocl |
| Image analysis software: ImageProExpress | Media Cybernetics, Inc. | Image-Pro Express, or more advanced products | Freeware ImageJ should also work for manual counting. More advanced software with segmentation abiities may allow partial automation of the process; e.g., ImageProPremier. |
| Merge and map section images: Photoshop | Adobe | Photoshop | |
| Cardiotoxin | Sigma | C9659 | Sigma C9659 has been discontinued. Other options for cardiotoxin are EMD Millipore #217503; American Custom Chemicals Corp. # BIO0000618; or Ge Script # RP17303; but these have not been validated. |
| reverse transcription kit: Superscript III First-strand synthesis system | Thermo Fisher Scientific | 18080051 | Any validated, high quality reverse transcription reagents can be used. |
| Standard PCR: GoTaq Flexi polymerase system | Promega | M8298 | Any validated, high quality Taq polymerase system can be used. If DNA sequencing is to be used for any application downstream of the PCR, then a high fidelity PCR system should be used instead. |
| SYBR green | Thermo Fisher Scientific | S7585 | For use in qPCR when not using a dedicated qPCR master mix. Use with SuperROX (for Applied Biosystems instruments) and GoTaq Flexi polymerase and buffers. |
| ROX: SuperROX, 15 mM | BioResearch Technologies, Inc. Novato CA | SR-1000-10 | SuperROX is more stable in the PCR reaction, so it is preferred for use as a qPCR passive reference dye over ROX (carboxy-X-rhodamine). For qPCR with Applied Biosystems instruments |
| Real-time PCR | Applied Biosystems | 7900HT |
참고문헌
- Foltz, S. J., et al. Abnormal skeletal muscle regeneration plus mild alterations in mature fiber type specification in Fktn-Deficient Dystroglycanopathy Muscular Dystrophy Mice. PLoS One. 11 (1), 0147049 (2016).
- Bartoli, M., et al. Noninvasive monitoring of therapeutic gene transfer in animal models of muscular dystrophies. Gene Ther. 13, 20-28 (2006).
- Ip, W. T., Huggins, C. E., Pepe, S., Delbridge, L. M. Evaluating RNA preparation options for archived myocardial biopsies. Heart Lung Circ. 20 (5), 329-331 (2011).
- Beedle, A. M., et al. Mouse fukutin deletion impairs dystroglycan processing and recapitulates muscular dystrophy. J. Clin. Invest. 122 (9), 3330-3342 (2012).
- Foltz, S. J., et al. Four-week rapamycin treatment improves muscular dystrophy in a fukutin-deficient mouse model of dystroglycanopathy. Skeletal Muscle. 6, 20 (2016).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nat. Protoc. 10, 1612-1624 (2015).
- Rump, L. V., Asamoah, B., Gonzalez-Escalona, N. Comparison of commercial RNA extraction kits for preparation of DNA-free total RNA from Salmonella cells. BMC Res. Notes. 3, 211 (2010).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. J. Vis. Exp. (45), e2565 (2010).
- Valdez, M. R., Richardson, J. A., Klein, W. H., Olson, E. N. Failure of Myf5 to support myogenic differentiation without myogenin, MyoD, and MRF4. Dev Biol. 219 (2), 287-298 (2000).
- Pavlath, G. K., Dominov, J. A., Kegley, K. M., Miller, J. B. Regeneration of transgenic skeletal muscles with altered timing of expression of the basic helix-loop-helix muscle regulatory factor MRF4. Am. J. Pathol. 162 (5), 1685-1691 (2003).
- Chomczynski, P., Mackey, K. Substitution of chloroform by bromo-chloropropane in the single-step method of RNA isolation. Anal. Biochem. 225 (1), 163-164 (1995).
- Lee, J. T. Y., Cheung, K. M. C., Leung, V. Y. L. Extraction of RNA from tough tissues with high proteoglycan content by cryosection, second phase separation and high salt precipitation. J. Biol. Methods. 2 (2), 20 (2015).
- Guo, D., Catchpoole, D. R. Isolation of intact RNA following cryosections of archived frozen tissue. BioTechniques. 34, 48-50 (2003).
- Goodpaster, T., Randolph-Habecker, J. A flexible mouse-on-mouse immunohistochemical staining technique adaptable to biotin-free reagents, immunofluorescence, and multiple antibody staining. J. Histochem. Cytochem. 62 (3), 197-204 (2014).
- Ikezawa, M., Minami, N., Takahashi, M., Goto, Y., Miike, T., Nonaka, I. Dystrophin gene analysis of 130 patients with Duchenne muscular dystrophy with a special reference to muscle mRNA analysis. Brain Dev. 20 (3), 165-168 (1998).
- Majumdar, G., Vera, S., Elam, M. B., Raghow, R. A streamlined protocol for extracting RNA and genomic DNA from archived human blood and muscle. Anal. Biochem. 474, 25-27 (2015).
- Espina, V., Heiby, M., Pieroban, M., Liotta, L. A. Laser capture microdissection technology. Expert Rev Mol Diagnostics. 7 (5), 647-657 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유