Method Article
Kryoschneiden von benachbarten Regionen eines einzelnen Maus Skelettmuskel für die Genexpression und histologische Analysen
In diesem Artikel
Zusammenfassung
Aufeinanderfolgende Kryo-Abschnitte werden gesammelt, um histologische Anwendungen und Anreicherung von RNA für Genexpressionsmessungen mit benachbarten Regionen aus einer einzigen Maus Skelettmuskel ermöglichen. 30 mg gepoolt Kryoabschnitte und Messungen werden direkt im Vergleich über mehrere Anwendungen hinweg - Qualitativ hochwertige RNA wird aus 20 erhalten.
Zusammenfassung
Mit diesem Verfahren werden aufeinanderfolgende Kryoschnitte gesammelt beide Mikroskopieanwendungen für Gewebe Histologie und Anreicherung von RNA für die Genexpression zu ermöglichen, benachbarte Bereiche von einer einzigen Maus Skelettmuskel verwendet. Typischerweise wird es ausreichende Homogenisierung von kleinen Skelettmuskelproben zu erreichen, herausfordernd, weil Puffervolumen für die effiziente Schleifanwendungen zu gering sein kann, aber ohne ausreichende mechanische Störung, die dichte Gewebearchitektur der Muskelgrenzen Eindringen von Pufferreagenzien, was letztlich geringe RNA-Ausbeute. Durch Befolgen des Protokolls hier berichtet wird, 30 & mgr; m Abschnitte werden gesammelt und vereinigt Kryoschneiden und anschließende Homogenisierung Nadel ermöglicht, um mechanisch den Muskel zu stören, die Erhöhung der Oberfläche für die Puffer Eindringen ausgesetzt. Die primären Beschränkungen der Technik sind, dass es einen Kryostaten erfordert, und es ist relativ geringen Durchsatz. Allerdings können qualitativ hochwertige RNA aus kleinen Proben von gepoolten m erhalten werdenuscle Kryoschnitte, so dass dieses Verfahren zugänglich für viele verschiedene Skelettmuskeln und anderen Geweben. Darüber hinaus ermöglicht diese Technik angepasst Analysen (zB Gewebe Histopathologie und Genexpression) aus benachbarten Regionen eines einzelnen Skelettmuskel , so dass Messungen direkt im Vergleich über mehrere Anwendungen hinweg werden können experimentelle Unsicherheit zu reduzieren und replikative Tierversuche notwendig zur Quelle ein kleines Gewebe zu reduzieren für mehrere Anwendungen.
Einleitung
Das Ziel dieser Technik ist es, mehrere experimentelle Analysen von verschiedenen Modalitäten, wie Histologie und Genexpression, zugänglich von einem einzigen kleinen Skelettmuskel Quelle Gewebe zu machen. Mikroskopieanwendungen sind die empfindlichsten Konservierungsverfahren abzutasten, die sorgfältig während der Kryokonservierung kontrolliert werden muss, die Bildung von Eiskristallen Artefakte zu begrenzen. Somit wird der Methodenentwicklung auf der Grundlage der tibialis anterior (TA) gefroren Muskel teilweise mit Einbettungsharz in einer -140 ° C mit flüssigem Stickstoff gekühlt 2-methylbutan-Bad als Ausgangsmaterial sowohl für die Mikroskopie Immunofluoreszenz abgedeckt und Genexpressionsanalyse.
Die Notwendigkeit, die gleiche Ausgangsmaterial für verschiedene technische Ansätze zu verwenden, ist besonders wichtig für die intramuskuläre Injektion basierende Experimenten, wo die linke und rechte Muskeln verschiedenen Bedingungen darstellen, eine Versuchs- und eine Kontroll. Zum Beispiel in der Muskelregeneration Studien, eine muscle ist mit einem Toxin injiziert weit verbreitete Gewebeschädigung zu verursachen , während der kontralateralen Muskel dient als Vehikel-injizierten Kontroll 1. In ähnlicher Weise Störungen Studien der Gentherapie für die Muskel beginnen in der Regel mit Validierung des Gentherapievektor durch intramuskuläre Injektion mit leerem Vektor verglichen werden, nicht verwandten Vektor oder Fahrzeugsteuerung auf der Gegenseite 2. Daher ist es nicht möglich, jeden TA Muskel zu einer anderen Anwendung beziehen.
Gemeinsame Strategien mit diesem Thema befassen, sind: i) eine andere Muskelgruppe für jede Anwendung zu verwenden, ii) zusätzliche Mäuse zu verwenden, oder iii) für jede Anwendung ein Stück des Muskels abzuschneiden. Allerdings erhebliche Unterschiede zwischen den Muskelgruppen machen es schwierig, Daten aus separaten Anwendungen zu vergleichen und weiteren Tieren erhöhen Kosten und sind schlecht gerechtfertigt, wenn andere Alternativen gibt. Die Aufteilung der Muskel nach der Sektion verschiedenen Anwendungen zu beziehen ist die beste Option in vielen Fällen. Jedoch sind die Muskelstücke oft zu klein für die Homogenisierung 2-5 Pulverisierung unter flüssigem Stickstoff oder mechanische Schleiftechniken zu verwenden. Muskel führt ein hochStrukturGewebe gepackt mit extrazellulären Matrix und kontraktilen Proteine, unzureichende mechanische Homogenisierung zu einer geringen Ausbeute an nachfolgende DNA, RNA oder Protein. Das Verfahren detailliert hier können kleine Mengen von Gewebe aus einer Hand Muskel für den Einsatz in vielfältigen Anwendungen, und die Einbeziehung von Kryoschneiden und Nadel Verreiben verbessert mechanische Homogenisierung für eine bessere RNA-Ausbeute.
Protokoll
Alle Tier Verfahren wurden von der University of Georgia Institutional Animal Care und Use Committee unter Verwendung von Tieren Protokoll A2013 07-016 (Beedle) zugelassen.
1. Kryokonservierung von Unfixierte Skelettmuskel
- Vorbereitung
- Schneiden Kork in kleine Quadrate (ca. 1 cm x 1 cm) mit einer Rasierklinge, schreiben auf den Korken mit einer feinen Spitze Marker, der an 2-Methyl resistent ist, die Quelle Maus und Muskel zu identifizieren, und machen einen sehr flachen Schnitt (ca. 1 mm) über die obere Oberfläche. Legen Sie eine Kunststoff-Deckglas in den Schnitt zur Ausrichtung des Gewebes zu verwenden. Wiederholen, bis ein Korken bereit ist, für jedes Gewebe kryokonserviert werden.
- Erhalten flüssigem Stickstoff, 2-Methyl, Einbettmittel, Tieftemperatur-Thermometer, Korken, Dissektionswerkzeuge und Studie Maus.
ACHTUNG: Flüssiger Stickstoff ist ein komprimiertes Gas , das bei Erhitzen explodieren können. Laborkittel, Tieftemperatur-Handschuhe und Gesichtsschutz beim Umgang mit flüssigen nitrogen; Kontakt mit der Haut oder den Augen kann zu Verbrennungen oder Erfrierungen verursachen. 2-Methyl ist eine entzündlich, giftig, Gesundheits- und Umweltrisiko dar . Persönliche Schutzausrüstung tragen (Laborkittel, Handschuhe, Schutzbrille), öffnen Sie den Vorratsbehälter in einem Abzug, übertragen die kleine Menge, die für das Einfrieren (in der Regel 200 bis 400 ml) in einen separaten Behälter, der dicht verschlossen werden kann, und zur Vermeidung von Inhalation . - Euthanize Mäuse mit einer genehmigten Methode der Sterbehilfe unter Narkose. Kurz gesagt, mit 2,5% Isofluran in Sauerstoff aus einem Isofluran Verdampfer mit der Maus in eine Inhalationskammer einlegen, warten Sie, bis 20 Sekunden nach der Maus für ein Pedal Reflex zu überprüfen nicht mehr bewegt. Wenn das Pedal reflex negativ ist, euthanize die Studie Maus durch zervikale Dislokation 6.
HINWEIS: Euthanasie Methoden bedürfen der Zustimmung des institutionellen Ethikkommission. - Entfernen Sie die Haut des distalen hindlimb darüber liegenden und schneiden Sie die distalen vorderen Sehnen knapp über dem Knöchel fein Punkt dissection Schere. Fassen Sie die distalen Sehnen mit einer feinen Pinzette und sanft nach oben ziehen und in Richtung der Knie während seitliche Faszie Schneiden des Muskels zu lösen. Ziehen Sie den Muskel aus senkrecht vom Knie und machen einen endgültigen Schnitt des TA - Muskel 7 auszuschneiden.
HINWEIS: Der Muskel TA wird hier verwendet als ein Beispiel, aber jede Maus Skelettmuskel oder das Herz kann des Benutzers Versuchsziele gegebenenfalls in diesem Protokoll für die TA ersetzt werden. Die einzige Einschränkung ist, dass ein Gewebe klein genug sein muss, schnelle Kryokonservierung über seine gesamte Tiefe zu erreichen; eine maximale Gewebe Größe von 1 cm x 1 cm wird empfohlen. - Wiederholen Sie auf dem anderen Bein und sezieren heraus alle anderen Gewebe gesammelt werden. Führen dissection so schnell wie möglich Gewebeabbau vor der Kryokonservierung zu begrenzen.
- Orient jeder Muskel für Querschnitte auf seiner voretikettierten Kork. Stellen Sie die Muskel senkrecht zu den Korken mit dem distalen Sehne berührt den Korken und die Spitze des Muskels extweg, aufrecht gehalten durch das Deckglas endet.
- Kryokonservierung alle Gewebe für die histologische Analyse so bald wie möglich nach der Sektion, vorzugsweise innerhalb von 5 min, aber auf jeden Fall nicht mehr als 15 min verstrichene Zeit seit Euthanasie der Quelle Tier.
- Kryokonservierung
- Beginnen Sie mit der Kryokonservierung Bad fünf Minuten vor dem Ende der Dissektion Abkühlung. Pour 2-methylbutan in einen offenen Metallbecher bis zu einer Tiefe von etwa 3 cm. Gießen von flüssigem Stickstoff in einen isolierten Behälter mit einer Tiefe von 2 bis 4 cm. Stellen Sie das Becherglas von 2-Methylbutan in den flüssigen Stickstoff; der Stickstoff zu kochen beginnt. Vermeiden Stickstoff Spritzwasser in das 2-Methyl Becher.
ACHTUNG: Bereiten Sie in einem Abzug oder einem gut belüfteten Bereich Einfrieren Bad. - Legen Sie eine Niedertemperatur-Thermometer in die 2-Methyl Temperatur zu überwachen und häufig mit einer Gabel umrühren, um sicherzustellen, gleichmäßige Kühlung. Weiter rühren und abkühlen, bis 2-methylbutane erreicht -140 ° C, das Hinzufügen neuer flüssigem Stickstoff zu dem äußeren Bad wie nötig.
HINWEIS: -140 ° C ist die optimale Temperatur Eiskristall Artefakte in quergestreiften Muskulatur zu minimieren; andere Gewebe bei verschiedenen Temperaturen Kryokonservierung besten (beispielsweise Gehirn, -90 ° C). - Einbettungs Harz nur auf den unteren 35 - 50% des Muskels, wo er den Korken trifft und fallen sofort den Korken in die 2-Methyl bei -140 ° C. wiederholen sich schnell bis zu 8 Geweben pro freeze Charge. Rühre 30 sec, den Boden des Bechers Abkratzen, um sicherzustellen, dass Gewebe nicht einfrieren in das Verfestigen 2-methylbutan.
- Mit einer Gabel, Löffel oder geschlitzt große Zange jedes Gewebe Korken aus der 2-Methyl zu ziehen. Schnell das Deckglas zu entfernen, überschüssige 2-Methyl in den Becher, und dann fallen die Gewebe Kork in den äußeren Stickstoff Bad abtupfen. Wiederholen Sie dies für den restlichen Korken in den Becher.
- Transfer-Proben in flüssigem Stickstoff oder auf Trockeneisein -80 ° C Gefrierschrank für die Lagerung.
- Wenn irgendwelche Gewebe für die Kryokonservierung bleiben, wiederholen Sie die Schritte 1.2.3 bis 1.2.4. Fügen Sie zusätzliche 2-Methyl dem Becher oder flüssigem Stickstoff auf dem äußeren Bad als notwendig und wieder kühl bis -140 ° C. Entsorgen Sie die 2-Methyl als gefährlicher Abfall eingestuft.
- Beginnen Sie mit der Kryokonservierung Bad fünf Minuten vor dem Ende der Dissektion Abkühlung. Pour 2-methylbutan in einen offenen Metallbecher bis zu einer Tiefe von etwa 3 cm. Gießen von flüssigem Stickstoff in einen isolierten Behälter mit einer Tiefe von 2 bis 4 cm. Stellen Sie das Becherglas von 2-Methylbutan in den flüssigen Stickstoff; der Stickstoff zu kochen beginnt. Vermeiden Stickstoff Spritzwasser in das 2-Methyl Becher.
2. Sammeln Cryoschnitte für Histologie und RNA-Anwendungen
- Vorbereitung.
- Pre-wiegen eine DNase / RNase-freie autoklaviert Rohr auf einer Analysenwaage. Dann bewegen sie in die Kryostatkammer vorzukühlen. Wiederholen, bis Rohre bereit sind, für alle zusammengefasste Kryoschnittes Proben gesammelt werden.
- Für Skelettmuskel-Schnitte, bestätigen, dass die Kryostatkammer Temperatur -21 bis -22 ° C durch seinen internen Thermostat ist. Übertragen keine Behälter mit Gewebe geschnitten in die Kammer zu ermöglichen, und der Behälter (s) mindestens 15 min vor dem Öffnen zu dem Kryostaten Temperatur äquilibrieren.
- Legen Sie eine neue Einweg-Kryostaten Klinge. Alternativ entfernen Sie das vorhandene Klinge, Spray mit RNase Dekontaminationslösung, Spülen mit ddH 2 O, und setzen Sie sie wieder in den Kryostaten zu kühlen. Sprühen Sie einen sauberen Tuch mit 70% Ethanol und vorsichtig die Klinge und Klingenklemm Plattform wischen.
- Spray ein sauberes Gewebe mit einer RNase Dekontaminationslösung und wischen Kryostaten Bürsten. Sprühen Sie ein Gewebe mit ddH 2 O, reinigen Sie die Bürsten wieder und stellte sie in der Kryostatkammer auf eine saubere Oberfläche.
ACHTUNG: Der Kryostat Klinge sollte durch den Messerschutz abgedeckt werden , wenn sie nicht in Gebrauch ist . Auch RNase Dekontaminationslösung ist giftig und friert einen Niederschlag in der Kälte Kryostatkammer zu bilden. Deshalb vorsichtig und seine Verwendung in der Kryostatkammer vermeiden.
- Spray ein sauberes Gewebe mit einer RNase Dekontaminationslösung und wischen Kryostaten Bürsten. Sprühen Sie ein Gewebe mit ddH 2 O, reinigen Sie die Bürsten wieder und stellte sie in der Kryostatkammer auf eine saubere Oberfläche.
- Innerhalb der Kryostatkammer, legen Sie einen Dime-Größe Tropfen (etwa 300 ul) des Harzes auf eine warme Probe chuck Einbettung, setzen Sie ein Gewebe Korken auf dem Harz, nach unten drücken, und legen Sie das Futter in den freezing Schiene oder auf ein Schnellgefrierelement, falls vorhanden.
- Nach dem Einbetten Harz verfestigt (weiß), fügen Sie zusätzliche Einbettung Harz auf dem Kork, um den unteren 35% des Gewebes und drücken Sie die Wärme-Extraktor in das Einbettmittel für ein schnelles Einfrieren besser in das Gewebe zu stabilisieren. Warten Sie 5 Minuten vor dem Schneiden das Harz zu ermöglichen, vollständig zu härten.
- Sicherzustellen, dass der Probenklammer in seiner am weitesten zurückgezogenen Position befindet, die am weitesten von der Klinge. Legen Sie die Gewebeprobe Futter in die Objektklammer.
- Kryoschnittes Vorbereitung.
- Lösen Sie die Messerträgerhalter, stellen Sie den Freiwinkel des Messers auf 10 ° (oder einem Winkel geeignet für den Messerträger verwendet wird), und wieder anziehen. Lösen Sie die Bremse und drehen Sie das Handrad den Muskel zur Klinge zu senken. Schätzen Sie den kürzesten Abstand zwischen dem Gewebe und Klinge, bewegen sich dann das Gewebe von der Klinge weg und greifen Bremse das Handrad.
- Lösen Sie die Höhenverstellung lever und bewegen den Klingenträger nach vorne oder hinten, beziehungsweise, wenn das Ende des Gewebes mehr als etwa 2 mm von der Klinge oder der Klinge trifft auf das Gewebe. Ziehen Sie und senken Sie wieder das Gewebe Abstand zu prüfen, von der Klinge. Wiederholen Anpassungen bis die Klinge 1 bis 2 mm von dem Ende des Gewebes durch visuelle Schätzung.
- Senken Sie das Gewebe in Richtung der Klinge und beurteilen Gewebe Winkel für Querschnitte. Verriegeln Sie das Handrad und lassen Sie die Probe Klemmhebel. Schieben der Probenklammer nach links oder rechts, bis die horizontale Ausrichtung des Gewebes an der Klinge senkrecht.
- Schieben Sie die Objektklammer nach oben oder unten die "y" Ausrichtung anzupassen, so dass Gewebeschnitte senkrecht zur Längsachse des Muskels sein wird. Ziehen Sie die Probe Klemmhebel.
- Verwenden Sie die Grob- und Feinvorschub die Probe zu fördern, bis sie gerade die Klinge berührt. Sofern Teile aus einem bestimmten Gewebetiefe zu suchen, setzen Sie die Summe der Schnittdicken auf Null (Spitze des Gewebes).
- Stellen Sie den Kryostaten auf die Trimm-Funktion mit Schnittdicke bei 30 & mgr; m. Schneiden Sie und verwerfen Abschnitte , bis die vorgewählte Tiefe für die Gewebesammlung erreicht wird (zB 400 & mgr; m von oben).
- Sammeln Sie Kryoabschnitte für die RNA-Extraktion.
- Öffnen Sie das Rohr zum Sammeln Abschnitte und legen Sie sie in der Nähe des Messerträgers. Verwenden Sie eine vorgekühlte, sauberen Pinsel jeden Abschnitt zu holen, wie sie von der Klinge und übertragen die Kryoschnittes in das Rohr geschnitten wird. Wiederholen, bis die vereinigten Abschnitte 30 mg wiegen oder die gewünschten Gewebetiefe erreicht ist.
HINWEIS: Für einen erwachsenen Maus tibialis anterior, Sammlung von Gewebetiefe von etwa 400 bis 4000 & mgr; m ergibt typischerweise 25 - 40 mg. Mit Metallzange zu übertragen Abschnitte mit dem Sammelrohr wird nicht empfohlen, da die Abschnitte auf der Metalloberfläche zu haften und verklumpen neigen. - Wenn Einbettmittel den Muskel Kryoschnittes umgibt, sperren Sie die Handbremse und die Verwendung einer Rasierklingekleine Stücke von Harz abrasieren, bis nur noch eine dünne Schicht um die Spitze des Muskels ist. Schneiden Sie immer Harz mit der Klinge weg abgewinkelt vom Muskel.
HINWEIS: Eine dünne Schicht Harz der Einbettung im Wesentlichen nicht die Downstream-RNA-Präparation beeinträchtigen. Wenn dickere Einbettmittel vorhanden ist, verwenden Sie Pinsel, die er aus dem Muskel weg zu necken, bevor Sie die Kryoschnittes in das Sammelrohr bewegt. - Alternativ Pool Abschnitte auf der Messerträger und die Übertragung in der Masse zu dem Sammelrohr.
HINWEIS: Jedoch neigt diese Methode langsamer zu sein, und die Abschnitte sind eher zusammenkleben und verklumpen, was die Effizienz der Nadel Homogenisierung in späteren Schritten zu reduzieren. - Schnell stellen die gepoolten Kryoschnittes Rohr in einer Analysenwaage und Rekordrohr Gewicht. Unmittelbar senden Sie das Rohr mit dem kalten Kryostaten Kammerabschnitt Temperatur nahe -20 ° C zu halten. Berechnen des Gewichts der vereinigten Abschnitte.
HINWEIS: Wenn die RNA-Isolierung auf Anzeige auftretenifferent Tag, speichern Sie die gepoolten Kryoschnittes Rohr bei -80 ° C bis zur Verwendung.
- Öffnen Sie das Rohr zum Sammeln Abschnitte und legen Sie sie in der Nähe des Messerträgers. Verwenden Sie eine vorgekühlte, sauberen Pinsel jeden Abschnitt zu holen, wie sie von der Klinge und übertragen die Kryoschnittes in das Rohr geschnitten wird. Wiederholen, bis die vereinigten Abschnitte 30 mg wiegen oder die gewünschten Gewebetiefe erreicht ist.
- Sammeln Sie Kryoabschnitte für die Histologie.
- Drücken Sie die Schnittdicke Knopf für die Feinschneide und Verwendung Pfeile, um die Kryostatschnitt Dicke auf 7 & mgr; m (oder einem anderen geeigneten Schnittdicke, in der Regel 6 bis 10 & mgr; m).
HINWEIS: dünneren Abschnitten (6 bis 10 um) sollte für die histologische Anwendungen verwendet werden, dass Färbereagenzien sicherstellen kann die Tiefe des Gewebeschnittes durchdringen. Dünne Schnitte können aus jeder Tiefe während der Kryoschneiden genommen werden, aber tiefere Abschnitte werden bevorzugt, da Harz einbetten, die mit Gewebetiefe erhöht, nicht histologischen Färbung nicht beeinträchtigt. - Schneiden Sie und verwerfen 4 bis 7 Abschnitte eine konsistente, auch Gewebeoberfläche zu erhalten. Notieren Sie sich die Gewebetiefe.
- Geschnitten, um einen Abschnitt und richten sie auf der Oberfläche des Klingenträgers. Nehmen Sie den Abschnitt durch schnell und sanft eine warme (Raumtemperatur) Mikroskop-Objektträger zu berührenauf den Abschnitt auf dem Messerträger. Bringen Sie den Schieber auf Raumtemperatur. Fortgesetzt, bis die Anzahl der gewünschten Folien erhalten wird. Notieren Sie sich die endgültige Gewebetiefe.
HINWEIS: eine zweite (duplicate) Abschnitt für jedes Gewebe Sammeln empfohlen. - Mit sectioning abgeschlossen ist, greifen in die Hand Radbremse, kehren die Probe in die hinterste Position, und das Gewebe Futter entfernen. Verwenden Sie den Kryostaten Wärmeelement das Einbetten von Harz zu schmelzen, das Gewebe Korken auf dem Proben Futter zu halten. Entfernen Gewebe Kork, trocken mit Gewebe, und zurück zur Lagerung.
- Wiederholen von Schritt 2.1.2 für jede verbleibende Gewebe. Erlauben Folien für 20 min zum Trocknen nach der letzten Gewebe angebracht ist. Verwenden Sie dann Dias für die histologische oder Immunfluoreszenzanfärbung oder Einfrieren bei -80 ° C in einer Dia-Box, bis sie benötigt.
- Drücken Sie die Schnittdicke Knopf für die Feinschneide und Verwendung Pfeile, um die Kryostatschnitt Dicke auf 7 & mgr; m (oder einem anderen geeigneten Schnittdicke, in der Regel 6 bis 10 & mgr; m).
3. RNA-Isolierung aus gepoolten Cryoschnitte
- RNA-Extraktion
- Verschieben Röhre (n) von gepoolten Kryoabschnitte auf Eis. Sofort im einorganischen RNA Extraktionsreagenz in einem Verhältnis von etwa 1 ml pro 50 mg Reagenz Kryoschnitt Gewicht, typischerweise 600 & mgr; l pro Röhrchen.
ACHTUNG: RNA - Isolierung Reagenzien sind giftig, ätzend und reizend. Folgen Sie den Anweisungen des Herstellers zum sicheren Umgang. - Unter Verwendung einer 1-ml-Spritze mit einer 18-Gauge-Nadel, ziehen die Flüssigkeit nach oben RNA-Extraktion und spülen Sie die Wände des Rohres, bis alle Gewebe in der Lösung suspendiert wird. Versuchen Sie, um Luftblasen während Nadel Homogenisierung minimieren.
- Verwenden Sie die Spitze der Nadel zu zerdrücken und zu zerstreuen alle verklumpten Kryoabschnitte und Stücke an der Rohrwand haften. Man reibt zu homogenisieren von fünf Strichen die Probe nach oben und unten durch die Nadel vorbei, und dann die Probe auf Eis zurückzukehren. Wiederholen sowohl die Schritte drei bis fünfmal oder so oft wie notwendig ist, alle Klumpen zu stören und die Probe leicht durch die Nadel passieren.
- Entfernen Sie die 18-Gauge-Nadel und ersetzen sie durch eine 22-Gauge-Nadel. sorgfältig triturate die Probe für fünf Schläge, und kehren dann die Probe auf Eis. Wiederholen Sie die Verreiben drei bis vier Mal eine sehr fein dispergierte Gewebehomogenat zu erreichen.
HINWEIS: Wenn Gewebepartikel beginnen die Nadel zu blockieren, wenn die Probe Ausarbeitung vertreiben alle Probe aus der Spritze und wechseln Sie wieder auf die 18-Gauge-Nadel für weitere Homogenisierung. Eine zusätzliche Verreibung Schritt mit einer 25 oder 26 Gauge-Nadel zugesetzt werden maximale Ausbeute zu erhalten. Jedoch kann die Nadel verstopft werden, so besteht die Gefahr der Probe Verschütten ist. - Bewegen Sie die Probe aus Eis auf Raumtemperatur. Inkubieren Sie für 5 min auf molekulare Komplexe unterbrechen.
- In einem Abzug mit 0,1 ml 1-Brom-3-chlorpentan (BCP) pro 1 ml RNA-Isolierung Reagenz verwendet (Schritt 3.1.1), typischerweise 60 & mgr; l pro Röhrchen. Das Röhrchen wird kräftig von Hand für 15 Sekunden (nicht vortexen). Inkubieren der Probe bei Raumtemperatur für 2 bis 3 min. Anschließend zentrifugieren für 15 min bei 12.000 xg und 4 ° C.
VORSICHT: BCP ist brennbar und giftig. Griff in einer Abzugshaube und Handschuhe tragen, einen Laborkittel und Schutzbrille. - sammeln Sie vorsichtig die obere wässrige Phase (farblos), die RNA und übertragen sie in ein sauberes Röhrchen. Fügen Sie ein gleiches Volumen von 70% igem Ethanol (in DEPC-Wasser) und Wirbel zu mischen. Inkubieren bei Raumtemperatur für bis zu 10 min.
HINWEIS: das mittlere und untere Zwischenphasen Phenol-BCP Phasen können für die genomische DNA und Protein verarbeitet werden, jeweils entsprechend den Anweisungen des Herstellers oder in einem Phenol-BCP gefährlichen Abfallbehälter zur Entsorgung gesammelt.
- Verschieben Röhre (n) von gepoolten Kryoabschnitte auf Eis. Sofort im einorganischen RNA Extraktionsreagenz in einem Verhältnis von etwa 1 ml pro 50 mg Reagenz Kryoschnitt Gewicht, typischerweise 600 & mgr; l pro Röhrchen.
- RNA-Reinigung.
- Folgen Sie den Anweisungen des Herstellers für die Proben Bindung, Waschen und Elution mit geringfügigen Abweichungen 8. Beispielsweise:
- Einen aliquoten Teil DNase / RNase-freies Wasser in einem 37 ° C Bad oder Inkubator Vorwärmen für Schritt 3.2.4.
- Fügen Sie die RNA-Probe von oben 3.1.8 zu einer Reinigungskolonne und Zentrifuge die Probe für 15 Sekundenbei 12.000 xg bei Raumtemperatur. Gießen der Strömung durch wieder in der gleichen Spalte und wieder zentrifugiert. Wiederholen Sie ein weiteres Mal RNA-Bindung, zu maximieren und dann die endgültige Fluss durch verwerfen.
- Führen Waschschritte gemäß den Anweisungen des Herstellers 8. Bewerben 700 & mgr; l Waschpuffer (kein Ethanol) auf die Säule, Spin für 15 Sekunden bei 12.000 · g, und entsorgen Sie die Strömung durch.
- In 500 ul Waschpuffer (mit Ethanol) auf die Säule, Spin für 15 Sekunden bei 12.000 · g, und entsorgen Sie die Strömung durch. Wiederholen Sie diesen Schritt einmal.
- Drehen Sie die leere Säule für 1 min bei 12.000 xg um die Membran zu trocknen.
- Übertragen Sie die Spin-Säule auf eine saubere RNase-, DNase-freie Röhrchen. In 40 ul vorgewärmtes DNase / RNase-freies Wasser (von 3.2.1) in die Mitte der Säule Membran. Bei Raumtemperatur inkubieren für 2 min und dann für 2 min bei 12.000 x g zentrifugieren.
HINWEIS: Die 40 & mgr; l Elutionsvolumen beträgt etwa 1,3 & mgr; l pro mg ursprünglichenGewebe für 30 mg gepoolt Kryoabschnitte. Stellen Sie die Elutionsvolumen als geeignet für unterschiedliche Ausgangsgewebegewichte, aber nicht reduzieren unter 32 & mgr; l. Eine zweite Elution unter Verwendung von etwa 0,7 & mgr; l pro mg des ursprünglichen Gewebes kann Gesamt-RNA Ausbeute zu erhöhen hinzugefügt werden. - Analyse der RNA (Säulenelution) für die Konzentration und Reinheit durch ein Spektrophotometer, Elektrophorese und / oder einem Bioanalyzer. Lagern Sie die RNA bei -80 ° C bis zum Downstream - Anwendungen benötigt werden , wie zum Beispiel die reverse Transkription für quantitative PCR - 4.
HINWEIS: Eine DNase-Behandlung wird empfohlen, vor der RNA in Downstream-Anwendungen verwendet wird. Diese Behandlung kann bei einigen RNA Reinigungssäulen vor dem Waschschritt durchgeführt werden, an diesem speziellen Punkt folgende Säulenelution, oder auf einem Aliquot der RNA als ersten Schritt in jedem Downstream-Anwendung. Die RNA sollte für mehrere Jahre stabil sein.
4. Die histologische Analyse von Immunofluoreszenz Staining Muscle Cryoschnitte
- Einfache Immunofluoreszenz-Protokoll.
- Verwenden Sie einen hydrophoben Stift, um die Gruppe von Abschnitten auf jeder Folie zu umkreisen. PBS in den eingekreisten Bereich (ca. 80 & mgr; l für eine kleine Fläche von bis zu 500 & mgr; l für eine große Oberfläche) vorsichtig fallen, darauf achten, daß das Gewebe zu berühren. Inkubieren für 5 min bei Raumtemperatur.
HINWEIS: Wenn gefrorene Folien verwenden, entfernen Sie Dias von -80 ° C Gefrierschrank und Inkubation bei Raumtemperatur für 20 bis 30 min und trocken auftauen, dann weiter wie oben. Mindestens zwei Folien benötigt werden: ein experimentelles Folie in primären und sekundären Antikörper inkubiert werden; und ein Steuerschieber, für den primären Antikörper ist ausgeschlossen, die "sekundäre nur" Kontrolle. - Tipp der Folie abgießen PBS. In 5% Eselserum in PBS (Blocking-Lösung) auf den eingekreisten Bereich; vorsichtig sein, um sicherzustellen, dass die Muskelpartien nicht austrocknen. Inkubieren bei Raumtemperatur für 30 min (oder bis zu mehreren Stunden in einer Feuchtigkeitskammer).
- Bereiten primären Antikörperlösung zur Muskelregeneration zu analysieren. Mischungsblockierungslösung, mit einem EMHC Antikörper (01.40) und einem ColVI Antikörper (1: 1000). Bereiten Sie etwa 150 & mgr; l, 300 & mgr; l oder 500 & mgr; l für kleine, mittlere oder große Gleitflächen sind. Rührers 5 sec und dann zentrifugieren für 2 min bei 15.000 xg jede Präzipitat zu pelletieren.
- Für experimentelle Rutschen, kippen Sie die Folie blockiert Lösung abgießen und dann primären Antikörperlösung aus 4.1.3 hinzuzufügen. Für die Sekundärsteuerschieber, kippen Sie den Schiebe Lösung abgießen blockiert und dann frisch Blockierungslösung (kein Antikörper) hinzufügen. Inkubiere Objektträger in einer feuchten Kammer bei 4 ° C über Nacht.
HINWEIS: Wenn Folien Pipettieren Antikörperlösungen auf, immer Flüssigkeit von der Oberseite der primären Antikörperlösung Rohr ziehen, stören keine Niederschlag am Boden des Röhrchens. - Tipp gleitet Lösung abgießen. In PBS tropfenweise zu dem eingekreisten Bereich jeder Folie zu waschen, Spitze zu gießenab, dann mehr PBS hinzufügen und für 3 bis 5 min inkubiert. Wiederholen für insgesamt drei Waschungen.
HINWEIS: Die Waschzeit sehr flexibel ist und kann bei Bedarf auf 20 min verlängert werden. Im Allgemeinen ist die Anzahl der Lösung ändert wichtiger als die Zeit. - Bereiten Sie sekundäre Antikörperlösung für alle Folien (einschließlich der sekundären Steuerschieber) unter Verwendung einer 1: 500 Verdünnung von roten und grünen Fluorophor-gekoppelten Sekundärantikörper Maus IgG1 (EMHC) und Kaninchen-IgG (ColVI) und 1 zu erkennen: 10.000 Verdünnung von DAPI Kern Fleck.
- Zum Beispiel mit 9 ul ddH 2 O zu 1 ul DAPI mischen , um eine Verdünnung von 1:10 von DAPI machen. Dann wird für einen 500 & mgr; l Endvolumen, fügen Sie 1,0 & mgr; l anti-Maus-IgG1-red + 1.0 & mgr; l anti-Kaninchen-IgG-green + 0,5 & mgr; l von 1:10 DAPI zu 447,5 & mgr; l Blockierungslösung. Vortex mischen und Zentrifuge für 2 min bei 15.000 xg jeden Niederschlag zu pelletieren.
HINWEIS: Im Idealfall alle Sekundärantikörper sollte aus den gleichen Wirtsspezies sein.
- Zum Beispiel mit 9 ul ddH 2 O zu 1 ul DAPI mischen , um eine Verdünnung von 1:10 von DAPI machen. Dann wird für einen 500 & mgr; l Endvolumen, fügen Sie 1,0 & mgr; l anti-Maus-IgG1-red + 1.0 & mgr; l anti-Kaninchen-IgG-green + 0,5 & mgr; l von 1:10 DAPI zu 447,5 & mgr; l Blockierungslösung. Vortex mischen und Zentrifuge für 2 min bei 15.000 xg jeden Niederschlag zu pelletieren.
- Tipp die Folien die letzte PBS waschen abgießen. In sekundären Antikörper-Lösung alle Gewebe zu decken. Decken Sie die Dias sie vor Licht zu schützen und für 30 Minuten bei Raumtemperatur inkubiert.
HINWEIS: Alle Sekundärantikörper sollten validiert werden mit anderen Arten in der dualen Markierungsexperimenten minimale Kreuzreaktivität zu haben. - Waschen Sie die Objektträger wie in 4.1.5 beschrieben. Nach der letzten Waschung, Zünglein an der Folie, um die PBS abgießen und die Folie auf einem Gewebe festgelegt. Hinzufügen von 3 bis 4 Tropfen einer wässrigen Befestigungsmittel entlang einer Seite.
- Stellen Sie den Rand eines Deckglas nur auf die Außenkante der Befestigungsmittel. Mit einer Pinzette, senken Sie langsam das Deckglas auf den Geweben, dann lassen Sie die Deck und vorsichtig in die richtige Position zu erschließen. Schließlich sanft jede Ecke des Deckglases drücken es zu stabilisieren.
- Schützen Sie die Folien aus Licht und lagern bei 4 ° C bis zur Verwendung.
HINWEIS: Für die Langzeitlagerung, eine dünne Schicht Nagellack entlang der Kante des the Deckglas, um die Folie vor dem Austrocknen zu verhindern.
- Verwenden Sie einen hydrophoben Stift, um die Gruppe von Abschnitten auf jeder Folie zu umkreisen. PBS in den eingekreisten Bereich (ca. 80 & mgr; l für eine kleine Fläche von bis zu 500 & mgr; l für eine große Oberfläche) vorsichtig fallen, darauf achten, daß das Gewebe zu berühren. Inkubieren für 5 min bei Raumtemperatur.
- Histologische Auswertung.
- Bild die Dias ein epifluoreszenten oder konfokalen Mikroskop mit geeigneten Filtern mit EMHC (rot) zu erfassen; ColVI (grün); und DAPI-gefärbten Zellkernen (blau), typischerweise ein 20x - Objektiv 1,5 verwendet wird .
- Bestätigen Sie, dass das Fluoreszenzsignal aus experimentellen Dias von der sekundären Steuerschieber unterschiedlich ist die Spezifität des EMHC und ColVI Erkennung 4 zu demonstrieren.
HINWEIS: EMHC positive regenerierende Fasern sollte sich von ca. 2 bis 7 Tage nach einer Muskelverletzung und variabel bei Mäusen mit Muskeldystrophie sichtbar sein. Collagen VI ist in der extrazellulären Matrix umgebenden Muskelfasern, Blutgefäße und Nerven und in den größeren Bindegewebsbündel von peri- und Epimysium. DAPI Kernfärbung ist nützlich Muskelfasern mit zentralen Kernen gegenüber peripheren Kerne Regeneration anzeigt Faser zu erkennen und das Vorhandensein von infiltrating Zellen. Nekrotische oder verletzten Fasern aufgrund Erkennung Fleck schwach von endogenem IgG mit dem Maus-IgG-Sekundärantikörpers kann, die die Fasern durch beschädigte Muskelmembranen eindringt. - Zur Quantifizierung der Regeneration nehmen überlappende Mikroskop Bilder mit jeder Fluoreszenzfilter über das gesamte Bild. Führen Sie die EMHC, ColVI und DAPI Bilder für jeden Standort und dann die Bilder ausrichten , um eine Karte des gesamten Abschnitts 1,5 rekonstruieren.
- Mit Analyse-Software, zählen die Anzahl der EMHC positive Fasern und die Gesamtzahl der Fasern letzten Regeneration zu berechnen (100 * (# EMHC + Fasern / # Gesamtfasern)). Außerdem zählen die Anzahl der zentral nukleierten Fasern aus der gesamten Fasern Regeneration über einen längeren Zeitraum (100 * (# CN + Fasern / # Gesamtfasern)) 1,5 zu messen.
Ergebnisse
Muscle Kryoschnittes RNA ist hoch in der Qualität und sorgt für eine ausreichende Ausbeute für die meisten Anwendungen
Die Analysen von sechzehn Skelettmuskel - RNA - Präparationen sind in Tabelle 1 unter Verwendung von 19,4 bis 41 mg gepoolten tibialis anterior (TA) Muskel von 8 Kontrollmäusen gezeigt. Sowohl linke (L) und rechten (R) TA Muskeln wurden in Regenerationsversuche vorbereitet mit 3 Tagen gesammelt Muskeln nach dem Längsintramuskuläre Injektion von 25 ul Kochsalzlösung oder 10 uM Cardio zu Muskelverletzung verursachen unter Verwendung von Verfahren berichtet , die zuvor 1. Wie in Tabelle 1 gezeigt, sind die A260 / 280 - Verhältnisse für die Muskel Kryoschnitt RNA typischerweise nahe bei 2 oder höher in diesen repräsentativen Proben. Als "reine" RNA - A260 zu haben gilt als / 280 von 2,0 und A260 / 280 von 1,8 bis 2,2, ist die Reinheit der Kryoschnittes RNA - Proben hervorragend 9. Die Gesamt-RNA Erholung war in der Regel over 10 & mgr; g pro Probe mit Ausbeuten von 0,18 bis mehr als 1 & mgr; g Gesamt-RNA pro mg Gewebe des Startens, ausreichend Material für die meisten nachgelagerten Anwendungen. Bemerkenswert ist, extrahiert RNA-Konzentration, Gesamt-RNA und RNA-Ausbeute pro mg Ausgangsgewebe von TA Muskeln 3 Tage post-toxin Verletzung war signifikant höher als aus mit Kochsalzlösung injiziert TAs. Dies legt nahe, dass es die Homogenisierung verbessert, wenn Muskelstruktur durch umfangreiche Verletzungen gestört ist und / oder dass es eine Zunahme der Gentranskription und / oder RNA-Stabilität in 3 Tage regenerierenden Muskel. Die Persistenz der RNA-Qualität wurde durch einfache 1x TAE / 1,5% Agarosegel-Elektrophorese von 1 ul Muskel Kryoschnitt RNA untersucht, nachdem Proben für 18 Monate bei -20 ° C gelagert wurden. Prominent 18S und 28S rRNA - Banden sind in den Proben noch offensichtlich hohe RNA - Qualität demonstriert, auch unter suboptimalen Lagerbedingungen (Abbildung 1A).
Muscle Kryoschnittes RNAunterstützt Downstream-Anwendungen
Ein Mikrogramm RNA pro gepoolt Kryoschnitt-Probe wurde mit DNase behandelt und revers transkribiert von oligo dT-Primern. Folgende RNase Behandlung betrug das Gesamtvolumen der revers transkribierten cDNA 30 & mgr; l. Einfach nicht quantitative PCR mit einem Überschuss Amplifikation wurde durchgeführt, um die Lebensfähigkeit der cDNA zu bestätigen. Myogenic regulatory factor 4 (MRF4), ein Transkriptionsfaktor mit Muskeldifferenzierung nach oben reguliert, wurde amplifiziert zuvor berichtet Maus unter Verwendung von Primern, spüren 5'-CTACATTGAGCGTCTACAGGACC und Antisense - 5'-CTGAAGACTGCTGGAGGCTG 10, von 2 ul - Vorlage unter Verwendung von Standard - PCR. Es war robust, spezifische Amplifikation des 234 bp MRF4 Fragment von links und rechts TA cDNA - Proben, aber RT- nicht (RNA enthalten, aber keine reverse Transkriptase), RT ddH 2 O (Reverse Transkription ohne RNA - Matrize) oder ddH 2 O PCR Kontrollen (1B).Die gleichen Proben wurden in dreifacher Ausführung für MRF4 und mOaz1 Referenzsteuerung 4 Quantifizierung mit relativen Verstärkung und passive Fluoreszenz Bezug auf Echtzeit - PCR - System ausgeführt werden . MRF4 wurde in der Toxin-injizierten rechten TA bei 0.097-facher ausgedrückt im Vergleich zur Kochsalzlösung injiziert links TA durch die ΔΔCt berechnet Methode 4. Dies ist vergleichbar mit früheren Berichten von niedrigen MRF4 Ausdruck 3 Tage nach dem Toxin Verletzungen durch einen Verlust von reifen Muskelfasern 11. Um die Konsistenz der Kryoschnitt RNAs für quantitative PCR vergleichen, wurden Ct-Werte für die mOaz1 Referenzgens verglichen. Von sechs Proben wurde mOaz1 Transkript mit einer durchschnittlichen Ct von 17,242 ± 1,483 sd nachgewiesen werden, während die durchschnittliche Ct 36,332 ± 3,61 sd in RT- Kontrollproben (n = 4). Die enge Gruppierung von mOaz1 Ct Signale über Proben legt nahe, dass RNA aus TA Muskel Kryoabschnitte isoliert führt wie erwartet in Downstream-RNA-Expression analysiert.
Die histologische Beurteilung benachbarter Kryoabschnitte.
Beispiele für indirekte Immunfluoreszenzfärbung von 7 um tibialis anterior Muskel Schnitte von littermate Kontrollmäusen 3 Tage nach der Toxin - Injektion werden regenerierende Fasern zu detektieren dargestellt (Abbildung 2). Beide Teile wurden aus Muskel gesammelt weniger als 150 um von der Region in einer Tiefe von 4,5 bis 4,6 mm von der proximalen Muskelfläche für RNA-Analyse verwendet werden. Embryonale Myosin schwere Kette (EMHC, rot) erkennt regenerierenden Fasern, Kollagen VI (ColVI, grün) werden die Muskelfasern und DAPI Flecken Kerne blau, nach Protokoll 4. Regionen mit konzentrierter Kern infiltrieren (blaues Signal) zeigen an Stellen von Toxin Verletzung , wie offensichtlich durch die Aktivierung von EMHC positive neu Muskelzellen zu regenerieren. Ganze Abschnitt Karten wie in diesem Beispiel werden für die Quantifizierung der Regeneration durch den Anteil der embryoni Berechnungc Myosin schwere Kette-exprimierenden Fasern (rot, neu regeneriert) oder zentral nukleierten Fasern wie zuvor 1 angegeben. Insbesondere ist es überraschend wenig Schaden in der TA Muskel in 2A. Obwohl es Unterschiede zwischen den Injektionen , ist typisch Toxin Injektionen betreffen einen viel größeren Anteil des Muskelraum 1, wie in 2B gezeigt. Daher schlägt diese histologische Analyse , dass das Toxin Verletzung in 2A minimal war und stellt ein wichtiges Instrument zur Genexpressionsdaten aus dem angrenzenden Muskel Kryoschnitt RNA Probe interpretieren. Wenn die gesamte Muskel für RNA-Präparation durch Standard-Schleifverfahren verwendet worden war, das unerwartet kleine Verletzung Bereich dieser Probe wäre es ein Ausreißer machen, die Downstream-Analysen Skew würde. Stattdessen aus dem gleichen Muskel ermöglicht, von den benachbarten Abschnitten des Ausmaß der Verletzung direkte Messung histologischen Quantifizierung Paarung. Dies ermöglicht die Verwendung von inclueine Mindestschadensschwelle Analysen treffen oder die Normalisierung der RNA-Analysen nach der Verletzung Größe sion / Ausschlusskriterien, um sicherzustellen, dass alle Proben in Downstream-RNA enthalten.

Abbildung 1: Qualitätsbeurteilung von RNA aus Pooled Muscle Cryoschnitte. A) 18S und 28S ribosomalen RNA - Banden sind prominente in RNA aus gepoolten Muskel Kryoschnitte 18 Monate nach der RNA - Präparation. B) Nicht-quantitative PCR für MRF4 folgende reverse Transkription. 200 und 300 bp Banden einer DNA-Leiter sind angegeben. RT-, reverse Transkriptionsreaktion mit RNA-Matrize, aber keine reverse Transkriptase. RT-H 2 O, reverse Transkription mit ddH 2 O, ohne RNA - Template. H 2 O, kein Template PCR - Steuerung mit ddH 2 O. In diesen Experimenten Toxin wurde in die rechte tibialis anterior injiziert (RTA) und Kochsalzlösung was injiziert in die linke (LTA). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 2: Beispiel Histologische Karten für die Muskelregeneration Studies. A, B) Zusammengestellt Karten einzelner M. tibialis anterior Abschnitte 3 Tage nach der Injektion Toxin Beispiele für schlecht (A) und normal (B) Toxin-induzierte Schädigung zeigt. Weiß boxed Regionen jedes Abschnitts Karte als Nebenbilder für höhere Vergrößerung betrachten, Rot, embryonale Myosin schwere Kette gezeigt; grün, Kollagen VI extrazelluläre Matrix-Protein; blau, DAPI Kernfärbung. Maßstabsbalken, 100 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
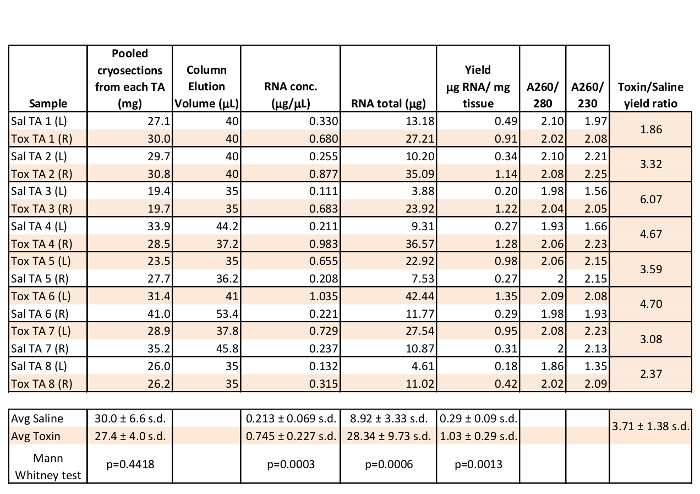
Tabelle 1: Repräsentative RNA Ausbeute und Reinheit Messungen von Pooled Muscle Kryoabschnitte. Sechzehn tibialis anterior (TA) Muskeln wurden geschnitten und gebündelt Kryoschnittes Proben wurden für die RNA verarbeitet. Gereinigte RNA (1 & mgr; l) wurde mit einer nanospectrophotometer analysiert. Spaltenstatistiken wurden in einer Tabelle durchgeführt, Gruppenvergleiche wurden mit Hilfe statistischer Software.
Diskussion
Um die besten Ergebnisse mit dieser Methode zu erreichen, halten Harz auf das untere Drittel beschränkt Einbetten oder die Hälfte des Muskels während der Kryokonservierung Gewebe, weil überschüssiges Harz wird die Sammlung der gepoolten Kryoabschnitte verlangsamen und erhöhen Harz Kontamination in der RNA-Isolierung eingebettet ist. Auch besondere Aufmerksamkeit während der Nadel Homogenisierung ist wichtig, die Ausbeute zu maximieren und die Wahrscheinlichkeit einer Verstopfung der Nadel zu minimieren. Das Protokoll kann durch die Verwendung eines Luer-Lok-Spritze modifiziert werden gegen Probenverlust zu schützen, wenn die Nadel blockiert wird und erfordert hohen Druck, um das verstopfungs zu entfernen. Eine zusätzliche Nadel Homogenisierungsschritt mit einer Gauge-Nadel 25 oder 26 auch eine feinere Gewebe Suspension weiter verbessert RNA-Ausbeute zu produzieren hinzugefügt werden. Während Chloroform BCP ersetzt werden könnte, ist dies nicht empfehlenswert , da BCP weniger toxisch und führt zu niedrigeren Niveaus der genomischen DNA - Kontamination in der wässrigen Phase während der organischen Extraktion der RNA 12. steigenddie Schnittdicke für gepoolte Kryoabschnitte über 30 & mgr; m wird auch nicht empfohlen, da die Homogenisierung weniger effizient sein wird.
Wenn RNA-Ausbeute unter gewünschten Niveaus ist, können verschiedene Strategien eingesetzt werden Genesung zu erhöhen, wie: i) Erhöhung der Milligramm Menge an Ausgangsmaterial möglich Ausbeute zu erhöhen; ii) Verringerung der Schnittdicke von weniger als 30 & mgr; m mechanische Homogenisierung des Gewebes zu verbessern; iii) Erhöhung der Dauer der Proben Inkubation und Nadel Homogenisierung in der organischen Extraktionsreagenz mechanischen und chemischen Gewebezerstörung zu verbessern; und iv) ob Gewebeklumpen bleiben, führen Sie einen zweiten Extraktionsschritt mit strengeren Nadel Homogenisierung. Alternativ kann es 13 gewebespezifischen Erwägungen wie beispielsweise zusätzliche Phasentrennung und Fällungsschritte für Proben mit hohem Proteoglykangehalt sein. Während der RNA Säulenreinigung kann eine größere Elutionsvolumen verwendet werden, und eine zweite Elution Durchführung kann maximize Gesamt-RNA Erholung, aber auf Kosten der RNA-Konzentration. Ein Post-column Alkoholfällung kann verwendet werden, um die RNA zu konzentrieren, wenn niedrige Konzentration ein Anliegen mit dieser Modifikation ist. Wenn RNA - Abbau ist ein Problem, Zeit Kryokonservierung beim Präparieren Verringerung rigorosere Reinigung von Kryostaten Oberflächen und Werkzeuge , um RNase Exposition zu minimieren, die Durchführung der Nadel Homogenisierungsschritt in einem kalten Raum, Zugabe eines RNase - Inhibitors Reagenzes zu den Kryoschnitten 14 und häufige Ersatz von RNase freien Lösungen kann jeder helfen Exposition gegenüber RNasen zu verhindern oder zu minimieren und Spaltungsaktivität zu reduzieren. Es ist möglich, dass das Gewebe in einem RNase-Inhibitor-Reagenz nach der Sektion kurz gebadet, aber vor der Kryokonservierung, können weitere Probenabbau zu reduzieren. Jedoch sollte Vorversuche durchgeführt werden, um sicherzustellen, dass eine solche Behandlung nicht Eiskristalle oder andere Artefakte während der Kryokonservierung nicht erhöht.
während embryonaleMyosin schwere Kette / Kollagen-VI indirekte Immunfluoreszenz für Muskelanalyse Verletzungs hier als ein Beispiel verwendet wird, dünne Kryoabschnitte auf Mikroskop montiert Folien aus diesen Experimenten kann für jede relevante histologische Fleck verwendet werden, die auf Gefrierschnitten durchgeführt werden können, einschließlich Immunofluoreszenz-Techniken mit Post -Fixierung und Hämatoxylin / Eosin-Färbung. Tatsächlich Anpassungen an die einfachen Immunofluoreszenz-Protokoll hier kann erforderlich sein, zur Verfügung gestellt. Zum Beispiel verwendet anti-Maus - Sekundärantikörper eine Maus primären Antikörper nachzuweisen (zB EMHC) können auch endogene Maus - Immunglobuline in dem Zielgewebe zu erfassen. Eine solche endogenen Antikörper akkumulieren typischerweise in beschädigten oder nekrotischen Muskelfasern in verletzten oder dystrophischen Muskel Hintergrund Immunfluoreszenzanfärbung verursacht. Eine Sekundärsteuerschieber (mit dem primären Antikörper weggelassen) sollte immer die Spezifität der Färbung zu beurteilen, untersucht werden. Wenn endogene Antikörper Hintergrund problematisch ist, sollte vor der Blockstufen seindem Protokoll hinzugefügt zu verhindern oder zu minimieren Nachweis von endogenem Maus - Immunglobulinen 15.
Die wichtigsten Einschränkungen des Verfahrens sind, dass sie einen Kryostaten erfordert, und es ist zeitraubend, was es relativ geringen Durchsatz ermöglicht. Zum Beispiel konnte ein Experte in der Technik zu 16 Muskeln für gepoolte Kryoabschnitte und Mikroskop-Objektträger (8 Dias mit doppelten Abschnitten aller 16 Gewebe) zu verarbeiten in ca. 9 bis 10 Stunden. Für Anfänger Sammlung von gepoolten Kryoabschnitte von 2 bis 4 Proben maßen nach Kryostaten Ausbildung Kryoschneiden, gemeistert werden konnte, und ein oder zwei Trainingssitzungen statt, die Gewinnung eines Qualitäts Kryoabschnitte für die Histologie mehr Erfahrung haben. Daher Ausrüstung, Zeit oder Training Faktoren können diese Methode machen weniger für weichere Gewebe nützlich, die gut homogenisiert mit einem manuellen Pistill Homogenisator sein kann.
Im Vergleich mit nicht-Kryostaten Homogenisieren Methoden, Skelettmuskel-RNA-Präparations wurden aus Muskelbiopsien mit RNA - Ausbeuten von 0,05 bis 0,7 & mgr; g RNA pre mg Muskel 16 und, in jüngerer Zeit von 0,27 bis 1,08 & mgr; g RNA pro mg Muskel 17 berichtet. Daher beschriebene Technik bietet hier RNA Ausbeuten so gut wie oder besser als nicht-Kryostaten Verfahren mit dem zusätzlichen Vorteil, dass gepaarte histologische Analysen aus einem zusammenhängenden Bereich derselben Probe. Bemerkenswert ist , verwendet eine frühere Studie auch zur Homogenisierung in Wirbelgewebe Kryoschneiden und in ähnlicher Weise festgestellt , dass Kryoschneiden Gewebe 13 für die RNA - Isolierung Homogenisierung Effizienz verbessert. Wenn diese Technik in Rinder-Skelettmuskel - Proben getestet wurde, betrug die durchschnittliche RNA - Ausbeute pro Probenvorbereitung 4,09 ± 0,36 ug, am unteren Ende des hier 13 berichtet normalen Bereich. Laser Mikrodissektion ist eine weitere Alternative für die Entnahme von Gewebe für die RNA-Extraktion aus einer Kryoschnittes. Laser Capture überlegen ist dieser gepoolten Kryoschnittes Verfahren indass es die Spezifität nur eine gewünschte Teilmenge von Zellen , die aus dem Abschnitt zu sammeln können , und es kann bis zu 50 & mgr; m dicke 18 auf einem einzigen Gewebeschnitt durchgeführt werden. Jedoch Sammlung eines Mikro seziert Probe kann schwierig und geeignete Ausrüstung sein, ist nicht weit verbreitet, gepoolten Kryoschnitt Homogenisierung zugänglicher Forscher machen. Wenn beide Methoden zur Verfügung stehen, um eine Präferenz eines Gewebe Subregion für eine Anwendung nur kleine RNA-Mengen benötigen, analysieren würde die Laser Mikrodissektion während gepoolten Kryoschnittes Homogenisierung ist am besten Gefallen, wenn Subregion Analyse weniger wichtig ist und höhere Mengen an RNA benötigt werden.
Während histologische und RNA-Isolierung Methoden der Fokus hier sind, wird die gepoolten Kryoschnittes Verfahren leicht Proteinlysaten vorzubereiten angepasst für Western-Blot-Analysen oder Messungen der Enzymaktivität. Zum Beispiel gepoolt Kryoabschnitte aus dem Herz für Western - Blot - löslich gemacht wurden analysiert 4 and gepoolt Kryoabschnitte aus dem TA wurden für Succinat - Dehydrogenase - Aktivität Assays der mitochondrialen Funktion 5 homogenisiert. Alternativ kann genomische DNA und Proteinfraktionen aus anderen Phasen während der organischen Extraktion nach RNA Isolation getrennt werden, was das Potential bieten genomische DNA ableiten, Protein, RNA, und histologische Messungen von einem einzelnen Gewebe nach einer einzigen Kryostaten Sitzung.
Insgesamt ist der Hauptvorteil dieses Verfahrens experimentelle Flexibilität zu erhöhen, indem mehrere analytische Ansätze ermöglicht, unterschiedliche Probenvorbereitung aus einem einzelnen Gewebe erfordern. Das Verfahren ist am besten geeignet für Muskeln und anderen Geweben mit umfangreichen intra- oder extrazelluläre Struktur, die die Effizienz der Pistill Basis Gewebehomogenisierung reduziert.
Offenlegungen
The author declares that she has no competing financial interests.
Danksagungen
Madison Grant, Steven Foltz, Halie Zastre and Junna Luan provided technical assistance. Research reported in this publication was supported by the National Institute of Arthritis and Musculoskeletal and Skin Diseases of the National Institutes of Health under award number AR065077. The content is solely the responsibility of the author and does not necessarily represent the official views of the National Institutes of Health.
Materialien
| Name | Company | Catalog Number | Comments |
| Cork | VWR Scientific | 23420-708 | Cut into small squares with a sharp blade. |
| Plastic coverslip | Fisher Scientific | 12-547 | Used to orient the muscle during freezing. |
| Low temperature thermometer | VWR Scientific | 89370-158 | |
| 2-methylbutane | Sigma | M32631-4L | Caution: hazardous chemical. Store in flammable cabinet. |
| Embedding resin: "cryomatrix" | Thermo Fisher Scientific | 6769006 | Other embedding resins can be substituted for cryomatrix. |
| Cryostat | Thermo Fisher Scientific | microm HM550 with disposable blade carrier | Any working cryostat should be sufficient for the protocol. |
| Disposable cryostat blade | Thermo Fisher Scientific | 3052835 | Use an appropriate blade or knife for the cryostat to be used. |
| RNAse decontamination solution: "RNase Zap" | Thermo Fisher Scientific | AM9780 | |
| Analytical balance | Mettler Toledo | XS64 | |
| Paint brush | Daler Rowney | 214900920 | Use to handle cryosections. Can be found with in stores with simple art supplies. |
| Razor blade | VWR Scientific | 55411-050 | |
| Microscope slide | VWR Scientific | 48311600 | |
| RNA organic extraction reagent: TRIzol | Thermo Fisher Scientific | 15596026 | Caution: TRIzol is a hazardous chemical. Note: Only organic extraction reagents are recommended for RNA extraction from skeletal muscle. |
| 18 gauge needle | VWR Scientific | BD305185 | |
| 22 gauge needle | VWR Scientific | BD305155 | |
| 26 gauge needle | VWR Scientific | BD305115 | Optional. Can be used for a third round of sample trituration in the RNA extraction protocol. |
| 1 ml syringe | VWR Scientific | BD309659 | For very high value samples, a Luer-Lok syringe is recommended (e.g., VWR BD309628). |
| 1-bromo-3-chloropentane (BCP) | Sigma | B9673 | |
| For 70% ethanol in DEPC water: 200 proof alcohol | Decon Laboratories, Inc. | +M18027161M | Mix 35 ml 200 proof alcohol + 15 ml DEPC water. |
| For 70% ethanol in DEPC water: DEPC-treated water | Thermo Fisher Scientific | AM9922 | Mix 35 ml 200 proof alcohol + 15 ml DEPC water. |
| RNA purification kit: PureLink RNA minikit | Thermo Fisher Scientific | 12183018A | Final steps of RNA preparation. |
| DNase/Rnase-free water | Gibco | 10977 | DEPC-treated water can also be used. |
| Spectrophotometer: Nanodrop 2000 | Thermo Fisher Scientific | NanoDrop 2000 | |
| Dnase I | Thermo Fisher Scientific | AM2222 | Treat purified RNA to remove any DNA contamination before downstream appications. |
| Hydrophobic pen | Thermo Fisher Scientific | 8899 | |
| Dulbecco's PBS | Gibco | 14190 | PBS for immunofluorescence protocol. |
| Donkey serum | Jackson ImmunoResearch Laoratories, Inc | 017-000-121 | Rehydrate normal donkey serum stock according to the manufacturer's instructions, then dilute an aliquot to 5% for immunofluorescence. Normal goat serum can also be used. |
| eMHC antibody | University of Iowa Developmental Studies Hybridoma Bank | F1.652 | |
| Collagen VI antibody | Fitzgerald Industries | #70R-CR009x | |
| Donkey anti-rabbit AlexaFluor488 | Thermo Fisher Scientific | A21206 | |
| Goat anti-mouse IgG1 AlexaFluor546 | Thermo Fisher Scientific | A21123 | |
| DAPI (4',6-diamidino-2-phenylindole) | Thermo Fisher Scientific | D1306 | |
| Aqueous mounting media: Permafluor | Thermo Fisher Scientific | TA-030-FM | Only use mounting media designed for fluorescent applications with anti-fade properties. |
| Glass coverslip | VWR Scientific | 16004-314 | Use for mounting slides at the end of immunofluorescence protocl |
| Image analysis software: ImageProExpress | Media Cybernetics, Inc. | Image-Pro Express, or more advanced products | Freeware ImageJ should also work for manual counting. More advanced software with segmentation abiities may allow partial automation of the process; e.g., ImageProPremier. |
| Merge and map section images: Photoshop | Adobe | Photoshop | |
| Cardiotoxin | Sigma | C9659 | Sigma C9659 has been discontinued. Other options for cardiotoxin are EMD Millipore #217503; American Custom Chemicals Corp. # BIO0000618; or Ge Script # RP17303; but these have not been validated. |
| reverse transcription kit: Superscript III First-strand synthesis system | Thermo Fisher Scientific | 18080051 | Any validated, high quality reverse transcription reagents can be used. |
| Standard PCR: GoTaq Flexi polymerase system | Promega | M8298 | Any validated, high quality Taq polymerase system can be used. If DNA sequencing is to be used for any application downstream of the PCR, then a high fidelity PCR system should be used instead. |
| SYBR green | Thermo Fisher Scientific | S7585 | For use in qPCR when not using a dedicated qPCR master mix. Use with SuperROX (for Applied Biosystems instruments) and GoTaq Flexi polymerase and buffers. |
| ROX: SuperROX, 15 mM | BioResearch Technologies, Inc. Novato CA | SR-1000-10 | SuperROX is more stable in the PCR reaction, so it is preferred for use as a qPCR passive reference dye over ROX (carboxy-X-rhodamine). For qPCR with Applied Biosystems instruments |
| Real-time PCR | Applied Biosystems | 7900HT |
Referenzen
- Foltz, S. J., et al. Abnormal skeletal muscle regeneration plus mild alterations in mature fiber type specification in Fktn-Deficient Dystroglycanopathy Muscular Dystrophy Mice. PLoS One. 11 (1), 0147049 (2016).
- Bartoli, M., et al. Noninvasive monitoring of therapeutic gene transfer in animal models of muscular dystrophies. Gene Ther. 13, 20-28 (2006).
- Ip, W. T., Huggins, C. E., Pepe, S., Delbridge, L. M. Evaluating RNA preparation options for archived myocardial biopsies. Heart Lung Circ. 20 (5), 329-331 (2011).
- Beedle, A. M., et al. Mouse fukutin deletion impairs dystroglycan processing and recapitulates muscular dystrophy. J. Clin. Invest. 122 (9), 3330-3342 (2012).
- Foltz, S. J., et al. Four-week rapamycin treatment improves muscular dystrophy in a fukutin-deficient mouse model of dystroglycanopathy. Skeletal Muscle. 6, 20 (2016).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nat. Protoc. 10, 1612-1624 (2015).
- Rump, L. V., Asamoah, B., Gonzalez-Escalona, N. Comparison of commercial RNA extraction kits for preparation of DNA-free total RNA from Salmonella cells. BMC Res. Notes. 3, 211 (2010).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. J. Vis. Exp. (45), e2565 (2010).
- Valdez, M. R., Richardson, J. A., Klein, W. H., Olson, E. N. Failure of Myf5 to support myogenic differentiation without myogenin, MyoD, and MRF4. Dev Biol. 219 (2), 287-298 (2000).
- Pavlath, G. K., Dominov, J. A., Kegley, K. M., Miller, J. B. Regeneration of transgenic skeletal muscles with altered timing of expression of the basic helix-loop-helix muscle regulatory factor MRF4. Am. J. Pathol. 162 (5), 1685-1691 (2003).
- Chomczynski, P., Mackey, K. Substitution of chloroform by bromo-chloropropane in the single-step method of RNA isolation. Anal. Biochem. 225 (1), 163-164 (1995).
- Lee, J. T. Y., Cheung, K. M. C., Leung, V. Y. L. Extraction of RNA from tough tissues with high proteoglycan content by cryosection, second phase separation and high salt precipitation. J. Biol. Methods. 2 (2), 20 (2015).
- Guo, D., Catchpoole, D. R. Isolation of intact RNA following cryosections of archived frozen tissue. BioTechniques. 34, 48-50 (2003).
- Goodpaster, T., Randolph-Habecker, J. A flexible mouse-on-mouse immunohistochemical staining technique adaptable to biotin-free reagents, immunofluorescence, and multiple antibody staining. J. Histochem. Cytochem. 62 (3), 197-204 (2014).
- Ikezawa, M., Minami, N., Takahashi, M., Goto, Y., Miike, T., Nonaka, I. Dystrophin gene analysis of 130 patients with Duchenne muscular dystrophy with a special reference to muscle mRNA analysis. Brain Dev. 20 (3), 165-168 (1998).
- Majumdar, G., Vera, S., Elam, M. B., Raghow, R. A streamlined protocol for extracting RNA and genomic DNA from archived human blood and muscle. Anal. Biochem. 474, 25-27 (2015).
- Espina, V., Heiby, M., Pieroban, M., Liotta, L. A. Laser capture microdissection technology. Expert Rev Mol Diagnostics. 7 (5), 647-657 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten