Method Article
Criosezionamento di regioni contigue di un muscolo scheletrico mouse unico per l'espressione genica e analisi istologiche
In questo articolo
Riepilogo
Consecutivi crio-sezioni sono raccolti per consentire alle applicazioni istologiche e l'arricchimento di RNA per misure di espressione genica utilizzando zone adiacenti da un muscolo scheletrico singolo mouse. RNA di alta qualità si ottiene da 20 - 30 mg di criosezioni e le misure messe in comune sono direttamente confrontato tra le applicazioni.
Abstract
Con questo metodo, criosezioni consecutivi sono raccolti per permettere alle applicazioni di microscopia per istologia dei tessuti e l'arricchimento di RNA per l'espressione genica utilizzando zone adiacenti da un muscolo scheletrico singolo mouse. In genere, è difficile da ottenere una adeguata omogeneizzazione dei piccoli campioni del muscolo scheletrico a causa volumi buffer può essere troppo bassa per le applicazioni di macinazione efficiente, ma senza sufficiente rottura meccanica, l'architettura del tessuto denso di limiti muscolari penetrazione dei reagenti tampone, in ultima analisi, causando bassa resa di RNA. Seguendo il protocollo qui riportato, 30 sezioni micron sono raccolti ed aggregati permettendo criosezionamento e successiva omogeneizzazione ago per interrompere meccanicamente il muscolo, aumentando l'area superficiale esposta per la penetrazione buffer. I limiti principali della tecnica sono che richiede un criostato, ed è relativamente ridotto. Tuttavia, RNA di alta qualità può essere ottenuto da piccoli campioni di m poolcriosezioni uscle, rendendo questo metodo accessibile per molti muscoli scheletrici diversi e altri tessuti. Analisi Inoltre, questa tecnica permette abbinato (ad esempio, istopatologia tessuto e di espressione genica) dalle regioni adiacenti di un singolo muscolo scheletrico in modo che le misurazioni sono direttamente confrontabili tra applicazioni per ridurre l'incertezza sperimentale e per ridurre gli esperimenti su animali replicativi necessario fonte un piccolo tessuto per la applicazioni multiple.
Introduzione
L'obiettivo di questa tecnica è quello di rendere più analisi sperimentali diverse modalità, quali l'espressione genica e istologia, accessibili da un unico piccolo tessuto d'origine muscolo scheletrico. applicazioni Microscopia sono più sensibili al campione metodi di conservazione, che devono essere controllati con attenzione per limitare la formazione di manufatti cristalli di ghiaccio durante crioconservazione. Pertanto, lo sviluppo del metodo si basa sulla tibiale anteriore (TA) muscolare congelati parzialmente coperto di incorporamento di resina in un raffreddato con azoto liquido vasca 2-metilbutano -140 ° C come materiale sorgente per immunofluorescenza e analisi dell'espressione genica.
La necessità di utilizzare lo stesso materiale di base per diversi approcci tecnici è particolarmente importante per gli esperimenti di iniezione a base intramuscolare cui i muscoli a destra e sinistra rappresentano differenti condizioni, una sperimentale e uno di controllo. Ad esempio, in studi di rigenerazione muscolare, uno muSCLE viene iniettato con una tossina provocare danni ai tessuti diffusa mentre il muscolo controlaterale serve come un controllo del veicolo iniettato 1. Analogamente, studi di terapia genica per disturbi muscolari tipicamente iniziano con la convalida del vettore terapia genica mediante iniezione intramuscolare da confrontare con vettore vuoto, vector estranei o controllo del veicolo sul lato controlaterale 2. Pertanto, non è possibile reperire ogni muscolo TA a un'altra applicazione.
Le strategie comuni per affrontare questo problema sono i seguenti: i) per utilizzare un gruppo muscolare diverso per ogni applicazione, ii) di utilizzare topi aggiuntivi, o iii) per tagliare un pezzo di muscolo per ogni applicazione. Tuttavia, le differenze sostanziali tra i gruppi muscolari rendono difficile il confronto dei dati da applicazioni separate, e altri animali aumentano spese e sono scarsamente giustificata se esistono altre alternative. Dividendo il muscolo dopo la dissezione di procurarsi diverse applicazioni è il migliore che l'opzionen molti casi. Tuttavia, i pezzi muscolari sono spesso troppo piccole per utilizzare polverizzazione sotto azoto liquido o tecniche di macinazione meccanica per omogeneizzazione 2-5. Come il muscolo è un tessuto altamente strutturale ricco di proteine della matrice extracellulare e contrattili, inadeguata omogeneizzazione meccanica porta ad una bassa resa di successive DNA, RNA o proteine. Il metodo descritto qui consente di piccole quantità di tessuto da un muscolo fonte per l'utilizzo in diverse applicazioni, e l'inclusione di criosezionamento e l'ago triturazione migliora omogeneizzazione meccanica per una migliore resa RNA.
Protocollo
Tutte le procedure di animali sono state approvate dalla Università della Georgia Istituzionale cura degli animali e del Comitato uso in condizioni di utilizzo degli animali protocollo A2013 07-016 (Beda).
1. La crioconservazione di non fissato muscolo scheletrico
- Preparazione
- Tagliare il sughero in piccoli quadrati (circa 1 cm x 1 cm) con una lama di rasoio, scrivere sul sughero con un pennarello punta fine che è resistente alla 2-metilbutano per identificare il mouse sorgente e muscolare, e fare un taglio molto bassa (circa 1mm) sulla superficie superiore. Inserire un vetrino di plastica nel taglio da utilizzare per orientare il tessuto. Ripetere fino a quando un tappo di sughero è pronto per ogni tessuto per essere crioconservati.
- Ottenere azoto liquido, 2-metilbutano, resina embedding, termometro a bassa temperatura, tappi, strumenti di dissezione e mouse studio.
ATTENZIONE: Liquido di azoto è un gas compresso che può esplodere se riscaldato. Indossare un camice da laboratorio, guanti a bassa temperatura, e la faccia durante la manipolazione del liquido niTrogen; contatto con la pelle o con gli occhi può provocare ustioni o congelamento. 2-metilbutano è un pericolo per l'ambiente infiammabile, tossico, salute e. Indossare dispositivi di protezione individuale (camice, guanti, occhiali di sicurezza), aprire il contenitore magazzino in una cappa aspirante, trasferire la piccola quantità necessaria per il congelamento (in genere da 200 a 400 ml) per un contenitore separato che può essere ben chiuso, e di evitare l'inalazione . - Euthanize topi con un metodo approvato dell'eutanasia sotto anestesia. In breve, inserire il mouse in una camera di inalazione con il 2,5% isoflurano in ossigeno da un vaporizzatore isoflurano, attendere 20 secondi dopo il mouse smette di muoversi per verificare la presenza di un riflesso del pedale. Quando il riflesso pedale è negativo, eutanasia il mouse studio per dislocazione cervicale 6.
NOTA: metodi di eutanasia richiedono l'approvazione da parte del comitato etico istituzionale. - Togliere la pelle sovrastante il hindlimb distale e tagliare i tendini anteriori distali appena sopra la caviglia, con punta fine Disseforbici ction. Afferrare i tendini distali con una pinza sottile e delicatamente tirare su e verso il ginocchio, mentre il taglio fascia laterale per rilasciare la muscolatura. Estrarre il muscolo fuori perpendicolarmente dal ginocchio e fare un taglio finale di asportare il muscolo TA 7.
NOTA: Il muscolo TA viene qui utilizzato come esempio, ma qualsiasi mouse muscolo scheletrico o cuore può essere sostituito per il TA in questo protocollo, se opportuno obiettivi sperimentali dell'utente. L'unica limitazione è che un tessuto deve essere abbastanza piccolo per ottenere crioconservazione rapida tutta la sua profondità; Si consiglia una dimensione massima del tessuto cm 1 x 1 cm. - Ripetere sulla gamba opposta, e sezionare eventuali altri tessuti da incassare. Eseguire dissezione più rapidamente possibile limitare la degradazione dei tessuti prima crioconservazione.
- Orient ogni muscolo per le sezioni trasversali sul suo sughero pre-etichettati. Basamento muscolo perpendicolare al sughero con il tendine distale toccare il tappo e la parte superiore della ext muscolarefinendo via, tenuto in posizione verticale dal vetrino.
- Cryopreserve tutti i tessuti per l'analisi istologica appena possibile dopo la dissezione, preferibilmente entro 5 minuti, ma sicuramente non più di 15 min tempo trascorso dalla euthanization dell'animale sorgente.
- Crioconservazione
- Iniziare il raffreddamento del bagno di crioconservazione cinque minuti prima della fine della dissezione. Versare 2-metilbutano in un becher metallo aperto ad una profondità di circa 3 cm. Versare azoto liquido in un contenitore isolato ad una profondità di 2 a 4 cm. Impostare il becher di 2-metilbutano in azoto liquido; l'azoto inizierà a bollire. Evitare gli schizzi di azoto nel bicchiere 2-metilbutano.
ATTENZIONE: Preparare il congelamento bagno in una cappa o un luogo ben ventilato. - Inserire un termometro a bassa temperatura in-2 metilbutano per monitorare la temperatura e mescolate spesso con una forchetta per garantire anche il raffreddamento. Continuare a mescolare e raffreddare fino a 2 methylbutane raggiunge -140 ° C, aggiungendo nuovi azoto liquido alla vasca esterna secondo necessità.
NOTA: -140 ° C è la temperatura ottimale per ridurre al minimo gli artefatti di cristalli di ghiaccio nel muscolo striato; altri tessuti possono cryopreserve migliore a diverse temperature (ad esempio, il cervello, -90 ° C). - Applicare resina incorporamento solo ai minori 35 - 50% del muscolo dove incontra il sughero e immediatamente cadere il tappo nella 2-metilbutano a -140 ° C. Rapidamente ripetere per un massimo di 8 tessuti per congelare batch. Agitare per 30 secondi, raschiando il fondo del recipiente per assicurare che i tessuti non congelano in solidificazione 2-metilbutano.
- Utilizzare una forchetta, cucchiaio fessurato o grandi pinze per tirare ogni tappo tessuto dal 2-metilbutano. rimuovere rapidamente il vetrino, tamponare l'eccesso di 2-metilbutano nel bicchiere, e poi cadere il tappo tessuto nel bagno di azoto esterno. Ripetere l'operazione per tutti i tappi rimanenti nel bicchiere.
- campioni di trasferimento in azoto liquido o in ghiaccio secco a-80 ° C per una conservazione.
- Se i tessuti rimangono per la crioconservazione, ripetere i passaggi da 1.2.3 a 1.2.4. Aggiungere ulteriore 2-metilbutano al bicchiere o azoto liquido per il bagno esterno, se necessario, e ri-cool a -140 ° C. Smaltire usato 2-metilbutano come rifiuti pericolosi.
- Iniziare il raffreddamento del bagno di crioconservazione cinque minuti prima della fine della dissezione. Versare 2-metilbutano in un becher metallo aperto ad una profondità di circa 3 cm. Versare azoto liquido in un contenitore isolato ad una profondità di 2 a 4 cm. Impostare il becher di 2-metilbutano in azoto liquido; l'azoto inizierà a bollire. Evitare gli schizzi di azoto nel bicchiere 2-metilbutano.
2. Raccogliere criosezioni per l'istologia e RNA Applicazioni
- Preparazione.
- Pre-pesare un tubo autoclavato DNasi / RNasi libero-su una bilancia analitica. Poi, spostarlo nella camera criostato a preraffreddare. Ripetere fino a quando i tubi sono pronti per tutti i campioni cryosection in pool da raccogliere.
- Per sezionamento muscolo scheletrico, verificare che la temperatura della camera criostato è -21 a -22 ° C dal suo termostato interno. Trasferire i contenitori con i tessuti da tagliare nella camera e consentire al contenitore (s) raggiunga la temperatura criostato per almeno 15 minuti prima dell'apertura.
- Inserire una nuova lama criostato usa e getta. In alternativa, rimuovere la lama esistente, spruzzare con la soluzione di decontaminazione RNasi, sciacquare con DDH 2 O, e reinserire nel criostato a raffreddare. Spruzzare un panno pulito con il 70% di etanolo e pulire accuratamente la piattaforma di bloccaggio della lama e la lama.
- Spruzzare un panno pulito con una soluzione di decontaminazione RNasi e pulire pennelli criostato. Spruzzare un tessuto con DDH 2 O, pulire di nuovo le spazzole e metterli nella camera criostato su una superficie pulita.
ATTENZIONE: La lama criostato dovrebbe essere coperto dalla guardia coltello quando non in uso. Inoltre, soluzione decontaminante RNasi è tossico e si blocca per formare un precipitato nella camera criostato fredda. Pertanto, maneggiare con cura ed evitare il suo uso nella camera criostato.
- Spruzzare un panno pulito con una soluzione di decontaminazione RNasi e pulire pennelli criostato. Spruzzare un tessuto con DDH 2 O, pulire di nuovo le spazzole e metterli nella camera criostato su una superficie pulita.
- All'interno della camera criostato, mettere un monetina dimensioni goccia (circa 300 ml) di incorporare in resina su un mandrino esemplare caldo, impostare un tappo di sughero di tessuto sulla parte superiore della resina, premere verso il basso, e quindi impostare il mandrino in freezing treno o su un elemento di congelamento rapido, se disponibile.
- Dopo l'incorporamento solidifica resina (bianco), aggiungere resina embedding aggiuntivo sulla parte superiore del tappo, intorno al 35% più basso del tessuto e premere l'estrattore di calore nella resina embedding di congelamento rapido per stabilizzare meglio il tessuto. Attendere 5 min prima di sezionamento per permettere alla resina di indurire completamente.
- Assicurarsi che il morsetto portacampione è nella sua posizione più arretrata, più lontana dalla lama. Inserire il mandrino tessuto provino nel morsetto campione.
- preparazione Cryosection.
- Allentare il supporto portante della lama, impostare l'angolo di spoglia della lama di 10 ° (o un angolo appropriato per il vettore lama usata), e serrare nuovamente. Rilasciare il freno e ruotare il volantino per abbassare il muscolo verso la lama. Stimare la distanza minima tra il tessuto e la lama, quindi spostare il tessuto lontano dalla lama e inserire il freno di volantino.
- Allentare la leve di regolazione dell'altezzar e spostare il portalama in avanti o indietro, rispettivamente se la fine del tessuto è superiore a circa 2 mm dalla lama o se la lama colpisce il tessuto. Serrare e abbassare nuovamente il tessuto per controllare la distanza dalla lama. Ripetere regolazioni fino a quando la lama è da 1 a 2 mm dall'estremità del tessuto dalla stima visiva.
- Abbassare il tessuto verso la lama e valutare l'angolo di tessuto per sezioni trasversali. Bloccare il volantino e rilasciare la leva di bloccaggio del campione. Premere il morsetto portacampione sinistra oa destra fino l'orientamento orizzontale del tessuto è perpendicolare alla lama.
- Spingere il campione Fissare su o giù per regolare l'orientamento "y" in modo che le sezioni di tessuto saranno perpendicolari all'asse lungo del muscolo. Stringere la leva di bloccaggio del campione.
- Utilizzare il corso e flusso fine in avanti per far avanzare il campione fino a quando non tocca appena la lama. Se cerca di sezioni da una particolare profondità dei tessuti, reimpostare la somma di sezione spessori a zero (superiore del tessuto).
- Impostare il criostato alla funzione di assetto con spessore di sezione a 30 micron. Tagliare ed eliminare sezioni fino a raggiungere la profondità prescelta per la raccolta del tessuto (ad esempio, 400 micron dall'alto).
- Raccogliere criosezioni per l'estrazione di RNA.
- Aprire il tubo per le sezioni che raccolgono e posizionarlo vicino al vettore lama. Utilizzare un pennello pre-raffreddata pulito per prelevare ciascuna sezione come è tagliato dalla lama e trasferire il cryosection nel tubo. Ripetere fino a quando le sezioni pool pesano 30 mg o viene raggiunta la profondità del tessuto desiderato.
NOTA: Per un tibiale anteriore topo adulto, raccolta dalla profondità del tessuto di circa 400 a 4.000 micron produce tipicamente 25 - 40 mg. Utilizzando pinze metalliche per trasferire le sezioni di tubo di raccolta non è raccomandato come sezioni tendono ad attaccarsi e ciuffo sulla superficie del metallo. - Se embedding resina circonda la cryosection muscolare, bloccare il freno a mano e utilizzare una lama di rasoio perradere pezzetti di resina fino vi è solo uno strato sottile intorno alla parte superiore del muscolo. resina tagliare sempre con la lama inclinata lontano dal muscolo.
NOTA: un sottile strato di resina embedding non alterare sensibilmente la preparazione di RNA a valle. Se è presente più spesso in resina embedding, usare i pennelli per prendere in giro via dal muscolo prima di spostare il cryosection nel tubo di raccolta. - In alternativa, piscina sezioni sul supporto della lama e il trasferimento in massa al tubo di raccolta.
NOTA: Tuttavia, questo metodo tende ad essere più lento, e le sezioni sono più propensi a bastone e raggrupparsi, che può ridurre l'efficienza della ago omogeneizzazione nei passaggi successivi. - posizionare rapidamente il tubo cryosection pool in un equilibrio e il tubo di registrare il peso analitico. restituire immediatamente la provetta alla camera criostato fredda per mantenere la temperatura sezione vicino -20 ° C. Calcolare il peso delle sezioni pool.
NOTA: Se l'isolamento di RNA avverrà annunciogiorno ifferent, memorizzare il tubo cryosection pool a -80 ° C fino al momento dell'uso.
- Aprire il tubo per le sezioni che raccolgono e posizionarlo vicino al vettore lama. Utilizzare un pennello pre-raffreddata pulito per prelevare ciascuna sezione come è tagliato dalla lama e trasferire il cryosection nel tubo. Ripetere fino a quando le sezioni pool pesano 30 mg o viene raggiunta la profondità del tessuto desiderato.
- Raccogliere criosezioni per istologia.
- Premere il pulsante di spessore della sezione per il sezionamento e utilizzare le frecce sottili per impostare lo spessore della sezione criostato a 7 micron (o altro spessore di sezione appropriata, in genere da 6 a 10 micron).
NOTA: Diluente sezioni (da 6 a 10 micron) devono essere utilizzati per applicazioni istologiche per garantire che i reagenti di colorazione può penetrare la profondità della sezione di tessuto. Le sezioni sottili possono essere prelevati da qualsiasi profondità durante il criosezionamento, ma le sezioni più profonde sono da preferire perché embedding resina, che aumenta con la profondità dei tessuti, non compromette colorazione istologica. - Tagliare e gettare da 4 a 7 sezioni per ottenere una superficie uniforme, tessuto. Prendere nota della profondità dei tessuti.
- Tagliare una sezione e orientarla sulla superficie del supporto della lama. Raccogliete la sezione in fretta e delicatamente toccando un ambiente caldo (temperatura ambiente) vetrino da microscopiola sezione sul supporto lama. Riportare il vetrino a temperatura ambiente. Continuare fino ad ottenere il numero di diapositive prescelte. Prendere nota della profondità del tessuto finale.
NOTA: Raccolta una seconda sezione (duplicato) per ogni tessuto è raccomandato. - Con sezionamento completo, azionare il freno volantino, restituire l'esemplare in posizione posteriore-più, e rimuovere il mandrino tessuti. Utilizzare l'elemento di calore criostato per sciogliere la resina embedding tenendo il tappo di sughero tessuto sul mandrino campione. Rimuovere sughero tessuto, asciugare con il tessuto, e tornare allo stoccaggio.
- Ripetere dal punto 2.1.2 per ciascun tessuto rimanente. Lasciare i vetrini si asciughino per 20 minuti dopo l'ultimo tessuto viene montato. Quindi, utilizzare diapositive per istologica o immunofluorescenza colorazione o congelamento a -80 ° C in una scatola di scorrimento fino a quando necessario.
- Premere il pulsante di spessore della sezione per il sezionamento e utilizzare le frecce sottili per impostare lo spessore della sezione criostato a 7 micron (o altro spessore di sezione appropriata, in genere da 6 a 10 micron).
3. Isolamento di RNA da Pooled criosezioni
- estrazione di RNA
- tubo Move (s) di criosezioni pool di ghiaccio. Aggiungere immediatamente unorganico reattivo estrazione di RNA in un rapporto di circa 1 ml di reagente per 50 mg di peso cryosection, tipicamente 600 microlitri per provetta.
ATTENZIONE: RNA reagenti di isolamento sono tossici, corrosivi e irritanti. Seguire le istruzioni del produttore per una manipolazione sicura. - Usando una siringa da 1 ml con un ago calibro 18, richiamare l'RNA estrazione liquido e lavare le pareti del tubo fino a tutto il tessuto viene sospeso in soluzione. Cercare di ridurre al minimo le bolle d'aria durante l'ago omogeneizzazione.
- Utilizzare la punta dell'ago per schiacciare e disperdere eventuali criosezioni aggregata e pezzi che aderiscono alla parete del tubo. Triturate per omogeneizzare facendo passare il campione su e giù attraverso l'ago per cinque colpi, e poi riportare il campione in ghiaccio. Ripetere entrambi i passaggi tre a cinque volte, o il numero di volte necessario per interrompere tutti grumi e passare il campione facilmente attraverso l'ago.
- Rimuovere l'ago calibro 18 e sostituirlo con un ago calibro 22. attenzione TRiturate il campione per cinque colpi, e poi tornare il campione in ghiaccio. Ripetere la triturazione tre a quattro volte per ottenere un tessuto omogenato finemente disperso.
NOTA: Se le particelle dei tessuti iniziano a bloccare l'ago in sede di elaborazione del campione, espellere tutta campione dalla siringa e tornare alla ago calibro 18 per un ulteriore omogeneizzazione. Un passo ulteriore triturazione con un ago 25 o 26 calibro può essere aggiunto per ottenere la resa massima. Tuttavia, l'ago può intasarsi cui vi è un rischio di fuoriuscita del campione. - Spostare il campione di ghiaccio a temperatura ambiente. Incubare per 5 minuti per distruggere complessi molecolari.
- In una cappa aspirante, aggiungere 0,1 ml di 1-bromo-3-chloropentane (BCP) per 1 ml di reagente isolamento dell'RNA utilizzato (fase 3.1.1), in genere 60 ml per provetta. Agitare la provetta vigorosamente a mano per 15 secondi (non vortex). Incubare il campione a temperatura ambiente per 2 a 3 min. Poi, centrifugare per 15 min a 12.000 xg e 4 ° C.
ATTENZIONE: BCP è infiammabile e tossico. Maniglia in una cappa aspirante e indossare guanti, un camice da laboratorio e occhiali di sicurezza. - Raccogliere accuratamente la fase acquosa superiore (incolore) contenente RNA e trasferirlo in una provetta pulita. Aggiungere un uguale volume di etanolo al 70% (in acqua DEPC) e agitare per miscelare. Incubare a temperatura ambiente per un massimo di 10 min.
NOTA: l'interfase medio e fasi di fenolo-BCP inferiori possono essere trattati per DNA genomico e proteine, rispettivamente, secondo le istruzioni del produttore o raccolti in un fenolo-BCP contenitore per rifiuti pericolosi per un appropriato smaltimento.
- tubo Move (s) di criosezioni pool di ghiaccio. Aggiungere immediatamente unorganico reattivo estrazione di RNA in un rapporto di circa 1 ml di reagente per 50 mg di peso cryosection, tipicamente 600 microlitri per provetta.
- purificazione dell'RNA.
- Seguire le istruzioni del produttore per vincolante del campione, il lavaggio e la eluizione con lievi 8 varianti. Per esempio:
- Posizionare una aliquota di acqua DNasi / RNasi-free in un bagno C 37 ° o incubatore di pre-caldo per passo 3.2.4.
- Aggiungere il campione di RNA da 3.1.8 sopra ad una colonna di purificazione e centrifugare il campione per 15 seca 12.000 xg a temperatura ambiente. Versare il flusso attraverso indietro nella stessa colonna e ri-centrifuga. Ripetere una volta in più per massimizzare il legame RNA, e poi scarta il flusso finale attraverso.
- Eseguire i passaggi di lavaggio in base alle istruzioni del produttore 8. Applicare 700 ml di tampone di lavaggio (senza etanolo) alla colonna centrifugare per 15 secondi a 12.000 xg, e scartare il flusso attraverso.
- Aggiungere 500 pl di tampone di lavaggio (con etanolo) alla colonna centrifugare per 15 secondi a 12.000 xg, ed eliminare il flusso attraverso. Ripetere questa operazione una sola volta.
- Centrifugare vuoto per 1 min a 12.000 xg per asciugare la membrana.
- Trasferire la colonna di selezione per un RNasi pulito, tubo-free DNasi. Aggiungere 40 ml di acqua preriscaldata DNasi / RNasi-free (da 3.2.1) al centro della membrana colonna. A temperatura ambiente, incubare per 2 minuti e quindi si centrifuga per 2 minuti a 12.000 x g.
NOTA: Il volume di eluizione di 40 ml è di circa 1,3 ml per mg di originaletessuti per 30 mg di criosezioni pool. Regolare il volume di eluizione come appropriato per i diversi pesi dei tessuti di partenza, ma non abbassare al di sotto di 32 ml. Una seconda eluizione, con circa 0,7 ml per mg di tessuto originale, può essere aggiunto per aumentare il rendimento totale RNA. - Analizzare l'RNA (colonna eluizione) per la concentrazione e la purezza da uno spettrofotometro, elettroforesi, e / o un bioanalyzer. Conservare l'RNA a -80 ° C fino al momento della applicazioni a valle, come trascrizione inversa per la PCR quantitativa 4.
NOTA: Si consiglia un trattamento DNasi prima di utilizzare l'RNA in applicazioni a valle. Questo trattamento può essere effettuato su alcune colonne di purificazione dell'RNA prima della fase di lavaggio, a questo punto specifico colonna seguente eluizione, o su una aliquota di RNA come primo passo in qualsiasi applicazione valle. L'RNA deve essere stabile per diversi anni.
4. analisi istologica da immunofluorescente Staining di criosezioni muscolari
- Semplice protocollo di immunofluorescenza.
- Utilizzare una penna idrofobico fare il giro del gruppo di sezioni in ogni diapositiva. Delicatamente rilasciare PBS nella zona cerchiata (circa 80 ml per una piccola superficie fino a 500 microlitri per una grande superficie), facendo attenzione a non toccare i tessuti. Incubare per 5 minuti a temperatura ambiente.
NOTA: Se si utilizza diapositive congelati, rimuovere diapositive da -80 ° C congelatore e incubare a temperatura ambiente per 20 a 30 minuti per scongelare e asciutto, quindi procedere come sopra. Sono necessari almeno due diapositive: una diapositiva sperimentale da incubato in anticorpo primario e secondario; e uno scivolo di controllo per il quale anticorpo primario è escluso, "l'unica secondario" di controllo. - Suggerimento la slitta per versare fuori PBS. Aggiungere 5% di siero asino in PBS (soluzione di saturazione) per l'area cerchiata; essere attenti a garantire che le sezioni muscolari non si seccano. Incubare a temperatura ambiente per 30 minuti (o fino a diverse ore in una camera umida).
- Preparare la soluzione anticorpo primario per analizzare la rigenerazione muscolare. Mescolare soluzione bloccante, con un anticorpo eMHC (01:40) e un anticorpo ColVI (1: 1.000). Preparare circa 150 ml, 300 ml o 500 ml per piccole, medie o grandi superfici di scorrimento, rispettivamente. Vortex per 5 secondi, e poi centrifugare per 2 min a 15.000 xg per far sedimentare i precipitato.
- Per diapositive sperimentali, punta la slitta per versare fuori il blocco soluzione e quindi aggiungere soluzione di anticorpo primario dal 4.1.3. Per il vetrino di controllo secondario, punta la slitta per versare fuori il blocco soluzione e quindi aggiungere la soluzione bloccante fresco (senza anticorpi). Incubare i vetrini in una camera umida a 4 ° C durante la notte.
NOTA: Quando pipettando soluzioni di anticorpi su vetrini, tirare sempre liquido dalla parte superiore del tubo di soluzione di anticorpo primario, non disturbare l'eventuale precipitato sul fondo della provetta. - Suggerimento scivola a versare off soluzione. Aggiungere PBS goccia a goccia alla regione cerchiata di ogni diapositiva per lavare, punta a versareoff, quindi aggiungere più PBS e incubare per 3 a 5 min. Ripetere per un totale di tre lavaggi.
NOTA: Il tempo di lavaggio è molto flessibile e può essere allungato fino a 20 minuti se lo si desidera. Generalmente, il numero di modifiche soluzione è più importante del tempo. - Preparare la soluzione di anticorpo secondario per tutte le diapositive (compreso il vetrino di controllo secondario) utilizzando una diluizione 1: 500 di anticorpi secondari rossi e verdi fluoroforo accoppiato per rilevare IgG1 mouse (eMHC) e IgG di coniglio (ColVI) e 1: 10.000 diluizione DAPI nucleare macchia.
- Ad esempio, mescolare 1 ml di DAPI con 9 ml di DDH 2 O per fare una diluizione 1:10 di DAPI. Poi, per un volume finale ml 500, aggiungere 1,0 microlitri anti-topo IgG1-rosso + 1,0 microlitri anti-coniglio IgG-verde + 0,5 l di 01:10 DAPI a 447,5 ml di soluzione bloccante. Vortex per mescolare e centrifugare per 2 minuti a 15.000 xg per far sedimentare i precipitato.
NOTA: Idealmente, tutti gli anticorpi secondari dovrebbe essere dalle stesse specie ospite.
- Ad esempio, mescolare 1 ml di DAPI con 9 ml di DDH 2 O per fare una diluizione 1:10 di DAPI. Poi, per un volume finale ml 500, aggiungere 1,0 microlitri anti-topo IgG1-rosso + 1,0 microlitri anti-coniglio IgG-verde + 0,5 l di 01:10 DAPI a 447,5 ml di soluzione bloccante. Vortex per mescolare e centrifugare per 2 minuti a 15.000 xg per far sedimentare i precipitato.
- Suggerimento le diapositive per versare fuori l'ultimo lavaggio PBS. Aggiungere la soluzione anticorpo secondario per coprire tutti i tessuti. Coprire i vetrini per proteggerli dalla luce e incubare a temperatura ambiente per 30 min.
NOTA: Tutti gli anticorpi secondari devono essere convalidati per avere reattività crociata minimo con altre specie negli esperimenti doppia etichettatura. - Lavare i vetrini come descritto in 4.1.5. Dopo l'ultimo lavaggio, capovolgere la slitta per versare fuori dal PBS e impostare la diapositiva su un tessuto. Aggiungere 3 a 4 gocce di un mezzo di montaggio acquoso lungo un lato.
- Impostare il bordo di un vetrino di vetro appena al bordo esterno del supporto di montaggio. Utilizzando pinze, abbassare lentamente il vetrino verso i tessuti, quindi, rilasciare il vetrino e picchiettare delicatamente in posizione. Infine, premere delicatamente ogni angolo del vetrino per stabilizzarlo.
- Proteggere le diapositive dalla luce e conservare a 4 ° C fino al momento dell'uso.
NOTA: Per la conservazione a lungo termine, applicare un sottile strato di smalto lungo il bordo di The vetrino per aiutare a prevenire il vetrino si secchi.
- Utilizzare una penna idrofobico fare il giro del gruppo di sezioni in ogni diapositiva. Delicatamente rilasciare PBS nella zona cerchiata (circa 80 ml per una piccola superficie fino a 500 microlitri per una grande superficie), facendo attenzione a non toccare i tessuti. Incubare per 5 minuti a temperatura ambiente.
- la valutazione istologica.
- Immagine le diapositive utilizzando un epifluorescente o microscopio confocale con filtri appropriati per rilevare eMHC (rosso); ColVI (verde); e nuclei (blu) DAPI-macchiato, in genere utilizzando un 20X obiettivo 1,5.
- Verificare che il segnale fluorescente da diapositive sperimentali è diverso dal vetrino di controllo secondario per dimostrare la specificità del eMHC e ColVI rilevamento 4.
NOTA: eMHC fibre rigeneranti positivi dovrebbero essere visibili da circa 2 a 7 giorni dopo un infortunio muscolare e variabile nei topi con distrofia muscolare. Il collagene VI è presente nella matrice extracellulare che circonda le fibre muscolari, vasi sanguigni e nervi e nei grandi fasci di tessuto connettivo peri- e epimisio. DAPI nucleare macchia è utile identificare fibre muscolari con nuclei centrali rispetto nuclei periferico indicano rigenerazione delle fibre, e la presenza di infiltrating cellule. fibre necrotiche o feriti possono macchiare debolmente con l'anticorpo secondario IgG di topo a causa del rilevamento di endogena IgG che penetra le fibre attraverso le membrane muscolari danneggiate. - Per quantificare la rigenerazione, scattare foto sovrapposte con il microscopio a fluorescenza ogni filtro attraverso l'intera immagine. Unire le immagini eMHC, ColVI e DAPI per ogni posizione e quindi allineare le immagini per ricostruire una mappa di tutta la sezione 1,5.
- Utilizzando il software di analisi, contare il numero di fibre positivi eMHC e il numero di fibre totali per calcolare recente rigenerazione (100 * (# eMHC + fibre / # fibre totali)). Inoltre, contare il numero di fibre centralmente nucleati su fibre totali per misurare la rigenerazione su un periodo più lungo (fibre 100 * (# CN + fibre / # totali)) 1,5.
Risultati
Muscle cryosection RNA è ad alto contenuto di qualità e fornisce il rendimento sufficiente per la maggior parte delle applicazioni
Analisi di sedici preparati di RNA muscolo scheletrico sono mostrati nella Tabella 1 utilizzando 19,4 a 41 mg di pool muscolo tibiale anteriore (TA) da 8 topi di controllo. Sia a sinistra (L) e destra muscoli (R) TA sono stati preparati in esperimenti di rigenerazione con muscoli raccolto 3 giorni dopo l'iniezione intramuscolare longitudinale di 25 ml di soluzione salina o 10 micron cardiotossina di causare lesioni muscolari utilizzando metodi precedentemente riferito 1. Come indicato nella tabella 1, le A260 / 280 di copertura del muscolo cryosection RNA sono in genere vicino al 2 o superiore in questi campioni rappresentativi. Come "pura" RNA è considerato di avere A260 / 280 di 2.0 e A260 / 280 di 1,8-2,2, la purezza dei campioni cryosection RNA è eccellente 9. Recupero totale RNA era tipicamente over 10 mg per campione con rese di 0,18 a oltre 1 mg di RNA totale per mg di tessuto di base, fornendo materiale sufficiente per molte applicazioni a valle. In particolare, la concentrazione di RNA, l'RNA totale estratto, e la resa di RNA per mg di tessuto a partire dai muscoli TA 3 giorni di lesioni post-tossina è stata significativamente superiore a quello da TA saline-iniettato. Questo suggerisce che si migliora omogeneizzazione quando la struttura muscolare è interrotto da un esteso danno e / o che vi è un aumento della trascrizione genica e / o la stabilità dell'RNA nel muscolo rigenerante 3 giorni. La persistenza di qualità dell'RNA è stata valutata mediante semplice 1x TAE / 1,5% gel di agarosio di 1 ml di muscolo cryosection RNA dopo che i campioni sono stati conservati a -20 ° C per 18 mesi. Prominenti 18S e 28S rRNA bande sono ancora evidenti nei campioni che dimostrano di alta qualità dell'RNA, anche in condizioni non ottimali di conservazione (Figura 1A).
Muscle cryosection RNAsupporta applicazioni a valle
Un microgrammo di RNA per campione cryosection pool è stato trattato con DNasi e reverse trascritto da oligo dT primer. Dopo il trattamento RNasi, il volume totale della trascrizione inversa cDNA era di 30 microlitri. PCR quantitativa non semplice con eccesso di amplificazione è stato eseguito per confermare la fattibilità del cDNA. Fattore miogenico normativo 4 (MRF4), un fattore di trascrizione upregulated con differenziamento muscolare, è stato amplificato utilizzando i primer del mouse precedentemente riportati, senso 5'-CTACATTGAGCGTCTACAGGACC e antisenso 5'-CTGAAGACTGCTGGAGGCTG 10, da 2 pl di modello utilizzando PCR standard. C'era robusto, l'amplificazione specifica del 234 bp MRF4 frammento di entrambi i campioni TA cDNA a destra ea sinistra, ma non RT (RNA incluso, ma non trascrittasi inversa), RT DDH 2 O (trascrizione senza stampo di RNA indietro), o DDH 2 O controlli PCR (Figura 1B).Gli stessi campioni sono stati eseguiti in triplicato per controllo di riferimento MRF4 e mOaz1 4 quantificazione usando amplificazione relativa e riferimento fluorescenza passiva su un sistema PCR in tempo reale. MRF4 è stata espressa a 0,097 volte del tossina iniettata TA destra rispetto alla soluzione salina-iniettato TA sinistra, calcolato con il metodo ΔΔCt 4. Questo è simile a precedenti segnalazioni di bassa espressione MRF4 3 giorni dopo la lesione tossina causa di una perdita di fibre muscolari mature 11. Per confrontare la coerenza di RNA cryosection per PCR quantitativa, valori Ct sono stati confrontati per il gene di riferimento mOaz1. Da sei campioni, mOaz1 trascrizione è stata rilevata con una Ct media di 17,242 ± 1.483 deviazione standard, mentre la media Ct era 36,332 ± 3.61 SD in campioni di controllo RT- (n = 4). La stretta raggruppamento di segnali mOaz1 Ct attraverso campioni suggerisce che l'RNA isolato da criosezioni muscolari TA si esibisce come previsto in espressione di RNA a valle analisi.
la valutazione istologica di criosezioni adiacenti.
Esempi di immunofluorescenza indiretta di 7 micron tibiale sezioni muscolari anteriore da topi di controllo littermate 3 giorni dopo l'iniezione di tossina sono mostrati per rilevare fibre rigeneranti (Figura 2). Entrambe le sezioni sono stati raccolti dal muscolo inferiore a 150 micron dalla regione da utilizzare per l'analisi di RNA ad una profondità tra 4,5 e 4,6 millimetri dalla superficie muscolare prossimale. Embryonic catena pesante della miosina (eMHC, rosso) rileva fibre rigeneranti, collagene VI (ColVI, verde) delinea le fibre muscolari, e le macchie DAPI Nuclei blu, secondo il protocollo 4. Le regioni con infiltrato nucleare concentrato (segnale blu) indicano i siti di lesione tossina , come evidente dalla attivazione delle cellule muscolari nuova rigeneranti positivi eMHC. mappe intera sezione come in questo esempio sono utilizzati per la quantificazione della rigenerazione calcolando la percentuale di embryonic miosina fibre catena pesante che esprimono (rosso, di recente rigenerata) o fibre centrale nucleate come riportato in precedenza 1. In particolare, non vi è sorprendentemente pochi danni nel muscolo TA in figura 2A. Mentre non vi è variazione tra le iniezioni, iniezioni di tossina tipici interessano una percentuale molto più grande del compartimento muscolare 1, come mostrato nella Figura 2B. Pertanto, questa analisi istologica suggerisce che il pregiudizio tossina in Figura 2A era minimo e fornisce un importante strumento per interpretare i dati di espressione genica dal campione RNA cryosection muscolare contigui. Se l'intero muscolo era stato usato per la preparazione di RNA con metodi di rettifica standard, il inaspettatamente piccola area lesioni di questo campione renderebbe un outlier che inclinare analisi a valle. Invece, accoppiando quantificazione istologica dal medesimo muscolo permette la misura diretta della portata del pregiudizio dalle sezioni adiacenti. Ciò consente l'uso di incluCriteri sione / esclusione al fine di garantire che tutti i campioni inclusi in RNA a valle analisi incontrare una soglia minima lesione o la normalizzazione di RNA analisi in base alle dimensioni lesioni.

Figura 1: Valutazione della Qualità delle RNA da Pooled muscolari criosezioni. A) 18S e 28S bande RNA ribosomiale sono prominenti in RNA da criosezioni muscolari pool di 18 mesi dopo la preparazione di RNA. B) Non-PCR quantitativa per MRF4 seguente trascrizione inversa. 200 e 300 bp bande di una scala del DNA sono indicati. RT, inversa reazione di trascrizione con stampo di RNA, ma non trascrittasi inversa. RT-H 2 O, trascrizione inversa con DDH 2 O, nessun modello di RNA. H 2 O, nessun modello di controllo PCR con DDH 2 O. In questi esperimenti, la tossina è stata iniettata destra tibiale anteriore (RTA) e wa salinis iniettato sinistra (LTA). Clicca qui per vedere una versione più grande di questa figura.

Figura 2: provate Maps istologiche per il muscolo Rigenerazione Studies. A, B) mappe compilata di singolo tibiale sezioni muscolari anteriore 3 giorni dopo l'iniezione di tossina che mostra esempi di poveri (A) e normale (B) lesioni tossina-indotta. Bianchi regioni in scatola di ogni mappa sezione sono mostrati come immagini ad incasso per la visualizzazione ingrandimento maggiore, Rosso, miosina embrionale catena pesante; verde, il collagene VI matrice extracellulare di proteine; blu, DAPI macchia nucleare. barra della scala, 100 micron. Clicca qui per vedere una versione più grande di questa figura.
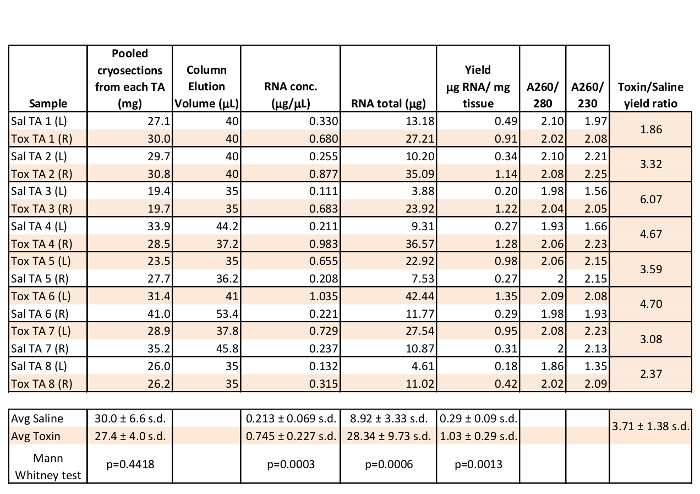
Tabella 1: Rappresentante RNA rendimento e la purezza Misure da criosezioni Muscle pool. Sedici tibiale anteriore (TA) i muscoli sono stati sezionati e campioni cryosection riuniti sono stati trattati per l'RNA. RNA purificato (1 ml) è stata analizzata con un nanospectrophotometer. statistiche di colonna sono stati eseguiti in un foglio di calcolo, il confronto di gruppo sono stati eseguiti utilizzando il software statistico.
Discussione
Per ottenere i migliori risultati con questo metodo, tenere embedding resina limitato al terzo inferiore o mezza del muscolo durante la crioconservazione di tessuto, perché la resina in eccesso rallenta la raccolta dei criosezioni pool e può aumentare l'incorporamento contaminazione resina nell'isolamento dell'RNA. Inoltre, attenzione durante dell'ago omogeneizzazione è importante per ottimizzare il rendimento e minimizzare la probabilità di intasamento dell'ago. Il protocollo può essere modificato utilizzando una siringa Luer-Lok per la protezione contro la perdita di campione se l'ago viene bloccato e richiede alta pressione per rimuovere l'ostruzione. Un passo ago omogeneizzazione supplementare con un ago calibro 25 o 26 può anche essere aggiunto per produrre una sospensione di tessuto più fine di ulteriormente migliorata resa RNA. Mentre cloroformio potrebbe essere sostituito per BCP, questo non è raccomandato come BCP è meno tossico e comporta bassi livelli di contaminazione di DNA genomico nella fase acquosa durante la centrifuga organica dell'RNA 12. Crescentelo spessore di taglio per criosezioni pool di oltre 30 micron non è raccomandato anche come omogeneizzazione sarà meno efficiente.
Se la resa RNA è di sotto dei livelli desiderati, diverse strategie possono essere utilizzati per aumentare il recupero, quali: i) aumentare la quantità milligrammo di materiale di partenza per aumentare la resa possibile; ii) di ridurre lo spessore di taglio inferiore a 30 micron per migliorare l'omogeneizzazione meccanica del tessuto; iii) aumentare la durata dell'incubazione campione e l'ago omogeneizzazione nel reagente di estrazione organico per migliorare la rottura meccanica e tessuti chimica; e iv) se pezzi di tessuto rimangono, eseguire una seconda fase di estrazione con più rigorosa omogeneizzazione ago. In alternativa, ci possono essere considerazioni tessuto-specifici, come ad esempio ulteriori fasi di separazione di fase e di precipitazione per campioni con alto contenuto di proteoglicani 13. Durante la purificazione colonna di RNA, un volume di eluizione più grande può essere utilizzato e l'esecuzione di una seconda eluizione può måximize recupero totale RNA, ma a scapito della concentrazione di RNA. Un alcool precipitazione post-colonna può essere utilizzata per concentrare l'RNA se bassa concentrazione è una preoccupazione con questa modifica. Se la degradazione dell'RNA è un problema, riducendo il tempo di crioconservazione durante la dissezione, più rigorosa pulizia di superfici criostato e strumenti per minimizzare l'esposizione RNasi, eseguire la fase ago omogeneizzazione in una camera fredda, aggiunta di un reagente inibitore RNase ai criosezioni 14, e frequente sostituzione delle soluzioni libere RNasi può ogni aiutare a prevenire o ridurre al minimo l'esposizione a RNasi e ridurre l'attività scissione. E 'possibile che brevemente il bagno il tessuto in un reattivo inibitore RNasi dopo la dissezione, ma prima crioconservazione può ridurre ulteriormente la degradazione del campione. Tuttavia, esperimenti preliminari devono essere eseguiti per garantire che tale trattamento non aumenta cristalli di ghiaccio o altri artefatti durante la crioconservazione.
mentre embrionalimiosina catena pesante / collagene VI immunofluorescenza indiretta viene qui utilizzato come esempio per l'analisi del muscolo di lesioni, criosezioni sottili montate su vetrini da microscopio da questi esperimenti possono essere utilizzati per ogni macchia istologica rilevanti che possono essere condotti su sezioni congelate, comprese le tecniche di immunofluorescenza con posta -fixation e ematossilina / eosina. In effetti, gli adattamenti al semplice protocollo di immunofluorescenza cui sopra potranno essere necessari. Ad esempio, anti-topo anticorpi secondari utilizzati per rilevare un mouse anticorpo primario (ad esempio, eMHC) possono anche rilevare immunoglobuline di topo endogeni nel tessuto bersaglio. Tali anticorpi endogeni tipicamente si accumulano nelle fibre muscolari danneggiate o necrotiche nel muscolo distrofico ferito o che causano sfondo immunofluorescenza colorazione. Una diapositiva di controllo secondario (con l'anticorpo primario omesso) dovrebbe sempre essere esaminato per valutare la specificità della colorazione. Se endogena anticorpo sfondo è problematico, fasi di pre-blocco dovrebbe essereaggiunta al protocollo per prevenire o ridurre al minimo il rilevamento di immunoglobuline endogene di topo 15.
Le principali limitazioni del metodo sono che richiede un criostato e richiede molto tempo, il che rende relativamente ridotto. Per esempio, un esperto nella tecnica è in grado di elaborare fino a 16 muscoli per criosezioni raggruppati e vetrini da microscopio (8 vetrini con sezioni duplicate di tutti 16 tessuti) in circa 9 a 10 ore. Per i novizi a criosezionamento, collezione di criosezioni pool da 2 a 4 campioni potrebbe essere ragionevolmente masterizzato dopo l'allenamento criostato e uno o due sessioni di prove libere, invece, ottenendo criosezioni qualità per istologia hanno più esperienza. Pertanto, i fattori attrezzature, di tempo o di formazione possono rendere questo metodo meno utile per i tessuti più morbidi, che può essere ben omogeneizzato con un pestello omogeneizzatore manuale.
In confronto con i metodi di omogeneizzazione non criostato, preparato RNA muscoli striatis sono stati segnalati da biopsie muscolari con rese di RNA di 0,05 e 0,7 mg di RNA pre mg di muscolo 16 e, più recentemente, 0,27-1,08 mg di RNA per mg di muscolo 17. Pertanto, la tecnica qui descritta fornisce rendimenti RNA buono come o migliori rispetto ai metodi non criostato con l'ulteriore vantaggio di consentire istologico accoppiato analizza da una regione contigua dello stesso campione. In particolare, uno studio precedente anche usato criosezionamento per omogeneizzazione nel tessuto vertebrale e allo stesso modo ha scoperto che il tessuto criosezionamento migliorato l'efficienza di omogeneizzazione per l'isolamento di RNA 13. Quando questa tecnica è stata testata nei bovini campioni di muscolo scheletrico, il rendimento medio di RNA per la preparazione del campione è stato 4,09 ± 0,36 mg, nella parte bassa del range di normalità riportato qui 13. microdissezione laser è un'altra alternativa per la raccolta di tessuto per l'estrazione di RNA da una cryosection. cattura laser è superiore a questo metodo cryosection pool inche permette la specificità di raccogliere solo un sottoinsieme di celle desiderato dalla sezione e può essere eseguita su una singola sezione di tessuto fino a 50 micron di spessore 18. attrezzature Tuttavia, la raccolta di un campione di micro-sezionato può essere difficile e adatto non è ampiamente disponibile, rendendo pool cryosection omogeneizzazione più accessibile ai ricercatori. Quando entrambi i metodi sono disponibili, una preferenza per analizzare un sub-regione del tessuto per un'applicazione che necessitano di quantità di RNA solo piccole favorirebbe laser cattura microdissezione mentre pool cryosection omogeneizzazione è migliore quando l'analisi sub-regione è meno importante e sono necessarie maggiori quantità di RNA.
Mentre i metodi di isolamento istologici e RNA sono il fuoco qui, il metodo cryosection pooled si adatta facilmente a preparare lisati proteici per analisi Western blot o misurazione dell'attività enzimatica. Ad esempio, criosezioni pool dal cuore sono stati solubilizzati per Western Blot analisi 4 aND criosezioni pool del TA sono stati omogeneizzati per succinato deidrogenasi saggi di attività della funzione mitocondriale 5. In alternativa, genomiche di DNA e proteine frazioni possono essere separate da altre fasi durante l'estrazione organica dopo l'isolamento di RNA, offrendo la possibilità di ricavare DNA genomico, proteine, RNA, e le misurazioni istologiche da un unico tessuto dopo una singola sessione criostato.
Nel complesso, il principale vantaggio di questo metodo è quello di aumentare la flessibilità sperimentale consentendo molteplici approcci analitici richiedono diversa preparazione del campione da un unico tessuto. Il metodo è più appropriato per i muscoli e altri tessuti con un'ampia intra o struttura extracellulare che riduce l'efficienza di omogeneizzazione tessuto pestello-based.
Divulgazioni
The author declares that she has no competing financial interests.
Riconoscimenti
Madison Grant, Steven Foltz, Halie Zastre and Junna Luan provided technical assistance. Research reported in this publication was supported by the National Institute of Arthritis and Musculoskeletal and Skin Diseases of the National Institutes of Health under award number AR065077. The content is solely the responsibility of the author and does not necessarily represent the official views of the National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| Cork | VWR Scientific | 23420-708 | Cut into small squares with a sharp blade. |
| Plastic coverslip | Fisher Scientific | 12-547 | Used to orient the muscle during freezing. |
| Low temperature thermometer | VWR Scientific | 89370-158 | |
| 2-methylbutane | Sigma | M32631-4L | Caution: hazardous chemical. Store in flammable cabinet. |
| Embedding resin: "cryomatrix" | Thermo Fisher Scientific | 6769006 | Other embedding resins can be substituted for cryomatrix. |
| Cryostat | Thermo Fisher Scientific | microm HM550 with disposable blade carrier | Any working cryostat should be sufficient for the protocol. |
| Disposable cryostat blade | Thermo Fisher Scientific | 3052835 | Use an appropriate blade or knife for the cryostat to be used. |
| RNAse decontamination solution: "RNase Zap" | Thermo Fisher Scientific | AM9780 | |
| Analytical balance | Mettler Toledo | XS64 | |
| Paint brush | Daler Rowney | 214900920 | Use to handle cryosections. Can be found with in stores with simple art supplies. |
| Razor blade | VWR Scientific | 55411-050 | |
| Microscope slide | VWR Scientific | 48311600 | |
| RNA organic extraction reagent: TRIzol | Thermo Fisher Scientific | 15596026 | Caution: TRIzol is a hazardous chemical. Note: Only organic extraction reagents are recommended for RNA extraction from skeletal muscle. |
| 18 gauge needle | VWR Scientific | BD305185 | |
| 22 gauge needle | VWR Scientific | BD305155 | |
| 26 gauge needle | VWR Scientific | BD305115 | Optional. Can be used for a third round of sample trituration in the RNA extraction protocol. |
| 1 ml syringe | VWR Scientific | BD309659 | For very high value samples, a Luer-Lok syringe is recommended (e.g., VWR BD309628). |
| 1-bromo-3-chloropentane (BCP) | Sigma | B9673 | |
| For 70% ethanol in DEPC water: 200 proof alcohol | Decon Laboratories, Inc. | +M18027161M | Mix 35 ml 200 proof alcohol + 15 ml DEPC water. |
| For 70% ethanol in DEPC water: DEPC-treated water | Thermo Fisher Scientific | AM9922 | Mix 35 ml 200 proof alcohol + 15 ml DEPC water. |
| RNA purification kit: PureLink RNA minikit | Thermo Fisher Scientific | 12183018A | Final steps of RNA preparation. |
| DNase/Rnase-free water | Gibco | 10977 | DEPC-treated water can also be used. |
| Spectrophotometer: Nanodrop 2000 | Thermo Fisher Scientific | NanoDrop 2000 | |
| Dnase I | Thermo Fisher Scientific | AM2222 | Treat purified RNA to remove any DNA contamination before downstream appications. |
| Hydrophobic pen | Thermo Fisher Scientific | 8899 | |
| Dulbecco's PBS | Gibco | 14190 | PBS for immunofluorescence protocol. |
| Donkey serum | Jackson ImmunoResearch Laoratories, Inc | 017-000-121 | Rehydrate normal donkey serum stock according to the manufacturer's instructions, then dilute an aliquot to 5% for immunofluorescence. Normal goat serum can also be used. |
| eMHC antibody | University of Iowa Developmental Studies Hybridoma Bank | F1.652 | |
| Collagen VI antibody | Fitzgerald Industries | #70R-CR009x | |
| Donkey anti-rabbit AlexaFluor488 | Thermo Fisher Scientific | A21206 | |
| Goat anti-mouse IgG1 AlexaFluor546 | Thermo Fisher Scientific | A21123 | |
| DAPI (4',6-diamidino-2-phenylindole) | Thermo Fisher Scientific | D1306 | |
| Aqueous mounting media: Permafluor | Thermo Fisher Scientific | TA-030-FM | Only use mounting media designed for fluorescent applications with anti-fade properties. |
| Glass coverslip | VWR Scientific | 16004-314 | Use for mounting slides at the end of immunofluorescence protocl |
| Image analysis software: ImageProExpress | Media Cybernetics, Inc. | Image-Pro Express, or more advanced products | Freeware ImageJ should also work for manual counting. More advanced software with segmentation abiities may allow partial automation of the process; e.g., ImageProPremier. |
| Merge and map section images: Photoshop | Adobe | Photoshop | |
| Cardiotoxin | Sigma | C9659 | Sigma C9659 has been discontinued. Other options for cardiotoxin are EMD Millipore #217503; American Custom Chemicals Corp. # BIO0000618; or Ge Script # RP17303; but these have not been validated. |
| reverse transcription kit: Superscript III First-strand synthesis system | Thermo Fisher Scientific | 18080051 | Any validated, high quality reverse transcription reagents can be used. |
| Standard PCR: GoTaq Flexi polymerase system | Promega | M8298 | Any validated, high quality Taq polymerase system can be used. If DNA sequencing is to be used for any application downstream of the PCR, then a high fidelity PCR system should be used instead. |
| SYBR green | Thermo Fisher Scientific | S7585 | For use in qPCR when not using a dedicated qPCR master mix. Use with SuperROX (for Applied Biosystems instruments) and GoTaq Flexi polymerase and buffers. |
| ROX: SuperROX, 15 mM | BioResearch Technologies, Inc. Novato CA | SR-1000-10 | SuperROX is more stable in the PCR reaction, so it is preferred for use as a qPCR passive reference dye over ROX (carboxy-X-rhodamine). For qPCR with Applied Biosystems instruments |
| Real-time PCR | Applied Biosystems | 7900HT |
Riferimenti
- Foltz, S. J., et al. Abnormal skeletal muscle regeneration plus mild alterations in mature fiber type specification in Fktn-Deficient Dystroglycanopathy Muscular Dystrophy Mice. PLoS One. 11 (1), 0147049 (2016).
- Bartoli, M., et al. Noninvasive monitoring of therapeutic gene transfer in animal models of muscular dystrophies. Gene Ther. 13, 20-28 (2006).
- Ip, W. T., Huggins, C. E., Pepe, S., Delbridge, L. M. Evaluating RNA preparation options for archived myocardial biopsies. Heart Lung Circ. 20 (5), 329-331 (2011).
- Beedle, A. M., et al. Mouse fukutin deletion impairs dystroglycan processing and recapitulates muscular dystrophy. J. Clin. Invest. 122 (9), 3330-3342 (2012).
- Foltz, S. J., et al. Four-week rapamycin treatment improves muscular dystrophy in a fukutin-deficient mouse model of dystroglycanopathy. Skeletal Muscle. 6, 20 (2016).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nat. Protoc. 10, 1612-1624 (2015).
- Rump, L. V., Asamoah, B., Gonzalez-Escalona, N. Comparison of commercial RNA extraction kits for preparation of DNA-free total RNA from Salmonella cells. BMC Res. Notes. 3, 211 (2010).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. J. Vis. Exp. (45), e2565 (2010).
- Valdez, M. R., Richardson, J. A., Klein, W. H., Olson, E. N. Failure of Myf5 to support myogenic differentiation without myogenin, MyoD, and MRF4. Dev Biol. 219 (2), 287-298 (2000).
- Pavlath, G. K., Dominov, J. A., Kegley, K. M., Miller, J. B. Regeneration of transgenic skeletal muscles with altered timing of expression of the basic helix-loop-helix muscle regulatory factor MRF4. Am. J. Pathol. 162 (5), 1685-1691 (2003).
- Chomczynski, P., Mackey, K. Substitution of chloroform by bromo-chloropropane in the single-step method of RNA isolation. Anal. Biochem. 225 (1), 163-164 (1995).
- Lee, J. T. Y., Cheung, K. M. C., Leung, V. Y. L. Extraction of RNA from tough tissues with high proteoglycan content by cryosection, second phase separation and high salt precipitation. J. Biol. Methods. 2 (2), 20 (2015).
- Guo, D., Catchpoole, D. R. Isolation of intact RNA following cryosections of archived frozen tissue. BioTechniques. 34, 48-50 (2003).
- Goodpaster, T., Randolph-Habecker, J. A flexible mouse-on-mouse immunohistochemical staining technique adaptable to biotin-free reagents, immunofluorescence, and multiple antibody staining. J. Histochem. Cytochem. 62 (3), 197-204 (2014).
- Ikezawa, M., Minami, N., Takahashi, M., Goto, Y., Miike, T., Nonaka, I. Dystrophin gene analysis of 130 patients with Duchenne muscular dystrophy with a special reference to muscle mRNA analysis. Brain Dev. 20 (3), 165-168 (1998).
- Majumdar, G., Vera, S., Elam, M. B., Raghow, R. A streamlined protocol for extracting RNA and genomic DNA from archived human blood and muscle. Anal. Biochem. 474, 25-27 (2015).
- Espina, V., Heiby, M., Pieroban, M., Liotta, L. A. Laser capture microdissection technology. Expert Rev Mol Diagnostics. 7 (5), 647-657 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon