Method Article
Cryosectioning المناطق المتاخمة من العضلات الهيكلية واحدة فأرة للالتعبير الجيني والتحليلات النسيجية
In This Article
Summary
يتم جمع متتالية المقاطع البرد لتمكين التطبيقات النسيجية والإثراء من الحمض النووي الريبي لقياس التعبير الجيني باستخدام المناطق المجاورة من ماوس واحدة العضلات والهيكل العظمي. يتم الحصول على جودة عالية RNA 20-30 ملغ من cryosections والقياسات المجمعة تتم مقارنة مباشرة عبر تطبيقات.
Abstract
مع هذا الأسلوب، يتم جمع cryosections التوالي لتمكين كل من التطبيقات المجهري لأنسجة الأنسجة والإثراء من الحمض النووي الريبي للتعبير الجينات باستخدام المناطق المجاورة من ماوس واحدة العضلات والهيكل العظمي. عادة، فإنه يمثل تحديا لتحقيق التجانس كافية من عينات صغيرة العضلات والهيكل العظمي وذلك لأن كميات المخزن المؤقت قد تكون منخفضة للغاية بالنسبة لتطبيقات طحن كفاءة، ولكن دون تعطيل الميكانيكية كافية، والهندسة المعمارية الأنسجة الكثيفة من اختراق حدود العضلات من الكواشف العازلة، مما تسبب في نهاية المطاف انخفاض العائد الحمض النووي الريبي. باتباع بروتوكول ذكرت هنا، يتم جمع 30 ميكرون أقسام وتجميع السماح cryosectioning والتجانس إبرة لاحق لتعطيل ميكانيكيا العضلات، وزيادة مساحة السطح المعرض للاختراق العازلة. القيود الأساسية للتقنية هي أنه يتطلب ناظم البرد، وأنه هو نسبيا منخفضة الإنتاجية. ومع ذلك، يمكن الحصول على جودة عالية من الحمض النووي الريبي عينات صغيرة من م المجمعةcryosections uscle، مما يجعل هذه الطريقة في متناول العديد من العضلات والهيكل العظمي المختلفة والأنسجة الأخرى. التحليلات وعلاوة على ذلك، تمكن هذه التقنية مطابقة (على سبيل المثال، التشريح الأنسجة والجينات) من المناطق المجاورة في العضلات والهيكل العظمي واحدة بحيث القياسات يمكن مقارنتها مباشرة عبر تطبيقات للحد من عدم اليقين التجريبي وللحد من التجارب على الحيوانات تنسخي اللازمة لمصدر الأنسجة صغيرة ل تطبيقات متعددة.
Introduction
والهدف من هذه التقنية هو جعل التحليلات التجريبية متعددة من طرائق مختلفة، مثل الأنسجة والتعبير الجيني، يمكن الوصول إليها من صغيرة الهيكل العظمي الأنسجة مصدر عضلة واحدة. تطبيقات المجهر هي الأكثر حساسية لعينة طرق المحافظة، والتي يجب أن تسيطر عليها بعناية للحد من تشكيل التحف الكريستال الجليد أثناء الحفظ بالتبريد. وهكذا، ويستند تطوير الأسلوب على الأمامية الظنبوبي (TA) في العضلات المجمدة مغطاة جزئيا مع تضمين الراتنج في السائل حمام 2-methylbutane تبريد النيتروجين -140 ° C كمادة مصدر لكلا المجهري المناعي والتعبير الجيني التحليلات.
الحاجة إلى استخدام نفس المادة المصدر لنهج تقنية متنوعة ذات أهمية خاصة للتجارب القائم على حقن في العضل حيث تمثل العضلات اليمنى واليسرى ظروف مختلفة، واحد المجموعتين الضابطة والتجريبية واحد. على سبيل المثال، في دراسات تجديد العضلات، مو واحديتم حقن scle مع المادة السامة أن يسبب تلف الأنسجة على نطاق واسع في حين تخدم العضلات المقابل كعنصر تحكم حقن المركبة 1. وبالمثل، دراسات العلاج الجيني للاضطرابات العضلات وعادة ما تبدأ مع المصادقة على ناقلات العلاج الجيني عن طريق الحقن العضلي يمكن مقارنتها مع ناقلات فارغة، ناقلات لا علاقة لها أو السيطرة على السيارة على الجانب المقابل 2. وبالتالي، فإنه ليس من الممكن أن مصدر كل عضلة TA إلى تطبيق آخر.
استراتيجيات مشتركة للتعامل مع هذه المسألة هي: ط) لاستخدام مجموعة مختلفة من العضلات لكل تطبيق، ب) لاستخدام الفئران إضافية، أو ج) لقطع قطعة من العضلات لكل تطبيق. ومع ذلك، اختلافات جوهرية بين المجموعات العضلية تجعل من الصعب مقارنة البيانات من التطبيقات منفصلة، والحيوانات إضافية تزيد النفقات ولها ما يبررها سيئة في حالة وجود بدائل أخرى. تقسيم العضلات بعد تشريح لمصدر التطبيقات المختلفة هو الخيار الأفضل طالعديد ن الحالات. ومع ذلك، فإن قطع العضلات وغالبا ما تكون صغيرة جدا لاستخدام سحق تحت النيتروجين السائل أو تقنيات طحن الميكانيكية لتجانس 2-5. كما العضلات هي الأنسجة الهيكلية للغاية معبأة مع مصفوفة ومقلص البروتينات خارج الخلية، وعدم كفاية التجانس الميكانيكية يؤدي إلى العائد المنخفض من الحامض النووي لاحق، RNA أو البروتين. طريقة مفصلة هنا يسمح كميات صغيرة من نسيج العضلات مصدر واحد للاستخدام في تطبيقات متعددة، وإدراج cryosectioning وإبرة سحن يحسن تجانس الميكانيكية لتحسين العائد الحمض النووي الريبي.
Protocol
تمت الموافقة على جميع الإجراءات الحيوانية من جامعة جورجيا المؤسسي رعاية الحيوان واستخدام اللجنة في ظل الاستخدام الحيوان بروتوكول A2013 07-016 (بيدل).
1. الحفظ بالتبريد العضلات الهيكلية غير المثبتة
- تجهيز
- قطع الفلين إلى مربعات صغيرة (حوالي 1 سم × 1 سم) مع شفرة حلاقة، والكتابة على الفلين مع علامة غيض الجميلة التي هي مقاومة لل2-methylbutane لتحديد الماوس المصدر والعضلات، واجراء خفض ضحلة جدا (حوالي 1 ملم) عبر السطح العلوي. إدراج ساترة البلاستيك إلى قطع لاستخدامها لتوجيه الأنسجة. كرر حتى الفلين جاهز للكل الأنسجة لتكون cryopreserved.
- الحصول على النيتروجين السائل، 2-methylbutane، الراتنج التضمين، ميزان الحرارة درجات الحرارة المنخفضة، الفلين، أدوات التشريح، والفأرة الدراسة.
تنبيه: السائل النيتروجين هو غاز مضغوط التي قد تنفجر إذا تم تسخينه. ارتداء معطف المختبر، والقفازات درجات الحرارة المنخفضة، وحماية الوجه عند التعامل مع السائل نيTrogen من. الاتصال مع الجلد أو العينين قد يسبب الحروق أو قضمة الصقيع. 2-Methylbutane هو قابل للاشتعال، سامة، مخاطر صحية وبيئية. ارتداء معدات الوقاية الشخصية (معطف المختبر، والقفازات، ونظارات السلامة)، فتح الحاوية الأسهم في غطاء الدخان، ونقل كمية صغيرة اللازمة لتجميد (عادة 200 إلى 400 مل) إلى وعاء منفصل التي يمكن أن تكون مغلقة بإحكام، وتجنب استنشاق . - الموت ببطء الفئران مع أسلوب معتمد للقتل الرحيم تحت التخدير. لفترة وجيزة، إدراج الماوس الى غرفة استنشاق مع 2.5٪ الأيزوفلورين في الأكسجين من المرذاذ الأيزوفلورين، انتظر حتى 20 ثانية بعد الماوس توقف تتحرك للتحقق من ردة فعل دواسة. عندما منعكس دواسة هو سلبي، الموت ببطء الماوس الدراسة من قبل خلع عنق الرحم 6.
ملاحظة: أساليب القتل الرحيم تتطلب موافقة لجنة الأخلاقيات المؤسسية. - إزالة الجلد المغطي hindlimb القاصي وقطع الأوتار الأمامية البعيدة فقط فوق الكاحل مع ديس غرامة نقطةمقص ction. فهم الأوتار القاصي مع ملقط غرامة وسحب بلطف صعودا ونحو الركبة في حين خفض فآسيا الجانبية للافراج عن العضلات. سحب العضلات من عمودي من الركبة واجراء خفض النهائي لاستئصال عضلة TA 7.
ملاحظة: يتم استخدام عضلة TA هنا كمثال على ذلك، ولكن أي فأر العضلات والهيكل العظمي أو قلب يمكن أن تكون بديلا للTA في هذا البروتوكول إذا كان ذلك مناسبا لأهداف تجريبية للمستخدم. والقيد الوحيد هو أن الأنسجة يجب أن تكون صغيرة بما يكفي لتحقيق الحفظ بالتبريد السريع في جميع أنحاء عمقها. ينصح حجم الأنسجة الحد الأقصى من 1 سم × 1 سم. - كرر على الساق المعاكسة، وتشريح خارج أي الأنسجة الأخرى التي يتعين جمعها. أداء تشريح في أسرع وقت ممكن للحد من تدهور الأنسجة قبل الحفظ بالتبريد.
- توجيه كل عضلة على المقاطع العرضية على الفلين وصفت مسبقا لها. الوقوف عضلة عمودي على الفلين مع وتر البعيدة لمس الفلين والجزء العلوي من تحويلة العضلاتإنهاء بعيدا، مرفوعة من قبل ساترة.
- Cryopreserve جميع أنسجة للتحليل النسيجي في أقرب وقت ممكن بعد تشريح، ويفضل في غضون 5 دقائق ولكن بالتأكيد ليست أكثر من 15 مرة دقيقة انقضت منذ euthanization من المصدر الحيواني.
- الحفظ بالتبريد
- تبدأ تبريد حمام الحفظ بالتبريد خمس دقائق قبل نهاية تشريح. صب 2-methylbutane إلى دورق المعادن مفتوحة على عمق حوالي 3 سم. صب النيتروجين السائل في وعاء معزول على عمق 2-4 سم. تعيين كوب من 2 methylbutane في النيتروجين السائل. وسوف تبدأ النيتروجين في الغليان. تجنب الرش النيتروجين في الكأس 2-methylbutane.
تنبيه: إعداد تجميد حمام في غطاء الدخان أو منطقة جيدة التهوية. - إدراج مقياس الحرارة درجات الحرارة المنخفضة إلى منطقة methylbutane 2 لمراقبة درجة الحرارة واثارة في كثير من الأحيان مع مفترق لضمان حتى يبرد. الاستمرار في إثارة وبارد حتى 2-ليthylbutane تصل إلى -140 درجة مئوية، مضيفا النيتروجين السائل الجديد إلى الحمام الخارجي عند الضرورة.
ملاحظة: -140 درجة مئوية هي درجة الحرارة المثلى للحد من القطع الأثرية وضوح الشمس الجليد في العضلات المخططة. الأنسجة الأخرى قد cryopreserve أفضل عند درجات حرارة مختلفة (على سبيل المثال، الدماغ، -90 درجة مئوية). - تطبيق الراتنج تضمين فقط إلى انخفاض 35-50٪ من العضلات حيث يلتقي الفلين وإسقاط فورا الفلين إلى منطقة methylbutane 2 في -140 درجة مئوية. تكرار بسرعة لمدة تصل إلى 8 الأنسجة لكل دفعة التجميد. يحرك المزيج لمدة 30 ثانية وتجريف قاع الكأس للتأكد من أن الأنسجة لا تجميد في ترسيخ 2-methylbutane.
- استخدام شوكة، ملعقة فترة زمنية محددة أو ملقط كبيرة لسحب كل الفلين الأنسجة من-methylbutane 2. بسرعة إزالة ساترة، ربت الزائدة 2-methylbutane في الكأس، ثم إسقاط الفلين الأنسجة في حمام النيتروجين الخارجي. أكرر للجميع الفلين المتبقية في الكأس.
- بنقل العينات في النيتروجين السائل أو على الجليد الجاف ل-80 درجة مئوية الثلاجة لمدة التخزين.
- إذا تبقى أي أنسجة لحفظ البرودة، كرر الخطوات من 1.2.3 إلى 1.2.4. إضافة إضافي 2-methylbutane إلى الدورق أو النيتروجين السائل إلى الحمام الخارجي حسب الضرورة وإعادة بارد إلى -140 درجة مئوية. التخلص من استخدام 2-methylbutane كنفايات خطرة.
- تبدأ تبريد حمام الحفظ بالتبريد خمس دقائق قبل نهاية تشريح. صب 2-methylbutane إلى دورق المعادن مفتوحة على عمق حوالي 3 سم. صب النيتروجين السائل في وعاء معزول على عمق 2-4 سم. تعيين كوب من 2 methylbutane في النيتروجين السائل. وسوف تبدأ النيتروجين في الغليان. تجنب الرش النيتروجين في الكأس 2-methylbutane.
2. جمع Cryosections لعلم الأنسجة والحمض النووي الريبي التطبيقات
- تجهيز.
- قبل تزن أنبوب تعقيمها الدناز / ريبونوكلياز خالية على الميزان التحليلي. ثم، نقله الى غرفة ناظم البرد إلى precool. كرر حتى أنابيب جاهزة لجميع العينات cryosection المجمعة التي يتعين جمعها.
- لباجتزاء الهيكل العظمي والعضلات، تأكد من أن درجة حرارة الغرفة ناظم البرد هي -21 إلى -22 درجة مئوية بحلول الحرارة الداخلية. نقل أي حاويات مع الأنسجة إلى أن يقتطع من الغرفة وتسمح للحاوية (ق) لكي تتوازن إلى درجة حرارة ناظم البرد لمدة 15 دقيقة على الأقل قبل الافتتاح.
- إدراج شفرة ناظم البرد المتاح جديدة. بالتناوب، وإزالة شفرة الحالية، رذاذ مع ريبونوكلياز الحل إزالة التلوث، وشطف مع ده 2 O، وإعادة تركيبها في ناظم البرد لتبرد. رش منديل نظيف مع 70٪ من الإيثانول ويمسح بعناية شفرة وشفرة منصة لقط.
- رش منديل نظيف مع محلول تطهير ريبونوكلياز والقضاء فرش ناظم البرد. رش الأنسجة مع ده 2 O، مسح فرش مرة أخرى وتضعها في الغرفة ناظم البرد على سطح نظيف.
تنبيه: يجب تغطية شفرة ناظم البرد من قبل حارس سكين عندما لا تكون قيد الاستعمال. أيضا، ريبونوكلياز الحل إزالة التلوث السام وسوف تجمد لتشكيل راسب في الغرفة ناظم البرد الباردة. وبالتالي، التعامل معها بحذر وتجنب استخدامه في الغرفة ناظم البرد.
- رش منديل نظيف مع محلول تطهير ريبونوكلياز والقضاء فرش ناظم البرد. رش الأنسجة مع ده 2 O، مسح فرش مرة أخرى وتضعها في الغرفة ناظم البرد على سطح نظيف.
- داخل غرفة ناظم البرد، وضع قطرة سنتات الحجم (حوالي 300 ميكرولتر) من تضمين الراتنج على تشاك عينة الدافئ، وضع الفلين الأنسجة على الجزء العلوي من الراتنج، واضغط لأسفل، ثم قم بتعيين تشوك في الابeezing السكك الحديدية أو على عنصر تجميد سريع إذا كانت متوفرة.
- بعد تضمين يتصلب الراتنج (أبيض)، إضافة الراتنج تضمين إضافية على أعلى من الفلين، حول انخفاض 35٪ من الأنسجة واضغط على مستخرج الحرارة في الراتنج تضمين لتجميد سريع لتحقيق الاستقرار في أفضل الأنسجة. انتظر 5 دقائق قبل باجتزاء للسماح للراتنج لتتصلب تماما.
- تأكد من أن المشبك العينة في الموقف الأكثر تراجع لها، الأبعد من النصل. إدراج تشاك عينة الأنسجة في المشبك العينة.
- إعداد Cryosection.
- قم بفك حامل الناقل شفرة، تعيين زاوية تطهير النصل إلى 10 درجة (أو زاوية مناسبة للناقل شفرة المستخدمة)، وإعادة تشديد. الافراج عن الفرامل وتحويل عجلة اليد لخفض عضلة نحو النصل. تقدير أقرب مسافة بين الأنسجة وشفرة، ثم نقل الأنسجة بعيدا عن شفرة وإشراك الفرامل عجلة اليد.
- تخفيف LEVE تعديل الارتفاعص ونقل الناقل شفرة إلى الأمام أو الخلف، على التوالي، وإذا كانت نهاية الأنسجة أكثر من حوالي 2 ملم من شفرة أو إذا كانت شفرة يضرب الأنسجة. تشديد وخفض الأنسجة مرة أخرى للتحقق المسافة من شفرة. تكرار التعديلات حتى نصل هي 1-2 ملم من نهاية الأنسجة عن طريق تقدير البصرية.
- خفض الأنسجة نحو النصل وتقييم زاوية الأنسجة لالمقاطع العرضية. قفل عجلة اليد والافراج عن رافعة عينة المشبك. دفع المشبك عينة اليمين أو اليسار حتى اتجاه أفقي من النسيج هو عمودي على النصل.
- دفع عينة المشبك أعلى أو لأسفل لضبط اتجاه "ص" بحيث أقسام الأنسجة سيكون عمودي على محور طويل من العضلات. تشديد رافعة عينة المشبك.
- استخدام بالطبع وغرامة التغذية إلى الأمام لدفع عينة حتى مجرد تلامس شفرة. إذا طلب مقاطع من عمق الأنسجة معين، إعادة مبلغ القسم سمك من الصفر (العلوي من الأنسجة).
- تعيين ناظم البرد إلى تقليص وظيفة مع سمك الباب 30 ميكرون. قص وتجاهل المقاطع حتى يتم الوصول إلى عمق انتقاؤه لجمع الأنسجة (على سبيل المثال، 400 ميكرون من أعلى).
- جمع cryosections لاستخراج الحمض النووي الريبي.
- فتح أنبوب للأقسام جمع ووضعه بالقرب من الناقل شفرة. استخدام، فرشاة نظيفة تبرد قبل أن تلتقط كل قسم كما هو قطع عليه من النصل ونقل cryosection في أنبوب. كرر حتى تزن الأقسام المجمعة 30 ملغ أو الوصول إلى عمق الأنسجة المطلوب.
ملاحظة: للحصول على الظنبوبي الأمامي الماوس الكبار، وجمع من عمق الأنسجة من حوالي 400 إلى 4000 ميكرومتر عادة ينتج 25 - 40 ملغ. باستخدام الملقط المعدني لنقل المقاطع لأنبوب جمع لا ينصح كما تميل الأقسام التمسك وتتجمع على سطح المعدن. - إذا تضمين الراتنج يحيط cryosection العضلات، وقفل فرملة اليد واستخدام شفرة حلاقة ليحلق قطع صغيرة من الراتنج حتى لا يوجد سوى طبقة رقيقة حول الجزء العلوي من العضلات. قطع دائما الراتنج مع شفرة الزاوية بعيدا عن العضلات.
ملاحظة: هناك طبقة رقيقة من تضمين الراتنج أمر لا ينتقص كثيرا من إعداد RNA المصب. إذا الراتنج تضمين اسمك موجودا، استخدام فرش لندف بعيدا عن العضلات قبل أن ينتقل إلى cryosection في أنبوب جمع. - بدلا من ذلك، أقسام تجمع على الناقل شفرة ونقل بكميات كبيرة إلى أنبوب جمع.
ملاحظة: ومع ذلك، فإن هذا الأسلوب يميل إلى أن يكون أبطأ، وأكثر عرضة للعصا وتتجمع معا، والتي يمكن أن تقلل من كفاءة التجانس إبرة في خطوات لاحقة أقسام. - المكان بسرعة أنبوب cryosection المجمعة إلى التحليلي التوازن وأنبوب سجل الوزن. العودة فورا الأنبوب إلى غرفة ناظم البرد الباردة للحفاظ على درجة حرارة الجزء بالقرب -20 درجة مئوية. حساب الوزن من المقاطع المجمعة.
ملاحظة: إذا RNA العزلة سيحدث على الإعلاناليوم ifferent، وتخزين أنبوب cryosection المجمعة في -80 درجة مئوية حتى الاستخدام.
- فتح أنبوب للأقسام جمع ووضعه بالقرب من الناقل شفرة. استخدام، فرشاة نظيفة تبرد قبل أن تلتقط كل قسم كما هو قطع عليه من النصل ونقل cryosection في أنبوب. كرر حتى تزن الأقسام المجمعة 30 ملغ أو الوصول إلى عمق الأنسجة المطلوب.
- جمع cryosections لالأنسجة.
- اضغط على زر سمك مقطع لغرامة باجتزاء واستخدام السهام لضبط قسم ناظم البرد سمك إلى 7 ميكرون (أو غيرها من القسم المناسب سمك، وعادة 6-10 ميكرون).
ملاحظة: أرق المقاطع (6-10 ميكرون) وينبغي أن تستخدم للتطبيقات النسيجية لضمان الكواشف تلطيخ يمكن ان تخترق عمق قسم الأنسجة. الشرائح الرقيقة التي يمكن اتخاذها من أي عمق أثناء cryosectioning، ولكن يفضل أقسام أعمق لتضمين الراتنج، الأمر الذي يزيد مع عمق الأنسجة، أمر لا ينتقص تلطيخ النسيجي. - قص وتجاهل 4-7 أقسام للحصول على سطح الأنسجة ثابت حتى. جعل علما عمق الأنسجة.
- قطع جزء وتوجيهه على سطح حاملة شفرة. التقاط القسم من قبل بسرعة وبلطف لمس الدافئة (درجة حرارة الغرفة) شريحة المجهرإلى قسم على الناقل شفرة. العودة الشريحة إلى درجة حرارة الغرفة. تستمر حتى يتم الحصول على عدد من الشرائح المطلوب. جعل علما عمق الأنسجة النهائي.
ملاحظة: جمع قسم ثان (مكررة) لكل الأنسجة ويوصى. - مع باجتزاء كاملة، إشراك فرامل العجلات جهة، والعودة العينة إلى موقف الخلفي معظم، وإزالة تشاك الأنسجة. استخدام عنصر الحرارة ناظم البرد لإذابة الراتنج تضمين عقد الفلين الأنسجة على تشاك العينة. إزالة الفلين الأنسجة، وتجف مع الأنسجة، والعودة إلى التخزين.
- كرر من الخطوة 2.1.2 لكل الأنسجة المتبقية. تسمح الشرائح لتجف لمدة 20 دقيقة بعد تم تركيب الأنسجة الماضية. ثم، استخدم الشرائح لالنسيجية أو تلطيخ مناعي أو التجميد في -80 درجة مئوية في مربع الشريحة لحين الحاجة إليها.
- اضغط على زر سمك مقطع لغرامة باجتزاء واستخدام السهام لضبط قسم ناظم البرد سمك إلى 7 ميكرون (أو غيرها من القسم المناسب سمك، وعادة 6-10 ميكرون).
3. عزل الحمض النووي الريبي من مجمع Cryosections
- استخراج الحمض النووي الريبي
- أنبوب نقل (ق) من cryosections المجمعة إلى جليد. على الفور إضافةالعضوية كاشف استخراج الحمض النووي الريبي في نسبة حوالي 1 مل كاشف لكل 50 ملغ الوزن cryosection، وعادة 600 ميكرولتر في أنبوب.
تنبيه: RNA الكواشف العزلة سامة، قابلة للتآكل، ومزعجة. اتبع إرشادات الشركة المصنعة للتعامل الآمن. - باستخدام حقنة 1 مل مع إبرة قياس 18، واستخلاص الحمض النووي الريبي استخراج السائل صعودا وشطف جدران الأنبوب حتى يتم تعليق جميع الأنسجة في الحل. محاولة للحد من فقاعات الهواء خلال التجانس إبرة.
- استخدام غيض من الإبرة إلى الهريس وتفريق أي cryosections وقطع تجمعت التمسك جدار الأنبوب. يسحن إلى التجانس عن طريق تمرير العينة صعودا وهبوطا من خلال إبرة لخمس ضربات، ثم يعود العينة إلى جليد. كرر الخطوتين 3-5 مرات، أو عدة مرات كما هو ضروري لتعطيل كافة كتل وتمرير العينة بسهولة من خلال إبرة.
- إزالة إبرة قياس 18 واستبدالها مع إبرة قياس 22. بعناية آرiturate العينة لخمس ضربات، ثم يعود العينة إلى جليد. كرر سحن 3-4 مرات للتحقيق جناسة الأنسجة جدا تفرق بدقة.
ملاحظة: إذا بدأت جزيئات الأنسجة لمنع الإبرة عند وضع العينة، وطرد كل عينة من حقنة والتبديل إلى إبرة قياس 18 للمزيد من التجانس. خطوة سحن إضافية مع إبرة 25 أو 26 مقياس يمكن أن تضاف إلى الحصول على العائد القصوى. ومع ذلك، فإن إبرة يمكن أن تصبح مسدودة حتى لا يكون هناك خطر من عينة إراقة. - نقل عينة من الجليد إلى درجة حرارة الغرفة. احتضان لمدة 5 دقائق لتعطيل المجمعات الجزيئية.
- في غطاء الدخان، إضافة 0.1 مل من 1-برومو-3-chloropentane (BCP) في 1 مل من كاشف RNA العزلة المستخدمة (الخطوة 3.1.1)، وعادة 60 ميكرولتر في الأنبوب. هز أنبوب بقوة باليد لمدة 15 ثانية (لا الدوامة). احتضان العينة في درجة حرارة الغرفة لمدة 2 إلى 3 دقائق. ثم، الطرد المركزي لمدة 15 دقيقة في 12000 x ج و 4 درجات مئوية.
الحذر: BCP غير قابلة للاشتعال والسامة. التعامل في غطاء الدخان وارتداء القفازات، معطف المختبر، ونظارات السلامة. - بعناية جمع المرحلة المائية العليا (عديم اللون) التي تحتوي على الحمض النووي الريبي وتحويلها إلى أنبوب نظيفة. إضافة حجم مساو من 70٪ من الإيثانول (في الماء DEPC) ودوامة لخلط. يحضن في درجة حرارة الغرفة لمدة تصل إلى 10 دقيقة.
ملاحظة: في الطور البيني المتوسطة والدنيا مراحل الفينول BCP يمكن معالجتها عن الحمض النووي الجيني والبروتين، على التوالي، وفقا لتعليمات الشركة المصنعة أو المجمعة في الفينول BCP حاوية النفايات الخطرة للتخلص المناسب.
- أنبوب نقل (ق) من cryosections المجمعة إلى جليد. على الفور إضافةالعضوية كاشف استخراج الحمض النووي الريبي في نسبة حوالي 1 مل كاشف لكل 50 ملغ الوزن cryosection، وعادة 600 ميكرولتر في أنبوب.
- تنقية الحمض النووي الريبي.
- اتبع إرشادات الشركة المصنعة لعينة ملزمة، غسل وشطف مع اختلافات طفيفة 8. فمثلا:
- وضع قسامة من المياه الدناز / ريبونوكلياز خالية في حمام C 37 درجة أو حاضنة لمرحلة ما قبل الحارة للخطوة 3.2.4.
- إضافة عينة الحمض النووي الريبي من 3.1.8 أعلاه للعمود تنقية وأجهزة الطرد المركزي العينة لمدة 15 ثانيةفي 12000 x ج في درجة حرارة الغرفة. صب التدفق من خلال العودة الى نفس العمود وإعادة الطرد المركزي. كرر وقت إضافي واحد لتحقيق أقصى قدر من الحمض النووي الريبي ملزمة، ومن ثم التخلص من تدفق النهائي من خلال.
- تنفيذ الخطوات غسل وفقا لتعليمات الشركة الصانعة 8. تطبيق 700 ميكرولتر من غسل العازلة (لا الإيثانول) إلى العمود، وتدور لمدة 15 ثانية في 12000 x ج، وتجاهل التدفق من خلال.
- إضافة 500 ميكرولتر من غسل العازلة (الإيثانول) إلى العمود، وتدور لمدة 15 ثانية في 12000 x ج، وتجاهل التدفق من خلال. كرر هذه الخطوة لمرة واحدة.
- تدور العمود الفارغ لمدة 1 دقيقة في 12000 x ج لتجف الغشاء.
- نقل عمود الدوران إلى RNase- نظيفة، خالية من أنبوب الدناز. إضافة 40 ميكرولتر من الدناز / الماء قبل حرارة ريبونوكلياز خالية (من 3.2.1) إلى مركز للغشاء العمود. في درجة حرارة الغرفة، واحتضان لمدة 2 دقيقة ثم الطرد المركزي لمدة 2 دقيقة في 12000 ز س.
ملاحظة: حجم شطف 40 ميكرولتر ما يقرب من 1.3 ميكرولتر لكل ملغ من الأصليالأنسجة لمدة 30 ملغ من cryosections المجمعة. ضبط حجم شطف بما يتناسب مع مختلف الأوزان الأنسجة الانطلاق، ولكن لا تقلل أقل من 32 ميكرولتر. ، يمكن إضافة شطف الثاني، وذلك باستخدام ما يقرب من 0.7 ميكرولتر لكل ملغ من الأنسجة الأصلية لزيادة المحصول الكلي الحمض النووي الريبي. - تحليل الحمض النووي الريبي (العمود شطف) للتركيز ونقاء من قبل معمل، الكهربائي، و / أو bioanalyzer. تخزين الحمض النووي الريبي في -80 درجة مئوية لحين الحاجة إليها لتطبيقات المصب، مثل النسخ العكسي لPCR الكمي (4).
ملاحظة: ينصح العلاج الدناز قبل استخدام الحمض النووي الريبي في التطبيقات المصب. هذا العلاج لا يمكن أن يؤديها على بعض الأعمدة تنقية الحمض النووي الريبي قبل خطوة الغسيل، وعند هذه النقطة المحددة التالية العمود شطف، أو على قسامة من الحمض النووي الريبي كخطوة أولى في أي تطبيق المصب. وينبغي أن يكون الحمض النووي الريبي مستقرا لعدة سنوات.
4. تحليل النسيجي بواسطة مناعي Staininغرام من Cryosections العضلات
- بروتوكول المناعي بسيط.
- استخدام قلم مسعور للدوران حول مجموعة من الفروع في كل شريحة. إسقاط بلطف برنامج تلفزيوني في منطقة حلقت (حوالي 80 ميكرولتر لمساحة صغيرة تصل إلى 500 ميكرولتر لمساحة كبيرة)، والحرص على عدم لمس الأنسجة. احتضان لمدة 5 دقائق في درجة حرارة الغرفة.
ملاحظة: في حالة استخدام شرائح المجمدة، وإزالة الشرائح من -80 درجة مئوية الفريزر ويحضن في درجة حرارة الغرفة لمدة 20 إلى 30 دقيقة إلى ذوبان الجليد والجافة، ثم المضي قدما على النحو الوارد أعلاه. وهناك حاجة إلى اثنين على الأقل من الشرائح: شريحة تجريبية واحدة إلى أن حضنت في الأجسام المضادة الأولية والثانوية. ويتم استبعاد شريحة واحدة التحكم الذي الضد الابتدائي، و "الثانوية فقط" السيطرة. - تلميح الشريحة صب قبالة برنامج تلفزيوني. إضافة 5٪ المصل حمار في برنامج تلفزيوني (عرقلة الحل) إلى منطقة دائري. كن حذرا للتأكد من أن أقسام العضلات لا تجف. يحضن في درجة حرارة الغرفة لمدة 30 دقيقة (أو حتى عدة ساعات في غرفة الرطوبة).
- يعد حل الأجسام المضادة الأولية لتحليل تجديد العضلات. مزيج عرقلة الحل، مع الأجسام المضادة eMHC (01:40)، والأجسام المضادة ColVI (1: 1000). إعداد ما يقرب من 150 ميكرولتر 300 ميكرولتر أو 500 ميكرولتر للشركات الصغيرة والمتوسطة، أو المناطق شريحة كبيرة، على التوالي. دوامة لمدة 5 ثوان، ثم الطرد المركزي لمدة 2 دقيقة في 15000 x ج لتكوير أي راسب.
- للشرائح التجريبية، تقلب الشريحة صب قبالة عرقلة الحل ثم قم بإضافة حل الأجسام المضادة الأولية من 4.1.3. للشريحة تحكم الثانوية، تقلب الشريحة صب قبالة عرقلة الحل ثم قم بإضافة عرقلة الحل الطازجة (أي الأجسام المضادة). احتضان الشرائح في غرفة الرطوبة في 4 درجات مئوية خلال الليل.
ملاحظة: عندما pipetting لحلول الأجسام المضادة على الشرائح، دائما سحب السائل من أعلى الأنبوب حل الأجسام المضادة الأولية، لا تعطيل أي راسب في الجزء السفلي من الأنبوب. - نصيحة الشرائح صب قبالة حل. إضافة برنامج تلفزيوني قطرة قطرة إلى المنطقة حلقت من كل شريحة لغسل، تلميح إلى صبالخروج، ثم إضافة المزيد من برنامج تلفزيوني واحتضان لمدة 3 إلى 5 دقائق. كرر ما مجموعه ثلاثة يغسل.
ملاحظة: الساعة غسل مرنة للغاية ويمكن أن تطول مدة تصل إلى 20 دقيقة إذا رغبت في ذلك. عموما، فإن عددا من التغييرات الحل هو أكثر أهمية من ذلك الوقت. - يعد حل الضد الثانوية لجميع الشرائح (بما في ذلك الشريحة تحكم الثانوية) باستخدام 1: 500 التخفيف من الأجسام المضادة الثانوية الحمراء والخضراء إلى جانب fluorophore للكشف IgG1 الماوس (eMHC) والأرنب مفتش (ColVI) و 1: 10000 التخفيف من دابي النووية وصمة.
- على سبيل المثال، مزيج 1 ميكرولتر من دابي مع 9 ميكرولتر من ده 2 O لجعل 01:10 التخفيف من دابي. ثم، ل500 الحجم النهائي ميكرولتر، إضافة 1.0 ميكرولتر مكافحة فأر IgG1 الحمراء + 1.0 ميكرولتر المضادة للأرنب، مفتش الأخضر + 0.5 ميكرولتر من 01:10 دابي إلى 447.5 ميكرولتر من عرقلة الحل. دوامة لخلط وأجهزة الطرد المركزي لمدة 2 دقيقة في 15000 x ج لتكوير أي راسب.
ملاحظة: من الناحية المثالية، ينبغي أن تكون جميع الأجسام المضادة الثانوية من الأنواع المضيفة نفسها.
- على سبيل المثال، مزيج 1 ميكرولتر من دابي مع 9 ميكرولتر من ده 2 O لجعل 01:10 التخفيف من دابي. ثم، ل500 الحجم النهائي ميكرولتر، إضافة 1.0 ميكرولتر مكافحة فأر IgG1 الحمراء + 1.0 ميكرولتر المضادة للأرنب، مفتش الأخضر + 0.5 ميكرولتر من 01:10 دابي إلى 447.5 ميكرولتر من عرقلة الحل. دوامة لخلط وأجهزة الطرد المركزي لمدة 2 دقيقة في 15000 x ج لتكوير أي راسب.
- تلميح الشرائح صب قبالة غسل برنامج تلفزيوني الماضي. إضافة حل الضد الثانوية لتغطية جميع أنسجة. تغطية الشرائح لحمايتها من الضوء ويحضن في درجة حرارة الغرفة لمدة 30 دقيقة.
ملاحظة: يجب التحقق من صحة جميع الأجسام المضادة الثانوية لديهم الحد الأدنى من التفاعل عبر مع الأنواع الأخرى في التجارب وضع العلامات المزدوجة. - تغسل الشرائح كما هو موضح في 4.1.5. بعد غسل الماضي، تقلب الشريحة لتخلصي من برنامج تلفزيوني ووضع الشريحة على الأنسجة. إضافة 3-4 قطرات من وسائل الإعلام تصاعد مائي على طول جانب واحد.
- تعيين حافة ساترة الزجاج فقط إلى الحافة الخارجية من وسائل الإعلام في تصاعد مستمر. باستخدام ملقط، خفض ببطء ساترة نحو الأنسجة، ثم، والإفراج عن ساترة وبلطف اضغط عليها في الموقف. أخيرا، اضغط بلطف كل ركن من أركان ساترة لتحقيق الاستقرار فيه.
- حماية الشرائح من الضوء وتخزينها في 4 درجات مئوية حتى الاستخدام.
ملاحظة: للتخزين على المدى الطويل، وتطبيق طبقة رقيقة من طلاء الأظافر على طول حافة عشرالبريد ساترة للمساعدة في منع الشريحة من الجفاف.
- استخدام قلم مسعور للدوران حول مجموعة من الفروع في كل شريحة. إسقاط بلطف برنامج تلفزيوني في منطقة حلقت (حوالي 80 ميكرولتر لمساحة صغيرة تصل إلى 500 ميكرولتر لمساحة كبيرة)، والحرص على عدم لمس الأنسجة. احتضان لمدة 5 دقائق في درجة حرارة الغرفة.
- التقييم النسيجي.
- صورة الشرائح باستخدام epifluorescent أو مبائر مع الفلاتر المناسبة للكشف عن eMHC (الأحمر)؛ ColVI (الأخضر)؛ والنوى (الأزرق) دابي الملون، وعادة ما تستخدم لموضوعي 20X 1،5.
- تأكد من أن إشارة الفلورسنت من الشرائح التجريبية تختلف عن الشريحة تحكم الثانوية للتدليل على خصوصية eMHC وColVI كشف 4.
ملاحظة: يجب أن تكون eMHC الألياف تجديد إيجابية واضحة من ما يقرب من 2-7 أيام بعد تعافيه من اصابة في العضلات وبنسب مختلفة في الفئران مع ضمور العضلات. الكولاجين السادس هو موجود في المصفوفة خارج الخلية المحيطة ألياف العضلات والأوعية الدموية، والأعصاب وفي حزم النسيج الضام أكبر من peri- وغمد العضلة. دابي وصمة عار النووية هي مفيدة لتحديد ألياف العضلات مع نواة مركزية مقابل نوى الطرفية مشيرا إلى تجديد الألياف، ووجود طnfiltrating الخلايا. الألياف الميتة أو إصابة قد وصمة عار ضعيفة مع الأجسام المضادة الثانوية الماوس مفتش بسبب الكشف عن الذاتية مفتش أن تخترق الألياف من خلال أغشية العضلات التالفة. - لتحديد تجديد، والتقاط الصور المجهر متداخلة مع بعضها مرشح الفلورسنت عبر كامل الصورة. دمج الصور eMHC، ColVI ودابي لكل موقع ثم محاذاة الصور لإعادة بناء خريطة لكامل القسم 1،5.
- استخدام برامج التحليل، والاعتماد على عدد من eMHC الألياف الإيجابية وعدد من إجمالي الألياف لحساب التجديد الأخير (مجموع الألياف 100 * (# eMHC + ألياف / #)). أيضا، الاعتماد على عدد من الألياف الأنوية مركزيا من مجموع الألياف لقياس تجديد على مدى فترة أطول (100 * (# CN + ألياف / # مجموعه البروتين)) 1،5.
النتائج
cryosection العضلات RNA عالية في الجودة ويوفر العائد كافية لمعظم التطبيقات
وأظهرت التحاليل التي أجريت على ستة عشر الاستعدادات العضلات والهيكل العظمي RNA في الجدول 1 باستخدام 19،4 حتي 41 ملغ من المجمعة الظنبوبي الأمامي (TA) في العضلات من 8 السيطرة على الفئران. كل من اليسار (L) وأعدت الحق العضلات (R) TA في التجارب تجديد مع العضلات التي تم جمعها بعد 3 أيام الحقن العضلي الطولي لل25 ميكرولتر من المياه المالحة أو cardiotoxin 10 ميكرومتر أن يسبب اصابة في العضلات باستخدام أساليب ذكرت سابقا 1. كما هو مبين في الجدول رقم 1، وA260 / 280 نسب لعضلة cryosection RNA وعادة ما تكون قريبة من 2 أو أعلى في هذه العينات التمثيلية. كما يعتبر "النقي" RNA أن يكون A260 / 280 من 2.0 و A260 / 280 من 1،8-2،2، ونقاء العينات cryosection RNA ممتاز 9. وبلغ اجمالي الانتعاش RNA عادة اوفهص 10 ميكروغرام لكل عينة مع غلة 0.18 إلى أكثر من 1 ميكروغرام من الحمض النووي الريبي مجموع لكل ملغ من بدء الأنسجة، وتوفير مواد كافية لمعظم التطبيقات المصب. والجدير بالذكر، كان RNA التركيز، والحمض النووي الريبي مجموع المستخرج، والعائد الحمض النووي الريبي في ملغ من الأنسجة بدءا من العضلات TA 3 أيام إصابة بعد السم أعلى بكثير من من المشرفون الدوليون حقن محلول ملحي. وهذا يشير إلى أن هناك تحسن التجانس عندما تعطل بنية العضلات بسبب الاصابة واسعة النطاق و / أو أن هناك زيادة في النسخ الجيني و / أو الاستقرار الحمض النووي الريبي في 3 يوم تجديد العضلات. تم تقييم استمرار جودة الحمض النووي الريبي بسيط 1X تاي / 1.5٪ هلام الاغاروز الكهربائي من 1 ميكرولتر من العضلات cryosection RNA بعد تم تخزينها العينات عند -20 درجة مئوية لمدة 18 شهرا. أبرز 18S وشرائح 28S الريباسي لا تزال واضحة في عينات مما يدل على الحمض النووي الريبي الجودة العالية، حتى في ظل ظروف التخزين دون المستوى الأمثل (الشكل 1A).
العضلات cryosection RNAتدعم تطبيقات المصب
وعولج واحد ميكروغرام من الحمض النووي الريبي في عينة cryosection المجمعة مع الدناز وعكس نسخه من جزئية الاشعال DT. بعد العلاج ريبونوكلياز، كان إجمالي حجم العكس كتب كدنا] 30 ميكرولتر. تم تشغيل بسيط PCR غير الكمي مع التضخيم الزائد لتأكيد جدوى كدنا]. تم تضخيم عامل عضلي التنظيمي 4 (MRF4)، وهو عامل النسخ upregulated مع تمايز العضلات، وذلك باستخدام بادئات الماوس ذكرت سابقا، بمعنى 5'-CTACATTGAGCGTCTACAGGACC والعقاقير 5'-CTGAAGACTGCTGGAGGCTG 10، من 2 ميكرولتر من قالب باستخدام PCR القياسية. كان هناك قوية، والتضخيم محدد من 234 سنة مضت MRF4 جزء من كلتا العينتين TA [كدنا اليمين واليسار، ولكن ليس RT- (شمل RNA، ولكن لا الناسخ العكسي)، RT ده 2 O (النسخ العكسي مع أي قالب RNA)، أو ده 2 O الضوابط PCR (الشكل 1B). تم تشغيل عينات نفسها في ثلاث نسخ للسيطرة إشارة MRF4 وmOaz1 4 الكمي باستخدام التضخيم النسبي وإشارة مضان السلبي على نظام PCR الوقت الحقيقي. وأعرب عن MRF4 في 0.097 أضعاف في حقن السم الصحيح TA مقارنة حقن محلول ملحي الأيسر TA، وتحسب على أساس طريقة ΔΔCt 4. هذا هو مماثل لتقارير سابقة من انخفاض التعبير MRF4 بعد 3 أيام إصابة السم بسبب فقدان الألياف العضلية الناضجة 11. مقارنة اتساق الرنا cryosection لPCR الكمي، وتمت مقارنة القيم ط لهذا الجين إشارة mOaz1. من ست عينات، تم الكشف عن mOaz1 نسخة بمتوسط ط م من 17.242 ± 1.483 الذاكرة الرقمية المؤمنة، في حين كان المتوسط ط م 36،332 ± 3.61 التنمية المستدامة في عينات السيطرة RT- (ن = 4). التجمع ضيق إشارات mOaz1 ط عبر عينات تشير إلى أن الحمض النووي الريبي معزولة عن cryosections العضلات TA ينفذ كما هو متوقع في تحليل التعبير RNA المصب.
المحافظة على together.within الصفحات = "1"> التقييم النسيجي للcryosections المجاور.
وترد أمثلة من تلطيخ المناعي غير المباشر لل7 ميكرون الظنبوبي أقسام العضلات الأمامية من السيطرة على الفئران littermate بعد 3 أيام حقن السم لكشف الألياف تجديد (الشكل 2). جمعت كلا القسمين من العضلات أقل من 150 ميكرون من المنطقة لاستخدامها في تحليل الحمض النووي الريبي في عمق 4،5-4،6 مم من سطح العضلات القريبة. الميوسين الجنينية السلسلة الثقيلة (eMHC والأحمر) بالكشف عن ألياف تجديد الكولاجين السادس (ColVI والأخضر) الخطوط العريضة لألياف العضلات، والبقع دابي نوى الزرقاء، وفقا لبروتوكول 4. المناطق مع ارتشاح النووي المركزة (إشارة الزرقاء) تشير إلى مواقع الإصابة السم ، يبدو واضحا في تنشيط خلايا eMHC إيجابية العضلات تجديد حديثا. وتستخدم خرائط قسم كاملة مثل هذا المثال لتقدير التجديد عن طريق حساب نسبة embryoniج الميوسين الألياف الثقيلة، معربا عن سلسلة (أحمر، مجدد حديثا) أو الألياف الأنوية مركزيا كما ذكرت سابقا 1. والجدير بالذكر أن هناك ضرر القليل من المستغرب في عضلة TA في الشكل 2A. في حين أن هناك تفاوتا بين الحقن، حقن توكسين نموذجية تؤثر على نسبة أكبر بكثير من حجرة العضلات 1، كما هو مبين في الشكل 2B. لذلك، يشير هذا التحليل النسيجي أن إصابة السم في الشكل 2A كانت ضئيلة ويوفر أداة هامة لتفسير البيانات التعبير الجيني من متجاورة العضلات cryosection عينة الحمض النووي الريبي. إذا كان قد تم استخدام العضلات كلها لإعداد الحمض النووي الريبي طرق طحن القياسية، فإن منطقة الإصابة صغيرة بشكل غير متوقع من هذه العينة جعله النموذجية التي من شأنها أن تحرف التحليلات المصب. بدلا من ذلك، الاقتران الكمي النسيجي من نفس العضلات يسمح القياس المباشر لمدى خطورة الاصابة من المقاطع المتجاورة. وهذا يتيح استخدام incluمعايير سيون / استبعاد لضمان أن جميع العينات المدرجة في الحمض النووي الريبي المصب يحلل تفي بالحد الأدنى الإصابة أو تطبيع من الحمض النووي الريبي التحليلات وفقا لحجم الاصابة.

الشكل 1: تقييم الجودة من الحمض النووي الريبي من Cryosections العضلات المجمعة. أ) 18S و 28S العصابات RNA الريباسي بارزة في الحمض النووي الريبي من cryosections العضلات المجمعة بعد 18 شهرا من إعداد الحمض النووي الريبي. ب) عدم الكمية PCR لMRF4 التالية النسخ العكسي. يشار إلى 200 و 300 فرق بي بي من سلم ال DNA. RT-، عكس رد فعل النسخ مع قالب RNA ولكن لا الناسخ العكسي. RT-H 2 O، النسخ العكسي مع ده 2 O، أي قالب الحمض النووي الريبي. H 2 O، أي سيطرة PCR قالب مع [ده 2 O. في هذه التجارب، تم حقن السم في الجزء الأمامي الظنبوبي الأيمن (RTA) ووا المالحةحقن الصورة إلى اليسار (CLS). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: عينة نسيجية خرائط لالعضلات الدراسات التجديد. A، B) خرائط جمعتها من الظنبوبي احد أقسام العضلات الأمامية بعد 3 أيام حقن السم تظهر أمثلة من الفقراء (A) وطبيعية (ب) الضرر الناجم عن السم. وتظهر المناطق محاصر البيضاء من كل قسم الخرائط كصور أقحم لأعلى مشاهدة التكبير، الأحمر، الميوسين الجنينية سلسلة الثقيلة؛ الأخضر، والكولاجين السادس بروتين المصفوفة خارج الخلية. الأزرق، دابي وصمة عار النووية. شريط الحجم، 100 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
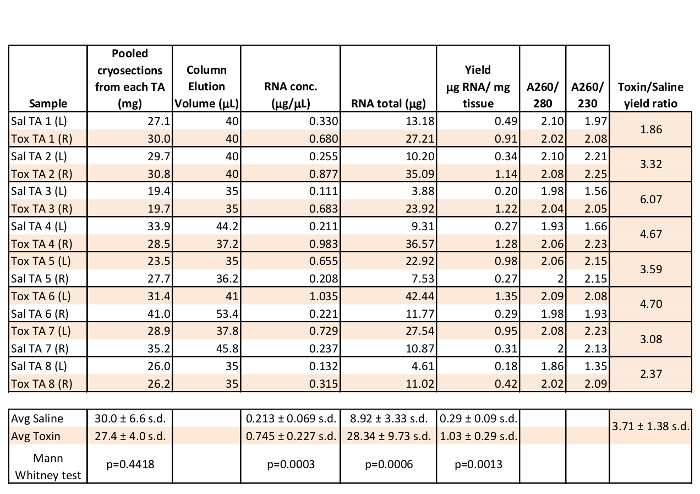
الجدول 1: الممثل RNA المحصول والطهارة قياسات من cryosections العضلات المجمعة. ومقطوع ستة عشر الظنبوبي الأمامي (TA) العضلات وتمت معالجة عينات cryosection المجمعة عن الحمض النووي الريبي. تم تحليل الحمض النووي الريبي المنقى (1 ميكرولتر) مع nanospectrophotometer. أجريت إحصاءات عمود في جدول، وأجريت مقارنات المجموعة باستخدام البرامج الإحصائية.
Discussion
لتحقيق أفضل النتائج مع هذا الأسلوب، والحفاظ على تضمين الراتنج يقتصر على الثلث السفلي أو نصف العضلات أثناء الحفظ بالتبريد الأنسجة بسبب الراتنج الزائد سيتباطأ جمع cryosections المجمعة وقد يزيد تضمين تلوث الراتنج في عزل الحمض النووي الريبي. أيضا، عناية فائقة خلال التجانس إبرة مهم لتعظيم العائد وتقليل احتمال انسداد الإبرة. يجوز تعديل بروتوكول باستخدام محقنة لور-لوك لحماية ضد فقدان العينة إذا أصبح الإبرة منعت ويتطلب ارتفاع ضغط لإزاحة تسد. خطوة إضافية إبرة التجانس مع 25 أو 26 إبرة قياس ويمكن أيضا أن تضاف إلى إنتاج تعليق الأنسجة الدقيقة لزيادة تعزيز العائد الحمض النووي الريبي. في حين يمكن أن تكون بديلا الكلوروفورم لBCP، هذا غير مستحسن كما BCP هو أقل سمية والنتائج في خفض مستويات التلوث الحمض النووي الجيني في المرحلة المائية أثناء استخراج العضوية من الحمض النووي الريبي (12). في ازديادكما لا ينصح سمك مقطع لcryosections تجمع أكثر من 30 ميكرون كما التجانس سيكون أقل كفاءة.
إذا العائد RNA أقل من المستوى المطلوب، يمكن توظيف استراتيجيات مختلفة لزيادة الانتعاش مثل: أ) زيادة كمية مليغرام من بدء المادية لزيادة احتمال العائد. ب) تقليل سمك الباب أقل من 30 ميكرون لتحسين تجانس الميكانيكية للأنسجة. ج) زيادة مدة عينة حضانة والتجانس إبرة في الكاشف استخراج العضوي لتحسين اختلال الميكانيكية والنسيج الكيميائية. والرابع) إذا ظلت قطع الأنسجة، نفذ خطوة استخراج الثانية مع تجانس إبرة أكثر صرامة. بدلا من ذلك، قد تكون هناك اعتبارات الأنسجة محددة، مثل فصل المرحلة وهطول الأمطار خطوات إضافية للعينات ذات المحتوى بروتيوغليكان عالية (13). خلال تنقية العمود RNA، وبلغ حجم التداول شطف أكبر يمكن استخدام وأداء لشطف الثاني يمكن أماهximize الكلي الانتعاش RNA، ولكن على حساب من تركيز الحمض النووي الريبي. والكحول هطول الأمطار بعد عمود يمكن استخدامها لتركيز الحمض النووي الريبي إذا تركيز منخفض هو مصدر قلق مع هذا التعديل. إذا تدهور الحمض النووي الريبي هو المشكلة، وتقليل الوقت اللازم لحفظ البرودة أثناء تشريح، والتنظيف أكثر صرامة من الأسطح والأدوات ناظم البرد للحد من التعرض ريبونوكلياز، وأداء الخطوة إبرة التجانس في غرفة باردة، بالإضافة إلى وجود كاشف ريبونوكلياز المانع للcryosections 14، ومتكررة استبدال الحلول المجانية ريبونوكلياز قد تساعد بعضها لمنع أو تقليل التعرض لRNases والحد من النشاط الانقسام. فمن الممكن أن الاستحمام لفترة وجيزة الأنسجة في الكاشف ريبونوكلياز المانع بعد تشريح، ولكن قبل الحفظ بالتبريد، قد يزيد من الحد من تدهور العينة. ومع ذلك، ينبغي إجراء التجارب الأولية لضمان أن أي معاملة من هذا القبيل لا يزيد بلورات الثلج أو غيرها من الأعمال الفنية أثناء الحفظ بالتبريد.
في حين الجنينيةيستخدم ميوسين الثقيلة سلسلة / الكولاجين السادس المناعي غير المباشر هنا كمثال لتحليل العضلات من الإصابة، التي شنت cryosections رقيقة على المجهر الشرائح من هذه التجارب يمكن استخدامها في أي وصمة عار النسيجية ذات الصلة التي يمكن أن تتم في أقسام المجمدة، بما في ذلك تقنيات مناعي مع آخر -fixation وتلطيخ الهيماتوكسيلين / يوزين. في الواقع، قد يكون من الضروري التكيف مع بروتوكول مناعي بسيط المقدمة هنا. على سبيل المثال، الأجسام المضادة الثانوية المضادة للماوس تستخدم للكشف عن الأجسام المضادة الأولية الماوس (على سبيل المثال، eMHC) ويمكن أيضا الكشف عن المناعية الذاتية الماوس في النسيج المستهدف. هذه الأجسام المضادة الذاتية تتراكم عادة في الألياف العضلية التالفة أو الميتة في العضلات المصابة أو التصنع مما تسبب في الخلفية مناعي تلطيخ. وينبغي دائما أن فحص شريحة تحكم الثانوية (مع الأجسام المضادة الأولية حذف) لتقييم خصوصية تلطيخ. إذا خلفية الأجسام المضادة الذاتية هي الإشكالية، وينبغي أن تكون الخطوات قبل كتلةوأضاف أن البروتوكول لمنع أو تقليل الكشف عن المناعية الذاتية الماوس 15.
القيود الرئيسية للالطريقة هي أنه يتطلب ناظم البرد ومن تستغرق وقتا طويلا، مما يجعل من الإنتاجية المنخفضة نسبيا. على سبيل المثال، كان خبيرا في تقنية قادرة على معالجة ما يصل إلى 16 العضلات لcryosections المجمعة وشرائح المجهر (8 الشرائح مع أقسام مكررة من جميع أنسجة 16) في حوالي 9-10 ساعة. بالنسبة للمستخدمين المبتدئين لcryosectioning، وجمع cryosections المجمعة 2-4 عينات يمكن أن يتقن معقول بعد التدريب ناظم البرد ودورات واحد أو اثنين من الممارسة، بدلا من ذلك، استغرق الحصول على cryosections نوعية للعلم الأنسجة المزيد من الخبرة. لذلك، قد العوامل المعدات، والوقت، أو تدريب جعل هذه الطريقة أقل فائدة للأنسجة ليونة التي يمكن أن تكون متجانسة بشكل جيد مع مدقة الخالط اليدوي.
في مقارنة مع طرق التجانس غير ناظم البرد، العضلات المخططة إعداد RNAوقد تم الإبلاغ عن الصورة من الخزعات العضلية مع عوائد RNA من 0،05-،7 ميكروغرام RNA ملغ قبل العضلات 16، وفي الآونة الأخيرة 0،27-1،08 ميكروغرام RNA في ملغ من العضلات 17. ولذلك، فإن تقنية الموضحة هنا توفر عوائد RNA جيدة مثل أو أفضل من الأساليب غير ناظم البرد مع ميزة إضافية تتمثل في تمكين النسيجية يقترن تحليلات من منطقة متجاورة من نفس العينة. والجدير بالذكر أن استخدام الدراسة السابقة أيضا cryosectioning للتجانس في الأنسجة الفقري، ووجدت كذلك أن cryosectioning الأنسجة عززت كفاءة التجانس لعزل الحمض النووي الريبي (13). عندما تم اختبار هذه التقنية في عينات العضلات والهيكل العظمي البقري، كان متوسط العائد الحمض النووي الريبي في إعداد العينات 4.09 ± 0.36 ميكروغرام، في نهاية منخفضة من المعدل الطبيعي ذكرت هنا 13. القبض على الليزر تسليخ مجهري هو بديل آخر لمجموعة من الأنسجة لاستخراج الحمض النووي الريبي من cryosection. القبض على الليزر هو أفضل من هذه الطريقة cryosection المجمعة فيأنه يسمح للخصوصية لجمع مجموعة فرعية فقط المطلوب من الخلايا من الباب، ويمكن أداؤها على قسم الأنسجة واحدة تصل إلى 50 ميكرون سميكة 18. معدات ومع ذلك، وجمع عينة تشريح الصغيرة يمكن أن يكون من الصعب ومناسب ليست متاحة على نطاق واسع، مما يجعل المجمعة cryosection التجانس في متناول الباحثين. عند كل الوسائل المتاحة، تفضيلا لتحليل الأنسجة شبه المنطقة لتطبيق يحتاجون كميات الحمض النووي الريبي الصغيرة فقط يفضلون ملقط ليزر في حين المجمعة cryosection التجانس هو أفضل عند تحليل المنطقة الفرعية أقل أهمية وهناك حاجة إلى كميات أكبر من الحمض النووي الريبي.
بينما الأساليب العزلة النسيجية وRNA هي التركيز هنا، ويتم تكييف طريقة cryosection المجمعة بسهولة لإعداد لست] البروتين لطخة غربية تحليلات أو القياسات نشاط الإنزيم. على سبيل المثال، تم بالفاعلات cryosections المجمعة من القلب لطخة غربية يحلل 4 لالثانية كانت المتجانس cryosections المجمعة من TA لفحوصات النشاط نازعة سكسينات وظيفة الميتوكوندريا 5. بدلا من ذلك، الجينوم الحمض النووي والبروتينات كسور يمكن فصلها عن المراحل الأخرى خلال استخراج العضوية بعد عزل الحمض النووي الريبي، وتقدم إمكانية لاستخلاص الحمض النووي الجيني، والبروتين، RNA، والقياسات النسيجية من الأنسجة واحدة بعد جلسة ناظم البرد واحدة.
وعموما، فإن الميزة الرئيسية لهذه الطريقة لزيادة المرونة التجريبية من خلال تمكين نهج تحليلية متعددة تتطلب إعداد عينة مختلفة من الأنسجة واحدة. هذه الطريقة الأنسب لالعضلات وغيرها من الأنسجة مع داخل الإقليم واسعة النطاق أو هيكل الخلية الذي يقلل من كفاءة تجانس النسيج القائم على مدقة.
Disclosures
The author declares that she has no competing financial interests.
Acknowledgements
Madison Grant, Steven Foltz, Halie Zastre and Junna Luan provided technical assistance. Research reported in this publication was supported by the National Institute of Arthritis and Musculoskeletal and Skin Diseases of the National Institutes of Health under award number AR065077. The content is solely the responsibility of the author and does not necessarily represent the official views of the National Institutes of Health.
Materials
| Name | Company | Catalog Number | Comments |
| Cork | VWR Scientific | 23420-708 | Cut into small squares with a sharp blade. |
| Plastic coverslip | Fisher Scientific | 12-547 | Used to orient the muscle during freezing. |
| Low temperature thermometer | VWR Scientific | 89370-158 | |
| 2-methylbutane | Sigma | M32631-4L | Caution: hazardous chemical. Store in flammable cabinet. |
| Embedding resin: "cryomatrix" | Thermo Fisher Scientific | 6769006 | Other embedding resins can be substituted for cryomatrix. |
| Cryostat | Thermo Fisher Scientific | microm HM550 with disposable blade carrier | Any working cryostat should be sufficient for the protocol. |
| Disposable cryostat blade | Thermo Fisher Scientific | 3052835 | Use an appropriate blade or knife for the cryostat to be used. |
| RNAse decontamination solution: "RNase Zap" | Thermo Fisher Scientific | AM9780 | |
| Analytical balance | Mettler Toledo | XS64 | |
| Paint brush | Daler Rowney | 214900920 | Use to handle cryosections. Can be found with in stores with simple art supplies. |
| Razor blade | VWR Scientific | 55411-050 | |
| Microscope slide | VWR Scientific | 48311600 | |
| RNA organic extraction reagent: TRIzol | Thermo Fisher Scientific | 15596026 | Caution: TRIzol is a hazardous chemical. Note: Only organic extraction reagents are recommended for RNA extraction from skeletal muscle. |
| 18 gauge needle | VWR Scientific | BD305185 | |
| 22 gauge needle | VWR Scientific | BD305155 | |
| 26 gauge needle | VWR Scientific | BD305115 | Optional. Can be used for a third round of sample trituration in the RNA extraction protocol. |
| 1 ml syringe | VWR Scientific | BD309659 | For very high value samples, a Luer-Lok syringe is recommended (e.g., VWR BD309628). |
| 1-bromo-3-chloropentane (BCP) | Sigma | B9673 | |
| For 70% ethanol in DEPC water: 200 proof alcohol | Decon Laboratories, Inc. | +M18027161M | Mix 35 ml 200 proof alcohol + 15 ml DEPC water. |
| For 70% ethanol in DEPC water: DEPC-treated water | Thermo Fisher Scientific | AM9922 | Mix 35 ml 200 proof alcohol + 15 ml DEPC water. |
| RNA purification kit: PureLink RNA minikit | Thermo Fisher Scientific | 12183018A | Final steps of RNA preparation. |
| DNase/Rnase-free water | Gibco | 10977 | DEPC-treated water can also be used. |
| Spectrophotometer: Nanodrop 2000 | Thermo Fisher Scientific | NanoDrop 2000 | |
| Dnase I | Thermo Fisher Scientific | AM2222 | Treat purified RNA to remove any DNA contamination before downstream appications. |
| Hydrophobic pen | Thermo Fisher Scientific | 8899 | |
| Dulbecco's PBS | Gibco | 14190 | PBS for immunofluorescence protocol. |
| Donkey serum | Jackson ImmunoResearch Laoratories, Inc | 017-000-121 | Rehydrate normal donkey serum stock according to the manufacturer's instructions, then dilute an aliquot to 5% for immunofluorescence. Normal goat serum can also be used. |
| eMHC antibody | University of Iowa Developmental Studies Hybridoma Bank | F1.652 | |
| Collagen VI antibody | Fitzgerald Industries | #70R-CR009x | |
| Donkey anti-rabbit AlexaFluor488 | Thermo Fisher Scientific | A21206 | |
| Goat anti-mouse IgG1 AlexaFluor546 | Thermo Fisher Scientific | A21123 | |
| DAPI (4',6-diamidino-2-phenylindole) | Thermo Fisher Scientific | D1306 | |
| Aqueous mounting media: Permafluor | Thermo Fisher Scientific | TA-030-FM | Only use mounting media designed for fluorescent applications with anti-fade properties. |
| Glass coverslip | VWR Scientific | 16004-314 | Use for mounting slides at the end of immunofluorescence protocl |
| Image analysis software: ImageProExpress | Media Cybernetics, Inc. | Image-Pro Express, or more advanced products | Freeware ImageJ should also work for manual counting. More advanced software with segmentation abiities may allow partial automation of the process; e.g., ImageProPremier. |
| Merge and map section images: Photoshop | Adobe | Photoshop | |
| Cardiotoxin | Sigma | C9659 | Sigma C9659 has been discontinued. Other options for cardiotoxin are EMD Millipore #217503; American Custom Chemicals Corp. # BIO0000618; or Ge Script # RP17303; but these have not been validated. |
| reverse transcription kit: Superscript III First-strand synthesis system | Thermo Fisher Scientific | 18080051 | Any validated, high quality reverse transcription reagents can be used. |
| Standard PCR: GoTaq Flexi polymerase system | Promega | M8298 | Any validated, high quality Taq polymerase system can be used. If DNA sequencing is to be used for any application downstream of the PCR, then a high fidelity PCR system should be used instead. |
| SYBR green | Thermo Fisher Scientific | S7585 | For use in qPCR when not using a dedicated qPCR master mix. Use with SuperROX (for Applied Biosystems instruments) and GoTaq Flexi polymerase and buffers. |
| ROX: SuperROX, 15 mM | BioResearch Technologies, Inc. Novato CA | SR-1000-10 | SuperROX is more stable in the PCR reaction, so it is preferred for use as a qPCR passive reference dye over ROX (carboxy-X-rhodamine). For qPCR with Applied Biosystems instruments |
| Real-time PCR | Applied Biosystems | 7900HT |
References
- Foltz, S. J., et al. Abnormal skeletal muscle regeneration plus mild alterations in mature fiber type specification in Fktn-Deficient Dystroglycanopathy Muscular Dystrophy Mice. PLoS One. 11 (1), 0147049 (2016).
- Bartoli, M., et al. Noninvasive monitoring of therapeutic gene transfer in animal models of muscular dystrophies. Gene Ther. 13, 20-28 (2006).
- Ip, W. T., Huggins, C. E., Pepe, S., Delbridge, L. M. Evaluating RNA preparation options for archived myocardial biopsies. Heart Lung Circ. 20 (5), 329-331 (2011).
- Beedle, A. M., et al. Mouse fukutin deletion impairs dystroglycan processing and recapitulates muscular dystrophy. J. Clin. Invest. 122 (9), 3330-3342 (2012).
- Foltz, S. J., et al. Four-week rapamycin treatment improves muscular dystrophy in a fukutin-deficient mouse model of dystroglycanopathy. Skeletal Muscle. 6, 20 (2016).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nat. Protoc. 10, 1612-1624 (2015).
- Rump, L. V., Asamoah, B., Gonzalez-Escalona, N. Comparison of commercial RNA extraction kits for preparation of DNA-free total RNA from Salmonella cells. BMC Res. Notes. 3, 211 (2010).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. J. Vis. Exp. (45), e2565 (2010).
- Valdez, M. R., Richardson, J. A., Klein, W. H., Olson, E. N. Failure of Myf5 to support myogenic differentiation without myogenin, MyoD, and MRF4. Dev Biol. 219 (2), 287-298 (2000).
- Pavlath, G. K., Dominov, J. A., Kegley, K. M., Miller, J. B. Regeneration of transgenic skeletal muscles with altered timing of expression of the basic helix-loop-helix muscle regulatory factor MRF4. Am. J. Pathol. 162 (5), 1685-1691 (2003).
- Chomczynski, P., Mackey, K. Substitution of chloroform by bromo-chloropropane in the single-step method of RNA isolation. Anal. Biochem. 225 (1), 163-164 (1995).
- Lee, J. T. Y., Cheung, K. M. C., Leung, V. Y. L. Extraction of RNA from tough tissues with high proteoglycan content by cryosection, second phase separation and high salt precipitation. J. Biol. Methods. 2 (2), 20 (2015).
- Guo, D., Catchpoole, D. R. Isolation of intact RNA following cryosections of archived frozen tissue. BioTechniques. 34, 48-50 (2003).
- Goodpaster, T., Randolph-Habecker, J. A flexible mouse-on-mouse immunohistochemical staining technique adaptable to biotin-free reagents, immunofluorescence, and multiple antibody staining. J. Histochem. Cytochem. 62 (3), 197-204 (2014).
- Ikezawa, M., Minami, N., Takahashi, M., Goto, Y., Miike, T., Nonaka, I. Dystrophin gene analysis of 130 patients with Duchenne muscular dystrophy with a special reference to muscle mRNA analysis. Brain Dev. 20 (3), 165-168 (1998).
- Majumdar, G., Vera, S., Elam, M. B., Raghow, R. A streamlined protocol for extracting RNA and genomic DNA from archived human blood and muscle. Anal. Biochem. 474, 25-27 (2015).
- Espina, V., Heiby, M., Pieroban, M., Liotta, L. A. Laser capture microdissection technology. Expert Rev Mol Diagnostics. 7 (5), 647-657 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved