Method Article
무 혈청의 수집 및 공급 장치없이 마우스 배아는 세포 자유로운 접근을위한 세포 조절 중간 줄기
요약
이 프로토콜은 혈청에서 파생 마우스 배아 줄기 세포의 수집 (MESC) -conditioned 매체 (MESC-CM)하는 방법을 제공한다 (소 태아 혈청, FBS) - 및 공급 장치 (마우스 배아 섬유 아세포, MEFs에) 셀에 대한 - 무료 조건 - 무료 방법. 이는 노화 및 노화 관련 질환의 치료에 적용될 수있다.
초록
The capacity of embryonic stem cells (ESCs) and induced pluripotent stem cells (iPSCs) to generate various cell types has opened new avenues in the field of regenerative medicine. However, despite their benefits, the tumorigenic potential of ESCs and iPSCs has long been a barrier for clinical applications. Interestingly, it has been shown that ESCs produce several soluble factors that can promote tissue regeneration and delay cellular aging, suggesting that ESCs and iPSCs can also be utilized as a cell-free intervention method. Therefore, the method for harvesting mouse embryonic stem cell (mESC)-conditioned medium (mESC-CM) with minimal contamination of serum components (fetal bovine serum, FBS) and feeder cells (mouse embryonic fibroblasts, MEFs) has been highly demanded. Here, the present study demonstrates an optimized method for the collection of mESC-CM under serum- and feeder-free conditions and for the characterization of mESC-CM using senescence-associated multiple readouts. This protocol will provide a method to collect pure mESC-specific secretory factors without serum and feeder contamination.
서문
이 프로토콜의 목표는 무 혈청 및 공급 장치가없는 배양 조건에서 마우스를 배아 줄기 세포 (MESC) -conditioned 매체 (MESC-CM)를 수집하고 그 생물학적 기능을 특성화하는 것입니다.
일반적으로 배아 줄기 세포 (는 ESC가)에 의한 자기 갱신 1-3에 대한 자신의 다 능성 및 용량에 재생 의학 및 세포 치료에 대한 큰 잠재력을 가지고있다. 그러나 줄기 세포의 직접적인 이식에는 면역 거부 및 종양 형성 4,5- 등 여러 한계를 가지고있다. 따라서, 무 세포 방법은 재생 의료 노화 개입 -6,7- 대한 다른 치료 전략을 제공 할 수있다.
노화는 성장 체포, 변형 된 세포 생리학과 행동의 영구적 인 상태에 의해 특징 조직과 장기의 노화에 휴대 대응으로 볼 수 있습니다. 암을 포함한 널리 질환, 심혈관 질환, t의 주요 위험 인자는 노화2 형 당뇨병을 YPE 및 신경 퇴행 8. 노화의 명백한 특성 중 하나는 줄기 세포 노화 및 배기 (9)에 의해 발생 조직의 재생 가능성의 감소이다. 많은 중요한 연구들은 일관 노화를 지연시키고 수명을 연장 할 수있는 능력을 가지고 라파 9 레스베라트롤 10 및 메트포르민 (11)과 혈액 유래 조직 인자, 즉 12 GDF11 같은 약물 분자를 보여 주었다.
본 연구에서는 MESC-CM은 혈청 요소 및 MEFs에에서 분비 인자의 오염을 제외 혈청없이 (소 태아 혈청, FBS) 및 공급 장치 (마우스 배아 섬유 아세포, MEFs에) 레이어를 수확하고있다. 결과적으로 MESC 별 분비 요인의 정확한 식별을 사용하도록 설정된 무 혈청 및 공급 장치가없는 CM 허용 이러한 조건.
이 제안 된 프로토콜은 상대적으로 매우 효율적인 비용 대비 효과, 쉽게한다작동합니다. 이 기술은 노화 관련 질환 등의 재생에 대한 개입을 향해 안전하고 잠재적으로 유리한 무 세포 치료 방법의 개발에 사용될 수있는 항 노화 효과를 매개 할 수 MESC 유래 가용성 요소의 특성화에 대한 통찰력을 제공한다 트리트먼트.
프로토콜
주 : 무 혈청 피더없는 CM 컬렉션 프로토콜의 개략도는도 1에 도시되어있다.
1. 재료 (MEFs에의 준비, 중간, 플레이트 및 솔루션)
- 문화 MEFs에 중간의 500 ml의를 준비합니다. 10 % FBS (ESC 품질), 50 단위 / ㎖ 페니실린, 50 ㎎ / ㎖ 스트렙토 마이신 둘 베코의 변형 이글의 중간 (DMEM)을 보충합니다.
- 설립 루틴 프로토콜 (13) 다음 배아에서 MEFs에 격리와 MEF 매체를 유지한다.
- 문화에 mESCs를 배지 500 ml의를 준비합니다. DMEM은 15 % FBS와 2 mM L- 글루타민, 100 μM 비 필수 아미노산 (NEAA), 100 μM의 β 머 캅토 에탄올, 100 유닛 / ㎖ 백혈병 억제 인자 (LIF), 50 단위 / ㎖ 페니실린, 50로 보충 ㎎을 / ㎖ 스트렙토 마이신.
- 0.1 % 젤라틴 용액 5 ㎖의 10cm 세포 배양 접시를 도포하여 젤라틴 화 플레이트 (5 젤라틴 화 플레이트 / MESC 1 판)을 준비한다. 적어도 10 분 동안 인큐베이션 실온에서 첨가 하였다.
- mESCs의 무 혈청 조건을 감소 세럼 중간의 500 ml의를 준비합니다. 중탄산 나트륨 1.2 g (PH 7.0) 혈청 미디어 감소 보완. 0.2 μm의 병 톱 필터를 통해 필터링합니다.
- 노화 관련 β - 갈 락토시다 아제 (SA β-GAL) 노화 세포의 검출을위한 염색 액 조제 1 ㎎ / ㎖ X-GAL를 40 mM의 시트르산 / 소듐 포스페이트 완충액 (pH 6.0) (디메틸 포름 아미드, DMF에 용해) 5 mM의 페리 시안화 칼륨, 5mM의 칼륨 페로시 아나이드, 150 mM의 염화나트륨, 2 밀리미터의 MgCl 2 (14).
주의 : (유해) DMF는 독성과 부식성 솔루션입니다. 솔루션을 처리 할 때 개인 보호 복 (예를 들어, 니트릴 또는 라텍스 장갑, 실험실 코트, 고글)을 착용 할 것. 흄 후드를 사용합니다. - 문화 인간 피부 섬유 아세포 (HDFS, NHDF - 광고 - 데르 - 섬유 아세포)에 배지 500 ml의를 준비합니다. 10 % FBS, 100 단위 / ml의 페니실린 및 100 ㎎ / ㎖ 스트렙토 마이신과 DMEM을 보충합니다.
참고 : 세포 배양 생물 안전 후드의 모든 단계를 수행합니다.
- 15cm 세포 배양 접시에 마이 토마 이신 C의 10 ㎍ / ml를 함유 MEF 배지 20 mL로 MEFs에 치료. 37 ° C에서 2 시간 5 % CO 2 품어.
- MEFs에에서 매체를 기음. PBS로 3 회 세포를 씻으십시오. 트립신 EDTA (TE, 1 배)의 3 ML을 추가하고 37 ° C에서 3 분 5 % CO 2 품어. 3 분 후, 300 x g에서 3 분 동안 원심 분리 MEF 매체 6 mL로 중화 TE.
- MEF 배지 5ml에 재현 탁. 트리 판 블루 염색법과 혈구를 사용하여 생성 된 세포 현탁액 중의 세포 수를 결정한다. MEF 배지에서 10 cm 세포 배양 접시 당 2 × 106 세포의 밀도로 불 활성화 된 MEFs 플레이트 (공급). 37 ° C에서 24 시간 5 % CO 2 품어.
- 온 (피더 도금 후 MESC 매체와 MEF 매체 24 시간 교체다음날).
- MESC 매체와 피더에 2 × 106 세포의 밀도로 플레이트 mESCs (G4 F1 하이브리드 ES 세포). 37 ° C에서 48 시간 5 % CO 2 품어.
참고 MESC-CM의 노화 방지 효과가 하부 통로 번호 mESCs는 15-17 사용될 때 예상 강하다. 우리는 Lunenfeld - 타넨 바움 연구소, 마운트 시나이 병원, 25 Orde 거리, 토론토, ON, M5T 3H7, 캐나다에서 박사 안드라스 나기에서 G4 MESC 라인을 인수했다. - 70-80% 서브 합류 상태에서 상대적으로 높은 밀도 및 통로에서 세포를 유지합니다. 매일 신선한 MESC 매체와 매체를 교체합니다.
3. 무 혈청의 수집 및 피더없는 조건 중간 (그림 1B 및 2B)
참고 : 세포 배양 생물 안전 후드의 모든 단계를 수행합니다.
- PBS 5 ㎖로 MESC 판을 씻어. TE (2.5 배)의 1 ML을 추가하고 37 ° C에서 3 분 5 % CO 2 품어. 3 분 후, MESC의 mediu 2 ㎖로 TE를 중화m 및 300 X g에서 3 분간 원심 분리기.
- MESC 매체의 각 젤라틴 코팅 된 배양 접시 (젤라틴 화 플레이트 5 / 1 MESC 판)에 MESC 매체 판 1ml를 5ml에 재현 탁. 37 ° C에서 문화와 5 % CO 2 80 ~ 85까지 %의 포화 상태에 도달한다.
- 세 세척의 총, 세척 당 10 분 동안 세포 (10cm 접시 당 8 ml)에 충당하기 위해 충분한 PBS로 mESCs을 씻으십시오. 37 ° C에서 24 시간 5 % CO 2 절감 세럼 중간에 품어.
주 : 세정 공정은 FBS 오염을 방지하는 것이 중요하다. 이 배양 시간 (18, 19)를 수행하는 것이 중요합니다. - 2,500 × g으로 20 분 동안 50 ML 원뿔 튜브와 원심 분리기에 MESC-CM를 수집합니다. 원심 분리 후 상등액 (CM)를 수집한다. 0.2 μm의 병 톱 필터를 통해 필터링합니다.
마우스 배아 4. 효과 줄기 세포 에어컨 중간 (MESC-CM)
참고 : MESC-CM의 효과는 다음과 같은 몇 가지 방법에 의해 확인되었다SA β-gal을 분석, 세포주기 분석, QRT-PCR.
- SA의 β-gal을 분석 (그림 3A)
- HDF 매체 6- 웰 플레이트에 웰당 2 × 104 세포의 밀도로 시드 HDFS. 37 ℃에서 밤새 인큐베이션하고, 5 % CO 2.
- 밤새 배양 한 후,를 폐기 HDF 매체의 절반은 MESC-CM 및 제어 매체를 추가 할 수 있습니다. 37 ° C에서 72 시간 5 % CO 2 품어. 제어 매체 mESCs의 부재 젤라틴 코팅 접시 (세럼 미디어 감소) 무 혈청 배지로부터 유도된다.
- 두 세척 총 워시 30 초 동안 세포 (6- 웰 플레이트에 2 ㎖) 덮을 PBS로 세포를 세척 하였다. 고정을 위해 3.7 % 파라 포름 알데히드 (PFA)를 추가합니다. 실온에서 5 분 동안 인큐베이션.
주의 : (유해) 파라 포름 알데히드는 독성과 부식성 솔루션입니다. 솔루션을 처리 할 때 개인 보호 복 (예를 들어, 니트릴 또는 라텍스 장갑, 실험실 코트, 고글)을 착용 할 것.흄 후드를 사용합니다. - 고정 용액 대기음. 단계 4.1.3에 설명 된대로 두 번 PBS와 고정 된 세포를 씻으십시오.
- (1-2 ml의 당 잘 6 잘 플레이트)에 SA β-여자 염색 솔루션을 추가합니다. 37 ° C에서 17.5 시간 동안 품어.
주 :이 CO 2 배양기에서 배양 될 수 없습니다. - 동방 β-여자 염색 솔루션을 대기음 단계 4.1.3에 설명 된대로 두 번 PBS로 세포를 씻어.
- 반 염색에 대한 에오신 솔루션을 추가합니다. 실온에서 5 분 동안 인큐베이션. 단계 4.1.3에 설명 된대로 두 번 PBS로 세포를 씻으십시오.
- 후속 분석을 위해 부착 된 디지털 카메라를 사용하여 광학 현미경 캡처 이미지를 사용하여 100 배의 배율에서 이미지 셀.
주 : 세포의 갯수가 블라인드 방식으로 계산 될 수 있고, SA의 β - 갈 양성 푸른 세포의 비율이 계산 될 수있다.
- 세포주기 분석 (그림 3B)
- 의 밀도에 씨앗 HDFSHDF 매체에서 6cm 세포 배양 접시에 웰 당 8 × 104 세포. 37 ℃에서 밤새 인큐베이션하고, 5 % CO 2.
- 밤새 배양 한 후,를 폐기 HDF 매체의 절반은 MESC-CM 및 제어 매체를 추가 할 수 있습니다. 37 ° C에서 24 시간 5 % CO 2 품어.
- 300 x g에서 5 분 동안 3.1 설명한 공정 및 원심 분리와 같이 세포를 Trypsinize. 차가운 PBS 용액으로 세포를 씻으 2,500 X g에서 3 분 동안 두 번 원심 분리기 (PBS 0.5 mM의 염화칼슘 2와 2 % FBS, 1.5 ML 튜브 당 1 ml를 포함). 차가운 PBS 용액 100 ㎕에 재현 탁.
- 텍싱 동안 차가운 에탄올 200 μl를 놓는 방법으로 세포를 고정합니다. 적어도 1 시간 동안 4 ℃에서 보관하십시오.
- 단계 4.2.3에서 설명 된 바와 같이, 회 냉 PBS 용액으로 세포를 세척 하였다.
- 를 50㎍ / ㎖의 RNase를 함유하는 구연산 나트륨 완충액 250 μL (1.12 %, pH가 8.5)에 세포를 재현 탁. 37 ° C에서 30 분 동안 품어.
- 구연산 나트륨 250 μl를 추가버퍼는 50 μg의 / ㎖ 프로피 디움 요오드를 포함. 실온에서 20 분 동안 인큐베이션.
- 20 유세포 분석을 이용하여 각각의 샘플에서 10,000 세포를 측정한다.
- QRT-PCR (그림 3C)
- 단계 4.1.1과 4.1.2에 설명 된대로 씨 HDFS하고, MESC-CM을 추가합니다.
- 제조사의 프로토콜에 따른 RNA 추출 키트를 사용하여 전체 RNA로부터 HDFS 격리. 분광 광도계 (21)를 사용하여 추출 된 총 RNA를 정량화.
- 제조자의 프로토콜 (20)에있어서, 올리고 (DT)과 프라이머 M-MLV 역전사 효소를 함유하는 반응 액 20 μL에 총 RNA 1 μg의 추가하여 cDNA를 합성.
- 녹색 PCR 마스터 믹스 및 유전자 특이 프라이머 (부록 표 1)을 사용하여, 실시간 PCR 시스템과의 cDNA의 증폭을 측정한다. GAPDH 식 데이터를 정상화. 다음 PCR 프로토콜을 사용하여 초기 드95 ° C에서 10 분 동안 naturation; 95 ° C에서 15 초 45주기, 55 ° C에서 20 초, 72 ° C에서 35 초; 95 ° C, 60 ℃에서 1 분, 95 ° C에서 30 초, 60 ° C에서 15 5 초에서 15 초 동안 용융 곡선 스테이지.
결과
원래 mESCs는 FBS 및 기타 영양 보충제 (도 1A 및 2A)와 MESC 매체에서 MEF 공급 장치에 유지됩니다. CM은 피더 층, FBS, 기타 영양 보충제 (도 1B 및 2B)없이 감소 세럼 미디어에서 mESCs에서 수집 하였다. 이 배양 조건은 우리가 공급, FBS, 또는 다른 보조 식품의 요인에 의해 잠재적 인 오염없이 에어컨 매체 MESC 별을 수집 할 수 있습니다. 제어 매체 mESCs없이, 동일한 배양 조건 하에서 수집 하였다.
ⅰ) 정상 MESC의 배양 조건 (그림 2A) 및 ⅱ) 무 혈청 및 공급 장치가없는 배양 조건 (그림 2B) : mESCs는 서로 다른 두 문화 미디어 사이의 형태학을 보여줍니다. MESC 식민지은 MEF 층에 성장하고 정상적인 MESC 문화 C에서 타원형과 빛나는 모습을 보여 주었다onditions (그림 2A). 반대로, 무 혈청 피더가없는 배양 조건에서 mESCs은 평평 불규칙 형태 (도 2b)를 보였다.
MESC-CM의 기능적 특성은 SA β-gal을 분석 (도 3a), 세포주기 분석 (도 3b) 및 qPCR에 (도 3c)와 같은 노화 관련 방법에 의해 달성되었다. MESC-CM과 HDFS 노화의 치료는 세포 노화 (도 3a)의 지표 인 양성 SA β - 갈 양성 세포의 수를 감소시켰다. 세포주기 분석은 그것이 G 0 / G 1 단계 (도 3b)의 셀의 수를 감소하는 반면 MESC-CM 처리가 심한 S 세포의 수를 증가시키고 G 2 / M 단계 것으로 나타났다. 또한 MESC-CM 처리 N (노화 관련 유전자의 발현 수준을 감소amely p53의, P21 및 P16) 및 노화 - 관련 분비 표현형 (SASP) 발현 수준 (IL-6).

그림 1 : 준비 및 MESC-CM의 최적화. 무 혈청 및 공급 장치가없는 CM의 준비 및 최적화를위한 실험 전략. (A) 일반 MESC 배양 조건 (B)의 serum 피더없는 MESC-CM 배양 조건. C는 : FBS 및 MEF없이 매체를 제어; CM : FBS 및 MEF없이 에어컨 매체. 배 등의 등의 허가를 수정. 15. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
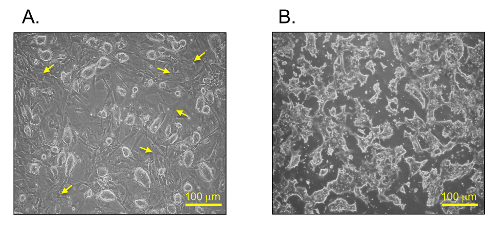
그림 2 : 밝은 필드 메신저mESCs 세. (A) 정상 조건 (B)의 serum과 공급이없는 상태에서 mESCs. 노란색 화살표는 정상 MESC의 배양 조건에서 피더 세포 (MEFs에)를 나타냅니다. 스케일 바는 100 μm의 =. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3 : MESC-CM의 노화 방지 효과의 특성. (A) SA β-여자 활동 염색 및 SA의 β-여자 양성 세포의 비율입니다. 유동 세포 계측법에 의해 (B) 세포주기 분석. (C) QRT-PCR에 의한 노화 관련 유전자 발현 수준 (p53과, P21 및 P16) 및 노화 - 관련 분비 표현형 (SASP) 발현 수준 (IL-6)의 발현 수준. 값은 평균 ± 표준 편차입니다. 도는 세개의 독립된 실험의 대표 값이다. 군 사이에 통계적으로 유의 한 차이는 단방향 ANOVA와 Tukey에의 사후 검사에 의해 확인되었다. * P <0.05, ** p <0.01. Y = 비 노화 세포; S : 노화 세포; C는 : FBS 및 MEF없이 매체를 제어; CM : FBS 및 MEF없이 에어컨 매체. 스케일 바는 10 μm의 =. 배 등의 등의 허가를 수정. 15. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
무 혈청 피더없는 MESC-CM의 성공적인 회수를 들어, 다음 방법이 고려되어야한다. 가장 중요한 요인은 MESC-CM의 컬렉션에 대한 초기 통로 mESCs를 사용합니다. 이전에는 초기 통로 MESC-CM 늦게 통과 mESCs에 비해 더 나은 안티 에이징 효과를 가지고 있음을 보였다. mESCs의 통과 수는 그들의 발달 잠재력 (16) 및 다 능성 (17)에 영향을 미치는 것으로보고되었다.
추가적인 연구가 항 노화 효과를 유도 MESC의 secretome의 특정 요소를 분석 할 필요가 있지만, 현재는 MESC-CM은 세포 수준에서 노화를 감소 충분하다고 결론 지을 수있다.
젊은 세포로 다시 노화 세포를 되돌릴 MESC 별 분비 요인의 식별은 미래 연구에 중요하다. 고품질은 항체 어레이 (15)를로 분비 분자에 대해 분석D secretome 분석은 매체 수집 프로세스 동안 세척 단계 (단계 3)은 중요하다. 세정 공정이 제대로 수행되지 않는 경우, 분비 성 분자는 혈청 (FBS) 구성 요소 (18, 19)에 의해 오염된다.
무 혈청 피더가없는 배양 시간 (24 시간)은 혈청 하에서 아사 세포자가 분해 또는 아폽토시스의 가능성을 증가시킬 수있다 (24 시간) 이상 긴 배양 시간으로서 상기 매체 수집 프로세스 (단계 3)에서 매우 중요 - 고갈 조건 (18, 19)를 feeder-. 피더 분자 (22)의 다수의 분비로 정상 ESC 배양 조건은 미분화 세포의 장기 배양 피더 레이어를 필요로한다. 젤라틴 - 코팅 된 플레이트는 피더 세포의 오염의 가능성을 방지한다.
무 혈청 및 공급 장치가없는 배양 조건에서 수확 MESC-CM은 노화 HDFS에서 항 노화 기능이 있습니다. mESC-의 항 노화 효과CM은 같은 SA β-여자 활동과 같은 노화 관련 여러 판독에 의해 입증되었다; 향상된 전위 증식 (세포주기 분석); 및 p53에, P21, P16, 및 IL-6 유전자 발현 수준 (- 3C도 3a)을 감소시켰다.
인간의 기본 세포가 MESC-CM으로 처리하는 경우, 이종 오염 임상 응용 프로그램에 대한 중요한 문제가 될 것이다. 따라서, 인간는 ESC 또는 iPSCs에서 분비 요인 조사는 인류의 기원에서 유래 CM의 임상 응용 프로그램에 대한 중요한 미래 연구 될 것이다. 줄기 세포와 항 노화 연구에 기초하여 무 세포의 융합 방법은 치료 방법의 개선으로보다 정밀한 결과, 노화 관련 질환의 현재의 이해를 확장 할 것으로 예상된다.
공개
The authors have nothing to disclose.
감사의 말
이 연구는 기초 과학 연구 프로그램 (2013R1A1A2060930) 및 의료 연구 센터 프로그램 (2015R1A5A2009124) 한국 연구 재단을 통해 (NRF), 과학, ICT의 교육부에 의해 투자 및 미래 계획에 의해 지원되었다. 이 연구는 또한 병원 아픈 어린이를위한 (HK) 성에서 시작해서 운영 그랜트에 의해 지원됩니다. 우리는 G4 MESC 라인을 제공하기 위해이 원고 박사 안드라스 나기 편집에서 우수한 도움 로라 Barwell 사라 JS 김에게 감사의 말씀을 전합니다.
자료
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | #11960-044 | |
| FBS | Invitrogen | #30044333 | 20%, ES cell quality |
| Penicillin and streptomycin | Invitrogen | #15140 | 50 units/ml penicillin and 50 mg/ml streptomycin |
| L-glutamine | Invitrogen | #25030 | 2 mM |
| Nonessential amino acids (NEAA) | Invitrogen | #11140 | 100 µM |
| β-mercaptoethanol | Sigma | #M3148 | 100 µM |
| Leukemia inhibitory factor | Millipore | #ESG1107 | 100 units/ml |
| OPTI-MEM | Invitrogen | #22600 | |
| X-gal | Sigma | #B4252 | 1 mg/ml |
| Paraformaldehyde (PFA) | Sigma | P6148 | 3.70% |
| Dimethylformamide (DMF) | Sigma | #D4551 | |
| Potassium ferricyanide | Aldrich | #455946 | 5 mM |
| potassium ferrocyanide | Aldrich | #455989 | 5 mM |
| NaCl | Sigma | #S7653 | 150 mM |
| MgCl2 | Sigma | #M2393 | 2 mM |
| Mitomycin C | Sigma | #M4287 | 10 µg/ml |
| Propidium iodide | Sigma | #P4170 | 50 µg/ml |
| TRIzol | Ambion | #15596018 | |
| M-MLV reverse transcript-tase | Promega | #M170B | |
| Power SYBR Green PCR master mix | Applied Biosystems | #4367659 | |
| HDFs, NHDF-Ad-Der-Fibroblast | LONZA | #CC-2511 | |
| Bottle top filter | Corning | #430513 | 0.2 μm |
참고문헌
- Thomson, J. A., et al. Embryonic stem cell lines derived from human blastocysts. Science. 282, 1145-1147 (1998).
- Lavasani, M., et al. Muscle-derived stem/progenitor cell dysfunction limits healthspan and lifespan in a murine progeria model. Nat Commun. 3, 608(2012).
- Woo, D. H., et al. Direct and indirect contribution of human embryonic stem cell-derived hepatocyte-like cells to liver repair in mice. Gastroenterology. 142, 602-611 (2012).
- Lee, A. S., Tang, C., Rao, M. S., Weissman, I. L., Wu, J. C. Tumorigenicity as a clinical hurdle for pluripotent stem cell therapies. Nat Med. 19, 998-1004 (2013).
- Moon, S. H., et al. A system for treating ischemic disease using human embryonic stem cell-derived endothelial cells without direct incorporation. Biomaterials. 32, 6445-6455 (2011).
- Tongers, J., Roncalli, J. G., Losordo, D. W. Therapeutic angiogenesis for critical limb ischemia: microvascular therapies coming of age. Circulation. 118, 9-16 (2008).
- Lazarous, D. F., et al. Basic fibroblast growth factor in patients with intermittent claudication: results of a phase I trial. J Am Coll Cardiol. 36, 1239-1244 (2000).
- Adams, P. D. Healing and hurting: molecular mechanisms, functions, and pathologies of cellular senescence. Mol Cell. 36, 2-14 (2009).
- Harrison, D. E., et al. Rapamycin fed late in life extends lifespan in genetically heterogeneous mice. Nature. 460, 392-395 (2009).
- Baur, J. A., Ungvari, Z., Minor, R. K., Le Couteur, D. G., de Cabo, R. Are sirtuins viable targets for improving healthspan and lifespan. Nat Rev Drug Discov. 11, 443-461 (2012).
- Martin-Montalvo, A., et al. Metformin improves healthspan and lifespan in mice. Nat Commun. 4, 2192(2013).
- Loffredo, F. S., et al. Growth differentiation factor 11 is a circulating factor that reverses age-related cardiac hypertrophy. Cell. 153, 828-839 (2013).
- Jozefczuk, J., Drews, K., Adjaye, J. Preparation of mouse embryonic fibroblast cells suitable for culturing human embryonic and induced pluripotent stem cells. J Vis Exp. , (2012).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nat Protoc. 4, 1798-1806 (2009).
- Bae, Y. U., Choi, J. H., Nagy, A., Sung, H. K., Kim, J. R. Antisenescence effect of mouse embryonic stem cell conditioned medium through a PDGF/FGF pathway. FASEB J. 30, 1276-1286 (2016).
- Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W., Roder, J. C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proc Natl Acad Sci U S A. 90, 8424-8428 (1993).
- Li, X. Y., et al. Passage number affects the pluripotency of mouse embryonic stem cells as judged by tetraploid embryo aggregation. Cell Tissue Res. 327, 607-614 (2007).
- Mbeunkui, F., Fodstad, O., Pannell, L. K. Secretory protein enrichment and analysis: an optimized approach applied on cancer cell lines using 2D LC-MS/MS. J Proteome Res. 5, 899-906 (2006).
- Makridakis, M., Vlahou, A. Secretome proteomics for discovery of cancer biomarkers. J Proteomics. 73, 2291-2305 (2010).
- Kim, K. S., et al. Regulation of replicative senescence by insulin-like growth factor-binding protein 3 in human umbilical vein endothelial cells. Aging Cell. 6, 535-545 (2007).
- Kim, K. S., et al. Induction of cellular senescence by insulin-like growth factor binding protein-5 through a p53-dependent mechanism. Mol Biol Cell. 18, 4543-4552 (2007).
- Eiselleova, L., et al. Comparative study of mouse and human feeder cells for human embryonic stem cells. Int J Dev Biol. 52, 353-363 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유