Method Article
Recogida de suero y libre de alimentador madre embrionarias de ratón medio celular acondicionado para un enfoque libre de células
En este artículo
Resumen
Este protocolo proporciona un método para la obtención de células madre embrionarias de ratón (MESC) -conditioned medio (mESC-CM) derivado de suero (suero bovino fetal, FBS) - y alimentadoras (fibroblastos de embriones de ratón, MEFs) -free condiciones para una célula enfoque exento. Puede ser aplicable para el tratamiento de envejecimiento y las enfermedades de envejecimiento asociado.
Resumen
The capacity of embryonic stem cells (ESCs) and induced pluripotent stem cells (iPSCs) to generate various cell types has opened new avenues in the field of regenerative medicine. However, despite their benefits, the tumorigenic potential of ESCs and iPSCs has long been a barrier for clinical applications. Interestingly, it has been shown that ESCs produce several soluble factors that can promote tissue regeneration and delay cellular aging, suggesting that ESCs and iPSCs can also be utilized as a cell-free intervention method. Therefore, the method for harvesting mouse embryonic stem cell (mESC)-conditioned medium (mESC-CM) with minimal contamination of serum components (fetal bovine serum, FBS) and feeder cells (mouse embryonic fibroblasts, MEFs) has been highly demanded. Here, the present study demonstrates an optimized method for the collection of mESC-CM under serum- and feeder-free conditions and for the characterization of mESC-CM using senescence-associated multiple readouts. This protocol will provide a method to collect pure mESC-specific secretory factors without serum and feeder contamination.
Introducción
El objetivo de este protocolo es recoger células madre embrionarias de ratón (MESC) -conditioned medio (mESC-CM) a partir de las condiciones de cultivo sin suero y libre de alimentadoras y caracterizar sus funciones biológicas.
En general, las células madre embrionarias (CES) tienen un gran potencial para la medicina regenerativa y la terapia celular debido a su pluripotencia y capacidad de auto-renovación 1-3. Sin embargo, el trasplante directo de las células madre tiene varias limitaciones, tales como el rechazo inmune y la formación de tumor 4,5. Por lo tanto, un enfoque libre de células puede proporcionar una estrategia terapéutica alternativa para la medicina regenerativa y las intervenciones de envejecimiento 6,7.
La senescencia es vista como un homólogo celular para el envejecimiento de los tejidos y órganos, que se caracteriza por un estado permanente de detención del crecimiento, alteración de la fisiología celular, y comportamientos. El envejecimiento es el principal factor de riesgo para las enfermedades prevalentes, incluyendo cáncer, enfermedades cardiovasculares, type la diabetes 2, 8 y la neurodegeneración. Una de las características evidentes del envejecimiento es la disminución en el potencial de regeneración de los tejidos, que es causada por el envejecimiento de células madre y el agotamiento 9. Muchos estudios han demostrado importantes moléculas farmacológicas, tales como la rapamicina 9, resveratrol 10, y metformina 11, y factores sistémicos transmitidas por la sangre, a saber, GDF11 12, que tiene la capacidad de retrasar el envejecimiento consistentemente y extender la vida.
En el presente estudio, mESC-CM ha sido cosechada sin suero capas (suero fetal bovino, FBS) y el alimentador (fibroblastos embrionarios de ratón, los MEF) para excluir la contaminación de los factores del suero y factores de secreción de MEFs. Estas condiciones permitieron un CM de suero y libre de alimentador que, por consiguiente permitió la identificación precisa de los factores de secreción mESC-específicas.
Este protocolo propuesto es altamente eficiente y relativamente rentable y fácilpara operar. Esta técnica proporciona información detallada sobre la caracterización de los factores solubles derivados de mESC que puede mediar un efecto anti-senescencia, que puede utilizarse para el desarrollo de un enfoque terapéutico libre de células seguro y potencialmente ventajoso hacia intervenciones para las enfermedades de envejecimiento asociado y otros regenerativa tratos.
Protocolo
NOTA: un esquema del suero y protocolo de recogida de CM libre de alimentador se muestra en la Figura 1.
1. Materiales (Preparación de MEFs, Medio, Placas, y soluciones)
- Preparar 500 ml de medio de cultivo para los MEFs. Suplemento de Dulbecco medio de Eagle modificado (DMEM) con 10% de FBS (calidad ESC), 50 unidades / ml de penicilina, y 50 mg / ml de estreptomicina.
- Aislar los MEF a partir de embriones después de un protocolo de rutina establecida 13 y mantenerlas en medio MEF.
- Preparar 500 ml de medio de cultivo para los mESCs. DMEM se complementa con 15% de FBS y 2 mM L-glutamina, 100 mM de aminoácidos no esenciales (NEAA), 100 mM β-mercaptoetanol, 100 unidades / ml de factor inhibidor de la leucemia (LIF), 50 unidades / ml de penicilina, y 50 mg / ml de estreptomicina.
- Preparar las placas gelatinizados (5 placas gelatinizados / 1 mESC placa) mediante el recubrimiento de 10 cm placas de cultivo celular con 5 ml de solución de gelatina 0,1%. Incubar durante al menos 10 minutos a temperatura ambiente.
- Preparar 500 ml de medio de suero reducido para una condición sin suero de mESCs. Suplemento suero reducido de medios con 1,2 g de bicarbonato de sodio (pH 7,0). Filtrar a través de un filtro sobre frascos, 0,2 micras.
- Preparar la asociada a la senescencia β-galactosidasa (SA β-gal) solución de tinción para la detección de células senescentes: 1 mg / ml de X-gal (disuelto en dimetilformamida, DMF), ácido cítrico 40 mM / tampón de fosfato sódico (pH 6,0) , mM de ferricianuro de potasio 5, ferrocianuro de potasio 5 mM, NaCl 150 mM, y MgCl 2 mM 2 14.
PRECAUCIÓN: (peligrosos) es una solución de DMF tóxico y corrosivo. Use ropa de protección personal (guantes Por ejemplo, nitrilo o de látex, una bata de laboratorio y gafas) al manejar una solución. Utilizar una campana de humos. - Preparar 500 ml de medio de cultivo a los fibroblastos dérmicos humanos (HDF, NHDF-Ad-Der-fibroblastos). Suplemento DMEM con FBS 10% y 100 unidades / ml de penicilina y 100 mg / ml de estreptomicina.
NOTA: Llevar a cabo todos los pasos en una campana de seguridad biológica de cultivo celular.
- Tratar los MEFs con 20 ml de medio de MEF que contiene 10 mg / ml de mitomicina C en una placa de cultivo celular 15 cm. Incubar durante 2 horas a 37 ° C y 5% de CO2.
- Aspirar el medio de MEF. Se lavan las células con PBS tres veces. Añadir 3 ml de tripsina-EDTA (TE, 1x) y se incuba durante 3 min a 37 ° C y 5% de CO 2. Después de 3 min, neutralizar el TE con 6 ml de medio de MEF y centrifugar durante 3 minutos a 300 x g.
- Resuspender en 5 ml de medio de MEF. Determinar el número de células en la suspensión de células resultante usando tinción con azul de tripano y un hemocitómetro. Placa MEFs inactivadas (alimentador) a una densidad de 2 x 10 6 células por 10 cm de placa de cultivo celular en medio MEF. Incubar durante 24 horas a 37 ° C y 5% de CO2.
- Reemplazar el medio MEF con medio mESC 24 horas después de la siembra del alimentador (en elel día siguiente).
- Placa de las mESCs (G4 híbrido F1 de células ES) a una densidad de 2 x 10 6 células en el alimentador con medio mESC. Incubar durante 48 horas a 37 ° C y 5% de CO2.
NOTA: El efecto anti-envejecimiento de mESC-CM es probable que más fuerte cuando el número más bajo de paso mESCs se utilizan 15-17. Hemos adquirido una línea G4 mESC del Dr. Andras Nagy en Lunenfeld-Tanenbaum Instituto de Investigación del Hospital Monte Sinaí, 25 Orde Street, Toronto, ON, M5T 3H7, Canadá. - Mantener las células a una densidad relativamente alta y el paso a un estado sub-confluente 70-80%. Sustituir el medio con medio mESC fresco todos los días.
3. Recogida de suero y libre de alimentador de medio condicionado (Figura 1B y 2B)
NOTA: Llevar a cabo todos los pasos en una campana de seguridad biológica de cultivo celular.
- Enjuague la placa mESC con 5 ml de PBS. Añadir 1 ml de TE (2,5 veces) y se incuba durante 3 min a 37 ° C y 5% de CO 2. Después de 3 min, neutralizar el TE con 2 ml de mESC medium y se centrifuga durante 3 minutos a 300 x g.
- Resuspender en 5 ml de medio mESC y la placa de 1 ml en cada placa de cultivo recubierta con gelatina (5 placas gelatinizados / 1 mESC placa) en medio mESC. Se alcanza cultivo a 37 ° C y 5% de CO 2 hasta el 80-85% de confluencia.
- Lavar mESCs con suficiente PBS para cubrir las células (8 ml por placa de 10 cm) durante 10 minutos por lavado, para un total de tres lavados. Incubar en medio con suero reducido durante 24 horas a 37 ° C y 5% de CO 2.
NOTA: La etapa de lavado es importante para evitar la contaminación de FBS. Es importante seguir el tiempo de incubación 18,19. - Recoger mESC-CM en un tubo cónico de 50 ml y centrifugar durante 20 min a 2.500 x g. Recoger la solución sobrenadante (CM) después de la centrifugación. Filtrar a través de un filtro sobre frascos, 0,2 micras.
4. Efectos de la madre embrionarias de ratón de la célula-medio condicionado (CM-mESC)
NOTA: Los efectos de mESC-CM fueron validados por varios métodos, tales comoSA ensayo de β-gal, el análisis del ciclo celular, y QRT-PCR.
- SA β-gal de ensayo (Figura 3A)
- HDF de semillas a una densidad de 2 x 10 4 células por pocillo en placas de 6 pocillos en medio HDF. Incubar durante la noche a 37 ° C y 5% de CO 2.
- Tras una incubación durante la noche, la mitad de descarte del medio HDF y añadir mESC-CM y el medio de control. Incubar durante 72 horas a 37 ° C y 5% de CO2. medio de control se deriva de medio libre de suero (suero reducido de Medios) en una placa de gelatina recubierto en ausencia de mESCs.
- Se lavan las células con PBS suficiente para cubrir las células (2 ml por placa de 6 pocillos) durante 30 segundos por lavado, para un total de dos lavados. Añadir 3,7% de paraformaldehído (PFA) para la fijación. Incubar durante 5 min a temperatura ambiente.
PRECAUCIÓN: (peligrosos) es una solución de paraformaldehído tóxico y corrosivo. Use ropa de protección personal (por ejemplo, guantes de nitrilo o de látex, una bata de laboratorio y gafas) al manipular la solución.Utilizar una campana de humos. - Aspirar la solución de fijación. Lavar las células fijadas con PBS dos veces, como se describe en el paso 4.1.3.
- Añadir la solución de tinción β-gal SA (1-2 ml por pocillo en una placa de 6 pocillos). Incubar durante 17,5 horas a 37 ° C.
NOTA: No es que se incubó en un incubador de CO2. - Aspirar la solución de tinción β-gal SA y lavar las células con PBS dos veces, como se describe en el paso 4.1.3.
- Añadir la solución de eosina para la contra-tinción. Incubar durante 5 min a temperatura ambiente. Se lavan las células con PBS dos veces, como se describe en el paso 4.1.3.
- Las células de las imágenes a un aumento de 100X utilizando un microscopio de luz y de captura de imágenes utilizando una cámara digital conectada para su posterior análisis.
NOTA: El número total de células se puede contar de forma ciega y el porcentaje de células azules positivas SA β-gal se puede calcular.
- Análisis del ciclo celular (Figura 3B)
- HDF de semillas a una densidad de8 x 10 4 células por pocillo en una placa de cultivo celular de 6 cm en un medio de HDF. Incubar durante la noche a 37 ° C y 5% de CO 2.
- Tras una incubación durante la noche, la mitad de descarte del medio HDF y añadir mESC-CM y el medio de control. Incubar durante 24 horas a 37 ° C y 5% de CO2.
- Tripsinizar las células, como se describe en el paso 3.1, y se centrifuga durante 5 min a 300 x g. Lavar las células con solución de PBS frío (PBS con 0,5 mM de CaCl2 y 2% de FBS, 1 ml por 1,5 tubo ml) dos veces y centrifugar durante 3 minutos a 2500 x g. Resuspender en 100 l de solución de PBS frío.
- Fijar las células dejando caer 200 l de etanol frío, mientras que vórtex. Almacenar a 4 ° C durante al menos 1 hora.
- Lavar las células con solución de PBS frío dos veces, como se describe en el paso 4.2.3.
- Resuspender las células en 250 l de tampón de citrato de sodio (1,12%, pH 8,5) que contiene 50 mg / ml de RNasa. Incubar durante 30 minutos a 37 ° C.
- Añadir 250 l de citrato de sodiotampón que contiene / yoduro de propidio 50 mg ml. Incubar durante 20 min a temperatura ambiente.
- Medir las células 10.000 en cada muestra mediante citometría de flujo 20.
- QRT-PCR (Figura 3C)
- HDF semillas y añadir mESC-CM, tal como se describe en los pasos 4.1.1 y 4.1.2.
- Aislar el ARN total a partir de los HDF utilizando un kit de extracción de ARN de acuerdo con el protocolo del fabricante. Cuantificar el ARN total extraído por medio de un espectrofotómetro 21.
- Sintetizar ADNc mediante la adición de 1 g de ARN total a un 20 l de mezcla de reacción que contiene oligo (dT) y M-MLV transcriptasa inversa, de acuerdo con el protocolo del fabricante 20.
- Medir la amplificación del cDNA con una máquina de PCR en tiempo real, utilizando PCR verde mezcla maestra y los cebadores específicos de genes (Suplemento Tabla 1). Normalizar los datos con expresión de GAPDH. Utiliza el siguiente protocolo de PCR: de inicialdesnaturalización durante 10 min a 95 ° C; 45 ciclos de 15 segundos a 95 ° C, 20 seg a 55 ° C y 35 seg a 72 ° C; y la etapa de la curva de fusión de 15 segundos a 95 ° C, 1 min a 60 ° C, 30 segundos a 95 ° C y 5 segundos a 60 ° C 15.
Resultados
Originalmente, mESCs se mantienen en un alimentador de MEF en medio mESC con FBS y otros suplementos (Figuras 1A y 2A). CM se recogió de mESCs en suero reducido de medios sin una capa de alimentación, FBS, u otros suplementos (Figuras 1B y 2B). Esta condición de cultivo nos permite recoger mESC específicos medio condicionado sin contaminación potencial por los factores de la alimentación, FBS, u otros suplementos. El medio de control se recogió en las mismas condiciones de cultivo, sin mESCs.
mESCs muestran diferentes morfologías entre los dos medios de cultivo: i) las condiciones normales de cultivo mESC (Figura 2A) y ii) suero y condiciones de cultivo libres de alimentador (Figura 2B). Las colonias mESC crecieron en una capa MEF y demostraron un aspecto ovalado y brillante bajo la normal de la cultura c mESCondiciones (Figura 2A). Por el contrario, los mESCs en el suero y las condiciones de cultivo libre de alimentadoras mostraron una morfología aplanada e irregular (Figura 2B).
La caracterización funcional de mESC-CM se logró mediante métodos asociados con la senescencia, tales como SA ensayo de β-gal (Figura 3A), el análisis del ciclo celular (Figura 3B), y qPCR (Figura 3C). El tratamiento de HDF senescentes con mESC-CM disminuyó el número de células β-gal-positivas positivas SA, que es un indicador de la senescencia celular (Figura 3A). Análisis del ciclo celular reveló que el tratamiento mESC-CM aumentó de manera espectacular el número de células en la fase S y G 2 / M, mientras que reduce el número de células en el G 0 / G 1 fase (Figura 3B). Además, el tratamiento mESC-CM disminuyó los niveles de expresión de genes asociados con la senescencia (nAmely, p53, p21, y p16) y los niveles de expresión fenotipo secretor (SASP) asociados con la senescencia (IL-6).

Figura 1: Preparación y optimización de mESC-CM. estrategia experimental para la preparación y optimización de CM libre de suero y libre de alimentador. (A) condiciones normales de cultivo mESC y (B) suero y condiciones de cultivo mESC-CM libre de alimentador. C: Control medio sin FBS y MEF; CM: medio condicionado sin FBS y MEF. Modificado con permiso de Bae et al. 15. Haga clic aquí para ver una versión más grande de esta figura.
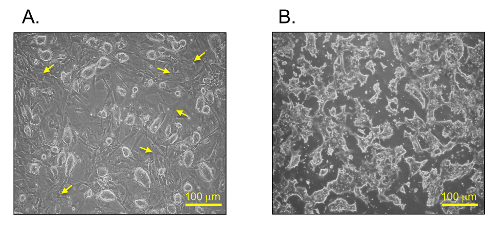
Figura 2: Campo brillante imedades de mESCs. mESCs en condiciones normales y de suero (A) (B) y condiciones libres de alimentador. Las flechas amarillas indican células de alimentación (MEF) en condiciones normales de cultivo mESC. Barras de escala = 100 m. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Caracterización del efecto anti-envejecimiento de mESC-CM. Actividad de tinción (A) SA β-gal y el porcentaje de células SA β-gal-positivas. (B) Análisis del ciclo celular por citometría de flujo. (C) Los niveles de expresión de los niveles asociados con la senescencia de expresión génica (p53, p21, y p16) y los niveles de expresión asociada a la senescencia secretora fenotipo (SASP) (IL-6) por qRT-PCR. Los valores son la media ± SD. Las cifras son representativos de tres experimentos independientes. Las diferencias estadísticamente significativas entre los grupos fueron identificados por ANOVA de una vía y prueba post-hoc de Tukey. * P <0,05, ** p <0,01. Y = células no senescentes; S: las células senescentes; C: Control medio sin FBS y MEF; CM: medio condicionado sin FBS y MEF. Barras de escala = 10 m. Modificado con permiso de Bae et al. 15. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Para el éxito de la recogida del suero y mESC-CM sin alimentador, las siguientes sugerencias deben ser tomados en consideración. El factor más importante es el uso de mESCs principios de paso para la recogida de mESC-CM. Anteriormente, se ha demostrado que temprano paso mESC-CM tiene mejores efectos anti-envejecimiento en comparación con mESCs paso finales. El número de pases de mESCs se ha informado que afectan a su potencial de desarrollo 16 y pluripotencia 17.
Aunque se necesita investigación adicional para analizar los factores específicos de la secretoma mESC, que inducen efectos anti-senescencia, que actualmente se puede concluir que mESC-CM es suficiente para disminuir la senescencia a nivel celular.
La identificación de factores de secreción-mESC específica que reviertan las células senescentes de nuevo a las células jóvenes será fundamental para futuros estudios. Para los análisis de alta calidad sobre las moléculas de secreción, como una matriz de anticuerpos 15d análisis secretoma, la etapa de lavado durante el proceso de recogida de medio (paso 3) es crítica. Si la etapa de lavado no se realiza correctamente, las moléculas de secreción estarán contaminados por el suero (FBS) 18,19 componentes.
El tiempo de incubación de suero y libre de alimentador (24 hr) es muy importante en el proceso de recolección medio (paso 3), como el tiempo de incubación más largo (más de 24 hr) puede aumentar la posibilidad de autolisis celular o apoptosis por inanición bajo el suero - feeder- y condiciones empobrecido 18,19. La condición normal cultura ESC requiere una capa de alimentación para el cultivo a largo plazo de las células no diferenciadas, como el alimentador segrega un gran número de moléculas de 22. La placa recubierta con gelatina evita la posibilidad de contaminación de las células alimentadoras.
El mESC-CM, cosechado de las condiciones de cultivo libre de suero y-subordinado, tiene una capacidad anti-senescencia en HDF senescentes. Los efectos anti-senescencia de mESC-CM ha sido demostrado por múltiples lecturas asociados con la senescencia, como SA actividad β-gal; un potencial proliferativo mejorado (análisis del ciclo celular); y la reducción de p53, p21, p16, y IL-6 niveles de expresión génica (Figura 3A - 3C).
Cuando las células humanas primarias son tratados con mESC-CM, xeno-contaminación sería una cuestión crítica para la aplicación clínica. Por lo tanto, una investigación de los factores de secreción de los CES o células iPS humanas sería un estudio futuro importante para la aplicación clínica de CM derivado de los orígenes humanos. Se espera que la convergencia de un enfoque libre de células en base a una células madre y un estudio de anti-senescencia de ampliar la comprensión actual de enfermedades asociados con la senescencia, lo que resulta en una mayor comprensión de mejoras en enfoques terapéuticos.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Esta investigación fue apoyada por el Programa de Investigación de Ciencias Básicas (2013R1A1A2060930) y el Programa del Centro de Investigación Médica (2015R1A5A2009124) a través de la Fundación Nacional de Investigación de Corea (NRF), financiado por el Ministerio de Ciencia, TIC, y la planificación futura. Esta investigación también está apoyado por una subvención de funcionamiento Puesta en marcha del Hospital for Sick Children (HK Sung). Nos gustaría dar las gracias a Laura y Sara Barwell JS Kim por su excelente ayuda en la edición de este manuscrito y el doctor Andras Nagy para proporcionar la línea G4 mESC.
Materiales
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | #11960-044 | |
| FBS | Invitrogen | #30044333 | 20%, ES cell quality |
| Penicillin and streptomycin | Invitrogen | #15140 | 50 units/ml penicillin and 50 mg/ml streptomycin |
| L-glutamine | Invitrogen | #25030 | 2 mM |
| Nonessential amino acids (NEAA) | Invitrogen | #11140 | 100 µM |
| β-mercaptoethanol | Sigma | #M3148 | 100 µM |
| Leukemia inhibitory factor | Millipore | #ESG1107 | 100 units/ml |
| OPTI-MEM | Invitrogen | #22600 | |
| X-gal | Sigma | #B4252 | 1 mg/ml |
| Paraformaldehyde (PFA) | Sigma | P6148 | 3.70% |
| Dimethylformamide (DMF) | Sigma | #D4551 | |
| Potassium ferricyanide | Aldrich | #455946 | 5 mM |
| potassium ferrocyanide | Aldrich | #455989 | 5 mM |
| NaCl | Sigma | #S7653 | 150 mM |
| MgCl2 | Sigma | #M2393 | 2 mM |
| Mitomycin C | Sigma | #M4287 | 10 µg/ml |
| Propidium iodide | Sigma | #P4170 | 50 µg/ml |
| TRIzol | Ambion | #15596018 | |
| M-MLV reverse transcript-tase | Promega | #M170B | |
| Power SYBR Green PCR master mix | Applied Biosystems | #4367659 | |
| HDFs, NHDF-Ad-Der-Fibroblast | LONZA | #CC-2511 | |
| Bottle top filter | Corning | #430513 | 0.2 μm |
Referencias
- Thomson, J. A., et al. Embryonic stem cell lines derived from human blastocysts. Science. 282, 1145-1147 (1998).
- Lavasani, M., et al. Muscle-derived stem/progenitor cell dysfunction limits healthspan and lifespan in a murine progeria model. Nat Commun. 3, 608(2012).
- Woo, D. H., et al. Direct and indirect contribution of human embryonic stem cell-derived hepatocyte-like cells to liver repair in mice. Gastroenterology. 142, 602-611 (2012).
- Lee, A. S., Tang, C., Rao, M. S., Weissman, I. L., Wu, J. C. Tumorigenicity as a clinical hurdle for pluripotent stem cell therapies. Nat Med. 19, 998-1004 (2013).
- Moon, S. H., et al. A system for treating ischemic disease using human embryonic stem cell-derived endothelial cells without direct incorporation. Biomaterials. 32, 6445-6455 (2011).
- Tongers, J., Roncalli, J. G., Losordo, D. W. Therapeutic angiogenesis for critical limb ischemia: microvascular therapies coming of age. Circulation. 118, 9-16 (2008).
- Lazarous, D. F., et al. Basic fibroblast growth factor in patients with intermittent claudication: results of a phase I trial. J Am Coll Cardiol. 36, 1239-1244 (2000).
- Adams, P. D. Healing and hurting: molecular mechanisms, functions, and pathologies of cellular senescence. Mol Cell. 36, 2-14 (2009).
- Harrison, D. E., et al. Rapamycin fed late in life extends lifespan in genetically heterogeneous mice. Nature. 460, 392-395 (2009).
- Baur, J. A., Ungvari, Z., Minor, R. K., Le Couteur, D. G., de Cabo, R. Are sirtuins viable targets for improving healthspan and lifespan. Nat Rev Drug Discov. 11, 443-461 (2012).
- Martin-Montalvo, A., et al. Metformin improves healthspan and lifespan in mice. Nat Commun. 4, 2192(2013).
- Loffredo, F. S., et al. Growth differentiation factor 11 is a circulating factor that reverses age-related cardiac hypertrophy. Cell. 153, 828-839 (2013).
- Jozefczuk, J., Drews, K., Adjaye, J. Preparation of mouse embryonic fibroblast cells suitable for culturing human embryonic and induced pluripotent stem cells. J Vis Exp. , (2012).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nat Protoc. 4, 1798-1806 (2009).
- Bae, Y. U., Choi, J. H., Nagy, A., Sung, H. K., Kim, J. R. Antisenescence effect of mouse embryonic stem cell conditioned medium through a PDGF/FGF pathway. FASEB J. 30, 1276-1286 (2016).
- Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W., Roder, J. C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proc Natl Acad Sci U S A. 90, 8424-8428 (1993).
- Li, X. Y., et al. Passage number affects the pluripotency of mouse embryonic stem cells as judged by tetraploid embryo aggregation. Cell Tissue Res. 327, 607-614 (2007).
- Mbeunkui, F., Fodstad, O., Pannell, L. K. Secretory protein enrichment and analysis: an optimized approach applied on cancer cell lines using 2D LC-MS/MS. J Proteome Res. 5, 899-906 (2006).
- Makridakis, M., Vlahou, A. Secretome proteomics for discovery of cancer biomarkers. J Proteomics. 73, 2291-2305 (2010).
- Kim, K. S., et al. Regulation of replicative senescence by insulin-like growth factor-binding protein 3 in human umbilical vein endothelial cells. Aging Cell. 6, 535-545 (2007).
- Kim, K. S., et al. Induction of cellular senescence by insulin-like growth factor binding protein-5 through a p53-dependent mechanism. Mol Biol Cell. 18, 4543-4552 (2007).
- Eiselleova, L., et al. Comparative study of mouse and human feeder cells for human embryonic stem cells. Int J Dev Biol. 52, 353-363 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados