Method Article
미세 유체 정밀 작은 볼륨 샘플 처리를위한 플랫폼 및 음향 마이크로 디바이스로 구분 생물 입자 크기의 사용
요약
This protocol describes a system architecture for performing automated small volume (0.15–1.5 ml) particle separations using a microfluidic device, and discusses methods to optimize acoustofluidic device performance and operation.
초록
미세 유체 장치의 주요 이점은, 따라서 시약 낭비를 줄이고 귀중한 샘플을 보존, 작은 양의 샘플을 조작 할 수있는 능력이다. 그러나, 강력한 샘플 조작을 달성하는 것이 거시적 환경과 장치의 통합을 해결하는 것이 필요하다. 미세 유체 장치와 반복, 민감한 입자 분리를 실현하기 위해,이 프로토콜은 미세 유체 장치를 사용 0.15-1.5 ml의 시료의 정확한 처리를 가능하게하는 완전한 자동화 및 통합 마이크로 유체 플랫폼을 제공한다. 이 시스템의 중요한 측면은 폐쇄 루프 샘플 수집, 시스템 청소 및 반복 작동을 보장하기위한 조치를 프라이밍을 수행 모듈 장치 레이아웃 및 연결을 칩에 안정적이고 유연한 세계의 결과로 강력한 비품 및 완전 자동화 된 유체 처리를 포함한다. 다른 미세 유동 장치는이 아키텍처와 상호 교환 적으로 사용될 수있다. 여기에 우리가 acoustofluidic 장치를 통합, 세부의 characterizATION, 성능 최적화 및 생체 시료의 크기 분리에 대한 사용을 보여줍니다. 분리 실험 중에 실시간 피드백을 사용하여, 시료 채취는 보존 시료를 농축하기 위해 최적화된다. 복수의 장비들의 통합을 필요로하지만,이 구조의 장점은 추가적인 시스템 최적화, 디바이스의 교체 용이성 및 정밀한 강력한 시료 처리하여 미지 시료를 처리하는 능력을 포함한다.
서문
샘플 분리 및 분류는 미세 유체 기술에 대한 응용 프로그램의 가장 유망한 분야 중 하나입니다. 이러한 시료 처리 단계는 효과적인 임상 진단, 치료제 개발, biosurveillance 노력, 생명 과학 연구 및 기술 발전을위한 필수적인. 무수한 미세 분리 전략뿐만 아니라 화학적 및 생물학적 종 유체 부유 분진 및 콜로이드 대해 입증되었다; 9 - 여러 리뷰는 필드 1에서 최근의 진보와 발전의 개요를 제공합니다. (이하 "핵심 장치"라 함)이 미세 유동 분리 기술의 많은 특징은 광범위 하였지만, 소수의보고는 시스템 레벨에서 샘플 분리 문제를 고려 하였다. 코어 장치는 일반적 변위 또는 가압 펌프에 의해 전달되는 유체로, 불소 수지 튜브에 인터페이스 개별 cm 크기의 칩이다.샘플 볼륨을 자동화, 안정성, 및 환원을 증가 포함 - - 마이크로 유체의 약속이 경우 아직 적어도 동등한 노력 코어 소자를 내장하는 완전한 분리 시스템의 설계에 할애해야 현실이다 .
또한, 마이크로 유체 접근법 biodetection에 대한 주요 과제는 마이크로 인터페이스 매크로이다. 이 ~ 거시적 요소에 미세 유체 장치의 물리적 인 "세계 - 투 - 칩"연결에, 전형적인 임상 또는 분석 샘플 볼륨 (~ 0.1 ㎖) 및 미세 유체 칩의 내부 용적 사이의 불일치 (에뿐만 아니라 의미 0.01 μL),뿐만 아니라 이들의 크기 스케일을 가교로 인한 통계적 샘플링 제한. 이러한 문제는 시료 전처리 및 준비 biodetection의 '약한 고리'이라는 인식에 기여한다. (10)이 작품 TA에 설명 된 플랫폼을이러한 문제를 해결하는 방향으로 KES 주요 단계.
시스템 레벨 뷰 촬영,이 프로토콜은 ~ 10 분 시간 척도에 (0.15 ~ 1.5 ml의 범위) 정밀 - 계량 분석 규모의 볼륨의 안정적인 처리를 자세히 설명합니다. 이것은 "원 버튼"동작이다 : 분획 수집 용 시료 및 대상 튜브를 함유하는 소스 바이알 시스템에 배치되면, "실행"명령 절차를 개시하고, 모든 단계를 컴퓨터로 제어된다. 런의 끝에서, 수집 바이알 분리 분획 하류 분석 시스템으로부터 제거 될 수있다.
본 시스템의 핵심 장치는 시료로부터 포유 동물 세포 크기 (5-20 μm의) 입자를 추출 acoustophoresis 칩이다. Acoustophoretic 분리는 높은 처리량은 주로하기 때문에 여기에서 선택되는, 라벨없는 및 비접촉 따라서 비루 분리 가능한 장점을 제공 (μL / 분 100S까지)몇 가지 다른 미세 유체 기술을 일치시킬 수 세포에서 SES. (13) 및이 프로토콜의 포커스 아니지만 기본 개념의 간단한 요약은 미세 유동 분리에 적용을 이해를 돕기 위해 다음 - 음향 입자의 물리 광범위 11 포커싱 설명되었다.
유체로 채워진 마이크로 채널에서 초음파 정상파 진동 저압의 노드를 향해 입자를 구동하는 힘을 발생시키는 압력 필드를 생성한다. 힘의 크기는 포커싱 탄성 이상적 크기 세포 (~ 7-15의 분리에 적합하고, 입자의 체적에 따라, 그리고 같은 상대 밀도 및 입자의 압축성 유래의 탄성 콘트라스트 인자 및 현탁 유체에. 14 바이러스 크기 (~ 50 ~ 200 ㎚) 입자 μm의). 큰 입자는 고압 측으로 이동 노드; 그러나, 힘의 크기부터가 매우 작보다 작은 2 ~ 3 μm의 이러한 작은 입자 또는 용해 된 종은 거의 전혀 이동하지 입자. 음향 분리 우리의 구체적인 구현은, 전술 한 바와 같이, (15)는 유체 채널을 세분화하기 위해 얇은 벽을 통합하고 조정, 초점 위치의 비대칭 배치를 할 수 있습니다. 이는 디바이스 설계에 유연성을 더하고 성능 이점을 포함한 증가 분리 품질과 속도 -은 완전히 다른 기재. 16,17
그러나,이 연구에서 기술 된 시스템 레벨 설계 방식의 가장 큰 장점은 미세 유체 소자의 코어 큰 다양성에 적응할 수 있다는 것이다. 적절한 조정이 입구 / 출구 구성의 변화를 설명하게하여 예를 들어, 관성, 유동장 분획 결정적 횡변위 (DLD), 및 동전 기적 다양한 형태의 디바이스를 포함하여 대부분의 다른 연속 유동 분리 모드는 용이하게 통합 될 수있다 , 유량,샘플 볼륨. 다양한 온 - 칩 필드의 유형 (전기, 자기) 또는 그라데이션 (열, 화학)와 장치는이 플랫폼이 수용 칩, 또는 추가 하드웨어의 통합에 추가 연결이 필요할 수 있습니다.
이 프로토콜은 마이크로 유체 분리 장치를 설계, 및 에칭과 패시베이션의주기를 교번하는 깊은 달성하는 데 사용되는, 많은 마이크로 제조 시설에서 (딥 반응성 이온 에칭에 의해 가능 DRIE, 플라즈마 에칭 공정을, 실리콘 - 유리 칩을 제조하는 데 필요한 단계를 제공한다 수직 측벽 18)와 기능을 제공합니다. 다음은 장치의 특성 acoustofluidic 분리 최적 작동 매개 변수를 결정하고, 최종적으로 상세히 완전 통합 분리 시스템과 생체 시료를 처리하기위한 절차를 설명한다. 전형적인 소자 특성화 결과와 시료 처리 데이터는 제시되고 논의하고,이 아프로의 주요 장점ACH는 모듈화, 견고성, 정밀도 및 자동화를 포함, 강조 표시됩니다.
프로토콜
1. Acoustophoretic 장치 설계 및 포토 마스크 레이아웃
참고 : 일반 고려 사항 및 미세 공정 설계 및 마스크 레이아웃에 대한 지침은 포토 마스크 디자인의 미세에 텍스트와 튜토리얼에서 찾을 수 있습니다 19-21을.
- 적절한 CAD 소프트웨어를 사용하여, 마스크 (1), 유체 층 (전면 측)에 배치. 원하는 응용 프로그램에 적합한 샘플 주입 및 분리를 허용하는 형상을 선택합니다.
- 탄성이 집속 공진 주파수 (f)의 N을 제공하는 w, 유체 채널 폭을 설정할 900 ㎛ 폭 채널 C는 해당 유체의 소리의 속도이고, n은 정재파의 노드 (예를 들어,의 수 방정식 F N = NC / 2w,에있어서, 1 MHz의보다 큰, 2 차원 노드 공명은 F 2 = 1.65 메가 헤르츠)로 예상된다.
참고 : 입자별개의 콘센트에서 종료한다 분리 채널의 끝 부분에 별개의 측면 위치를 점유이야. 이 프로토콜에서, 입자 크기에 의해 분리되므로,도 1에 도시 된 바와 같이 출구 각각 작은 입자와 큰 입자 출구 용 SPO 및 LPO를 지정된다. - 시간 입자의 길이가 특정 유량으로 분리 필드에 노출을 제어하기 위해 유체 채널 길이를 설정한다. 긴 입자가 분리 세력으로 인해 마이그레이션하기위한 온 - 칩의 체류 시간이 더 필요한 칩 공간에 대한 해제 거래해야합니다.
주 : 우리의 탄성 집속 장치에있어서, 유로가 증가 체류 시간 (도 2a)에 대한 세 개의 칩 아래를 통과한다. 300 X 200 μm의 단면을, 117 mm 길이 분리 채널을 통해 유동하는 200 μL / 분으로, 입자의 전형적인 총 유량 음향 분야에서 평균 2.1 초에 보낸다.
- 탄성이 집속 공진 주파수 (f)의 N을 제공하는 w, 유체 채널 폭을 설정할 900 ㎛ 폭 채널 C는 해당 유체의 소리의 속도이고, n은 정재파의 노드 (예를 들어,의 수 방정식 F N = NC / 2w,에있어서, 1 MHz의보다 큰, 2 차원 노드 공명은 F 2 = 1.65 메가 헤르츠)로 예상된다.
- 마스크 layo에서 유체 포트를 포함표준화 된 그리드 (5-mm 피치)에 배치 된 표준 튜브에 연결 UT. 제조 및 개별 장치의 다이 싱 동안 서로 마스크의 정렬에 적합한 기준 마크를 포함합니다.
- 마스크 2 만 유체 포트가 포함 통해 레이어 (뒷면)을 배치합니다. 정렬 1 마스크에 대한 기준 마크를 포함합니다.
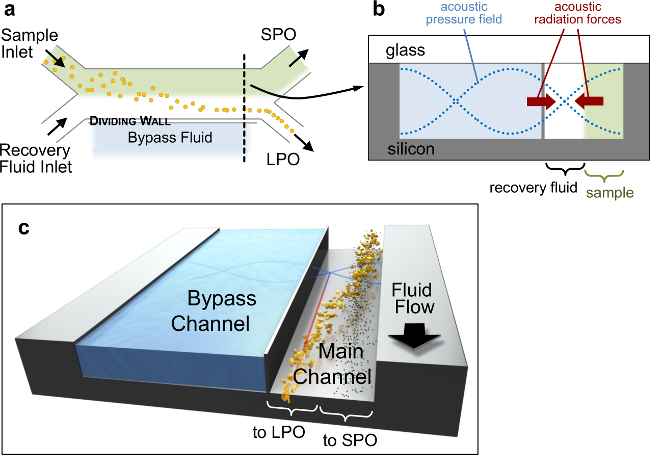
그림 1. Acoustofluidic 장치. acoustophoretic 장치 구조의 도식 스케치. () H-전체 필터 구성을 도시 상위 뷰 (축척되지 않은). (b) 검정에 의해 표시된 위치에서 상기 채널 단면의 회로도에 파선 (A), 압력 장 (청색 점선)을 향하여 입자들을 구동 탄성 차 방사선 힘 (PRF)의 감각을 도시 마디면 (빨간색 화살표). 채널 단면적약 10 μm의 두께 주 (300 μm의 폭) 및 바이 패스 채널 분리 벽 900 × 200 μm의입니다. (C) 입자 분리의 3D 표현입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Acoustophoresis을위한 미세 유체 칩 2. 클린 룸 제작
- 패턴 양면에 마스크 2를 이용하여이면 측의 유체 포트는 표준 포지티브 형 레지스트를 포토 리소그래피에 의해 0.5 mm의 두께, 100 mm 직경의 <100>의 실리콘 웨이퍼를 연마. 350-400 ㎛의 깊이로 깊은 반응성 이온 에칭 (DRIE)에 의해 에칭 형상이.
- 웨이퍼를 뒤집어, 패턴 전면 유체 채널 구조 표준 마스크 1을 사용하여 실리콘의 다른면에 포토 리소그래피를 긍정적 인 레지스트. 이어서, 포토 레지스트를 사용하여 초 (빈 실리콘) 웨이퍼 캐리어 소자 웨이퍼를 탑재.
- 관통 에칭 포트 위치 (웨이퍼 캐리어는 DRIE 공구 표면 보호)에 실리콘을, 200 ㎛의 깊이로하여 DRIE 또한, 채널 에칭. 에 몸을 담근 솔루션을 레지스트 제거하여 빈 Si 웨이퍼에서 장치 웨이퍼를 드 마운트.
- 소자 웨이퍼와 (1 (3)의 비율에 황산과 과산화수소) 피라냐 용액을 사용 특색 0.5 mm 두께의 붕규산 유리 웨이퍼를 청소한다.
- 양극 다음 매개 변수를 사용하여 유리, 실리콘 웨이퍼를 접합하여, 유체 채널 인쇄 : 350 ° C에서 1,000 N, 온도 3 mTorr의 피스톤 압력에서 챔버 압력을 0.2 mA 미만이 될 때까지 750 V를 적용.
- 다이 싱 톱에 다이아몬드 블레이드와 개별 칩을 따로 따로 잘라.
3. 최종 장치 조립
- 압전 트랜스 듀서 부착
주 : 초음파 실리콘 측에 부착 된 압전 - 세라믹 변환기에 의해 마이크로 유체 칩에서 발생된다.- 시에서우와 성분 저점도 에폭시 키트, 두 구성 요소의 권장 비율을 무게 철저히 섞는다.
- 피펫 에폭시 혼합물을 분배하고 얇은 심지어 층 (37.5 × 10 × 0.5 mm의 치수를 갖는 압전 용 에폭시 혼합물의 약 10 μL)을 생성하는 티탄산 지르콘 산납 (PZT) 압전 세라믹 고르게 확산.
- 적합한 지그 또는 고정구를 사용하여, 후속 와이어 부착 (도 2a 참조) 일측에 돌출 된 영역을 제공하고, 미세 유체 칩 압전 - 세라믹의 에폭시 측 정렬하고 접촉하는 두 성분을 가지고. 구성 요소의 균열 않도록주의하면서 바이스 클램프 조립체, 및 에폭시 제조자가 권장하는 온도에서 경화 및 기간.
- 에폭시가 경화되면, 와이어 t 않도록 압전와 가장 짧은 가능한 접촉을, 미세한 팁 납땜 인두로 납땜함으로써, 압전 세라믹의 각 측면에 이르게 미세 게이지를 부착hermally 해제 편광을. 또한, 압전에 와이어를 접착제에 도전성 접착제를 사용합니다.

그림 2. 유체 브레드 보드, 칩 장착 및 세계 - 투 - 칩 인터페이스입니다. (A) 음향 미세 유체 칩의 사진 부착 된 압전 변환기 와이어 리드 (70 × 9 × 1mm의 외부 치수), 분리의 세 가지 패스를 보여주는 칩 아래로 채널 (B)의 칩 - 대 - 세계 인터페이스, (C)의 클램핑기구를 사용하여 유체 브레드 보드의 밑면에 장착 된 칩에 대한 사용자 유체 나사 피팅 및 가공 튜브 성분 브레드 보드에 개구를 스패닝 있도록 TUBI 인터페이스 냉각 팬, (d) 연결된 호스 연결 장치 및 냉각 팬과 브레드의 평면도, 및 (e)의 나사 부속품의 단면 개략도장착 된 마이크로 유체 칩 겨. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 장치 설치 및 세계 - 투 - 칩 인터페이싱
- "유체 브레드"클램핑기구를 사용하여 (관통 구멍 스레드 정기적 간격의 격자 판)에 칩을 부착합니다. 탄성 실험시의 온도를 조절하는 회로판에 냉각 팬을 부착 (도 2 참조).
주의 : 전형적인 구동 전압에서 작동하지 않고 냉각 팬은 70-80 ℃로 소자 온도를 올린다. 이로 인해 인해 유체의 변경 음속에 공진 주파수를 이동하고, 부정적으로 처리되고있는 생물학적 입자의 생존에 영향을 미칠 수 있습니다. - 이전에 다른 곳에서 (22)을 설명하고 그림 2, 칩 - 투 - 세계 커넥터에 나사.이 내가 가입표준을 사용하여 입구와 출구에 추가 튜브에 nterface 튜브 ¼ "-28 1/16에 대한 노동 조합"튜브.
- "유체 브레드"클램핑기구를 사용하여 (관통 구멍 스레드 정기적 간격의 격자 판)에 칩을 부착합니다. 탄성 실험시의 온도를 조절하는 회로판에 냉각 팬을 부착 (도 2 참조).
음향 초점 성능 4. 특성
참고 : 음향 초점을 특성화에 필요한 시스템 구성 요소는 재료 목록에서 함께 그룹화됩니다. 4.1 단계 및 후속 단계는 여기에서 논의 acoustofluidic 장치에 특정 작업을 설명하는 반면, 4.2 이하,이 플랫폼에 사용되는 핵심 장치에 적용됩니다.
- 시스템 구성
- 유체 펌프 및 수집 바이알에 호스 (예컨대 1/16 "외경 불소 수지 튜브)를 사용하는 제 3 연결 제조사의 설명에 따라, 유체 브레드 보드 세계 - 칩 접속을 이용하여 미세 유체 칩을 조립한다. CCD 카메라가 장착 형광 이미징 할 수있는 현미경의 무대에 브레드 보드 어셈블리를 장착합니다.
- 작은 내부 diamete의 길이를 연결R (ID) 튜브 즉시 시스템을 안정시키고 칩 출구 사이의 흐름 분할을 제어 흐름 제한, 역할을 할 수있는 칩 (그림 4 참조) 후 (0.006은 "권장)를. 다른 모든 연결 들면, 0.01 "0.03"와 같은 더 큰 ID 튜브를 사용합니다.
- μ는 유체의 동점도이며 길이 (L) 및 식 R H를 이용하여, 내경 D = 128 μL / πD 4와 튜브의 각 부분의 유체 유동 저항 R H를 추정한다. 인해 주어진 유량 Q에서 튜브의 각 길이에 대한 압력 강하 Δ Δ P는 P = H의 QR 주어진다.
- 분리 방법이 사용되기에 적절한 출구 사이의 유동을 분할 제한 기의 길이의 비를 선택한다. 이 프로토콜의 음향 칩 최적의 분리는 SPO가 필요합니다 approxima의 LPO 흐름 비율을tely 65 : 35 %.
- 출구 흐름 제한 기의 길이를 선택하도록 그들의 유체 저항 시스템 (적절히 직렬 또는 병렬로 합산)의 나머지의 총 저항보다 적어도 3-4 배 더 크다. 이 연구에서 사용 된 acoustophoresis 장치, 튜브 (35)의 길이와 LPO와 SPO에 대한 65cm가 적당하다.
참고 :주의 깊은 고려가 어떤 미세 유체 핵심 장치의 R h를 부여해야합니다. 우리의 탄성이 일에 칩을 포커싱, R h를 인해 상대적으로 큰 채널 크기로 낮고, 그렇게 연결된 호스 저항을 쉽게 초과. 작은 채널 치수 장치의 경우, 칩의 저항은 케이스 디자인 및 온 - 칩 채널 R (H)의 제어는이 프로토콜의 1 단계 동안 추가로 고려하는 시스템 튜브의 나머지를 지배 할 수있다. 상세 설계 원칙과 가이드 라인은 문학에서 사용할 수 있습니다. (23, 24)
- 시스템 검증
- 누수가 미세 유체 장치는 결함이 없으며 모든 배관 연결이 밀봉되어 있는지 확인하기 위해 확인. 주사기와 필요에 따라 유입 관을 통해 물을 분배하고 메인 채널에서 유체 누출 모니터링.
- 칩을 통해 공지 된 체적을 분배하고, 유량비가 예상대로되도록하여 콘센트로부터 수집 된 양을 측정한다. 예상 부피비에서 편차는 콘센트 또는 누출 연결 중 하나에 방해가있을 수 있습니다.
- 시스템 청결을 유지하고 이전과 어떤 실험을 실행 한 후 적절한 세척 용액 (예를 들어, 표백제, 에탄올, 물)로 전체 시스템 (유체 튜브 칩)을 높이 막힘 방지합니다.
- 막힘을 취소 할 수있는 명확한 콘센트를 연결하면서 출구 중 하나 막힘 또는 방해의 경우, 시스템을 세척하십시오. 이것이 실패 할 경우, 플러싱시 유동 방향을 역전임의로 (수동 작동 식 주사기를 사용)의 신속한 역류 펄스를인가. 여전히 방해를 제거 할 수없는 경우에 마지막으로, 필요에 따라 튜브 또는 칩을 대체.
- 음향이 초점에 대한 주파수 스캔 설정
- 이러한 탈 이온수, 에탄올, 또는 주사기와 수동 주입하여 인산염 완충 식염수 (PBS)로 유체 바이 패스 채널 (그림 1 참조)를 입력합니다. 샘플을 처리하는과이 유체가 접촉하지 않습니다. 다른 유체를 바이 패스하여 노드의 위치를 조정하는 다른 사항 16,17 설명된다. 노드가 분할 벽에 근접해야하는 경우, 간단히 말해서, 에탄올과 같은, 낮은 밀도 우회 유체를 사용한다; 가까운 입력 샘플 스트림 노드 배치, 예컨대 글리세롤 용액으로서, 유체 밀도를 선택한다.
- (V / W) 5-8 ㎛의 중합체 형광 비드와 같은 PBS로 완충액 약 0.01 %의 비드 용액을0.05 % 트윈 -20과 비드 용액과 시료 주입구 주사기를 채우기. (이 바이 패스 통로와 동일한 액체 일 필요는 없다) 버퍼와 같은 버퍼 입구 주사기를 채우기. 일반적으로, 버퍼가 애플리케이션 (단계 5.1 참조)에 맞게 선택되고 있습니다.
- 현미경 스테이지와 유체 브레드 단지 시야에 두 채널 (분리 및 수동)와 배출구 전에 직선 채널 영역에서 채널의 깊이로 대략 반쯤 초점. 추가 경사 각도 외부 광원은 화상 데이터의 성공적인 사후 처리를 위해, 채널 벽이 표시되도록 요구 될 수있다.
- 자동 주파수 스캔 및 이미지 캡처
- 압전 변환기에 자극 신호를 전달하기 위해 무선 주파수 (RF) 증폭기와 함수 발생기 (예를 들면, RG-58 BNC 커넥터가 장착) 차폐 케이블을 사용하여 전기 접속을 만든다. 선택적으로,에 오실로스코프를 연결실제 전압을 모니터링하기위한 함수 발생기의 출력은 트랜스 듀서에 적용.
- 냉각 팬 켜고 피크 - 피크 (V의 PP)을 볼트 압전 변환기에 RF 증폭기의 출력은 12-25의 범위가되도록 함수 발생기 세트.
- (50) 200 μL / 분 사이에 같은 유량에 모두 주사기를 설정합니다. 모두 동일한 모터를 구동하기 위해 주사기 단일 시린지 펌프를 사용하는 것이 흐름에 교란을 최소화하도록 권장한다.
- 시작 및 끝 주파수들, 주파수 값의 스텝 사이즈, 및 내셔널 인스트루먼트의 LabVIEW 같은 실험실 자동화 도구 키트를 사용하여 압전 구동 전압을 지정하여 주파수 스캔 절차를 수행한다.
- 각각의 주파수 단계에서 시스템이 평형화 후 (권장 10 및 100 밀리 초 사이의 노출 시간) 10 후속 분석을위한 칩에 흐르는 구슬의 이미지를 캡처 할 수 있도록 15 초 동안 전압을인가한다.
- 전자 사이ACH는 구슬이 채널을 통해 균일 재배포 이전에 적용된 주파수 단계에서 초점에 편견을 제거 할 수 있도록 약 20 초 동안 전압을 끄고, 주파수 단계를 적용했다.
- 이미지 분석은 공진 주파수 및 초점 위치를 확인하는 방법
- (예 :이 의정서와 함께 제공되는 AF_freqScanPlotter.m MATLAB 스크립트로) 이미지 분석 스크립트를 실행하고 프롬프트에 필요한 정보를 입력 : 단계 4.4에서 생성 된 이미지 파일의 목록을 선택, 스캔 시작을 입력 주파수와 스텝 크기를 중지 전체 채널 폭, 벽 위치, 그리고 마지막으로는 분리 및 바이 패스 채널을 모두 포함하여 분석하는 화상 영역을 선택한다.
- 분석 스크립트 평균 각 주파수 단계에서 촬영 된 이미지들의 세트를 관찰하고, 유동 방향을 따라 강도 값들을 평균화. 이 형광 강도의 단면 선 - 스캔을 초래한다.
참고 : highe에 해당하는 주파수 세인트 강도는 공진 주파수 (도 3, 중간 행), 및 높은 강도가 초점 위치 (도 3, 하단 행) 인 발생 채널의 위치로서 정의된다.

잘 결합 (A)에 대한 주파수 스캔 데이터와 제대로 결합 (B) 피에조 칩의 그림 3. 대표 주파수 스캔. 예. 상위 행 : 구슬의 형광 강도 (빨간색 높은 나타내고, 파란색은 낮은 강도를 나타냅니다). 중동 행 : 각각의 주파수에서 최대 강도. 하단 행 : 최대 강도에 의해 결정되는 빨간색 점선이 위치를 중심으로 예측 나타냅니다 최대 강도의 위치 및 빨간색 다이아몬드는 공진 주파수를 나타냅니다.G "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 자동 분리
참고 : 자동 분리 실험으로 인해 미세 유체 칩에 적용되는 크기에 의존하는 음향 초점 힘 작은 입자가 큰 입자를 분리하기 위해 실행됩니다. 필요한 시스템 구성 요소는 자재 목록에서 함께 그룹화된다.
- 시스템 구성 및 샘플 준비
- 도 4에 도시 된 바와 같이, 주사기 펌프에 미세 유체 칩을 연결하는, 컴퓨터 - 제어 멀티 - 포트 선택 밸브는, PC-인터페이스 유량계 및 튜빙.이 구성은 미세 유체 분리 칩을 통해 샘플 처리를 자동화뿐만 아니라 자동화 가능 실험 사이의 단계를 청소 교차 오염 및 샘플 이월을 제거합니다.
- 분석에 의해 분석에 필요한 세포 또는 입자에 적합한 샘플 버퍼를 사용하여 분리하거나 할분리 후 사용. 단계 4.3.2에서와 같이, 복구 완충액 (그러나 반드시 우회 유체) 샘플 유체와 일치해야한다.
참고 : 일반적으로 생체 시료 (예를 들어, PBS)와 함께 사용되는 모든 수성 버퍼는 물과 유사한 음향 특성을 가지고 있으며 상당히 음향 장치의 성능을 변경하지 않습니다. 밀도와 물에서 크게 다른 점도 샘플 유체의 사용은 가능하지만, 오직 중요한 acoustophoresis 경험을 가진 운영자 추천했다.

자동 분리 실험에 대한 그림 4. 음향 시스템 구성. 파란색 선이 시스템을 통해 주 흐름 경로를 추적. 모든 녹색과 검은 색 선 0.03 "내경 (ID) 튜브, 모든 파란색과 회색 컬러 라인은 0.01이다"입니다 전자와, ID 튜브ID "0.006이다 ID, 및 흐름 제한"0.03이다 들고 코일의 xception. 주사기가 버퍼로 가득하고, 유지 코일이 주사기에 어떤 샘플이나 청소 시약의 흡수를 방지하기 위해 충분한 볼륨 (550 μL)를 가지고있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 분리 절차
- 사전 실행 상태. 분리를 실행하기 전에, 청소 시약 저수지 (표백제, 에탄올, 버퍼가) 충분한 유체를 가질 수 있도록, 폐기물 저장소가 가득하지 않고, 유체 라인을 준비하는 (즉, 솔루션 가득). 후자의 조건이 불투명하거나, 시스템이 아이들 한 후 처음으로 실행되는 경우 (예를 들어, 특정 일에 처음으로), 자동 청소 절차를 실행하는 경우 (아래의 단계 5.3 참조). rese을 낭비 흐름 칩 출구에서 밸브 3과 4를 설정합니다처음 rvoirs.
- 냉각 팬의 전원을 켜고 4.5 단계에서의 결정에 따라, 사용되는 음향 칩의 공진 주파수 함수 발생기를 설정합니다. 함수 발생기에 전압 세트 포인트를 조정되도록 원하는 분리에 적합한 12, 25 V의 프로파일 사이의 RF 증폭기 출력한다.
- 시스템에 샘플 입력 유리 병, 버퍼 입력 유리 병, 적절한 수집 튜브를 연결합니다. 그냥 그 픽업 튜브에 샘플 입력 병을 연결하기 전에, 소용돌이 유리 병 간단히 해결 할 수있는 어떤 입자를 다시 일시 중지합니다. 이어서, 바이알을 첨부 지체없이 분리 루틴을 개시.
주의 : 처리 될 샘플 감염원을 포함하는 경우, 바이알을 밀폐 시스템을 유지하고 시료 에어로졸을 방지하기 위해 상부 스크류 타입이어야한다. 생물학적 재료로 작업 할 때 필요한 보호 장비를 착용하고 REQ를 사용하는 동안 또한, 모든 튜브 및 튜브를 처리생물학적 위험 그룹 및 바이오 안전성 수준에 대한 uired 위험 통제 및 절차는 재료에 적합합니다. 불확실성의 경우에는 기관의 정책 및 프로토콜을 참조하십시오. - , 밸브를 제어 센서 흐름과 완전 자동 분리 루틴을 수행하기 위해 펌프 실험실 자동화 툴킷에서 프로그램을 사용합니다.
주 : 루틴, 밸브 스위치는 주사기 펌프 탈퇴를 작동 및 주입 및 모니터가 제대로 출력 샘플 분획 수집을위한 타이밍을 센서 데이터 흐름. 수동으로 수행 것처럼 주요 단계는 5.2.4.3을 5.2.4.1에서 다음과 같이 요약 할 수 있습니다.- 프라임 픽업 튜브. 완전히 동시에 밸브 (1)에 접속하는 튜브를 채우기 위해 샘플 입력 약병으로부터 약 15 μL를 철회, 유사한 방식으로 2 밸브 버퍼 입력 비알 연결 관 프라임, 밸브 (1)의 주요한 공기 입구가되도록 어떤 유체가 포함되어 있지 않습니다. 마지막으로, 낭비 추방 밸브 (1) 및 (2) 스위치로딩 코일 들어간 유체 또는 공기 과잉.
- 도 5a에 도시 된 바와 같이, 샘플 코일을로드. 250 ㎕의 샘플들을 처리하기위한 전형적인 로딩 시퀀스는 50 μL / 분, 200 μL / 분으로 선행 완충액 35 μL이어서 200 μL / 분에서 샘플의 후 250 μL, 최종적으로 공기의 25 μl를 철회하는 것 50 μL / 분 공기의 또 다른 25 μL.
참고 : 모든 볼륨 및 흐름 속도는 사용자가 선택할 수 있습니다. 이 로딩 순서는 유체 플러그가 분리 장치를 통과하는 방법의 역순으로되어 있습니다. - 샘플 주입을 시작합니다. 원하는 속도 (일반적으로 100 μL / 분)에로드 된 유체 플러그를 주입하는 주사기 펌프를 설정합니다. 그 흐름은 정상이고 4.1 단계에서 결정된 비율로, 그 막힘이 발생하지 않은되도록 유량 센서와 SPO LPO의 유량을 감시한다.
- 분리 된 분수를 수집합니다. 유량 센서는 유량에서 스파이크를 검출 할 때, PA를 나타내는제 공극 ssage는 시료 수집 바이알 (스텝 5.2.1에서 시작) 폐기물로부터 대응하는 출력 전환 밸브.
- 칩의 샘플을 통과 한 후, 유량 센서가 제 2 공기 갭을 검출 관찰. 이 시점에서, 다시 낭비 출력 전환 밸브. 단계 5.2.4.2에서로드의 전체 볼륨이 분배 한 후, 시린지 펌프 주입을 중지하고 유량이 0이되면 자동화 루틴을 종료.
- 분리 실험을 완료 한 후, SPO LPO 및 시료 수집 바이알을 분리 및 후속 분석을 위해 적절하게 저장한다.
- 자동 세척 및 오염 제거
참고 : 각 샘플, 플러시를 처리하기 전에 다음과 같은 자동화 된 루틴을 사용하여 전체 유체 시스템의 오염을 제거.- throu 플러시 과도한 세정액을 수집하고 SPO LPO 수집 바이알 튜브뿐만 아니라 빈 튜브에서 샘플 픽업 튜브 확보튜브 GH.
- 자동 청소 시스템 루틴을 시작합니다. 단계 5.2에서 자동화 된 분리 절차와 마찬가지로, 밸브 및 주사기 펌프를 제어한다 프로그램 세정 시약 유지 코일을 순차적으로 로딩, 그리고 시스템을 통해 플러시.
- 70 % 에탄올로 한 다음, 10 % 표백제로 세척하고, 물 또는 적절한 생리 식염수 완충액으로 종료 (예를 들면, 1X PBS 또는 시료 처리에 사용 된 버퍼) : 다음 세정 루틴을 수행한다. 표백제 및 에탄올 450 μL, 물 / 버퍼 1,000 μL 다음 플러시 볼륨을 사용합니다.
- LPO 출구 밸브가 차단되어 포트로 설정되어있는 동안 세척 단계 동안, 유출 흐름 제한에 잠재적 막힘을 제거하고, 반대로 후, SPO에 각 시약을 세척. SPO 또는 LPO 하나가 차단 될 때 튜브와 배압 축적에 기포 발생을 최소화하기 위해 300 ~ 500 μL / 분의 회수 및 주입 흐름 속도를 유지한다.
- Disca과량 플러싱 솔루션들이 생물학적 또는 화학적 폐기물을 처리하기위한 적절한 절차를 수행하여 수집 된 튜브를 RD.
결과
탄성 미세 유체 소자 설계의 주요 기능은도 1에서 강조하고, 완전히 다른 곳에 기재되어있다. (15)를 간략하게, 두 개의 유체 스트림 흐름 나란히 분리 채널에서 얇은 실리콘 벽에 의해 병렬로 바이 패스 통로로부터 분리. 주 사력 크기는 입자 부피 스케일링 때문에 작은 입자는 원래의 스트림 (도 1B, C)에 남아있는 반면, 큰 입자는, 인접한 회수 액체 스트림에있는 음압 노드 향해 혼합 샘플 입력 스트림 밖으로 이동한다. 분할 된 2 채널 구조는 입자 분리 (17)를 개선하고 다른 바이 패스 통로의 유체를 사용하여 노드 위치의 조정을 허용한다. 세계 연결 칩 16 유체 브레드와 조명기는 강력한 플랫폼을 제공하며, 모듈 식 설계는 유체 칩 사이의 빠른 변화를 가능하게 (그림 2). 이 Configuration 마찬가지로하는 실 1,000 PSI까지, 빠르고 안정적으로 (그림 2B, E)를 만들 수, 가역 유체 연결을 할 수 있습니다.
칩의 공진 주파수 f res를, 간단한 1D 분석 계산을 이용하여 추정 될 수있다 (1.1.1 단계를 참조). 우리의 디바이스 단면 (16)의보다 완전한 2 차원 유한 요소 모델에서 2 노드에 대한 예상 공진 초점 위치는 벽으로부터 225 μm의하며 예상 주파수는 1.68 메가 헤르츠이다. 그러나, 실제 장치의 F 입술은 작동 온도와 종 방향 및 횡 방향 공진의 결합에 따라 ± 100 kHz의에 따라 다를 수 있습니다. 프로토콜의 단계 4에 기재된 바와 같이, 따라서, 장치 조립 후, F 입술 경험적 관련 유속 및 압전 구동 전압에서 검증되어야한다.도 3은 200 μL / 분에서 찍은 대표 주파수 스캔을 도시 주 바이 패스 채널의 물, 20 V의 PP와 피에조에 공급된다. 압전 및 미세 유체 소자 사이에 결합하면 좋은 경우에는, 입자가 예상 초점 위치 (도 3a)에 대한 형광 강도와 이주에 명확한 피크 결과, 공진 주파수에 밀접하게 초점을 맞출 것이다. 열악한 커플 링이있을 때 대조적으로, 입자는 잘 집중되지 않고 주파수 스캔 결과는도 3b와 유사 할 것이다. 이러한 장치에서, 압전 변환기는 가역 접착제가 사용 된 경우, 재 장착 될 필요가있다; 초점을 고품질 또는 빠른 흐름이 필요한 응용 프로그램에 중요한 경우 그렇지 않으면,이 장치는 적합하지 않다. 도 3의 데이터는 후속 실험에서 동작 주파수의 선택, 및 전압을 통보하고 효율적인 입자 분리 가능한 유량 범위.
파일 / ftp_upload / 53051 / 53051fig5.jpg "/>
도 5는 시료 처리를 자동화. 샘플 코일에 넣은 시료 (A) 회로도. (B)를 성공적으로 분리 실험의 대표적인 흐름 프로필. (C) SPO 콘센트가 약 220 초에 막혀있는 동안 실행의 분리에서 프로필을 흐른다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
효과적인 구분자이다 칩을 식별 한 후, 이들은도 4에 도시 된 시스템에 통합된다. 전체 시스템 배기량이 주 유동 경로를 따라 0.01 "내경 튜빙을 사용하여 최소화된다 (블루 라인).도 5a는 화장을 도시 시스템을 통해 주입 전형적인 샘플 플러그. "선행 버퍼"(~ 35 μL)의 소량 prece 데 필요한드 샘플 분리 칩을 통해 이동하는 동안 흐름의 변동을 제거하기 위해 흐름의 샘플.도 5b는 성공적 자동화 탄성 분리 실험에 의한 데이터 플로우를 도시한다. 성공적인 실행의 주요 기능은 다음과 같습니다 LPO와 SPO 모두 유량 (1) 과도 상승 압력을 구축하고 유체 시스템을 통해 흐르기 시작으로, (2) 기포의 흐름을 나타내는 날카로운 스파이크 ( 인셋 인해 두 콘센트에서 불균등 흐름 LPO 전에 SPO 도달해야 단일 기포)의 확장 된 프로파일을 나타내고, 시스템을 통해 샘플을 이동함에 따라 두 기포 사이 모두 출구 내지 (3) 안정 흐름 및 (4) 전체 샘플 부피 전후 출구에서의 유량의 점진적인 감소는 시스템에 전달된다. 문제가 실행은 SPO 약 2백20초 후 막힌되었다 것으로 보인다 5C를 그림과 유사한 흐름 프로필에서 바로 알 수 있습니다. 생에서 (S)의 경우, 단계 5.3에 기재된 것과 유사한 세정 절차는 채널을 방해를 없애기 위해 실행되어야한다.
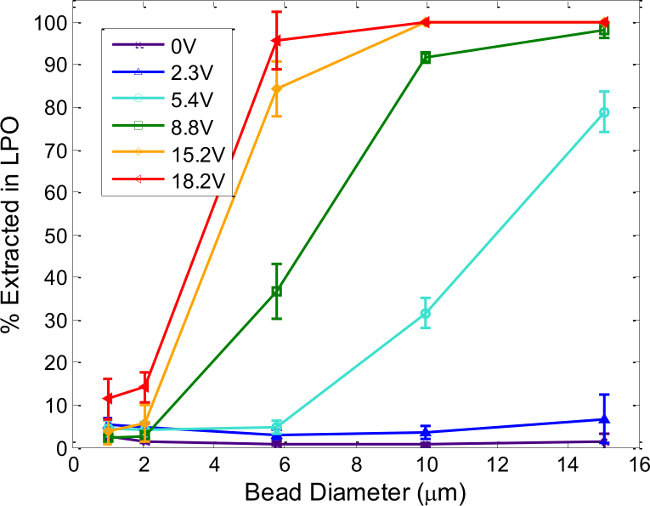
그림 6. 장치 조정 기능 : 입자 크기 및 전압 효과. LPO 추출 폴리스티렌 미소 구의 %가 압전 - 세라믹에 공급 입경 및 전압에 의존한다. 각 라인은 장치를 통해 단계 4. 총 유량에 기재된 바와 같이 결정된 공진 주파수에서 다른 동작 전압에 대응하는 200 μL / 분, 1.62 및 1.64 MHz의 사이에인가 된 구동 주파수와. 오차 막대는 적어도 세 개의 별도 실험의 표준 편차를 나타낸다. 재현과 http://pubs.rsc.org / EN / 내용 / ArticleLanding / 2014 / / c4an00034j에서 화학의 왕립 학회의 허가에 의해 수정.대상 = "_ 빈">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
도 6에 도시 한 다양한 폴리스티렌 입자 크기 및 효율적인 분리를 위해 필요한 동작 파라미터를 보여 압전 구동 전압을 사용하여 분리 결과를 컴파일. 예상대로 일반적으로 높은 전압 (즉, 더 큰 음향 힘은), 작은 입자를 추출해야합니다. 구동 전압은 무한정으로 인해 큰 방열 및 음향 흐름의 증가 효과, 그러나, 증가 될 수 없다. 13 플롯은 특정 구동 전압에서 상당히 다른 복구 (예를 들어, 10 - 표시 입자 분리 입자 크기에 대한 일반적인 가이드 역할 8.8 V PP에서 2 μm의 입자)가 잘 분리됩니다. 일반적으로, 바이러스 (~ 100 ㎚)와 셀 (~ 10 μm의)은 DIFF의 셀 수있는 바와 같이, 신속하고 효율적으로 분리 할 수있는 바와 같이 큰 사이즈의 차이 입자 개체군erent 크기 (예를 들어, 6-8 ㎛의 원반형 8-15 μm의 적혈구 및 백혈구). 다른 유형의 세포와 함께 작동하기 위해 필요한 조건은 특정 세포 형태, 밀도 및 압축성으로 셀 크기에 추가하여, 그 탄성에 영향을 미치는 반면, 경험적으로 결정되어야한다. 이를 위해, 단계 4의 절차는 임의의 새로운 셀 또는 입자 형 분리에 사용 가능한 상태를 결정하는데 유용하고,뿐만 아니라, 특정 acoustophoresis 장치의 품질을 평가하기위한 것이다.

세포 바이러스 스파이크 된 시료도 7 분리 효율. 골든 게이트 바이러스 (GGV)으로 스파이크 뎅기 바이러스 (DENV) 및 (B)는 Raji 세포와 보아 신장 세포 타서 (A)는 Raji 세포로부터 분리 결과. 회수 백분율은 특정 바이러스에서 종료 또는 세포의 비율로서 정의된다칩 배출되는 총량에 비해 출구. (B)에서 샘플 의해서만 가능한 낮은 양으로 한 번 처리 된 반면에 대한 오차 막대 (A)는, (3) 시험의 표준 편차이다. 1X PBS는 모든 실험에 대한 바이 패스 통로에 물, 샘플 버퍼 및 복구 유체로서 사용 하였다. 칩의 동작 주파수는 16, 20 V의 PP 사이의 구동 전압과, 1.60 및 1.64 MHz의 사이였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
인간은 Raji 세포 (105 세포 / ㎖, 평균 직경 80-10 μm의 25) 뎅기 바이러스 (DENV 10으로 스파이크 : 생물학적 입자 분리 본 플랫폼의 유용성을 입증하기 위해, 우리는 첫 번째 잘 특성화 생물학적 시료를 처리하는 데 사용 5 PFU / ㎖, 대략 직경 50 nm의 26). 그림 7는 (칩으로부터 수집 된 각 입자의 총량과 비교하여 각각의 출구로부터 수집 된 각 입자 형의 분율로 정의)와 SPO LPO 모두 수집은 Raji 세포 DENV의 비율을 나타낸다. 실험을 3 중으로 반복하고, DENV가 정량 역전사 중합 효소 연쇄 반응 (RT-qPCR에)를 사용하여 정량 하였다 동안은 Raji 세포는 코 울터 계수기를 사용하여 정량화 하였다.
다음으로, 시스템의 성능은 입자의 정확한 물리적 특성을 알 수있을 수있는 임상 시료를 처리하기위한 더 현실적인 시나리오에서 시험하고, 샘플 가능한 수량은 낮다. 여기, 우리는 아직 측정되지 않은 최근에 확인 된 골든 게이트 바이러스 (GGV), 뱀 병원체 감염 보아 신장 세포. 27 GGV 바이러스 입자의 크기의 분리를 평가하지만, GGV는 Arenaviridae 제품군에 속하는 때문에, 의 가능성이있다비슷한 크기, 내지 100 nm 사이에 150. 28 우리는 GGV와 샘플 처리는 라지 인간 세포 (안 바이러스 감염 대상)와 보아 신장 세포 (GGV에 대한 감염 대상, 대략적인 크기 (10) (104 PFU / ㎖)를 아군 104 세포 / ㎖에서 두 세포 유형과 27 μm의). 이러한 샘플은 낮은 수량에 사용할 수 있었던 것처럼, 하나의 실험 실행에서 분리 결과는 그림 7B는 라지 세포, 보아 세포의 비율을 보여줍니다.이 연구에서보고하고, GGV는 SPO와 LPO에서 수집됩니다. 세포는 hemacytometer에 계산하여이 실험에서 정량화 된 바이러스는 RT-qPCR에 의해 정량화 하였다.
토론
이 프로토콜은 자동화 된 생물학적 샘플 처리를 수행하도록 거시적 장비 미세 유동 장치의 시스템 레벨의 통합을 제공한다. 이 플랫폼의 모듈성은 예를 들어, 제시된 프로토콜은 특성화 및 acoustofluidic 입자 분리 장치의 성능을 최적화에 초점을 맞추고, 그 어떤 연속 흐름 장치에 적용 할 수 있도록하고. 이 프로토콜의 세 가지 주요 장점이 강조된다 (I) 모듈 및 칩 - 투 - 세계는 장치의 성능 (II) 강력한 특성 및 입자 분리에 대한 정밀하게 측정 된 샘플 볼륨 (III) 자동 처리, 인터페이스.
나는. 모듈화 및 칩 - 투 - 세계의 인터페이스
도 2에 도시 된 바와 같이, 마이크로 유체 칩은 용이하게 직접 관찰 용 현미경의 스테이지에 맞게 맞춤형 브레드 보드에 장착된다. 브레드 보드는 5mm 피치 그리드, ENA에 # 6-40 UNF 나사 구멍이 포함되어칩을 블링은 확보하고, 유체 연결 할 수 있습니다. 유체 연결은 가공 끝으로 튜브를 PEEK되는 고무 얼굴 밀봉 가스켓 및 스테인레스 스틸 칼라와 유체 칩에있는 실. 이 인터페이스 방식은 쉽게 칩 교체 및 신속한 장치의 재 설계, 몇 가지를 요구하거나 다른 시스템 구성 요소에 대한 변경없이 제공 칩 발자국 그리드 형식을 준수있게. 예를 들어, 우리는 연속 흐름 전기 열 세포 용해, 화학 합성 시약 29 빠른 혼합 및 단일 셀 포착 및 심문 마이크로 유체 칩이 플랫폼을 사용했다.
II. 장치 성능의 강력한 특성
어떤 미세 유체 분리 장치의 성능을 최적화하기 위해, 그 동작은 제 철저 특징되어야한다. 여기에 설명 된 시스템은 이렇게 빠르고 자동화 된 프로토콜의 개발을 지원한다. 특정 examp 들어탄성 포커싱 장치, 초점 품질, 동작 주파수 및 미세 유체 채널 내의 입자의 중심 위치의 제작은 각각의 디바이스에 대하여 측정되어야한다. 이러한 측정은, 압전 세라믹 구동 주파수와 전압의 유량 범위에 걸쳐 스위핑 필요 고품질 분리 최적 파라미터의 조합을 식별 할. 제시된 프로토콜은 자동적으로 이러한 튜닝 가능한 파라미터를 변화 및 데이터 - 비즈니스 정보를 캡처, 즉 후 처리 품질, 주파수, 및 위치 (도 3)을 중심으로 입자의 필요한 측정을 생성하는 채널에 흐르는 입자의 형광 이미지.
음향 장치 성능의 전체 특성은 반복 단계 4.4 다른 실험 조건에서 필요에 따라 4.5이 필요합니다. 예를 들어, 칩의 절대 위치를 초점 비교적 낮은 유속과 높은 전압에서 주파수 스캔을 실행하여 발견의 노드 위치에 완벽한 마이그레이션을 보장합니다. 또한, 이러한 주파수 스캔은 (알려진 크기의 폴리스티렌 비드 RUN) 장치 조립체의 품질을 평가하거나, (칩 비즈 특성화 된 후) 이전에 알려지지 않은 입자 형태는 시스템에서 동작하는 방법을 결정한다. 가난한 에너지 전달 가진 사람도 집중하지 반면 미세 유체 채널에 압전 세라믹에서 좋은 에너지 전달과 칩이 꽉 높은 유량 (> 1 ml / 분) 및 낮은 전압 (12 ~ 15 V의 PP)에 집중 발생합니다 저 유량 (<100 μL / 분)과 높은 전압 (> 20 V의 PP)에서. 우리는 마이크로 유체 칩과 압전 세라믹 사이의 친밀한 접촉이 유체에 효율적인 에너지 전송을위한 중요한 것으로 나타났습니다. 고성능 장치의 안정적인 생산이 가능하게 미세 유체 칩을 접합하는 압전 세라믹의 최적 방법의 추가 조사.
마지막으로, 완료acoustophoretic 장치의 동작의 포토 미소 행할 분리 실험에서, 4 단계 (도 3)의 관련 동작 파라미터의 함수로서 SPO 및 LPO에서 수집 된 입자 계수와의 이미지 기반 주파수 스캔 측정을 조합함으로써 얻을 수있다 도 6에 도시 된 바와 같이 5 단계에서 설명 된 바와 같이, 자동화 실험 이러한 일련의 급속 입자 분리 장치에 대한 최적의 파라미터 공간을 사용자에게 알려주는, 개개의 디바이스의 성능 및 조정 기능을 특성화 할 수있다.
III. 입자 분리를위한 자동화 된 작은 샘플 처리
성공적인 정확한 미세 유체 칩 기반 시료 처리의 경우, 확실하고 정확하게 미터, 하중이 전달하며 지나가는 유체의 양을 수집하는 것이 중요하다. 샘플 부피가 적은 경우 정밀성이 특히 중요임상 또는 연구 실험실 설정에서 일반적입니다 (~ 0.1 ㎖). (30) 정확한 시료 처리 때 샘플없이 피드백 장치에 주사기와 주입에 샘플을 수동으로 철수를 고용 전통적인 마이크로 유체 실험에 도전 분리 된과가 수집되어야 할 때. 제시된 프로토콜은 샘플 로딩 코일을 고용하고 자동화 된 작은 샘플 볼륨의 분리를 재현 할 수 있도록 유량 센서에서 실시간 피드백과 결합을 토출.
도 5는 전형적인 분리 실험에서 SPO LPO 측정 및 유동 프로파일을 도시한다. 먼저, 적어도 35 μL의 선행 버퍼 샘플 음향 칩에 도달하기 전에 안정적인 흐름을 보장하기 위해로드된다. 때문에 주요 버퍼에 샘플 희석이 과도되기 때문에 100 μL 미만의 샘플 볼륨이 시스템 구성하지 않는 것이 좋습니다. 공기 플러그 번째의 시작 부분에 사용되는주요 버퍼 전에 전자 주입 혼합 시료의 희석 및 유량 센서에 지표로 제공 방지, 다음과 유체에서 샘플 플러그를 분리합니다. 유체로서 초기 과도는 시스템을 통해 이동이 시작된 후, 양쪽에 예리한 스파이크 출구 신호는 제 기포의 통과를 나타낸다. 샘플 시스템을 통해 2 공기 기포가 통과하여 다른 스파이크 및 주사기 펌프 정지 된 후 제로 유량 결국 최종 감소 흐름 이러한 과도 안정된 흐름의 장기간 뒤 따른다.
유량 센서를 통해 공기의 통로 플러그 따라서 비 유체 샘플 볼륨에 의해 손실 된 시료와 희석액을 최소화 시작하고 샘플 수집을 정지 밸브를 전환 트리거 포인트로서 사용된다. 처리 된 샘플 볼륨의 폐 루프 계량 전에 실험 입력 샘플이 변경 될 때마다의 개시에이 값을 재 프로그램 할 필요가 없다. 이 기능은특히 중요한 샘플 량은 많은 임상 시료의 경우, 예를 들어 제한되는 경우. 실시간 흐름 모니터링은 또한 문제에 도움; (예를 들어, 막힘이 출구의 하나에 형성) 나쁨 실행도 5b에서와 같이, 생성 된 플로우 정보로부터 바로 알 수있다.
유연성 및 acoustofluidic 분리 효과 제시 시스템 아키텍처를 사용하여, 정제 DENV 및 GGV 바이러스 축적량을 입증 마이크로 유체 칩을 통해 세포 축적량에 아군 및 처리에 의해 분리 하였다.도 7a는는 Raji 세포가 97, 바이러스로부터 잘 분리되었다는 것을 나타낸다 칩 종료는 Raji 세포의 %함으로써 SPO에 DENV의 고농축 샘플을 떠나는 LPO 것으로 확인되었다. 이에 비해, DENV 분리 효율 DENV의 70 %에서 발견 SPO 칩을 종료하여, 낮았다. 이것은 separati의 회전에 의한 약간의 대류 혼합에 기인 할 수있다채널 있지만 LPO으로 인해 Raji 세포와 함께 마이그레이션 일부 DENV 입자에 가능성. 유선 횡 방향으로 가로 질러 마이그레이션 세포도 낮은 레이놀즈 수에서, 그들과 함께 약간의 유체를 끕니다. 이 메커니즘뿐만 아니라 표면 비특이적 흡착에 의해, 바이러스 입자는 LPO로 옮긴다. 드 노보 시퀀싱이 검출 및 바이러스를 식별하는 데 사용되는 경우 역시, SPO에 DENV의 고농축 샘플은 예를 들면, 중요한 이점이다.
도 7b는 하나의 실험 실행에서, 칩을 종료 보아 세포의 약 70 %는 Raji 세포 거의 100 %의 분리 효율에 비해, LPO에서 발견 된 것을 보여준다. 따라서 작은 탄성 힘의 결과로 인해 Raji 세포에 비해 두 세포 유형을 분리 성능의 차이가 작은 평균 크기 또는 보아 세포의 낮은 밀도에 기인 할 수있다. 이러한 추측과, 보아의 크기, 밀도와 형태를 확인하거나 반박현탁액 세포는 (일반적으로 부착 성장하는) 보아 세포의 정확하게, 추가 조사를위한 노력을 측정해야합니다. 동일한 실험에서와 마찬가지로 DENV 실험으로, 회수 GGV의 대부분은 바이러스 성 분획의 농축을 나타내는 SPO에서 종료.
제시된 데이터는 생물학적 시료를 처리하기위한 다양한 공학 광범위하게 적용 가능한 플랫폼의 고유의 과제를 강조. 중요한 것은, 생물학적 상호 작용은 물리적 및 기계적 효과만큼 큰 역할을 시작할 수 있습니다. 그러나, 이들의 예비 실험은 또한 전력 및 임상 연구 및 응용에 대한 시료 처리 시스템이 구조를 사용하는 가능성을 입증한다. 강력한, 잘 특성화 설계 시스템으로,이 플랫폼은 새로운 과학적 질문에 대한 답을 추구 할 수있는 기능을 제공합니다.
공개
The authors have nothing to disclose.
감사의 말
This work was performed under the auspices of the U.S. Department of Energy by Lawrence Livermore National Laboratory under Contract DE-AC52-07NA27344, and partially supported by LLNL’s Laboratory Directed Research and Development (LDRD) program, 14-LW-077. The authors thank Michael Wilson, Mark Stenglein and Joe DeRisi at the Univeristy of California, San Francisco for generously providing GGV and Boa cell samples. EJF acknowledges support from the LLNL Lawrence Scholar Graduate Program. MS acknowledges support from the UC Office of the President Lab Fees Research Program. LLNL-JRNL-665235
자료
| Name | Company | Catalog Number | Comments |
| Materials required for Steps 1-3: Device Design, Fabrication and Assembly | |||
| Double Sided Polished Silicon Wafer | Silicon Quest International, Inc. San Jose, CA, USA | 100 mm <100> prime wafer | 1-20 ohm-cm, 495 ± 25 µm Double-side polished |
| Glass Wafer | Bullen Ultrasonics, Eaton, OH, USA | 100 mmx0.5 mm Boro | |
| Photoresist, AZ 1518 | MicroChemicals GmbH, Ulm, Germany | AZ 1518 | Photoresist used to adhere wafer to blank wafer for DRIE etching |
| Photoresist, AZ 4620 | MicroChemicals GmbH, Ulm, Germany | AZ 4620 | Photoresist to define fluidic and via mask patterns |
| DRIE plasma etcher | STPS, Newport, NP, United Kingdom | Multiplex Advance Oxide Etch (AOE) ICP system | |
| Wafer Bonder | Electronic Visions Group, St.Florian am Inn, Austria | EVG 501 | |
| Dicing saw | Kulicke & Soffa Industries, Singapore | K&S 982 | |
| Epoxy kit | Epoxy Technology, Billerica, MA, USA | EPO-TEK 301 | Epoxy used to couple piezo and microfluidic chip |
| PZT piezoceramic | Piezo Systems, Woburn, MA, USA | PSI-5A4E | 37.5 × 10 × 0.5 mm |
| 28 AWG Kynar-insulated solid wire | Squires Electronics, Cornelius, OR, USA | UL1422 | |
| 2-part silver epoxy | MG Chemicals, Surrey, BC, Canada | 8331 | Conductive adhesive for attaching wire leads to PZT |
| L-edit | Tanner EDA, Monrovia, CA, USA | Ledit v15.1 64-bit | CAD software for mask layout |
| Materials required for Step 4: Characterizaiton of Acoustic Focusing Performance | |||
| Dual Pump | Harvard Apparatus, Holliston, MA, USA | PHD ULTRA Series, 703007 | |
| 5 ml syringes | Becton-Dickinson, Franklin Lakes, NJ, USA | 309646 | |
| Luer to Threaded port adapter | IDEX, Oak Harbor, WA, USA | P-659 | Connects syringe to tubing |
| Union | IDEX, Oak Harbor, WA, USA | P-623 | Connects world to chip connections to fluoropolymer tubing. Can also use webbed |
| Ferrule 1/4-28 flat bottom | IDEX, Oak Harbor, WA, USA | P-200 | Used with nut to make connections between tubing and syringe, flow sensors and world to chip hardware |
| Nut 1/4-28 flat bottom | IDEX, Oak Harbor, WA, USA | P-202 | Used with ferrule to make connections between tubing and syringe, flow sesnsors and world to chip hardware |
| 1/16" OD Fluoropolymer tubing | IDEX, Oak Harbor, WA, USA | 1912L | Tubing to connect syringe pumps to world to chip connections. Tubing size is not critical during claibration steps (.01-.03" ID typically used, other suitable part numbers: 1907L, 1902L). |
| Small ID fluoropolymer tubing | IDEX, Oak Harbor, WA, USA | 1476-20 | Used for Flow restrictors: 0.006" ID, 1/16" OD FEP |
| PEEK tubing | Connects from chip to fluoropolymer tubing. | ||
| Cooling fan | Multicomp, Leeds, England | MC19663 | |
| Function Generator | Agilent, Santa Clara, CA, USA | 33220A | |
| RF amplifier | ENI, Rochester, NY | 325 LA | Must be able to amplify signals from <1 V in the range of 1-2 MHz to 25 Vpp to the piezo. |
| CCD Camera | Photometrics, Tucscon, AZ, USA | CoolSnap HQ | |
| Inverted Microscope | Zeiss, Oberkochen, Germany | Axiovert S100 | |
| FITC filter set | Chroma Tech, VT, USA | SP101 | |
| Objective, 10X | Zeiss, Oberkochen, Germany | ACHROPLAN | |
| Oscilloscope | Tektronix, Beaverton, OR, USA | TDS3014B | To monitor voltage output by RF amplifier |
| MatLab | Mathworks, Natick, MA, USA | R2014a | |
| Driver interface software to integrate Photometrics camera with LabVIEW | R Cubed Software, Lawrenceville, NJ, USA | SITK | |
| Tween 20 | Sigma Aldrich, St. Lousi, MO, USA | P9416 | |
| Dragon Green Fluorescent 5.76 or 7.32 µm Beads | Bangs Laboratory, IN, USA | FS06F | |
| Additional materials required for Step 5: Automated Separation | |||
| Multiport valves | VICI, Houston, TX, USA | C25Z-3180EUHA | In the current configuration 4 valves are needed |
| Flow Sensors | Sensirion, Westlake Village, CA, USA | SLI-1000 | |
| Fluoropolymer tubing, .01 and .03" ID | IDEX, Oak Harbor, WA, USA | 1902L and 1912L | High purity PFA preferred |
| Nut | VICI, Houston, TX, USA | ZN1PK-10 | Used with ferrule to make connections between tubing and valves. Alternative part numbers: MZN1PK-10, LZN1PK-10 |
| Ferrule | VICI, Houston, TX, USA | ZGF1PK-10 | Used with nut to make connections between tubing and valves. |
| LabVIEW | National Instruments, Austin, TX, USA | LabVIEW Professional Development system | Laboratory Automation Software |
| PBS | Teknova, Hollister, CA, USA | P0200 | |
| Raji Cells | ATTC, Manassas, VA, USA | CCL86 | |
| Boa Cells | Kindly provided by the DeRisi Laboratory at UCSF | ||
| GGV | Kindly provided by the DeRisi Laboratory at UCSF | ||
| DENV | Kindly provided by Jose Pena at LLNL | ||
| Coulter Counter Z2 | Beckman Coulter, Brea, CA, USA | Z2 | |
| Hemacytometer | Fisher Scientific, Waltman, MA, USA | 0267151B | |
참고문헌
- Gossett, D. R., Weaver, W. M., et al. Label free cell separation and sorting in microfluidic systems. Analytical and Bioanalytical Chemistry. 397 (8), 3249-3267 (2010).
- Lenshof, A., Laurell, T. Continuous separation of cells and particles in microfluidic systems. Chemical Society Reviews. 39 (3), 1203-1217 (2010).
- Sajeesh, P., Sen, A. K. Particle separation and sorting in microfluidic devices a review. Microfluidics and Nanofluidics. 17 (1), 1-52 (2014).
- Bhagat, A. A. S., Bow, H., Hou, H. W., Tan, S. J., Han, J., Lim, C. T. Microfluidics for cell separation. Medical & Biological Engineering & Computing. 48 (10), 999-1014 (2010).
- McGrath, J., Jimenez, M., Bridle, H. Deterministic lateral displacement for particle separation a review. Lab Chip. 14 (21), 4139-4158 (2014).
- Jubery, T. Z., Srivastava, S. K., Dutta, P. Dielectrophoretic separation of bioparticles in microdevices A review. ELECTROPHORESIS. 35 (5), 691-713 (2014).
- Jin, C., McFaul, S. M., et al. Technologies for label free separation of circulating tumor cells from historical foundations to recent developments. Lab on a Chip. 14 (1), 32 (2014).
- Trujillo, F. J., Juliano, P., Barbosa Cánovas, G., Knoerzer, K. Separation of suspensions and emulsions via ultrasonic standing waves – A review. Ultrasonics Sonochemistry. 21 (6), 2151-2164 (2014).
- Bridle, H., Miller, B., Desmulliez, M. P. Y. Application of microfluidics in waterborne pathogen monitoring A review. Water Research. 55, 256-271 (2014).
- Mariella Jr, R. Sample preparation the weak link in microfluidics-based biodetection. Biomedical microdevices. 10 (6), 777-784 (2008).
- Gor’kov, L. P. On the forces acting on a small particle in an acoustic field in an ideal fluid. Soviet Physics Doklady. 6, 773-775 (1962).
- Settnes, M., Bruus, H. Forces acting on a small particle in an acoustical field in a viscous fluid. Physical Review E. 85 (1), 016327 (2012).
- Barnkob, R., Augustsson, P., Laurell, T., Bruus, H. Acoustic radiation and streaming-induced microparticle velocities determined by microparticle image velocimetry in an ultrasound symmetry plane. Physical Review E. 86 (5), (2012).
- Bruus, H. Acoustofluidics 7 The acoustic radiation force on small particles. Lab Chip. 12 (6), 1014-1021 (2012).
- Fong, E. J., Johnston, A. C., et al. Acoustic focusing with engineered node locations for high performance microfluidic particle separation. Analyst. 139 (5), 1192-1200 (2014).
- Fong, E. J., Bora, M., et al. Continuously Variable Node Position in a High Throughput Acoustofluidic Device. Micro Total Analysis Systems. , 1184-1186 (2014).
- Jung, S. Y., Notton, T., Fong, E., Shusteff, M., Weinberger, L. S. Spatial tuning of acoustofluidic pressure nodes by altering net sonic velocity enables high-throughput efficient cell sorting. Lab on a Chip. 15 (4), 1000-1003 (2015).
- Franssila, S. Deep Reactive Ion Etching. Introduction to Microfabrication. , 255-270 (2010).
- Sharma Rao, B., Hashim, U. Microfluidic Photomask Design Using CAD Software for Application in Lab On Chip Biomedical Nanodiagnostics. Advanced Materials Research. 795, 388-392 (2013).
- Melin, J., Quake, S. R. Microfluidic Large Scale Integration The Evolution of Design Rules for Biological Automation. Annual Review of Biophysics and Biomolecular Structure. 36 (1), 213-231 (2007).
- Madou, M. J. . Fundamentals of microfabrication: the science of miniaturization. , (2002).
- Krulevitch, P., Benett, W., Hamilton, J., Maghribi, M., Rose, K. Polymer based packaging platform for hybrid microfluidic systems. Biomedical Microdevices. 4 (4), 301-308 (2002).
- Leslie, D. C., Easley, C. J., et al. Frequency specific flow control in microfluidic circuits with passive elastomeric features. Nature Physics. 5 (3), 231-235 (2009).
- Oh, K. W., Lee, K., Ahn, B., Furlani, E. P. Design of pressure driven microfluidic networks using electric circuit analogy. Lab on a Chip. 12 (3), 515-545 (2012).
- Mittelbrunn, M., Gutiérrez Vázquez, C., et al. Unidirectional transfer of microRNA loaded exosomes from T cells to antigen presenting cells. Nature Communications. 2, 282 (2011).
- Acosta, E. G., Castilla, V., Damonte, E. B. Functional entry of dengue virus into Aedes albopictus mosquito cells is dependent on clathrin mediated endocytosis. Journal of General Virology. 89 (2), 474-484 (2008).
- Stenglein, M. D., Sanders, C., et al. Identification Characterization and In Vitro Culture of Highly Divergent Arenaviruses from Boa Constrictors and Annulated Tree Boas Candidate Etiological Agents for Snake Inclusion Body Disease. 3 (4), e00180 12 (2012).
- Packard, M., Wheeler, E., Alocilja, E., Shusteff, M. Performance Evaluation of Fast Microfluidic Thermal Lysis of Bacteria for Diagnostic Sample Preparation. Diagnostics. 3 (1), 105-116 (2013).
- Lion, N., Reymond, F., Girault, H. H., Rossier, J. S. Why the move to microfluidics for protein analysis. Current Opinion in Biotechnology. 15 (1), 31-37 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유