Method Article
Une plate-forme microfluidique pour le traitement de précision de petit volume échantillon et son utilisation pour Taille séparer les particules biologiques avec un Microdevice acoustique
Dans cet article
Résumé
This protocol describes a system architecture for performing automated small volume (0.15–1.5 ml) particle separations using a microfluidic device, and discusses methods to optimize acoustofluidic device performance and operation.
Résumé
Un avantage majeur de dispositifs microfluidiques est la capacité de manipuler petits volumes d'échantillons, réduisant ainsi les déchets de réactif et la préservation de précieux échantillons. Cependant, pour atteindre la manipulation de l'échantillon robuste, il est nécessaire d'aborder l'intégration de l'appareil avec l'environnement macroscopique. Pour réaliser la séparation des particules reproductible, sensible avec des dispositifs microfluidiques, ce protocole présente une plate-forme microfluidique automatisée et intégrée complète qui permet un traitement précis de 0.15-1.5 ml échantillons en utilisant des dispositifs microfluidiques. Les aspects importants de ce système comprennent conception modulaire de l'appareil et des accessoires robustes résultant dans le monde fiable et flexible à puce connexions, et la manipulation de liquide entièrement automatisé qui réalise le prélèvement d'échantillons en boucle fermée, le nettoyage du système et d'amorçage des mesures pour assurer un fonctionnement reproductible. Dispositifs microfluidiques différents peuvent être utilisés de façon interchangeable avec cette architecture. Ici, nous incorporons un dispositif acoustofluidic, détail son characterization, optimisation des performances, et de démontrer son utilisation pour la taille-séparation des échantillons biologiques. En utilisant la rétroaction en temps réel au cours des expériences de séparation, la collecte de l'échantillon est optimisée pour conserver et concentrer l'échantillon. Bien que nécessitant l'intégration de plusieurs pièces d'équipement, les avantages de cette architecture comprennent la capacité de traiter des échantillons inconnus sans aucune optimisation supplémentaire du système, la facilité de remplacement de l'appareil, et précis, le traitement des échantillons robuste.
Introduction
La séparation de l'échantillon et le fractionnement est l'un des domaines les plus prometteurs de l'application des technologies microfluidiques. Ces étapes de manipulation des échantillons font partie intégrante des diagnostics cliniques efficaces, le développement de produits thérapeutiques, les efforts de biosurveillance, et les progrès dans la recherche et la technologie des sciences de la vie. Une des stratégies de séparation microfluidiques myriade Il a été démontré pour les particules et colloïdes en suspension fluide, ainsi que des espèces chimiques et biologiques; plusieurs commentaires donnent un aperçu des progrès et des développements récents dans ces domaines 1 - 9. Bien que beaucoup de ces technologies de séparation microfluidiques (ci-après dénommé «Périphériques de base») ont été largement caractérisé, quelques rapports ont considéré le problème de la séparation de l'échantillon à un niveau du système. Les appareils de base sont généralement individuels puces à l'échelle centimétrique, interfacés à un tube de polymère fluoré, avec fluide délivré par un déplacement ou une pression pompe.Pourtant, si la promesse de la microfluidique - y compris l'automatisation, la fiabilité, et la réduction augmenté dans des volumes d'échantillon - est de devenir une réalité, au moins un effort équivalent doit être consacré à la conception d'un système de séparation complet dans lequel le Core dispositif est intégré .
En outre, un défi majeur pour les approches microfluidiques à biodétection est le macro au micro interface. Cela concerne non seulement les connexions physiques "monde-à-puce" d'un dispositif microfluidique aux composants macroscopiques, et à l'inadéquation entre les volumes typiques de l'échantillon clinique ou analytique (~ 0,1-10 ml) et le volume interne de puces microfluidiques (~ 0,01 à 10 pi), mais aussi des limitations d'échantillonnage statistique de pontage résultant de ces échelles de taille. Ces problèmes contribuent à la perception que le pré-traitement et de préparation de l'échantillon sont le «maillon faible» de biodétection. La plate-forme 10 décrit dans ce travail TAkes grands pas vers relever ces défis.
Prenant une vue de niveau système, ce protocole détaille le traitement fiable des volumes d'analyse à l'échelle précise-dosées (allant de 0,15 à 1,5 ml) sur des échelles de temps ~ 10 min. Cette opération est "un bouton": une fois le flacon de source contenant les échantillons et de destination des flacons pour la collecte de fractions sont placés dans le système, la commande "Exécuter" initie la procédure, et toutes les étapes sont contrôlés par l'ordinateur. A la fin d'un cycle, les flacons de collecte peuvent être retirés du système d'analyse en aval des fractions séparées.
La base périphérique dans ce système est une puce de acoustophorèse qui extrait (5-20 um) des particules de cellules de mammifères de taille de l'échantillon. Acoustophoretic séparation est choisie ici principalement parce qu'il est à haut débit (jusqu'à 100s de pi / min), l'étiquette-libre, et sans contact, offrant ainsi des avantages à séparer viru viableSES à partir de cellules que peu d'autres techniques microfluidiques peuvent égaler. La physique des particules acoustique mise au point ont été largement décrits 11 - 13 et ne sont pas l'objet de ce protocole, mais un bref résumé des concepts sous-jacents suivants pour aider à comprendre l'application à la séparation microfluidique.
Les ondes stationnaires ultrasonores de résonance dans des microcanaux remplis de liquide produisent des champs de pression, qui donnent naissance à des forces qui animent particules vers les nœuds de basse pression. L'ampleur de la force dépend du volume de la particule, et sur un facteur de contraste acoustique provenant des densités relatives et des compressibilités de la particule et le fluide de mise en suspension. 14 En tant que tel, acoustique de focalisation est parfaitement adapté à une séparation de taille des cellules (~ 15/07 um) de 50 à 200 nm (~) des particules virales moyenne. Les particules les plus grosses migrent vers un noeud de pression; Toutefois, étant donné l'ampleur de la force est très petit pourparticules de taille inférieure 2-3 pm, ces petites particules ou espèces dissoutes à peine bouger du tout. Notre mise en œuvre spécifique de séparation acoustique, tel que décrit précédemment, comprend 15 une paroi mince pour subdiviser le canal de fluide et permet accordable, le placement asymétrique de la position de focalisation. Cela ajoute flexibilité dans la conception de l'appareil, et les avantages, y compris la performance amélioration de la qualité de la séparation et la vitesse sont entièrement décrits ailleurs. 16,17
Cependant, un avantage majeur de l'approche de conception au niveau du système décrit dans ce travail est qu'il est adaptable à une grande variété de dispositifs microfluidiques de base. Par exemple, la plupart des autres modes de séparation à flux continu, y compris inertielle, de champ d'écoulement fractionnement, déplacement latéral déterministe (DLD), et divers types de dispositifs électrocinétiques peuvent être facilement incorporés, avec les ajustements appropriés effectués pour tenir compte des changements dans la configuration d'entrée / sortie , les débits,et des volumes d'échantillons. Les appareils avec différents types de champs sur puce (électrique, magnétique) ou des gradients (thermiques, chimiques) peuvent nécessiter des connexions supplémentaires à la puce, ou l'intégration de matériel supplémentaire, qui accueille cette plate-forme.
Ce protocole prévoit les étapes nécessaires à la conception d'un dispositif de séparation microfluidique, et pour fabriquer des puces silicium-verre par gravure profonde par ions réactifs (DRIE, un processus plasma gravure disponibles dans de nombreux établissements de microfabrication, qui utilise des cycles de gravure et de passivation alternatif pour atteindre profonde caractéristiques avec des parois latérales verticales 18). Ensuite, nous décrivons la caractérisation du dispositif acoustofluidic pour déterminer les paramètres de fonctionnement optimales pour la séparation, et enfin en détail le système de séparation entièrement intégré et la procédure de traitement des échantillons biologiques. Résultats de la caractérisation de dispositif typiques et des données de traitement des échantillons sont ensuite présentés et discutés, et les avantages clés de cette approACH sont mis en évidence, notamment la modularité, robustesse, de précision et d'automatisation.
Protocole
1. Acoustophoretic conception de l'appareil et mise en page Photomask
REMARQUE: Considérations générales et des conseils pour la conception de processus de microfabrication et masque mise en page peut être trouvé dans les textes sur la microfabrication et des tutoriels de conception de photomasques 19 - 21.
- Disposez Masque 1, la couche fluidique (face avant), en utilisant un logiciel de CAO approprié. Choisir une géométrie qui permet l'injection d'échantillon et de séparation approprié pour l'application souhaitée.
- Pour acoustique de focalisation, définir la largeur de canal fluidique w pour fournir une fréquence de résonance f n supérieure à 1 MHz en fonction de l'équation f n = nc / 2w, où c est la vitesse du son dans le fluide concerné et n est le nombre de noeuds d'ondes stationnaires (par exemple, par un large canal de 900 pm, le deux résonance noeud est attendue à f 2 = 1,65 MHz).
REMARQUE: particuless occupant des positions latérales distinctes près de l'extrémité du canal de séparation devrait quitter sorties distinctes. Dans ce protocole, les particules sont séparées selon la taille, de sorte que les sorties sont désignées SPO LPO, de petites particules et de grandes particules sortie, respectivement, comme représenté sur la figure 1. - Régler la longueur de canal de fluide pour commander la longueur de temps de particules sont exposées à la matière de séparation à un débit spécifique. Plus sur puce temps de séjour pour les particules de migrer en raison de forces de séparation doit être troqué contre l'empreinte plus grande de la puce nécessaire.
NOTE: Dans nos appareils acoustiques de focalisation, le canal d'écoulement fait trois passes en bas de la puce pour l'augmentation du temps de séjour (Figure 2a). À un débit total typique de 200 pi / min, les particules circulant dans le 300 x 200 um section transversale, le canal longue séparation de 117 mm dépenser en moyenne 2,1 s dans le domaine acoustique.
- Pour acoustique de focalisation, définir la largeur de canal fluidique w pour fournir une fréquence de résonance f n supérieure à 1 MHz en fonction de l'équation f n = nc / 2w, où c est la vitesse du son dans le fluide concerné et n est le nombre de noeuds d'ondes stationnaires (par exemple, par un large canal de 900 pm, le deux résonance noeud est attendue à f 2 = 1,65 MHz).
- Inclure les ports fluidiques dans le layo de masqueut pour les connexions à tube norme disposés sur une grille standardisée (5 mm pitch). Inclure les points repères appropriés pour l'alignement des masques les uns aux autres au cours de la fabrication et de découpage en dés dispositifs individuels.
- Disposez Mask 2, la couche Via (de dos), qui ne comprend que les ports fluidiques. Inclure points repères pour l'alignement de masque 1.
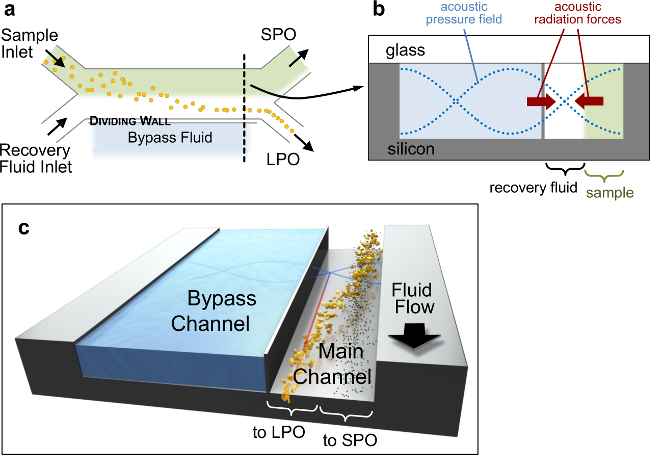
Figure 1. Dispositif Acoustofluidic. Sketches schématiques d'architecture de dispositif acoustophoretic. (A) Vue d'en haut, montrant la configuration globale H-filtre (pas à l'échelle). (B) Schéma de la section de canal à l'emplacement marqué par la ligne noire pointillée en (a), montrant le champ de pression (bleu pointillés), et le sens des forces acoustiques primaires de rayonnement (PRF) qui poussent les particules vers plans nodaux (flèches rouges). La section transversale de canalest de 900 × 200 um avec un mur d'environ 10 um d'épaisseur séparant la principale (300 m de large) et des canaux de dérivation. (C) de la représentation 3D de la séparation des particules. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
2. salle blanche fabrication de puces microfluidiques pour Acoustophorèse
- Motif les orifices de fluide de retour du côté de l'aide Mask 2 sur une double-face polie de 0,5 mm d'épaisseur, 100 mm de diamètre <100> plaquette de silicium par la norme photolithographie positive résister. Etch par cette géométrie profonde gravure ionique réactive (DRIE) à une profondeur de 350-400 um.
- Tournez sur la plaquette, et la géométrie de canal de fluide motif l'avant-côté en utilisant le masque 1 par la norme positive résister à la photolithographie sur l'autre côté du silicium. Ensuite, monter la plaquette de l'appareil à une seconde (silicium vierge) porteuse tranche en utilisant résine photosensible.
- Graver les canaux, également par DRIE, jusqu'à une profondeur de 200 um, par gravure du silicium dans les emplacements de ports (la plaquette de support afin de protéger la surface de l'outil de DRIE). De-montage de la tranche de l'appareil à partir du flan tranche de silicium par trempage dans une solution de décapage de résister.
- Nettoyer la tranche de l'appareil et une tranche de 0,5 mm d'épaisseur en verre borosilicate sans relief en utilisant une solution Piranha (acide sulfurique et de peroxyde d'hydrogène dans un rapport de 3: 1).
- Sceller les canaux de fluide par liaison anodique des plaquettes de verre et de silicium en utilisant les paramètres suivants: pression de la chambre à 3 mTorr, la pression de piston à 1000 N, de la température à 350 ° C, et appliquer 750 V jusqu'à ce que le courant chute en dessous de 0,2 mA.
- Couper les puces individuelles à part avec une lame de diamant sur une scie de découpage en dés.
3. Dispositif d'assemblage final
- Capteur piézo-jointe
NOTE: L'échographie est généré dans la puce microfluidique par un transducteur piézo-céramique fixé sur le côté de silicium.- De àwo-composante kit époxy à faible viscosité, peser le ratio recommandé des deux composants et les mélanger soigneusement.
- Répartir le mélange époxy avec une pipette et répartir uniformément à travers un zirconate titanate de plomb (PZT) piézocéramique pour créer une fine couche (environ 10 pi de mélange époxy pour un piezo avec des dimensions de 37,5 x 10 x 0,5 mm).
- Utilisation d'un bâti ou gabarit approprié, aligner le côté époxy de la piézocéramique avec la puce microfluidique, fournissant une zone en surplomb sur un côté pour fixation de fil suivant (voir Figure 2a), et de rapprocher les deux éléments en contact. Serrer l'ensemble dans un étau, en prenant soin de ne pas craquer l'un des composants, et de guérir à la température et la durée recommandée par le fabricant époxy.
- Après l'époxy a durci, attachez bien-fil de calibre conduit à chaque côté de la piézocéramique, en soudant avec un fer à souder fine pointe, ce qui rend le contact plus brève possible avec le piézo pour éviter thermally dé-il polarisant. Sinon, utilisez un adhésif conducteur de coller fils à la piézo.

Figure 2. fluidique Breadboard, Chip montage et mondiale à puce Interface. Photos de (a) la puce microfluidique acoustique (dimensions extérieures de 70 x 9 x 1 mm) avec attachés des fils conducteurs de transducteur piézoélectrique, montrant trois passes de la séparation canal descendant la puce, (b) les vissages fluidiques personnalisé et des composants de tubes usinés pour l'interface puce-à-monde, (c) la puce montée sur la face inférieure de la planche à pain fluidique en utilisant des dispositifs de serrage, couvrant une ouverture dans la carte de test pour permettre ventilateur de refroidissement, (d) une vue de dessus de la planche à pain avec des connexions de tuyaux attachés et ventilateur de refroidissement, et (e) une coupe schématique des raccords vissés cette interface l'Tubing avec la puce microfluidique monté. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Dispositif de montage et World-To-Chip Interfacing
- Fixez la puce à la "planche à pain fluidique» (une plaque avec une grille de régulièrement espacées filetée trous traversants) en utilisant des dispositifs de serrage. Joindre un ventilateur de refroidissement pour la carte de test pour réguler la température au cours des expériences acoustiques (voir la figure 2).
NOTE: Le fonctionnement sans ventilateur de refroidissement à des tensions typiques d'entraînement augmente la température de l'appareil à 70-80 ° C. Cela déplace de manière significative la fréquence de résonance due à la vitesse du son dans le fluide modifiée, et peut avoir un impact négatif sur la viabilité de toutes les particules biologiques en cours de traitement. - Visser connecteurs puce-à-monde, précédemment décrit ailleurs 22 et illustré à la figure 2. Joindre à ces itubes de NTERFACE à tube supplémentaire sur les entrées et sorties à l'aide de la norme ¼ "-28 syndicats pour 1/16" tube.
- Fixez la puce à la "planche à pain fluidique» (une plaque avec une grille de régulièrement espacées filetée trous traversants) en utilisant des dispositifs de serrage. Joindre un ventilateur de refroidissement pour la carte de test pour réguler la température au cours des expériences acoustiques (voir la figure 2).
4. Caractérisation des performances de mise au point acoustique
REMARQUE: Les composants du système requises pour la caractérisation acoustique concentrant sont regroupés dans la liste des matières. Les étapes 4.1 et 4.2 ci-dessous concernent toutes les Core utilisé avec cette plate-forme, que les étapes suivantes décrivent les opérations spécifiques à l'appareil acoustofluidic discuté ici.
- Configuration du système
- Assemblez la puce microfluidique en utilisant des connexions dans le monde à puce sur la carte de test fluidique, comme décrit dans la section 3. Les connexions de rendre l'utilisation des tubes (comme 1/16 "de tube de polymère fluoré de diamètre extérieur) à un fluide flacons de pompe et de collecte. Monter la planche à pain sur la scène d'un microscope capable de l'imagerie de fluorescence équipé d'une caméra CCD.
- Connectez longueurs de petite diamete intérieurer (ID) tube (0,006 "est recommandé) immédiatement après la puce (voir la figure 4) pour servir de réducteurs de débit, qui stabilisent le système et contrôlent le fractionnement du flux entre les sorties de la puce. Utiliser des tubes plus grands d'identité, telles que 0,01 "ou 0,03", pour toutes les autres connexions.
- Estimer la résistance à l'écoulement hydrodynamique R h de chaque morceau de tube de longueur L et de diamètre interne D en utilisant l'équation R = h 128 ul / nD 4, où μ est la viscosité dynamique du fluide. La chute de pression Δ P revenant à chaque longueur de tube à un débit donné Q est donnée par Δ P = QR h.
- Choisir un rapport de longueur de restriction de diviser l'écoulement entre les sorties en fonction de la méthode de séparation utilisée. Séparation optimale avec les puces acoustiques dans ce protocole nécessite un SPO: rapport d'écoulement de la LPO approximationtement 65: 35%.
- Choisir la longueur des limiteurs d'écoulement de sortie de telle sorte que leur résistance fluidique est au moins 3-4 fois plus grande que la résistance totale dans le reste du système (additionné de façon appropriée en série ou en parallèle). Pour le dispositif de acoustophorèse utilisée dans ce travail, longueurs de tubes de 35 et 65 cm pour la LPO et le SPO sont adaptés.
REMARQUE: Une attention particulière doit être accordée à R h de toute base dispositif microfluidique. Pour notre acoustique concentrant puce dans ce travail, R h est faible en raison de ses dimensions relativement importantes de canal, de sorte que les résistances de la tubulure connectés facilement dépasser il. Pour les appareils avec des dimensions de canaux plus petits, la résistance de la puce peut dominer le reste de la tubulure du système, dans lequel la conception de cas et le contrôle de sur puce canal R h est une considération additionnelle lors de l'étape 1 du présent protocole. Principes et lignes directrices de conception détaillées sont disponibles dans la littérature. 23,24
- Vérification du système
- Vérifier les fuites pour vérifier que le dispositif microfluidique présente pas de défauts et toutes les connexions de tuyaux sont scellés. Distribuer de l'eau à travers les tubes d'entrée en fonction des besoins avec une seringue et pour surveiller toute fuite de fluide dans le canal principal.
- Distribuer un volume connu par la puce, et de mesurer les volumes collectés à partir des sorties pour garantir que le rapport d'écoulement est tel que prévu. Les écarts par rapport au rapport de volume escompté peuvent indiquer des blocages dans l'une des sorties ou des connexions qui fuient.
- Pour maintenir la propreté du système et éviter le colmatage rincer l'ensemble du système (tubulure fluidique et puce) avec des solutions de nettoyage appropriés (par exemple, l'eau de Javel, l'éthanol, de l'eau) avant et après l'exécution des expériences.
- Dans le cas de sabots ou des blocages dans l'un des points de vente, rincer le système tout en branchant la sortie claire pour dégager le blocage. Si cela échoue, inverser le sens d'écoulement pendant le rinçage,éventuellement l'application d'impulsions rapides de flux inverse (à l'aide d'une seringue actionnée manuellement). Enfin, si le blocage ne peut toujours pas être retiré, remplacer le tube ou puce, si nécessaire.
- Fréquence configuration de numérisation pour la focalisation acoustique
- Remplir le canal de dérivation (voir figure 1) avec un fluide tel que l'eau désionisée, de l'éthanol, ou une solution saline tamponnée phosphate (PBS) par injection avec une seringue manuelle. Notez que ce fluide ne vient pas en contact avec l'échantillon en cours de traitement. Les détails de réglage de la position de noeud en utilisant différents fluides de contournement sont décrites ailleurs 16,17. En résumé, si le noeud doit être plus proche de la paroi de séparation, en utilisant un fluide de dérivation de plus faible densité, tel que l'éthanol; destiné à être placé plus près de noeud dans le flux d'échantillon d'entrée, pour choisir un fluide plus dense, par exemple une solution de glycérol.
- Ajouter une solution de talon d'environ 0,01% (p / v) de billes fluorescentes 5-8 um de polymère en suspension dans un tampon tel que PBS avec0,05% de Tween-20 et remplir la seringue d'entrée d'échantillon avec la solution de talon. Remplir la seringue d'entrée de la mémoire tampon avec le même tampon (ceci ne doit pas nécessairement être le même fluide que dans le canal de by-pass). A noter que, en général, le tampon est choisi pour convenir à l'application (voir étape 5.1).
- Avec la carte de test fluidique sur la platine du microscope, se concentrer à mi-chemin dans la profondeur du canal à une région de canal droite juste avant la sortie avec les deux canaux (séparation et de dérivation) dans le champ de vision. Une source supplémentaire de lumière externe oblique-angle peut être tenu de rendre les parois du canal visible, pour la réussite de post-traitement des données d'image.
- Scan Fréquence automatique et de capture d'image
- Effectuer les connexions électriques à l'aide de câbles blindés (par exemple, RG-58 équipé de connecteurs BNC) à un générateur de fonction avec la fréquence radio (RF) amplificateur pour délivrer le signal d'excitation au transducteur piézoélectrique. Eventuellement, utiliser un oscilloscopela sortie du générateur de fonction pour la surveillance de la tension réelle appliquée au transducteur.
- Allumer le ventilateur de refroidissement, et régler le générateur de fonction de telle sorte que la sortie de l'amplificateur RF au transducteur piézo-électrique est dans la gamme de 12 à 25 volts crête-à-crête (V pp).
- Régler les deux seringues à la même vitesse d'écoulement comprise entre 50 et 200 pl / min. En utilisant une pompe à seringue unique pour entraîner deux seringues avec le même moteur il est recommandé de réduire au minimum les perturbations de l'écoulement.
- Effectuer une procédure de balayage de fréquence en spécifiant les début et de fin des fréquences, la taille de l'étape entre les valeurs de fréquence et la tension de commande piézo utilisant une trousse d'outils d'automatisation de laboratoire tels que LabVIEW de National Instruments.
- A chaque étape de fréquence, appliquer la tension pendant 15 secondes pour permettre au système à l'équilibre, puis de capturer 10 images de perles qui coule à travers la puce pour une analyse ultérieure (temps d'exposition entre 10 et 100 ms sont recommandés).
- Entre ehaque appliquée pas de fréquence, éteignez la tension pendant environ 20 secondes pour laisser les perles redistribuent uniformément à travers le canal et éliminer les préjugés en mettant l'accent de l'étape de fréquence précédemment appliquée.
- Analyse d'image pour déterminer la fréquence de résonance et en se concentrant Position
- Exécuter un script d'analyse d'image (comme le script AF_freqScanPlotter.m MATLAB fourni avec ce protocole) et entrez les informations requises aux invites: sélectionnez la liste des fichiers d'image générées à l'étape 4.4, entrez le début de balayage et arrêter les fréquences et la taille de l'étape, la largeur de la voie, l'emplacement du mur, et enfin sélectionner la zone d'image à analyser, y compris à la fois la séparation et des canaux de dérivation.
- Observer la moyenne de script analyse l'ensemble des images capturées à chaque pas de fréquence, et la moyenne des valeurs d'intensité le long de la direction d'écoulement. Il en résulte une section transversale de balayage ligne de l'intensité de fluorescence.
REMARQUE: La fréquence correspondant à la highe st intensité est définie comme la fréquence de résonance (figure 3, rangée du milieu), et la position dans le canal où la plus haute intensité se produit est la position de focalisation (Figure 3, rangée du bas).

Figure 3. Représentant balayage en fréquence. Exemple de données de balayage de fréquence pour bien couplé (A) et mal couplé (B) et piézo puce. Rangée du haut: l'intensité de fluorescence des perles (rouge représente élevée, et le bleu représente faible intensité). Rangée du milieu: intensité maximale à chaque fréquence. Rangée du bas: l'emplacement de l'intensité maximale, où la ligne pointillée rouge indique prédit position de focalisation, et les diamants rouges indiquent la fréquence de résonance telle que déterminée par l'intensité maximale.g "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
5. Séparation automatique
NOTE: L'expérience de séparation automatisé est exécuté pour séparer les grosses particules de petites particules en raison des acoustiques concentrant forces de taille dépendant appliquées dans la puce microfluidique. Les composants du système requis sont regroupés dans la liste des matières.
- Configuration du système et la préparation d'échantillons
- Se connecter la puce microfluidique de la pompe à seringue, les soupapes de sélection multi-port contrôlés par l'ordinateur, débitmètres PC-interface, et un tube, comme représenté sur la Figure 4. Cette configuration permettant le traitement d'échantillons automatisé à travers la puce de séparation microfluidique, ainsi que automatisées étapes de nettoyage entre les expériences pour éliminer la contamination croisée et l'échantillon report.
- Utiliser un tampon d'échantillon appropriés pour les cellules ou les particules à séparer, ou tel que requis par l'analyse de dosageêtre utilisés après la séparation. Comme à l'étape 4.3.2, le tampon de récupération (mais pas nécessairement du fluide de by-pass) doivent correspondre à l'échantillon de fluide.
REMARQUE: Tous les tampons aqueux habituellement utilisés avec des échantillons biologiques (par exemple, PBS) ont des propriétés acoustiques semblables à l'eau et ne changera pas sensiblement la performance du dispositif acoustique. L'utilisation d'échantillons de fluides avec densité et la viscosité significativement différente de l'eau est possible, mais seulement recommandé pour les opérateurs ayant une expérience significative acoustophorèse.

Figure 4. Configuration du système acoustique pour les expériences de séparation automatisé. Les lignes bleues retracer la voie principale d'écoulement à travers le système. Toutes les lignes vertes et noires sont 0,03 "de diamètre interne (ID) des tubes, et toutes les lignes bleues et grises de couleur sont de 0,01" tube ID, avec le eXception des bobines de maintien, qui sont 0,03 "ID, et les réducteurs de débit, qui sont 0.006" ID. Les seringues sont remplis avec le tampon, et les bobines de maintien avoir un volume suffisant (550 pi) pour empêcher l'absorption de tous les échantillons ou des réactifs de nettoyage dans les seringues. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Séparation procédure
- État de pré-terme. Avant d'exécuter la séparation, veiller à ce que les réservoirs de réactifs de nettoyage (eau de Javel, l'éthanol, tampons) ont suffisamment de liquide, les réservoirs de déchets ne sont pas pleins, et les lignes fluides sont amorcées (ie, rempli de solution). Si cette dernière condition est incertain, ou si le système est en cours d'exécution pour la première fois après la marche au ralenti (par exemple, la première fois sur un jour donné), exécutez une procédure de nettoyage automatique (voir l'étape 5.3 ci-dessous). Réglez Vannes 3 et 4 à la sortie de la puce à l'écoulement à perdre Thérèservoirs départ.
- Allumez le ventilateur de refroidissement, et régler le générateur de fonction à la fréquence de résonance pour la puce acoustique étant utilisé, tel que déterminé à l'étape 4.5. Réglez le point de consigne de tension sur le générateur de fonction de sorte que les sorties de l'amplificateur RF entre 12 et 25 V pp, le cas échéant pour la séparation souhaitée.
- Connectez l'entrée de l'échantillon Vial, tampon d'entrée Vial, et les flacons de collecte appropriés pour le système. Juste avant de fixer le flacon de Exemple d'entrée à son tube de ramassage, vortex brièvement flacon pour remettre en suspension les particules qui pourraient se sont installés. Ensuite, fixez le flacon et d'initier la routine de séparation sans délai.
ATTENTION: Si l'échantillon à traiter contient des agents potentiellement infectieux, les flacons doivent être d'un type vis-dessus, afin de maintenir un système étanche et empêcher l'échantillon d'aérosol. En outre, lorsque vous travaillez avec des matières biologiques dangereuses, gérer tous les flacons et tubes tout en portant l'équipement de protection nécessaire et l'aide de la reqcontrôles et procédures de danger uired pour le Groupe des risques biologiques et de niveau de biosécurité appropriées pour le matériau. Consultez les politiques et protocoles institutionnels en cas d'incertitude. - Utilisez un programme dans une boîte à outils d'automatisation de laboratoire pour contrôler les valves, capteurs de débit et de la pompe pour effectuer la routine de séparation entièrement automatique.
NOTE: La routine commute les vannes, actionne la pompe seringue retrait et de perfusion, et moniteurs de flux de données capteurs pour chronométrer correctement la collecte de fractions d'échantillons de sortie. Les principales étapes sont résumées ci-dessous dans 5.2.4.1 travers 5.2.4.3, que si elle est effectuée manuellement.- Premier tube de ramassage. Retirer environ 15 pi de l'entrée flacon d'échantillon pour remplir complètement le tuyau de raccordement à Valve 1. Simultanément, le premier tube reliant la Vial tampon d'entrée à la valve 2. De la même manière, le premier l'entrée d'air de Valve 1 à veiller à ce qu'il ne contient pas de fluide. Enfin, passer Vannes 1 et 2 pour expulser de gaspillerl'excès de liquide ou de l'air qui est entré dans la bobine de chargement.
- Charger la bobine d'échantillon, comme représenté sur la figure 5a. Une séquence de chargement typique de traitement d'un échantillon de 250 ul est de retirer 25 ul d'air à 50 ul / min, puis 250 ul d'échantillon à 200 ul / min, suivi par 35 pi de premier tampon à 200 ul / min, et enfin encore 25 pi d'air à 50 pl / min.
NOTE: Tous les volumes et débits sont sélectionnables par l'utilisateur. Notez que cette séquence de chargement est dans l'ordre inverse de la façon dont les bouchons fluides iront à travers le dispositif de séparation. - Commencez perfusion échantillon. Régler les pompes à seringues pour infuser les bouchons fluide chargé à la vitesse souhaitée (typiquement 100 pi / min). Surveiller les débits à la SPO LPO et avec des capteurs de débit pour garantir que l'écoulement est stable et à un rapport déterminé à l'étape 4.1, et que le colmatage n'a pas eu lieu.
- Recueillir des fractions séparées. Lorsque les capteurs de flux détectent un pic de débit, indiquant paSsage du premier entrefer, passer la vanne de sortie correspondant à partir de déchets (où il a commencé à l'étape 5.2.1) à un prélèvement d'échantillons flacon.
- Après passage de l'échantillon à partir de la puce, d'observer le détecteur d'écoulement détecte le second entrefer. À ce stade, mettez les vannes de sortie de retour à perdre. Après le volume complet chargé de l'étape 5.2.4.2 est distribué, arrêter la perfusion de la pompe de la seringue et mettre fin à la routine d'automatisation lorsque le débit atteint zéro.
- Après l'expérience de la séparation est terminée, débranchez le SPO et les flacons de prélèvement d'échantillons LPO et de les stocker de manière appropriée pour une analyse ultérieure.
- Automated nettoyage et de décontamination
NOTE: Avant de traiter chaque échantillon, rincer et décontaminer l'ensemble du système fluidique en utilisant la routine automatique suivante.- Fixez le SPO et tubes collection de flacons LPO, ainsi que le tube échantillon de ramassage dans des flacons vides de collecter des solutions de nettoyage excédentaires qui seront vidées throuGH tubes.
- Lancer la routine de nettoyage du système automatisé. Comme avec la procédure de séparation automatisée à l'étape 5.2, le programme devrait contrôler les soupapes et pompe seringue séquentiellement charger la bobine de maintien avec des réactifs de nettoyage, et rincez-les à travers le système.
- Effectuer la routine de nettoyage suivante: ras de Javel à 10%, puis avec 70% d'éthanol, et se terminer par l'eau ou un tampon salin approprié (par exemple, 1x PBS ou le tampon utilisé pour le traitement de l'échantillon). Utilisez les volumes de chasse suivants: 450 pi pour l'eau de Javel et de l'éthanol, et 1000 ul d'eau / tampon.
- Au cours des étapes de rinçage, vider chaque réactif dans le SPO tandis que la vanne de sortie LPO est réglé sur un port qui est bloqué, alors vice-versa, pour retirer toute obstruction potentiels dans les réducteurs de débit de sortie. Maintenir retrait et de débit de perfusion de 300 à 500 ul de taux / min afin de minimiser la génération de bulles dans le tube et l'accumulation de contre-pression lorsque soit le SPO ou la LPO est bloquée.
- Discard les solutions de rinçage en excès et les flacons dans lesquels ils collectées en suivant les procédures appropriées pour la manipulation des déchets biologiques ou chimiques.
Résultats
Les principales caractéristiques de la conception du dispositif acoustique-microfluidique sont mis en évidence dans la figure 1, et décrits en détail ailleurs. 15 En bref, côte-à-côte deux courants de fluide écoulement dans un canal de séparation, séparé d'un canal de dérivation parallèle par une paroi mince de silicium. Etant donné que la magnitude de la force de rayonnement primaire évolue avec le volume des particules, les grosses particules migrent hors du flux d'entrée mixte-échantillon vers le noeud de pression acoustique situé dans le flux de fluide de récupération adjacente, tandis que les petites particules restent dans le flux initial (figure 1B, C). L'architecture à deux canaux subdivisé améliore la séparation des particules 17 et permet l'ajustement de la position de noeud à l'aide de différents fluides du canal de dérivation. 16 La planche à pain et appareils fluidique fournit une plate-forme robuste pour monde à la puce connexions, et la conception modulaire permet un changement rapide entre les puces fluidiques (Figure 2). Ce configuration permet également des connexions fluides réversibles, qui joint jusqu'à 1000 psi, être prises rapidement et de manière fiable (Figure 2B, E).
La fréquence de résonance f res d'une puce peuvent être estimées en utilisant des calculs analytiques 1D simples (voir l'étape 1.1.1). De plus complète d'un modèle par éléments finis 2D de notre section transversale de l'appareil, 16 la position de focalisation attendue pour une résonance à 2 225 um noeud est de la paroi et la fréquence attendue est 1,68 MHz. Cependant, f res de dispositifs réels peuvent varier de ± 100 kHz, en fonction de la température de fonctionnement et du couplage de résonances longitudinales et latérales. Par conséquent, après le montage de l'appareil, f res doivent être vérifiées empiriquement à des débits pertinents et des tensions de commande piézoélectrique, tel que décrit dans l'étape 4 du protocole. La figure 3 montre balayages en fréquence représentant prises à 200 pi / min, avec de l'eau dans les principales et de dérivation des canaux, et 20 V pp fourni à la piézo. Lors de l'accouplement entre le piézo et dispositif microfluidique est bonne, les particules vont se concentrent étroitement à la fréquence de résonance, ce qui entraîne un pic clair dans l'intensité de la fluorescence et la migration vers la position de focalisation prévu (figure 3A). En revanche, quand il ya un mauvais couplage, les particules ne se concentrera pas bien et les résultats de l'analyse de fréquence seront similaires à la figure 3B. Dans de tels dispositifs, le transducteur piézoélectrique peut avoir besoin d'être ré-montée, si un adhésif réversible a été utilisé; autrement, ce dispositif est inadapté quand de haute qualité en mettant l'accent ou le débit rapide sont essentiels pour l'application requise. Les données de la figure 3 informent le choix de la fréquence de fonctionnement pour des expériences ultérieures, et la tension et de la plage de débit disponible pour les particules efficace séparation.
fichiers / ftp_upload / 53051 / 53051fig5.jpg "/>
Figure 5. automatisé de traitement de l'échantillon. (A) Schéma d'échantillon chargé dans la bobine de l'échantillon. (B) de profil d'écoulement Représentant d'une expérience de séparation réussie. (C) Débit profil d'une séparation de fonctionner au cours de laquelle la sortie SPO bouché à environ 220 sec. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Après avoir identifié les puces qui sont des séparateurs efficaces, ils sont incorporés dans le système représenté sur la figure 4. Système Volume total balayé est minimisée en utilisant des tubes avec 0,01 "de diamètre intérieur le long du trajet d'écoulement principal (lignes bleues). La figure 5A illustre le maquillage d'un bouchon d'échantillon typique infusé à travers le système. Une petite quantité de "leader tampon" (~ 35 pi) est nécessaire pour Precede l'échantillon dans le flux d'éliminer les fluctuations de débit tandis que l'échantillon se déplace à travers la puce de séparation. La figure 5B montre les données de flux résultant d'une expérience réussie de séparation acoustique automatisé. Principales caractéristiques d'une course réussie comprennent: (1) une augmentation transitoire du débit à la fois dans la LPO et le SPO que la pression monte et le liquide commence à couler à travers le système, (2) un pic aigu indiquant le passage d'une bulle d'air (la encart montre un profil élargi d'une seule bulle), qui devrait atteindre le SPO avant la LPO en raison de l'écoulement inégale des deux points, (3) flux stable à travers les deux points entre les deux bulles d'air que l'échantillon se déplace à travers le système, et (4) une diminution progressive du débit dans les deux points après que le volume de l'échantillon complet est remis au système. Essais problématiques sont immédiatement apparents à partir de profils d'écoulement similaires à la figure 5C, où il apparaît que le SPO est devenu bouché après environ 220 secondes. Dans thi s cas, une procédure de nettoyage analogue à celle décrite à l'étape 5.3 doit être exécuté pour déboucher le canal.
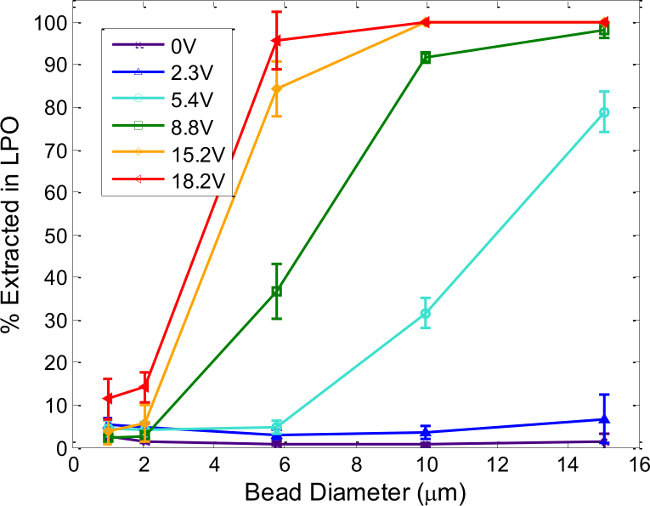
Figure 6. Dispositif accordabilité: taille des particules et des effets de tension. Pour cent des microsphères de polystyrène extraites dans la LPO dépend de la taille des particules et la tension fournie à la piézocéramique. Chaque ligne correspond à une tension de fonctionnement différent à la fréquence de résonance, déterminée comme décrit à l'étape 4. Le débit total à travers le dispositif est de 200 pi / min, avec des fréquences d'entraînement appliquée entre 1,62 et 1,64 MHz. Les barres d'erreur représentent l'écart type d'au moins trois expériences séparées. Reproduit et modifié par la permission de la Société royale de chimie de http://pubs.rsc.org / fr / content / ArticleLanding / 2014 / AN / c4an00034j.target = "_ blank"> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
La figure 6 montre les résultats compilés de séparation à l'aide de différentes tailles de particules de polystyrène et des tensions d'entraînement piézo-électriques qui illustrent les paramètres nécessaires pour une séparation efficace de fonctionnement. En général, des tensions plus élevées (à savoir, les forces acoustiques plus) sont nécessaires pour extraire les particules plus petites, comme prévu. Tensions d'entraînement ne peuvent pas être indéfiniment augmenté, cependant, en raison d'une meilleure dissipation de la chaleur et de plus en plus des effets de la diffusion acoustique. 13 L'intrigue sert de guide général pour les tailles de séparation de particules particules qui montrent la récupération significativement différents à une tension de commande spécifique (par exemple, 10 et les particules de 2 um à 8,8 V pp) se séparent ainsi. Généralement, les populations de particules avec une grande différence de taille, tels que les virus (~ 100 nm) et les cellules (~ 10 um) peuvent être séparés rapidement et efficacement, tout comme les cellules de différentes tailles (par exemple, 6-8 pm érythrocytes discoïdes et 8-15 pm leucocytes). Les conditions spécifiques requises pour travailler avec d'autres types de cellules doivent être déterminées empiriquement, que la forme des cellules, la densité et la compressibilité affecter son contraste acoustique, en plus de la taille de la cellule. À cette fin, les procédures de l'étape 4 sont utiles pour déterminer les conditions de séparation utilisables pour tout nouveau type de cellule ou de particules, et non seulement pour évaluer la qualité d'un dispositif de acoustophorèse particulier.

Figure 7. efficacité de séparation de Cell-Virus échantillons enrichis. Séparation résulte de (A) cellules Raji dopés avec des virus de la dengue (DENV) et (B) cellules Raji et les cellules de rein de Boa dopés avec Golden Gate Virus (GGV). Les pourcentages sont collectées sont définies comme la fraction de virus ou de cellules sortant un spécifiquela sortie par rapport à la quantité totale sortant de la puce. Les barres d'erreur pour (A) sont l'écart type de 3 essais, tandis que les échantillons de (B) ont été traitées uniquement une fois en raison des faibles quantités disponibles. 1x PBS a été utilisé comme fluide de tampon d'échantillon et de récupération, avec de l'eau dans le canal de dérivation pour toutes les expériences. Fréquences de fonctionnement de Chip variaient entre 1,60 et 1,64 MHz, avec des tensions d'entraînement entre 16 et 20 V pp. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
Pour démontrer l'utilité de cette plate-forme pour la séparation de particules biologiques, nous avons d'abord utilisé pour traiter des échantillons biologiques bien caractérisés: les cellules humaines Raji (10 5 cellules / ml, diamètre moyen 8-10 um 25) dopés par le virus de la dengue (de MENV, 10 5 pfu / ml, diamètre d'environ 50 nm 26). Figure 7A montre le pourcentage de cellules Raji et DENV recueillies à la fois dans le SPO LPO (définie comme la fraction de chaque type de particules ont été recueillies à partir de chaque orifice de sortie par rapport à la quantité totale de chaque particule collectées depuis la puce). L'expérience a été répétée en triple exemplaire, et des cellules Raji ont été quantifiés en utilisant un compteur Coulter, tandis que MDE a été quantifiée en utilisant une réaction en chaîne polymerase à transcription inverse quantitative (RT-qPCR).
Ensuite, les performances du système a été testé dans un scénario qui est plus réaliste pour le traitement d'échantillons cliniques, dans lequel les caractéristiques physiques exactes des particules peut être inconnue, et les quantités d'échantillons disponibles sont plus faibles. Ici, nous avons évalué la séparation du virus de la porte d'or récemment identifiés (GGV), un serpent pathogène infectant des cellules de rein boa constrictor. 27 La taille de la particule virale GGV n'a pas encore été mesurée, mais depuis GGV appartient à la famille Arenaviridae, il est susceptible d'untaille similaire, entre 100 et 150 nm. 28 Nous avons traité des échantillons avec GGV dopés (10 4 pfu / ml) dans les cellules Raji humaines (pas une cible de l'infection par le virus), et les cellules boa rénaux (cible de l'infection pour GGV, taille approximative 10 27 um), avec deux types de cellules à 10 4 cellules / ml. Comme ces échantillons étaient disponibles en faibles quantités, la séparation résulte de seulement un essai expérimental sont rapportés dans ce travail. La figure 7B montre le pourcentage de cellules Raji, cellules Boa, et GGV collectées auprès de la SPO et la LPO. Les cellules ont été quantifiées dans ces expériences par comptage sur un hémacytomètre et les virus ont été quantifiés par RT-qPCR.
Discussion
Ce protocole présente l'intégration au niveau du système de dispositifs microfluidiques à l'équipement macroscopique pour effectuer le traitement automatique de l'échantillon biologique. La modularité de cette plate-forme lui permet d'être adaptable à tout appareil à flux continu, et, à titre d'exemple, le protocole présenté met l'accent sur la caractérisation et l'optimisation des performances d'un dispositif de séparation de particules acoustofluidic. Trois avantages majeurs de ce protocole sont mis en évidence: (i) la modularité et de la puce-à-monde interfaçage, (ii) la caractérisation robuste des performances de l'appareil, et (iii) le traitement automatisé des volumes d'échantillons dosées avec précision pour la séparation de particules.
je. Modularité et puce-à-monde interfaçage
Comme le montre la figure 2, la puce microfluidique est monté sur une planche à pain de commande pour adapter facilement sur une platine de microscope pour l'observation directe. La planche à pain contient # 6-40 trous filetés UNF sur une grille 5 mm à pas, enabling la puce d'être fixé, et les raccordements de fluides à faire. Les connexions de fluide sont PEEK tubes avec extrémités usinées, qui joint contre la puce fluidique avec un joint d'étanchéité en caoutchouc face et un collier en acier inoxydable. Ce schéma d'interface fait pour faciliter le remplacement de la puce et la refonte de l'appareil rapide, nécessitant peu ou pas de changements à d'autres composants du système, fournis empreintes de puces conformes au format de la grille. Par exemple, nous avons utilisé cette plate-forme avec des puces microfluidiques pour l'électrophorèse à flux continu, la lyse cellulaire thermique, 29 un mélange rapide des réactifs pour la synthèse chimique, et la capture une seule cellule et les interrogatoires.
je je. La caractérisation de la performance robuste de l'appareil
Afin d'optimiser la performance de tout dispositif de séparation microfluidique, son fonctionnement doit d'abord être caractérisé à fond. Le système décrit ici soutient le développement de protocoles rapides et automatisées pour ce faire. Pour l'Exemp spécifiquele de dispositifs acoustiques se concentrant, la qualité en mettant l'accent, fréquence de fonctionnement, et la position des particules concentrées dans le canal microfluidique doit être mesurée pour chaque dispositif individuel. Ces mesures nécessitent balayant une gamme de fréquences d'entraînement piézocéramique, des tensions et des débits, d'identifier les combinaisons de paramètres optimaux pour la séparation de haute qualité. Le protocole présenté varie automatiquement ces paramètres accordables et capture l'pertinent de données à-dire, des images fluorescentes de particules circulant dans le canal qui sont post-traitées pour générer les mesures requises de particules de focalisation qualité, la fréquence et la position (Figure 3).
Caractérisation complète de la performance du dispositif acoustique nécessite la répétition des étapes 4.4 et 4.5 que nécessaire dans différentes conditions expérimentales. Par exemple, la position de focalisation absolue d'une puce se trouve en exécutant le balayage de fréquence à des débits relativement faibles et haute tensions afin d'assurer une migration complète de l'emplacement du noeud. En outre, ces analyses de fréquence peuvent évaluer la qualité de l'assemblage de l'appareil (lorsqu'il est exécuté avec des billes de polystyrène de taille connue), ou pour déterminer comment un type de particules précédemment inconnue va se comporter dans le système (après une puce a été caractérisé avec des perles). Une puce avec un bon transfert d'énergie à partir de la piézocéramique au canal microfluidique entraînera concentrant serrée à débits élevés (> 1 ml / min) et de faibles tensions (12-15 V pp), tandis que ceux avec un transfert d'énergie pauvres ne se concentrer encore à des débits faibles (<100 pi / min) et des tensions élevées (> 20 V pp). Nous avons trouvé que le contact intime entre la puce microfluidique et de la piézocéramique est essentiel pour le transfert efficace de l'énergie dans le fluide. Une enquête plus approfondie de la méthode optimale de collage de la puce microfluidique et de la piézocéramique permettra une production fiable de dispositifs de haute performance.
Enfin, un système completimage du fonctionnement d'un dispositif acoustophoretic peut être obtenu en combinant le balayage de fréquence des mesures de l'étape 4 (et la figure 3) le nombre de particules collectées à partir de la SPO et la LPO en fonction de paramètres de fonctionnement pertinents basés sur l'image, à partir d'expériences de séparation effectuées avec des microsphères , comme décrit dans l'étape 5. Comme le montre la figure 6, une telle série d'expériences automatisés peut rapidement caractériser la performance d'accordabilité et un dispositif individuel, informer l'utilisateur de l'espace de paramètres optimal pour faire fonctionner le dispositif pour la séparation de particules.
iii. Le traitement automatisé de petits échantillons pour la séparation de particules
Pour le traitement des échantillons microfluidique à base de copeaux de succès et précis, il est essentiel de manière fiable et précise mètres, charge, délivre, et de recueillir les volumes de fluide à mesure qu'ils traversent. Cette précision est particulièrement importante lorsque le volume d'échantillon est petit(~ 0,1-1 ml), ce qui est commun dans les paramètres de laboratoire cliniques ou de recherche. 30 manipulation de l'échantillon précis est difficile dans des expériences microfluidiques traditionnels qui emploient le retrait manuel de l'échantillon dans une seringue et de perfusion dans un dispositif sans évaluations de quand l'échantillon a été séparé et quand il doit être recueilli. Le protocole présenté emploie automatisé échantillon bobine de chargement et de distribution couplée avec une rétroaction en temps réel à partir de capteurs de débit pour permettre aux séparations reproductibles de petits volumes d'échantillons.
La figure 5 montre les profils de débit mesurés à la SPO LPO et à partir d'une expérience typique de séparation. Premièrement, leader tampon d'au moins 35 pi est chargé d'assurer l'écoulement stable avant de l'échantillon atteint la puce acoustique. Exemples de volumes inférieurs à 100 pi ne sont pas recommandés pour cette configuration du système, parce que la dilution des échantillons en raison de la mémoire tampon leader devient excessive. Une prise d'air est utilisé au début de the injection avant que le tampon de premier plan pour séparer la fiche de l'échantillon de fluide qui en résulte, ce qui empêche le mélange et la dilution de l'échantillon et servant d'indicateur pour les capteurs de débit. Après une transitoire initiale comme fluide commence à se déplacer à travers le système, les signaux pointus pic dans les deux points indiquent le passage de la première bulle d'air. Ces transitoires sont suivies d'une longue période de flux stable que l'échantillon traverse le système, puis un autre pic lorsque la seconde bulle d'air passe, et enfin une éventuelle diminution du débit à zéro après l'arrêt de la pompe à seringue.
Le passage des bouchons d'air à travers les capteurs de débit est utilisé comme points de déclenchement pour commuter les vannes pour démarrer et arrêter la collecte d'échantillons, minimisant ainsi l'échantillon perdue et la dilution par les volumes de fluides non-échantillons. Closed-loop dosage de volumes d'échantillons transformés élimine le besoin de re-programmer ces valeurs avant le début de l'expérience, chaque fois que l'échantillon d'entrée est modifiée. Cette fonctionnalité estparticulièrement important lorsque le volume de l'échantillon est limitée, par exemple dans le cas d'un grand nombre d'échantillons cliniques. La surveillance du débit en temps réel contribue également à dépannage; une mauvaise série (par exemple, un sabot de formation dans l'un des points de vente) est immédiatement évident à partir des profils de flux qui en résultent, comme dans la figure 5b.
Pour démontrer la flexibilité et l'efficacité de la séparation acoustofluidic utilisant l'architecture du système présenté, MENV purifiée et GGV stocks de virus ont été dopés dans les stocks de cellules et séparé par un traitement par la puce microfluidique. Figure 7a montre que les cellules Raji ont été bien séparés des virus, comme 97 % des cellules Raji sortant de la puce ont été jugés dans le LPO, laissant ainsi un échantillon hautement enrichi du MENV dans le SPO. En comparaison, l'efficacité du MENV séparation était plus faible, avec 70% du MENV quitter la puce trouvé dans le SPO. Cela peut être attribué à un léger mélange de convection induite par les tours de la separatisur le canal, mais plus probablement à des particules de DENV migrateurs avec les cellules Raji dans la LPO. Les cellules migrent latéralement à travers les lignes de courant traînent un peu de liquide avec eux, même à faible nombre de Reynolds. Par ce mécanisme, ainsi que l'adsorption non spécifique de la surface, les particules virales transfert dans la LPO. Néanmoins, l'échantillon hautement enrichi de MDE dans le SPO est un avantage important, par exemple lorsque le séquençage de novo est utilisé pour détecter et identifier les virus.
Figure 7b montre que, dans un essai expérimental, seulement environ 70% des cellules Boa sortant de la puce ont été trouvés dans la LPO, comparativement à près de 100% d'efficacité de séparation des cellules Raji. La différence de rendement de séparation entre les deux types de cellules peut être attribuable à une taille moyenne inférieure ou une densité plus faible de cellules Boa par rapport aux cellules Raji, donc résultant en des forces acoustiques plus petites. Pour confirmer ou réfuter ces suppositions, la taille, la densité et la morphologie de Boacellules en suspension (qui poussent normalement adhérente) des cellules Boa doivent être mesurés avec précision, un effort pour complément d'enquête. Dans les mêmes expériences, de manière similaire aux expériences de MDE, la majeure partie de la GGV récupéré est sorti du SPO, indiquant un enrichissement de la fraction virale.
Les données présentées mettent en lumière les défis inhérents à l'ingénierie des plates-formes largement applicables pour-traitement d'une variété d'échantillons biologiques. Surtout, les interactions biologiques peuvent commencer à jouer en tant que grand rôle que les effets physiques et mécaniques. Cependant, ces expériences préliminaires montrent également la puissance et la promesse d'utiliser cette architecture de système pour le traitement des échantillons dans des applications cliniques et de recherche. Comme un système robuste, bien caractérisé d'ingénierie, cette plate-forme offre la possibilité de chercher des réponses à de nouvelles questions scientifiques.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was performed under the auspices of the U.S. Department of Energy by Lawrence Livermore National Laboratory under Contract DE-AC52-07NA27344, and partially supported by LLNL’s Laboratory Directed Research and Development (LDRD) program, 14-LW-077. The authors thank Michael Wilson, Mark Stenglein and Joe DeRisi at the Univeristy of California, San Francisco for generously providing GGV and Boa cell samples. EJF acknowledges support from the LLNL Lawrence Scholar Graduate Program. MS acknowledges support from the UC Office of the President Lab Fees Research Program. LLNL-JRNL-665235
matériels
| Name | Company | Catalog Number | Comments |
| Materials required for Steps 1-3: Device Design, Fabrication and Assembly | |||
| Double Sided Polished Silicon Wafer | Silicon Quest International, Inc. San Jose, CA, USA | 100 mm <100> prime wafer | 1-20 ohm-cm, 495 ± 25 µm Double-side polished |
| Glass Wafer | Bullen Ultrasonics, Eaton, OH, USA | 100 mmx0.5 mm Boro | |
| Photoresist, AZ 1518 | MicroChemicals GmbH, Ulm, Germany | AZ 1518 | Photoresist used to adhere wafer to blank wafer for DRIE etching |
| Photoresist, AZ 4620 | MicroChemicals GmbH, Ulm, Germany | AZ 4620 | Photoresist to define fluidic and via mask patterns |
| DRIE plasma etcher | STPS, Newport, NP, United Kingdom | Multiplex Advance Oxide Etch (AOE) ICP system | |
| Wafer Bonder | Electronic Visions Group, St.Florian am Inn, Austria | EVG 501 | |
| Dicing saw | Kulicke & Soffa Industries, Singapore | K&S 982 | |
| Epoxy kit | Epoxy Technology, Billerica, MA, USA | EPO-TEK 301 | Epoxy used to couple piezo and microfluidic chip |
| PZT piezoceramic | Piezo Systems, Woburn, MA, USA | PSI-5A4E | 37.5 × 10 × 0.5 mm |
| 28 AWG Kynar-insulated solid wire | Squires Electronics, Cornelius, OR, USA | UL1422 | |
| 2-part silver epoxy | MG Chemicals, Surrey, BC, Canada | 8331 | Conductive adhesive for attaching wire leads to PZT |
| L-edit | Tanner EDA, Monrovia, CA, USA | Ledit v15.1 64-bit | CAD software for mask layout |
| Materials required for Step 4: Characterizaiton of Acoustic Focusing Performance | |||
| Dual Pump | Harvard Apparatus, Holliston, MA, USA | PHD ULTRA Series, 703007 | |
| 5 ml syringes | Becton-Dickinson, Franklin Lakes, NJ, USA | 309646 | |
| Luer to Threaded port adapter | IDEX, Oak Harbor, WA, USA | P-659 | Connects syringe to tubing |
| Union | IDEX, Oak Harbor, WA, USA | P-623 | Connects world to chip connections to fluoropolymer tubing. Can also use webbed |
| Ferrule 1/4-28 flat bottom | IDEX, Oak Harbor, WA, USA | P-200 | Used with nut to make connections between tubing and syringe, flow sensors and world to chip hardware |
| Nut 1/4-28 flat bottom | IDEX, Oak Harbor, WA, USA | P-202 | Used with ferrule to make connections between tubing and syringe, flow sesnsors and world to chip hardware |
| 1/16" OD Fluoropolymer tubing | IDEX, Oak Harbor, WA, USA | 1912L | Tubing to connect syringe pumps to world to chip connections. Tubing size is not critical during claibration steps (.01-.03" ID typically used, other suitable part numbers: 1907L, 1902L). |
| Small ID fluoropolymer tubing | IDEX, Oak Harbor, WA, USA | 1476-20 | Used for Flow restrictors: 0.006" ID, 1/16" OD FEP |
| PEEK tubing | Connects from chip to fluoropolymer tubing. | ||
| Cooling fan | Multicomp, Leeds, England | MC19663 | |
| Function Generator | Agilent, Santa Clara, CA, USA | 33220A | |
| RF amplifier | ENI, Rochester, NY | 325 LA | Must be able to amplify signals from <1 V in the range of 1-2 MHz to 25 Vpp to the piezo. |
| CCD Camera | Photometrics, Tucscon, AZ, USA | CoolSnap HQ | |
| Inverted Microscope | Zeiss, Oberkochen, Germany | Axiovert S100 | |
| FITC filter set | Chroma Tech, VT, USA | SP101 | |
| Objective, 10X | Zeiss, Oberkochen, Germany | ACHROPLAN | |
| Oscilloscope | Tektronix, Beaverton, OR, USA | TDS3014B | To monitor voltage output by RF amplifier |
| MatLab | Mathworks, Natick, MA, USA | R2014a | |
| Driver interface software to integrate Photometrics camera with LabVIEW | R Cubed Software, Lawrenceville, NJ, USA | SITK | |
| Tween 20 | Sigma Aldrich, St. Lousi, MO, USA | P9416 | |
| Dragon Green Fluorescent 5.76 or 7.32 µm Beads | Bangs Laboratory, IN, USA | FS06F | |
| Additional materials required for Step 5: Automated Separation | |||
| Multiport valves | VICI, Houston, TX, USA | C25Z-3180EUHA | In the current configuration 4 valves are needed |
| Flow Sensors | Sensirion, Westlake Village, CA, USA | SLI-1000 | |
| Fluoropolymer tubing, .01 and .03" ID | IDEX, Oak Harbor, WA, USA | 1902L and 1912L | High purity PFA preferred |
| Nut | VICI, Houston, TX, USA | ZN1PK-10 | Used with ferrule to make connections between tubing and valves. Alternative part numbers: MZN1PK-10, LZN1PK-10 |
| Ferrule | VICI, Houston, TX, USA | ZGF1PK-10 | Used with nut to make connections between tubing and valves. |
| LabVIEW | National Instruments, Austin, TX, USA | LabVIEW Professional Development system | Laboratory Automation Software |
| PBS | Teknova, Hollister, CA, USA | P0200 | |
| Raji Cells | ATTC, Manassas, VA, USA | CCL86 | |
| Boa Cells | Kindly provided by the DeRisi Laboratory at UCSF | ||
| GGV | Kindly provided by the DeRisi Laboratory at UCSF | ||
| DENV | Kindly provided by Jose Pena at LLNL | ||
| Coulter Counter Z2 | Beckman Coulter, Brea, CA, USA | Z2 | |
| Hemacytometer | Fisher Scientific, Waltman, MA, USA | 0267151B | |
Références
- Gossett, D. R., Weaver, W. M., et al. Label free cell separation and sorting in microfluidic systems. Analytical and Bioanalytical Chemistry. 397 (8), 3249-3267 (2010).
- Lenshof, A., Laurell, T. Continuous separation of cells and particles in microfluidic systems. Chemical Society Reviews. 39 (3), 1203-1217 (2010).
- Sajeesh, P., Sen, A. K. Particle separation and sorting in microfluidic devices a review. Microfluidics and Nanofluidics. 17 (1), 1-52 (2014).
- Bhagat, A. A. S., Bow, H., Hou, H. W., Tan, S. J., Han, J., Lim, C. T. Microfluidics for cell separation. Medical & Biological Engineering & Computing. 48 (10), 999-1014 (2010).
- McGrath, J., Jimenez, M., Bridle, H. Deterministic lateral displacement for particle separation a review. Lab Chip. 14 (21), 4139-4158 (2014).
- Jubery, T. Z., Srivastava, S. K., Dutta, P. Dielectrophoretic separation of bioparticles in microdevices A review. ELECTROPHORESIS. 35 (5), 691-713 (2014).
- Jin, C., McFaul, S. M., et al. Technologies for label free separation of circulating tumor cells from historical foundations to recent developments. Lab on a Chip. 14 (1), 32 (2014).
- Trujillo, F. J., Juliano, P., Barbosa Cánovas, G., Knoerzer, K. Separation of suspensions and emulsions via ultrasonic standing waves – A review. Ultrasonics Sonochemistry. 21 (6), 2151-2164 (2014).
- Bridle, H., Miller, B., Desmulliez, M. P. Y. Application of microfluidics in waterborne pathogen monitoring A review. Water Research. 55, 256-271 (2014).
- Mariella Jr, R. Sample preparation the weak link in microfluidics-based biodetection. Biomedical microdevices. 10 (6), 777-784 (2008).
- Gor’kov, L. P. On the forces acting on a small particle in an acoustic field in an ideal fluid. Soviet Physics Doklady. 6, 773-775 (1962).
- Settnes, M., Bruus, H. Forces acting on a small particle in an acoustical field in a viscous fluid. Physical Review E. 85 (1), 016327 (2012).
- Barnkob, R., Augustsson, P., Laurell, T., Bruus, H. Acoustic radiation and streaming-induced microparticle velocities determined by microparticle image velocimetry in an ultrasound symmetry plane. Physical Review E. 86 (5), (2012).
- Bruus, H. Acoustofluidics 7 The acoustic radiation force on small particles. Lab Chip. 12 (6), 1014-1021 (2012).
- Fong, E. J., Johnston, A. C., et al. Acoustic focusing with engineered node locations for high performance microfluidic particle separation. Analyst. 139 (5), 1192-1200 (2014).
- Fong, E. J., Bora, M., et al. Continuously Variable Node Position in a High Throughput Acoustofluidic Device. Micro Total Analysis Systems. , 1184-1186 (2014).
- Jung, S. Y., Notton, T., Fong, E., Shusteff, M., Weinberger, L. S. Spatial tuning of acoustofluidic pressure nodes by altering net sonic velocity enables high-throughput efficient cell sorting. Lab on a Chip. 15 (4), 1000-1003 (2015).
- Franssila, S. Deep Reactive Ion Etching. Introduction to Microfabrication. , 255-270 (2010).
- Sharma Rao, B., Hashim, U. Microfluidic Photomask Design Using CAD Software for Application in Lab On Chip Biomedical Nanodiagnostics. Advanced Materials Research. 795, 388-392 (2013).
- Melin, J., Quake, S. R. Microfluidic Large Scale Integration The Evolution of Design Rules for Biological Automation. Annual Review of Biophysics and Biomolecular Structure. 36 (1), 213-231 (2007).
- Madou, M. J. . Fundamentals of microfabrication: the science of miniaturization. , (2002).
- Krulevitch, P., Benett, W., Hamilton, J., Maghribi, M., Rose, K. Polymer based packaging platform for hybrid microfluidic systems. Biomedical Microdevices. 4 (4), 301-308 (2002).
- Leslie, D. C., Easley, C. J., et al. Frequency specific flow control in microfluidic circuits with passive elastomeric features. Nature Physics. 5 (3), 231-235 (2009).
- Oh, K. W., Lee, K., Ahn, B., Furlani, E. P. Design of pressure driven microfluidic networks using electric circuit analogy. Lab on a Chip. 12 (3), 515-545 (2012).
- Mittelbrunn, M., Gutiérrez Vázquez, C., et al. Unidirectional transfer of microRNA loaded exosomes from T cells to antigen presenting cells. Nature Communications. 2, 282 (2011).
- Acosta, E. G., Castilla, V., Damonte, E. B. Functional entry of dengue virus into Aedes albopictus mosquito cells is dependent on clathrin mediated endocytosis. Journal of General Virology. 89 (2), 474-484 (2008).
- Stenglein, M. D., Sanders, C., et al. Identification Characterization and In Vitro Culture of Highly Divergent Arenaviruses from Boa Constrictors and Annulated Tree Boas Candidate Etiological Agents for Snake Inclusion Body Disease. 3 (4), e00180 12 (2012).
- Packard, M., Wheeler, E., Alocilja, E., Shusteff, M. Performance Evaluation of Fast Microfluidic Thermal Lysis of Bacteria for Diagnostic Sample Preparation. Diagnostics. 3 (1), 105-116 (2013).
- Lion, N., Reymond, F., Girault, H. H., Rossier, J. S. Why the move to microfluidics for protein analysis. Current Opinion in Biotechnology. 15 (1), 31-37 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon