Method Article
면역 결핍 마우스의 구인두 칸디다증의 Th17 염증 모델
요약
Although Candida infection models are available to study host immune resistance, a model to study T cell mediated immunopathology in the context of Candida infection is absent. Here we describe a method to establish Th17 immunopathology associated with oral Candida infection in immunodeficient mice.
초록
Oropharyngeal Candidiasis (OPC) disease is caused not only due to the lack of host immune resistance, but also the absence of appropriate regulation of infection-induced immunopathology. Although Th17 cells are implicated in antifungal defense, their role in immunopathology is unclear. This study presents a method for establishing oral Th17 immunopathology associated with oral candidal infection in immunodeficient mice. The method is based on reconstituting lymphopenic mice with in vitro cultured Th17 cells, followed by oral infection with Candida albicans (C. albicans). Results show that unrestrained Th17 cells result in inflammation and pathology, and is associated with several measurable read-outs including weight loss, pro-inflammatory cytokine production, tongue histopathology and mortality, showing that this model may be valuable in studying OPC immunopathology. Adoptive transfer of regulatory cells (Tregs) controls and reduces the inflammatory response, showing that this model can be used to test new strategies to counteract oral inflammation. This model may also be applicable in studying oral Th17 immunopathology in general in the context of other oral diseases.
서문
Oral infections and inflammation have been related to cancer and cardiovascular diseases, and have dramatic impact on overall human health2,3. Opportunistic infections and inflammation caused by C. albicans are associated with primary immunodeficiencies (PID)4,5, inflammatory disorders such as periodontitis 6,7, Sjogren’s syndrome, and salivary gland disease8,9, as well as oral squamous cell carcinoma 10-12. C. albicans is a dimorphic commensal fungus that colonizes the mouths of 60% of healthy humans asymptomatically, yet it is the most common fungal pathogen causing infections when the host defense is weakened13-15. It causes recurring and chronic infections and inflammation in patients with AIDS and PID, and also in other immunocompromised individuals. As a commensal, its colonization load is associated with the change in the diversity of the overall oral microbiome16. As a pathogen it causes several forms of oropharyngeal candidiasis such as acute pseudomembranous, acute atrophic, chronic atrophic, chronic hypertrophic/hyperplastic, and angular cheilitis.
Protection against C. albicans is determined not only by host immune resistance, but also by the ability to appropriately control Candida-induced immunopathology. Although commensals such as C. albicans contribute to modulation and exacerbation of other oral inflammatory conditions, the mechanisms by which dysbiosis occur during opportunistic infections are unclear. Besides the known role of adaptive Th17 cells in memory response to C. albicans17, their role in initiation and perpetuation of inflammation pathology during chronic infections remain unclear. Furthermore, oral inflammatory diseases such as Sjogren’s syndrome and periodontitis are associated with Th17 mediated pathology. Interestingly, these diseases are also strongly associated with frequent OPC. However, the interactions among Th17 cells, oral immunopathology of OPC and other oral inflammatory diseases are unstudied.
Although mouse models of primary and secondary infection of oral candidiasis are available, a mouse model to study Candida infection associated Th17 inflammation, especially in the context of immunodeficiency is unavailable. This study presents a method for establishing oral Th17 inflammation associated with oral Candida infection in mice. Candida infection in mice is characterized by fungal lesions, inflammation in the tongue, decreased food intake, weight loss and eventually a moribund state. Oral pathology resembles chronic candidal infection lesions, as well as epithelial dysplasia in mouse oral cancer models12,18.
프로토콜
참고 : 마우스를 사용하여 실험 기관 동물 복지위원회 (IACUC) 가이드 라인에 따라 실시 하였다.
(감염에 세 가지 일 이전) I N 체외 배양 된 Th17 세포와 마우스 - / - 1. 헝겊-1을 재구성
- 수용성의 존재에 혼자 U-바닥 96 웰 플레이트, 또는 3 × 104 CD4 + CD25 + Foxp3의 + Tregs과 함께 공동 문화를에서 Th17 세포, 문화 CD4 + CD44low CD62Lhigh CD25- 나이브 T 세포 (× 104 3) 수립 α-CD3 (1 ㎍ / ㎖) α-CD28 (2 ㎍ / ㎖) Th17 조건 하에서 항체 및 항원 제시 세포 (IL-6 (25 NG / ㎖), TGF-의 β를 이용하여 편광 (이 NG / ㎖) , α-IFN-γ (2 ㎍ / ml) 및 α -IL-4 (2 ㎍ / ㎖)) 3~4일 대.
참고 : 나이브 세포와 T의, 규정 정렬 형광 활성화 된 셀을 사용하여 정렬 된 (FACS)자기 세포 분리 절차 D 배양 앞서 설명한 바와 같이 19-22. - 4 일에, 피펫을 사용하여 Th17 세포를 재 부유 한 후, 문화에서 그들을 수집하고, 멸균 조건을 원심 분리기.
- 자신의 생존과 표현형에 대한 검사 이러한 세포의 작은 나누어지는 가져 가라. 요오드화 프로피 듐 (중에는 200ng / ㎖)를 첨가하고, 유세포 분류법으로 즉시 평가 생존, RPMI 배지 500 μL에이를 재현 탁. restimulation 후 IL-17A 생산의 평가 유동 세포 계측법에 의해 표현형을 수행합니다 (6.3 절 참조).
- 달리 명시하지 않는 한 모든 원심 분리 단계에서 39 ° C에서 6 분 동안 480 XG에 멸균 PBS에서 세포 주 벌크 씻는다.
- 6~8주 된 CD45.2 Rag1에 입양 전송을 위해 이러한 세포를 사용하여 - / - 면역 결핍 쥐.
- 찬 멸균 PBS를 사용하여 1 × 10 7 세포 / ㎖의 세포 밀도로 세포를 재현 탁.
- intrap에 의한 세포의 100 μl를 주입eritoneal 주사 한 마우스가 1 × 10 6 세포를 수신하도록, 1 ㎖의 투베르쿨린 주사기에 25 G 바늘을 사용. 일부 마우스는 PBS 또는 Th17 세포를 받게됩니다, 다른 마우스는 TREG 세포와 공동 배양 Th17 세포를 받게됩니다.
참고 : 무균 모든 단계를 수행합니다.
2. C. 성장 감염 알비 칸스 (일일 감염 이전에)
- 접종 전에 CAF2-1 C. 다섯 식민지를 분산 알비 칸스 실험실 멸균 PBS 현탁액 100 ㎕의 변형 및 멸균 국물에 서스펜션을 추가합니다.
- C. 5 식민지를 접종 효모 질소 염기의 50 ㎖에 칸디다 알비 칸스 (아미노산없이 YNB) / 펩톤 / 덱 스트로스 브로 쓰 배지 및 130 rpm에서 15 내지 18 시간 동안 30 ℃에서 진탕 배양기에서 배양한다.
- 즉, 균류의 성장을 표시 한, 백탁 국물 용 모니터.
3. 칸디다수확과 (감염의 날) 계수 절차
- 15 ml의 튜브에 칸디다 균 배지 10 ㎖를 수집합니다. 큰 볼륨의 경우, 50 ㎖ 튜브에 칸디다를 수집합니다.
- 달리 명시하지 않는 한 모든 단계에서 RT에서 5 분 동안 1,900 XG에 blastospores 원심 분리기. 상등액을 제거하여 원심 분리를 blastospores 펠렛.
- 하나 이상의 튜브가있는 경우, 펠릿 멸균 PBS를 첨가 다중 튜브의 칸디다 blastospores 수영장 카운팅 및 PBS 10 ㎖로 재현 탁 그들을.
- 1.5 ml의 마이크로 원심 튜브에 blastospores의 20 μl를 타고 배 파라 포름 알데히드의 20 μl를 추가하고 15 ~ 20 분 동안 실온에서 품어. 현미경으로 혈구를 사용하여 고정 blastospores를 계산합니다.
참고 : 파라 포름 알데히드는 발암입니다. 만 흄 후드의 원액을 엽니 다. - 한편, t를 원심 분리하여, 두 번 이상 반복 세척 blastosporesPBS에서 밑단하고 blastospores을 펠렛. 감염에 대한 준비, ABSL1 후드, RT에서 15 ml의 튜브에 펠릿을 유지합니다.
- 감염 blastospores을 재 부유에 대한 RT에서 일부 멸균 PBS를 남겨주세요.
- 카운팅 한 후, 효모 세포 / ml의 X10이 8 blastospore 효모의 세포 수를 조정할 blastospore 펠렛을 멸균 PBS를 추가한다. 이는 쥐를 감염 사용될 blastospore 현탁액이다.
참고 : 무균 모든 단계를 수행합니다.
4. 마우스 감염 (셀 전송 후 3 ~ 5 일)
주 : 앞서 설명 된 바와 같이 19,23-25 기본적인 감염 과정이 수행된다.
- - / - PBS 3 일 이전에 세포를받은 쥐 헝겊-1의 무게.
- 자신의 체중을 이용하여 마취제의 용량을 계산합니다. INTR에 의해, 1 ㎖의 투베르쿨린 주사기에 25 G 바늘을 사용하여, 케타민 / 자일 라진 (xylazine)의 혼합물 (16.1 ㎎ / ㎖ 및 1.6 ㎎ / ㎖)을 투여하여 쥐를 마취aperitoneal 주입.
- 체중 10g 당 50 μL를 관리. (즉, 케타민 0.8 mg의 체중의 자일 라진 / 10g 또는 0.08 mg의 케타민과 80 mg의 체중 kg 당 자일 라진 8 mg을 각각). 발가락 핀치 응답을 마취 후 매 15 분을 준수하십시오.
참고 :이 투여 량은 감염 과정에 대한 충분한 마취의 60 ~ 90 분을 유도 할 것이다. - 건조로부터 각막을 방지하기 위해 마우스의 눈 안과 윤활유 연고를 적용합니다. 눈의 윤활유가 건조 수있는 바와 같이, 안과 윤활마다 45 분을 반복합니다.
- 체중 10g 당 50 μL를 관리. (즉, 케타민 0.8 mg의 체중의 자일 라진 / 10g 또는 0.08 mg의 케타민과 80 mg의 체중 kg 당 자일 라진 8 mg을 각각). 발가락 핀치 응답을 마취 후 매 15 분을 준수하십시오.
- 마취 중 마우스의 재수 화를 돕기 위해 앞다리 피하 후면에 인접한 식염수 (0.9 %의 NaCl) 1ml를 주입한다.
- 새로운, 깨끗한 케이지를 얻습니다. 일단 감염 새로운 케이지에 각 마우스를 배치, 한 번에 감염 절차를 하나의 마우스를 따르십시오. 제 PBS / 가짜 감염을 수행 한 다음 칸디다 감염 촉진제로 진행업.
- 마취 마우스를 들고 혀의 기지를 공개하는 넓은 입을 엽니 다.
- 설하 90 분 동안 구강, PBS 또는 blastospore 현탁액 50 μL로 포화 3mm 직경 목화 공을 놓습니다. 코튼 볼이 움직이지 않는 것을 보장, 폐 울혈을 방지하기 위해 다시 쥐에게 15 분마다 전면 플립합니다.
- 구강에 가짜 또는 칸디다 균 접종 90 분을 보장하기 위해 모든 마우스에 대한 타이머를 설정합니다.
- 가열 램프 (4피트 거리)에서 케이지, 열 젤 패드에 각 마우스에 보관하십시오.
- 혀는 혀를 lacerating 치아를 방지하기 위해 치아 내부와 멀리 철회되어 있는지 확인합니다.
- 90 분의 끝에서 마우스의 입에서 면봉을 제거한다. 75분보다 빨리 마취에서 회복 수있는 마우스 시계. 이러한 경우에, 단지 케타민 (40 ㎎ / kg)으로 다시 마취.
5. 포스트 Procedur전자 (90 분 마취시) 모니터링
- 90 분 마취 중 열 젤 패드를 사용합니다.
- 체온을 유지하고 질식을 방지하기 위하여, 생쥐는 보통 옥수수 냉이 마우스 침구에 복구 할 수 없다.
- 마취에서 회복 한 후, 뒷면에 두 개의 위치에 멸균 0.9 % 염화나트륨 피하의 추가 1 ml에 관리 할 수 있습니다.
- 다섯 PBS (가짜) 케이지 당 접종 한 마우스에 계속. 케이지 당 하우스 만 1-2 감염된 쥐.
- 습관과 전반적인 건강을 정리, 체중의 변화를주의하는 것이 시술 후 매일 이니셜 절차 카드를 작성합니다.
6. 염증 평가
6.1) 체중 감소
- 감염 절차 이전에 하루에 시작, 감염 동안 매일 마우스의 무게를.
참고 : 일반적으로, Th17 세포없이 T의, 규정에 주입 된 면역 결핍 마우스 (20)에 굴복인해 -30 %의 중량 손실은 19 진균 부담 증가 및 염증을 악화.
혀의 6.2) 조직학 득점
- 자궁 경부 전위 다음 CO 2 질식하여 쥐를 희생.
- 턱을 열고 가위와 집게로 혀를 해부하다. 혀를 잡아 무딘 집게를 사용하고, 가위 입의 뒤쪽으로 다가 사용하는 혀의 뒤쪽 끝을 절개.
- 면역 세포 화학 헤 마톡 실린 및 에오신 혀 조직의 (H & E) 염색의 경우, 얼음 차가운 PBS와 혀의 조직을 씻어. 15 ml의 튜브 / N을 2-3 방언을 10 % 포르말린 5 mL를 추가하고 O를 수정.
- 다음날, 포르말린을 제거하고, 하이퍼 고정을 방지하기 위해 70 % 에탄올 5 ml의 조직 몰입. 단면 및 파라핀 섹션의 염색, 파라핀 삽입을 계속 상용 서비스로 보내십시오.
참고 : 상업 조직학 서비스는 다음 단계를 수행하는 데 사용됩니다.
- 다음날, 포르말린을 제거하고, 하이퍼 고정을 방지하기 위해 70 % 에탄올 5 ml의 조직 몰입. 단면 및 파라핀 섹션의 염색, 파라핀 삽입을 계속 상용 서비스로 보내십시오.
- 슬라이드 다시 상업 조직학 서비스에서 일단, 학년 광학 현미경 조직 절편을 관찰하여 염증.
- 0은 염증 되 않으며, 5 가장 심한 염증 인 상태 0-5 점수. 표 1을 사용하여 염증 점수.
Th17 세포에 의해 6.3) 사이토킨 생성
참고 : 과도한 TNF-α 생산은 과도한 면역 병리의 판독 중 하나입니다. 마우스를 적응 적 Th17 세포 만 전송되면, 그것은 Th17 세포에서 과도한 TNF-α의 생산과 관련된 면역 병리 발생된다.
- 전술 한 방법을 사용하여 비장 19,26, 경부 림프절, 겨드랑 lymphnodes, 혀에서 단일 세포 현탁액을 수집.
- Brefeldin A (10 ㎍ / ㎖)으로 4 시간 동안 포르 볼 미리 스테이트 아세테이트 (PMA) (50 NG / ml) 및 이오 노마 이신 (500 NG / ㎖)와 함께 세포를 Restimulate는 L 첨가대서양 표준시 2 시간. PBS로 세포를 세척하고 제조업체의 지침에 따라 상용 고정 / 투과성으로 키트를 사용하여 고정한다.
- 앞서 설명한 바와 같이 19를 형광 접합 된 항 TNF-α, IL-항 17a 및 ROR - γt 항체를 이용하여 세포 내 사이토 카인 염색법을 수행한다.
- / ml의 최종 농도 3 μg의 - 간단히, 항 TNF-α, IL-항 17a 및 ROR - γt 항체, 각각의 AT (2) 항체의 칵테일 (1X)의 투과성으로 버퍼에 세포를 재현 탁.
- RT에서 1 시간 동안 세포를 배양한다.
- 배양 후, 1X의 투과성으로 버퍼로 세포를 씻어.
- 유세포 분석을 0.5 % 소 혈청 알부민 500 μl의 PBS에서 세포 펠렛을 재현 탁.
결과
이 모델에서, 걸 레-1의 칸디다 -infected 마우스 및 감염되지 않은 쥐 모두 - / - 면역 결핍 배경이 적응 적 감염 3-5 일 전에 Th17 세포를 옮겼다. 10-12 마우스의 총 위장 감염이 각 그룹의 생쥐 및 칸디다 감염, 각 그룹에서 4-5으로, 실험에 사용 하였다. 주입 Th17 세포는 각각 (도 1a)을 Thy1.1 또는 CD45.1 염색법을 사용하여 생체 내에서 추적 된되도록 나이브 세포, CD45.1 congenic Thy1.1 또는 마우스로부터 유래 하였다. 공동 양도 된 T는, 규정 CD45.1 Th17 세포로부터 구별되도록 CD45.2 마우스로부터 유도 하였다. 일부 실험에서, CB-17 SCID Thy1.2받는 마우스는 Thy1.1을 Balb / C 마우스 및 congenic Thy1.2 마우스로부터 수득 된 T, 규정에 의한 Th17 공여체 세포를 사용 하였다. 전용 + 칸디다에는 쥐 -infected 아니지만 비감염 생쥐 모집 및 재구성 CD45.1의 퍼짐을 나타내 까지. 이 결과는 균 Th17 특정 응답이 혀 림프절 (도 1a)에 개시되는 것을 보여준다. 결과는 각 그룹의 마우스를 하나의 데이터를 나타낸다.
만 T의, 규정에 이식 공동 된 생쥐에서, Foxp3의 + CD45.1 부정적인 CD4 + 세포는 CLN 검출되었다. 이 주입 된 T의, 규정도 감염 부위 (그림 1B)에 채용 된 것을 알 수있다. 결과는 각 그룹의 마우스를 하나의 데이터를 나타낸다. - / - 헝겊-1에 감염된 반면 무게와 감염 4 일 후에 회복을 잃고, 코르티손 면역 억제 마우스가 회복되지 않았지만, 추가 손실 무게로 이전 27 표시. 모두, 규정 된 T의 존재 또는 부재 Th17 세포를받은 생쥐의 그룹은 초기 중량을 잃었다. 그러나, 체중 감소로부터 회수 된 T를 수신하고, 규정 마우스는 감염을 해결. 2m얼음 칸디다 감염은 각 그룹에서 위장 감염 군에 사용 하였다 4. 코티 그룹의 3 마우스가 있었다. Th17 세포를받은 생쥐는 (그림 2) 19 점진적으로 무게를 잃었다. 해당 그룹의 마우스의 일부는 안락사했다. 이러한 결과는 해당 그룹의 모든 마우스의 가중치의 평균을 나타낸다. 호중구는 감염의 초기 통관에 필요한 있지만, 조직에서의 연속 표시 및 모집 해결되지 않은 염증의 표시이다. 따라서 호중구 침윤 그러한 일 -7- 감염 후 후술 시점에서 호중구 마커의 발현, GR-1을 결정함으로써, 감염된 혀 조사 하였다. Th17 세포를받은 마우스 만, T, 규정 된 (도 3b)를 주입 한 쥐에 비하여, GR-1 + 호중구 짝수 일 -4- 감염 후 고등 염증성 침윤 (도 3A)를 가지고 있었다. 이러한 결과는 보여 주었다 presenc에T의, 규정의 전자는, 마우스는보다 효율적으로 염증을 해결하고 감염에서 회복되었다.
감염 후 7 일에, 비장 (SPLN), CLN과 혀 조직을 고립시키고, 단일 세포 현탁액을 유동 세포 계측법에 대해 분석 하였다. CLN은 Th17 세포 만받은 쥐에서 CD45.1 Th17 세포 (그림 1)과 강화 된 TNF-α 생산 (그림 4A, 4B) 증가 밝혔다. 한편, T는 수신자가 Th17 세포 (도 1 및 4A, 4B)에 의해 Th17 세포의 감소 된 주파수 및 TNF-α의 생산을 감소 REG 보였다. 이 실험에서, 2 마우스에서 수확 풀링 한 번의 마우스의 CLN, 혀 조직의 데이터가 표시됩니다. 이른 시간 지점에서 IL-17A 생산 T 높았다 비록 기, Th17 세포에 의한 IL-17A 생산 (데이터 미도시) 모두에서 최소이었다 이후 시점에서, 수신자 (19) REG. 요오드 산 쉬프 염색T의, 규정을 받았습니다 마우스뿐만 아니라 감염 (그림 5) 후 하루 5 일-7에 곰팡이를 삭제 반면, 혀, 만 Th17 세포를받은 쥐에서 곰팡이 균사 증가했다. 또한, 혀의 염증 조직 병리학 점수는 만 Th17 세포 (그림 6)를받은 쥐에 비해 T의, 규정을받은 생쥐에서 감소 염증 점수를 보였다. 염증을 채점하는 것은 같은 유두의 존재와 혀 조직 학적 매개 변수를 기반으로 한, (지속적인 조직 복구를 나타내는) 해결되지 않은 감염을 나타내는 균사 침입 표면 상피 층, 볼 효모 또는 균사의 intactness, 기저층의 비후, 면역 세포 (호중구와 Th17 세포) 침윤의 존재. 이 결과는 직접적으로 감염을 감소시키지 않았다 Th17 세포의 주입을 입증하지만 기본 C. 의한 진균 부담 증가 및 면역 병리 칸디다 알비 칸스 인 감염기, T의, 규정의 공동 전송이 면역 병리를, 개선 반면.
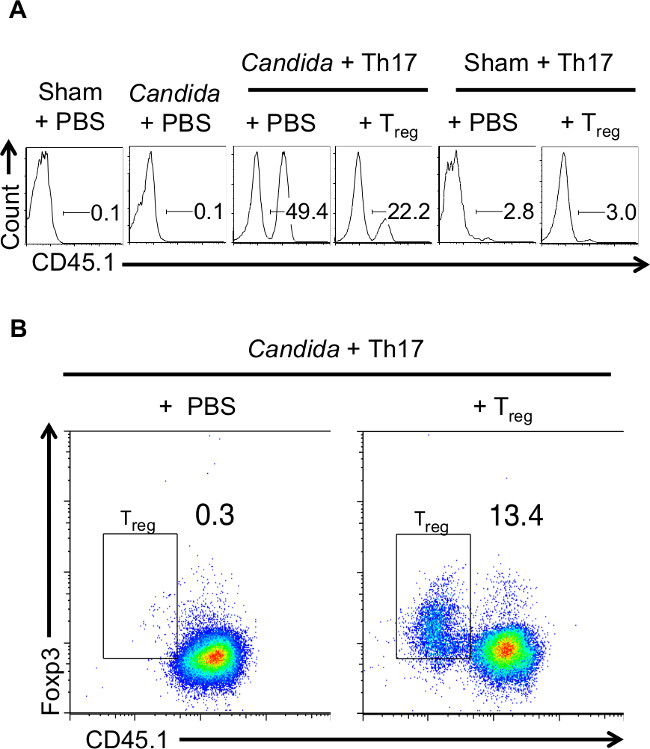
그림 1. 주입 된 Th17 세포와 T의 등록 세포가 C의 림프절 (CLN)에 모집 및 확장 알비 칸스 (Candida albicans)가 쥐를 감염 (A) 헝겊-1 -.. / - CD45.2 마우스가 Th17 세포 또는 Th17으로 재구성되었다 + T는 5 일간 Th17 조건으로 편광 된 세포 REG. Th17 세포 CD45.2 마우스로부터 수득 하였다 CD45.1 congenic 마우스 및 T의 레지 세포로부터 얻었다. 일부 마우스는 어떤 세포 (가짜 또는 칸디다 + PBS)를받지 못했습니다. 각 그룹의받는 사람 마우스는 가짜 컨트롤 또는 C에 감염되었다 알비 칸스. 감염 후 5 일에서 CLN은 ISOLAT했다ED는 단일 세포 현탁액을 만들고 (FSC, SSC 캐터 모든 백혈구에서 게이트) 유동 세포 계측법에 의해 Th17 세포 발현 주입 CD45.1을 추적하는 (B) 넝마 1 -. / - 생쥐 Th17 세포로 재구성 하였다 CD45.2 또는 Th17 + T의 등록의 "A"에서와 같이 세포와 C에 감염. 알비 칸스. CLN은 단일 세포 현탁액을하고 CD45.1과 (모든 CD4 세포에 게이트) 유동 세포 계측법에 의해 세포 내 Foxp3의 발현을 측정하기 위해 분리 하였다. 플롯 T의 등록 게이트 부정적인 CD45.1, Foxp3의 + CD4 + 세포를 보여준다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2 주조 Th17 셀 C는 체중 감소의 원인 . T의, 규정의 알비 칸스 (Candida albicans) 감염 마우스와 병용 투여가 체중 감소의 회복을 향상시킨다. SCID CB-17 마우스 그림 1A와 같이 Th17 세포 또는 Th17 + T의 등록 세포로 재구성되었다. 삼일 후,받는 사람 마우스는 C.에 감염되었다 알비 칸스 (Candida albicans). 각 그룹의 일부 마우스는 가짜 컨트롤에 감염되었다. 면역 억제 마우스는 코르티손 아세테이트 (콜트) 주입을 받았다. D-1 (언젠가 감염 이전)이 표시됩니다에 대한 알비 칸스 (C. albicans)로 표시 세포를 재구성하고 감염된 생쥐 %의 체중 변화,. 데이터가 감염되지 않은 (가짜 + PBS) 마우스의 무게 데이터를 표준화 된 기준으로합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
"SRC ="/ 파일 / ftp_upload / 52538 / 52538fig3highres.jpg "/>
그림 3. 주조 Th17 세포는 C에 혀 면역 병리가 발생합니다. 알비 칸스 (Candida albicans)가 마우스와 T의, 규정의 병용 투여 C의 방언의 면역 병리. 조직 학적 평가를 줄여 감염 알비 칸스 (Candida albicans)는 쥐를 감염. 마우스를 지시 된 세포로 재구성하고도 1A에서와 같이 감염시켰다. 감염 후 5 일에서 방언은. 쥐에서 분리 하였다 (A) 방언의 시상 부분은 염증과 면역 세포의 침윤 (IF)를 평가하기 위해 H & E 염색 하였다. (PA) 및 (EP) 각각 유두 혀의 상피층을 나타낸다. at50X 배율 볼 슬라이드 현미경 이미지. (B) 항 GR-1 항체를 사용하여 GR-1 호중구 마커에 대한 조직 학적 면역 염색 (클리오NE : IF로 표시 감염 후 5 일에 혀 섹션에서 1A8-Ly6g) (갈색). 표시됩니다 100X 배율에서 볼 슬라이드 현미경 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

T의, 규정의 그림 4. 병용 투여 주입 Th17 세포에서 TNF-α (α)를 감소시킨다. (A) 넝마 1 - / - 생쥐 CD45.2 Th17 세포 또는 Th17 + T 세포의 등록과 함께 재구성 C. 감염시켰다 알비 칸스 (Candida albicans)는도 1a에서와 같이. 감염 후 5 일째, CLN 혀 조직을 단일 세포 현탁액을 만들기 위해 분리 하였다. 이 세포는 세포 내 staini 전에 PMA와 이오 노마 이신 재 자극했다NG 및 유동 세포 계측법 분석한다. Th17 세포의 세포 내 ROR - γt 및 TNF-α 발현을 유세포 콘타가 도시된다. (B) "A"에서와 같이 실험을 수행로부터 TNFαpositive 세포의 비율의 통계적 표현 (CD4 + 세포 상에 게이팅). 데이터가 감염되지 않은 그룹의 4 마우스, 각 감염된 그룹의 6 마우스를 나타내고, 두 개의 독립적 인 실험에서 풀링. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5. 증가 면역 병리는 C의 증가 곰팡이 부담과 연관되어 있습니다. 알비 칸스 (Candida albicans)가 쥐를 감염. CB-17 SCID 마이크전자를 Balb / C Th17 세포와 재구성, 또는 Figure1A에서와 Th17 + T의 등록 세포 및 C로 감염되었다 알비 칸스. 감염된 마우스의 혀의 조직 학적 평가가 도시되어있다. 감염 후 7 일째, 설편 수확 진균 병변 및 염증 세포의 침윤 (IF)을 평가하고, (CA)을 균을 검출하는과 요오드 산 쉬프 (PAS) 염색. 슬라이드 at100X 배율을 볼 수 있었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
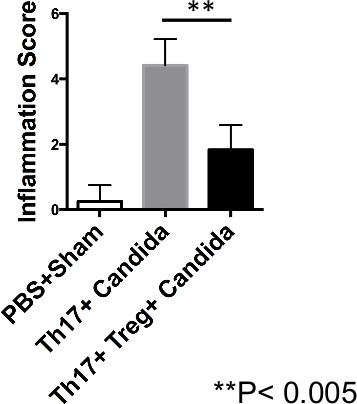
그림 6. T의 사무 처리 규정 제 C의 면역 병리를 개선. 알비 칸스 (Candida albicans)에 감염된 쥐를. CB-17 SCID 마우스를 Balb / C Th17 세포를 재구성하거나, Th17 + T 세포의 등록도 1a에서와 같이, 및 C. 감염시켰다시켰다 알비 칸스. 그림 5에서와 같이 평가 감염된 마우스의 방언의 평균 조직 학적 점수의 통계 표현입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 점수 | 특성 |
| 0 | 0 - 눈에 보이는 효모 또는 균사, 혀 등의 표면에 그대로 표면 상피, 분명히 존재하고 손상되지 않은 용의자 (수도 있고 조직 내에서 단핵 세포에 침투하지 않을 수 있습니다), 기저층, 아니 침투 면역 세포의 더 두꺼워. |
| (1) | 1 - 눈에 보이는 효모하거나 균사전자, 비정형 또는 약간 손상의 상피 세포, 피해를 최소화하고 자주 침투 면역 세포와 분명히 존재 유두. |
| 이 | 2 - 용의자 감소하지만, 손상, 기저층의 비후 자주 침투 면역 세포에 존재합니다. |
| 3 | 3 - 눈에 보이는 효모 및 침입 균사, 손상된 유두, 손상된 상피 가끔 병변, 기저 층의 비후 및 면역 세포 침투의 작은 클러스터의 증거 가끔 클러스터. |
| 4 | 4 - 볼 효모 및 침입 균사, 손상된 유두, 손상된 상피 세포, 면역 세포의 최소한의 침투, 기저층과 면역 세포에 침투 자주 클러스터의 비후 자주 병변의 증거를 자주 클러스터. |
| (5) | - 5 등의면에서 균사 침입, 광범위하게 손상된 상피 세포의 큰 침투의 광범위한 증거몇 면역 세포, 또는 전혀 검출 유두, 기저층의 비후 및 면역 세포 침투의 매우 빈번하고 큰 클러스터. |
표 1 : 조직 학적 점수 값
토론
이 모델은 경구 C. 유도에 기초 알비 칸스 (Candida albicans) 감염 따라 Th17 염증. 때문에 T의, 규정의 부재로, Th17 세포에 의한 염증은 무제한이며 제대로 해결 면역 병리로 연결됩니다. 시험관이 Th17 세포가 입양 전송에 사용했다 편광 순진한 CD4 세포를 유도. 40 - 배양 된 CD4 + 세포의 50 %가 약 3 일 검출 가능한 IL-17A 식 (Th17 세포)를 보여 주며, 따라서 마우스에서 주사에 사용 하였다. 모델의 주요 이점은 Th17 세포가 효율적으로 T의 레지 주입으로 개선 될 수있는 특정 면역 병리 감염을 야기한다는 것이다. 따라서 모델은 양성 대조군으로 T의 레지 분사 면역 전략을 시험하기 위해 사용될 수있다. 염증은 쉽게 감염 마우스의 Th17 세포에 의한 체중 감소, 조직 병리학 점수 및 염증성 사이토킨 생성에 기초하여 평가된다.
t 후그는 Th17 세포의 이동, 그들은 혀, 감염의 주요 사이트를 포함하여 차 림프 기관과 다양한 조직으로 마이그레이션 입양. 감염 후, 다른 염증 세포는 감염을 취소 혀를 모집했다. 그러나, T의 등록 매개 면역없이, Th17 세포 자체가 감염을 해결하지만 고조 면역 병리가 발생하지 않았다. T, 규정 된 공동 양도 완전히 염증을 해결. 흥미롭게도, T의, 규정의 부재에서 악화 된 염증 마우스는 또한 곰팡이 부담을 증가 보였다. 우리의 이전 보고서는이 T의, 규정과에 비해, 생쥐에서 감소 IL-17A 생산에 의한 것으로 나타났다. 우리의 현재 실험은 인해 가능성이 증가하고 상피 세포의 세포 사멸에 의해, 염증을 악화와 곰팡이 부담이 28 증가 증가 TNF-α에있을 수 있다는 생각을 지원합니다. 점막에서 IL-17A의 면역 보호 효과를 고려우리는 곰팡이 부담 증가와 함께 관찰 염증 병리 Th17 세포 또는 호스트 저항의 부족에 의해 생성 된 IL-17A에 의한 아니라고 생각합니다. 이 때문에 TNF-α 및 주입 Th17 세포에 의해 생성 된 가능한 다른 염증성 사이토킨시킨다. - / - Th17 세포가 결여 된 마우스 최소한의 염증 및 감염의 후속 해상도 만 Th17 세포가 심각한 체중 감소에 굴복 수신 것들 (도 1)이 보여 걸레 관찰에 의해 확인 될 수있다. - / - 마우스는 많은 면역 병리 (27)없이 기본 OPC 감염을 취소 한이 데이터에 대한 일관성, 또한 이전에 그 헝겊을 보였다. - / - 마우스 17,29,30 이러한 조건에서 종속 IL-17A는 선천성 면역 세포 생산에 보상 메커니즘 헝겊에 감염을 취소하는 것으로 나타났다. IL-17A는 감염의 초기 단계에서 보호 역할을하고있다 Th17 세포와 호중구 모집에 의해 생성되지만, 함께 찍은, EXCTNF-α와 Th17 세포에 의해 다른 사이토 카인, 호중구 원인의 지속적인 존재 (메모리) 생산은 면역 병리를 악화. Th17 세포에 의해 생성 된 TNF-α 또한 염증성 사이토 카인의 역할은 면역 병리의 맥락에서 조사가 남아있다.
모델의 주요 한계는 인간의 생리 학적 관련성에 OPC 여부 질문이다. Th17 세포 Th17 세포의 활성화가 만성 OPC 병원성 여부 여러 구강 질환에서 병리학 적 매개체 인 것으로 도시되어 있지만 조사가 남아있다. C.의 역할을 암시하는 최근 소견 염증과 암에 알비 칸스 (Candida albicans)는 구강에서 Th17의 면역 병리 조사 (31)의 활성 필드입니다. 따라서 여기에서 설명하는 모델은 더 신중하게 Th17 세포의 특정 역할을 연구하는 데 사용할 수 있으며, 어떻게 경구 면역 질환 및 구강 암에 대한 자세한 통찰력을 제공, 선천성 면역 세포와 상호 작용합니다.
기술에서 중요한 단계는 해당 모집 및 적응 적 전송 Th17 세포의 확장이다. 이것은 전송 전에 시험관 편광 Th17 세포의 생존 및 IL-17A 생산에 크게 의존한다. 그것은 유동 세포 계측법에 의해 자신의 생존과 사이토 카인 생산 (19)를 분석을 테스트하는 것이 가장 좋습니다. Th17 세포 주입 및 마우스 감염의 적절한 실행은 감염 따라 Th17의 면역 병리으로 이어질 것입니다. 이 모델은 또한 다른 감염의 맥락에서의 면역 병리 Th17과 구강 염증을 저지하기위한 전략을 테스트하기 위해 적용될 수있다. 또한,이 모델을 사용하여, 하나는 다시 이차 감염을 수행하고, 만성 감염의 맥락에서 면역 병리 악화에 Th17 세포의 역할을 연구 할 수있다. 이 모델은 면역 결핍 쥐를 포함, 그것은 만성 칸디다 감염이 반복되는 고통 AIDS 및 PID 환자에서 볼 구강 dysbiosis 매우 관련이있을 수 있습니다.
공개
The authors declare that they have no competing financial interests.
감사의 말
We thank Dr. Helene Bernstein for providing us with access to her flow cytometer. We also thank CFAR flow cytometry facility for the flow cytometry services. This project was in part supported by CTSC core utilization funding and STERIS corporation/University Hospitals-Division of Infectious diseases grant to PP.
자료
| Name | Company | Catalog Number | Comments |
| CAF-2 | University of Pittsburgh (Sarah Gaffen) | - | Candida culture |
| U-bottom 96 well plates | Fisher | 055588 | Used for cell culture |
| a-CD3 | eBiosciences | 16-0031-85 | Polarization of cells to Th17 conditions |
| a-CD28 | eBiosciences | 16-0281-85 | Polarization of cells to Th17 conditions |
| m-IL-6 | Bio Basic | RC232 | Polarization of cells to Th17 conditions |
| h-TGF-b | R&D | 240-B | Polarization of cells to Th17 conditions |
| a-IFN-g | eBiosciences | 16-7311-85 | Polarization of cells to Th17 conditions |
| a-IL-4 | eBiosciences | 16-7041-85 | Polarization of cells to Th17 conditions |
| α-IL17A ef660 | eBiosciences | 50-7177-82 | Used for cell culture - 1:50 |
| α-TNFa-PE-Cy7 | eBiosciences | 25-7423-41 | Used for cell culture - 1:100 |
| α-RORgt PE | eBiosciences | 12-6981-82 | Used for cell culture - 1:50 |
| YNB w/o amino acids)/Peptone/Dextrose broth medium | Bio Basic | S507.SIZE | Mediium for candida growth |
| Shaker incubator | New Brunswick Scientific | Innova 4300 | Incubation growth for candida |
| 15 ml tubes | Bio Basic | BT888-SY | Used for cell culture and candida growth |
| 50 ml tubes | Bio Basic | CT 788-YS | Used for cell culture and candida growth |
| Table top Centrifuge | VWR International LLC | 82017-654 | For pelleting candida -900 g |
| Allegra Centrifuge | Beckman Coulter | 392302 | Cell culture - 480 g |
| 1.5 ml eppendorf tubes | Bio Basic | BT620-NS | Preparing final concentration of candida |
| 2x paraformaldehyde | Electron Microscopy Sciences | 15710 | Fixing candida for count |
| Hemocytometer | VWR International LLC | 15170-172 | Counting cells |
| PBS - Phosphate Buffered Saline | Bio Basic | PD8117 | Preparation of buffers |
| Ketamine/xylazine | Case Western Reserve University - Animal Resource Center | - | Obtained from ARC approved protocol for anesthesia |
| Ophthalmic lubricant ointment | Allergan | - | Eye ointment for animals to prevent dryness |
| Saline (0.9% NaCl) | G Biosciences | 786-561 | Administerd to animals to prevent dehydration |
| 3-mm-diameter cotton wool ball | VWR International LLC | BP7603 | 3 mm balls for candida infection |
| Heat gel pads | Case Western Reserve University - Animal Resource Center | - | for maintaining the body temperaturre and fast recovery |
| Hematoxylin and Eosin staining | Histoserv - MD | - | Tissue histology |
| 10% formalin | Electron Microscopy Sciences | JC1111/MC | Tissue histology |
| 70% ethanol | VWR International LLC | 97064-490 | Sterilization purpose |
| PMA - Phorbol 12-myristate 13-acetate | Sigma-Aldrich | P1585-1MG | Restimulation of cells |
| Ionomycin | Life Technologies | 124222 1mg | Restimulation of cells |
| Fixation permeabilization kit | eBiosciences | E16913-106 | Fixing cells for Flow cytometry |
| Tuberculin syringes | BD Biosciences | 309659 | Mice injection |
| 25 G x 3/8 needles | BD Biosciences | 309626 | Mice injection |
| Rag1 -/- mice | Jackson laboratories | Stock no: 002216 | Recipient mice |
| CD45.1 congenic mice | Jackson laboratories | Stock no:002014 | Donor Th17 cells |
| CB17-SCID mice | Jackson laboratories | Stock no: 001303 | Recipient mice |
| Balb/c mice | Jackson laboratories | Stock no: 000651 | Donor Th17 cells |
참고문헌
- Allam, J. P., et al. IL-23-producing CD68(+) macrophage-like cells predominate within an IL-17-polarized infiltrate in chronic periodontitis lesions. Journal of Clinical Periodontology. 38 (10), 879-886 (2011).
- Loesche, W. J. Periodontal disease: link to cardiovascular disease. Compendium Of Continuing Education In Dentistry. 21 (6), 463-466 (2000).
- Sfyroeras, G. S., Roussas, N., Saleptsis, V. G., Argyriou, C., Giannoukas, A. D. Association between periodontal disease and stroke. Journal Of Vascular Surgery. 55 (4), 1178-1184 (2012).
- Huppler, A. R., Bishu, S., Gaffen, S. L. Mucocutaneous candidiasis: the IL-17 pathway and implications for targeted immunotherapy. Arthritis Research & Therapy. 14 (4), 217 (2012).
- Sitheeque, M. A., Samaranayake, L. P. Chronic hyperplastic candidosis/candidiasis (candidal leukoplakia). Critical Reviews In. Oral Biology And Medicine : An Official Publication Of The American Association Of Oral Biologists. 14 (4), 253-267 (2003).
- Canabarro, A., et al. Association of subgingival colonization of Candida albicans and other yeasts with severity of chronic periodontitis. Journal Of Periodontal Research. 48 (4), 428-432 (2013).
- Urzua, B., et al. Yeast diversity in the oral microbiota of subjects with periodontitis: Candida albicans and Candida dubliniensis colonize the periodontal pockets. Medical Mycology. 46 (8), 783-793 (2008).
- Ergun, S., et al. Oral status and Candida colonization in patients with Sjogren's Syndrome. Medicina Oral, Patologia Oral Y Cirugia Bucal. 15 (2), e310-e315 (2010).
- Hernandez, Y. L., Daniels, T. E. Oral candidiasis in Sjogren's syndrome: prevalence, clinical correlations, and treatment. Oral Surgery, Oral Medicine, And Oral Pathology. 68 (3), 324-329 (1989).
- Gall, F., et al. Candida spp. in oral cancer and oral precancerous lesions. The New Microbiologica. 36 (3), 283-288 (2013).
- Grady, J. F., Reade, P. C. Candida albicans as a promoter of oral mucosal neoplasia. Carcinogenesis. 13 (5), 783-786 (1992).
- Dwivedi, P. P., Mallya, S., Dongari-Bagtzoglou, A. A novel immunocompetent murine model for Candida albicans-promoted oral epithelial dysplasia. Medical Mycology. 47 (2), 157-167 (2009).
- Cheng, S. C., Joosten, L. A., Kullberg, B. J., Netea, M. G. Interplay between Candida albicans and the mammalian innate host defense. Infection and Immunity. 80 (4), 1304-1313 (2012).
- Marodi, L., Johnston, R. B. Invasive Candida species disease in infants and children: occurrence, risk factors, management, and innate host defense mechanisms. Current Opinion In Pediatrics. 19 (6), 693-697 (2007).
- Kumamoto, C. A. Inflammation and gastrointestinal Candida colonization. Current Opinion In. Microbiology. 14 (4), 386-391 (2011).
- Kraneveld, E. A., et al. The relation between oral Candida load and bacterial microbiome profiles in Dutch older adults. PloS One. 7 (8), e42770 (2012).
- Hernandez-Santos, N., et al. Th17 cells confer long-term adaptive immunity to oral mucosal Candida albicans infections. Mucosal Immunology. 6 (5), 900-910 (2013).
- Hasina, R., et al. ABT-510 is an effective chemopreventive agent in the mouse 4-nitroquinoline 1-oxide model of oral carcinogenesis. Cancer Prevention Research. 2 (4), 385-393 (2009).
- Pandiyan, P., et al. CD4(+)CD25(+)Foxp3(+) regulatory T cells promote Th17 cells in vitro and enhance host resistance in mouse Candida albicans Th17 cell infection model. Immunity. 34 (3), 422-434 (2011).
- Pandiyan, P., et al. The role of IL-15 in activating STAT5 and fine-tuning IL-17A production in CD4 T lymphocytes. J Immunol. 189 (9), 4237-4246 (2012).
- Pandiyan, P., Lenardo, M. J. The control of CD4+CD25+Foxp3+ regulatory T cell survival. Biology Direct. 3 (6), (2008).
- Pandiyan, P., Zheng, L., Ishihara, S., Reed, J., Lenardo, M. J. CD4(+)CD25(+)Foxp3(+) regulatory T cells induce cytokine deprivation-mediated apoptosis of effector CD4(+) T cells. Nat Immunol. 8 (12), 1353-1362 (2007).
- Conti, H. R., Huppler, A. R., Whibley, N., Gaffen, S. L., Coligan, J. E. Animal models for candidiasis. Current Protocols In Immunology. 105, 11-19 (2014).
- Conti, H. R., et al. Th17 cells and IL-17 receptor signaling are essential for mucosal host defense against oral candidiasis. J Exp Med. 206 (2), 299-311 (2009).
- Kamai, Y., et al. New model of oropharyngeal candidiasis in mice. Antimicrobial Agents And Chemotherapy. 45 (11), 3195-3197 (2001).
- Pandiyan, P., Bhaskaran, N., Zhang, Y., Weinberg, A. Isolation of T cells from mouse oral tissues. Biological Procedures Online. 16 (1), 4 (2014).
- Gladiator, A., Wangler, N., Trautwein-Weidner, K., LeibundGut-Landmann, S. Cutting edge: IL-17-secreting innate lymphoid cells are essential for host defense against fungal infection. J Immunol. 190 (2), 521-525 (2013).
- Leppkes, M., Roulis, M., Neurath, M. F., Kollias, G., Becker, C. Pleiotropic functions of TNF-alpha in the regulation of the intestinal epithelial response to inflammation. International Immunology. 26 (9), 509-515 (2014).
- Bishu, S., et al. The adaptor CARD9 is required for adaptive but not innate immunity to oral mucosal Candida albicans infections. Infection and Immunity. 82 (3), 1173-1180 (2014).
- Quintin, J., et al. Differential role of NK cells against Candida albicans infection in immunocompetent or immunocompromised mice. Eur J Immunol. 44 (8), 2405-2414 (2014).
- Ramirez-Garcia, A., et al. Candida albicans and cancer: Can this yeast induce cancer development or progression. Critical Reviews In Microbiology. , 1-13 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유