Method Article
Th17 Entzündung Modell Oropharyngeale Candidiasis in immundefizienten Mäusen
In diesem Artikel
Zusammenfassung
Although Candida infection models are available to study host immune resistance, a model to study T cell mediated immunopathology in the context of Candida infection is absent. Here we describe a method to establish Th17 immunopathology associated with oral Candida infection in immunodeficient mice.
Zusammenfassung
Oropharyngeal Candidiasis (OPC) disease is caused not only due to the lack of host immune resistance, but also the absence of appropriate regulation of infection-induced immunopathology. Although Th17 cells are implicated in antifungal defense, their role in immunopathology is unclear. This study presents a method for establishing oral Th17 immunopathology associated with oral candidal infection in immunodeficient mice. The method is based on reconstituting lymphopenic mice with in vitro cultured Th17 cells, followed by oral infection with Candida albicans (C. albicans). Results show that unrestrained Th17 cells result in inflammation and pathology, and is associated with several measurable read-outs including weight loss, pro-inflammatory cytokine production, tongue histopathology and mortality, showing that this model may be valuable in studying OPC immunopathology. Adoptive transfer of regulatory cells (Tregs) controls and reduces the inflammatory response, showing that this model can be used to test new strategies to counteract oral inflammation. This model may also be applicable in studying oral Th17 immunopathology in general in the context of other oral diseases.
Einleitung
Oral infections and inflammation have been related to cancer and cardiovascular diseases, and have dramatic impact on overall human health2,3. Opportunistic infections and inflammation caused by C. albicans are associated with primary immunodeficiencies (PID)4,5, inflammatory disorders such as periodontitis 6,7, Sjogren’s syndrome, and salivary gland disease8,9, as well as oral squamous cell carcinoma 10-12. C. albicans is a dimorphic commensal fungus that colonizes the mouths of 60% of healthy humans asymptomatically, yet it is the most common fungal pathogen causing infections when the host defense is weakened13-15. It causes recurring and chronic infections and inflammation in patients with AIDS and PID, and also in other immunocompromised individuals. As a commensal, its colonization load is associated with the change in the diversity of the overall oral microbiome16. As a pathogen it causes several forms of oropharyngeal candidiasis such as acute pseudomembranous, acute atrophic, chronic atrophic, chronic hypertrophic/hyperplastic, and angular cheilitis.
Protection against C. albicans is determined not only by host immune resistance, but also by the ability to appropriately control Candida-induced immunopathology. Although commensals such as C. albicans contribute to modulation and exacerbation of other oral inflammatory conditions, the mechanisms by which dysbiosis occur during opportunistic infections are unclear. Besides the known role of adaptive Th17 cells in memory response to C. albicans17, their role in initiation and perpetuation of inflammation pathology during chronic infections remain unclear. Furthermore, oral inflammatory diseases such as Sjogren’s syndrome and periodontitis are associated with Th17 mediated pathology. Interestingly, these diseases are also strongly associated with frequent OPC. However, the interactions among Th17 cells, oral immunopathology of OPC and other oral inflammatory diseases are unstudied.
Although mouse models of primary and secondary infection of oral candidiasis are available, a mouse model to study Candida infection associated Th17 inflammation, especially in the context of immunodeficiency is unavailable. This study presents a method for establishing oral Th17 inflammation associated with oral Candida infection in mice. Candida infection in mice is characterized by fungal lesions, inflammation in the tongue, decreased food intake, weight loss and eventually a moribund state. Oral pathology resembles chronic candidal infection lesions, as well as epithelial dysplasia in mouse oral cancer models12,18.
Protokoll
HINWEIS: Die Experimente mit Mäusen wurden in Übereinstimmung mit der institutionellen Tierschutzausschusses (IACUC) Richtlinien durchgeführt.
1. Reconstituting der Rag-1 - / - Mäuse, die mit I n vitro kultiviert Th17-Zellen (drei Tage vor der Infektion)
- Zum Herstellen Th17 Zellen, der Kultur CD4 + CD25- CD44low CD62Lhigh naiven T-Zellen (3 x 104) in U-Boden-Platten mit 96 Vertiefungen allein oder Cokultur sie zusammen mit 3 x 104 CD4 + CD25 + Foxp3 + Treg in Gegenwart löslicher α-CD3 (1 & mgr; g / ml), α-CD28 (2 ug / ml) Antikörper und Antigen-präsentierenden Zellen unter Bedingungen, Th17 (polarisiert mit IL-6 (25 ng / ml), TGF-β (2 ng / ml) , α-IFN-γ (2 ug / ml) und α-IL-4 (2 & mgr; g / ml)) für drei bis vier Tage.
HINWEIS: Naive Zellen und T regs wurden mittels Fluoreszenz-aktivierter Zellsortierung sortiert (FACS) eind magnetische Zellisolierungsverfahren und kultiviert wie zuvor 19 bis 22 beschrieben. - Am Tag 4 nach Resuspendieren der Th17-Zellen mit der Pipette, sammeln sie aus Kulturen und zentrifugieren unter sterilen Bedingungen.
- Nehmen Sie eine kleine Teilmenge dieser Zellen, um ihre Lebensfähigkeit und zur Phänotypisierung zu untersuchen. Resuspendieren sie in 500 ul RPMI-Medium, fügen Propidiumiodid (200 ng / ml) und eine Bewertung ihrer Rentabilität sofort mittels Durchflusszytometrie. Führen Phänotypisierung mittels Durchflusszytometrie Beurteilung der IL-17A Produktion nach Restimulation (siehe Abschnitt 6.3).
- Zentrifuge und wäscht die Hauptmasse der Zellen in sterilem PBS bei 480 × g für 6 Minuten bei 4 ° C in allen Stufen, wenn nicht anders angegeben.
- Verwenden Sie diese Zellen für die adoptive Transfer in 6-8 Wochen alte CD45.2 Rag1 - / - immundefizienten Mäusen.
- Resuspendieren der Zellen in 1 x 10 7 Zellen / ml Zelldichte mit kaltem sterilem PBS.
- Injizieren 100 ul der Zellen durch intraperitoneal Injektion, unter Verwendung von 25 G Nadeln auf 1 ml Tuberkulin-Spritze, derart, dass eine Maus erhält 1 x 10 6 Zellen. Einige Mäuse PBS oder Th17 Zellen nur zu empfangen, und andere Mäuse Th17 Zellen, co-kultiviert mit Treg-Zellen wurden erhalten.
HINWEIS: Führen Sie alle Schritte unter aseptischen Bedingungen.
2. Wachsende C. albicans für eine Infektion (einen Tag vor der Infektion)
- Vor der Inokulation zerstreuen fünf Kolonien der CAF2-1 C. albicans Laborstamm in 100 ul sterilem PBS-Suspension, und fügen Sie die Suspension auf die sterile Brühe.
- Impfen 5 Kolonien der C albicans in 50 ml des Hefe-Stickstoff-Base (YNB ohne Aminosäuren) / Peptone / Dextrose-Broth-Medium und Inkubation in einem Schüttelinkubator bei 30 ° C für 15-18 h bei 130 Umdrehungen pro Minute.
- Überwachen Sie die Brühe für Bewölkung, denn das ist ein Indiz für das Wachstum des Pilzes.
3. CandidaErnte und Counting-Verfahren (Am Tag der Infektion)
- Sammeln Sie 10 ml Candida Brühe in 15 ml Tuben. Für größere Volumina, sammeln Candida in 50 ml Tuben.
- Zentrifugieren Blastosporen bei 1900 × g für 5 min bei RT in allen Stufen, wenn nicht anders angegeben. Pellet die Blastosporen durch Zentrifugation, gefolgt von der Entfernung des Überstandes.
- Wenn es mehr als ein Rohr Vereinige die Candida Blastosporen aus mehreren Rohren, Zugabe von sterilem PBS auf die Pellets und Resuspendieren sie in 10 ml PBS für die Zählung.
- Nehmen Sie 20 ul Blastosporen in 1,5 ml Mikrozentrifugenröhrchen, fügen Sie 20 ul der 2X Para und Inkubation bei Raumtemperatur für 15-20 min. Zählen Sie die Fest Blastosporen mit dem Hämozytometer unter dem Mikroskop.
HINWEIS: Paraformaldehyd ist krebserregend. Öffnen Sie die unverdünnte Lösung nur im Abzug durchführen. - In der Zwischenzeit wiederholt wenigstens zweimal Waschen der Blastosporen durch Zentrifugieren them in PBS, und Pelletieren der Blastosporen. Halten Sie die Pellets in 15-ml-Röhrchen bei Raumtemperatur, in der ABSL1 Haube, bereit für die Infektion.
- Lassen Sie etwas sterilem PBS bei RT Resuspendieren der Blastosporen für eine Infektion.
- Nach dem Zählen hinzufügen sterilem PBS in die Blastospore Pellet um die Zellzahlen Hefe Blastospore bis 2 x10 8 von Hefezellen / ml einzustellen. Dies ist der Blastosporen Suspension, verwendet, um die Mäuse zu infizieren wird.
HINWEIS: Führen Sie alle Schritte unter aseptischen Bedingungen.
4. Mäuse Infektion (3-5 Tage nach der Zellübertragung)
HINWEIS: Die Grund Infektion Verfahren durchgeführt wird, wie oben beschrieben, 19,23-25.
- Wiegen Sie die Rag-1 - / - Mäuse, die PBS oder die Zellen drei Tage zuvor erhalten.
- Berechnen Sie die Dosis des Narkosemitteln mit ihrem Körpergewicht. Anesthetize der Mäuse durch die Verabreichung von Ketamin / Xylazin-Mischung (16,1 mg / ml und 1,6 mg / ml), unter Verwendung von 25 G Nadeln auf 1 ml Tuberkulin-Spritze durch intraperitoneal Injektion.
- Gabe von 50 & mgr; l pro 10 g Körpergewicht. (Das heißt, 0,8 mg Ketamin und 0,08 mg Xylazin / 10 g Körpergewicht oder 80 mg Ketamin und 8 mg Xylazin pro kg Körpergewicht beziehungsweise). Beachten Sie für toe Prise Reaktion alle 15 min nach der Narkose.
HINWEIS: Diese Dosis wird 60-90 min der Anästhesie, die genug für die Infektion Verfahren einzuleiten. - Übernehmen Sie die Augen Schmiermittel Salbe in den Augen der Mäuse, die Hornhaut vor dem Austrocknen zu verhindern. Da das Auge Schmiermittel kann austrocknen, wiederholen Augen Schmierung alle 45 min.
- Gabe von 50 & mgr; l pro 10 g Körpergewicht. (Das heißt, 0,8 mg Ketamin und 0,08 mg Xylazin / 10 g Körpergewicht oder 80 mg Ketamin und 8 mg Xylazin pro kg Körpergewicht beziehungsweise). Beachten Sie für toe Prise Reaktion alle 15 min nach der Narkose.
- Injizieren 1 ml Salzlösung (0,9% NaCl) subkutan am Rücken benachbart dem Vorderbein zu Rehydration der Mäuse während der Anästhesie zu helfen.
- Besorgen Sie sich einen neuen, sauberen Käfig. Folgen Sie der Infektion Verfahren eine Maus zu einem Zeitpunkt, indem jede Maus in den neuen Käfig einmal infiziert. Führen Sie die PBS / Schein-Infektion zuerst, und dann auf die Candida-Infektion gro gehenups.
- Nehmen Sie den narkotisierten Maus und öffnen Sie den Mund weit auf, um die Basis der Zunge zeigen.
- Legen Sie eine 3 mm Durchmesser Wattebausch mit 50 ul PBS oder Blastospore Aussetzung gesättigten, sublingual in der Mundhöhle für 90 min. Drehen Sie die Mäuse alle 15 min vor und zurück zu Staulunge zu vermeiden, sicherstellen, dass die Watte nicht zu bewegen.
- Einrichten eines Zeitgebers für jede Maus 90 Minuten von Sham oder Candida Inokulation in der Mundhöhle zu gewährleisten.
- Halten Sie sie in einem Käfig unter der Wärmelampe (4 Meter), und jede Maus auf Hitze Gel-Pads.
- Stellen Sie sicher, dass die Zunge in und von den Zähnen zurückgezogen, um die Zähne zerreißt die Zunge zu vermeiden.
- Am Ende der 90 Minuten, entfernen Sie den Wattebausch aus dem Mund der Maus. Sehen Sie für jede Maus, die aus der Narkose erholen kann früher als 75 Minuten. In einem solchen Fall zu betäuben sie wieder mit Ketamin (40 mg / kg) allein.
5. Beitrag procedure Monitoring (während der 90 Minuten Anästhesie)
- Verwenden Sie Hitze Gel-Pads während der 90 Minuten Narkose.
- Um die Körpertemperatur zu halten und zum Ersticken zu vermeiden, darf nicht zulassen, dass Mäuse, um auf den regulären Maiskolben Maus Betten erholen.
- Nach der Erholung von der Anästhesie verabreichen zusätzliche 1 ml steriler 0,9% NaCl subkutan an zwei Stellen auf der Rückseite.
- Bleiben Sie auf dem fünf PBS (Schein) geimpft Mäusen pro Käfig. Haus nur 1-2 infizierten Mäusen pro Käfig.
- Füllen Sie das Verfahren Karte mit Initialen jeden Tag nach dem Eingriff zu notieren, die Veränderungen im Körpergewicht, Körperpflege Gewohnheiten und die allgemeine Gesundheit.
6. Die Beurteilung der Entzündung
6.1) Gewichtsverlust
- Wiegen Sie die Mäuse jeden Tag während der Infektion, beginnend am Tag vor der Infektion Verfahren.
HINWEIS: In der Regel werden die immundefizienten Mäuse mit Th17 Zellen und ohne T regs injiziert erliegen 20-30% Gewichtsverlust aufgrund erhöhter Pilzbelastung 19 und verschlimmert die Entzündung.
6.2) Histologie Scoring der Zunge
- Opfern die Mäuse durch CO 2 Ersticken durch Genickbruch folgte.
- Die Backen öffnen und sezieren die Zunge mit einer Schere und Pinzette. Verwenden stumpfen Pinzette, um den Mund zu halten und mit der Schere erreichen, um den hinteren Teil des Mundes, um das hintere Ende der Zunge einzuschneiden.
- Für immunzytochemische Hämatoxylin und Eosin (H & E) Färbung der Zunge Gewebe, spülen Sie die Zunge Gewebe mit eiskaltem PBS. 5 ml 10% Formalin für 2-3 Zungen und befestigen Sie O / N in 15 ml Tuben.
- Am nächsten Tag, entfernen Sie das Formalin und tauchen das Gewebe in 5 ml 70% Ethanol, um hyper-Fixierung zu verhindern. Senden Sie sie aus, um kommerziellen Dienst und Paraffineinbettung weiter, Schneiden und Färben von Paraffinschnitten.
HINWEIS: Kommerzielle Histologie Service wird verwendet, um diese Schritte durchführen.
- Am nächsten Tag, entfernen Sie das Formalin und tauchen das Gewebe in 5 ml 70% Ethanol, um hyper-Fixierung zu verhindern. Senden Sie sie aus, um kommerziellen Dienst und Paraffineinbettung weiter, Schneiden und Färben von Paraffinschnitten.
- Sobald die Dias aus dem Handels Histologie Service zurück, Grad der Entzündung durch die Beobachtung der Gewebeschnitte unter einem Lichtmikroskop.
- Score von 0 bis 5, wobei 0 keine Entzündung und 5 die schwerste Entzündungen. Ergebnis der Entzündung mit Tabelle 1.
6.3) Zytokin-Produktion von Th17-Zellen
HINWEIS: Übermäßiger TNF-α Produktion ist eine der Ablesungen für eine übermäßige Immunpathologie. Wenn Mäuse adoptiv mit Th17 Zellen nur übertragen, verursacht es Immunpathologie, die mit übermäßiger TNF-α-Produktion in Th17-Zellen assoziiert ist.
- Sammeln Sie eine Einzelzellsuspension aus Milz, Lymphknoten, axillären Lymphknoten, und der Zunge, mit zuvor beschriebenen Verfahren 19,26.
- Restimulieren der Zellen mit Phorbolmyristatacetat (PMA) (50 ng / ml) und Ionomycin (500 ng / ml) für 4 h mit Brefeldin A (10 ug / ml) in der l hinzugefügtast 2 Std. Waschen Sie die Zellen mit PBS und fixieren Sie diese mit einem handelsüblichen Fixierung / Permeabilisierung Kit gemäß Herstellerangaben.
- Führen intrazelluläre Cytokin Färbung mit dem Fluorochrom konjugierten anti-TNF-α, Anti-IL-17A und ROR & ggr; t-Antikörper wie zuvor beschrieben 19.
- Kurz gesagt, die Zellen werden in dem 1X Permeabilisierung Puffer mit dem Cocktail von Anti-TNF-α, Anti-IL-17A und ROR & ggr; t-Antikörper, jedes Antikörpers mit einem 2 - 3 ug / ml Endkonzentration.
- Inkubieren der Zellen für 1 h bei RT.
- Nach der Inkubation, waschen Sie die Zellen mit 1X Permeabilisierung Puffer.
- Zellpellet in 500 ul PBS mit 0,5% Rinderserumalbumin für die Durchflußzytometrie-Analyse.
Ergebnisse
In diesem Modell werden sowohl die Candida infizierten Mäusen und nicht-infizierte Mäuse in Rag-1 - / - immundefizienten Hintergrund wurden adoptiv mit Th17 Zellen 3-5 Tage vor der Infektion übertragen. Insgesamt 10-12 Mäuse wurden für die Experimente verwendet, mit 2 Mäuse in jeder Sham infizierten Gruppen und 4-5 in jedem der Candida infizierten Gruppen. Naive Zellen wurden von kongenen Thy1.1 oder CD45.1 Mäusen stammten, damit injiziert Th17 Zellen wurden in vivo unter Verwendung von Thy1.1 oder CD45.1 Färbung bzw. (1A) verfolgt. Co-über T regs wurden CD45.2 Mäusen, um sie von CD45.1 Th17-Zellen zu unterscheiden. Für einige Experimente, CB-17 scid Thy1.2 Empfängermäusen, Th17 Donorzellen aus Thy1.1 Balb / C-Mäuse und T regs von kongenen Thy1.2 Mäusen erhalten wurden verwendet. Nur Candida infizierten Mäusen, nicht aber die nicht-infizierten Mäuse zeigten die Rekrutierung und den Ausbau des wiederhergestellten CD45.1 + Th17 Zellen im CLN, den Lymphknoten. Dieses Ergebnis zeigt, dass der Pilz Th17 spezifische Antwort ist in Zungen Lymphknoten (1A) initiiert. Die Ergebnisse stellen Daten von einer Maus in jeder Gruppe.
Nur in den Mäusen, die mit T regs co-transferiert wurden Foxp3 + CD45.1 negativen CD4 + -Zellen in der CLN erkannt. Dies zeigt, dass die injizierten T regs wurden auch an den Ort der Infektion (1B) rekrutiert. Die Ergebnisse stellen Daten von einer Maus in jeder Gruppe. Während infiziert Rag-1 - / - Gewicht und nach 4 Tagen der Infektion wieder zu verlieren, habe Cortison immunsupprimierten Mäusen nicht erholen, sondern weiter an Gewicht verloren, wie zuvor 27 gezeigt. Beide Gruppen von Mäusen, die Th17-Zellen in Gegenwart oder Abwesenheit von regulatorischen T empfangenen Gewicht verloren zunächst. Allerdings sind die Mäuse, die T regs von Gewichtsverlust wieder aufgenommen und beschlossen, die Infektion. 2 mEis wurden in der Sham-infizierten Gruppe 4 in jeder Candida infizierten Gruppe verwendet, und. Es wurden 3 Mäuse in Kortisongruppe. Die Mäuse, die Th17-Zellen erhielten nur, Gewicht verloren progressiv (Bild 2) 19. Einige der Mäuse in dieser Gruppe mußten eingeschläfert werden. Diese Ergebnisse zeigen den Durchschnitt der Gewichte aller Mäuse in dieser Gruppe. Obwohl Neutrophile sind für den anfänglichen Abstand der Infektion erforderlich, ihre ständige Präsenz und die Rekrutierung im Gewebe ist ein Zeichen der ungelösten Entzündung. Daher wurde Neutrophileninfiltration in der infizierten Zunge sucht durch Bestimmung der Expression eines neutrophilen Marker, Gr-1, zu späteren Zeitpunkten, wie Tag-7 nach der Infektion. Mäuse, Th17 Zellen erhielten nur, hatten höhere entzündlichen Infiltraten (3A), einschließlich Gr-1 + Neutrophilen auch Tag-4 nach der Infektion, verglichen mit den Mäusen, die mit regulatorischen T (3B) injiziert. Diese Ergebnisse zeigten, dass im Presence von T regs, gelöst Mäusen die Entzündung effizienter und erholte sich von der Infektion.
Am Tag 7 nach der Infektion wurden die Milz (SPLN) CLN und die Zunge Geweben isoliert, und Einzelzellsuspensionen wurden für die Durchflusszytometrie analysiert werden. CLN ergab bei Mäusen, die nur Th17-Zellen erhielten erhöhte CD45.1 Th17-Zellen (Abbildung 1) und erhöhte TNF-α-Produktion (4A, 4B). Andererseits reg T Empfänger hat eine herabgesetzte Frequenz Th17 Zellen und reduziert TNF-α-Produktion durch Th17 Zellen (1 & 4A, 4B). In diesen Experimenten werden die Daten von CLN einer einzelnen Maus und Zungengewebe geerntet und von 2 Mäusen gepoolt gezeigt. Obwohl zu frühen Zeitpunkten IL-17A Produktion war bei T reg Empfänger 19, zu späteren Zeitpunkten in den beiden Gruppen, die IL-17A-Produktion durch Th17 Zellen minimal war (Daten nicht gezeigt). Periodische Färbung Säure Schiff-der Zunge zeigte in Mäusen, die nur Th17 Zellen empfangen erhöht Pilzhyphen, während Mäuse, die regulatorischen T empfangen ebenfalls deaktiviert den Pilz an Tag-5 und Tag 7 nach der Infektion (Figur 5). Außerdem Histopathologie Bonitur der Zungenentzündung zeigten auch verringerter Entzündung Scores bei Mäusen, die regulatorischen T empfangen wird, im Vergleich zu Mäusen, die nur Th17 Zellen (6) übermittelt. Punktwertung der Entzündung auf die Zunge histopathologischen Befunden wie Vorhandensein von Papillen auf der Basis, die Unversehrtheit der oberflächlichen Epithelschicht, sichtbar Hefe oder Hyphen, dringen Hyphen Angabe nicht lösen Infektion, Verdickung der basalen Schicht (Hinweis auf laufende Gewebereparatur) und die Anwesenheit von infiltrierenden Immunzellen (Neutrophile und Th17 Zellen). Diese Ergebnisse zeigten, dass die Injektion von Th17-Zellen nicht direkt Infektion zu verringern, aber erhöht die Pilzbelastung und Immunpathologie von primären C verursacht albicans Infektion, während Co-Transfer von T regs verbessert Immunpathologie.
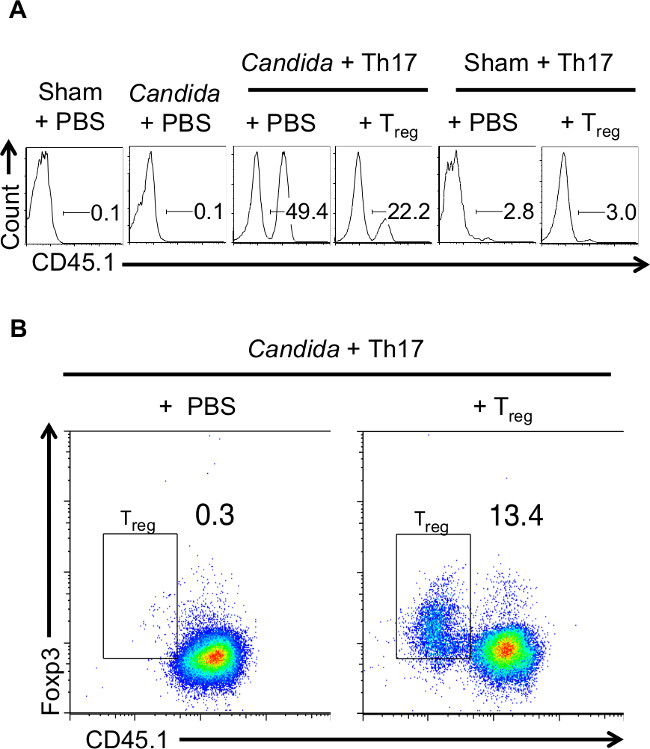
Abbildung 1: Eingespritzte Th17-Zellen und T-Zellen reg rekrutieren und zu erweitern in den Lymphknoten (CLN) des C. albicans infizierten Mäusen (A) Rag-1. -. / - CD45.2 Mäuse wurden mit Th17 Zellen oder Th17 rekonstituierte + T reg-Zellen, die unter Th17 Bedingungen 5 Tage lang polarisiert wurden. Th17 Zellen wurden aus CD45.1 kongenen Mäusen und T reg Zellen wurden aus CD45.2 Mäusen erhalten wird. Einige Mäuse wurden keine Zellen (Sham oder Candida + PBS) erhalten. Empfänger Mäuse in jeder Gruppe wurden mit Schein-Kontrollen oder mit C infiziert albicans. Am Tag 5 nach der Infektion wurden CLN ISOLATed, um eine Einzelzellsuspension zu machen und verfolgen die injiziert CD45.1 Ausdruck Th17-Zellen mittels Durchflusszytometrie (auf allen Leukozyten in FSC, SSC Streu gated) (B) Rag-1. - / - CD45.2 Mäuse wurden mit Th17-Zellen rekonstituiert oder Th17 + T reg Zellen, wie in "A" und C infiziert. albicans. CLN wurden isoliert, um eine Einzelzellsuspension zu machen und messen CD45.1 und intrazelluläre Foxp3-Expression mittels Durchflusszytometrie (auf allen CD4-Zellen gated). Die T reg Toren in den Kurven zeigen die CD45.1 negativ, Foxp3 + CD4 + Zellen. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 2. Eingespritzte Th17 Zellen verursachen Gewichtsverlust in C . Albicans infizierten Mäusen und gleichzeitige Verabreichung von T regs verbessert Erholung von Gewichtsverlust. SCID CB-17-Mäuse wurden mit Th17 Zellen oder Th17 + T reg-Zellen, wie in 1A wiederhergestellt. 3 Tage später wurden die Empfängermäuse mit C infiziert albicans. Einige Mäuse in jeder Gruppe wurden mit Schein-Kontrollen infiziert. Immunsupprimierten Mäusen erhielt Cortisonacetat (Cort) Injektion. Die prozentuale Gewichtsänderung bei Mäusen mit angegebenen Zellen rekonstituiert und mit C. albicans infiziert, bezogen auf d-1 (ein Tag vor der Infektion) gezeigt. Daten normiert in Bezug auf die Gewichtsdaten von nicht infizierten (Sham + PBS) Mäuse sind. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
"Src =" / files / ftp_upload / 52.538 / 52538fig3highres.jpg "/>
Abbildung 3. Eingespritzte Th17 Zellen verursachen Zunge Immunpathologie in C. Albicans infizierten Mäusen und gleichzeitige Verabreichung von T regs reduziert die Immunpathologie. Die histologische Auswertung der Zungen der C. albicans infizierten Mäusen. Mäuse wurden mit den angegebenen Zellen rekonstituiert und wie in 1A infiziert. Am Tag 5 nach der Infektion wurden die Zungen aus Mäusen isoliert. (A) Sagittalschnitte der Zungen wurden mit H & E gefärbt, um Entzündungen und Infiltration (IF) der Immunzellen zu bewerten. (Pa) und (Ep) bezeichnen Papillen und die Epithelschicht der Zunge auf. Mikroskopische Aufnahmen der Folien angesehen at50X Vergrößerung. (B) Die histologische Immunfärbung für Gr-1 Neutrophilen Marker mit Anti Gr-1-Antikörper (Clone: 1A8-Ly6g) in den Ansatzabschnitten am Tag 5 nach der Infektion (braun, mit IF gekennzeichnet). Mikroskopische Aufnahmen der Folien bei 100-facher Vergrößerung betrachtet werden angezeigt. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 4: Die gleichzeitige Verabreichung von T regs reduziert TNF α in Th17-Zellen injiziert. (A) Rag-1 - / - CD45.2 Mäuse wurden mit Th17 Zellen oder Th17 + T reg Zellen rekonstituiert und mit C infiziert albicans, wie in 1A. Am Tag 5 nach der Infektion, CLN und Zungengewebe wurden isoliert, um eine Einzelzellsuspension zu bilden. Diese Zellen wurden mit PMA und Ionomycin vor intrazellulären staini restimuliertng und Durchflusszytometrie analysiert. Durchflusszytometrische Konturdiagrammen von intrazellulärem ROR-Yt und TNF- α Expression der Th17 Zellen gezeigt (gated on CD4 + Zellen). (B) statistische Darstellung des Prozentsatzes an Zellen aus TNFαpositive Experimente wie in "A" durchgeführt. Die Daten repräsentieren 4 Mäuse in nicht infizierten Gruppe und 6 Mäuse in jeder infizierten Gruppe und sind aus zwei unabhängigen Experimenten gepoolt. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 5. Erhöhte Immunpathologie ist auch mit erhöhter Pilzbelastung in C verbunden. Albicans infizierten Mäusen. CB-17 SCID-Mikrofone wurden mit Balb / C-Th17-Zellen rekonstituiert oder Th17 + T reg Zellen, wie in Abbildung 1A, und wurden mit C infiziert albicans. Histologische Beurteilung der Zunge aus infizierten Mäusen gezeigt. Am Tag 7 nach der Infektion wurden die Zungen geerntet und gefärbt mit Perjodsäure Schiff'schen (PAS), Pilzläsionen, Entzündung und Infiltration (IF) von Zellen zu beurteilen und Pilz detektieren (Ca). Die Objektträger wurden at100X Vergrößerung betrachtet. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
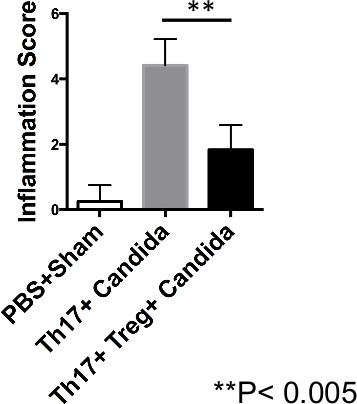
Abbildung 6. T regs verbessern Immunpathologie in C. Albicans infizierten Mäusen. CB-17 SCID-Mäuse wurden mit Balb / C Th17 Zellen wie in 1A rekonstituiert oder Th17 + T reg Zellen und wurden mit C infiziert albicans. Statistische Darstellung der mittleren histologischen Scores der Zungen aus infizierten Mäusen, wie in Abbildung 5 bewertet. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
| Ergebnis | Charakteristik |
| 0 | 0 - keine sichtbare Hefe oder Hyphen intakten Oberflächenepithel am dorsalen Oberfläche der Zunge, Papillen deutlich vorhanden und unbeschädigt sind (oder auch nicht infiltrierenden mononukleären Zellen innerhalb des Gewebes sein kann), keine Verdickung der basalen Schicht, keine Infiltration Immunzellen. |
| 1 | 1 - kein sichtbarer Hefe oder Hyphene, zerlumpt oder leicht beschädigte oberflächlichen Epithel, Papillen deutlich mit minimalen Schäden und selten infiltrieren Immunzellen vorhanden. |
| 2 | 2 - Papillen reduziert, aber mit Schäden, Verdickung der basalen Schicht und häufige infiltrieren Immunzellen vorhanden. |
| 3 | 3 - gelegentlich Cluster sichtbar Hefe und eindringenden Hyphen, Hinweise auf beschädigte Papillen, gelegentliche Läsionen von beschädigten Epithel, Verdickung der basalen Schicht und und kleine Gruppen von Immunzellen infiltriert. |
| 4 | 4 - häufig Cluster sichtbar Hefe und eindringenden Hyphen, Hinweise auf beschädigte Papillen, häufigen Verletzungen von beschädigten Epithel, minimale Infiltration von Immunzellen, Verdickung der basalen Schicht und häufige Cluster von Immunzellen infiltriert. |
| 5 | 5 - zahlreiche Hinweise von eindringenden Hyphen, stark beschädigt Epithel auf der dorsalen Oberfläche, große InfiltrationImmunzellen, wenige oder keine nachweisbare Papillen, Verdickung der basalen Schicht und sehr häufige und große Cluster von Immunzellen infiltriert. |
Tabelle 1: Die histologische Scoring Werte
Diskussion
Dieses Modell basiert auf Induktion von oraler C basiert albicans-Infektion abhängig Th17 Entzündung. Wegen der Abwesenheit von regulatorischen T ist die Th17 Zelle induzierte Entzündung ungebremst und führt zu schlecht aufgelöst Immunpathologie. In vitro abgeleitet naiven CD4-Zellen polarisiert Th17 Zellen wurden für die adoptive Übertragung verwendet. 40 bis 50% des gezüchteten CD4 + Zellen zeigen nachweisbare IL-17A-Expression um Tag 3 (Th17-Zellen), und wurden daher für die Injektion in Mäusen verwendet. Der große Vorteil des Modells ist, dass Th17 Zellen verursachen Infektion spezifische Immunpathologie, die effizient mit T reg Einspritzung verbessert werden kann. Somit kann das Modell verwendet werden, um die Immunmodulation Strategien mit T reg Injektion als positive Kontrolle getestet. Entzündung ist leicht auf der Basis der Gewichtsverlust, histopathologische Wertungs und proinflammatorischen Cytokin-Produktion durch die Th17 Zellen der infizierten Mäusen untersucht.
Nach ter adoptiven Transfer von Th17-Zellen, zu sekundären lymphatischen Organen und verschiedenen Geweben einschließlich der Zunge, der primären Infektionsherd wanderten sie. Nach der Infektion wurden die anderen entzündlichen Zellen auch an der Zunge angeworben, um die Infektion zu löschen. Doch ohne T reg vermittelten Immunmodulation, Th17 Zellen selbst nicht, die Infektion zu beheben, sondern verursacht erhöhte Immunpathologie. Co-Transfer von T regs die Entzündung vollständig gelöst. Interessanterweise Mäusen mit verschlimmert Entzündung in Abwesenheit von T regs, zeigte auch erhöhte Pilzbelastung. Unsere früheren Bericht zeigte, dass dies aufgrund der reduzierten IL-17A-Produktion in Mäusen, im Vergleich zu denen mit T regs. Unsere gegenwärtigen Experimente unterstützen die Idee, daß es auch aufgrund der erhöhten TNF-α, die die Entzündung verschlechtert, möglicherweise durch Erhöhung Epithelzelle Apoptose und verstärktem Pilzbelastung 28 sein. Unter Berücksichtigung der immunoprotektiven Wirkungen von IL-17A an der SchleimhautGlauben wir, dass entzündliche Pathologie, die wir beobachten mit wachsender Pilzbelastung nicht auf IL-17A von Th17-Zellen oder das Fehlen von Wirtsresistenz hergestellt. Es wird aufgrund der TNF-α und möglicherweise andere durch injizierte Th17 Zellen produzierten pro-inflammatorische Zytokine verursacht. - / - Mäusen frei von Th17-Zellen nur eine minimale Entzündung und nachfolgende Auflösung der Infektion und nur diejenigen, die erhalten Th17 Zellen erlag schweren Gewichtsverlust (Abbildung 1) zeigen, kann dies durch die Beobachtung, dass Rag validiert werden. Konsequente auf diese Daten hat es sich auch bereits gezeigt, dass die RAG - / - Mäusen deaktivieren Sie das primäre OPC Infektion ohne viel Immunpathologie 27. Unter diesen Bedingungen haben kompensatorische Mechanismen abhängig von IL-17A Herstellung angeborenen Immunzellen wurde gezeigt, dass die Infektion in Rag löschen - / - Mäusen 17,29,30. Zusammengenommen, auch IL-17A von Th17 Zellen und Neutrophilenrekrutierung produziert eine schützende Rolle bei Anfangsphasen der Infektion spielen, excbeeindruckendes Produktion von TNF-α und anderer Zytokine von Th17-Zellen und die fortgesetzte Anwesenheit von Neutrophilen Ursachen verstärkt Immunpathologie. Die Rollen der proinflammatorischen Zytokine außer TNF-α von Th17 Zellen gewonnen wurden, im Rahmen der Immunpathologie untersucht werden.
Die Hauptbeschränkung des Modells ist die Frage, ob es sich um physiologisch relevante Menschen OPC. Obwohl Th17 Zellen abgebildet pathologischen Mediatoren in verschiedenen Munderkrankungen, ob eine chronische Aktivierung von Th17 Zellen pathogen in OPC sein müssen noch untersucht werden. Mit den jüngsten Erkenntnisse impliziert die Rolle der C albicans bei Entzündungen und Krebs, ist Th17 Immunpathologie in der Mundhöhle ein aktives Forschungsgebiet 31. So kann das Modell, das hier beschrieben wird, verwendet werden, um genauer zu studieren spezifischen Rollen der Th17-Zellen und wie sie interagieren mit angeborenen Immunzellen, detaillierte Einblicke in die orale Immunkrankheiten und Mundhöhlenkrebs.
Der entscheidende Schritt in der Technik ist die entsprechende Einstellung und Erweiterung der adoptiv transferierte Th17-Zellen. Diese ist stark abhängig von der Funktionsfähigkeit und IL-17A Herstellung der in vitro polarisiert Th17 Zellen vor der Übertragung. Am besten ist es, um ihre Überlebensfähigkeit und Zytokin-Produktion mittels Durchflusszytometrie analysiert 19 zu testen. Ordnungsgemäße Durchführung des Th17 Zellinjektion und Mäuse Infektion zu Infektion abhängig Th17 Immunpathologie führen. Dieses Modell kann angewendet werden, um Strategien zu testen, um Th17 Immunpathologie und mündlichen Entzündung im Zusammenhang mit anderen Infektionen sowie zu vereiteln. Auch unter Verwendung dieses Modells, eines sekundären Reinfektionen ausführen kann und Studium der Rolle von Th17 Zellen Verschlimmerung Immunpathologie im Rahmen der chronischen Infektionen. Da dieses Modell beinhaltet immundefizienten Mäusen, kann es sein, sehr wichtig für die orale Dysbiose in AIDS und PID-Patienten, die aus wiederkehrenden chronischen Candida-Infektionen leiden zu sehen.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
We thank Dr. Helene Bernstein for providing us with access to her flow cytometer. We also thank CFAR flow cytometry facility for the flow cytometry services. This project was in part supported by CTSC core utilization funding and STERIS corporation/University Hospitals-Division of Infectious diseases grant to PP.
Materialien
| Name | Company | Catalog Number | Comments |
| CAF-2 | University of Pittsburgh (Sarah Gaffen) | - | Candida culture |
| U-bottom 96 well plates | Fisher | 055588 | Used for cell culture |
| a-CD3 | eBiosciences | 16-0031-85 | Polarization of cells to Th17 conditions |
| a-CD28 | eBiosciences | 16-0281-85 | Polarization of cells to Th17 conditions |
| m-IL-6 | Bio Basic | RC232 | Polarization of cells to Th17 conditions |
| h-TGF-b | R&D | 240-B | Polarization of cells to Th17 conditions |
| a-IFN-g | eBiosciences | 16-7311-85 | Polarization of cells to Th17 conditions |
| a-IL-4 | eBiosciences | 16-7041-85 | Polarization of cells to Th17 conditions |
| α-IL17A ef660 | eBiosciences | 50-7177-82 | Used for cell culture - 1:50 |
| α-TNFa-PE-Cy7 | eBiosciences | 25-7423-41 | Used for cell culture - 1:100 |
| α-RORgt PE | eBiosciences | 12-6981-82 | Used for cell culture - 1:50 |
| YNB w/o amino acids)/Peptone/Dextrose broth medium | Bio Basic | S507.SIZE | Mediium for candida growth |
| Shaker incubator | New Brunswick Scientific | Innova 4300 | Incubation growth for candida |
| 15 ml tubes | Bio Basic | BT888-SY | Used for cell culture and candida growth |
| 50 ml tubes | Bio Basic | CT 788-YS | Used for cell culture and candida growth |
| Table top Centrifuge | VWR International LLC | 82017-654 | For pelleting candida -900 g |
| Allegra Centrifuge | Beckman Coulter | 392302 | Cell culture - 480 g |
| 1.5 ml eppendorf tubes | Bio Basic | BT620-NS | Preparing final concentration of candida |
| 2x paraformaldehyde | Electron Microscopy Sciences | 15710 | Fixing candida for count |
| Hemocytometer | VWR International LLC | 15170-172 | Counting cells |
| PBS - Phosphate Buffered Saline | Bio Basic | PD8117 | Preparation of buffers |
| Ketamine/xylazine | Case Western Reserve University - Animal Resource Center | - | Obtained from ARC approved protocol for anesthesia |
| Ophthalmic lubricant ointment | Allergan | - | Eye ointment for animals to prevent dryness |
| Saline (0.9% NaCl) | G Biosciences | 786-561 | Administerd to animals to prevent dehydration |
| 3-mm-diameter cotton wool ball | VWR International LLC | BP7603 | 3 mm balls for candida infection |
| Heat gel pads | Case Western Reserve University - Animal Resource Center | - | for maintaining the body temperaturre and fast recovery |
| Hematoxylin and Eosin staining | Histoserv - MD | - | Tissue histology |
| 10% formalin | Electron Microscopy Sciences | JC1111/MC | Tissue histology |
| 70% ethanol | VWR International LLC | 97064-490 | Sterilization purpose |
| PMA - Phorbol 12-myristate 13-acetate | Sigma-Aldrich | P1585-1MG | Restimulation of cells |
| Ionomycin | Life Technologies | 124222 1mg | Restimulation of cells |
| Fixation permeabilization kit | eBiosciences | E16913-106 | Fixing cells for Flow cytometry |
| Tuberculin syringes | BD Biosciences | 309659 | Mice injection |
| 25 G x 3/8 needles | BD Biosciences | 309626 | Mice injection |
| Rag1 -/- mice | Jackson laboratories | Stock no: 002216 | Recipient mice |
| CD45.1 congenic mice | Jackson laboratories | Stock no:002014 | Donor Th17 cells |
| CB17-SCID mice | Jackson laboratories | Stock no: 001303 | Recipient mice |
| Balb/c mice | Jackson laboratories | Stock no: 000651 | Donor Th17 cells |
Referenzen
- Allam, J. P., et al. IL-23-producing CD68(+) macrophage-like cells predominate within an IL-17-polarized infiltrate in chronic periodontitis lesions. Journal of Clinical Periodontology. 38 (10), 879-886 (2011).
- Loesche, W. J. Periodontal disease: link to cardiovascular disease. Compendium Of Continuing Education In Dentistry. 21 (6), 463-466 (2000).
- Sfyroeras, G. S., Roussas, N., Saleptsis, V. G., Argyriou, C., Giannoukas, A. D. Association between periodontal disease and stroke. Journal Of Vascular Surgery. 55 (4), 1178-1184 (2012).
- Huppler, A. R., Bishu, S., Gaffen, S. L. Mucocutaneous candidiasis: the IL-17 pathway and implications for targeted immunotherapy. Arthritis Research & Therapy. 14 (4), 217 (2012).
- Sitheeque, M. A., Samaranayake, L. P. Chronic hyperplastic candidosis/candidiasis (candidal leukoplakia). Critical Reviews In. Oral Biology And Medicine : An Official Publication Of The American Association Of Oral Biologists. 14 (4), 253-267 (2003).
- Canabarro, A., et al. Association of subgingival colonization of Candida albicans and other yeasts with severity of chronic periodontitis. Journal Of Periodontal Research. 48 (4), 428-432 (2013).
- Urzua, B., et al. Yeast diversity in the oral microbiota of subjects with periodontitis: Candida albicans and Candida dubliniensis colonize the periodontal pockets. Medical Mycology. 46 (8), 783-793 (2008).
- Ergun, S., et al. Oral status and Candida colonization in patients with Sjogren's Syndrome. Medicina Oral, Patologia Oral Y Cirugia Bucal. 15 (2), e310-e315 (2010).
- Hernandez, Y. L., Daniels, T. E. Oral candidiasis in Sjogren's syndrome: prevalence, clinical correlations, and treatment. Oral Surgery, Oral Medicine, And Oral Pathology. 68 (3), 324-329 (1989).
- Gall, F., et al. Candida spp. in oral cancer and oral precancerous lesions. The New Microbiologica. 36 (3), 283-288 (2013).
- Grady, J. F., Reade, P. C. Candida albicans as a promoter of oral mucosal neoplasia. Carcinogenesis. 13 (5), 783-786 (1992).
- Dwivedi, P. P., Mallya, S., Dongari-Bagtzoglou, A. A novel immunocompetent murine model for Candida albicans-promoted oral epithelial dysplasia. Medical Mycology. 47 (2), 157-167 (2009).
- Cheng, S. C., Joosten, L. A., Kullberg, B. J., Netea, M. G. Interplay between Candida albicans and the mammalian innate host defense. Infection and Immunity. 80 (4), 1304-1313 (2012).
- Marodi, L., Johnston, R. B. Invasive Candida species disease in infants and children: occurrence, risk factors, management, and innate host defense mechanisms. Current Opinion In Pediatrics. 19 (6), 693-697 (2007).
- Kumamoto, C. A. Inflammation and gastrointestinal Candida colonization. Current Opinion In. Microbiology. 14 (4), 386-391 (2011).
- Kraneveld, E. A., et al. The relation between oral Candida load and bacterial microbiome profiles in Dutch older adults. PloS One. 7 (8), e42770 (2012).
- Hernandez-Santos, N., et al. Th17 cells confer long-term adaptive immunity to oral mucosal Candida albicans infections. Mucosal Immunology. 6 (5), 900-910 (2013).
- Hasina, R., et al. ABT-510 is an effective chemopreventive agent in the mouse 4-nitroquinoline 1-oxide model of oral carcinogenesis. Cancer Prevention Research. 2 (4), 385-393 (2009).
- Pandiyan, P., et al. CD4(+)CD25(+)Foxp3(+) regulatory T cells promote Th17 cells in vitro and enhance host resistance in mouse Candida albicans Th17 cell infection model. Immunity. 34 (3), 422-434 (2011).
- Pandiyan, P., et al. The role of IL-15 in activating STAT5 and fine-tuning IL-17A production in CD4 T lymphocytes. J Immunol. 189 (9), 4237-4246 (2012).
- Pandiyan, P., Lenardo, M. J. The control of CD4+CD25+Foxp3+ regulatory T cell survival. Biology Direct. 3 (6), (2008).
- Pandiyan, P., Zheng, L., Ishihara, S., Reed, J., Lenardo, M. J. CD4(+)CD25(+)Foxp3(+) regulatory T cells induce cytokine deprivation-mediated apoptosis of effector CD4(+) T cells. Nat Immunol. 8 (12), 1353-1362 (2007).
- Conti, H. R., Huppler, A. R., Whibley, N., Gaffen, S. L., Coligan, J. E. Animal models for candidiasis. Current Protocols In Immunology. 105, 11-19 (2014).
- Conti, H. R., et al. Th17 cells and IL-17 receptor signaling are essential for mucosal host defense against oral candidiasis. J Exp Med. 206 (2), 299-311 (2009).
- Kamai, Y., et al. New model of oropharyngeal candidiasis in mice. Antimicrobial Agents And Chemotherapy. 45 (11), 3195-3197 (2001).
- Pandiyan, P., Bhaskaran, N., Zhang, Y., Weinberg, A. Isolation of T cells from mouse oral tissues. Biological Procedures Online. 16 (1), 4 (2014).
- Gladiator, A., Wangler, N., Trautwein-Weidner, K., LeibundGut-Landmann, S. Cutting edge: IL-17-secreting innate lymphoid cells are essential for host defense against fungal infection. J Immunol. 190 (2), 521-525 (2013).
- Leppkes, M., Roulis, M., Neurath, M. F., Kollias, G., Becker, C. Pleiotropic functions of TNF-alpha in the regulation of the intestinal epithelial response to inflammation. International Immunology. 26 (9), 509-515 (2014).
- Bishu, S., et al. The adaptor CARD9 is required for adaptive but not innate immunity to oral mucosal Candida albicans infections. Infection and Immunity. 82 (3), 1173-1180 (2014).
- Quintin, J., et al. Differential role of NK cells against Candida albicans infection in immunocompetent or immunocompromised mice. Eur J Immunol. 44 (8), 2405-2414 (2014).
- Ramirez-Garcia, A., et al. Candida albicans and cancer: Can this yeast induce cancer development or progression. Critical Reviews In Microbiology. , 1-13 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten