Method Article
Th17 Infiammazione Modello di orofaringea candidosi in topi immunodeficienti
In questo articolo
Riepilogo
Although Candida infection models are available to study host immune resistance, a model to study T cell mediated immunopathology in the context of Candida infection is absent. Here we describe a method to establish Th17 immunopathology associated with oral Candida infection in immunodeficient mice.
Abstract
Oropharyngeal Candidiasis (OPC) disease is caused not only due to the lack of host immune resistance, but also the absence of appropriate regulation of infection-induced immunopathology. Although Th17 cells are implicated in antifungal defense, their role in immunopathology is unclear. This study presents a method for establishing oral Th17 immunopathology associated with oral candidal infection in immunodeficient mice. The method is based on reconstituting lymphopenic mice with in vitro cultured Th17 cells, followed by oral infection with Candida albicans (C. albicans). Results show that unrestrained Th17 cells result in inflammation and pathology, and is associated with several measurable read-outs including weight loss, pro-inflammatory cytokine production, tongue histopathology and mortality, showing that this model may be valuable in studying OPC immunopathology. Adoptive transfer of regulatory cells (Tregs) controls and reduces the inflammatory response, showing that this model can be used to test new strategies to counteract oral inflammation. This model may also be applicable in studying oral Th17 immunopathology in general in the context of other oral diseases.
Introduzione
Oral infections and inflammation have been related to cancer and cardiovascular diseases, and have dramatic impact on overall human health2,3. Opportunistic infections and inflammation caused by C. albicans are associated with primary immunodeficiencies (PID)4,5, inflammatory disorders such as periodontitis 6,7, Sjogren’s syndrome, and salivary gland disease8,9, as well as oral squamous cell carcinoma 10-12. C. albicans is a dimorphic commensal fungus that colonizes the mouths of 60% of healthy humans asymptomatically, yet it is the most common fungal pathogen causing infections when the host defense is weakened13-15. It causes recurring and chronic infections and inflammation in patients with AIDS and PID, and also in other immunocompromised individuals. As a commensal, its colonization load is associated with the change in the diversity of the overall oral microbiome16. As a pathogen it causes several forms of oropharyngeal candidiasis such as acute pseudomembranous, acute atrophic, chronic atrophic, chronic hypertrophic/hyperplastic, and angular cheilitis.
Protection against C. albicans is determined not only by host immune resistance, but also by the ability to appropriately control Candida-induced immunopathology. Although commensals such as C. albicans contribute to modulation and exacerbation of other oral inflammatory conditions, the mechanisms by which dysbiosis occur during opportunistic infections are unclear. Besides the known role of adaptive Th17 cells in memory response to C. albicans17, their role in initiation and perpetuation of inflammation pathology during chronic infections remain unclear. Furthermore, oral inflammatory diseases such as Sjogren’s syndrome and periodontitis are associated with Th17 mediated pathology. Interestingly, these diseases are also strongly associated with frequent OPC. However, the interactions among Th17 cells, oral immunopathology of OPC and other oral inflammatory diseases are unstudied.
Although mouse models of primary and secondary infection of oral candidiasis are available, a mouse model to study Candida infection associated Th17 inflammation, especially in the context of immunodeficiency is unavailable. This study presents a method for establishing oral Th17 inflammation associated with oral Candida infection in mice. Candida infection in mice is characterized by fungal lesions, inflammation in the tongue, decreased food intake, weight loss and eventually a moribund state. Oral pathology resembles chronic candidal infection lesions, as well as epithelial dysplasia in mouse oral cancer models12,18.
Protocollo
NOTA: Gli esperimenti con i topi sono stati eseguiti in conformità al comitato benessere degli animali istituzionale (IACUC) le linee guida.
1. Ricostituzione della Rag-1 - / - I topi con cellule I n Vitro Colta Th17 (Tre giorni prima di infezione)
- Per stabilire le cellule Th17, cultura CD4 + CD44low CD62Lhigh CD25- cellule T naive (3 x 104) in U-bottom 96 pozzetti da soli, o co-coltura con 3 x 104 CD4 + CD25 + Foxp3 + Tregs in presenza di solubile α-CD3 (1 mg / ml), α-CD28 (2 mg / ml) anticorpi e cellule presentanti l'antigene, in condizioni Th17 (polarizzati utilizzando IL-6 (25 ng / ml), β TGF- (2 ng / ml) , α-IFN-γ (2 mg / ml) e α -IL-4 (2 mg / ml)) per tre o quattro giorni.
NOTA: le cellule T reg ingenuo e sono stati ordinati con la fluorescenza delle cellule attivate (FACS) unad procedure di isolamento delle cellule magnetiche e coltivate come descritto in precedenza 19-22. - Il giorno 4, dopo risospendere le cellule Th17 con la pipetta, raccogliendoli da culture, e li centrifugare in condizioni sterili.
- Prendete una piccola aliquota di queste cellule per esaminare la loro vitalità e per fenotipizzazione. Li Risospendere in 500 ml di RPMI media, aggiungere ioduro di propidio (200 ng / ml) e valutare immediatamente la loro redditività mediante citometria a flusso. Eseguire fenotipizzazione mediante citometria di flusso valutazione della produzione di IL-17A dopo restimolazione (vedere paragrafo 6.3).
- Centrifugare e lavare la parte più consistente delle cellule in PBS sterile a 480 xg per 6 minuti a 4 ° C in tutte le fasi se non diversamente specificato.
- Utilizzare queste cellule per il trasferimento adottivo in 6-8 settimane di età CD45.2 Rag1 - / - topi immunodeficienti.
- Risospendere le cellule a densità cellulare 1 x 10 7 cellule / ml usando freddo sterile PBS.
- Iniettare 100 ml di cellule di intrapiniezione eritoneal, con 25 aghi G su 1 ml siringhe tubercolina, tale che un mouse riceve 1 x 10 6 cellule. Alcuni topi riceveranno cellule Th17 o PBS solo, e altri topi riceveranno cellule Th17 che erano co-coltura con cellule Treg.
NOTA: Eseguire tutte le operazioni in modo asettico.
2. Crescere C. albicans per infezione (un giorno prima infezione)
- Prima di inoculazione, disperdere cinque colonie della CAF2-1 C. albicans ceppo di laboratorio in 100 ml di sospensione sterile PBS, e aggiungere la sospensione al brodo sterile.
- Seminare 5 colonie di C. albicans in 50 ml della base di azoto di lievito (YNB senza amminoacidi) / Peptone / Destrosio brodo e incubare in un incubatore shaker a 30 ° C per 15-18 ore a 130 rpm.
- Monitorare il brodo per nuvolosità, dato che è un'indicazione per la crescita del fungo.
3. CandidaRaccolta e procedura di conteggio (Nel giorno di infezione)
- Raccogliere 10 ml di brodo di Candida in provette da 15 ml. Per volumi maggiori, raccogliere Candida in 50 ml provette.
- Centrifugare le blastospores a 1900 xg per 5 minuti a temperatura ambiente in tutte le fasi, se non diversamente specificato. Agglomerare le blastospores mediante centrifugazione, seguita dalla rimozione del supernatante.
- Se vi è più di un tubo, in comune i blastospores Candida da più tubi, aggiungendo PBS sterile al pellet e risospendere in 10 ml di PBS per il conteggio.
- Prendere 20 ml di blastospores in provette da 1,5 ml microcentrifuga, aggiungere 20 ml di paraformaldeide 2X e incubare a temperatura ambiente per 15-20 minuti. Contare le blastospores fissi utilizzando il emocitometro sotto il microscopio.
NOTA: Paraformaldeide è cancerogeno. Aprire la soluzione diluita solo nella cappa. - Nel frattempo, ripetere lavare i blastospores almeno due volte, per centrifugazione them in PBS, e pellet le blastospores. Tenere il pellet in 15 ml provette a RT, nella cappa ABSL1, pronto per l'infezione.
- Lascia un po 'sterile PBS a temperatura ambiente per risospendere le blastospores di infezione.
- Dopo conteggio, aggiungere PBS sterile al pellet Blastospora per regolare il numero di cellule di lievito Blastospora a 2 x10 8 del lievito cellule / ml. Questa è la sospensione Blastospora che verrà utilizzato per infettare i topi.
NOTA: Eseguire tutte le operazioni in modo asettico.
4. Topi Infezione (3-5 giorni dopo il trasferimento Cell)
NOTA: La procedura di infezione di base viene eseguita come descritto in precedenza 19,23-25.
- Pesare il Rag-1 - / - topi che hanno ricevuto PBS o le cellule tre giorni prima.
- Calcolare la dose di agenti anestetici che utilizzano il loro peso corporeo. Anestetizzare topi somministrando ketamina / xilazina miscela (16,1 mg / ml e 1,6 mg / ml), con 25 aghi G su 1 ml siringhe tubercolina, da intriniezione aperitoneal.
- Somministrare 50 ml per 10 g di peso corporeo. (Cioè, 0,8 mg di ketamina e 0,08 mg di xilazina / 10 g di peso corporeo o 80 mg di ketamina e 8 mg di xilazina per kg di peso corporeo, rispettivamente). Osservare per la risposta pizzico punta ogni 15 minuti dopo l'anestesia.
NOTA: Questo dosaggio indurrà 60-90 min di anestesia, che è sufficiente per la procedura di infezione. - Applicare il lubrificante pomata oftalmica negli occhi dei topi per evitare le cornee si secchi. Come il lubrificante occhio potrebbe seccarsi, ripetere la lubrificazione oftalmica ogni 45 min.
- Somministrare 50 ml per 10 g di peso corporeo. (Cioè, 0,8 mg di ketamina e 0,08 mg di xilazina / 10 g di peso corporeo o 80 mg di ketamina e 8 mg di xilazina per kg di peso corporeo, rispettivamente). Osservare per la risposta pizzico punta ogni 15 minuti dopo l'anestesia.
- Iniettare 1 ml di soluzione fisiologica (NaCl 0,9%) per via sottocutanea sul dorso adiacente alla zampa anteriore, per aiutare reidratazione dei topi durante l'anestesia.
- Ottenere un nuovo, gabbia pulita. Seguire la procedura di infezione un mouse alla volta, posizionando ciascun topo nella nuova gabbia volta infettati. Eseguire il / infezione farsa PBS prima, e poi passare alle gro infezione da Candidaups.
- Prendete il mouse anestetizzato e aprire la bocca per rivelare la base della lingua.
- Inserire una sfera di diametro 3 millimetri di cotone saturato con 50 ml di PBS o Blastospora sospensione, sublinguale nella cavità orale per 90 min. Capovolgere il mouse ogni 15 minuti parte anteriore e posteriore per evitare congestione polmonare, assicurando che i batuffoli di cotone non si muovono.
- Impostare un timer per ogni topo per garantire 90 min di Sham o Candida inoculazione nella cavità orale.
- Tenerli in una gabbia sotto la lampada di calore (4 metri di distanza), e ogni mouse su cuscinetti di gel di calore.
- Assicurarsi che la lingua è ritirata all'interno e lontano dai denti, per evitare i denti lacerano lingua.
- Alla fine di 90 min, rimuovere il batuffolo di cotone dalla bocca del mouse. Guarda per qualsiasi mouse che può recuperare da anestesia prima di 75 minuti. In tal caso, le anestetizzare nuovo con ketamina (40 mg / kg) soltanto.
5. Posta immissioe Monitoraggio (durante la 90 min Anesthesia)
- Usare tamponi di gel di calore durante la 90 min anestesia.
- Per mantenere la temperatura corporea e per prevenire il soffocamento, non permettere topi per recuperare il normale assestamento del mouse corn-cob.
- Dopo il recupero dall'anestesia, amministrare un ulteriore 1 ml di sterile 0,9% NaCl per via sottocutanea in due posizioni sul retro.
- Tieniti cinque PBS (sham) topo inoculato per gabbia. Solo 1-2 Casa topi infettati per gabbia.
- Compilare la scheda di procedura con le iniziali ogni giorno dopo la procedura di annotare i cambiamenti nel peso corporeo, governare le abitudini e la salute generale.
6. Valutare l'infiammazione
6.1) La perdita di peso
- Pesare i topi ogni giorno durante l'infezione, a partire dal giorno precedente procedura di infezione.
NOTA: in genere, i topi immunodeficienti iniettati con le cellule Th17 e senza regs T soccombono 20-30% Di perdita di peso a causa di maggiore onere fungina 19 e aggravata infiammazione.
6.2) Istologia punteggio della lingua
- Sacrifica i topi da CO 2 asfissia seguita da dislocazione cervicale.
- Aprire le ganasce e sezionare fuori la lingua con le forbici e pinze. Utilizzare pinze smussato per tenere la lingua, e utilizzando le forbici protendono verso il retro della bocca di incidere all'estremità posteriore della lingua.
- Per ematossilina immunocitochimica e eosina (H & E) colorazione dei tessuti lingua, lavare i tessuti lingua con ghiaccio freddo PBS. Aggiungere 5 ml di formalina al 10% per 2-3 lingue e fissarli O / N in provette da 15 ml.
- Il giorno successivo, togliere formalina e immergere i tessuti in 5 ml di etanolo al 70% per evitare iper-fissazione. Send them out al servizio commerciale per continuare con paraffina, sezionamento e colorazione delle sezioni di paraffina.
NOTA: istologia servizio commerciale viene utilizzato per eseguire questa procedura.
- Il giorno successivo, togliere formalina e immergere i tessuti in 5 ml di etanolo al 70% per evitare iper-fissazione. Send them out al servizio commerciale per continuare con paraffina, sezionamento e colorazione delle sezioni di paraffina.
- Una volta che le diapositive sono tornati dal servizio istologia commerciale, di grado l'infiammazione osservando le sezioni di tessuto al microscopio ottico.
- Punteggio da 0 a 5, con 0 essendo senza infiammazione, e 5 è l'infiammazione più grave. Nota l'infiammazione utilizzando Tabella 1.
6.3) la produzione di citochine da parte delle cellule Th17
NOTA: L'eccessiva produzione di TNF-α è una delle letture per eccessiva immunopatologia. Quando i topi sono adoptively trasferiti con cellule Th17 solo, provoca immunopatologia associato eccessiva produzione di TNF-α nelle cellule Th17.
- Raccogliere una sospensione singola cellula da milza, linfonodi cervicali, linfonodi ascellari, e la lingua, usando i metodi descritti in precedenza 19,26.
- Restimolare le cellule con acetato di forbolo miristato (PMA) (50 ng / ml) e Ionomicina (500 ng / ml) per 4 ore con Brefeldina A (10 mg / ml) aggiunto nella last 2 hr. Lavare le cellule con PBS e fissare utilizzando un kit di fissaggio / permeabilizzazione commerciale secondo le istruzioni del produttore.
- Eseguire intra citochine cellulari colorazione utilizzando il fluorocromo coniugato anti-TNF-α, anti-IL-17A e anticorpi ROR-γt come descritto in precedenza 19.
- Brevemente, risospendere le cellule nel buffer permeabilizzazione 1X con il cocktail anti-TNF-α, anti-IL-17A e anticorpi ROR-γt, ciascun anticorpo a 2 - 3 g / ml concentrazione finale.
- Incubare le cellule per 1 ora a RT.
- Dopo l'incubazione, lavare le cellule con tampone permeabilizzazione 1X.
- Risospendere il pellet cellulare in 500 ml di PBS con 0.5% albumina sierica bovina per citometria a flusso.
Risultati
In questo modello, sia i topi -infected Candida e topi non infetti in Rag-1 - / - sfondo immunodeficienti sono state adoptively trasferiti con le cellule Th17 3-5 giorni prima l'infezione. Un totale di 10-12 topi sono stati utilizzati per gli esperimenti, con 2 topi in ciascun sham infettati gruppi, e 4-5 in ciascuno dei gruppi infetti Candida. Cellule naive sono stati ottenuti da congenici Thy1.1 o CD45.1 topi, in modo che le cellule Th17 iniettate sono stati monitorati in vivo utilizzando Thy1.1 o CD45.1 colorazione rispettivamente (Figura 1A). T regs co-trasferite sono state derivate da topi CD45.2 per distinguerle dalle cellule Th17 CD45.1. Per alcuni esperimenti, CB-17 Thy1.2 topi riceventi SCID, sono stati utilizzati cellule Th17 donatori ottenute da topi Thy1.1 Balb / C e T reg ottenute da topi Thy1.2 congenici. Solo Candida -infected topi, ma non i topi non infetti esposto il reclutamento e l'espansione di CD45.1 ricostituito + cellule Th17 nel CLN, i linfonodi drenanti. Questo risultato dimostra che il fungo Th17 risposta specifica viene iniziata in linguetta linfonodi drenanti (Figura 1A). I risultati rappresentano dati da un topo in ciascun gruppo.
Solo nei topi che sono co-trasferite con T reg, CD4 + negativo cellule Foxp3 + CD45.1 sono stati rilevati nel CLN. Ciò dimostra che i REGS T iniettate sono stati reclutati al sito di infezione (Figura 1B). I risultati rappresentano dati da un topo in ciascun gruppo. Mentre infettato Rag-1 - / - perdere peso e recuperato dopo 4 giorni di infezione, il cortisone topi immunodepressi non ha recuperato, ma ulteriormente perso peso, come indicato in precedenza 27. Entrambi i gruppi di topi che hanno ricevuto cellule Th17 in presenza o assenza di T reg perso peso inizialmente. Tuttavia, i topi che hanno ricevuto T reg recuperati dalla perdita di peso e risolto l'infezione. 2 mghiaccio sono stati utilizzati nel gruppo Sham infettato, e 4 in ciascun gruppo infetto Candida. C'erano 3 topi nel gruppo di cortisone. I topi che hanno ricevuto le cellule Th17 solo, perso peso progressivamente (Figura 2) 19. Alcuni dei topi in quel gruppo doveva essere eutanasia. Questi risultati mostrano la media dei pesi di tutti i topi nel gruppo. Sebbene neutrofili sono necessari per la liquidazione iniziale dell'infezione, la loro presenza continua e il reclutamento in tessuto è un segno di infiammazione irrisolto. Pertanto l'infiltrazione di neutrofili è stata esaminata in lingua infetto, determinando l'espressione di un marcatore neutrofili, Gr-1, a successivi momenti come giorno 7 dopo l'infezione. I topi che hanno ricevuto le cellule Th17 solo, aveva infiltrati infiammatori elevati (Figura 3A), compresi Gr-1 + neutrofili anche giorno-4 dopo l'infezione, rispetto ai topi iniettati con regs T (Figura 3B). Questi risultati hanno dimostrato che nel Presence di T REGS, topi risolto l'infiammazione in modo più efficiente e recuperato dall'infezione.
Il giorno 7 dopo l'infezione, milza (SPLN), CLN e la lingua dei tessuti sono stati isolati, e sospensioni di cellule singole sono state fatte per il flusso di analisi di citometria. CLN rivelato un aumento delle cellule Th17 CD45.1 (Figura 1) e accresciuta produzione di TNF-α (4A, 4B) nei topi che hanno ricevuto solo le cellule Th17. D'altro canto, T reg destinatari mostrava diminuita frequenza di cellule Th17 e ridotta produzione di TNF-α dalle cellule Th17 (Figura 1 e 4A, 4B). In questi esperimenti, sono riportati i dati di CLN di un singolo mouse, e tessuti lingua raccolte e raccolti da topi 2. Anche se a primi punti temporali produzione di IL-17A è stato superiore a T reg destinatari 19, in momenti successivi in entrambi i gruppi, la produzione di IL-17A da cellule Th17 era minima (dati non riportati). Periodic Acid Schiff colorazione didella lingua ha mostrato maggiore ife fungine nei topi che hanno ricevuto solo le cellule Th17, mentre i topi che hanno ricevuto T reg e cancellate il fungo in giorno 5 e il giorno 7 dopo l'infezione (Figura 5). Inoltre, istopatologia punteggio della lingua infiammazione ha anche mostrato punteggi di infiammazione ridotte nei topi che hanno ricevuto T reg, rispetto ai topi che hanno ricevuto solo le cellule Th17 (Figura 6). Segnare l'infiammazione si è basata sulla lingua parametri istopatologici quali, la presenza di papille, l'integrità dello strato superficiale epiteliale, lievito visibile o ife, invadendo ife che indica un'infezione non risolvere, ispessimento dello strato basale (indicativo di riparazione dei tessuti in corso), e la presenza di cellule immunitarie infiltranti (neutrofili e cellule Th17). Questi risultati hanno dimostrato che l'iniezione di cellule Th17 non ridurre direttamente l'infezione, ma aumentato il peso di funghi e immunopatologia causati da primario C. albicans 'infezionezione, mentre co-trasferimento di T reg migliorato immunopatologia.
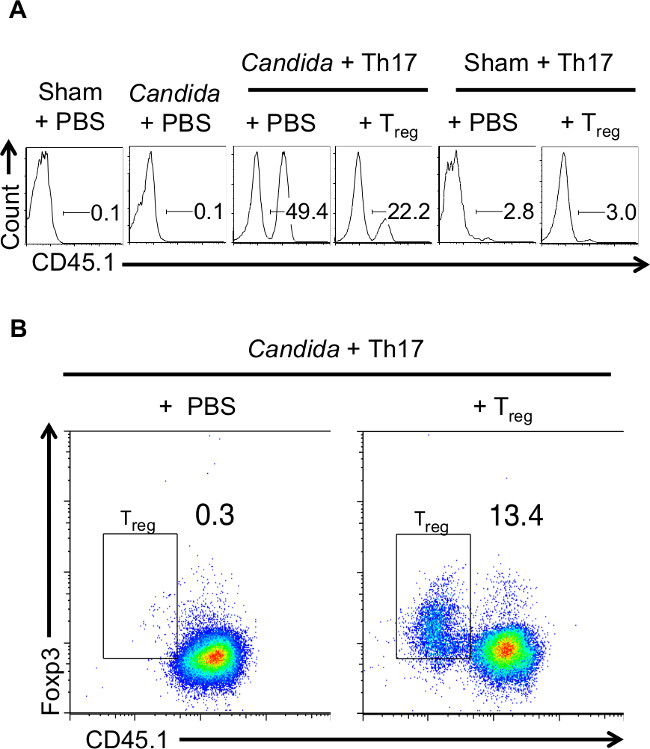
Figura 1. iniettato cellule Th17 e le cellule T reg reclutano e si espandono nei linfonodi drenanti (CLN) del C albicans topi infettati (A) Rag-1 -.. / - Mice CD45.2 sono stati ricostituiti con cellule Th17 o Th17 + T reg cellule che sono state polarizzate in condizioni Th17 per 5 giorni. Cellule Th17 sono state ottenute da topi congenici CD45.1 e le cellule T reg sono stati ottenuti da topi CD45.2. Alcuni topi non hanno ricevuto alcun cellule (Sham o Candida + PBS). Topi riceventi in ogni gruppo sono state infettate con i controlli simulati o con C. albicans. Il giorno 5 dopo l'infezione, CLN erano isolated a fare una sospensione di cellule singole e monitorare il CD45.1 iniettato esprimendo cellule Th17 di citometria a flusso (recintato su tutti i leucociti di FSC, scatter SSC) (B) Rag-1 -. / - CD45.2 topi sono stati ricostituiti con cellule Th17 o le cellule Th17 reg + T come in "A" e infettati con C. albicans. CLN sono stati isolati per fare una sospensione di cellule singole e misurare CD45.1 e intracellulare espressione Foxp3 mediante citometria di flusso (gated su tutte le cellule CD4). Le porte T reg nei grafici mostrano la CD45.1 negativo, Foxp3 + CD4 + cellule. Cliccate qui per vedere una versione più grande di questa figura.

Figura 2. iniettato cellule Th17 causano la perdita di peso in C . Albicans topi infettati e co-somministrazione di T reg migliora il recupero da perdita di peso. SCID CB-17 topi sono stati ricostituiti con cellule Th17 o cellule Th17 reg + T come in Figura 1A. 3 giorni dopo, i topi riceventi sono stati infettati con C. albicans. Alcuni mouse in ogni gruppo sono stati infettati con controlli farsa. Topi immunodepressi ricevuto cortisone acetato (Cort) iniezione. Il cambiamento di peso percentuale in topi ricostituiti con cellule indicate e infettate con C. albicans, rispetto a D-1 (un giorno prima infezione) è mostrato. I dati sono normalizzati rispetto ai dati di peso da non infetti (Sham + PBS) topi. Cliccate qui per vedere una versione più grande di questa figura.
"Src =" / files / ftp_upload / 52538 / 52538fig3highres.jpg "/>
Figura 3. iniettato cellule Th17 causano lingua immunopatologia in C. Albicans topi e co-somministrazione di T reg riduce la valutazione immunopatologia. Istologica delle lingue del C. infetti albicans infettato topi. I topi sono stati ricostituiti con cellule infettate e indicati come nella Figura 1A. Il giorno 5 dopo l'infezione, linguette sono stati isolati dai topi. (A) sezioni sagittali delle linguette sono state colorate con H & E per valutare l'infiammazione e infiltrazione (IF) delle cellule immunitarie. (Pa) e (Ep) denotano papille e lo strato epiteliale della lingua rispettivamente. Immagini microscopiche delle diapositive visualizzate at50X ingrandimento. (B) immunocolorazione istologico per Gr-1 marcatore neutrofili usando contro Gr-1 anticorpi (Clone: 1A8-Ly6g) nelle sezioni lingua il giorno 5 dopo l'infezione (marrone, indicato con IF). Immagini microscopiche delle diapositive viste in ingrandimento 100X sono mostrati. Cliccate qui per vedere una versione più grande di questa figura.

Figura 4. La co-somministrazione di T reg riduce α TNF in cellule Th17 iniettate. (A) Rag-1 - / - mice CD45.2 sono stati ricostituiti con cellule Th17 o cellule Th17 reg + T e infettate con C. albicans come in Figura 1A. Il giorno 5 dopo l'infezione, CLN e lingua tessuti sono stati isolati per effettuare una sospensione singola cella. Queste cellule sono state restimolati con PMA e Ionomicina prima staini intracellulareng e flusso analisi di citometria. Trame citometria a flusso contorno di intracellulare ROR-γt e TNF-α espressione delle cellule Th17 sono mostrati (gated su cellule CD4 +). (B) rappresentazione statistica della percentuale di cellule TNFαpositive da esperimenti eseguiti come in "A". I dati rappresentano 4 topi in gruppo non infetto, e 6 topi in ciascun gruppo infetto, e sono messi a disposizione dai due esperimenti indipendenti. Cliccate qui per vedere una versione più grande di questa figura.

Figura 5. Aumento immunopatologia è anche associata ad un aumento degli oneri fungina in C. Albicans topi infettati. CB-17 mic SCIDe sono stati ricostituiti con cellule Balb / C Th17, o le cellule Th17 reg + T come in Figure1A, e sono stati infettati con C. albicans. È indicata la valutazione istologica della lingua da topi infetti. Il giorno 7 dopo l'infezione, le lingue sono state raccolte e colorati con del periodico Acid Schiff (PAS) per valutare le lesioni fungine, l'infiammazione e l'infiltrazione (IF) di cellule, e di rilevare funghi (Ca). Le diapositive sono state visualizzate at100X ingrandimento. Cliccate qui per vedere una versione più grande di questa figura.
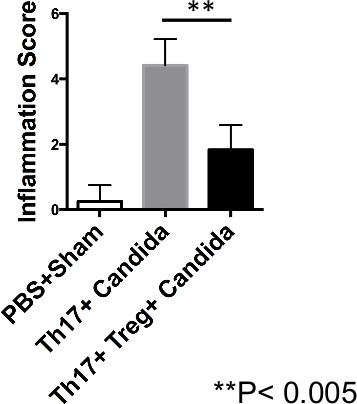
Figura 6. regs T migliorano immunopatologia in C. Albicans topi infettati. CB-17 topi SCID sono stati ricostituiti con cellule Balb / C Th17, o le cellule Th17 reg + T come in Figura 1A, e sono stati infettati con C. albicans. Rappresentazione statistica dei punteggi istologici medi delle lingue da topi infetti valutati come in Figura 5. Cliccate qui per vedere una versione più grande di questa figura.
| Punto | Caratteristiche |
| 0 | 0 - nessun lievito visibile o ife, epitelio intatto superficiale sulla superficie dorsale della lingua, papille chiaramente presente e non danneggiata (può o non può essere infiltrante cellule mononucleari nel tessuto), senza ispessimento dello strato basale, non infiltranti cellule immunitarie. |
| 1 | 1 - nessun lievito o ifa visibilee, cencioso o leggermente danneggiato epitelio superficiale, papille ben presente con il minimo danno e cellule immunitarie infiltranti infrequenti. |
| 2 | 2 - papille ridotta ma presente con un danno, l'ispessimento dello strato basale e frequenti cellule immunitarie infiltranti. |
| 3 | 3 - gruppi occasionali di lievito visibile e invadendo ife, la prova di papille danneggiato, lesioni occasionali di epitelio danneggiato, l'ispessimento dello strato basale e e piccoli gruppi di infiltrarsi cellule immunitarie. |
| 4 | 4 - frequenti gruppi di lievito visibile e invadendo ife, la prova di papille danneggiato, lesioni frequenti di epitelio danneggiato, minima infiltrazione di cellule immunitarie, l'ispessimento dello strato basale e frequenti ammassi di infiltrarsi cellule immunitarie. |
| 5 | 5 - diffusa evidenza di invadere ife, epitelio ampiamente danneggiato sulla superficie dorsale, grande infiltrazione dicellule immunitarie, pochi o nessun papille rilevabile, ispessimento dello strato basale e cluster altamente frequenti e grandi di infiltrarsi cellule immunitarie. |
Tabella 1: Valori punteggio istologici
Discussione
Questo modello è basato su indurre orale C. infezione albicans dipendente infiammazione Th17. A causa della mancanza di T reg, l'infiammazione delle cellule Th17 indotta è sfrenato e porta a immunopatologia mal risolto. In vitro derivato cellule CD4 naive polarizzate come le cellule Th17 sono stati utilizzati per il trasferimento adottivo. 40 - 50% della coltura CD4 + cellule mostrano rilevabile espressione di IL-17A intorno al giorno 3 (cellule Th17), e quindi sono stati utilizzati per l'iniezione nei topi. Il principale vantaggio del modello è che le cellule Th17 causare infezioni immunopatologia specifico che può essere efficacemente migliorato con l'iniezione T reg. Così il modello può essere utilizzato per testare strategie immunomodulazione con iniezione T reg come controllo positivo. L'infiammazione è facilmente valutata in base alla perdita di peso, e il punteggio istopatologico produzione di citochine pro-infiammatorie da parte delle cellule Th17 dei topi infettati.
Dopo tegli adottivi trasferimento di cellule Th17, hanno migrato organi linfoidi secondari e vari tessuti tra cui la lingua, il sito primario di infezione. Dopo l'infezione, altre cellule infiammatorie sono stati reclutati alla lingua per eliminare l'infezione. Tuttavia, senza l'immunomodulazione T reg mediata, cellule Th17 stessi non hanno risolto l'infezione, ma ha causato immunopatologia accresciuta. Co-trasferimento di T reg completamente risolto l'infiammazione. È interessante notare che i topi con infiammazione esacerbato in assenza di T reg, ha anche mostrato un aumento degli oneri fungina. Il nostro rapporto precedente ha mostrato che ciò era dovuto alla ridotta produzione di IL-17A in topi, rispetto a quelli con T reg. I nostri esperimenti attuali supportano l'idea che può anche essere causa di un aumento TNF-α che peggiorato l'infiammazione, possibilmente aumentando l'apoptosi delle cellule epiteliali e aumentato carica fungina 28. Considerando gli effetti immunoprotettivi di IL-17A alla mucosa, Riteniamo che la patologia infiammatoria che osserviamo con crescente onere fungina non è dovuta a IL-17A prodotta da cellule Th17 o mancanza di resistenza dell'ospite. E 'causata da TNF-α ed eventualmente altre citochine pro-infiammatorie prodotte dalle cellule Th17 iniettate. Questo può essere convalidata dalla constatazione che Rag - / - mice privo di cellule Th17 mostrare solo infiammazione minima e la successiva risoluzione dell'infezione e solo quelli che hanno ricevuto le cellule Th17 ceduto alla grave perdita di peso (Figura 1). Coerentemente a questi dati, è stato anche precedentemente dimostrato che Rag - / - mice cancellare l'infezione primaria OPC senza molto immunopatologia 27. In queste condizioni, meccanismi di compensazione dipendente da IL-17A che producono cellule immunitarie innate hanno dimostrato di eliminare l'infezione in Rag - / - mice 17,29,30. Nel loro insieme, anche se l'IL-17A prodotta da cellule Th17 e neutrofili reclutamento stanno giocando un ruolo di protezione nelle fasi iniziali dell'infezione, excproduzione essive di TNF-α e altre citochine da parte delle cellule Th17, e la continua presenza di neutrofili cause aggravata immunopatologia. I ruoli di citochine pro-infiammatorie, oltre TNF-α prodotto dalle cellule Th17 restano da indagare nel contesto di immunopatologia.
Il principale limite del modello è la questione se sia fisiologicamente rilevanti di OPC umana. Anche se le cellule Th17 sono dimostrato di essere mediatori patologici in diverse malattie orali, se l'attivazione cronica delle cellule Th17 è patogeno in OPC restano da indagare. Con i recenti scoperte implicano il ruolo di C. albicans in infiammazione e cancro, Th17 immunopatologia nella cavità orale, è un tema di indagine 31. Così il modello descritto qui può essere usato per studiare più attentamente ruoli specifici di cellule Th17 e come interagiscono con le cellule dell'immunità innata, dando intuizioni dettagliate a malattie immunologiche orali e cancro orale.
Il passo fondamentale nella tecnica è il reclutamento e l'espansione delle cellule Th17 adoptively trasferiti appropriata. Questo dipende in larga misura la vitalità e IL-17A produzione in vitro cellule Th17 polarizzate prima del trasferimento. E 'meglio per testare la loro vitalità e la produzione di citochine mediante citometria a flusso analisi 19. La corretta esecuzione dell'iniezione delle cellule e topi infezione Th17 porterà a infezioni dipendente Th17 immunopatologia. Questo modello può essere applicato a testare strategie per contrastare Th17 immunopatologia e infiammazione orale nel contesto di altre infezioni pure. Inoltre, utilizzando questo modello, si può effettuare reinfezioni secondarie e studiare il ruolo delle cellule Th17 nell'esacerbare immunopatologia nel contesto delle infezioni croniche. Poiché questo modello prevede topi immunodeficienti, può essere molto rilevante per disbiosi orale visto in pazienti affetti da AIDS e PID, che soffrono di infezioni croniche da Candida ricorrenti.
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
We thank Dr. Helene Bernstein for providing us with access to her flow cytometer. We also thank CFAR flow cytometry facility for the flow cytometry services. This project was in part supported by CTSC core utilization funding and STERIS corporation/University Hospitals-Division of Infectious diseases grant to PP.
Materiali
| Name | Company | Catalog Number | Comments |
| CAF-2 | University of Pittsburgh (Sarah Gaffen) | - | Candida culture |
| U-bottom 96 well plates | Fisher | 055588 | Used for cell culture |
| a-CD3 | eBiosciences | 16-0031-85 | Polarization of cells to Th17 conditions |
| a-CD28 | eBiosciences | 16-0281-85 | Polarization of cells to Th17 conditions |
| m-IL-6 | Bio Basic | RC232 | Polarization of cells to Th17 conditions |
| h-TGF-b | R&D | 240-B | Polarization of cells to Th17 conditions |
| a-IFN-g | eBiosciences | 16-7311-85 | Polarization of cells to Th17 conditions |
| a-IL-4 | eBiosciences | 16-7041-85 | Polarization of cells to Th17 conditions |
| α-IL17A ef660 | eBiosciences | 50-7177-82 | Used for cell culture - 1:50 |
| α-TNFa-PE-Cy7 | eBiosciences | 25-7423-41 | Used for cell culture - 1:100 |
| α-RORgt PE | eBiosciences | 12-6981-82 | Used for cell culture - 1:50 |
| YNB w/o amino acids)/Peptone/Dextrose broth medium | Bio Basic | S507.SIZE | Mediium for candida growth |
| Shaker incubator | New Brunswick Scientific | Innova 4300 | Incubation growth for candida |
| 15 ml tubes | Bio Basic | BT888-SY | Used for cell culture and candida growth |
| 50 ml tubes | Bio Basic | CT 788-YS | Used for cell culture and candida growth |
| Table top Centrifuge | VWR International LLC | 82017-654 | For pelleting candida -900 g |
| Allegra Centrifuge | Beckman Coulter | 392302 | Cell culture - 480 g |
| 1.5 ml eppendorf tubes | Bio Basic | BT620-NS | Preparing final concentration of candida |
| 2x paraformaldehyde | Electron Microscopy Sciences | 15710 | Fixing candida for count |
| Hemocytometer | VWR International LLC | 15170-172 | Counting cells |
| PBS - Phosphate Buffered Saline | Bio Basic | PD8117 | Preparation of buffers |
| Ketamine/xylazine | Case Western Reserve University - Animal Resource Center | - | Obtained from ARC approved protocol for anesthesia |
| Ophthalmic lubricant ointment | Allergan | - | Eye ointment for animals to prevent dryness |
| Saline (0.9% NaCl) | G Biosciences | 786-561 | Administerd to animals to prevent dehydration |
| 3-mm-diameter cotton wool ball | VWR International LLC | BP7603 | 3 mm balls for candida infection |
| Heat gel pads | Case Western Reserve University - Animal Resource Center | - | for maintaining the body temperaturre and fast recovery |
| Hematoxylin and Eosin staining | Histoserv - MD | - | Tissue histology |
| 10% formalin | Electron Microscopy Sciences | JC1111/MC | Tissue histology |
| 70% ethanol | VWR International LLC | 97064-490 | Sterilization purpose |
| PMA - Phorbol 12-myristate 13-acetate | Sigma-Aldrich | P1585-1MG | Restimulation of cells |
| Ionomycin | Life Technologies | 124222 1mg | Restimulation of cells |
| Fixation permeabilization kit | eBiosciences | E16913-106 | Fixing cells for Flow cytometry |
| Tuberculin syringes | BD Biosciences | 309659 | Mice injection |
| 25 G x 3/8 needles | BD Biosciences | 309626 | Mice injection |
| Rag1 -/- mice | Jackson laboratories | Stock no: 002216 | Recipient mice |
| CD45.1 congenic mice | Jackson laboratories | Stock no:002014 | Donor Th17 cells |
| CB17-SCID mice | Jackson laboratories | Stock no: 001303 | Recipient mice |
| Balb/c mice | Jackson laboratories | Stock no: 000651 | Donor Th17 cells |
Riferimenti
- Allam, J. P., et al. IL-23-producing CD68(+) macrophage-like cells predominate within an IL-17-polarized infiltrate in chronic periodontitis lesions. Journal of Clinical Periodontology. 38 (10), 879-886 (2011).
- Loesche, W. J. Periodontal disease: link to cardiovascular disease. Compendium Of Continuing Education In Dentistry. 21 (6), 463-466 (2000).
- Sfyroeras, G. S., Roussas, N., Saleptsis, V. G., Argyriou, C., Giannoukas, A. D. Association between periodontal disease and stroke. Journal Of Vascular Surgery. 55 (4), 1178-1184 (2012).
- Huppler, A. R., Bishu, S., Gaffen, S. L. Mucocutaneous candidiasis: the IL-17 pathway and implications for targeted immunotherapy. Arthritis Research & Therapy. 14 (4), 217 (2012).
- Sitheeque, M. A., Samaranayake, L. P. Chronic hyperplastic candidosis/candidiasis (candidal leukoplakia). Critical Reviews In. Oral Biology And Medicine : An Official Publication Of The American Association Of Oral Biologists. 14 (4), 253-267 (2003).
- Canabarro, A., et al. Association of subgingival colonization of Candida albicans and other yeasts with severity of chronic periodontitis. Journal Of Periodontal Research. 48 (4), 428-432 (2013).
- Urzua, B., et al. Yeast diversity in the oral microbiota of subjects with periodontitis: Candida albicans and Candida dubliniensis colonize the periodontal pockets. Medical Mycology. 46 (8), 783-793 (2008).
- Ergun, S., et al. Oral status and Candida colonization in patients with Sjogren's Syndrome. Medicina Oral, Patologia Oral Y Cirugia Bucal. 15 (2), e310-e315 (2010).
- Hernandez, Y. L., Daniels, T. E. Oral candidiasis in Sjogren's syndrome: prevalence, clinical correlations, and treatment. Oral Surgery, Oral Medicine, And Oral Pathology. 68 (3), 324-329 (1989).
- Gall, F., et al. Candida spp. in oral cancer and oral precancerous lesions. The New Microbiologica. 36 (3), 283-288 (2013).
- Grady, J. F., Reade, P. C. Candida albicans as a promoter of oral mucosal neoplasia. Carcinogenesis. 13 (5), 783-786 (1992).
- Dwivedi, P. P., Mallya, S., Dongari-Bagtzoglou, A. A novel immunocompetent murine model for Candida albicans-promoted oral epithelial dysplasia. Medical Mycology. 47 (2), 157-167 (2009).
- Cheng, S. C., Joosten, L. A., Kullberg, B. J., Netea, M. G. Interplay between Candida albicans and the mammalian innate host defense. Infection and Immunity. 80 (4), 1304-1313 (2012).
- Marodi, L., Johnston, R. B. Invasive Candida species disease in infants and children: occurrence, risk factors, management, and innate host defense mechanisms. Current Opinion In Pediatrics. 19 (6), 693-697 (2007).
- Kumamoto, C. A. Inflammation and gastrointestinal Candida colonization. Current Opinion In. Microbiology. 14 (4), 386-391 (2011).
- Kraneveld, E. A., et al. The relation between oral Candida load and bacterial microbiome profiles in Dutch older adults. PloS One. 7 (8), e42770 (2012).
- Hernandez-Santos, N., et al. Th17 cells confer long-term adaptive immunity to oral mucosal Candida albicans infections. Mucosal Immunology. 6 (5), 900-910 (2013).
- Hasina, R., et al. ABT-510 is an effective chemopreventive agent in the mouse 4-nitroquinoline 1-oxide model of oral carcinogenesis. Cancer Prevention Research. 2 (4), 385-393 (2009).
- Pandiyan, P., et al. CD4(+)CD25(+)Foxp3(+) regulatory T cells promote Th17 cells in vitro and enhance host resistance in mouse Candida albicans Th17 cell infection model. Immunity. 34 (3), 422-434 (2011).
- Pandiyan, P., et al. The role of IL-15 in activating STAT5 and fine-tuning IL-17A production in CD4 T lymphocytes. J Immunol. 189 (9), 4237-4246 (2012).
- Pandiyan, P., Lenardo, M. J. The control of CD4+CD25+Foxp3+ regulatory T cell survival. Biology Direct. 3 (6), (2008).
- Pandiyan, P., Zheng, L., Ishihara, S., Reed, J., Lenardo, M. J. CD4(+)CD25(+)Foxp3(+) regulatory T cells induce cytokine deprivation-mediated apoptosis of effector CD4(+) T cells. Nat Immunol. 8 (12), 1353-1362 (2007).
- Conti, H. R., Huppler, A. R., Whibley, N., Gaffen, S. L., Coligan, J. E. Animal models for candidiasis. Current Protocols In Immunology. 105, 11-19 (2014).
- Conti, H. R., et al. Th17 cells and IL-17 receptor signaling are essential for mucosal host defense against oral candidiasis. J Exp Med. 206 (2), 299-311 (2009).
- Kamai, Y., et al. New model of oropharyngeal candidiasis in mice. Antimicrobial Agents And Chemotherapy. 45 (11), 3195-3197 (2001).
- Pandiyan, P., Bhaskaran, N., Zhang, Y., Weinberg, A. Isolation of T cells from mouse oral tissues. Biological Procedures Online. 16 (1), 4 (2014).
- Gladiator, A., Wangler, N., Trautwein-Weidner, K., LeibundGut-Landmann, S. Cutting edge: IL-17-secreting innate lymphoid cells are essential for host defense against fungal infection. J Immunol. 190 (2), 521-525 (2013).
- Leppkes, M., Roulis, M., Neurath, M. F., Kollias, G., Becker, C. Pleiotropic functions of TNF-alpha in the regulation of the intestinal epithelial response to inflammation. International Immunology. 26 (9), 509-515 (2014).
- Bishu, S., et al. The adaptor CARD9 is required for adaptive but not innate immunity to oral mucosal Candida albicans infections. Infection and Immunity. 82 (3), 1173-1180 (2014).
- Quintin, J., et al. Differential role of NK cells against Candida albicans infection in immunocompetent or immunocompromised mice. Eur J Immunol. 44 (8), 2405-2414 (2014).
- Ramirez-Garcia, A., et al. Candida albicans and cancer: Can this yeast induce cancer development or progression. Critical Reviews In Microbiology. , 1-13 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon