Method Article
SDF-1α-키토산 덱스 트란 황산 나노 입자의 제조 및 특성
요약
The objective of this protocol is to incorporate SDF-1α, a stem cell homing factor, into dextran sulfate-chitosan nanoparticles. The resultant particles are measured for their size and zeta potential, as well as the content, activity, and in vitro release rate of SDF-1α from the nanoparticles.
초록
Chitosan (CS) and dextran sulfate (DS) are charged polysaccharides (glycans), which form polyelectrolyte complex-based nanoparticles when mixed under appropriate conditions. The glycan nanoparticles are useful carriers for protein factors, which facilitate the in vivo delivery of the proteins and sustain their retention in the targeted tissue. The glycan polyelectrolyte complexes are also ideal for protein delivery, as the incorporation is carried out in aqueous solution, which reduces the likelihood of inactivation of the proteins. Proteins with a heparin-binding site adhere to dextran sulfate readily, and are, in turn, stabilized by the binding. These particles are also less inflammatory and toxic when delivered in vivo. In the protocol described below, SDF-1α (Stromal cell-derived factor-1α), a stem cell homing factor, is first mixed and incubated with dextran sulfate. Chitosan is added to the mixture to form polyelectrolyte complexes, followed by zinc sulfate to stabilize the complexes with zinc bridges. The resultant SDF-1α-DS-CS particles are measured for size (diameter) and surface charge (zeta potential). The amount of the incorporated SDF-1α is determined, followed by measurements of its in vitro release rate and its chemotactic activity in a particle-bound form.
서문
덱스 트란 황산 (DS)과 키토산 (CS)는 (DS)에 여러 대체 음으로 하전 된 황산 그룹과 폴리 사카 라이드, 또는 양전하 아민 그룹입니다 (CS를 탈 아세틸). 수용액에 혼합 할 때, 두 가지 다당류는 정전 기적 상호 작용을 통해 고분자 전해질 복합체를 형성한다. 얻어진 착물 수용액 (침전물)로부터 상분리한다 큰 응집체 또는 수분 산성 (콜로이드)의 소형 입자를 형성 할 수있다. 이러한 결과에 기여하는 구체적인 조건은 광범위하게 연구되어 왔으며, 최근의 리뷰에서 요약 한 상세히 도시되어있다. 이러한 조건 중에서, 수분 산성 입자를 제조하기위한 두 가지 기본적인 요구 반대로 대전 된 중합체는 1)이 크게 상이한 몰 질량을 가져야이고; 2) 비 화학량 론적 비율로 혼합 될 수있다. 이러한 조건에 의해 생성 된 전하 전하 중성 복합체 중합체 세그먼트를 허용중화는 분리 및 입자의 코어를 형성하고, 여분의 중합체는 외부 쉘을 형성하기 위해 하나한다. 이 프로토콜에 기재된 당쇄 입자는 폐 전달을 위해 의도되고, 음으로 하전 된 순으로 설계되고, 나노 사이즈의. 음극 표면 전하 입자 2,3의 세포 흡수의 가능성을 감소시킨다. 나노 사이즈의 입자는 원위기도 통로를 통해 용이하게한다. 이 목표를 달성하기 위해, 본 제조에 사용되는 DS의 양은 CS 초과 (중량비 3 : 1); 고 분자량은 DS (중량 평균 MW 500,000)와 저분자 CS (MW kDa의 범위 50-190, 75~85% 탈 아세틸)이 사용된다.
SDF-1α는 화성 활동을 통해 원점 복귀 기능을 발휘 줄기 세포 호밍 요인이다. SDF-1α는 원점과 골수 조혈 줄기 세포의 유지에 중요한 역할을하고 proge의 모집부상 수리 4,5의 말초 조직에 nitor 세포. SDF-1α는 단백질이 프로테아제 (CD26 / DPPIV) 불활로부터 보호, 헤파린 / 헤파 란 설페이트, 형태 다이머에 결합하고, 세포 표면 수용체를 통해 표적 세포와 상호 작용할 수 있도록 그 단백질 서열에 헤파린 결합 부위를 갖는다 6-8. DS는 헤파린 / 헤파 란 황산과 유사한 구조적 특성이있다; 따라서, DS에 대한 SDF-1α의 결합은 천연 고분자 리간드의 그것과 유사하다.
다음 프로토콜에서 우리는 SDF-1α-DS-CS 나노 입자의 제조 방법을 설명합니다. 절차는 이전에 9를 연구 된 제제 중 하나를 나타냅니다. 프로토콜은 원래 VEGF-DS-CS 나노 입자 (10)의 조사에서 적합하다. 소규모 제조 용이 동일한 스톡 용액 및 제조 조건으로 확장 할 수있는 기술된다. 제조 후, 입자 b를 특징Y는 크기, 제타 전위, SDF-1α 통합의 정도, 체외 방출 시간 및 통합 SDF-1α의 활동을 조사.
프로토콜
SDF-1α 글리 칸 나노 입자의 1. 준비
생체 내 전달의 목적으로 인해, 제조에 사용 된 모든 용기, 피펫 팁을 소독.
- 초순수에서 다음 원액을 준비 : 1 % 덱스 트란 황산; 1 M의 NaOH (PES 막으로 멸균 여과); 0.1 % (0.8 연속적 0.22 μm의 필터를 통해 필터 및 그 후에 NaOH로 pH가 5.5로 조정), 0.2 % 빙초산 키토산; 0.1 M ZnSO 4; 15 % 만니톨; 0.92 ㎎ / ㎖ SDF-1α (80 ° C에서 분취 액에 저장되고, 4 ℃에서 보관 일단 해동 C).
- 0.22 μm의 필터 멤브레인을 통해 재고 솔루션을 소독. 리 물러의 amebocyte 용 해물 (LAL) 젤 응고 분석에 준비된 용액에 독소 수준을 평가합니다. 수준이 <0.06 EU / ㎖ 있는지 확인합니다.
- 자기 교반 막대를 함유하는 1.5 mL 유리 바이알에 0.18 ml의 초순수를 추가한다. 800 rpm으로 교반 속도를 설정합니다. 0.1 ml의 1 %를 추가덱스 트란 설페이트 및 2 분 동안 교반한다. 0.08 mg을 SDF-1α (0.92 Mg를 0.087 ㎖ / ml의 SDF-1α 용액)를 첨가하고, 20 분 동안 교반한다.
- 0.33 ml의 0.1 % 키토산 적가하고 추가 5 분 동안 교반한다. 변경 볶음 최대 속도 (1 분 이상) 0.1 ML의 주사기로 천천히 0.1 ml의 0.1 M ZnSO 4를 추가합니다.
- 800 rpm으로 교반 속도를 반환하고, 30 분 동안 교반한다. 0.4 ml의 15 % 만니톨을 추가하고 5 분 동안 교반한다. 1.5ml의 미세 원심 분리 튜브에 반응 혼합물을 전송. 10 분 동안 4 ° C에서 16,000 XG에 원심 분리기.
주 : 만니톨의 존재는 원심 분리 후 입자의 부유를 용이하게한다. 펠릿의 소형화에 따라 만니톨의 농도는 0 %에서 5 %로 변화 될 수있다. 원심 분리 후, 각 입자의 완전 재현 탁하여 최종 현탁액 응집체를 피하기 위해 중요하다. - 기음 뜨는 천천히 액체의 마지막 한 방울을 제거하기 위해 피펫을 사용합니다. 0.2 ml의 5 % 만니톨을 추가합니다. 0.5 ml의 펠렛을 일시 중단, 29 G의 옛 성은DLE 주사기. 1 ml의 5 % 만니톨을 추가합니다. 15 분 동안 16,000 XG에 원심 분리기.
- 단계를 반복 1.6.
- 뜨는을 기음. 0.2 ml의 5 % 만니톨 펠렛을 재현 탁. 4 ° C에서 입자 현탁액을 저장합니다.
주 : 입자 현탁액도 저장 -80 ° C에서 동결 또는 동결 건조 될 수있다. 서스펜션 포함 5 % 만니톨 동결 및 해동 후 또는 동결 건조 및 수분 보충 후 입자의 응집을 방지하기 위해 필수적이다. 만니톨 보존 후의 현탁액을 원심 분리에 의해 제거 될 수있다.
입자 크기와 제타 전위 2. 측정
입경 및 제타 전위를 소재리스트에 표시된 입자 분석기로 각각 동적 광산란 및 전기 영동 광 산란에 의해 분석된다.
- 축적 시간 : 다음 입자 크기 측정을위한 파라미터를 설정 (70); 반복 시간 : 4; 온도 : 25 ° C;희석제 : 물; 강도 조절 : 자동.
- 물 (10 배 희석)와 SDF-1α-DS-CS 샘플을 희석. 이러한 에펜 도르프 베트로 일회용 UV 큐벳에 시료 100 ㎕를 넣습니다. 셀 홀더에 큐벳을 삽입합니다. "최적"(~ 10,000 CPS)에 도달하기 위해 강도 조정 기다립니다. 데이터 수집을 시작합니다.
- 측정이 완료되면, 직경 (㎚) 및 다 분산도 지수 cumulants 결과를 기록한다. 4 반복 판독 각각으로부터 얻어진 결과를 평균치와 표준 편차를 계산한다.
- 로드 제타 전위 측정 플로우 셀에 10 배 희석 한 시료의 입자 500 μL. 누적 시간 : 다음 측정을위한 매개 변수를 설정합니다 (10); 반복 시간 : 5; 온도 : 25 ° C; 희석제 : 물; 강도 조절 : 자동. 제타 전위 (MV)의 결과를 기록한다. (5) 판독 반복의 각각으로부터 얻어진 결과를 평균 및 표준을 계산 deviatioN.
입자의 SDF-1α의 3 정량화
- 1.3 램 믈리 샘플 버퍼에 0.01, 0.02, 0.03, 0.04, 0.05 ㎎ / ㎖의 농도 자유 양식 SDF-1α를 희석. 40 μL의 1.3 배 램 믈리 샘플 버퍼 6 μL SDF-1α-DS-CS 샘플을 희석. (나눈다. 작은 분취 량으로 원액을 0.25 M 트리스 -HCl, pH가 7.5, 8 % SDS, 40 % 글리세롤, 0.05 ㎎ / 브로 모 페놀 블루,는 ml 8 % 2- 머 캅토 에탄올을 함유 4X 램 믈리 스톡 완충액을 준비하고 -20 ℃로 유지 단일 사용하기 위해 C를 °.)
- 10 분 동안 100 ℃에서 샘플을 가열한다. 소용돌이 입자를 완전히 해리시키기 위해 10 분 동안 가열 시간 배 샘플 (최대 속도로 10 초 동안 각각). 2 분 동안 RT에 샘플을 냉각. 0.5 분 10,000 XG에 원심 분리기는 응축수를 가져올 수 있습니다. 소용돌이는 다시 잘 섞는다.
참고 :이 시점에서, 시료 용액이 눈에 보이는 침전물 존재와 명확해야한다. - 로드 10# 181; L 샘플 / 웰에 4-20 %의 SDS 젤. 20 분 동안 200 V의 전기를 실행합니다. 코마시 블루 단백질 얼룩 젤을 얼룩.
- 분자 이미 저와 농도계 분석 소프트웨어를 사용하여 SDF-1α의 단백질 밴드 밀도를 검사합니다. 무료 SDF-1α 표준 구성된 표준 곡선에 대한 입자 SDF-1α의 양을 계산합니다.
생체 외 자료 분석 4.
- 1 칼슘과 마그네슘 (D-PBS)없이 둘 베코 인산염 완충 생리 식염수와 SDF-1α 글리 칸 입자를 혼합 : 1의 비율 (v / v)로.
- 1.5 ml의 튜브에 0.05 ㎖의 분취 량으로 입자 현탁액을 나눕니다. 튜브의 바닥에 샘플을로드합니다. 기포를 도입 또는 액체의 표면을 방해하지 않도록. 파라 필름으로 튜브의 상단을 밀봉합니다.
주 : 이때, 액체는 튜브 믹서 후속 상하 회전시 하단에 남아있을 것이다. - 37에서 튜브를 회전# 176; C 회전 마이크로 튜브 믹서에. 지정된 시간에 튜브에서 분취 액을 제거하고 즉시 4 ° C에서 10 분 동안 16,000 XG에서 원심 분리.
- 상층 액과 펠렛을 분리, 0.05 ml의 D-PBS로 펠렛을 재구성. -20 ° C에서 샘플을 저장합니다. 모든 샘플이 수집 된 후 전술 한 바와 같이, SDS 겔상에서 상등액과 펠릿을 조사.
5. 마이그레이션 분석
이 분석은 SDF-1α의 화성 활동을 측정합니다. 세포 표면의 수용체 (CXCR4)와 SDF-1α의 상호 작용은 SDF-1α의 그라데이션으로 세포의 이동을 야기한다. 이 분석에서, 세포는 낮은 잘으로하고 SDF-1α 솔루션 (낮은 우물에서 반투과성 막에 의해 분리) 상부 우물에로드됩니다.
- SDF-1α 희석 (유리 또는 입자 - 결합 된 형태) -3- FO에서 이주 완충액 (0.5 % 소 혈청 알부민을 함유하는 RPMI-1640 배지)100, 33, 11, 3.7, 1.2, 0.41, 0.14, 및 0.05 ng를 / ㎖의 최종 농도로 용액을 희석 LD.
- 24 웰 플레이트에 웰에 희석 된 SDF-1α 솔루션 또는 마이그레이션 버퍼 만 (대조군)의 0.6 ML을 추가합니다. 잘 (입력 셀 제어)에 0.57 ml의 마이그레이션 버퍼를 추가합니다. 30 분 동안 37 ℃에서 배양한다. 이러한 낮은 잘 위에없이 Transwell (기공 크기 5 μm의 직경 6.5 mm)로 투과 세포 배양 삽입을 놓습니다. 트랜스 웰에 0.1 ml의 된 Jurkat 세포 (5 × 10 5)를 삽입로드. 잘 입력 세포 제어에 직접 0.03 ml의 세포를로드합니다. 5 % CO 2 인큐베이터에서 2 시간 동안 37 ℃에서 플레이트를 인큐베이션.
- 트랜스 웰 인서트를 제거합니다. 4 ml의 폴리스티렌 튜브에 낮은 우물로 마이그레이션 한 세포를 전송합니다. 유량 계측기와 마이그레이션 된 세포를 계산합니다.
- negat에 숫자의 감산 입력 후 세포 수 (X 웰 100/30 입력 셀 컨트롤 세포 수)의 백분율로 계산 이주컨트롤 (에만 이동 완충액을 함유하는 웰에 마이그레이션 셀) 필자.
결과
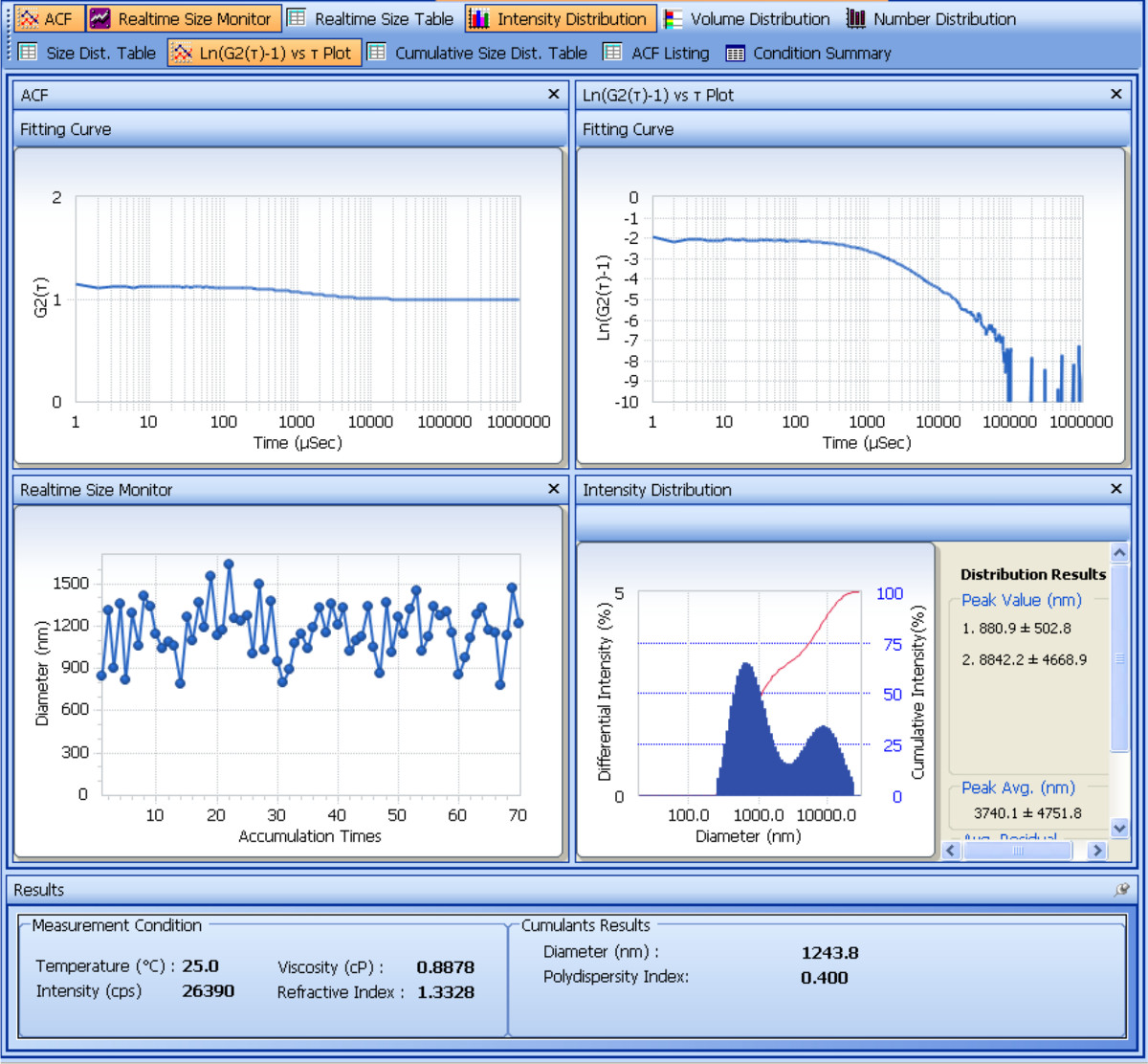
제조 된 SDF-1α-DS-CS 입자의 크기 및 제타 전위는 입자 분석기로 측정된다. 1 사이즈의 측정 분석을 보여준다. 네 개의 반복 된 측정에 의한 결과로부터 cumulants, SDF-1α-DS-CS 입자의 유체 역학적 평균 직경은 661 ± 8.2 (㎚)이고 분산도는 0.23 ± 0.02이다. 제타 전위 측정의 결과는도 2에 도시되어있다. 다섯 반복 측정에서, SDF-1α-DS-CS 입자의 제타 전위는 -24.8 ± 0.5 MV이다. 전술 한 바와 같이, SDF-1α-DS-CS 입자 현탁액에 5 % 만니톨의 존재는 냉동 및 해동 과정에서 입자의 응집을 예방에 필수적이다.도 3으로 보여 물에 현탁시키고 동결 입자의 크기 측정 -80 ° C. 별개의 집계 피크는 해동 후 볼 수 있습니다.
AMOSDF-1α-DS-CS 입자의 SDF-1α의 UNT는 SDS 겔 전기 영동으로 추정된다. 그림 4a는 SDF-1α 통합없이 SDF-1α 표준, DS-CS 나노 입자 (제어 입자와 쿠마시 블루 염색 SDS 겔을 보여줍니다 Ctrl 키 NP)와 SDF-1α-DS-CS 나노 입자 (SDF-1α NP) 된 시료. 표준 곡선은 SDF-1α 표준 대역 (도 4B)의 농도 분석으로부터 구성된다. 표준 곡선으로부터 계산 SDF-1α NP 샘플에서 SDF-1α의 농도는 0.03 ㎎ / ㎖ (중복의 평균)을 나타냅니다. 샘플 완충액으로 샘플의 희석 (6 + 40) / 6이기 때문에, 원래의 시료 농도는 0.23 ㎎ / ㎖이다. 입자 제제의 최종 부피가 0.2 ml에있는 바와 같이, 최종 현탁액 총 SDF-1α는 0.046 mg이었다. 반응 혼합물 중의 SDF-1α의 입력을 감안하면 질량 0.08 ㎎, DS-CS 입자 중에 SDF-1α의 포획 효율은 57 % 인 것이다. 전표오산는 이전에 쿠마시 블루로 염색하는 것으로보고되었습니다. 염색은, 그러나,도 4a에 도시 된 겔에서 중요하지 않다. 이것은 아마도, 키토산 겔에 로딩 (매트릭스 입자)의 양에 관한 것이다. 어떤 경우에, 입자 매트릭스로부터 완전히 분리 및 SDF-1α의 분리 정확하게 혼입 된 단백질의 양을 평가하기 위해 필요하다. 이 겔은 더 밴드 SDF-1α 단백질 대역과 색소 전면 사이에서 발견되지 않은 것처럼 SDF-1α가 검출 가능, 10 분 동안 또는 와류 법에 의해 100 ℃에서 가열에 의해 분해되지 않았 음을 보여준다.
나노 입자로부터 SDF-1α의 시험 관내 방출 속도를 7 일 동안 37 ° C에서 50 % D-PBS 중의 입자의 배양에 의해 결정된다. 0 시간, 3 시간, 8 시간, 24 시간, 48 시간, 7 일에서, 시료의 분취 량을 원심 분리하여 즉시 제거하고 있습니다. 릴리스 SDF-1α는 (상등액) 입자 - 결합 된 SD로부터 분리F-1α (펠렛). 시료는 SDS 겔상에서 실행하고 상청액 SDF-1α의 양 및 펠릿 쿠마시 염색 및 농도계 분석에 의해 측정된다된다. 분석의 전형적인 SDS 겔은도 5에 도시되어있다. 알 수 있듯이, 입자 결합 SDF-1α는 최소 7 일 동안 배양 한 후에 해제된다.
입자 - 결합 된 SDF-1α의 활성은 자유 SDF-1α에 비해 이주 세이 (주 화성 분석법)으로 측정하고있다. 이 분석에서, DS-CS 나노 입자에서 SDF-1α 직렬 이주 완충액으로 희석하고, 2 시간 동안 세포로 배양 된 Jurkat. 마이그레이션 세포 유동 세포 계수기로 계산됩니다. (0.05-11 NG / ㎖ SDF-1α 농도) 데이터는 비선형 회귀 피팅 플롯하고, EC (50)가 계산된다. 도 6에 도시 된 바와 같이, 입자 - 결합 된 SDF-1α는 ^ 자유 SDF-1과 이동의 동일한 정도로 유도5; 모든 농도에서 측정 하였다. SDF-1α의 자유 및 입자 결합 된 형태의 EC (50) 값은 각각 0.55과 0.45 ng를 / ㎖이다.

그림 1. 분석 화면 입경 동적 광산란 측정을 도시 샷. 상위 두 패널은 자기 상관 함수의 플롯, G2 (τ)과의 대수 [G2 (τ) -1] 시간의 경과를 나타낸다. 악기의 디지털 신호 프로세서 (상관)는 지연 시간 (τ)의 함수로서 검출 된 광 강도를 나타낸다. 줄거리는 SDF-1α-DS-CS 입자가 0.2 밀리 초 사이에 강도 지수 붕괴 원인이된다는 것을 알 수있다. 평균 붕괴 상수를 구하려면 <Γ>

도 2는 화면 분석 전기 영동 광산란 샷을 도시입자의 제타 전위의 측정. 상단 패널은 시간 플롯을 통해 G2 (τ)를 보여줍니다. 서서히 진동 감쇠 함수는 일반적으로 전기 영동 광산란 실시되는 대전 입자에서 관찰된다. 함수는 전계에서 이동하는 입자들에 의한 주파수 시프트 (도플러 시프트)를 반영한다. G2 (τ)의 푸리에 변환은 중간 패널에 나타낸 전력 스펙트럼 (주파수 플롯 대 강도)를 제공한다. 주파수 시프트 피크의 중심은 제타 전위가 계산되는 입자의 이동도를 정의한다. 계산 제타 전위는 화면 하단에 도시되어있다.
동결 및 해동 후에 물에서 SDF-1 α-DS-CS 입자도 3의 측정 된 입자 크기. 만니톨 부재에서 입자를 형성 AG동결 융해 후 gregates. 추가 세기 / 크기 피크의 형성 및도 1에 비해 cumulants 직경 분산의 증가를 참고.

무료 SDF-1α 표준, DS-CS 나노 입자 (Ctrl 키 NP)와 SDF-1α-DS-로드 쿠마시 염색 SDS 겔의 그림 4. DS-CS 나노 입자의 SDF-1 α 설립 정량화. (A) 사진 CS 나노 입자 (SDF-1α NP) 샘플 바와 같이. SDF-1α 단백질 밴드와 젤 실행 염료 전면 표시됩니다. Ctrl 키 NP 샘플 쿠마 파란색과 키토산 밴드 (폭) 희미하게 볼 수 있습니다로 염색되지 않습니다. (B)는 밴드 표준 곡선 (자유 SDF-1α 표준 구성 duplica 평균되는 농도계 분석으로테). 나노 입자의 SDF-1α의 양을 0.3 μg의 평균 값 / 웰 (10 μL)을 제공 표준 곡선에 대하여 계산된다.

SDF-1 α 체외 릴리즈 타임 과정을 보여주는 그림 5. SDS 젤. SDS 겔 쿠마 묻은는 SDF-1α-DS의 배양 후 (상층 액)에 발표 SDF-1α의 양 (펠렛)에 결합 된 SDF-1α를 보여줍니다 다양한 시간 37 ° C에서 -CS 나노 입자. 9 허가를 다시 인쇄.

SDF-1 α (원) 및 SDF-1α 나노 입자 (NP)는 Jurkat 세포 이동 분석에서 (사각형). SDF-1α 무료 나노 입자 모두에서 행의 그림 6. 용량 - 반응 곡선MS는 각각 0.55의 EC 값을 50 ng를 0.45 / ㎖와 동일한 활성을 나타냈다. 9 허가를 다시 인쇄.
토론
전술 한 바와 같이, DS-CS 나노 입자 폴리 음이온 (DS)과 폴리 양이온 (CS) 분자간 전하 중성화를 통해 형성된다. 전하 상호 작용은 분자 충돌시 쉽게 발생하기 때문에, 혼합 중에 중합체 용액 및 교반 속도의 농도는 생성 된 입자의 크기가 중요하다. 일반적인 경향은 더 DS 및 CS 솔루션 (15) 및 작은 입자의 높은 교반 속도 결과를 희석하고 있다는 것이다.
SDF-1α 글리 칸의 나노 입자 제제는 필요에 따라 변경 될 수있다. 예를 들어,이 프로토콜에서 사용되는 SDF-1α / DS / CS의 양 및 비율은 각각 0.08 / 0.33 / 1 (㎎ / ㎎ / MG)이다. SDF-1α 나노 입자의 용도에 따라, 이러한 비율을 변경할 수있다. SDF-1α의 양을 첨가하는 경우는 ~, 입자가 더 작 650 내지 0.04 mg의 대신에 0.08의 Mg (0.04 / 0.33 / 1 ㎎ / ㎎ / MG)이며, SDF-1α 포집 효율이 약간 greater 70 ~ 80 9 %. 생체 내 전달 그러나, 글리 칸 매트릭스는 더 많은 양의 SDF-1α 당 존재하게 될 것이다. 작은 입자 크기가 요구되는 경우, SDF-1α 당쇄의 나노 입자 제제는 추가로 변형 될 수있다. 참고 문헌 15에 설명 된 바와 같이 하나의 대안은, 저분자 키토산을 사용하는 것이다. 또한 주목해야 그러나, 키토산 엔도톡신 높은 친 화성을 갖는다 (리포 폴리 사카 라이드를 음으로 하전); 그러므로, 내 독소 레벨 테스트 또는 잠재적 정제 전에 생체 내 전달에 대한 키토산 제품의 사용에 대한 필요가있다. 두 번째 대안은 미리 형성된 작은 DS-CS 나노 입자에 SDF-1α를로드하는 것입니다. 후자 입경 및 SDF-1α에 더욱 용이하게 조작 할 수 있기 때문에,보다 작은 입자가 발생할 수 DS-CS 입자의 외부 쉘에 SDF-1α의 소량로드 DS에 대한 높은 친 화성을 갖는다.
다른 유형과 비교하면나노 입자 (예를 들어, PLGA (11), 폴리 안 하이드 라이드 (12), 젤라틴 (13) 나노 입자), DS-CS 나노 입자는 특정 장점과 제한이 있습니다. DS-CS 나노 입자의 주요한 장점은 1) 입자 제조는 유기 용매 또는 격렬한 초음파를 포함하지 않는다. 부드러운 단백질 제제 불 활성화의 가능성을 감소시키기 때문에 또한, 따라서 단백질 인자 혼입에 적합하다; 2) 입자의 매트릭스 조직 환경과 호환 입자하게 적은 독성 및 염증 세포 외 매트릭스와 유사한 구조적 특성을 갖는다; 3) 글리 칸 입자 결합 된 SDF-1α 모방 단백질과 글리 칸 입자에 통합 된 후 SDF-1α의 전체 화성 활동을 설명하는 세포 외 기질 사이의 자연스러운 결합 관계. 입자 결합 된 형태로 완전히 활성화 SDF-1α는 조직 전자의 정지 원점 복귀 인자로 역할을 할 수 있습니다nvironment. DS-CS 나노 입자의 제한이있다 : 1) 입자의 지름은 상기 언급 된 입자보다 일반적으로 크다; 2) 쉽게 혈액 순환에 직접 주입 적합하지 않을 수 있습니다 염 용액에 축소합니다.
입자 - 결합 된 SDF-1α는 최소 칠일 배양 후에 나노 입자로부터 방출되는 것으로한다. 이 현상은 또한 생체 내에서 그 기능에 기여 헤파린 SDF-1α의 높은 친화력에 관한 것이다. 헤파린 결합 도메인과 단백질이 헤파린에 대해 서로 다른 유사성을 일반적으로있을 것이기 때문에, 자신의 방출 속도는 다를 가능성이 있습니다. 예를 들어, VEGF 165 -ds-CS 나노 입자가 유사한 제형으로 제조, 통합 VEGF (165)의 44 %는 제 시간에 발표하고, 29 %는 37 ° C (14)에서 배양하는 동안 다음 47 시간에 발표되었다. 따라서, 특정 PROT 대한 시험 관내 방출 패턴EIN은 개별적으로 테스트 될 필요가있다.
SDF-1α-DS-CS 나노 입자의 제조의 목적은 폐에 SDF-1α을 제공하며 조직에서 줄기 세포의 유도 신호를 확립하는 것이다. 특정 포맷은 나노 입자의 고체 조직 주입에 필요한 것은 아니다 입자는 또한, 동일한 목적을 위해 다른 조직으로 전달 될 수있다. SDF-1α는 나노 매트릭스 DS에 의해 안정화되고, 최소 입자로부터 방출된다는 사실은 세포 모집 원리 줄기 지원하며,이 입자 조직 재생에 도움이 될 것으로 예상된다.
단백질 당쇄 나노 입자가 세포 표면 글리코 사 미노 글리 칸 및 세포 외 기질의 것과 유사한 매트릭스를 가지고 있기 때문에, 입자 혼입 단백질 음전하 외 매트릭스 분자는 양의 결합과 경쟁 할 수있다 (이러한 행렬들로 교환 할 수있는 가능성이있다 생체 내에서 충전 단백질) . 이러한 교환 따라서, 상기 시험 관내 특성화 이후, 초기 조사 될 필요 단백질 방출 역학을 변경하고있다.
공개
The authors declare that they have no competing financial interests.
감사의 말
HL671795, HL048743 및 HL108630 :이 작품은 NIH 보조금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Dextran sulfate | Fisher | BP1585-100 | |
| Chitosan, low molecular weight | Sigma | 448869 | |
| Zinc sulfate heptahydrate | Sigma | 204986 | |
| D-Mannitol | Sigma | M9546 | |
| UltraPure water | Invitrogen | 10977-023 | |
| SDF-1α | Prepared according to reference 8. | ||
| Syringe filter, PES membrane 0.22 μm | Millipore | SLGP033RS | |
| Magnetic Micro Stirring Bars (2 x 7 mm) | Fisher | 14-513-63 | |
| Glass vial Kit; SUN-SRi | Fisher | 14-823-182 | |
| Delsa Nano C Particle Analyzer | Backman Coulter | ||
| Eppendorf UVette Cuvets | Eppendorf | 952010069 | |
| 4–20% Mini-PROTEAN TGX Gel | Bio-Rad | 456-1096 | |
| GelCode Blue Safe Protein Stain | Fisher | PI-24592 | |
| Molecular Imager VersaDoc MP 4000 System | BioRad | 170-8640 | |
| Corning Transwell Permeable Supports | Corning | 3421 | |
| Accuri C6 Flow Cytometer | BD Biosciences | ||
| Dulbecco’s phosphate buffered saline | Sigma | D8537 | |
| Pyrogent plus kit | Fisher | NC9753738 |
참고문헌
- Delair, T. Colloidal polyelectrolyte complexes of chitosan and dextran sulfate towards versatile nanocarriers of bioactive molecules. Eur J Pharm Biopharm. 78 (1), 10-18 (2011).
- Morachis, J. M., Mahmoud, E. A., Almutairi, A. Physical and chemical strategies for therapeutic delivery by using polymeric nanoparticles. Pharmacol Rev. 64 (3), 505-519 (2012).
- Yue, Z. G., et al. Surface charge affects cellular uptake and intracellular trafficking of chitosan-based nanoparticles. Biomacromolecules. 12 (7), 2440-2446 (2011).
- Ghadge, S. K., Muhlstedt, S., Ozcelik, C., Bader, M. SDF-1alpha as a therapeutic stem cell homing factor in myocardial infarction. Pharmacol Ther. 129 (1), 97-108 (2011).
- Sharma, M., Afrin, F., Satija, N., Tripathi, R. P., Gangenahalli, G. U. Stromal-derived factor-1/CXCR4 signaling: indispensable role in homing and engraftment of hematopoietic stem cells in bone marrow. Stem Cells Dev. 20 (6), 933-946 (2011).
- Sadir, R., Baleux, F., Grosdidier, A., Imberty, A., Lortat-Jacob, H. Characterization of the stromal cell-derived factor-1alpha-heparin complex. J Biol Chem. 276 (11), 8288-8296 (2001).
- Amara, A., et al. Stromal cell-derived factor-1alpha associates with heparan sulfates through the first beta-strand of the chemokine. J Biol Chem. 274 (34), 23916-23925 (1999).
- Sadir, R., Imberty, A., Baleux, F., Lortat-Jacob, H. Heparan sulfate/heparin oligosaccharides protect stromal cell-derived factor-1 (SDF-1)/CXCL12 against proteolysis induced by CD26/dipeptidyl peptidase IV. J Biol Chem. 279 (42), 43854-43860 (1074).
- Yin, T., et al. SDF-1alpha in glycan nanoparticles exhibits full activity and reduces pulmonary hypertension in rats. Biomacromolecules. 14 (11), 4009-4020 (2013).
- Huang, M., Vitharana, S. N., Peek, L. J., Coop, T., Berkland, C. Polyelectrolyte complexes stabilize and controllably release vascular endothelial growth factor. Biomacromolecules. 8 (5), 1607-1614 (2007).
- McCall, R. L., Sirianni, R. W. PLGA nanoparticles formed by single- or double-emulsion with vitamin E-TPGS. J Vis Exp. (82), 51015(2013).
- Carrillo-Conde, B. R., Roychoudhury, R., Chavez-Santoscoy, A. V., Narasimhan, B., Pohl, N. L. High-throughput synthesis of carbohydrates and functionalization of polyanhydride nanoparticles. J Vis Exp. (65), 3967(2012).
- Xu, J., Amiji, M. Therapeutic gene delivery and transfection in human pancreatic cancer cells using epidermal growth factor receptor-targeted gelatin nanoparticles. J Vis Exp. (59), e3612(2012).
- Lauten, E. H., et al. Nanoglycan complex formulation extends VEGF retention time in the lung. Biomacromolecules. 11 (7), 1863-1872 (2010).
- Schatz, C., Domard, A., Viton, C., Pichot, C., Delair, T. Versatile and efficient formation of colloids of biopolymer-based polyelectrolyte complexes. Biomacromolecules. 5 (5), 1882-1892 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유