Method Article
Préparation et caractérisation des SDF-1α-chitosane-Sulfate de Dextran nanoparticules
Dans cet article
Résumé
The objective of this protocol is to incorporate SDF-1α, a stem cell homing factor, into dextran sulfate-chitosan nanoparticles. The resultant particles are measured for their size and zeta potential, as well as the content, activity, and in vitro release rate of SDF-1α from the nanoparticles.
Résumé
Chitosan (CS) and dextran sulfate (DS) are charged polysaccharides (glycans), which form polyelectrolyte complex-based nanoparticles when mixed under appropriate conditions. The glycan nanoparticles are useful carriers for protein factors, which facilitate the in vivo delivery of the proteins and sustain their retention in the targeted tissue. The glycan polyelectrolyte complexes are also ideal for protein delivery, as the incorporation is carried out in aqueous solution, which reduces the likelihood of inactivation of the proteins. Proteins with a heparin-binding site adhere to dextran sulfate readily, and are, in turn, stabilized by the binding. These particles are also less inflammatory and toxic when delivered in vivo. In the protocol described below, SDF-1α (Stromal cell-derived factor-1α), a stem cell homing factor, is first mixed and incubated with dextran sulfate. Chitosan is added to the mixture to form polyelectrolyte complexes, followed by zinc sulfate to stabilize the complexes with zinc bridges. The resultant SDF-1α-DS-CS particles are measured for size (diameter) and surface charge (zeta potential). The amount of the incorporated SDF-1α is determined, followed by measurements of its in vitro release rate and its chemotactic activity in a particle-bound form.
Introduction
Sulfate de dextran (DS) et le chitosan (CS) sont des polysaccharides avec plusieurs groupes sulfate chargés négativement substitués (dans DS) ou des groupes aminés chargés positivement (désacétylés CS). Lorsqu'il est mélangé à une solution aqueuse, les deux polysaccharides forment des complexes polyélectrolytiques par des interactions électrostatiques. Les complexes résultants peuvent former de gros agrégats qui seront phases séparées de la solution aqueuse (précipités), ou de petites particules qui sont dispersables dans l'eau (colloïdes). Les conditions spécifiques qui contribuent à ces résultats ont été largement étudiées et ont été résumés et illustrés en détail dans une étude récente 1. Parmi ces conditions, deux conditions de base pour la production de particules dispersibles dans l'eau sont les polymères de charges opposées doivent 1) ont une masse molaire sensiblement différente; et 2) être mélangés dans un rapport non stoechiométrique. Ces conditions permettront aux segments polymères complexés charge neutre produites par la chargeneutralisation de séparer et de former le noyau de la particule, et le polymère en excès pour former la coque externe 1. Les particules glycanes décrites dans ce protocole sont destinés à une administration pulmonaire, et sont conçus pour être nette chargé négativement, et de dimensions nanométriques. La charge de surface négative réduit la probabilité d'absorption cellulaire des particules 2,3. Les particules de dimension nanométrique de faciliter le passage à travers les voies aériennes distales. Pour atteindre cet objectif, la quantité de DS utilisé dans cette préparation est supérieure à CS (rapport pondéral 3: 1); et de haute masse moléculaire DS (moyenne en poids MW 500 000) et de faible poids moléculaire CS (gamme de 50 à 190 MW kDa, 75-85% désacétylé) sont utilisés.
SDF-1α est un facteur de ralliement de cellules souches, qui exerce la fonction de référencement à travers son activité chimiotactique. SDF-1α joue un rôle important dans la prise d'origine et le maintien des cellules souches hématopoïétiques dans la moelle osseuse, et dans le recrutement de progecellules Nitor à tissus périphériques à la réparation des lésions de 4,5. SDF-1α a un site de liaison à l'héparine dans la séquence de la protéine, ce qui permet à la protéine de se lier à l'héparine / sulfate d'héparane, former des dimères, être protégés contre la protéase (CD26 / DPPIV) inactivation, et d'interagir avec des cellules cibles par l'intermédiaire des récepteurs de surface cellulaire 6-8. DS a des propriétés structurelles similaires à celles de l'héparine / héparane-sulfate; Ainsi, la liaison du SDF-1α pour DS serait similaire à celui de ses ligands polymères naturels.
Dans le protocole suivant, nous décrivons la préparation de nanoparticules SDF-1α-DS-CS. Les procédures représentent l'une des formules qui ont été précédemment étudiés 9. Le protocole est à l'origine adapté d'une enquête de nanoparticules VEGF-DS-CS 10. Une petite préparation à grande échelle est décrite, qui peut être facilement mise à l'échelle avec les mêmes solutions d'achat d'actions et les conditions de préparation. Après la préparation, les particules sont caractérisées by examiner leur taille, le potentiel zêta, degré d'incorporation SDF-1α, in vitro temps de libération, et l'activité du SDF-1α incorporé.
Protocole
1. Préparation de SDF-1α Glycan nanoparticules
En raison de la fin de la livraison in vivo, stériliser tous les récipients, pipettes et embouts utilisés dans la préparation.
- Préparer les solutions d'achat d'actions suivantes dans UltraPure Eau: 1% de sulfate de dextran; 1 M NaOH (stérile filtrée par une membrane PES); 0,1% de chitosane à 0,2% d'acide acétique glacial (0,8 filtre à travers des filtres de 0,22 um et de façon consécutive et ajuster le pH à 5,5 avec du NaOH après); ZnSO 4 0,1 M; 15% de mannitol; et 0,92 mg / ml SDF-1α (stockée en aliquotes à 80 ° C, et maintenu à 4 ° C, une fois décongelés).
- Stériliser les solutions mères de 0,22 um membranes filtrantes. Évaluer les niveaux d'endotoxines dans la solution préparée avec dosage lysat d'amibocytes de limule (LAL) gel de caillot. Veiller à ce que les niveaux sont <0,06 EU / ml.
- Ajouter 0,18 ml UltraPure eau pour un flacon en verre de 1,5 ml contenant une barre d'agitation magnétique. Réglez la vitesse d'agitation à 800 tpm. Ajouter 0,1 ml 1%le sulfate de dextrane et agiter pendant 2 min. Ajouter 0,08 mg SDF-1α (0,087 ml de 0,92 mg / ml SDF-1α solution) et agiter pendant 20 min.
- Ajouter 0,33 ml 0,1% goutte à goutte de chitosane et remuer pendant 5 min. Modifier la vitesse d'agitation au maximum et ajouter 0,1 ml de 0,1 M de ZnSO 4 lentement avec une seringue 0,1 ml (plus de 1 min).
- La vitesse d'agitation revenir à 800 tpm et remuer pendant 30 min. Ajouter 0,4 ml 15% de mannitol et remuer pendant 5 min. Transférer le mélange réactionnel dans un tube de microcentrifugation de 1,5 ml. Centrifuger à 16 000 xg à 4 ° C pendant 10 min.
Remarque: La présence de mannitol facilite la remise en suspension des particules après centrifugation. En fonction de la compacité de la pastille, la concentration en mannitol peut varier de 0% à 5%. Remise en suspension des particules après chaque centrifugation est essentielle pour éviter des agrégats dans la suspension finale. - Aspirer le surnageant et utiliser une pipette pour enlever la dernière goutte de liquide lentement. Ajouter 0,2 ml 5% de mannitol. Suspendre le culot avec 0,5 ml, 29 G neeseringue dle. Ajouter 1 ml 5% de mannitol. Centrifuger à 16 000 g pendant 15 min.
- Répétez l'étape 1.6.
- Aspirer le surnageant. Reprendre le culot dans 0,2 ml 5% de mannitol. Conservez la suspension de particules à 4 ° C.
Remarque: La suspension de particules peut également être conservé congelé à -80 ° C ou lyophilisé. Dont 5% de mannitol dans la suspension est essentiel pour empêcher l'agrégation des particules après congélation et décongélation ou après lyophilisation et réhydratation. Le mannitol peut être éliminé par centrifugation de la suspension après le stockage.
2. Mesure de la taille des particules et potentiel Zeta
La taille des particules et le potentiel zêta sont analysées par diffusion de lumière dynamique et électrophorétique diffusion de la lumière, respectivement, avec un analyseur de particules indiqué dans la liste de matériaux.
- Définissez les paramètres suivants pour la mesure de la taille des particules: temps d'accumulation: 70; Répéter fois: 4; Température: 25 ° C;Diluant: eau; réglage de l'intensité: auto.
- Diluer l'échantillon SDF-1α-DS-CS avec de l'eau (10 dilution). Charger 100 pl de l'échantillon dans une cuvette UV jetable tel qu'une cuvette Eppendorf. Insérer la cuve dans le porte-cellule. Attendez que le réglage de l'intensité pour atteindre "Optimum" (~ 10 000 cps). Lancer l'acquisition de données.
- Une fois la mesure terminée, enregistrer les résultats de cumulants diamètre (nm) et l'indice de polydispersité. La moyenne des résultats obtenus à partir de chacune des quatre lectures répétées et calculer l'écart-type.
- Charge 500 ul de l'échantillon de particules dilué 10 fois à une cellule d'écoulement pour la mesure du potentiel zêta. Définissez les paramètres suivants pour la mesure: temps d'accumulation: 10; Répéter fois: 5; Température: 25 ° C; Diluant: eau; réglage de l'intensité: auto. Consigner les résultats de la potentiel zêta (mV). Moyenne, le résultat obtenu par chacune des cinq lectures répétées, et calculer la norme deviation.
3. Quantification des SDF-1α dans les particules
- Diluer forme libre SDF-1α à des concentrations de 0,01, 0,02, 0,03, 0,04 et 0,05 mg / ml dans un tampon d'échantillon Laemmli 1.3x. Diluer 6 pi échantillons SDF-1α-DS-CS avec 40 ul 1.3x tampon d'échantillon Laemmli. (Préparer 4x Laemmli stocks tampon contenant 0,25 M Tris-HCl, pH 7,5, 8% de SDS, 40% de glycérol, 0,05 mg / ml de bleu de bromophénol, et 8% de 2-mercaptoéthanol. Divisez la solution mère dans de petites fractions et de garder à -20 ° C à usage unique.)
- Chauffer les échantillons à 100 ° C pendant 10 min. Vortex les échantillons deux fois (chacun pendant 10 secondes à la vitesse maximale) pendant le temps de chauffage de 10 min pour dissocier les particules complètement. Refroidir les échantillons à température ambiante pendant 2 min. Centrifuger à 10 000 g pendant 0,5 à 1 min pour faire baisser le condensat de l'eau. Vortex à nouveau pour bien mélanger.
Remarque: À ce stade, la solution de l'échantillon doit être clair sans précipité visible présente. - Charge 10 &# 181; l 'échantillon / puits d'un gel de SDS à 4-20%. Exécutez électrophorèse à 200 V pendant 20 min. Colorer le gel avec Coomassie protéines bleuissement.
- Examiner la densité de la bande de protéine de SDF-1α en utilisant un logiciel d'imagerie et d'analyse de densitométrie moléculaire. Calculer la quantité de SDF-1α dans les particules contre une courbe standard construite aux normes SDF-1α gratuits.
4. Dosage de libération in vitro
- Mélanger des particules de glycane SDF-1α avec une solution saline tamponnée au phosphate de Dulbecco sans calcium et magnésium (D-PBS) à un rapport 1: 1 (v / v).
- Divisez la suspension de particules dans 0,05 ml aliquotes dans 1,5 ml tubes. Charger les échantillons au fond des tubes. Éviter l'introduction de bulles d'air ou de troubler la surface du liquide. Sceller le haut des tubes avec du parafilm.
Remarque: Ce faisant, le liquide reste au fond lors de la rotation de haut en bas sur le mélangeur ultérieur du tube. - Tournez les tubes à 37 ans &# 176; C sur une rotation Micro-Tube Mixer. Enlever des parties aliquotes des tubes aux moments désignés et centrifuger les échantillons immédiatement à 16 000 xg pendant 10 min à 4 ° C.
- Séparer les surnageants et granulés, et reconstituer le culot avec 0,05 ml de D-PBS. Conserver les échantillons à -20 ° C. Après que tous les échantillons sont prélevés, examiner les surnageants et culots sur un gel de SDS comme décrit ci-dessus.
5. Migration Assay
Ce test mesure l'activité chimiotactique des SDF-1α. Interaction de SDF-1α avec son récepteur (CXCR4) sur la surface de la cellule provoque la migration de la cellule en direction du gradient SDF-1α. Dans ce dosage, les cellules sont chargées dans un puits supérieur (séparés par une membrane semi-perméable à partir d'un puits inférieur) solution SDF-1α et dans une bien moindre.
- Diluer SDF-1α (libre ou liée à la particule forme) avec le tampon de migration (milieu RPMI-1640 contenant 0,5% d'albumine de sérum bovin) dans un trois-fold dilution en série à des concentrations finales de 100, 33, 11, 3,7, 1,2, 0,41, 0,14, et 0,05 ng / ml.
- Ajouter 0,6 ml de la solution SDF-1α dilué ou tampon de migration uniquement (contrôle négatif) à un puits dans la plaque de 24 puits. Ajouter 0,57 ml de tampon de migration vers un puits (contrôle de la cellule d'entrée). Incuber à 37 ° C pendant 30 min. Placer un perméable insert de culture cellulaire tel que Transwell (taille des pores 5 um, diamètre 6,5 mm) au-dessus du puits inférieur. Charge 0,1 ml des cellules de Jurkat (5 × 10 5) dans l'insert Transwell. Chargez 0,03 ml de cellules directement à la commande de cellules d'entrée ainsi. Incuber la plaque à 37 ° C pendant 2 heures dans un incubateur à CO2 à 5%.
- Retirez les inserts Transwell. Transférer les cellules qui ont migré vers les puits inférieurs à un tube 4 ml de polystyrène. Comptez le nombre de cellules ayant migré avec un cytomètre de flux.
- Calculer la migration en pourcentage du nombre de cellules d'entrée (nombre de cellules dans le contrôle de la cellule d'entrée et x 100/30) après soustraction des nombres dans negative contrôles (cellules ayant migré dans les puits contenant tampon de migration uniquement).
Résultats
La taille et le potentiel zéta des particules SDF-1α-DS-CS préparés sont déterminées avec un analyseur de particules. La figure 1 montre l'analyse de la mesure de la taille. A partir des résultats obtenus à partir des cumulants quatre mesures répétées, le diamètre hydrodynamique moyen des particules SDF-1α-DS-CS est 661 ± 8,2 (nm) et la polydispersité est de 0,23 ± 0,02. Le résultat de la mesure du potentiel zêta est représenté sur la Figure 2. A partir des cinq mesures répétées, le potentiel zêta des particules SDF-1α-DS-CS est -24,8 ± 0,5 mV. Comme mentionné plus haut, la présence de 5% de mannitol dans la suspension de particules SDF-1α-DS-CS est essentiel pour la prévention de l'agrégation de particules pendant un processus de congélation et de décongélation. La figure 3 représente la mesure de la taille des particules en suspension dans l'eau et congelées à -80 ° C. Un pic d'agrégation distincte est visible après décongélation.
Le amount de SDF-1α dans les particules SDF-1α-DS-CS est estimé par électrophorèse sur gel de SDS. La figure 4A montre une bleui gel SDS Coomassie aux normes de SDF-1α, DS-CS nanoparticules (particules de contrôle sans incorporation SDF-1α , Ctrl NP) et SDF-1α-DS-CS nanoparticules (SDF-1α NP) échantillons chargés. Une courbe d'étalonnage est construite à partir de l'analyse de la densité des bandes standards SDF-1α (figure 4B). Calcul à partir de la courbe standard indique que la concentration SDF-1α dans l'échantillon NP SDF-1α est de 0,03 mg / ml (moyenne de double). Étant donné que la dilution de l'échantillon avec le tampon d'échantillon est (6 + 40) / 6, la concentration de l'échantillon initial est de 0,23 mg / ml. Comme le volume final de la préparation des particules est de 0,2 ml, SDF-1α totale dans la suspension finale est de 0.046 mg. Compte tenu de la masse d'entrée de SDF-1α dans le mélange réactionnel est de 0,08 mg, l'efficacité de piégeage de SDF-1α dans les particules DS-CS est de 57%. ChitOsan a déjà été signalé pour colorer au bleu de Coomassie. La coloration, cependant, ne est pas significative dans le gel représenté sur la figure 4A. Il est peut-être liée à la quantité de chitosane (matrice de particules) chargé sur le gel. Dans tous les cas, une dissociation complète et à la séparation de SDF-1α partir de la matrice de particules est nécessaire pour évaluer avec précision la quantité de la protéine incorporée. Ce gel montre également que SDF-1α est pas détectable dégradée par chauffage à 100 ° C pendant 10 min ou par le processus de vortex, comme aucune bande se trouvent entre le SDF-1α bande de protéine et le front de colorant.
Le taux en vitro de libération de SDF-1α des nanoparticules est déterminée par incubation des particules dans 50% de D-PBS à 37 ° C pendant 7 jours. À 0 h, 3 h, 8 h, 24 h, 48 h et 7 jours, des aliquotes des échantillons sont retirés et immédiatement centrifugé. Le SDF-1α publié (dans le surnageant) est séparée de la SD liée aux particulesF-1α (pastille). Les échantillons sont passés sur un gel SDS, et la quantité de SDF-1α dans les surnageants et culots sont déterminés par coloration de Coomassie et analyse de densitométrie. Un gel SDS typique de l'analyse est représenté sur la figure 5. Comme démontré, la particule liée SDF-1α est très peu libéré après une incubation de 7 jours.
L'activité du SDF-1α fixés sur des particules est mesurée par un test de migration (essai chimiotactique), et par rapport à celui de la libre SDF-1α. Dans cet essai, SDF-1α dans les nanoparticules DS-CS est dilué en série avec un tampon de migration, et on incube avec des cellules Jurkat pendant 2 heures. Les cellules ayant migré sont comptées avec un cytomètre de flux. Les données (avec des concentrations de SDF-1α de 0,05 à 11 ng / ml) sont tracées avec raccord régression non linéaire, et la CE 50 est calculé. Comme le montre la figure 6, le SDF-1α fixés sur des particules induit dans la même mesure que celui de la migration d'une connexion SDF-1 ^5; à toutes les concentrations mesurées. Les valeurs de CE 50 des formes libres et liés aux particules de SDF-1α sont 0,55 et 0,45 ng / ml, respectivement.

Figure 1. Analyse écran tourné montrant mesure dynamique de diffusion de la lumière de la taille des particules. Les deux panneaux supérieurs montrent les parcelles de la fonction d'auto-corrélation, G2 (τ), et logarithme de [G2 (τ) -1] au fil du temps. Le processeur de signal numérique de l'instrument (corrélateur) exprime l'intensité lumineuse détectée en fonction du temps de retard (τ de). Le graphique montre que les particules SDF-1α-DS-CS causé une décroissance exponentielle de l'intensité entre 0,2 à 2 ms. Pour obtenir la constante de décroissance moyenne <Γ>

Figure 2. Analyse écran tourné montrant électrophorétique diffusion de la lumièremesure du potentiel zêta des particules. Le panneau supérieur montre un G2 (τ) sur parcelle de temps. La fonction d'oscillation progressivement décomposition est généralement observée dans les particules chargées qui sont soumis à une électrophorèse et de diffusion de la lumière. La fonction reflète le décalage de fréquence (effet Doppler) causée par les particules en mouvement dans le domaine électrique. Une transformation de Fourier de G2 (τ) donne le spectre de puissance (intensité vs tracé de fréquence) montré dans le panneau du milieu. Le centre de la crête de fréquence de changement de vitesse définit la mobilité des particules, à partir de laquelle le potentiel zêta est calculée. Le potentiel zêta calculée est affichée en bas de l'écran.
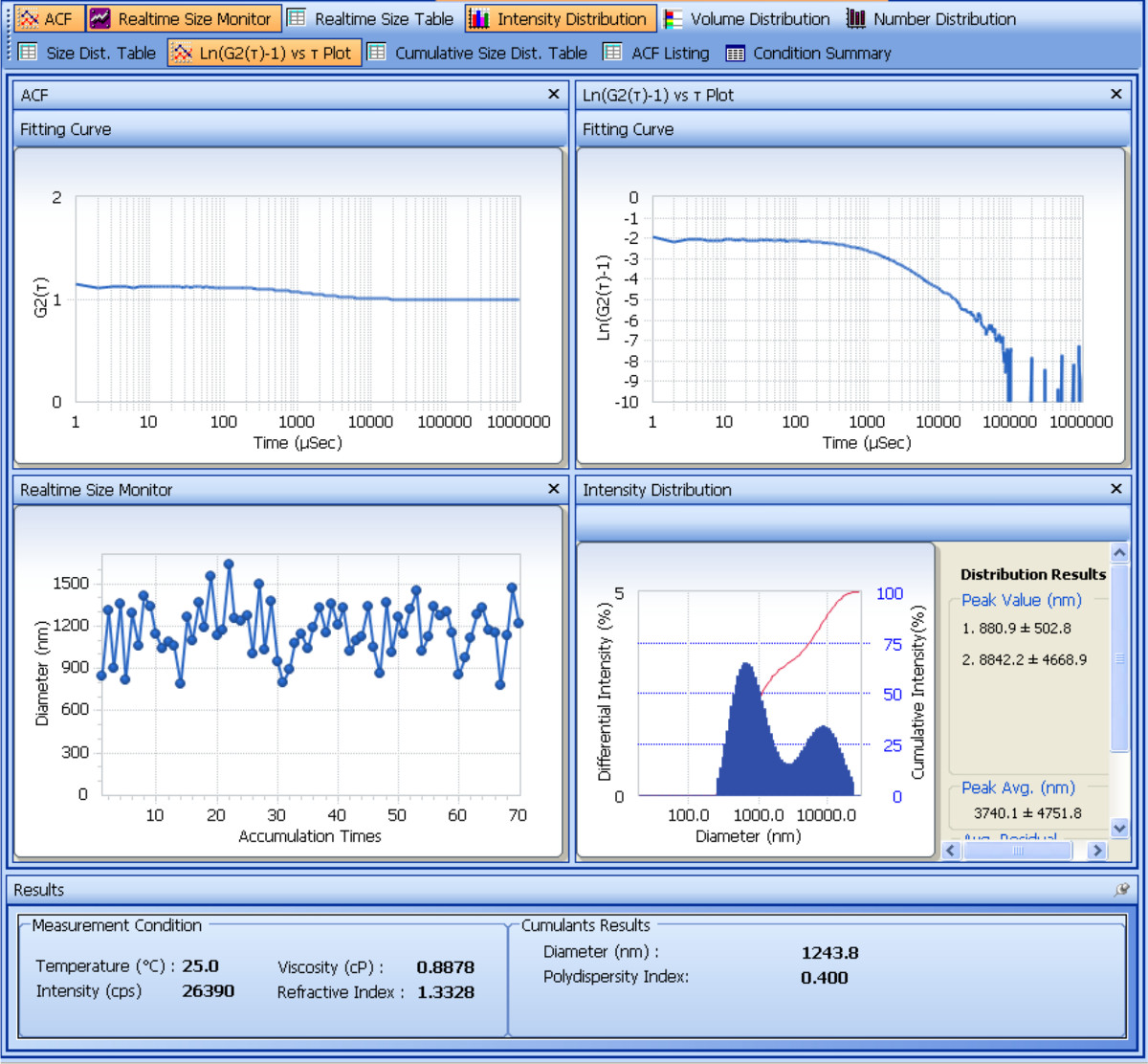
Figure 3. mesure de la taille des particules de SDF-1 des particules α-DS-CS après congélation et décongélation dans l'eau. En l'absence de mannitol, les particules forment aggregates après congélation et décongélation. Notez la formation d'une intensité supplémentaire / pic taille et l'augmentation de diamètre et une polydispersité de cumulants par rapport à celle de la figure 1.

Figure 4. Quantification de SDF-1 α incorporation dans des nanoparticules DS-CS. (A) Photographie de gel SDS Coomassie teinté chargé de normes libres SDF-1α, DS-CS nanoparticules (Ctrl NP), et SDF-1α-DS CS nanoparticules (SDF-1α NP) échantillons comme indiqué. Les bandes de protéine SDF-1α et le gel colorant marche avant sont marqués. Les échantillons Ctrl NP ne sont pas colorées au bleu de Coomassie et les bandes de chitosane (de large) sont vaguement visible. (B) Les bandes sont analysées à l'aide d'un densitomètre, à partir de laquelle la courbe d'étalonnage est construite avec les normes de SDF-1α libres (moyenne de Duplicate). La quantité de SDF-1α dans les nanoparticules est calculé à l'encontre de la courbe étalon, ce qui donne une valeur moyenne de 0,3 ug / puits (10 pl).

Figure 5. SDS gel montrant SDF-1 α in vitro cours du temps de libération. Coomassie-gel coloré SDS montre la quantité de publié SDF-1α (dans le surnageant) et lié SDF-1α (en granulés) après incubation de SDF-1α-DS nanoparticules -CS à 37 ° C pour diverses périodes de temps. Re-imprimée avec la permission de neuf.

6. courbes dose-réponse Figure de SDF-1 α (cercles) et SDF-1α nanoparticules (NP) (carrés) dans un test de migration des cellules Jurkat. SDF-1α à la fois libre et à destination de nanoparticulesms présentait la même activité avec la CE 50 valeurs de 0,55 et 0,45 ng / ml, respectivement. Re-imprimée avec la permission de neuf.
Discussion
Comme mentionné ci-dessus, les nanoparticules DS-CS sont formés par neutralisation de la charge entre le polyanion (DS) et de polycation (CS) molécules. Étant donné que l'interaction de charge se produit facilement pendant la collision moléculaire, la concentration des solutions de polymère et la vitesse d'agitation au cours du mélange est critique pour la taille des particules résultantes. Une tendance générale est que plus dilué DS et CS solutions 15 et le résultat de la vitesse d'agitation plus élevé en particules plus petites.
La formulation des nanoparticules SDF-1α glycane peut être modifiée. Par exemple, les montants et les ratios de SDF-1α / DS / CS utilisés dans ce protocole sont 0,08 / 0,33 / 1 (mg / mg / mg), respectivement. En fonction de l'utilisation prévue de nanoparticules SDF-1α, ces rapports peuvent changer. Si la quantité de SDF-1α ajoutée au mélange est de 0,04 mg (0,04 / 0,33 / 1, mg / mg / mg) au lieu de 0,08 mg, les particules seront plus petites, ~ 650 nm, et l'efficacité de piégeage SDF-1α légèrement grand, 70-80% 9. Cependant, lors de la livraison in vivo, une plus grande quantité de la matrice de glycane est présent par SDF-1α. Si une taille de particule plus petite est souhaitée, la formulation de nanoparticules glycanniques SDF-1α peut encore être modifié. Une alternative consiste à utiliser un chitosan de plus petit poids moléculaire, tel que démontré dans 15 Réf. Il convient de noter, cependant, que le chitosane a une forte affinité pour l'endotoxine (lipopolysaccharide chargé négativement); Ainsi, un test de niveau d'endotoxine ou potentiellement une purification est nécessaire à l'utilisation de produits de chitosane avant l'administration in vivo. La deuxième solution est de charger SDF-1α sur de petites nanoparticules DS-CS pré-formées. Étant donné que celui-ci peut être manipulé plus facilement la taille des particules et SDF-1α a une affinité élevée pour DS, en chargeant une petite quantité de SDF-1α à l'enveloppe externe des particules DS-CS peut se traduire par de plus petites particules.
Par rapport aux autres types denanoparticules (par exemple, 11 PLGA, polyanhydride 12, ou de la gélatine 13 nanoparticules), les nanoparticules DS-CS ont des avantages et de limitations particulières. Les principaux avantages de nanoparticules DS-CS sont les suivants: 1) la préparation de particules ne implique pas de solvants organiques ou sonication vigoureuse. Il est donc approprié pour facteur protéique constitution, comme une préparation douce réduit la probabilité de protéines inactivation; 2) la matrice des particules a une propriété de structure similaire à celle de la matrice extracellulaire, ce qui rend les particules compatibles avec l'environnement des tissus et est moins toxique et inflammatoire; et 3) glycanes imite SDF-1α liés aux particules une relation de liaison naturel entre la protéine et la matrice extracellulaire, ce qui explique l'activité chimiotactique pleine de SDF-1α après avoir été incorporé dans les particules glycanes. Le SDF-1α pleinement actif sous la forme de particules lié lui permet de servir comme un facteur de ralliement fixe dans les tissus environnement. Les limites des nanoparticules DS-CS sont les suivants: 1) les diamètres des particules sont en général plus grands que les particules mentionnées ci-dessus; et 2) se effondrer facilement dans des solutions salines, qui peuvent ne pas convenir à injection directe dans la circulation sanguine.
Le SDF-1α fixés sur des particules se avère très peu libéré des nanoparticules après une incubation de sept jours. Ce phénomène est lié à la forte affinité de SDF-1α pour l'héparine, ce qui contribue également à sa fonction in vivo. Puisque les protéines avec des domaines de liaison à l'héparine auront généralement des affinités différentes pour l'héparine, leur taux d'émission risquent de diverger. Par exemple, dans un VEGF 165 -DS-CS nanoparticule préparé dans une formulation similaire, 44% du VEGF incorporé 165 a été libéré dans la première heure et 29% a été libéré dans les 47 heures suivantes pendant l'incubation à 37 ° C 14. Par conséquent, le profil de libération in vitro pour une prot spécifiqueein doit être testé individuellement.
Le but de la préparation des nanoparticules SDF-1α-DS-CS est de fournir SDF-1α au poumon et établir un signal de ralliement de cellules souches dans le tissu. Les particules peuvent également être délivrés à d'autres tissus dans le même but, bien que le format de nanoparticules spécifique ne est pas requise pour l'injection de tissu solide. Le fait que le SDF-1α est stabilisée par DS dans la matrice de nanoparticules et est très peu libéré des particules appuie tige principes de recrutement cellulaire, et la particule devrait être bénéfique pour la régénération tissulaire.
Etant donné que les nanoparticules de protéine-glycane ont une matrice similaire à celle des glycosaminoglycanes de surface des cellules et la matrice extracellulaire, il est possible que les protéines de particules incorporées peuvent être échangées dans ces matrices (Les molécules de la matrice extracellulaire chargés négativement peuvent concurrencer la liaison du positivement protéine chargée) in vivo . Cet échange peut modifier les protéines cinétique de libération, et, par conséquent, doit être étudiée plus après la première dans la caractérisation in vitro.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
Ce travail a été financé par des subventions du NIH: HL671795, HL048743 et HL108630.
matériels
| Name | Company | Catalog Number | Comments |
| Dextran sulfate | Fisher | BP1585-100 | |
| Chitosan, low molecular weight | Sigma | 448869 | |
| Zinc sulfate heptahydrate | Sigma | 204986 | |
| D-Mannitol | Sigma | M9546 | |
| UltraPure water | Invitrogen | 10977-023 | |
| SDF-1α | Prepared according to reference 8. | ||
| Syringe filter, PES membrane 0.22 μm | Millipore | SLGP033RS | |
| Magnetic Micro Stirring Bars (2 x 7 mm) | Fisher | 14-513-63 | |
| Glass vial Kit; SUN-SRi | Fisher | 14-823-182 | |
| Delsa Nano C Particle Analyzer | Backman Coulter | ||
| Eppendorf UVette Cuvets | Eppendorf | 952010069 | |
| 4–20% Mini-PROTEAN TGX Gel | Bio-Rad | 456-1096 | |
| GelCode Blue Safe Protein Stain | Fisher | PI-24592 | |
| Molecular Imager VersaDoc MP 4000 System | BioRad | 170-8640 | |
| Corning Transwell Permeable Supports | Corning | 3421 | |
| Accuri C6 Flow Cytometer | BD Biosciences | ||
| Dulbecco’s phosphate buffered saline | Sigma | D8537 | |
| Pyrogent plus kit | Fisher | NC9753738 |
Références
- Delair, T. Colloidal polyelectrolyte complexes of chitosan and dextran sulfate towards versatile nanocarriers of bioactive molecules. Eur J Pharm Biopharm. 78 (1), 10-18 (2011).
- Morachis, J. M., Mahmoud, E. A., Almutairi, A. Physical and chemical strategies for therapeutic delivery by using polymeric nanoparticles. Pharmacol Rev. 64 (3), 505-519 (2012).
- Yue, Z. G., et al. Surface charge affects cellular uptake and intracellular trafficking of chitosan-based nanoparticles. Biomacromolecules. 12 (7), 2440-2446 (2011).
- Ghadge, S. K., Muhlstedt, S., Ozcelik, C., Bader, M. SDF-1alpha as a therapeutic stem cell homing factor in myocardial infarction. Pharmacol Ther. 129 (1), 97-108 (2011).
- Sharma, M., Afrin, F., Satija, N., Tripathi, R. P., Gangenahalli, G. U. Stromal-derived factor-1/CXCR4 signaling: indispensable role in homing and engraftment of hematopoietic stem cells in bone marrow. Stem Cells Dev. 20 (6), 933-946 (2011).
- Sadir, R., Baleux, F., Grosdidier, A., Imberty, A., Lortat-Jacob, H. Characterization of the stromal cell-derived factor-1alpha-heparin complex. J Biol Chem. 276 (11), 8288-8296 (2001).
- Amara, A., et al. Stromal cell-derived factor-1alpha associates with heparan sulfates through the first beta-strand of the chemokine. J Biol Chem. 274 (34), 23916-23925 (1999).
- Sadir, R., Imberty, A., Baleux, F., Lortat-Jacob, H. Heparan sulfate/heparin oligosaccharides protect stromal cell-derived factor-1 (SDF-1)/CXCL12 against proteolysis induced by CD26/dipeptidyl peptidase IV. J Biol Chem. 279 (42), 43854-43860 (1074).
- Yin, T., et al. SDF-1alpha in glycan nanoparticles exhibits full activity and reduces pulmonary hypertension in rats. Biomacromolecules. 14 (11), 4009-4020 (2013).
- Huang, M., Vitharana, S. N., Peek, L. J., Coop, T., Berkland, C. Polyelectrolyte complexes stabilize and controllably release vascular endothelial growth factor. Biomacromolecules. 8 (5), 1607-1614 (2007).
- McCall, R. L., Sirianni, R. W. PLGA nanoparticles formed by single- or double-emulsion with vitamin E-TPGS. J Vis Exp. (82), 51015(2013).
- Carrillo-Conde, B. R., Roychoudhury, R., Chavez-Santoscoy, A. V., Narasimhan, B., Pohl, N. L. High-throughput synthesis of carbohydrates and functionalization of polyanhydride nanoparticles. J Vis Exp. (65), 3967(2012).
- Xu, J., Amiji, M. Therapeutic gene delivery and transfection in human pancreatic cancer cells using epidermal growth factor receptor-targeted gelatin nanoparticles. J Vis Exp. (59), e3612(2012).
- Lauten, E. H., et al. Nanoglycan complex formulation extends VEGF retention time in the lung. Biomacromolecules. 11 (7), 1863-1872 (2010).
- Schatz, C., Domard, A., Viton, C., Pichot, C., Delair, T. Versatile and efficient formation of colloids of biopolymer-based polyelectrolyte complexes. Biomacromolecules. 5 (5), 1882-1892 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon