Method Article
Herstellung und Charakterisierung von SDF-1α-Chitosan-Nanopartikel Dextransulfat
In diesem Artikel
Zusammenfassung
The objective of this protocol is to incorporate SDF-1α, a stem cell homing factor, into dextran sulfate-chitosan nanoparticles. The resultant particles are measured for their size and zeta potential, as well as the content, activity, and in vitro release rate of SDF-1α from the nanoparticles.
Zusammenfassung
Chitosan (CS) and dextran sulfate (DS) are charged polysaccharides (glycans), which form polyelectrolyte complex-based nanoparticles when mixed under appropriate conditions. The glycan nanoparticles are useful carriers for protein factors, which facilitate the in vivo delivery of the proteins and sustain their retention in the targeted tissue. The glycan polyelectrolyte complexes are also ideal for protein delivery, as the incorporation is carried out in aqueous solution, which reduces the likelihood of inactivation of the proteins. Proteins with a heparin-binding site adhere to dextran sulfate readily, and are, in turn, stabilized by the binding. These particles are also less inflammatory and toxic when delivered in vivo. In the protocol described below, SDF-1α (Stromal cell-derived factor-1α), a stem cell homing factor, is first mixed and incubated with dextran sulfate. Chitosan is added to the mixture to form polyelectrolyte complexes, followed by zinc sulfate to stabilize the complexes with zinc bridges. The resultant SDF-1α-DS-CS particles are measured for size (diameter) and surface charge (zeta potential). The amount of the incorporated SDF-1α is determined, followed by measurements of its in vitro release rate and its chemotactic activity in a particle-bound form.
Einleitung
Dextransulfat (DS) und Chitosan (CS) sind Polysaccharide mit mehreren substituierten negativ geladenen Sulfatgruppen (DS) oder positiv geladenen Amingruppen (deacetyliert CS). Wenn in einer wässrigen Lösung gemischt, die zwei Polysacchariden Polyelektrolytkomplexe durch elektrostatische Wechselwirkungen. Die resultierenden Komplexe können große Aggregate, die aus der wässrigen Lösung (Präzipitate)-Phase abgetrennt werden, oder kleine Teilchen, die in Wasser dispergierbare (Kolloide) sind zu bilden. Die spezifischen Bedingungen, die zu diesen Ergebnissen beigetragen haben, wurden ausführlich untersucht und wurden zusammengefasst und in einer aktuellen Bewertung 1 im Detail dargestellt. Unter diesen Bedingungen sind die entgegengesetzt geladenen Polymere müssen 1) deutlich unterschiedliche Molmasse zwei grundlegende Anforderungen für die Herstellung von in Wasser dispergierbaren Teilchen; und 2) in einem nicht-stöchiometrischen Verhältnis vermischt werden. Diese Bedingungen werden die ladungsneutrale komplexierten Polymersegmente durch Ladungs erzeugt erlaubenNeutralisation zu trennen und bilden den Kern des Teilchens, und das überschüssige Polymer an der Außenschale 1 bilden. Die in diesem Protokoll beschrieben Glykan Partikel zur pulmonalen Verabreichung von Nanometerdimensionen bestimmt und sind entworfen net werden negativ geladen, und. Die negative Oberflächenladung verringert die Wahrscheinlichkeit der zellulären Aufnahme der Teilchen 2,3. Partikel von Nanometerdimension erleichtern den Durchgang durch die distalen Atemwege. Um dieses Ziel zu erreichen, ist die Menge des DS in dieser Zubereitung von mehr als CS (Gewichtsverhältnis 3: 1); und hochmolekulare DS (Gewichtsmittel MW 500.000) und Niedermolekulare CS (MW-Bereich von 50 bis 190 kDa, 75-85% deacetylierte) verwendet.
SDF-1α ist ein Stammzelle Homing Faktor, der die Referenzfahrt-Funktion durch seine chemotaktische Aktivität ausübt. SDF-1α spielt eine wichtige Rolle in der Referenzfahrt und der Wartung von hämatopoetischen Stammzellen im Knochenmark, und bei der Einstellung von progenitor Zellen peripheren Gewebe für Verletzungen Reparatur 4,5. SDF-1α hat eine Heparin-Bindungsstelle in der Proteinsequenz, die das Protein an Heparin / Heparansulfat, Dimere zu binden, aus Protease (CD26 / DPPIV) Inaktivierung geschützt werden, und mit Zielzellen in Wechselwirkung über Zelloberflächenrezeptoren ermöglicht 6-8. DS ähnliche strukturelle Eigenschaften wie Heparin / Heparansulfat; So kann die Bindung von SDF-1α DS wäre ähnlich der des natürlichen polymeren Liganden.
In dem folgenden Protokoll beschreiben wir die Herstellung von SDF-1α-DS-CS Nanopartikel. Die Verfahren stellen eine der Formulierungen, die bisher untersucht wurden, 9. Das Protokoll ist ursprünglich aus einer Untersuchung von VEGF-DS-CS-Nanopartikeln 10 angepasst. Eine kleine technische Herstellung beschrieben, die leicht mit den gleichen Stammlösungen und Herstellungsbedingungen skaliert werden kann. Nach der Herstellung werden die Teilchen b gekennzeichnety Prüfung ihrer Größe, Zetapotential, das Ausmaß der SDF-1α Einarbeitung in vitro Freigabezeit, und die Aktivität des einge SDF-1α.
Protokoll
1. Vorbereitung der SDF-1α Glycan Nanopartikel
Aufgrund der Zweck der in vivo-Abgabe, Sterilisieren alle Behälter, Pipetten und Spitzen in der Zubereitung verwendet.
- Die folgenden Stammlösungen in hochreinem Wasser: 1% Dextransulfat; 1M NaOH (steril mit einem PES-Membran gefiltert); 0,1% Chitosan in 0,2% Eisessig (Filter durch 0,8 und 0,22 um Filter nacheinander und Einstellen des pH auf 5,5 mit NaOH später); 0,1M ZnSO 4; 15% Mannit; und 0,92 mg / ml SDF-1α (in Aliquots bei -80 ° C gelagert, und bei 4 ° C gehalten wurde, einmal aufgetaut).
- Sterilisieren Stammlösungen durch 0,22 um Filtermembranen. Beurteilen Endotoxinspiegel in der hergestellten Lösung mit Limulus-Amöbozyten-Lysat (LAL) Gelklumpens Assay. Stellen Sie sicher, dass die Pegel <0,06 EU / ml.
- In 0,18 ml Reinstwasser in ein 1,5 ml-Glasfläschchen mit einem magnetischen Rührstab. Stellen Sie die Rührgeschwindigkeit auf 800 Umdrehungen pro Minute. 0,1 ml 1%Dextransulfat und rühre 2 min. Hinzufügen 0,08 mg SDF-1α (0,087 ml von 0,92 mg / ml SDF-1α-Lösung) und rühre 20 min.
- In 0,33 ml 0,1% Chitosan tropfenweise und unter Rühren für 5 min. Ändern Rührgeschwindigkeit auf die maximale und 0,1 ml 0,1 M ZnSO 4 langsam mit einer 0,1 ml Spritze (über 1 min).
- Zurückzukehren Rührgeschwindigkeit auf 800 Upm und rührt 30 min. Fügen Sie 0,4 ml 15% Mannit und rühren für 5 min. Übertragen der Reaktionsmischung auf ein 1,5 ml Mikrozentrifugenröhrchen. Zentrifugieren bei 16.000 × g bei 4 ° C für 10 min.
Anmerkung: Die Anwesenheit von Mannit erleichtert die Resuspension der Partikel nach Zentrifugation. Abhängig von der Dichte des Pellets kann Mannit Konzentration von 0% bis 5% variieren. Vollständige Resuspendierung der Partikel nach jedem Zentrifugationsschritt ist kritisch, um Aggregate in der endgültigen Suspension zu vermeiden. - Überstand wird abgesaugt und mit einer Pipette den letzten Tropfen Flüssigkeit langsam zu entfernen. 0,2 ml 5% Mannit. Hängen Sie das Pellet mit 0,5 ml, 29 G needle Spritze. 1 ml 5% Mannit. Zentrifugieren bei 16.000 xg für 15 min.
- Wiederholen Sie Schritt 1.6.
- Saugen Sie den Überstand. Das Pellet in 0,2 ml 5% Mannit. Bewahren Sie die Partikel-Suspension bei 4 ° C.
Anmerkung: Die Partikelsuspension kann auch bei -80 ° C gefroren gelagert oder lyophilisiert werden. Einschließlich 5% Mannitol in der Suspension ist wesentlich, um die Aggregation der Partikel nach dem Einfrieren und Auftauen oder nach Lyophilisierung und Rehydratisierung zu verhindern. Mannitol kann durch Zentrifugieren der Suspension nach der Lagerung entfernt werden.
2. Messung der Partikelgröße und Zetapotential
Die Teilchengröße und Zeta-Potential werden durch dynamische Lichtstreuung und Elektrophorese-Lichtstreuung, die jeweils analysiert, mit einer in der Materialliste angegeben Teilchenanalysator.
- Richten Sie die folgenden Parameter für Partikelgrößenmessung: Thesaurierung Zeiten: 70; Wiederholungszeiten: 4; Temperatur: 25 ° C;Verdünnungsmittel: Wasser; Intensitätseinstellung: auto.
- Verdünnen Sie die SDF-1α-DS-CS-Probe mit Wasser (10-fache Verdünnung). Last 100 ul der Probe auf eine wegwerfbare UV Küvette wie einem Eppendorf Küvette. Die Küvette in den Küvettenhalter einsetzen. Warten Sie auf die Intensitätseinstellung zu "Optimum" (~ 10.000 cps) zu erreichen. Starten Sie die Datenerfassung.
- Nachdem die Messung abgeschlossen ist, notieren Sie die Kumulanten Ergebnisse der Durchmesser (nm) und Polydispersitätsindex. Der Mittelwert der von jedem der vier wiederholten Ablesungen stammenden Ergebnisse und die Berechnung der Standardabweichung.
- Last 500 ul des 10-fach verdünnten Partikelprobe zu einer Durchflusszelle zum Zeta-Potential-Messung. Richten Sie die folgenden Parameter für die Messung: Thesaurierung Zeiten: 10; Wiederholzeiten: 5; Temperatur: 25 ° C; Verdünnungsmittel: Wasser; Intensitätseinstellung: auto. Aufzeichnung der Ergebnisse des Zetapotential (mV). Durchschnitt das Ergebnis von jedem der 5 wiederholten Ablesungen stammenden, und berechnen Sie die Standard deviation.
3. Quantifizierung von SDF-1α in den Teilchen
- Verdünne freier Form SDF-1α, um Konzentrationen von 0,01, 0,02, 0,03, 0,04 und 0,05 mg / ml in 1,3 x Laemmli-Probenpuffer. Verdünnen 6 ul SDF-1α-DS-CS Proben mit 40 ul 1,3x Laemmli-Probenpuffer. (Bereiten 4x Laemmli Lager-Puffer, der 0,25 M Tris-HCl, pH 7,5, 8% SDS, 40% Glycerin, 0,05 mg / ml Bromphenolblau und 8% 2-Mercaptoethanol. Teilen Sie die Stammlösung in kleine Aliquots bringen und -20 ° C zur Einzelnutzung.)
- Erhitzen Sie die Proben bei 100 ° C für 10 min. Vortex die Proben zweimal (jeweils 10 Sekunden bei maximaler Geschwindigkeit) während des 10 min Erhitzungsdauer, um die Teilchen vollständig zu dissoziieren. Kühlen Sie die Proben auf Raumtemperatur für 2 min. Zentrifuge bei 10.000 × g für 0,5-1 min hinunter die Wasserkondensat zu bringen. Vortex wieder gut mischen.
Hinweis: An dieser Stelle sollte der Probenlösung klar ohne sichtbare Niederschlag vorhanden sein. - Last 10 &# 181; l Probe / Vertiefung zu einem 4-20% SDS-Gel. Führen Elektrophorese bei 200 V für 20 min. Färben Sie das Gel mit Coomassie-Blau-Färbung Protein.
- Untersuchen Sie die Proteinbande Dichte von SDF-1α mit einem Molekular Imager und Densitometrie-Analyse-Software. Berechnen der Menge des SDF-1α in den Teilchen mit einer Standardkurve mit freiem SDF-1α-Standards konstruiert.
4. In-vitro-Freisetzungstest
- Mischungs SDF-1α Glykan Teilchen mit Dulbeccos phosphatgepufferter Salzlösung ohne Calcium und Magnesium (D-PBS) bei einem Verhältnis 1: 1 (v / v).
- Teilen Sie die Partikelsuspension in 0,05 ml-Aliquots in 1,5-ml-Röhrchen. Laden der Proben auf den Boden der Röhrchen. Einleiten von Luftblasen zu vermeiden oder die Oberfläche der Flüssigkeit zu stören. Verschließen Sie die Spitze der Röhrchen mit Parafilm.
Anmerkung: Dabei wird die Flüssigkeit am Boden während der nachfolgenden oben nach unten auf dem Drehrohrmischer sein. - Drehen Sie die Rohre auf 37 &# 176; C auf einer rotierenden Mikrorohr Mixer. Aliquots Entfernen aus den Rohren in den angegebenen Zeiten und sofort zu zentrifugieren die Proben bei 16.000 g für 10 min bei 4 ° C.
- Trennen Sie die Überstände und Pellets und Rekonstitution des Pellets mit 0,05 ml D-PBS. Lagern Sie die Proben bei -20 ° C. Nachdem alle Proben gesammelt werden, prüft die Überstände und Pellets auf einem SDS-Gel, wie oben beschrieben.
5. Migration Assay
Dieser Test misst die chemotaktische Aktivität von SDF-1α. Wechselwirkung von SDF-1α mit seinem Rezeptor (CXCR4) auf der Zelloberfläche bewirkt Migration der Zelle in Richtung der SDF-1α Gradienten. In diesem Assay werden die Zellen in einen oberen und und SDF-1α-Lösung (die durch eine semipermeable Membran von einer unteren Vertiefung getrennt) in einer unteren Vertiefung geladen.
- Verdünne SDF-1α (frei oder partikelgebundene Form) mit Migrationspuffer (RPMI-1640-Medium, das 0,5% Rinderserumalbumin) in einem 3-fold serielle Verdünnung, um Endkonzentrationen von 100, 33, 11, 3,7, 1,2, 0,41, 0,14 und 0,05 ng / ml.
- Hinzufügen von 0,6 ml der verdünnten SDF-1α Lösung oder Migrationspuffer allein (negative Kontrolle), um ein gut in der 24-Well-Platte. In 0,57 ml Migrationspuffer auf eine gut (Eingabezellensteuerung). Bei 37 ° C für 30 min. Legen Sie einen durchlässigen Zellkultureinsatzes wie Transwell (Porengröße 5 um, Durchmesser 6,5 mm) auf der Oberseite des unteren gut. Last 0,1 ml Jurkat-Zellen (5 × 10 5) in den Transwell einzufügen. Laden 0,03 ml Zellen direkt an die Eingangszelle Kontrollvertiefung. Inkubieren der Platte bei 37 ° C für 2 h in einem 5% CO 2 -Inkubator.
- Entfernen Sie die Transwell-Einsätze. Übertragen Sie die Zellen, die zu den unteren Vertiefungen in ein 4 ml Polystyrolröhrchen eingewandert sind. Zählen Sie die migrierten Zellen mit einem Durchflusszytometer.
- Migrations Berechnen als Prozentsatz der Eingangszellennummer (Zellennummer in der Eingangszelle Kontrollkavität x 100/30) nach Subtraktion der Anzahlen in negative Kontrollen (Zellen, die Vertiefungen, die nur Migrationspuffer migriert).
Ergebnisse
Die Größe und Zetapotential der vorbereiteten SDF-1α-DS-CS-Partikel mit einer Partikelanalysegerät bestimmt. Figur 1 zeigt die Analyse der Größenmessung. Aus den Ergebnissen von Kumulanten vier wiederholten Messungen erhalten wird, ist die mittlere hydrodynamische Durchmesser der SDF-1α-DS-CS Partikel 661 ± 8,2 (nm) und die Polydispersität beträgt 0,23 ± 0,02. Das Ergebnis der Zetapotentialmessung ist in Fig. 2 gezeigt Von den fünf wiederholten Messungen, das Zetapotential der SDF-1α-DS-CS Teilchen -24.8 ± 0.5 mV. Wie oben erwähnt, ist die Anwesenheit von 5% Mannitol in der SDF-1α-DS-CS Teilchensuspension wesentlich zur Verhinderung der Partikelaggregation während der Gefrier- und Auftau-Verfahren, Fig. 3 zeigt die Größenmessung der in Wasser suspendiert und bei gefrorenen Teilchen -80 ° C. Eine deutliche Aggregation Spitze sichtbar ist nach dem Auftauen.
Die amount von SDF-1α in der SDF-1α-DS-CS Teilchen wird durch SDS-Gelelektrophorese abgeschätzt. 4A zeigt ein Coomassieblau-gefärbtes SDS-Gel mit SDF-1α Standards DS-CS-Nanopartikel (Regulierungsteilchen ohne SDF-1α Einarbeitung , Strg NP) und SDF-1α-DS-CS-Nanopartikel (SDF-1α NP) Proben geladen. Eine Standardkurve wird aus der Dichteanalyse der SDF-1α Standardbänder (4B) ausgebildet sind. Berechnung aus der Standardkurve zeigt, dass das SDF-1α-Konzentration in der SDF-1α NP Probe beträgt 0,03 mg / ml (Mittelwert von Duplikat). Da das Verdünnen der Probe mit dem Probenpuffer (6 + 40) / 6 ist die ursprüngliche Probenkonzentration 0,23 mg / ml. Da das endgültige Volumen der Partikelpräparat 0,2 ml, insgesamt SDF-1α in der endgültigen Suspension von 0,046 mg. Unter Berücksichtigung der zugeführten Masse von SDF-1α in der Reaktionsmischung ist 0,08 mg, die Einschlusseffizienz von SDF-1α in den DS-CS-Teilchen beträgt 57%. Zettelosan wurde früher berichtet, mit Coomassie-Blau-Farbstoff. Die Färbung ist jedoch nicht in der in 4A gezeigten Gels signifikant. Es ist vielleicht zu der Menge an Chitosan (Teilchenmatrix) auf das Gel geladen bezogen. In jedem Fall ist eine vollständige Dissoziation und Abtrennung von SDF-1α aus der Partikelmatrix zur genauen Bestimmung der Menge des eingebrachten Proteins notwendig. Dieses Gel zeigt auch, dass SDF-1α ist nicht nachweisbar durch Erhitzen bei 100 ° C für 10 min abgebaut oder durch Wirbelprozess, da keine Banden zwischen SDF-1α-Protein-Bande, und die Farbstoff-Front vorhanden.
Die in vitro-Freisetzungsrate von SDF-1α aus den Nanopartikeln wird durch Inkubation der Partikel in 50% D-PBS bei 37 ° C für 7 Tage bestimmt. Bei 0 h, 3 h, 8 h, 24 h, 48 h und 7 Tagen werden Aliquote der Proben entnommen und sofort zentrifugiert. Das frei SDF-1α (im Überstand) von der partikelgebundenen SD abgetrenntF-1α (Pellet). Die Proben werden auf einem SDS-Gel laufen gelassen, und die Menge an SDF-1α in den Überständen und Pellets werden durch Coomassie-Färbung und Densitometrie-Analyse bestimmt. Ein typisches SDS-Gel der Analyse ist in Abbildung 5 dargestellt. Wie gezeigt, wird das Partikel gebunden SDF-1α minimal nach einer 7-tägigen Inkubation freigesetzt.
Die Aktivität des partikelgebundenen SDF-1α ist ein Migrationsassay (chemotaktischen Assay) gemessen wird, und im Vergleich zu der freien SDF-1α. In diesem Assay wird SDF-1α in den DS-CS Nanopartikel seriell mit Migrationspuffer verdünnt und mit Jurkat-Zellen für 2 Stunden inkubiert. Die migrierten Zellen mit einem Durchflusszytometer gezählt. Die Daten (mit SDF-1α-Konzentrationen von 0,05 bis 11 ng / ml) werden mit nicht-linearer Regression Fitting aufgetragen, und die EC 50 berechnet. Wie in 6 gezeigt, wird die Partikel-gebundenen SDF-1α induzierte das gleiche Ausmaß an Migration als die des freien SDF-1 ^5; bei allen Konzentrationen gemessen. Die EC 50 -Werte der freien und der Partikel-gebundenen Formen von SDF-1α sind 0,55 und 0,45 ng / ml.

Abbildung 1. Analyse Screenshot zeigt die dynamische Lichtstreuung Messung der Partikelgröße. Die beiden oberen Felder zeigen die Grundstücke der Autokorrelationsfunktion, G2 (τ) und Logarithmus [G2 (τ) -1] über die Zeit. Des Instruments digitalen Signalprozessor (Korrelator) drückt die detektierte Lichtintensität als Funktion der Verzögerungszeit (τ). Die Kurve zeigt, dass SDF-1α-DS-CS-Partikel verursacht einen exponentiellen Abfall der Intensität zwischen 0,2 bis 2 ms. Um die durchschnittliche Zerfallskonstante erhalten <Γ>

Abbildung 2. Analyse Screenshot zeigt elektrophoretischen LichtstreuungMessung von Partikel Zeta-Potential. Das obere Feld zeigt einen G2 (τ) über die Zeit Grundstück. Die allmählich abklingende oszillierende Funktion ist typischerweise in geladene Teilchen, die Elektrophorese und die Lichtstreuung unterzogen werden beobachtet. Die Funktion entspricht der Frequenzverschiebung (Doppler-Verschiebung) durch die sich bewegenden Teilchen im elektrischen Feld verursacht wird. Eine Fourier-Transformation der G2 (τ) gibt die in der Mitteltafel gezeigten Leistungsspektrum (Intensität gegen Frequenz Grundstück). Das Zentrum der Frequenzverschiebung Peak definiert die Beweglichkeit der Teilchen, aus denen das Zeta-Potential berechnet. Die berechnete Zetapotential wird an der Unterseite des Bildschirms angezeigt.
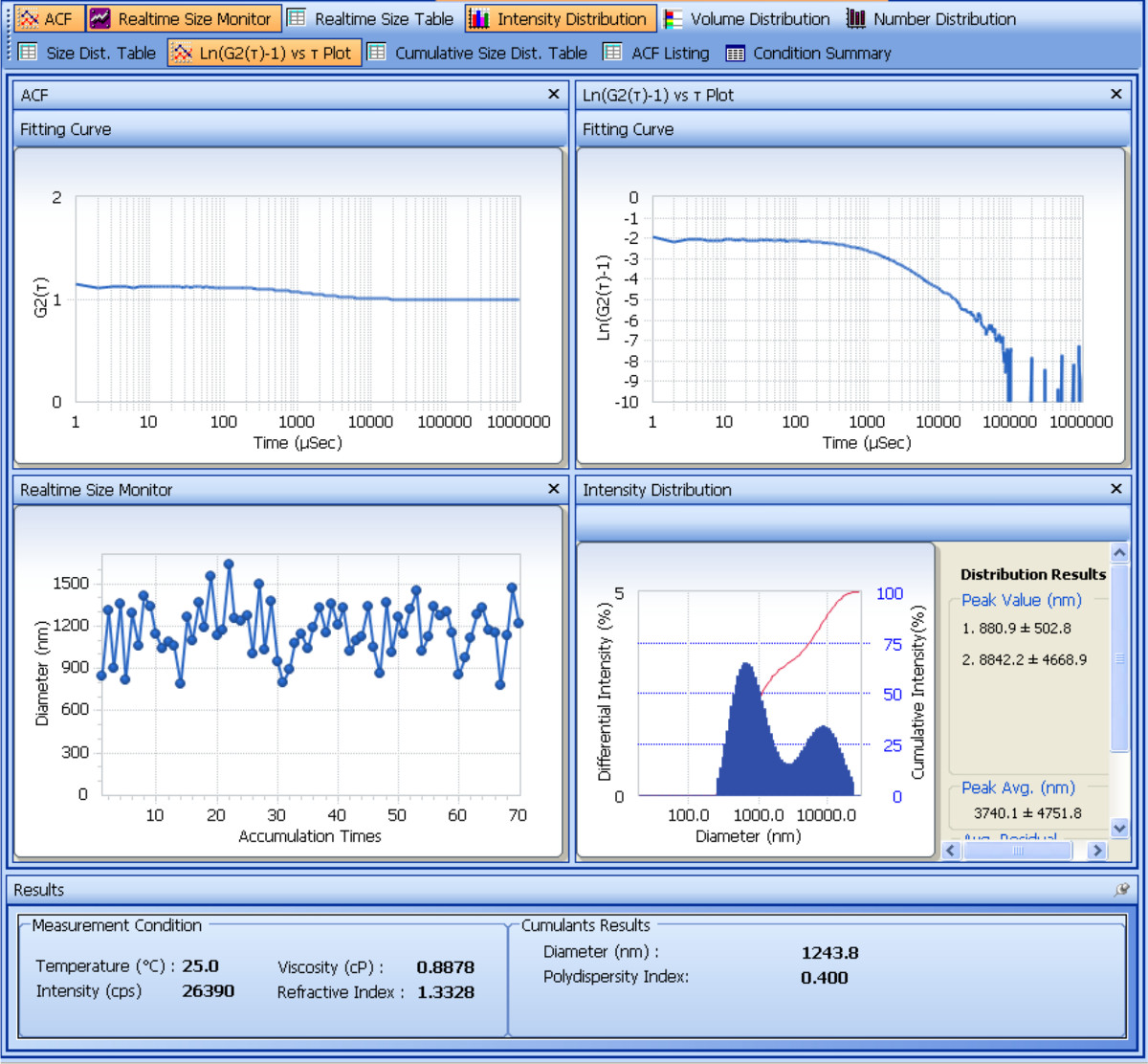
Abbildung 3. Teilchengrößenmessung von SDF-1 α-DS-CS-Teilchen nach dem Einfrieren und Auftauen in Wasser. In Abwesenheit von Mannit, bilden die Teilchen agKörnungen nach Einfrieren und Auftauen. Beachten Sie die Ausbildung einer zusätzlichen Intensitäts / size Peak und die Zunahme der Kumulanten Durchmesser und die Polydispersität im Vergleich zu der von 1.

Abbildung 4. Quantifizierung der SDF-1 α Einbau in DS-CS-Nanopartikeln. (A) Fotographie der Coomassie gefärbten SDS-Gel mit kosten SDF-1α Standards DS-CS-Nanopartikel (Strg NP) und SDF-1α-DS geladen CS-Nanopartikel (SDF-1α NP) Proben wie angegeben. Die SDF-1α Proteinbanden und das Gel läuft Farbstofffront sind gekennzeichnet. Die Strg NP Proben nicht mit Coomassie-Blau und der Chitosan-Bands (breit) sind vage sichtbar gefärbt. (B) Die Bänder werden mit einem Densitometer, aus dem der Standardkurve wird mit den freien SDF-1α Standards gebaut (durchschnittlich duplica analysiertte). Die Menge an SDF-1α in den Nanopartikeln gegen die Standardkurve, die einen Mittelwert von 0,3 & mgr; g / Vertiefung (10 ul) gibt, berechnet.

Abbildung 5. SDS-Gels, SDF-1-α in vitro Freisetzungszeitverlauf. Coomassie-gefärbten SDS-Gel zeigt die Menge an freigesetztem SDF-1α (in Überständen) und SDF-1α (Pellets) nach Inkubation von SDF-1α-DS -CS Nanopartikel bei 37 ° C für verschiedene Zeiträume. Mit freundlicher Genehmigung von 9 neu gedruckt.

Abbildung 6. Dosis-Antwort-Kurven von SDF-1 α (Kreise) und SDF-1α Nanopartikel (NP) (Quadrate) in einer Jurkat-Zellmigrationsassay. SDF-1α in sowohl freier als auch Nanopartikel zur gebundenenms zeigte die gleiche Tätigkeit mit EC 50 Werte von 0,55 und 0,45 ng / ml. Mit freundlicher Genehmigung von 9 neu gedruckt.
Diskussion
Wie oben erwähnt, werden die DS-CS Nanopartikeln durch Ladungsneutralisation zwischen Polyanion (DS) und Polykation (CS) Molekülen gebildet. Da die Ladungswechselwirkung während der Molekular Kollision leicht, die Konzentration der Polymerlösungen und die Rührgeschwindigkeit beim Vermischen von entscheidender Bedeutung für die Größe der resultierenden Teilchen. Ein genereller Trend ist, dass mehr DS und CS-Lösungen 15 und höhere Rührgeschwindigkeit Ergebnis in kleinere Partikel verdünnt.
Die Formulierung der SDF-1α Glykan Nanopartikel können variiert werden. Zum Beispiel können die Mengen und Verhältnisse der SDF-1α / DS / CS in diesem Protokoll verwendet werden 0,08 / 0,33 / 1 (mg / mg / mg) auf. Abhängig von der beabsichtigten Verwendung des SDF-1α Nanopartikel können diese Verhältnisse ändern. Wenn die Menge an SDF-1α zu der Mischung zugegeben 0,04 mg (0,04 / 0,33 / 1, mg / mg / mg) anstelle von 0,08 mg, wobei die Partikel kleiner sind, ~ 650 nm und die SDF-1α Einschlußeffizienz geringfügig größere, 70-80% 9. Wenn jedoch in vivo geliefert, eine größere Menge des Glycans Matrix pro SDF-1α vorliegen. Wenn eine kleinere Teilchengrße gewünscht wird, kann die Formulierung von SDF-1α Glykan Nanopartikeln weiter modifiziert werden. Eine Alternative ist, ein geringeres Molekulargewicht Chitosan verwenden, wie in Ref 15 gezeigt. Es sollte jedoch angemerkt werden, dass Chitosan hat eine hohe Affinität für Endotoxin (negativ geladene Lipopolysaccharide); Somit ist ein Test der Endotoxingehalt oder potentiell eine Reinigung für die Verwendung von Chitosan-Produkte vor der in-vivo-Zufuhr notwendig. Die zweite Alternative ist die SDF-1α auf vorgeformte kleinen DS-CS-Nanopartikeln zu laden. Da letztere leichter in Teilchengröße und SDF-1α manipuliert werden soll, eine hohe Affinität für DS, Laden einer kleinen Menge an SDF-1α an den äußeren Mantel der DS-CS Teilchen in kleinere Teilchen führen.
Verglichen mit anderen Arten vonNanopartikel (zB PLGA 11, Polyanhydrid 12 oder Gelatine-Nanopartikel 13), haben die DS-CS-Nanopartikel bestimmte Vor- und Nachteile. Die wesentlichen Vorteile der DS-CS-Nanopartikeln sind: 1) die Partikel Zubereitung enthält organische Lösemittel oder kräftige Beschallung nicht um. Es ist daher für die Proteinfaktor Einarbeitung als schonende Zubereitung verringert die Wahrscheinlichkeit Proteininaktivierung; 2) die Matrix der Partikel hat eine ähnliche strukturelle Eigenschaft als extrazelluläre Matrix, die mit Gewebe-Umgebung kompatibel der Partikel macht und weniger toxischen und entzündlichen; und 3) Glycan partikelgebundenen SDF-1α ahmt einen natürlichen Bindungsbeziehung zwischen dem Protein und der extrazellulären Matrix, die die volle chemotaktische Aktivität von SDF-1α, nachdem sie in die Teilchen einge Glykan erläutert. Das vollaktive SDF-1α in der partikelgebundenen Form erlaubt es, als stationäre Referenzfaktor im Gewebe e dienennvironment. Die Beschränkungen der DS-CS Nanopartikel sind: 1) die Durchmesser der Teilchen im allgemeinen grßer als die oben genannten Teilchen; und 2) leicht in Salzlösungen, die nicht für die direkte Injektion in den Blutkreislauf sein kann zusammenbrechen.
Die Partikel-gebundenen SDF-1α gefunden wird minimal von den Nanopartikeln nach einem siebentägigen Inkubation freigesetzt werden. Dieses Phänomen ist auf die hohe Affinität von SDF-1α für Heparin, das auch dazu beiträgt, seine Funktion in vivo bezogen. Da Proteine mit Heparin-bindenden Domänen in der Regel unterschiedliche Affinitäten für Heparin, ihre Freisetzungsraten wahrscheinlich abweichen. Zum Beispiel wird in einem VEGF 165 -DS- CS Nanopartikel in einer ähnlichen Formulierung hergestellt wurde, wurden 44% der einge VEGF 165 in der ersten Stunde freigesetzt und 29% wurde in der nächsten 47 Stunden bei Inkubation bei 37 ° C 14 freigegeben. Daher ist die in vitro-Freisetzungsmuster für einen bestimmten protEin muss individuell getestet werden.
Der Zweck der Aufstellung von SDF-1α-DS-CS-Nanopartikeln ist die SDF-1α in Lunge und stellen Sie eine Stammzell-Referenzsignal in das Gewebe. Die Partikel können auch auf andere Gewebe für den gleichen Zweck geliefert werden, obwohl die spezifischen Nanopartikel Format nicht für festes Gewebe Injektion erforderlich. Die Tatsache, dass SDF-1α wird von DS in der Nanopartikelmatrix stabilisiert und minimal von den Partikeln freigesetzt unterstützt Stammzellenrekrutierungsprinzipien und das Teilchen wird erwartet, vorteilhaft für die Geweberegeneration zu sein.
Da die Protein-Glycan-Nanopartikel haben eine ähnliche Matrix zu der Zelloberfläche und der extrazellulären Matrix, Glycosaminoglycane, ist es möglich, dass die Partikel-Proteine eingearbeitet in diese Matrizen ausgetauscht werden (Die negativ geladenen extrazellulären Matrixmolekülen kann mit der Bindung des positiv konkurrieren geladenen Protein) in vivo . Dieser Austausch kann die Protein-Freisetzungskinetik zu verändern, und somit muss, nach der anfänglichen in vitro-Charakterisierung weiter untersucht werden.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
HL671795, HL048743 und HL108630: Diese Arbeit wurde vom NIH Zuschüsse unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Dextran sulfate | Fisher | BP1585-100 | |
| Chitosan, low molecular weight | Sigma | 448869 | |
| Zinc sulfate heptahydrate | Sigma | 204986 | |
| D-Mannitol | Sigma | M9546 | |
| UltraPure water | Invitrogen | 10977-023 | |
| SDF-1α | Prepared according to reference 8. | ||
| Syringe filter, PES membrane 0.22 μm | Millipore | SLGP033RS | |
| Magnetic Micro Stirring Bars (2 x 7 mm) | Fisher | 14-513-63 | |
| Glass vial Kit; SUN-SRi | Fisher | 14-823-182 | |
| Delsa Nano C Particle Analyzer | Backman Coulter | ||
| Eppendorf UVette Cuvets | Eppendorf | 952010069 | |
| 4–20% Mini-PROTEAN TGX Gel | Bio-Rad | 456-1096 | |
| GelCode Blue Safe Protein Stain | Fisher | PI-24592 | |
| Molecular Imager VersaDoc MP 4000 System | BioRad | 170-8640 | |
| Corning Transwell Permeable Supports | Corning | 3421 | |
| Accuri C6 Flow Cytometer | BD Biosciences | ||
| Dulbecco’s phosphate buffered saline | Sigma | D8537 | |
| Pyrogent plus kit | Fisher | NC9753738 |
Referenzen
- Delair, T. Colloidal polyelectrolyte complexes of chitosan and dextran sulfate towards versatile nanocarriers of bioactive molecules. Eur J Pharm Biopharm. 78 (1), 10-18 (2011).
- Morachis, J. M., Mahmoud, E. A., Almutairi, A. Physical and chemical strategies for therapeutic delivery by using polymeric nanoparticles. Pharmacol Rev. 64 (3), 505-519 (2012).
- Yue, Z. G., et al. Surface charge affects cellular uptake and intracellular trafficking of chitosan-based nanoparticles. Biomacromolecules. 12 (7), 2440-2446 (2011).
- Ghadge, S. K., Muhlstedt, S., Ozcelik, C., Bader, M. SDF-1alpha as a therapeutic stem cell homing factor in myocardial infarction. Pharmacol Ther. 129 (1), 97-108 (2011).
- Sharma, M., Afrin, F., Satija, N., Tripathi, R. P., Gangenahalli, G. U. Stromal-derived factor-1/CXCR4 signaling: indispensable role in homing and engraftment of hematopoietic stem cells in bone marrow. Stem Cells Dev. 20 (6), 933-946 (2011).
- Sadir, R., Baleux, F., Grosdidier, A., Imberty, A., Lortat-Jacob, H. Characterization of the stromal cell-derived factor-1alpha-heparin complex. J Biol Chem. 276 (11), 8288-8296 (2001).
- Amara, A., et al. Stromal cell-derived factor-1alpha associates with heparan sulfates through the first beta-strand of the chemokine. J Biol Chem. 274 (34), 23916-23925 (1999).
- Sadir, R., Imberty, A., Baleux, F., Lortat-Jacob, H. Heparan sulfate/heparin oligosaccharides protect stromal cell-derived factor-1 (SDF-1)/CXCL12 against proteolysis induced by CD26/dipeptidyl peptidase IV. J Biol Chem. 279 (42), 43854-43860 (1074).
- Yin, T., et al. SDF-1alpha in glycan nanoparticles exhibits full activity and reduces pulmonary hypertension in rats. Biomacromolecules. 14 (11), 4009-4020 (2013).
- Huang, M., Vitharana, S. N., Peek, L. J., Coop, T., Berkland, C. Polyelectrolyte complexes stabilize and controllably release vascular endothelial growth factor. Biomacromolecules. 8 (5), 1607-1614 (2007).
- McCall, R. L., Sirianni, R. W. PLGA nanoparticles formed by single- or double-emulsion with vitamin E-TPGS. J Vis Exp. (82), 51015(2013).
- Carrillo-Conde, B. R., Roychoudhury, R., Chavez-Santoscoy, A. V., Narasimhan, B., Pohl, N. L. High-throughput synthesis of carbohydrates and functionalization of polyanhydride nanoparticles. J Vis Exp. (65), 3967(2012).
- Xu, J., Amiji, M. Therapeutic gene delivery and transfection in human pancreatic cancer cells using epidermal growth factor receptor-targeted gelatin nanoparticles. J Vis Exp. (59), e3612(2012).
- Lauten, E. H., et al. Nanoglycan complex formulation extends VEGF retention time in the lung. Biomacromolecules. 11 (7), 1863-1872 (2010).
- Schatz, C., Domard, A., Viton, C., Pichot, C., Delair, T. Versatile and efficient formation of colloids of biopolymer-based polyelectrolyte complexes. Biomacromolecules. 5 (5), 1882-1892 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten