Method Article
SDF-1α-キトサン硫酸デキストランナノ粒子の調製とキャラクタリゼーション
要約
The objective of this protocol is to incorporate SDF-1α, a stem cell homing factor, into dextran sulfate-chitosan nanoparticles. The resultant particles are measured for their size and zeta potential, as well as the content, activity, and in vitro release rate of SDF-1α from the nanoparticles.
要約
Chitosan (CS) and dextran sulfate (DS) are charged polysaccharides (glycans), which form polyelectrolyte complex-based nanoparticles when mixed under appropriate conditions. The glycan nanoparticles are useful carriers for protein factors, which facilitate the in vivo delivery of the proteins and sustain their retention in the targeted tissue. The glycan polyelectrolyte complexes are also ideal for protein delivery, as the incorporation is carried out in aqueous solution, which reduces the likelihood of inactivation of the proteins. Proteins with a heparin-binding site adhere to dextran sulfate readily, and are, in turn, stabilized by the binding. These particles are also less inflammatory and toxic when delivered in vivo. In the protocol described below, SDF-1α (Stromal cell-derived factor-1α), a stem cell homing factor, is first mixed and incubated with dextran sulfate. Chitosan is added to the mixture to form polyelectrolyte complexes, followed by zinc sulfate to stabilize the complexes with zinc bridges. The resultant SDF-1α-DS-CS particles are measured for size (diameter) and surface charge (zeta potential). The amount of the incorporated SDF-1α is determined, followed by measurements of its in vitro release rate and its chemotactic activity in a particle-bound form.
概要
デキストラン硫酸(DS)及びキトサン(CS)は、(CSを脱アセチル化)(DS)の複数の置換、負に帯電した硫酸基を有する多糖類である、又は正に帯電したアミン基を。水溶液中で混合する場合、2つの多糖類は、静電相互作用を介して高分子電解質複合体を形成する。得られた複合体は、水溶液(沈殿物)からの相分離、または水分散性(コロイド)である小さい粒子となり、大きな凝集体を形成することができる。これらの成果に貢献する具体的な条件は、広く研究されており、最近の総説1にまとめ、詳細に説明してきた。これらの条件の中で、水分散性粒子を製造するための2つの基本的な要件は反対に荷電したポリマーは、1)著しく異なるモル質量を持っている必要がある。 2)非化学量論比で混合する。これらの条件は、電荷によって発生した電荷中立複合化ポリマーセグメントを許可します中和は、分離し、粒子のコアを形成し、過剰なポリマーは、外殻1を形成するためである。このプロトコールに記載されたグリカン粒子は、肺送達のために意図され、負に帯電し、ナノメートル寸法の正味のように設計されている。負の表面電荷は、粒子2,3の細胞取り込みの可能性を低減する。ナノメートル寸法の粒子は、遠位気道の通過を容易にする。この目標を達成するために、この調製に用いられるDSの量は、CSの過剰である(重量比3:1)。及び高分子量DS(重量平均MW50万)および低分子量CS(MW範囲50から190 kDaの、75%〜85%脱アセチル化)が使用されている。
SDF-1αは、その走化性活性を通じてホーミング機能を発揮する幹細胞のホーミング因子である。 SDF-1αは、ホーミングおよび骨髄中の造血幹細胞の維持に重要な役割を果たし、progeの動員傷害の修復4,5のための末梢組織へnitor細胞。 SDF-1αタンパク質は、プロテアーゼ(CD26 / DPPIV)不活性化から保護され、ヘパリン/ヘパラン硫酸、フォームダイマーに結合し、細胞表面受容体を介して標的細胞と相互作用することができ、そのタンパク質配列において、ヘパリン結合部位を有する6-8。 DSはヘパリン/ヘパラン硫酸と同様の構造特性を持つ。このように、DSにSDF-1αの結合は、その天然高分子リガンドのものと同様であろう。
以下のプロトコールでは、SDF-1α-DS-CSナノ粒子の調製を記載する。手順は以前に9を検討されてきた製剤のいずれかを表す。プロトコルは、もともとVEGF-DS-CSナノ粒子10の調査から適合される。小規模調製物は、容易に同一のストック溶液と製造条件をスケールアップすることができ、記載されている。調製の後、粒子がbを特徴とするyは、それらのサイズ、ゼータ電位、SDF-1α取り込みの程度を、in vitroでの放出時間、及び組み込まれたSDF-1αの活性を調べる。
プロトコル
SDF-1αグリカンナノ粒子の作製
インビボ送達の目的のために、調製に使用される全ての容器、ピペット、とヒントを滅菌する。
- 超純水で、次のストック溶液の準備:1%硫酸デキストランを。 1 MのNaOH(滅菌PES膜で濾過したもの); 0.2%の氷酢酸中の0.1%キトサン(連続して、0.8〜0.22μmのフィルターを通して濾過し、その後NaOHでpHを5.5に調整する); 0.1 MのZnSO 4。 15%マンニトール。 0.92 mg / mlのSDF-1α(80℃でアリコートで保存し、4℃で維持を一旦解凍C)。
- 0.22μmのフィルター膜を通すストック溶液を滅菌する。カブトガニ変形細胞溶解物(LAL)ゲルクロットアッセイと調製した溶液中のエンドトキシンレベルを評価。レベルは<0.06 EU / mlであることを確認します。
- 磁気撹拌棒を含む1.5 mlのガラスバイアルに0.18ミリリットルの超純水を加える。 800rpmで撹拌速度を設定します。 0.1ミリリットルの1%を追加します。硫酸デキストラン、2分間撹拌した。 0.08 mgのSDF-1α(0.92 mg / mlのSDF-1α溶液を0.087ミリリットル)を追加し、20分間攪拌。
- 0.33ミリリットルの0.1%キトサンを滴下して添加し、5分間撹拌した。最大に変更し、撹拌速度をと(1分以上)0.1ミリリットルの注射器でゆっくりと0.1ミリリットルの0.1MのZnSO 4を追加します。
- を800rpmに攪拌速度を戻し、30分間撹拌した。 0.4ミリリットルの15%のマンニトールを加え、5分間攪拌する。 1.5mlマイクロチューブに反応混合物を転送します。 10分間4℃で16000×gで遠心し。
注意:マンニトールの存在は、遠心分離後の粒子の再懸濁を容易にします。ペレットの小型化に応じて、マンニトールの濃度は、0%から5%に変化させることができる。各遠心分離後の粒子の完全な再懸濁は、最終懸濁液中の凝集を回避することが重要です。 - 上清を吸引し、ゆっくりと液体の最後の一滴を削除するには、ピペットを使用しています。 0.2ミリリットルの5%マンニトールを追加します。 0.5ミリリットルとのペレットを中断し、29 G旧姓DLE注射器。 1ミリリットルの5%マンニトールを追加します。 15分間16000×gで遠心分離する。
- 手順を繰り返し1.6。
- 上清を吸引除去する。 0.2ミリリットルの5%マンニトールでペレットを再懸濁。 4℃で粒子懸濁液に保管してください。
注:粒子懸濁液は、-80℃で凍結または凍結乾燥することができる。懸濁液中を含む5%のマンニトールを凍結融解した後、凍結乾燥及び再水和の後、粒子の凝集を防止することが必須である。マンニトールは、保存後の懸濁液の遠心分離により除去することができる。
粒子径およびゼータ電位の2.測定
粒径およびゼータ電位を素材リストに示され、粒子分析器を用いて、それぞれ、動的光散乱法、電気泳動光散乱によって分析される。
- 積算回数:以下の粒子サイズ測定のためのパラメータを設定する70。リピート回数:4;温度:25°C。希釈液:水;強度調整:オート。
- 水(10倍希釈)とSDF-1α-DS-CSサンプルを希釈する。そのようなエッペンドルフキュベットのような使い捨てのUVキュベットに100μlの試料をロードします。セルホルダーにキュベットを挿入します。 「最適」(〜万CPS)に到達するために強度調整を待ちます。データ収集を開始します。
- 測定が完了した後、直径(nm)であり、多分散性指数のキュムラントの結果を記録する。 4繰り返し測定値のそれぞれから得られた結果を平均し、標準偏差を計算する。
- 負荷ゼータ電位測定用のフローセルに10倍希釈された粒子試料を500μl。蓄積時間:以下の測定のためのパラメータを設定し10と、リピート回数:5;温度:25°C。希釈液:水;強度調整:オート。ゼータ電位(MV)の結果を記録します。平均の結果は、5を繰り返し測定値のそれぞれから得られ、標準deviatioを計算N。
粒子におけるSDF-1αの3定量
- 1.3倍Laemmliサンプルバッファーで0.01、0.02、0.03、0.04、および0.05 mg / mlの濃度に自由形式のSDF-1αを希釈する。 40μlの1.3倍Laemmliサンプルバッファーで6μlのSDF-1α-DS-CSサンプルを希釈する。 (0.05ミリグラム/ブロモフェノールブルーミリリットル、8%2-メルカプトエタノール0.25 Mトリス塩酸、pHが7.5、8%SDS、40%グリセロールを含む4倍レムリストック緩衝を準備します。小さなアリコートに原液を分割し、-20℃で保つ単回使用のためにCを°。)
- 10分間100℃で試料を加熱する。渦完全に粒子を解離するために、10分の加熱時間の間、二倍のサンプル(最大速度で10秒間ずつ)。 2分間RTにサンプルをクールダウン。凝縮水をダウンさせるために30秒〜1分間万×gで遠心し。もう一度よく混ぜるする渦。
注:この時点では、試料液が目に見える沈殿物が存在すると明確にする必要があります。 - 負荷10&#181; Lサンプル/ウェルに4〜20%SDSゲル。 20分間200Vで電気泳動を実行します。クマシーブルータンパク質染色でゲルを染色。
- 分子イメージャとトメ解析ソフトウェアを使用して、SDF-1αのタンパク質バンドの密度を調べます。無料のSDF-1α基準に作成した標準曲線に対して粒子中のSDF-1αの量を計算します。
インビトロ放出アッセイ4.
- 1でカルシウムとマグネシウム(D-PBS)なしのダルベッコのリン酸緩衝生理食塩水でSDF-1αグリカン粒子を混ぜる:1の比(v / v)である。
- 1.5ミリリットルチューブ内の0.05ミリリットルのアリコートに粒子懸濁液を分割します。チューブの底にサンプルをロードします。気泡を導入するか、液体の表面を乱さない。パラフィルムを有する管の上部をシール。
注:その際、液体がチューブミキサーに後続の上から下への回転時に底に残る。 - 37でチューブを回転させて#176; C回転マイクロチューブミキサーで。指定された時間にチューブからアリコートを取り出し、すぐに4℃で10分間16000×gでサンプルを遠心する。
- 上清およびペレットを分離し、0.05ミリリットルD-PBSでペレットを再構成。 -20℃でサンプルを保管してください。全てのサンプルが収集された後、上述したように、SDSゲル上で上清およびペレットを調べる。
5.移動アッセイ
このアッセイは、SDF-1αの走化性活性を測定します。細胞表面上のその受容体(CXCR4)とSDF-1αの相互作用は、SDF-1αの勾配に向かって細胞の遊走を引き起こす。このアッセイでは、細胞が低くウェルに及びSDF-1α溶液(下井戸から半透膜で区切られた)上部のウェルにロードされます。
- SDF-1αを希釈(遊離または粒子に結合した形)3-foのマイグレーションバッファー(0.5%ウシ血清アルブミンを含むRPMI-1640培地)と100、33、11、3.7、1.2、0.41、0.14、および0.05 ng / mlの最終濃度にLDの連続希釈。
- 24ウェルプレート中のウェルに希釈したSDF-1αソリューションや移行バッファーのみ(陰性対照)の0.6ミリリットルを追加します。ウェル(入力セル制御)に0.57ミリリットルの移行バッファを追加します。 30分間37℃でインキュベートする。そのような低いウェルの上にトランスウェル(孔径5μmの、直径6.5ミリメートル)のような透過性細胞培養インサートを置きます。トランスウェルインサートにロード0.1ミリリットルジャーカット細胞(5×10 5)。よく直接入力セルコントロールに0.03ミリリットルの細胞をロードします。 5%CO 2インキュベーター中で2時間、37℃でプレートをインキュベート。
- トランスウェルインサートを取り外します。 4ミリリットルポリスチレンチューブに下のウェルに移動した細胞を転送します。フローサイトメーターで移動した細胞を数える。
- negat内の数字を引いた後の入力セル数(ウェル100/30入力xセル制御中の細胞数)の割合としての移行を計算するコントロール(のみ泳動緩衝液を含むウェルに遊走した細胞)をアイブ。
結果
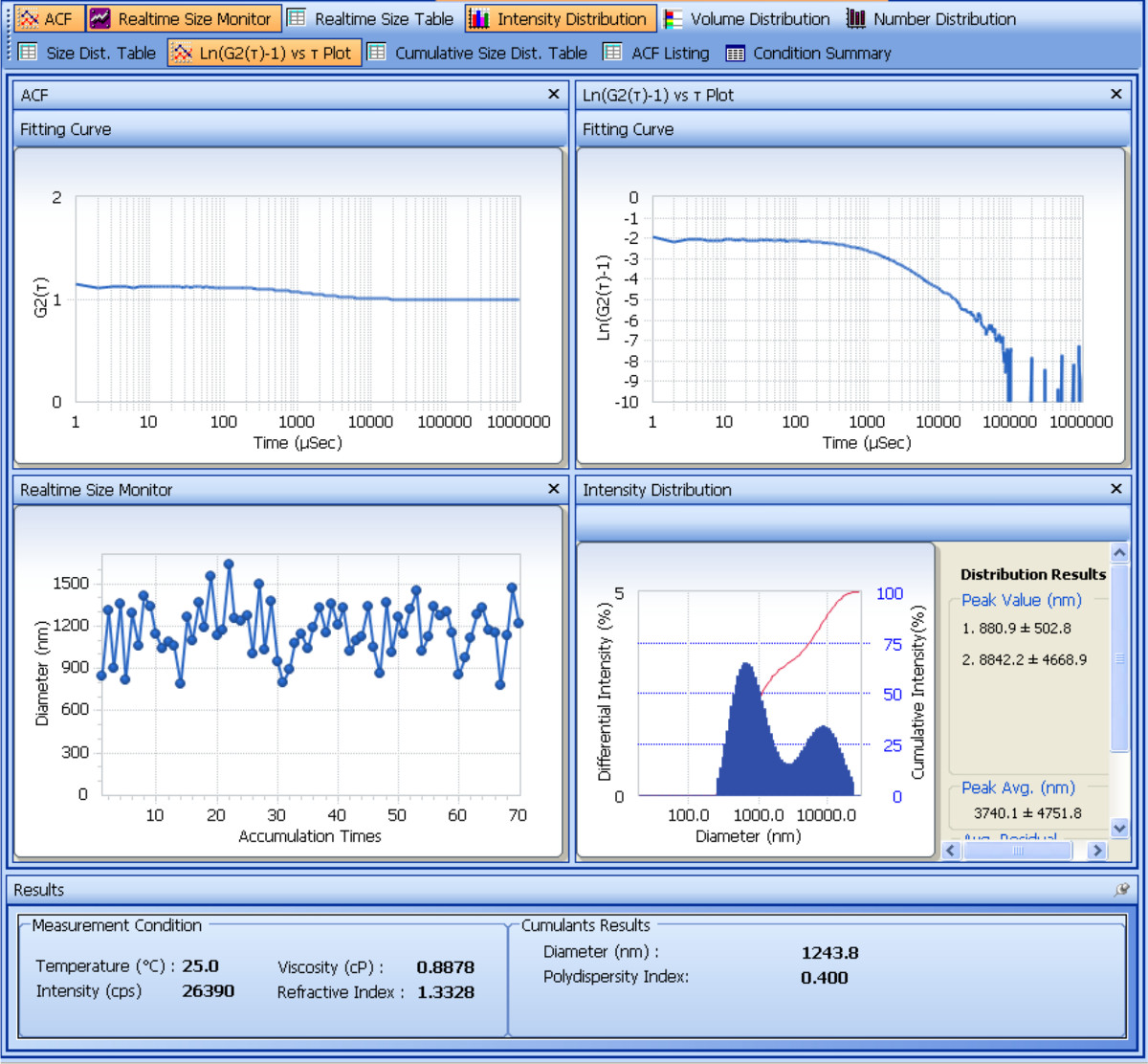
調製されたSDF-1α-DS-CS粒子のサイズとゼータ電位は、粒子分析器を用いて測定される。1、サイズ測定の分析を示す図 。 4反復測定から得られたキュムラント結果から、SDF-1α-DS-CS粒子の平均流体力学的直径は661±8.2(nm)であり、多分散性は0.23±0.02である。ゼータ電位測定の結果を図2に示されている5つ繰り返し測定から、SDF-1α-DS-CS粒子のゼータ電位は、-24.8±0.5 mVである。 SDF-1α-DS-CS粒子懸濁液を凍結融解プロセスの間に粒子の凝集を防止するために必須である5%のマンニトールの存在は、上述したように、 図3は、水中に懸濁された粒子のサイズ測定を示すとで凍結-80℃。明確な集約のピークは解凍後表示されます。
AMOSDF-1α-DS-CS粒子におけるSDF-1αのUNTは、SDSゲル電気泳動により推定される。 図4Aは、SDF-1αの組み込みなし、SDF-1αの規格にクーマシーブルー染色SDSゲルを示すDS-CSナノ粒子(制御粒子、CtrlキーNP)とSDF-1α-DS-CSナノ粒子(SDF-1αNP)サンプルがロードされた。標準曲線は、SDF-1α標準バンド( 図4B)の濃度分析から構成されている。標準曲線から計算は、SDF-1αNPサンプル中のSDF-1α濃度は0.03 mg / mlの(重複しての平均値)であることを示している。サンプル緩衝液を用いて試料の希釈(6 + 40)/ 6であるので、元のサンプルの濃度は0.23 mg / mlである。粒子調製の最終容量が0.2ミリリットルであるように、最終懸濁液中の総SDF-1αは0.046 mgである。反応混合物中のSDF-1αの入力量を考慮すると、DS-CS粒子におけるSDF-1αの捕捉効率は57%であり、0.08 mgである。伝票烏山は、以前にクマシーブルーで染色することが報告されている。染色は、しかしながら、 図4(a)に示すゲルで重要ではない。これは、おそらく、ゲル上に負荷されたキトサン(粒子マトリックス)の量に関係している。いずれの場合においても、粒子マトリックスから完全に解離し、SDF-1αの分離が正確に組み込まれたタンパク質の量を評価するために必要である。このゲルはまた、SDF-1αを検出可能にするバンドがSDF-1αタンパク質バンドと色素の先端との間に検出されないように、10分間、またはボルテックス処理によって100℃で加熱することによって分解されないことを示している。
ナノ粒子からのSDF-1α のインビトロ放出速度は、7日間37℃で、50%D-PBS中での粒子のインキュベーションによって決定される。 0時間、3時間、8時間、24時間、48時間、および7日目に、試料のアリコートを取り出し、直ちに遠心分離する。 (上清中)をリリースし、SDF-1αは、粒子結合SDから分離されているF-1α(ペレット)。サンプルはSDSゲル上で泳動され、そして上清およびペレット中のSDF-1αの量は、クマシー染色およびデンシトメトリー分析によって決定される。分析の代表的なSDSゲルは、図5に示される。示されるように、SDF-1αに結合した粒子は、最小限の7日間のインキュベーション後に放出される。
粒子に結合したSDF-1αの活性は、遊走アッセイ(走化性アッセイ)によって測定される、フリーSDF-1αと比較している。このアッセイでは、DS-CSナノ粒子中のSDF-1αを連続泳動バッファーで希釈し、そして2時間Jurkat細胞とインキュベートした。移動した細胞をフローサイトメーターでカウントされます。 (0.05から11 / mlのSDF-1αの濃度)データは、非線形回帰フィッティングをプロットし、EC 50を算出する。 図6に示すように、粒子に結合したSDF-1α^自由にSDF-1と移動のと同程度に誘導される5;すべての濃度で測定した。 SDF-1αの自由粒子に結合した形のEC 50値は、それぞれ、0.55および0.45 ng / mlである。

図1解析画面は、粒子サイズの動的光散乱測定を示すショット。上の2つのパネルは、自己相関関数のプロット、G2(τ)との対数[G2(τ)-1]の経時を示す。機器のデジタル信号プロセッサ(相関器)、遅延時間(τ)の関数として検出される光強度を表す。プロットは、SDF-1α-DS-CS粒子は0.2〜2ミリ秒の間の強度の指数関数的減衰を引き起こしたことを示しています。平均崩壊定数を入手するには、<Γ>

電気泳動光散乱を示す図2の解析のスクリーンショット粒子ゼータ電位の測定。トップパネルには、時間プロット上G2(τ)を示す。徐々に減衰振動関数は、典型的には、電気泳動光散乱にさらされる荷電粒子が観察される。関数は、電場中で移動する粒子に起因する周波数シフト(ドップラーシフト)を反映している。 G2(τ)のフーリエ変換は、中央のパネルに示すパワースペクトル(周波数プロット対強度)を与える。周波数シフトピークの中心は、ゼータ電位が算出された粒子の移動度を定義する。計算されたゼータ電位は、画面の下部に表示されます。
水の凍結及び解凍後のSDF-1α-DS-CS粒子の図3の粒径測定。マンニトールの非存在下では、粒子がagを形成する凍結融解後にgregates。付加的な強度/サイズピークを形成し、 図1のものと比較しキュムラント直径および多分散性の増加に注意してください。

無料のSDF-1αの規格、DS-CSナノ粒子(CtrlキーNP)、およびSDF-1α-DS-を搭載し、クーマシー染色SDSゲルの図4. DS-CSナノ粒子中のSDF-1α取り込みの定量化。(A)写真CSナノ粒子(SDF-1αNP)のサンプル示されているように。 SDF-1αタンパク質バンドと色素フロントを実行しているゲルがマークされています。 CtrlキーNP試料をクマシーブルー及びキトサンバンド(ワイド)ぼんやりと見えるで染色されていない。 (B)のバンドを、標準曲線を自由SDF-1αの規格で構成された濃度計、duplica(平均で分析するTE)。ナノ粒子中SDF-1αの量は、0.3 /ウェル(10μL)の平均値を与える標準曲線、に対して計算される。

SDF-1αin vitro放出の時間経過を示す図5. SDSゲルは。クーマシー染色SDSゲルは、SDF-1α-DSのインキュベーションの後(上清中)をリリースし、SDF-1αの量と(ペレット中)バウンドSDF-1αを示しています種々の時間、37℃で-CSナノ粒子。 9からの許可を得て再印刷。

SDF-1α(丸)及びSDF-1αのナノ粒子(NP)ジャーカット細胞遊走アッセイにおける(四角)。SDF-1α無料とナノ粒子の両方で行きの図6.用量反応曲線ミリ秒は、それぞれ、0.55および0.45 ng / mlでのEC 50値と同一の活性を示した。 9からの許可を得て再印刷。
ディスカッション
上記のように、DS-CSナノ粒子はポリアニオン(DS)及びポリカチオン(CS)分子間の電荷中和により形成される。電荷相互作用は、分子衝突の間に容易に起こるので、混合中のポリマー溶液と撹拌速度の濃度は、得られた粒子のサイズのために重要である。一般的な傾向は、よりDSとCSのソリューション15と、より小さい粒子より高い撹拌速度結果を希釈することである。
SDF-1αグリカンのナノ粒子製剤を変化させることができる。例えば、このプロトコルで使用されるSDF-1α/ DS / CSの量および比はそれぞれ、0.08 / 0.33 / 1(ミリグラム/ミリグラム/ mg)である。 SDF-1αのナノ粒子の使用目的に応じて、これらの比率を変更することができる。 SDF-1αの量を混合物に加えた場合の代わりに0.08ミリグラムの0.04ミリグラム(0.04 / 0.33 / 1、MG / MG / mg)であり、粒子がわずかに小さい、〜650nmであり、SDF-1αの捕捉効率になりますグラムreater 70〜80%9。 インビボで送達された場合しかし、グリカンマトリックスより多量のSDF-1αにつき存在するだろう。より小さい粒径が所望される場合、SDF-1αグリカンナノ粒子の製剤は、さらに改変することができる。参考文献15に示されているように一つの選択肢は、より小さな分子量のキトサンを使用することである。なお、しかしながら、キトサンはエンドトキシンに対して高い親和性を有する(負に荷電したリポ多糖);このように、エンドトキシンレベルの試験又は潜在精製前のインビボ送達へのキトサン製品の使用のために必要である。第二の選択肢は、予め形成された小型のDS-CSのナノ粒子上にSDF-1αをロードすることです。後者は、粒子サイズ及びSDF-1αでより容易に操作することができるので、より小さな粒子をもたらすことができるDS-CS粒子の外殻にSDF-1αの少量をロードする、DSに対して高い親和性を有する。
他のタイプと比較してナノ粒子は、( 例えば 、PLGA 11、ポリ無水物12、またはゼラチン13ナノ粒子)、DS-CSナノ粒子は、特定の利点と限界がある。 DS-CSナノ粒子の主な利点は、1)粒子調製は、有機溶剤や積極的な超音波処理を必要としない。穏やかな調製物は、タンパク質の不活性化の可能性を低減するように、それは、したがって、タンパク質因子の組み込みに適している。 2)粒子のマトリックスは、組織環境と互換性の粒子を作り、より少ない毒性および炎症性である細胞外マトリックス、類似した構造特性を有している。そして3)グリカン粒子に結合したSDF-1α模倣タンパク質と糖鎖の粒子に組み込まれた後、SDF-1αの完全な走化性活性を説明する細胞外マトリックス、間の天然の結合関係。粒子結合形で十分に活性SDF-1αは、それが組織Eの静止ホーミング因子として機能することができますnvironment。 DS-CSナノ粒子の制限は以下のとおりです。1)粒子の直径は、上記の粒子よりも一般的に大きい。 2)容易に血液循環への直接注入には適していない塩溶液中で崩壊する。
粒子に結合したSDF-1αは、最小限7日間のインキュベーション後に、ナノ粒子から放出されることが見出されている。この現象はまた、 インビボでのその機能に寄与するヘパリンに対するSDF-1αの高い親和性に関連している。ヘパリン結合ドメインを有するタンパク質は、一般的に、ヘパリンに対して異なる親和性を持つことになりますので、それらの放出速度はおそらく異なります。例えば、類似の処方で調製したVEGF 165 -DS-CSナノ粒子に、組み込まれたVEGF 165の44%は、最初の一時間にリリースされましたし、29%、37℃14でのインキュベーションの間に、次の47時間にリリースされました。したがって、特定のprotのためのin vitro放出パターンアインは、個別に試験する必要がある。
SDF-1α-DS-CSのナノ粒子の調製の目的は、肺へのSDF-1αを提供し、組織内の幹細胞のホーミング信号を確立することである。特定のナノ粒子形式は固形組織の注射のために必要ではないが、粒子はまた、同じ目的のために他の組織に送達することができる。 SDF-1αは、ナノ粒子のマトリックス内にDSによって安定化され、最小限の粒子から放出されるという事実は、細胞動員原理幹サポートし、粒子が組織再生のために有益であると期待される。
タンパク質グリカンナノ粒子は、細胞表面のグリコサミノグリカンと細胞外マトリックスと同様のマトリックスを有しているので、それは、粒子に組み込まれたタンパク質は、負に荷電した細胞外マトリックス分子が正にの結合と競合することができる(これらのマトリックスに交換可能であることが可能である生体内での荷電タンパク質) 。この交換は、タンパク質の放出速度を変化させ、そして、従って、さらなるインビトロ特徴初期の後に調査する必要があることができる。
開示事項
The authors declare that they have no competing financial interests.
謝辞
HL671795、HL048743、およびHL108630:この作品は、NIHの助成金によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Dextran sulfate | Fisher | BP1585-100 | |
| Chitosan, low molecular weight | Sigma | 448869 | |
| Zinc sulfate heptahydrate | Sigma | 204986 | |
| D-Mannitol | Sigma | M9546 | |
| UltraPure water | Invitrogen | 10977-023 | |
| SDF-1α | Prepared according to reference 8. | ||
| Syringe filter, PES membrane 0.22 μm | Millipore | SLGP033RS | |
| Magnetic Micro Stirring Bars (2 x 7 mm) | Fisher | 14-513-63 | |
| Glass vial Kit; SUN-SRi | Fisher | 14-823-182 | |
| Delsa Nano C Particle Analyzer | Backman Coulter | ||
| Eppendorf UVette Cuvets | Eppendorf | 952010069 | |
| 4–20% Mini-PROTEAN TGX Gel | Bio-Rad | 456-1096 | |
| GelCode Blue Safe Protein Stain | Fisher | PI-24592 | |
| Molecular Imager VersaDoc MP 4000 System | BioRad | 170-8640 | |
| Corning Transwell Permeable Supports | Corning | 3421 | |
| Accuri C6 Flow Cytometer | BD Biosciences | ||
| Dulbecco’s phosphate buffered saline | Sigma | D8537 | |
| Pyrogent plus kit | Fisher | NC9753738 |
参考文献
- Delair, T. Colloidal polyelectrolyte complexes of chitosan and dextran sulfate towards versatile nanocarriers of bioactive molecules. Eur J Pharm Biopharm. 78 (1), 10-18 (2011).
- Morachis, J. M., Mahmoud, E. A., Almutairi, A. Physical and chemical strategies for therapeutic delivery by using polymeric nanoparticles. Pharmacol Rev. 64 (3), 505-519 (2012).
- Yue, Z. G., et al. Surface charge affects cellular uptake and intracellular trafficking of chitosan-based nanoparticles. Biomacromolecules. 12 (7), 2440-2446 (2011).
- Ghadge, S. K., Muhlstedt, S., Ozcelik, C., Bader, M. SDF-1alpha as a therapeutic stem cell homing factor in myocardial infarction. Pharmacol Ther. 129 (1), 97-108 (2011).
- Sharma, M., Afrin, F., Satija, N., Tripathi, R. P., Gangenahalli, G. U. Stromal-derived factor-1/CXCR4 signaling: indispensable role in homing and engraftment of hematopoietic stem cells in bone marrow. Stem Cells Dev. 20 (6), 933-946 (2011).
- Sadir, R., Baleux, F., Grosdidier, A., Imberty, A., Lortat-Jacob, H. Characterization of the stromal cell-derived factor-1alpha-heparin complex. J Biol Chem. 276 (11), 8288-8296 (2001).
- Amara, A., et al. Stromal cell-derived factor-1alpha associates with heparan sulfates through the first beta-strand of the chemokine. J Biol Chem. 274 (34), 23916-23925 (1999).
- Sadir, R., Imberty, A., Baleux, F., Lortat-Jacob, H. Heparan sulfate/heparin oligosaccharides protect stromal cell-derived factor-1 (SDF-1)/CXCL12 against proteolysis induced by CD26/dipeptidyl peptidase IV. J Biol Chem. 279 (42), 43854-43860 (1074).
- Yin, T., et al. SDF-1alpha in glycan nanoparticles exhibits full activity and reduces pulmonary hypertension in rats. Biomacromolecules. 14 (11), 4009-4020 (2013).
- Huang, M., Vitharana, S. N., Peek, L. J., Coop, T., Berkland, C. Polyelectrolyte complexes stabilize and controllably release vascular endothelial growth factor. Biomacromolecules. 8 (5), 1607-1614 (2007).
- McCall, R. L., Sirianni, R. W. PLGA nanoparticles formed by single- or double-emulsion with vitamin E-TPGS. J Vis Exp. (82), 51015(2013).
- Carrillo-Conde, B. R., Roychoudhury, R., Chavez-Santoscoy, A. V., Narasimhan, B., Pohl, N. L. High-throughput synthesis of carbohydrates and functionalization of polyanhydride nanoparticles. J Vis Exp. (65), 3967(2012).
- Xu, J., Amiji, M. Therapeutic gene delivery and transfection in human pancreatic cancer cells using epidermal growth factor receptor-targeted gelatin nanoparticles. J Vis Exp. (59), e3612(2012).
- Lauten, E. H., et al. Nanoglycan complex formulation extends VEGF retention time in the lung. Biomacromolecules. 11 (7), 1863-1872 (2010).
- Schatz, C., Domard, A., Viton, C., Pichot, C., Delair, T. Versatile and efficient formation of colloids of biopolymer-based polyelectrolyte complexes. Biomacromolecules. 5 (5), 1882-1892 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved