Method Article
캡처 복합 질량 분석 - 소설의 C 디 GMP 이펙터 단백질을 식별 할 수있는 강력한 도구
요약
The ubiquitous second messenger c-di-GMP controls growth and behavior of many bacteria. We have developed a novel Capture Compound Mass Spectrometry based technology to biochemically identify and characterize c-di-GMP binding proteins in virtually any bacterial species.
초록
상당한 진전은 제 메신저 C 디 GMP의 합성 (diguanylate cyclases) 열화 (포스 포)에 관여하는 효소의 확인 및 특성화를 향해 지난 10 년 동안 만들어졌다. 대조적으로, 약간의 정보가이 시그널링 분자가 세포 과정의 다양한 범위를 조절하는 분자 메커니즘을 통해 세포 성분과 관련하여 가능하다. 알려진 이펙터 단백질의 대부분은 필츠 (Pilz) 가족에 속한다 또는 촉매를 포기하고 이펙터 기능을 채택했다 diguanylate cyclases 또는 포스 포 디에스 퇴화된다. 따라서, 더 나은 실험 방법은 실리코 예측의 신뢰성이 실패하는 신규 이펙터를 식별하고 검증하는 데 필요한 박테리아 광범위 셀룰러 C 디 GMP 네트워크를 정의한다.
우리는 최근에 강력한 도구로 새로운 캡처 복합 질량 분석 (CCMS) 기반 기술을 개발했다생화학 적 식별 및 C 디 GMP 결합 단백질을 특성화. 이 기법은 이전에 하나의 유기체에 적용 가능한 다양한 것으로보고되었다. 여기서 우리는 이러한 신호 성분을 프로빙 이용하는 프로토콜의 자세한 설명을 제공한다. 예로서, 우리는 녹농균, C 디 GMP는 병독성 및 생물막 제어에 중요한 역할을하는 기회 적 병원균 사용. CCMS는 C 디 GMP 네트워크의 공지되거나 예측 된 성분의 74 % (51분의 38)를 식별. 본 연구는 상세히 CCMS 절차를 설명하고, 소분자 시그널링에 관련된 신규 한 구성 요소를 식별하기위한 강력하고 다양한 도구로 정한다.
서문
C 디 GMP 그들의 성장 및 행동의 다양한 측면을 제어하기 위해 사용되는 대부분의 세균에 의해 두번째 키 메신저. 예를 들어, C-디 GMP는 세포주기 진행, 운동성 및 엑소 폴리 사카 라이드 및 표면 adhesins 2-4의 발현을 조절한다. 이러한 프로세스의 조정을 통해 C 디 GMP는 biofilm 형성, 병원성 박테리아 5의 범위의 만성 감염과 관련된 프로세스를 촉진합니다. C 디 GMP는 촉매 GGDEF 도메인 4 항구 diguanylate cyclases (DGCs)라는 효소에 의해 synthetized된다. 일부 DGCs 다운 C-GMP 디 바인딩시 클라 제 활성을 조절하는 사이트 억제을 갖는다. C 디 GMP의 분해는 촉매 EAL 또는 HD-GYP 중 도메인 6,7 숨겨 포스 포의 두 가지 클래스 (PDE는)에 의해 촉매된다.
직접 C 디 GMP 결합 공지 효과기 단백질의 대부분은 단백질의 세 개의 클래스 중 하나에 속한다 : 촉매를동맹 비활성 GGDEF 또는 EAL 도메인과 필츠 (Pilz) 도메인, C 디 GMP 8 바인딩에 따라 구조 변화를 받아야 작은 분자 스위치. DGCs, PDE는 필츠 단백질은 잘 특징과 도메인은 상대적으로 안전하게 실리에 예측할 수있다. 특히 관심은 이제 C 디 GMP 이펙터의 새로운 클래스의 식별에 초점을 맞추고 있습니다. 다른 바인딩 모티브 일부 C 디 GMP 이펙터는 부르크 홀데 리아 cenocepacia에서 CRP / FNR 단백질 가족 Bcam1349 또는 P.의 전사 조절 FleQ로 최근에 이러한 설명했다 녹농균 (9, 10). 또한, C-GMP 디 특정 리보 스위치 최근 식별과 C 디 GMP 의존적 11 유전자 발현을 제어하는 것으로 나타났다. 다른 이펙터의 C 디 GMP 바인딩 모티브는 제대로 보존 된 단백질의 생물 정보 학적 예측을 어렵게하고있다. 이 문제를 해결하기 위해, 우리는 C 디 GMP의 SPE의 사용에 기초 생화학 방법을 개발cific 캡처 화합물은 질량 분석 1,12,13과 함께.
우리는 최근 (CDG-CC, 그림 1) 새로운 가의 C 디 GMP 캡처 화합물을 설계 한 일. 이 화학 골격이 구성된다 결합 단백질 C 디 GMP를 캡처 미끼로 이용 1) C 디 GMP 잔기, 2) UV-광활성 반응성 기는 링크 크로스를 사용 결합 단백질 CDG-CC 및 3) 비오틴 스트렙 타비 딘 - 코팅 된 자성 비드를 이용하여 캡쳐 된 단백질을 분리. CDG-CC 직접 구체적 세포 용 해물과 같은 거대 분자의 복합체 C로부터 디 GMP 이펙터를 캡쳐 할 수있다. 캡처 계 화합물 및 화학 프로테오믹스 기반 방식은 이전 생물 광범위한 적용 것으로보고 된 예 Caulobacter crescentus, 살모넬라 엔테 혈청 형 티피 뮤 리엄 및 P. aeruginosa의 1,14.
이 방법론 논문에서,우리는 P. 추출물을 사용 CCMS 절차의 깊이 설명에 제공 예를 들어 녹농균. 이 연구는 생화학 적으로 작은 분자 신호 전달에 관여하는 새로운 구성 요소를 식별 할 수있는 강력하고 다양한 도구로 CCMS를 설정합니다.
프로토콜
1. 해물 준비
- P. 성장 원하는 OD에 LB에 루기 노사 세포.
참고 : 지침 : 로그 상 문화에 대한 고정 위상 문화에 대한 ≈ 100 ml의 문화 / 샘플 ≈ 500㎖의이 배양 / 샘플 (외경 600 ㎚ = 0.5)를 사용합니다. - 5,000 x g에서 20 분 동안 원심 분리하여 펠렛.
- 재현 탁 0.5 ~ 1 ml의 용해 버퍼에 펠렛의 g (6.7 MM의 MES, 6.7 mM의 HEPES, 200 mM의 NaCl을, 6.7 mM의 한국 공항 공사, DDT 1 ㎜, pH를 7.5)와 단백질 분해 효소 억제제 (완전 미니, EDTA 무료)를 추가 할뿐만 아니라 DNaseI있다.
- 를 Lyse 20,000 psi에서 프랑스의 압력 셀을 통해 3 통로에 의해 세포 (자료 목록 참조).
- 초 원심 분리기 4 ° C에서 1 시간 동안 100,000 x g에서 세포 용 해물.
- 뜨는을 저장 (2 단계로 이동합니다).
- 피펫 팅 아래에 의해 용해 버퍼 1 배 1 mL를 펠렛을 씻으십시오.
- 초 원심 분리기 4 ℃에서 1 시간 동안 100,000 x g에서.
- 에 펠렛을 플래시 동결막 단백질 (단계 3 참조)의 포착을 위해 사용될 때까지 -20 ℃에서 액체 질소 저장.
C 디 GMP 무료 및 기타 뉴클레오티드 2. 제거 (가용 분 만 해당)
- 차가운 용해 완충액 10 mL로 PD10 탈염 컬럼 (참조 자료 목록)를 씻으십시오.
- 뉴클레오티드를 제거하기 위해 상등액 PD10 상 (≈ 1 ml)에 붓는다.
- 4 ml의 차가운 용해 완충 용액 (500 μL 단계)로 용출시켰다.
- 브래드 포드 분석에 의해 결정되는 곳 분수를 선택하고 그들을 풀.
3. 펠렛의 재 부상과 가용화 (막 분수 전용)
- (세제)없이 1X 캡쳐 버퍼 500 μl에 1,000에 펠렛을 재현 탁 (표 1 참조).
참고 : 펠릿 재현 탁하기 어렵다. 대략 잘 솔루션을 균질화 주사기 (27) G를 사용 후, 펠렛을 재현 탁에 그것은 피펫 먼저 피펫 최대 및 아래 좋습니다. - 1 % 추가 (W / V) N 도데 실-β-D-maltopyranoside (DDM).
- 회전 바퀴에 적어도 2 시간 (또는 O / N) 4 ° C에서 품어.
- 초 원심 분리기 4 ℃에서 1 시간 동안 100,000 x g에서.
- 뜨는을 수확.
4. 단백질 농도 측정
- (막 분획에 대한 분석으로 BCA) 브래드 포드 분석으로 단백질 농도를 측정한다.
- 10 ㎎ / ㎖에 총 단백질 농도를 설정합니다.
5. 캡처
- GDP, GTP, ATP, CTP의 1 ㎜, 5 배의 캡처 버퍼 (100 mM의 HEPES, 250 mM의 한국 공항 공사, 50 mM의 MgAc, 5 % 글리세롤, 산도 7.5) (표 1) 20 μL와 단백질 300 μg의 혼합. H 2 O. 100 μL에 대한 반응 볼륨을 조절
주 : 전량 경쟁 제어시 CDG 및 C-CC 디 GMP의 볼륨을 포함한다 (단계 5.3 및 표 2 참조).
참고 : 모든 실험은 200에서 수행되었다# 181; L (12) 튜브 PCR 스트립 (온도 과학).
참고 : 막 분획을 위해, 항상 임계 미셀 농도 (8) M 우레아의 단백질 가용화 단계까지 (7.1 단계) (V / W 0.01 %) 이상 DDM 농도를 유지해야합니다. - 회전 바퀴에 30 분 동안 4 ° C에서 품어.
- 10 μM CDG-CC (최종 농도)를 추가합니다.
주 : ( "비드 제어"로 칭함) CDG-CC없이 제어하고, 1 mM의 C 디 GMP ( "대회 관리")가 보충 된 제어를 포함 (표 2 참조).
주 : CDG-CC 농도는 1 내지 10 μM로 조절 될 수있다. - 어둠 속에서, 회전 바퀴에 적어도 2 시간 (O / N의 막 분획) 4 ° C에서 품어.
- CaproBox를 사용하여 4 분 동안 자외선과 CDG-CC의 반응 부분의 활성화에 의해 짧은 스핀, 크로스 링크, 후 (소스 = 310 nm의, 조도 ≥10 mW의 / cm² 이상, 거리 재료 목록을 참조 λ = 2cm). 주 : 스트립 가교 결합 전에 뚜껑을 제거합니다.
- 부드럽게 균질화, 25 ㎕의 5 배 세척 버퍼 (5 M의 NaCl 250 mM 트리스, 산도 7.5) 잘 재 부유 스트렙 타비 딘 자석 구슬의 50 μl를 추가합니다.
- 회전 바퀴에 1 시간 동안 4 ° C에서 품어.
6. 세척 단계
참고 : (자석 : 재료 목록 참조). 자석 PCR 스트립 뚜껑에 자석 구슬의 캡처, 시작합니다. 그 다음 세척 용액을 포함하여 새로운 PCR 스트립을 대체. 자석을 제거하고 구슬을 재현 탁하고, 2 분을 품어. 스핀 다운과 신선한 뚜껑으로 뚜껑을 교체합니다.
- 세척 단계 (가용 분획 만)
- 200 μL 1X 세척 버퍼에 6 회 반복한다.
- 200 μL를 HPLC 등급 H 2 O에 한 번 세척
- 200 μL 80 % 아세토 니트릴 6 회 반복한다.
- 200 μL를 HPLC 등급 H 2 O 2 회 반복한다
- 세척 단계 (membra북동 부분 만)
- + 0.1 % DDM 200 μL 1X 세척 버퍼에 5 회 반복한다.
- + 0.05 % DDM 200 μL 1X 세척 버퍼하는 과정을 2 회 반복한다.
- + 0.025 %의 DDM 200 μL 1X 세척 버퍼에 한 번 씻으십시오.
- + 0.0125 %의 DDM 200 μL 1X 세척 버퍼에 한 번 씻으십시오.
- 200 ㎕의 100 mM의 ABC에서 3 회 반복한다 (탄산 수소 암모늄, NH 4 CO 3) + 2 M 우레아.
7. MS 샘플 준비
- 20 μl의 100 mM의 ABC (막 분획에 대한 + 8 M 우레아 100 mM의 ABC)에 (직접 뚜껑) 구슬을 재현 탁 1.5 ml의 튜브에 전송합니다.
- 막 분획은 500 rpm으로 흔들면서 5 분 동안 60 ℃에서 배양한다.
- 200 mM의 TCEP (트리스 (2- 카르복시 에틸) 포스 핀) 0.5 μL를 첨가하고, 500 rpm으로 흔들면서, 60 ℃에서 1 시간 동안 배양한다. 25 ℃로 냉각시킨다.
- 를 떨고, 요오도 아세트 아미드 새로 제조 된 400 mm의 0.5 μl를 추가하고 30 분 동안 25 ° C에서 배양500 rpm으로 어둠 속을 t.
- 0.5 ㎕의 0.5 M N의 아세틸 시스테인을 추가하고 500 rpm으로 진탕, 10 분 동안 25 ° C에서 품어.
- 막 분획 만 : 1 μL리스-C를 추가하고 37 ° C, O / N 품어.
- 2 μg의 트립신을 추가하고 500 RPM (건조를 방지하기 위해 파라 필름에 포장) 진탕, 37 ° C에서 O / N을 배양한다.
주 : 샘플이 단계에서 -20 ℃에서 저장 될 수있다.
참고 : 막 분수는 : 트립신을 첨가하기 전에 <2 M의 요소 농도를 조정하는 100 mM의 ABC를 추가합니다. - 간단히 튜브를 스핀 다운 자석 구슬을 수집합니다.
- 새로운 1.5 ML 튜브에 뜨는을 전송 (구슬이 남아있는 경우이 단계를 반복).
- 5 μL 5 % TFA (트리 플루오로 아세트산) + 1 μL 2 M 염산 (막 분획 15 ㎕의 5 % TFA + 5 μL 2 M 염산)를 추가합니다.
- 조건 C18를 MicroSpin 열 μL 아세토 니트릴 150 (둥지 그룹, MA, USA) (스핀 2,400 rpm에서 20 초).
- 동등0.1 % TFA (스핀 20 초, 2,400 RPM) μL C18 컬럼 (150)와 2 번 librate.
- 샘플을 넣고 2 분, 2,000 rpm으로 스핀.
- 흐름을 통해 열 상을 다시 넣고 회전 단계 (2 분, 2,000 RPM)를 반복합니다.
- 0.1 % TFA μL (150)로 3 회 세척, 5 % 아세토 니트릴 (20 초, 2,400 RPM).
- 새로운 튜브를 취하여 150 μL, 0.1 % TFA 회 용리, 50 % 아세토 니트릴 (2 분, 2,000 RPM).
- 속도 진공 청소기의 펩티드를 건조.
- 40 μL의 98 % H 2 O 2 % 아세토 니트릴, 0.15 % 포름산에서 재현 탁.
- 초음파 처리 20 초 (펄스주기 0.5, 진폭 100 %; 재료 목록 참조), 5 초, 12,000 RPM (벤치 탑 원심 분리기)를 스핀 다운. 소용돌이 10 초, 5 초, 12,000 rpm으로 스핀 다운. LC-MS / MS 분석을위한 HPLC 바이알로 옮긴다.
- -20 ° C에서 동결.
주 : 샘플이 단계에서 -20 ℃에서 저장 될 수있다.
8. LC-MS / MS 분석
- 나노 LC를 실행 (나노 LC 시스템) equippRP-HPLC 컬럼 (75 μm의 X 37cm) C18 수지 충전과 ED (매직 C18 AQ이 3 μm) 95 % 용매 A (0.15 % 포름산, 2 % 아세토 니트릴), 5 % 용매 B의 선형 구배를 사용하여 ( 0.2 μL / 분의 유속으로 60 분에 걸쳐 용매 B 35 % 98 % 아세토 니트릴, 0.15 % 포름산).
- (전기 분무 이온 원에 연결된 이중 - 압력 LTQ Orbitrap Velos 질량 분광계) LC-MS / MS를 이용하여 펩티드를 분석한다.
주 : 데이터 수집 모드는 MS가 (20)에서 가장 강한 이온의 선형 이온 트랩에 MS / MS 스캔이어서 60,000 FWHM의 해상도 질량 분석기의 FT 부 스캔 한 고해상도를 수득 하였다. MS / MS 시도의 효율을 높이기 위해 충전 상태 스크리닝 잠정은 미사용 배제하는 것을 가능하게하고, 단독 이온을 충전 하였다. 전구체 100 이온 수를 초과 할 때 담합에 의한 분해가 트리거했다. 동적 제외 기간은 30 초로 설정 하였다. 이온 축적 시간은 300 밀리 초 (MS) 및 (50)에 설정된밀리 초 (MS / MS).
9. 데이터베이스 검색
- P. 다운로드 aeruginosa의 NCBI 데이터베이스 NCBI 홈페이지를 통해 ( http://www.ncbi.nlm.nih.gov/ ).
- MassMatrix 변환 도구 (사용 마스코트 일반 파일에 MS 원시 스펙트럼 (MGF) 변환 http://www.massmatrix.net/mm-cgi/downloads.py을 ).
- P.에 대해 마스코트 버전 2.3을 사용하여이 MGF 파일을 검색 앞으로 함유 역 미끼 단백질 항목 aeruginosa의 NCBI 데이터베이스.
- 두 개의 완전히 트립신 펩티드의 분열을 놓친 용인 (프롤린 뒤에 제외) 리신과 아르기닌 후 실리 트립신 소화를 수행합니다.
- 변수 수정 및 고정 수정과 같은 시스테인 잔기의 carboxyamidomethylation (57.021464 다)와 같은 산화 된 methionines (15.99491 다)를 허용하는 데이터베이스 검색 매개 변수를 설정합니다. 마스코트 우리를 검색을위한고해상도 스캔을 보내고, 15 ppm으로 전구체 물질 허용 오차를 설정하고 다 0.6 단편 질량 허용 오차를 설정합니다. 마지막으로, 1 %에 단백질 FDR을 설정합니다.
- P.의 마스코트 검색을 가져 오기 비계 (Proteomesoftware, 버전 3)에 루기 노사 CCMS 실험은, 1 % 단백질 FDR 가까이를 취득하고, 총 스펙트럼 수를 추출하는 매개 변수를 설정합니다.
- 대표적인 결과는 본 논문에서는, 우리는 경쟁 제어 실험을 비교하는 쌍 T 테스트를 사용하고, 0.1 이하의 p 값, 2 (스펙트럼 수를 실험 / 경쟁 제어 스펙트럼 위의 스펙트럼 카운트 비율 안타를 고려 카운트).
- 데이터는 추가 분석을 위해 스프레드 시트 소프트웨어에서 내보낼 수 있습니다.
10. 레이블이없는 정량화
- Progenesis LC-MS 소프트웨어 (비선형 역학, 버전 4.0)에 원시 파일을 가져옵니다.
- 기본 setti에서 LC-MS 배향 및 특징 검출을 수행NGS.
- Progenesis LC-MS에서 MGF 형식으로 데이터를 내 보냅니다.
- NCBI P. 대하여 MASCOT를 사용 MS / MS 스펙트럼을 검색 앞으로 함유 역 미끼 단백질 항목 aeruginosa의 데이터베이스.
- Progenesis LC-MS로 데이터베이스 검색 결과를 가져 오기 및 MS1 기능에 펩티드의 식별을 매핑합니다.
- (0.1 이하, Q 값, 상기 2 스펙트럼 계수 비 임계) 데이터 평가 (유의 수준의 계산식 폴드 변경 비율)의 내용 SafeQuant ProteinSQAnalysis 스크립트를 사용 하였다.
결과
P.에 새로운 C 디 GMP 이펙터를 확인하려면 aeruginosa에 우리는 체계적으로 P.의 가용성과 막 분수를 분석하는 CCMS를 사용 로그 상 문화 루기 노자 균주 PAO1 (OD = 0.5 (600)). 여기에서 우리는 요약하고이 낚시 원정대의 대표적인 결과에 대해 설명합니다. 네 개의 독립적 인 생물 복제를 사용 하였다. 각 실험을위한 두 가지 CDG-CC 농도 (5 μM 및 10 μM)을 사용 하였다. 특이성 프로브, 실험 (표 1) (즉, CDG-CC)없이 비드 제어 최종적 1mM의 경쟁자로서 C 디와 GMP의 존재 또는 부재하에 수행 하였다.
(도 2) 위에 상세히 설명하면 다음과 같은 방법을 우리는 비계 형식으로 캡처 단백질의 목록을 생성했다. 가능성 오염 물질을 제거 하였다. 이 리보솜 단백질, 스트렙 타비 딘, 트립신, 혈청 알부민, 케라틴과 다른 인간의 단백질을 포함. 단백질식별 오류가 발견 레이트 (FDR)은 비계 소프트웨어를 사용하여 1 %로 설정하고, 데이터는 Excel로 내보낼. 비계 의해 제공된 수탁 번호 Excel에서 VLOOKUP 함수를 사용하여 궤적 번호로 변환 될 수 께 P. 목록에 링크 aeruginosa의 궤적 번호. 이 단계에서, 히트리스트는 가용성 분획 768 단백질 및 막 분획에 대한 433 단백질을 포함한다. 그러나 대부분의 단백질은 크게 캡처 실험에서 농축되지 않습니다. 따라서, 가능성 비특이적 포착 단백질 (비드 컨트롤 만 긍정적 또는 C 디 GMP 경쟁자의 존재 하에서)를 제거 하였다. 우리는 두 가지보다 더 큰 비율로 캡처 실험과 경쟁 제어 및 전용으로 간주 단백질 사이의 스펙트럼 카운트 비율을 계산 하였다. 또한 우리는 캡처 실험과 경쟁 컨트롤 사이의 의미 측정을 제공하고, 0.1의 허용 임계 값을 설정하는 스펙트럼 카운트 쌍을 이루는 t 테스트를 고용했다. 마지막으로우리는 모두 촬영이 캡처 화합물 농도에 대한 네 가지 실험에서 확인 된 최소한 네 펩타이드 만 강력한 히트를 고려했다. 이러한 기준에 따라 필요하고 검증하여 조절 및 C 디 GMP가 임계 값을 설정하기위한 기준으로 결합 단백질을 예측한다. 정렬 후,리스트는 가용성 분획 76 즈음하여 막 분획 단백질을 133으로 감소시켰다. 이것은 수용성 P. 13에서 21 막 단백질을 포함 공지 또는 C 디 GMP (표 2)를 결합하는 예상되는 녹농균. 다른 수용성 63, 112 막 단백질은 공지 된 디 - C-GMP 결합 도메인 중 하나를 포함하지 않는 새로운 추정 C 디 GMP가 결합 단백질이다. 이 안타는 특정 C 디 GMP 바인딩을 테스트하여 검증 될 지금있다.
이전 화면에서 우리는 GlyA2 (PA2444), GlyA3 (PA4602)과 Gsp69 (PA1127) 1 낚시질. 이 3 단백질, 복제 과발현 및로부터 정제 하였다대장균, 33 P를 사용하여 UV-가교 실험에서 C 디 GMP 바인딩 유효성을 검사 할 수는 C 디 GMP (15)을 표시. S K D는 참 신규 CCMS 이펙터를 사용하여 동정 할 수 있다는 것을 나타내는, 각각 1.0, 2.0 및 6.9 μM로 결정되었다.
이 대표적인 예 외에도 여러 성장 조건으로부터 수확 된 세포의 추출물, 각종 세포 C 디 GMP 농도 (N = 24)를 사용하여 CCMS. 전반적으로 우리는 알려진의 74 % (51분의 38)를 체포 또는 P. 예측 aeruginosa의 PAO1 C 디 GMP 신호 구성 요소 (24/32 수용성 단백질, 14/19 막 단백질). 이들 유전자의 적어도 아홉은 특정 조건 (산화 스트레스, 쿼럼 센싱, 바이오 필름) 16 세 미만 복사 할 것으로 나타났다 감안할 때 일부는 모든 C 디 GMP를 결합하지 않을 수, 범위의이 정도는 포화에 가까운 수 있습니다. 함께 관찰이 그 w 이러한 구성 요소의 대부분오히려 높은 특이성 (표 2)로 촬영 강력하게이 기술은 효과적이고 강력한 주장한다.
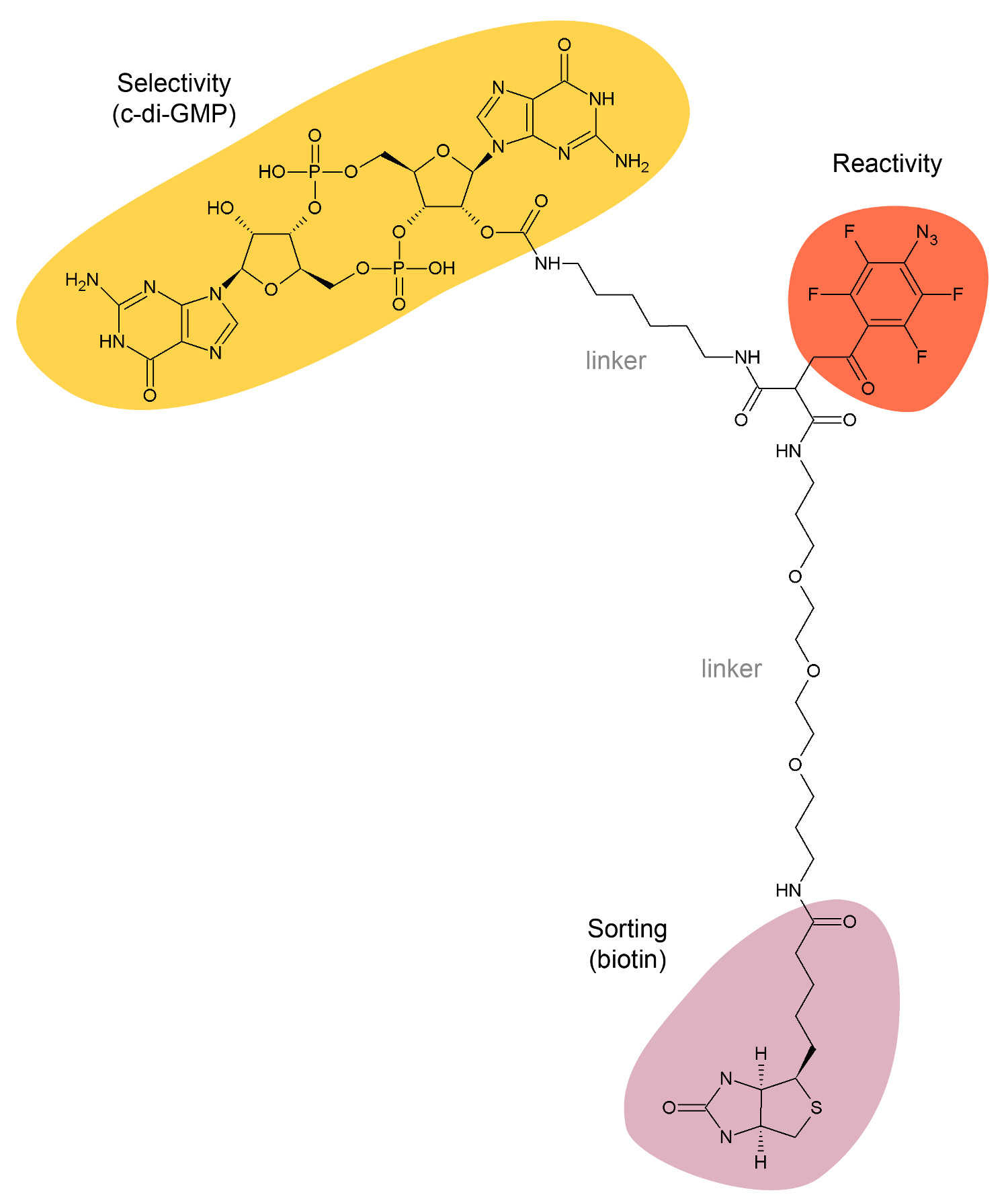
그림 1 : C 디 GMP 캡처 화합물의 화학 구조.

그림 2 :. CCMS 워크 플로우 요약 기계 용해 후 무료 뉴클레오티드가 PD10 제외 열을 사용하여 제거한다. 수용성 또는 막 분획 단백질 CDG-CC와 인큐베이션하고, 혼합물을 가교 결합 단백질 캡쳐 UV 조사에 노출된다. 거친 세척 단계는 코팅 자석 구슬을 스트렙 타비 딘에 결합 된 화합물로 수행됩니다. 온 - 비드 트립신 소화 펩티드를 제공,다음 구슬 분리 및 질량 분석 식별을위한 양성자되는. 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
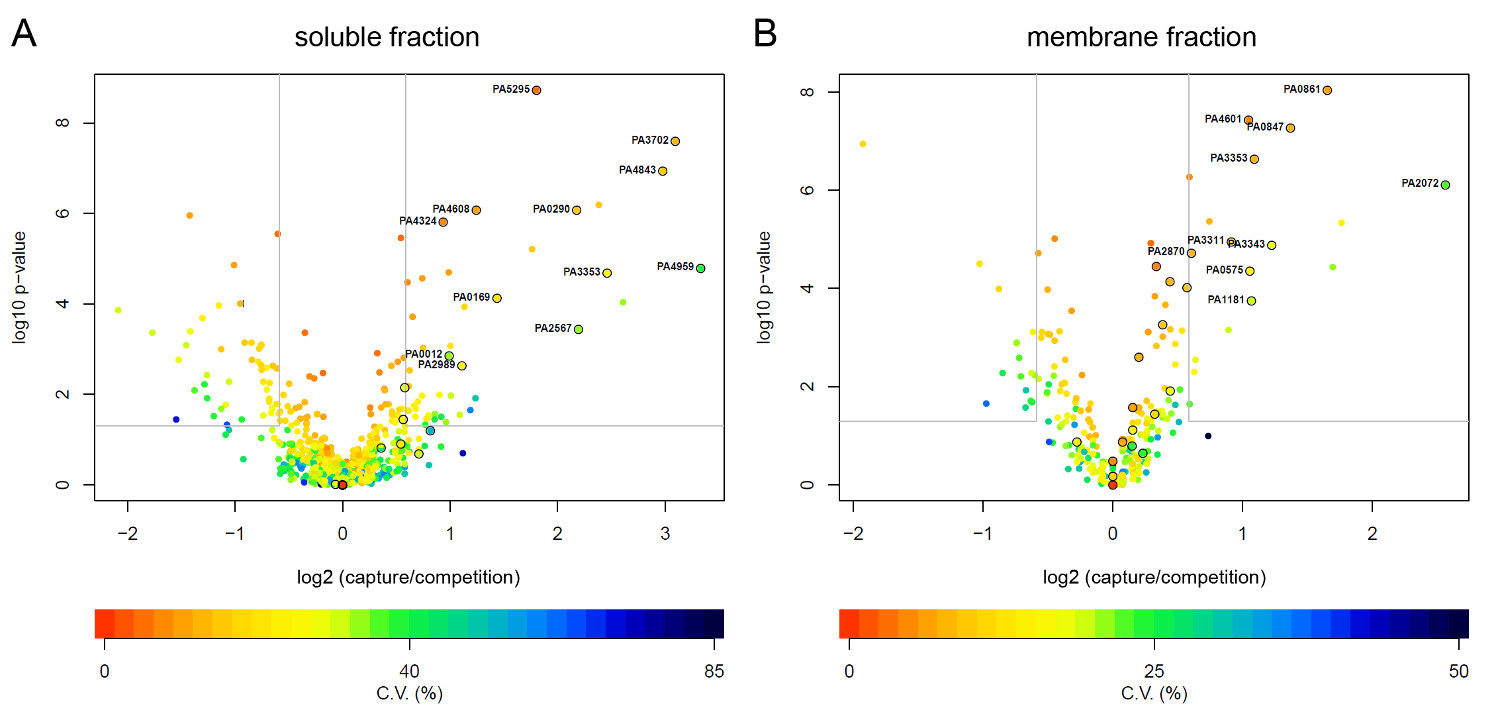
그림 3 : P.의 Volcanoplots 녹농균 단백질 크게 CCMS 충실. 본문에 설명 된 LC-MS / MS 분석 및 라벨없는 정량 후, 단백질을 분류 하였다. 캡처 및 경쟁 실험 간의 검출 펩티드 LOG2 강도 비율 계산 유의성 분석 (변성 t 통계량 경험적 베이 즈 방법 (17))로부터 유도 된 값을 플롯 팅 하였다. -P 값 <0.05 및 강도 비> 대한 중요성 임계 값 내 단백질은 1.5 배량이다 indicat회색 상자에 에드. 도 4는 가용성 분획 (A)과 막 분획 (B) 10 μM의 C-디 GMP-CC의 존재하에 수행하고, 1mM의 C 디 GMP와 경쟁 실험 복제. 동그라미 점 알려진 C 디 GMP 결합 단백질에 해당합니다. 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 화면 캡쳐 : | 버퍼 | 화학 | 출처 | 집중 |
| 박테리아 용해 버퍼 10 배 | MES | 시그마 | 67 mM의 | |
| pH가 7.5 | HEPES | 시그마 | 67 mM의 | |
| 염화나트륨 | 나를RCK | 2 M | ||
| 나 아세테이트 | 머크 | 67 mM의 | ||
| DTT | 플루 | 10 mM의 | ||
| DNaseI | 로슈 | 20 U / ㎖ | ||
| 전체 프로테아제 억제제 칵테일 | 로슈 | 1 탭 / 10 ml의 | ||
| 버퍼 5 배 캡처 | HEPES | 시그마 | 100 mM의 | |
| 한국 공항 공사 | 시그마 | 250 mM의 | ||
| MgAc (무수) | 시그마 | 50 mM의 | ||
| 글리세린 | 시그마 | 50 % (V / V) | ||
| GDP, GTP, ATP, CTP | 시그마 | 1 mM의 각 | ||
| 세척 버퍼 5 배 | 트리스 -HCl | 머크 | 1 M | |
| (가용 분을위한) | EDTA | 시그마 | 0.5 M | |
| pH가 7.5 | 염화나트륨 | 시그마 | 5 M | |
| n- 옥틸-β-D-코피 라노 | Anagrade (어피 메트릭스) | 42.5 μM | ||
| 세척 버퍼 5 배 | 트리스 -HCl | 머크 | 1 M | |
| (막 분획) | EDTA | 시그마 | 0.5 M | |
| pH가 7.5 | 염화나트륨 | 시그마 | 5 M | |
| 기타 화학 물질 : | 탄산 수소 암모늄 (ABC) | 플루 | ||
| 요소 | Applichem | |||
| MS의 샘플 준비 : | 버퍼 | 화학 | 출처 | 집중 |
| C18 버퍼 | TFA | 내뚫다 | 0.1 % (V / V) | |
| H 2 O의 HPLC 등급 | 99.9 % (V / V) | |||
| C18 버퍼 B | TFA | 내뚫다 | 0.1 % (V / V) | |
| 아세토 니트릴 | Biosolve | 49.9 % (V / V) | ||
| H 2 O의 HPLC 등급 | 50 % (V / V) | |||
| C18 버퍼C | TFA | 내뚫다 | 0.1 % (V / V) | |
| 아세토 니트릴 | Biosolve | 5 % (V / V) | ||
| H 2 O의 HPLC 등급 | 94.9 % (V / V) | |||
| LC 버퍼 | 포름산 | 시그마 | 0.15 % (V / V) | |
| 아세토 니트릴 | Biosolve | 2 % | ||
| H 2 O의 HPLC 등급 | 97.85 % | |||
| 기타 화학 물질 : | 트리스 (2- 카르복시 에틸) 포스 핀 (TCEP) | 시그마 | ||
| 요오도 아세트 아미드 (IAA) | 시그마 | |||
| N의 아세틸 시스테인 | 시그마 | |||
| 엔도리스-C | 와코 | |||
| 트립신 | 프로 메가 |
표 1 :. 버퍼 조성, 화학 물질 및 공급 업체의 구성 요약을 버퍼링한다. C 디 GMP 캡처 화합물, (경쟁 제어를위한) C 디 GMP, 스트렙 타비 딘 코팅 자석 구슬, 캡처 버퍼 및 세척 버퍼는 caproKit에 포함되어 있습니다.
| 비드 제어 | 캡처 실험 | 경쟁 제어 | |
| 단백질 추출물 (10 ㎎ / ㎖) | 30 μL | 30 μL | 30 μL |
| C 디 GMP (10 mM)을 | 0 μL | 0 μL | 10 μL |
| 뉴클레오티드 (각 염기의 10 mM의) | 10 μL | 10 μL | 10 μL |
| 캡처 버퍼 5 배 | 20 μL | 20 μL | 20 μL |
| H 2 O | 42 μL | 32 μL | 22 μL |
| 30 분 인큐베이션 | |||
| C 디 GMP ~ CC (재고 100 μM) | 0 μL | 5 ~ 10 μL | 5 ~ 10 μL |
| 최종 농도 : | 비드 제어 | 캡처 실험 | 경쟁 제어 |
| C 디 GMP ~ CC (μM) | 0 μM | 5-10 μM | 5-10 μM |
| 경쟁자 C 디 GMP (μM) | 0 μM | 0 μM | 1000 μM |
표 2 :. 비드 컨트롤 반응 혼합물의 캡처 반응 혼합물 요약 (즉, 캡처 화합물없이) (C 디 GMP-CC)와, 캡처 실험 및 C- 과량 포함 된 경쟁 제어 디 GMP. C 디 GMP-CC 최종 농도가 조절 될 수 있고, 일반적으로 5 ~ 10㎛ 사이에서 설정된다.
| 단백질 이름 | 로커스 ID | 도메인 아키텍처 | 캡처 실험 / 경쟁 실험 1 | |||||||
| ) 가용성 분획 | CDG-CC는 = 5 μM | CDG-CC는 = 10 μM | ||||||||
| - | PA4843 | REC-REC-GGEEF * | 14/0 | 14/0 | 13/0 | 11/0 | 14/0 | 12/0 | 14/0 | 14/0 |
| WspR | PA3702 | REC-GGEEF * | 9/0 | 9/0 | 10/0 | 9/0 | 11/0 | 10/0 | 11/0 | 11/0 |
| - | PA2567 | GAF-SPTRF - EAL | 8/0 | 4/0 | 9/0 | 0/0 | 7/0 | 3/0 | 8/0 | 8/0 |
| - | PA3353 | 필츠 (Pilz) | 11/0 | 12/0 | 13/0 | 12/0 | 12/0 | 10/0 | 11/0 | 12/0 |
| - | PA0290 | PAS-GGDEF | 5/0 | 3/0 | 6/0 | 5/0 | 8/0 | 5/0 | 6/0 | 6/0 |
| - | PA5295 | GDDEF - EAL | 3/0 | 3/0 | 3/0 | 1/0 | 6/0 | 6/0 | 5/0 | 4/0 |
| FimX | PA4959 | PAS-GDSIF-EVL | 23/1 | 21/0 | 21/0 | 11/0 | 3분의 24 | 2분의 23 | 22/0 | 20/0 |
| - | PA4608 | 필츠 (Pilz) | 3/0 | 3/0 | 3/0 | 0/0 | 3/0 | 2/0 | 3/0 | 3/0 |
| - | PA0012 | 필츠 (Pilz) | 3/0 | 2/0 | 2/0 | 2/0 | 2/0 | 2/0 | 4/0 | 2/0 |
| - | PA2989 | 필츠 (Pilz) | 1/0 | 1/0 | 2/0 | 1/0 | 1/0 | 2/0 | 3/0 | 3/0 |
| - | PA4324 | 필츠 (Pilz) | 2/0 | 2/0 | 1/0 | 1/0 | 2/0 | 2/0 | 1/0 | 2/0 |
| - | PA3177 | GGEEF | 2/0 | 1/0 | 3/0 | 0/0 | 1/0 | 1/0 | 3/0 | 1/0 |
| - | PA4396 | REC-DEQHF | 0/0 | 1/0 | 4/0 | 0/0 | 1/0 | 0/0 | 5/0 | 1/0 |
| - | PA0169 | GGEEF * | 3/0 | 2/0 | 6/0 | 7/0 | 7/1 | 6/2 | 9/1 | 7/1 |
| - | PA2799 | 필츠 (Pilz) | 1/0 | 0/0 | 2/0 | 0/0 | 0/0 | 0/0 | 3/0 | 1/0 |
| - | PA5017 | PAS-GAF-PAS-ASNEF - EAL | 1/0 | 2/0 | 1/0 | 0/0 | 1/0 | 3/2 | 0/0 | 0/0 |
| - | PA5487 | GGEEF * | 0/0 | 0/0 | 0/0 | 1/0 | 1/0 | 0/0 | 1/0 | 1/0 |
| b) 막 분획 | CDG-CC는 = 5 μM | CDG-CC는 = 10 μM | ||||||||
| - | PA2072 | CHASE4-TM-PAS-GGDEF EAL- | 13/1 | 25/0 | 27/0 | 19/0 | 36/0 | 36/0 | 31/0 | 23/0 |
| - | PA0861 | TM-PAS-GGDEF-ELL | 6/1 | 14/0 | (1)3/0 | 10/0 | 17/0 | 18/0 | 13/0 | 8/0 |
| - | PA3353 | 필츠 (Pilz) | 6/0 | 10/0 | 9/0 | 7/0 | 10/0 | 10/0 | 6/0 | 5/0 |
| - | PA3343 | 5TM-GGDEF | 3/0 | 7/0 | 7/0 | 4/0 | 12/0 | 10/0 | 7/0 | 7/0 |
| - | PA1181 | MASE1-PAS-PAS-PAS-PAS-GGDEF-ELL | 3/0 | 6/0 | 9/0 | 3/0 | 12/0 | 12/0 | 5/0 | 2/0 |
| - | PA0847 | TM-CHASE4 - HAMP-PAS-GGDEF | 0/0 | 4/0 | 4/0 | 1/0 | 15/0 | 13/0 | 8/0 | 6/0 |
| - | PA0575 | PBPb-TM-PAS-PAS-PAS-PAS-GGDEF EAL- | 1/0 | 7/0 | 6/0 | 3/0 | 10/0 | 10/0 | 6/0 | 2/0 |
| yfiN | PA1120 | 2TM - HAMP-GGDEF | 2/0 | 4/0 | 3/0 | 3/0 | 5/0 | 4/0 | 3/0 | 1/0 |
| - | PA0290 | PAS-GGDEF | 1/0 | 4/0 | 3/0 | 2/0 | 1/0 | 5/0 | 1/0 | 2/0 |
| - | PA4929 | 7TMR : DISMED2-7TMR : DISMED2-GGDEF | 2/0 | 4/0 | 2/0 | 2/0 | 2/0 | 2/0 | 2/0 | 1/0 |
| 모라 | PA4601 | TM-TM-PAS-PAS-PAS-PAS-GGDEF EAL- | 3/0 | 7/0 | 7/3 | 5/0 | 9/0 | 10/0 | 5/0 | 4/0 |
| - | PA1851 | 5TM-GGDEF | 1/0 | 2/0 | 1/0 | 2/0 | 4/0 | 3/0 | 1/0 | 1/0 |
| - | PA2870 | TM-GGDEF | 0/0 | 0/0 | 1/0 | 0/0 | 4/0 | 4/0 | 4/0 | 2/0 |
| - | PA3311 | TM-MHYT-MHYT-MHYT-AGDEF - EAL | 1/1 | 5/0 | 7/1 | 4/0 | 8/0 | 8/0 | 5/1 | 3/0 |
| bifA | PA4367 | TM-GGDQF - EAL | 1/0 | 2/0 | 1/0 | 2/0 | 1/0 | 2/0 | 2/1 | 1/0 |
| - | PA4608 | 필츠 (Pilz) | 0/0 | 1/0 | 1/0 | 0/0 | 3/0 | 3/0 | 2/0 | 2/0 |
| - | PA4332 | 5TM-GGEEF | 1/0 | 3/0 | 2/0 | 1/0 | 1/0 | 1/0 | 2/0 | 0/0 |
| - | PA0012 | 필츠 (Pilz) | 1/0 | 1/0 | 1/0 | 1/0 | 1/0 | 1/0 | 1/0 | 0/0 |
| - | PA2989 | 필츠 (Pilz) | 4/0 | 8/0 | 7/0 | 7/0 | 5/2 | 11/2 | 7/2 | 8/3 |
| - | PA1433 | HAMP-RGGEF-KVL | 0/0 | 0/0 | 0/0 | 0/0 | 1/0 | 1/0 | 1/0 | 1/0 |
| - | PA4843 | REC-REC-GGEEF | 0/0 | 0/0 | 1/1 | 1/0 | 0/0 | 1/0 | 1/0 | 0/0 |
| * = GGDEF 도메인 I 사이트를 포함 | ||||||||||
| 확인 된 펩타이드의 스펙트럼 카운트 한 수 | ||||||||||
표 3 : P. 본문에 설명 된 구성 요소를 구체적으로 캡처 시그널링 녹농균 공지 C-GMP는 디. 확인 된 단백질은 제 정렬 하였다. 단백질은 자신의 이름과 궤적 번호로 식별, 우리는 그들의 아키텍처가 캡처 특이성과 재현성을 보여주기 위해 (N = 4, CDG-CC = 5 μM, 10 μM) NCBI 보존 도메인 데이터베이스 온라인 도구를 사용하여 예측 표시된다 방법.
토론
특별한주의가 프로토콜의 여러 단계에서주의해야한다. 단백질 농도가 10 ㎎의 농도를 갖는 중요한 파라미터이다 / ml의 세포가 특정한 성장 조건 (예를 들면 작은 콜로니 생물막 또는 변이체) 하에서 성장 될 때 도달하기 힘들어. 따라서, 펠릿 부유 용균 완충액 저용량에서 수행되어야한다. 단백질 농도는 8 ㎎ / ㎖로 감소 될 수있다. Nesper 외. (1)에 의해 게시 된 방법과 비교하여, 우리는 뉴클레오티드 결합 단백질의 비특이적 포획을 최소화하기 위해 캡처 반응물에 다양한 뉴클레오타이드를 첨가. 뉴클레오티드 첨가 특이성을 개선하지만, 동시에 동일한 사이트의 서로 다른 뉴클레오티드 결합 단백질의 포착을 방지 할 수있다. 예를 들어 최근에 도시 된 효과기 FleQ는 ATP와 결합하는 C 디 GMP D 18 이상으로 한 우리의 이전의 실험에서 ATP의 부재하에 구체적 고기 잡이 아닌시켰다ATA ATP의 과잉 존재하에 여기에 제시된.
CDG-CC는 신중하게 빛으로부터 보호되어야한다. 주변 광이 UV의 작은 부분을 포함하지만, 알루미늄 호일로 싸서 캡처 복합 콘텐츠뿐만 아니라 UV 조사에 의해 활성화되기 전에 캡쳐 믹스 보관하여주십시오. 따라 세척 단계는 캡처 된 단백질에 공유 CDG-CC에 결합되므로, 특이성을 높이기 위해 매우 엄격 할 수있다. LC-MS / MS 분석에 관해서는, 실험은 깨끗한 각질없는 환경에서 수행되어야한다. 또한, HPLC 호환 버퍼는 특히 세척 단계 후, 사용되어야한다. 후보리스트는 전형적 복제물 (예로서 표 2 참조) 사이에 낮은 변형을 (사통 용) 300 내지 800의 단백질을 포함한다.
단백질과 CDG-CC 농도와 같은 일부 매개 변수는 유기체에 따라 최적화 할 필요가 있습니다nalyzed. 특정 조건 하에서 발현 둘러 풍부한 단백질 또는 단백질 쉽게 놓칠 수 있기 때문에,주의가 채용 배양 조건에 관한주의해야한다. 이 문제는 동일한 배양 조건 수집 글로벌 단백질 ATLAS와 적중 목록을 비교하여 극복 될 수있다. 이 막 단백질을 가용화 할 수있는 능력에 대하여 최적화 될 필요가 있고 또한 MS 호환 될 필요가 마지막으로, 세제의 최적화는, 문제가 될 수있다.
하나는이 발판의 나머지 한 리보오스의 2'OH 그룹을 통해 연결되어 같이 CC의 C 디 GMP 분자가 화학적으로 변형되는 것을 명심해야합니다. 이 수정하여 거짓 네거티브 필름을 제공하는 몇 가지 이펙터와 결합 할 수있는 능력을 변경할 수 있습니다. 이러한 맥락에서 우리가 EAL 도메인을 품고 있지만, P.의 GGDEF 도메인이 부족한 단백질을 캡처 결코 주목할 필요가있다 녹농균, EAL 단백질은 컬 같은 다른 종에서 캡처 되었더라도obacter crescentus. 이것은 가난한 액세스 또는 결합 부위에, 또는 EAL 단백질에 의해 CDG-CC의 분해에 CDG-CC의 선호도가 낮은 원인 일 수 있습니다. 반면에, 많은 염기 결합 단백질은 큰 정도, 아마 잘못된 반응이다, 상대적으로 낮은 특이도 포착했다. 예컨대 DRaCALA 20과 같은 기술을 사용하여 C 디 GMP에 결합하는 특정의 추가의 검증, UV 15 가교, 시차 주사 fluorimetry (DSF) (21), 마이크로 스케일 열 영동 (MST) (22)는 등온 열량 측정 (ITC) 23-24은 ...이다 따라서 필요.
이것은 캡처 화합물 C 디 GMP 잔기의 분획을 세포 용 해물에서 포스 포에 의해 분해되는 것 또한 가능하다. 따라서 이것은 가교 전에 포스 포 활동을 제한 절차는 4 ℃에서 수행되어야하는 이유 중 하나이다.
procedu다시 많은 박테리아 종에 적용 할 수 있으며, 성공적으로 아주 약간의 수정 1과 3 개의 다른 종의 박테리아에 사용되고 있습니다. 캡처 화합물 기반 기술은 철저한 세정을 사용하여 가양 성을 감소시킬 수있다 (예를 들어 1 M 염, 높은 세제 농도, 막 단백질, 80 % 아세토 니트릴 경우에 2 M 우레아)의 공유 결합에 의존하지 않는 다른 기술에 비해,. 후보 검증이 지루하고 시간이 많이 걸리는 과정이 될 수 있음을 감안할 때,이 기반 화학 단백질 체학 (proteomics)와 같은 대체 방법의 주요 장점은 (14) 접근 방법이다.
이 그림 비디오 방법은 파악하고 작은 분자 신호 전달에 관여하는 새로운 구성 요소를 특징 짓는 강력하고 다양한 도구로 CCMS를 설정합니다. 미래에, 다른 그룹 선택성을 보유하는 유사한 캡처 화합물은 신규 한 C 디 AMP 이펙터 소분자 시그널링에 관여하는 단백질을 캡처하는 데 사용될 수있다.
공개
The authors have nothing to disclose.
감사의 말
We thank Alberto Reinders for his work in optimizing the CCMS conditions for P. aeruginosa. We also thank Pablo Manfredifor the annotation of the P. aeruginosa proteins. This work was supported by the Swiss National Science Foundation (SNF) Sinergia grant CRSII3_127433.
자료
| Name | Company | Catalog Number | Comments |
| caproBox | caprotec bioanalytics | 1-5010-001 (220 V) | UV lamps coupled to a cooling 96-plate cooling block, for the photoactivation |
| caproMag | caprotec bioanalytics | included in the CCMS Starter Kit | For easy handling of magnetic particles without pipetting |
| c-di-GMP caproKit | caprotec bioanalytics | upon request | The kit contains the c-di-GMP-capture compound, c-di-GMP (for the competition control), streptavidin coated magnetic beads, capture buffer, and washing buffer |
| Disposable PD-10 Desalting Columns | GE Healthcare | 17-0851-01 | |
| 12-tube PCR strips | Thermo Scientific | AB-1114 | |
| UIS250v sonicator with VialTweeter | Hielscher ultrasound technology | UIS250v and VialTweeter | |
| Miniature French Pressure Cell | Thermo Electron Corporation | FA-003 |
참고문헌
- Nesper, J., Reinders, A., Glatter, T., Schmidt, A., Jenal, U. A novel capture compound for the identification and analysis of cyclic di-GMP binding proteins. J Proteomics. 75, 4874-4878 (2012).
- Hengge, R. Principles of c-di-GMP signalling in bacteria. Nature reviews. Microbiology. 7, 263-273 (2009).
- Sondermann, H., Shikuma, N. J., Yildiz, F. H. You've come a long way: c-di-GMP signaling. Curr. Opin. Microbiol. 15, 140-146 (2012).
- Schirmer, T., Jenal, U. Structural and mechanistic determinants of c-di-GMP signalling. Nature reviews. Microbiology. 7, 724-735 (2009).
- Furukawa, S., Kuchma, S., O'Toole, G. Keeping their options open: acute versus persistent infections. J. Bacteriol. 188, 1211-1217 (2006).
- Christen, M., Christen, B., Folcher, M., Schauerte, A., Jenal, U. Identification and characterization of a cyclic di-GMP-specific phosphodiesterase and its allosteric control by GTP. J. Biol. Chem. 280, 30829-30837 (2005).
- Ryan, R. P., Fouhy, Y., Lucey, J. F., Dow, J. M. Cyclic di-GMP signaling in bacteria: recent advances and new puzzles. J. Bacteriol. 188, 8327-8334 (2006).
- Habazettl, J., Allan, M. G., Jenal, U., Grzesiek, S. Solution structure of the PilZ domain protein PA4608 complex with cyclic di-GMP identifies charge clustering as molecular readout. J. Biol. Chem. 286, 14304-14314 (2011).
- Fazli, M., et al. The CRP/FNR family protein Bcam1349 is a c-di-GMP effector that regulates biofilm formation in the respiratory pathogen Burkholderia cenocepacia. Molecular Microbiology. 82, 327-341 (2011).
- Hickman, J. W., Harwood, C. S. Identification of FleQ from Pseudomonas aeruginosa as a c-di-GMP-responsive transcription factor. Molecular Microbiology. 69, 376-389 (2008).
- Sudarsan, N., et al. Riboswitches in eubacteria sense the second messenger cyclic di-GMP. Science. 321, 411-413 (2008).
- Lenz, T., et al. Profiling of methyltransferases and other S-adenosyl-L-homocysteine-binding Proteins by Capture Compound Mass Spectrometry (CCMS). J Vis Exp. , (2010).
- Köster, H., et al. Capture compound mass spectrometry: a technology for the investigation of small molecule protein interactions. Assay Drug Dev Technol. 5, 381-390 (2007).
- Düvel, J., et al. A chemical proteomics approach to identify c-di-GMP binding proteins in Pseudomonas aeruginosa. Journal of Microbiological Methods. 88, 229-236 (2012).
- Christen, B., et al. Allosteric control of cyclic di-GMP signaling. J. Biol. Chem. 281, 32015-32024 (2006).
- Balasubramanian, D., Mathee, K. Comparative transcriptome analyses of Pseudomonas aeruginosa. Human genomics. 3, 349-361 (2009).
- Smyth, G. K. Linear models and empirical bayes methods for assessing differential expression in microarray experiments. Stat Appl Genet Mol Biol. 3 (3), (2004).
- Baraquet, C., Harwood, C. S. Cyclic diguanosine monophosphate represses bacterial flagella synthesis by interacting with the Walker A motif of the enhancer-binding protein FleQ. Proc. Natl. Acad. Sci. U.S.A. 110, 18478-18483 (2013).
- Nesper, J., Reinders, A., Glatter, T., Schmidt, A., Jenal, U. A novel capture compound for the identification and analysis of cyclic di-GMP binding proteins. J Proteomics. 75, 4874-4878 (2012).
- Roelofs, K. G., Wang, J., Sintim, H. O., Lee, V. T. Differential radial capillary action of ligand assay for high-throughput detection of protein-metabolite interactions. Proc. Natl. Acad. Sci. U.S.A. 108, 15528-15533 (2011).
- DeSantis, K., Reed, A., Rahhal, R., Reinking, J. Use of differential scanning fluorimetry as a high-throughput assay to identify nuclear receptor ligands. Nuclear receptor signaling. 10, e002(2012).
- Seidel, S. A., et al. Microscale thermophoresis quantifies biomolecular interactions under previously challenging conditions. Methods. 59, 301-315 (2013).
- Merighi, M., Lee, V. T., Hyodo, M., Hayakawa, Y., Lory, S. The second messenger bis-(3‘-5’)-cyclic-GMP and its PilZ domain-containing receptor Alg44 are required for alginate biosynthesis in Pseudomonas aeruginosa. Molecular Microbiology. 65, 876-895 (2007).
- Qi, Y., et al. Binding of cyclic diguanylate in the non-catalytic EAL domain of FimX induces a long-range conformational change. J. Biol. Chem. 286, 2910-2917 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유