JoVE Science Education
General Chemistry
次の方法でこのコンテンツにアクセスいただけます。
Nanyang Technological University経験式を決定します。
概要
ソース: 環境科学および林業のニューヨーク州立大学博士ニール エイブラムス講座
何かの化学実験室で毎日心では化合物の化学式を決定します。この決定を支援する多くのツールがありますが、経験式の決定である最も簡単な (そして最も正確) の一つ。なぜこれが便利なのか。質量保存の法則のため任意の反応は重量測定、または質量の変化によって続くことができます。経験式は、分子化合物内の要素 (または化合物) の中で最小の整数比を提供します。この実験で、重量分析が使用、塩化銅水和物、CuxCly·nH2o. 実験式を決まります
原則
水和物は、化合物に接続されている (共有結合ではない) が水の分子を持っている化学物質の化合物です。水和する数式は、化合物と水の分子との間にドット (「·」) に象徴されます。水和物は、簡単を残して水を除いた無水化合物、加熱時に水分を失います。この場合、塩化銅、銅xClyでしょう。無水と水和塩の形態の質量の違いは、化学化合物銅xCly·水の質量 (およびモル) に対応します。nH2o.無水塩化銅は水に溶解し、銅はフォーム固体銅とアルミニウムの酸化還元反応によって削除されます。合計塩化銅水和物と還元銅金属と水の分子の合計質量の差は、サンプル中の塩化物量に対応します。(Cu, Cl, H2O) の各コンポーネントの質量はモル、倍数比例の法則という化合物の実験式を決定する率を使用して変換されます。化合物の真の化学式は、その分子の質量を知らなくても判断できないが、比率が常に同じ。
手順
1. 水和物の脱水
- 正確に塩化銅水和物のサンプルの重量を量るし、乾燥と tared るつぼに入れます。るつぼは吸着した水分を駆動する 120 ° c 乾燥していることが重要です。一般に、化合物の 1-2 g で十分です。
- 緑がかった青から色が変わるまで、ブンゼン バーナーやその他の火炎のソースを使用してサンプルを熱に赤褐色 (図 1)。この色の変化は、塩化銅の無水の形を表しています。カバーは、飛散防止にるつぼに滞在することができますが、水蒸気をエスケープするを許可するようにわずかに開く必要があります。
- 水は全体のサンプルをオフ駆動色、全体で一定であることを確認するサンプルをかき混ぜます。
- 代わりに、サンプルを 110 ° c. の上の乾燥オーブンに配置できます。
- 乾燥器でサンプルを冷却します。これは水がサンプルを復元することを防ぎます。
- 無水試料の質量を測定します。違いは、加熱時に失われた水和物から水に対応しています。

図 1.セラミックるつぼ、ブンゼン バーナー 。
2. 銅を分離します。
- 100 mL ビーカーにサンプルを転送し、脱イオン水 50 mL に試料を溶解します。ソリューションが青で点灯水和固体より青より通常のもう一度。
- ビーカーにアルミニウム金属の少量 (~0.20 g) を追加します。これは、赤みを帯びた金属を削減する銅とアルミ、無色 Al3 +へ酸化します。Cu2 +イオン形銅0としてソリューションの青い色が消えるはずです。30 分後、銅のすべては固体銅に減るようにアルミの追加の小さな断片を追加します。
- ソリューションには、Al3 +イオン、固体銅とアルミニウムの少量が含まれています。
- 〜 5 mL 6 M 塩酸アルミニウムは両性である、それに反応することができますを意味を追加し、酸または塩基の存在下での溶解によって任意の余分なアルミニウムを溶解します。
- 真空は、あらかじめ重量を量られた濾紙片を含む Büchner 漏斗で無色の溶液をフィルター処理します。無水エタノールでリンスします。空気乾燥 (ないオーブン乾燥) 銅の (II) 酸化物の形成を防ぐためにサンプル。
- 固体差による塩化物イオンの質量を決定する銅の質量を測定します。
3. 計算
- 違いによる塩化物イオンの質量を決定します。
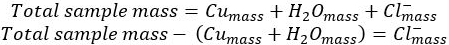
- 混合物の各成分のモル質量を使用すると、各コンポーネントのモグラを決定します。
- 最小整数成分の割合、化合物の実験式として知られているを与える最小のコンポーネントのモルによって各成分のモルを分割します。
結果
- 実験
- るつぼで塩化銅水和物の 1.25 g を加熱します。加熱・冷却し後、最終的な質量は、塩化銅、銅xClyの 0.986 g です。
- 50 mL の脱イオン水に銅xCly試料を溶かし、細かいアルミ メッシュの 0.2 g をビーカーに追加します。
- 反応して、余分なアルミニウムを溶解後乾燥銅金属 0.198 g は回復します。
- サンプルでは塩化物イオンの質量を生成する初期塩化銅水和物から銅と水の質量を引きます。
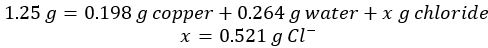
- データ
- 化合物のコンポーネントの最小整数比を決定するには、各コンポーネントの質量をモルに変換し、(この場合は銅) のサンプルのモルの数が最小でそれぞれを分割します。
コンポーネント 質量 (g) モル質量 (g/mol) モグラ 比 整数比を計算 銅 0.479 63.55 x 10-3 7.53 
1 塩化 0.533 35.45 10-2 x 1.50 
1.99 ≈ 2 水 0.273 18.01 10-2 x 1.51 
2.01 ≈ 2 表 1。実験結果。
- 結果として得られる最小整数比利回り式 CuCl2·2 H2o.
- 最終的な比率の結果 10 進数の値が、イベント全体の数式に整数値の定数が掛けたでしょう。一般的な分数値が 0.25、づつ、0.50、0.667、正確な 0.75 です。たとえば、数式が得られた最小整数比はない2.5C7H9を得、実験式 C ・14H18N2O52 によって、数式全体を掛けた値でしょう。
- 化合物の分子量を知らなくても実験式から分子式を決定できません。次の例では、この理由は示されます。
名 分子式 実験式 酢酸 CH3COOH CH2O ホルムアルデヒド CH2O CH2O グルコース C6H12O6 CH2O 表 2。一般的な経験式の例です。
すべての 3 つの化合物はある非常に異なる分子式が同じの経験式です。
申請書と概要
1 つの例で、唯一の C、H を含む不明な生体分子を仮定し、O が新しい燃料としてよく認められます。燃料の数式を決定する 1 つの方法は、空気で燃焼することし、製品の分析します。
CxHyOz O2 → mCO2 + nH2O
O2は過剰では、生体由来の CO2のすべての炭素を知っているだろう私たちとすべての水素は H2o. に存在します。その総質量と初期サンプルの質量の違いは分子中の酸素の質量になります。モグラに変換し、実験式を決定することができます。
別の例で、MgxCly·水和物サンプルnH2O が与えられます。水の分子の質量は再び加熱することにより簡単に決定でしょう。いくつかの容解性の規則を使用して、塩化物はそれから AgCl(s)を形成する+、Ag 銀イオンと沈殿します。塩化銀(s)の質量が見つかったら、Cl-のモル AgCl(s)のモル質量を使用して決定、Cl-のグラムに変換されます。これは経験式に続いてサンプルでは Mg の質量を決定することになります。
実際の分子式を識別するセンターでは経験式を決定します。フォレンジック医薬品から分子式の決定は、次のステップに経験式を取ることを意味不明な化合物を識別するキーです。通常、実験式の定量元素分析元素の重量パーセントの情報を取得する結合されます。これらのデータからモル比を計算し、実験式が決定されます。質量分析計のような他の分析ツールを用いた分子の質量を決定できます。その後、真の分子式を決定する分子固まりと経験的質量の比率が計算されます。
スキップ先...
このコレクションのビデオ:

Now Playing
経験式を決定します。
General Chemistry
181.5K 閲覧数

共通の実験室ガラス製品と用途
General Chemistry
655.7K 閲覧数

・濃度
General Chemistry
274.0K 閲覧数

固体と液体の密度を決定します。
General Chemistry
555.9K 閲覧数

水溶液の質量パーセントの組成を決定します。
General Chemistry
383.4K 閲覧数

イオン性化合物の溶解度ルールの決定
General Chemistry
141.3K 閲覧数

PH メーターを使用してください。
General Chemistry
345.4K 閲覧数

滴定の概要
General Chemistry
424.2K 閲覧数

理想気体法律
General Chemistry
78.4K 閲覧数

平衡定数の吸光光度定量
General Chemistry
158.4K 閲覧数

ル Châtelier の原理
General Chemistry
265.0K 閲覧数

未知の化合物を決定するための凝固点降下
General Chemistry
160.6K 閲覧数

率の法律および反作用の順序を決定します。
General Chemistry
196.0K 閲覧数

エンタルピーの示差走査熱量測定の変更を使用してください。
General Chemistry
44.5K 閲覧数

錯体化学
General Chemistry
91.4K 閲覧数
ISSN 2578-6067
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。