קביעת הנוסחה האמפירית
Overview
מקור: המעבדה של ד"ר ניל אברמס - מכללת SUNY למדעי הסביבה ויערנות
קביעת הנוסחה הכימית של תרכובת היא בלב מה כימאים עושים במעבדה כל יום. כלים רבים זמינים כדי לסייע בקביעה זו, אבל אחד הפשוטים (והמדויקים ביותר) הוא קביעת הנוסחה האמפירית. למה זה שימושי? בגלל חוק שימור המסה, כל תגובה יכולה להיות מלווה באופן כבידתי, או על ידי שינוי במסה. הנוסחה האמפירית מספקת את יחס המספר השלם הקטן ביותר בין אלמנטים (או תרכובות) בתוך תרכובת מולקולרית. בניסוי זה, ניתוח כבידתי ישמש כדי לקבוע את הנוסחה האמפירית של נחושת כלוריד hydrate, CuxCly·nH2O.
Principles
הידרטים הם תרכובות כימיות שיש להן מולקולות מים מחוברות (אך לא מלוכדות באופן קוולנטי) לתרכובת. נוסחאות לחות מסמלות נקודה ("·) בין התרכובת למולקולת המים. לחות בקלות לאבד מולקולות מים על חימום, משאיר מאחור את תרכובת נטול מים (ללא מים). במקרה זה, זה יהיה נחושת כלוריד, CuxCly. ההבדל במסה בין הצורות נטולות התייבשות והלח של המלח מתאים למסה (ומולים) של מים בתרכובת הכימית CuxCly· nH2O. כלוריד נחושת נטול מים מומס לאחר מכן במים, והנחושת מוסרת באמצעות תגובה אדומה עם אלומיניום ליצירת נחושת מוצקה. ההבדל במסה בין הידרציה נחושת כלורי הכולל ואת הסכום של מתכת נחושת מופחתת ומולקולות מים מתאים המסה של כלוריד במדגם. המסה של כל רכיב (Cu, Cl, H2O) מומרת שומות, לפיה החוק של פרופורציות מרובות מאפשר שימוש ביחס כדי לקבוע את הנוסחה האמפירית של המתחם. הנוסחה הכימית האמיתית של המתחם לא ניתן לקבוע מבלי לדעת את המסה המולקולרית שלה, אבל היחס תמיד יישאר זהה.
Procedure
1. מייבש את הידרציה
- שוקלים במדויק דגימה של לחות כלוריד נחושת ומניחים אותו לתוך כור היתוך מיובש מראש מזופת. חשוב כי כור ההיתוך מיובש מעל 120 °C (70 °F) כדי לגרש כל לחות ספיחה. בדרך כלל, 1-2 גרם של תרכובת יספיק.
- מחממים את המדגם באמצעות מבער בונזן או מקור להבה אחר עד שהוא משנה צבע מכחול ירקרק לחום אדמדם(איור 1). שינוי צבע זה מעיד על הצורה נטולת התייבשות של כלוריד נחושת. הכיסוי יכול להישאר על כור ההיתוך כדי למנוע התזה, אבל צריך להיפתח מעט כדי לאפשר אדי מים לברוח.
- מערבבים את המדגם כדי להיות בטוחים שהמים מונעים מהדגימה כולה והצבע קבוע לאורך כל הדרך.
- כחלופה, ניתן להכניס את הדגימה לתנור ייבוש מעל 110 מעלות צלזיוס.
- מצננים את הדגימה במתן. זה מונע מים rehydrating המדגם.
- למדוד את המסה של מדגם נטול מים. ההבדל מתאים למים מן הידרציה שאבדה עם חימום.

איור 1. מבער בונזן עם כור היתוך קרמי.
2. בידוד נחושת
- מעבירים את הדגימה ל-100 מ"ל וממיסים את המדגם ב-50 מ"ל של מים דה-יוניים. הפתרון צריך להפוך כחול שוב, בדרך כלל יותר כחול מאשר מוצק hydrated.
- הוסף כמות קטנה (~ 0.20 גרם) של מתכת אלומיניום לכלוב. זה יגרום הנחושת להפחית מתכת אדמדמה, ואת האלומיניום יהיה חמצון אל3 +חסר צבע . הצבע הכחול של הפתרון צריך להיעלם כמו Cu2 + יונים טופס Cu0. לאחר 30 דקות, להוסיף חתיכות קטנות נוספות של אלומיניום כדי להבטיח את כל הנחושת מופחת נחושת מוצקה.
- הפתרון מכיל כעת אל3+ יונים, נחושת מוצקה וכמות קטנה של אלומיניום מוצק.
- להמיס כל עודף אלומיניום על ידי הוספת ~ 5 מ"ל של 6 M HCl. אלומיניום הוא amphoteric, כלומר זה יכול להגיב ולהתמוסס בנוכחות חומצה או בסיס.
- מסננים ואקום את הפתרון חסר הצבע במשפך Büchner המכיל פיסת נייר סינון ששוקלת מראש. יש לשטוף באתנול מוחלט. יבש אוויר (לא תנור יבש) המדגם כדי למנוע היווצרות של תחמוצת נחושת (II).
- למדוד את המסה של מוצק נחושת כדי לקבוע את המסה של יון כלוריד על ידי הבדל.
3. חישובים
- קבע את המסה של יון הכלוריד לפי הבדל:
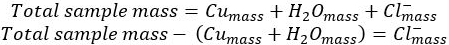
- השתמש במסה הטוחנת של כל רכיב של המתחם כדי לקבוע את המולים של כל רכיב.
- חלק את השומות של כל רכיב על ידי מולות של הרכיב הקטן ביותר כדי לתת את יחס המספר השלם הקטן ביותר של רכיבים, הידוע גם בשם הנוסחה האמפירית של המתחם.
Results
- ניסוי
- מחממים 1.25 גרם של נחושת כלוריד לחות כור היתוך. לאחר חימום ולאחר מכן קירור, המסה הסופית היא 0.986 גרם של נחושת כלוריד, CuxCly.
- להמיס את מדגם CuxCly ב 50 מ"ל של מים deionized ולהוסיף 0.2 גרם של רשת אלומיניום בסדר לכוס.
- לאחר תגובה והמסת עודף אלומיניום, 0.198 גרם של מתכת נחושת מיובשת הוא התאושש.
- הפחת את המסה של נחושת ומים מן הידרציה נחושת הראשונית כדי להניב את המסה של יון כלוריד במדגם:
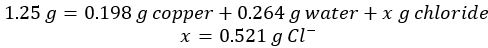
- נתונים
- כדי לקבוע את יחס המספר השלם הקטן ביותר של רכיבים במתחם, להמיר את המסה של כל רכיב מולים ולאחר מכן לחלק כל אחד על ידי המספר הקטן ביותר של שומות במדגם (נחושת במקרה זה):
רכיב מסה (ז) מסת טחנת (g/מול) שומות יחס יחס מספר שלם מחושב נחושת 0.479 63.55 7.53 x 10-3 
1 כלוריד 0.533 35.45 1.50 x 10-2 
1.99 ≈ 2 מים 0.273 18.01 1.51 x 10-2 
2.01 ≈ 2 טבלה 1. תוצאות ניסוי.
- יחס המספר השלם הקטן ביותר שנוצר מניב נוסחה של CuCl2· 2H2O.
- במקרה שהיחס הסופי מניב ערכים עשרוניים, הנוסחה כולה תוכפל בקבוע כדי להעניק ערכי מספרים שלמים. ערכי שבר נפוצים הם 0.25, 0.333, 0.50, 0.667 ו- 0.75. לדוגמה, אם יחס המספר השלם הקטן ביותר הניב את הנוסחה הניבה C7H9NO2.5, הנוסחה כולה תוכפל ב- 2 כדי לתת את הנוסחה האמפירית C14H18N2O5.
- נוסחה מולקולרית לא יכולה להיקבע מהנוסחה האמפירית מבלי לדעת את המסה המולקולרית של המתחם. הסיבה לכך מודגמת בדוגמה שלהלן:
שם נוסחה מולקולרית נוסחה אמפירית חומצה אצטית CH3COOH CH2O פורמלדהיד CH2O CH2O גלוקוז C6H12O6 CH2O טבלה 2. דוגמה לנוסחה אמפירית נפוצה.
לכל שלוש התרכובות יש את אותה נוסחה אמפירית, אבל נוסחאות מולקולריות שונות מאוד.
Application and Summary
בדוגמה אחת, נניח ביומולקול לא ידוע המכיל רק C, H, ו- O נמצא לפעול היטב כמו דלק חדש. דרך אחת לקבוע את הנוסחה של הדלק תהיה דליק אותו באוויר ולנתח את המוצרים:
CxHyOz + O2 → mCO2 + nH2O
בעוד O2 הוא עודף, היינו יודעים את כל הפחמן בפחמן דוחמצני שמקורו biomolecule וכל המימן יהיה נוכח H2O. ההבדל בין המסה הכוללת לבין המסה של הדגימה הראשונית יהיה מסת החמצן במולקולה. לאחר מכן נוכל להמיר שומות ולקבוע את הנוסחה האמפירית.
בדוגמה אחרת, דגימת הידרציה של MgxCly· nH2O ניתן. המסה של מולקולות המים שוב תיקבע בקלות על ידי חימום. באמצעות כמה כללי מסיסות, כלוריד הוא לאחר מכן מזורז עם יון כסף, Ag+, כדי ליצור AgCl(ים). לאחר המסה של AgCl(ים) נמצא, מולים של Cl- נקבעים באמצעות המסה הטוחנת של AgCl(ים) ולאחר מכן המרה לגרמים של Cl-. זה יאפשר לנו לקבוע את המסה של Mg במדגם ואחריו הנוסחה האמפירית.
קביעת נוסחה אמפירית נמצאת במרכז זיהוי הנוסחה של המולקולה עצמה. מתרופות לזיהוי פלילי, קביעת נוסחה מולקולרית היא המפתח לזיהוי תרכובת לא ידועה, כלומר לקחת את הנוסחה האמפירית לשלב הבא. בדרך כלל, הקביעה של נוסחה אמפירית משולבת עם ניתוח אלמנטרי כדי לקבל מידע אחוז משקל אלמנטרי. מנתונים אלה מחושבים יחסי הטוחנת ונקבעת הנוסחה האמפירית. אנחנו יכולים לקבוע את המסה של מולקולה באמצעות כלי אנליטי אחר, כמו ספקטרומטר מסה. לאחר מכן, היחס בין המסה המולקולרית למסה אמפירית מחושב כדי לקבוע את הנוסחה המולקולרית האמיתית.
Skip to...
Videos from this collection:

Now Playing
קביעת הנוסחה האמפירית
General Chemistry
179.9K Views

כלי זכוכית ושימושים נפוצים במעבדה
General Chemistry
653.2K Views

פתרונות וריכוזים
General Chemistry
273.0K Views

קביעת הצפיפות של מוצק ונוזל
General Chemistry
554.7K Views

קביעת הרכב אחוז המסה בפתרון מימי
General Chemistry
383.0K Views

קביעת כללי המסיסות של תרכובות יוניות
General Chemistry
141.1K Views

שימוש במד pH
General Chemistry
344.2K Views

מבוא לתמצית
General Chemistry
423.3K Views

חוק הגז האידיאלי
General Chemistry
78.1K Views

קביעת ספקטרופוטומטריה של קבוע שיווי משקל
General Chemistry
158.2K Views

עקרון לה שאטלייה
General Chemistry
263.9K Views

דיכאון נקודת הקפאה כדי לקבוע תרכובת לא ידועה
General Chemistry
160.4K Views

קביעת חוקי התעריפים וסדר התגובה
General Chemistry
195.7K Views

שימוש בסריקה דיפרנציאלית קלורימטריה למדידת שינויים באנטלפיה
General Chemistry
44.4K Views

מתחמי כימיה של תיאום
General Chemistry
91.2K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved