Method Article
腫瘍微小環境PETイメージングのための合成モジュール上の[68Ga]Ga-3BP-3940の自動調製
要約
本研究では、GAIA V2シンセサイザーを用いた[68Ga]Ga-3BP-3940作製の自動化プロセスについて、線維芽細胞活性化タンパク質のPETイメージングについて述べる。また、3つのテストバッチで実施された品質管理テストの結果も紹介します。
要約
腫瘍微小環境の陽電子放出断層撮影イメージングのための線維芽細胞活性化タンパク質を標的とする分子イメージングプローブである3BP-3940の自動ガリウム68放射性標識のためのGAIA合成モジュールで、高速で効率的な方法が開発されました。反応条件は、アセテート緩衝液(最終濃度0.1 M)、放射線分解防止剤としてのメチオニン(最終濃度:5.4 mg/mL)、3BP-3940 30 μgを98°Cで8分間加熱しました。 C18 カートリッジの最終精製ステップは、高純度の放射性標識製品を得るために必要でした。対照的に、発電機で製造された 68Gaは、陽イオン交換カートリッジの濃縮ステップなしで直接使用されました。3つのバリデーションバッチを作製した結果、この分析法の信頼性が確認され、無線HPLC(99.1%±0.1%)と無線TLC(99.2%±0.1%)の両方で測定される高い放射性化学的純度(RCP)で[68Ga]Ga-3BP-3940±0.6分で合成することができました。ラジオHPLCで測定したRCP値に基づく平均放射性化学収量は、74.4%±3.3%でした。放射性標識産物の安定性は、調製後最大4時間実証されました。このプロトコールは、[68Ga]Ga-3BP-3940の調製のための信頼性、迅速性、効率的な方法論を提供し、臨床現場に容易に転置することができます。
概要
近年、腫瘍微小環境(TME)を標的とすることは、診断および治療への応用において大きな関心を集めています1。TMEには、細胞の種類、シグナル伝達分子、細胞外マトリックス(ECM)高分子が豊富に存在するため、さまざまな潜在的な分子標的がもたらされます2。常在する宿主細胞と浸潤する宿主細胞の中で、がん関連線維芽細胞(CAF)はTME内の線維芽細胞の明確なサブセットを形成し、正常な線維芽細胞とは異なる表現型です。CAFは、独自の細胞および分子特性を通じて、腫瘍の進行、転移、免疫回避、および治療抵抗性に重要な役割を果たします3。これらの間葉系細胞は、線維芽細胞活性化タンパク質(FAP)の発現によって特徴付けられる活性化表現型を示します。分子的には、CAFはサイトカイン、ケモカイン、成長因子(TGF-β、IL-6、CXCL12など)、およびECMタンパク質(コラーゲン、フィブロネクチンなど)の複雑な配列を分泌し、ECMを再構築し、腫瘍形成促進環境を促進します4。
FAPは、CAF膜の細胞外表面に過剰発現し、局在する特異性の高いタンパク質として、特に核医学および放射性医薬品の用途において、信頼性の高い分子標的のすべての特性を示します5。これに関連して、DOTA基で官能化されたキノリンベースのFAPの低分子阻害剤(FAPI)が開発され、臨床使用に迅速に導入されました6,7,8。具体的には、陽電子放出断層撮影法(PET)イメージング用のガリウム-68(β+エミッター、t1/2 = 68分)で放射性標識されたFAPI-04およびFAPI-46は、線維性疾患、心臓病学、および腫瘍学8,9、特に[18F]フルオロデオキシグルコース([18F]FDG)の有用性が限られている癌に対して有意な価値を示しています10.しかし、腫瘍学および非悪性疾患のイメージングへの貢献は否定できない一方で、低分子FAPIは、特に腫瘍内滞留時間が最適ではないため、標的放射性核種療法(TRT)のアプリケーションに対して一定の制限を示し、健康な組織への意図しない照射につながる可能性があります11。この問題に対処するために、多価リガンドの設計11,12や半減期の短い治療用放射性核種の使用13,14,15など、いくつかの戦略が検討されてきた。FAPに対する親和性が高く、細胞内在化を高い割合で引き起こす新しい分子スキャフォールドも開発されています。
これらの1つは、偽ペプチド誘導体FAP-2286です。これは、1,3,5-ベンゼントリメタンチオール部分16によって環化され、DOTAキレート剤に結合された7-アミノ酸配列を含んでいます。ヒトでの最初の研究では、[68Ga]Ga-FAP-2286は[68Ga]Ga-FAPI-46と同様の生体内分布プロファイルを示し、肝臓、腎臓、および心臓での生理学的取り込みがわずかに高いことが実証されました17。この研究では、主に首、肝臓、胃、膵臓、卵巣、食道のがんを患っている64人の患者が、がんの病期分類または再発の検出のために[68Ga]Ga-FAP-2286によるPETイメージングを受けました。[68Ga]Ga-FAP-2286の取り込みは、原発腫瘍、リンパ節転移、および遠隔転移において[18F]FDGよりも著しく高く、画像のコントラストと病変の検出可能性が向上しました。[68Ga]Ga-FAP-2286 PET/CTではすべての原発腫瘍が認められたが、[18F]FDG PET/CTでは病変のほぼ20%が欠落していた。浸潤リンパ節の検出率は、[68Ga]Ga-FAP-2286、骨転移および内臓転移で高かった。さまざまながん疾患の患者21人の小規模なグループを対象とした別の研究でも、この造影剤の優れた感度が実証され、[68Ga]Ga-FAP-228618の診断効率を反映しています。より具体的な研究では、尿路上皮がんや肺がんなどの単一の種類のがんに焦点を当てており、[68Ga]Ga-FAP-2286の臨床分子イメージングにおける高い可能性が改めて強調されています4,5。治療に関しては、予備研究では、多様な進行性転移性癌の11人の患者11人を対象に、ルテチウム-177(β-エミッター、t1/2 = 6.7 d)で放射性標識されたFAP-2286の使用を調査しました19。ほとんどの患者は、8週間間隔で2つの治療サイクルを受け、サイクルあたりの平均投与量は[177Lu]Lu-FAP-2286の5.8±2.0GBqでした。この薬剤は、骨転移において約44時間の有効半減期で、腫瘍内保持が長期化することを示しました。[177Lu]Lu-FAP-2286の安全性と有効性は、現在、ノバルティス(NCT04939610)が後援する第1/2相LuMIERE臨床試験で評価されています7,8。さらに小規模な研究プロトコルが文献9,20に文書化されており、複数の症例報告が発表されています21,22,23,24,25,26、このTRTの有効性と優れた忍容性が実証されています。
FAP-2286で行われた最小限の構造変更が、最適化されたアナログ3BP-3940(図1)27につながった。このベクター分子に関する科学文献はまだ限られていますが、イメージングと治療の両方の応用について初期の研究が行われてきました。予備的な報告では、さまざまな末期転移性癌の18人の患者における[68Ga]Ga-3BP-3940の使用について説明し、この放射性医薬品は適切なPET造影剤であると結論付けており、その優れた腫瘍対バックグラウンド比と非常に低い腎臓の取り込みを強調しています28。別の研究では、肝転移を有する単一の膵臓癌患者がPETイメージングのために150MBqの[68Ga]Ga-3BP-3940を投与され、原発腫瘍および転移性病変における強い取り込みが示された29。その後、同じ患者がTRTに対して9.7GBqの[177Lu]Lu-3BP-3940を単回投与されました。治療の忍容性は良好で、バイタルサインや生物学的パラメータに大きな変化はありませんでした。別の研究では、3BP-3940を使用したセラノスティックアプローチの最初のヒト結果が示されました:患者は[68Ga]Ga-3BP-3940 PETイメージングで選択され、その後、異なる同位体(177Lu、 90Y、または 225Ac)で標識された3BP-3940を、単独またはタンデムの組み合わせ(例えば、 177Lu + 225Ac)で1〜5回の治療サイクルで投与されました30.アウトカムは、完全寛解1例、部分寛解4例、病勢安定3例、病勢進行12例であった。コホート(n = 28)の全生存期間中央値は、TRTの開始から9か月でした。
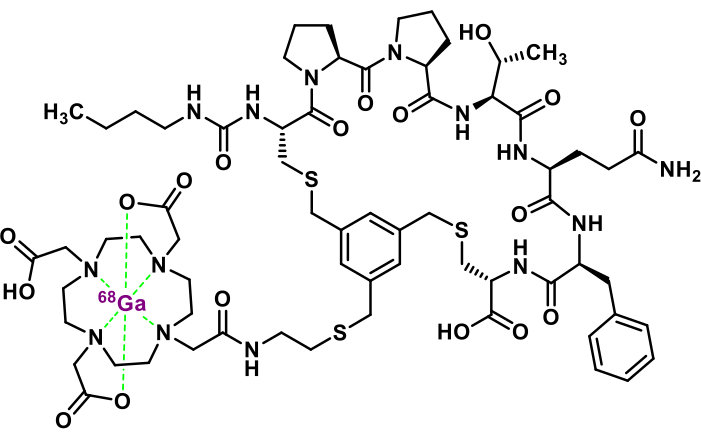
図1:[68Ga]Ga-3BP-3940の化学構造。 この図の拡大版を表示するには、ここをクリックしてください。
FAP-2286や3BP-3940などの実験用放射性医薬品の68Ga放射性標識プロセスには、通常、調製ステップを自動化するための合成モジュールが含まれます。特に、メソッドの自動化により、プロセスの堅牢性とGMPコンプライアンスが確保され、手動の調製方法と比較してオペレーターの放射線被ばくが最小限に抑えられます31,32,33。多くの場合、このようなプロトコルは、対応する実験的放射性医薬品を製造するセンターを承認する前に、治験薬ドシエ(IMPD)の一部として規制当局によって期待されている34。今日まで、抗FAP偽ペプチドの自動68Ga放射性標識に関する詳細な情報は、文献29,35,36,37,38においてほとんど入手できない。さらに、報告されるデータは、通常、特定のシンセサイザーのモデルにのみ適用されます。また、市販されているさまざまな溶液は、HCl中の68Ga3+溶出液(通常は0.1 M)の比量によって特徴付けられるため、使用される68Ga発生器のタイプは、特定の特異性をもたらす可能性があり、これは自動放射性標識条件に直接影響を与える可能性があります。
これに関連して、GAIA V2合成モジュールを使用して、偽ペプチド3BP-3940を68Gaで迅速かつ効率的に自動放射性標識するための詳細なプロトコルを紹介します。このシンセサイザーは、流体の流れを制御するために蠕動ポンプに接続された、それぞれ5つのマニホールドの3つのランプで構成されるチューブセットの使用に依存しています。また、反応媒体加熱用のバイアルオーブン、複数の放射能プローブ、システム内のこれらのパラメータを監視するための圧力センサーも備えています。他のモデルほど普及していませんが、このオートマトンは私たちのセンターで日常的に使用されており、31,39,40,41,42,43,44の施設でますます多く設置されています。この作業では、GALLIAD 68Ge/68Gaジェネレーターを68Ga溶出液の事前精製なしで使用しました。この方法は、[68Ga]Ga-3BP-3940の製造に堅牢で高速かつ便利なソリューションを提供するように設計されており、放射性標識中のオペレーターの放射線防護も最適化します。これはまた、この特定のシンセサイザーモデルで報告されるこの放射性医薬品の最初の調製プロトコルであり、これほど詳細です。
プロトコル
注:このプロトコルには、放射性同位元素の使用が含まれます。この手順を実施する人は、密封されていない放射性物質の取り扱いについて適切な訓練を受け、所属機関の放射線安全責任者から承認を得る必要があります。自動シンセサイザーは、指定されたシールド付きホットセルに配置する必要があります。放射性物質を含む手動の手順は、シールドされたホットセル内または適切な放射線シールドの背後でも実行する必要があります。
1. 試薬の調製
注:[68Ga]Ga-3BP-3940( 材料表参照)の自動製造に必要な試薬は、放射性医薬品調製ユニット(GMPグレードCクリーンルーム)で調製しました。試薬は、任意の順序で、合成の2時間前まで調製できます。
- 緩衝液(酢酸ナトリウム0.8M)の調製
- 次の原料を入手してください:酢酸ナトリウム三水和物EMPROVE API Ph Eur、BP、JP、USP、FCC、E262。
- 滅菌容器(微量遠心チューブ、5 mLなど)で正しく同定し、精密天びんを使用して、544.32 mgに近い酢酸ナトリウム三水和物の正確な質量を秤量します。
- 較正されたマイクロピペットと滅菌コーンを使用して、酢酸ナトリウムを5 mL近くの注射用水(WFI)に可溶化し、WFIが以下に説明するようにします。
WFI容量 = (秤量バッファー質量 x 5)/544.32 - 溶液をボルテックスし、超音波浴(40kHz、~1分)に通して可溶化を促進します。
- 21G針を装備した10mLシリンジを使用して、緩衝液を回収します。シリンジと新しい針の間に0.22 μmフィルターを取り付け、セプタムを消毒した後、緩衝液を直接ろ過して、適切に同定された滅菌密封バイアル(TC-ELU 5など)に入れます。
- 放射線分解防止剤溶液(メチオニン10 mg/mL)の調製
- 次の原材料を入手します:L-メチオニン(Ph.Eur.、USP)純粋、医薬品グレード。
- 滅菌容器(微量遠心チューブ5 mLなど)で正しく同定し、精密天秤を使用して50 mg近くのL-メチオニンの正確な質量を秤量します。
- 較正されたマイクロピペットと滅菌コーンを使用して、L-メチオニンを5 mL近くのWFI容量に可溶化し、WFIが以下に説明するようにします。
WFI容量 = (秤量バッファー質量 x 5)/50 - 溶液をボルテックスし、超音波浴(40kHz、~1分)に通して可溶化を促進します。
- 21G針を装備した10mLシリンジを使用して、メチオニン溶液を回収します。シリンジと新しい針の間に0.22μmフィルターを取り付け、セプタムを消毒した後、溶液を直接適切に識別された滅菌密封バイアル(TC-ELU 5、Curiumなど)にろ過します。
2. 品質管理のための設備の整備
- 最終製品のpH制御
- 適切な保護シールドの後ろに、最終製品のその後のチェックのために、pHペーパーのストリップを配置します。
- radio-TLCによる放射化学的純度制御
- 適切な移動相を含む2つのTLC移行タンクを準備します。移動相 A:クエン酸バッファー 0.1 M pH 4 の水中、Rf = 0-0.2 ([68Ga]Ga-3BP-3940、Rf = 0.8-1、遊離 68Ga3+)。移動相 B:水とメタノールの 1:1 混合物(v/v)中の酢酸アンモニウム緩衝液 1 M、[68Ga]ガリウムコロイドで Rf = 0-0.2、[68Ga]Ga-3BP-3940 で Rf = 0.8-1 と予想されています。
- 適切な保護シールドの後ろに、最終製品のRCPを後で制御するために、2つのTLC移行タンクを2つのiTLC-SGプレートの隣に配置します。
- ラジオクロマトグラフのスイッチを入れ、関連する取得ソフトウェアをオペレーティングコンピュータで開きます。最初に実行する解析の識別情報を事前に入力します。
- ラジオHPLCによる放射化学的純度制御
- 解析に必要なカラムモデル(C18 ACE Equivalence)がシステムにインストールされていることを確認します。
- HPLC用の新しい移動相、すなわちHPLC用の水+0.1%TFA(溶媒A)およびアセトニトリル+0.1%TFA(溶媒B)を調製します。溶媒Aボトルと溶媒BボトルをラジオHPLCの対応するラインに接続します。
- 操作用コンピュータの電源を入れ、制御ソフトウェアに接続します。
- 必要に応じて、ポンプモジュールのパージバルブを開き、分析に使用するライン(ラインAとラインB)をパージします。この操作の後、パージバルブを閉じます。
- グラジエントの開始点に等しい割合の溶媒(95% A/5% B)で、0.6 mL/分の流量で少なくとも 20 分間、システムを平衡化します。[68Ga]Ga-3BP-3940 HPLC 分析シーケンスでは、0.6 mL/min に維持された流速を使用し、移動相グラジエントを 0.1% TFA の水 (A) から 0.1% TFA のアセトニトリル (B) まで次のようにプログラムします: 0 - 1 分 95/5 A/B;95/5 A/B から 60/40 A/B までの 1 〜 8 分間の線形グラジエント。8 - 9 分 60/40 A/B;60/40 A/B から 95/5 A/B までの 9 - 10 分の線形グラジエント。10 - 12分 95/5 A/B.
- ステップ 2.3.5. で説明した移動相グラジエントを使用した分析法を選択し、最初に実行する分析の識別情報を事前に入力してください。
- シールド容器に、分析するサンプルを受け取るためのガラスインサート付きのHPLCバイアルを準備し、適切な保護シールドの後ろに置きます。
3. 合成モジュールの準備
- シールドセルの電源とライトをオンにします。シンセサイザーを制御しているラップトップの電源を入れ、モジュールソフトウェアにログオンします。
- 必要に応じて、古いキットをシンセサイザーから取り出し、廃棄物は適切な容器に捨ててください。
- 合成モジュールを収容するシールドキャビネットの内部とシンセサイザー自体の清掃を、適用される衛生基準に従って行ってください。
- シンセサイザーソフトウェアで、[ ユーザー]を押してから、ユーザー名を選択し、関連するパスワードをポップアップウィンドウに入力します。 [Method ]をクリックし、[68Ga]Ga-3BP-3940合成用に以前に設定した自動プロトコルを選択します。
- [Preparation]を押し、合成タイトル、ベクターバッチ番号、試薬キットのバッチ番号、およびコメントを適切なテキストボックスに入力します。この段階では、さまざまなキット調製手順のチェックリストも設定し、従うことができます(補足図1)。
4. 合成カセットの準備とカセットの取り付け
- 放射性医薬品ラボの作業台をワイプと適切な洗剤消毒剤で清掃し、作業台に滅菌ドレープを置きます。
- 滅菌済みの[68Ga]Ga標識カセット(RT-01-H参照)と試薬キット(補足図2)を入手してください。チューブセットの3つのランプは、モジュール上で左から右にA、B、およびCとして識別されます。各ランプの多様体には、上から下(ランプAおよびC)または左から右(ランプB)に1から5までの番号が付けられています。
- 以下の手順に従ってカセットを組み立てます。
- [68Ga]Gaカセット封筒を開封し、損傷がないか確認し、カセットの各ルアー接続を締めます。すべてのスパイクキャップを取り外します。
- 5 mL のルアーロックシリンジと 21G ニードルを使用して、試薬キットから 5 mL のエタノールアブソリックを引き出し、C18 カートリッジに非常にゆっくりと通し、次に 5 mL の WFI (キットに付属していません) を引き出し、同じ C18 カートリッジに非常にゆっくりと通してプレコンディショニングします。
- 合成モジュールに設定されたチューブのランプAを配置し、2つのラッチを回してランプを所定の位置に保持します。垂直A1チューブの自由端を19G針に接続し、廃バイアルに挿入します。
- 廃バイアルに通気針を追加し、排気バイアルを受け取るシールド容器の後ろに最適な後方に配置します。0.22μmのフィルターをA4の位置に置きます。
- 水平 A1 チューブをモジュールのフロント パネルの左下にある圧力センサーに接続します。
- オス/オスアダプターを使用して、0.22 μ端子フィルターと80 mmの20G針で終わる30 cmの延長部を水平A5位置に接続します。
- 上記の20G針を密封された滅菌済みの避難バイアル(TC-ELU 5など)に挿入し、曝気針を追加して、避難バイアルをシールド容器に配置します。
- 垂直A1と垂直C1を接続するチューブラインを、ランプBの上の保持フックの後ろに配置します。
- 水平マニホールドA2とB1を短い延長線(キットに含まれていないか、最初にC5水平に接続されたもの)で、すでにA2の位置に取り付けられているアダプターを使用して接続します。
- 合成モジュールにランプ B を配置し、2 つのラッチを回してランプを所定の位置に保持します。
- プレコンディショニングされた C18 カートリッジを水平 C2 の位置に接続し、アダプターの水平 B5 バルブを C2 に接続したままにします。
- 合成モジュールにランプ C を置き、2 つのラッチを回してランプを所定の位置に保持します。
- オス/オスアダプターを使用して、水平C5から50cmの延長線を GALLIAD68Gaジェネレーターに接続します。
- チューブセットのステンドグラス反応バイアルをモジュールのオーブンに入れます。チューブを垂直A5から垂直C5に慎重に配置し、ポンプを閉じてチューブが正しく配置されていることを確認し、チューブをポンプの左側にあるアクティビティセンサーに通します。
- 中間チェックを実行して、 図2に示すように、カセットとチューブがラジオシンセサイザーに組み立てられ、試薬がまだないことを確認します。
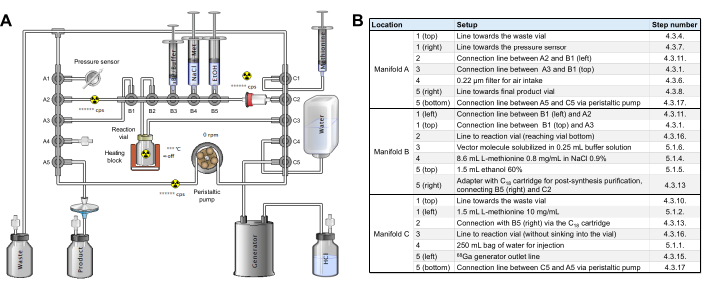
図2:合成モジュールの構成 (A) 合成モジュール上での[68Ga]Ga-3BP-3940の自動合成のセットアップ。(B)GAIA合成モジュールを用いた[68Ga]Ga-3BP-3940の自動作製における試薬ポジションの詳細。 この図の拡大版を表示するには、ここをクリックしてください。
5. 試薬の取り付け
- ランプをモジュールに取り付けたら、以下で説明するように試薬を取り付けます。
- Spikeアダプターを使用して、試薬キットのWFI 250 mLバッグをC4チューブに接続し、モジュールの右側にある専用フックにバッグを吊るします。
- 20G 針を装備した 3 mL の 3 ピース Luer Lock シリンジを使用して、事前に調製した L-メチオニン 10 mg/mL 溶液 1.5 mL を引き出し、シリンジを水平 C1 チューブに接続し、シリンジをモジュールの右側にある専用スロットに吊るします。液体表面とシリンジプランジャーシールの間に約2 mLの空気を残して、完全な液体移送を確保します。
- 20G針付きの1mLシリンジを使用して、事前に調製した10 mg/mL L-メチオニン溶液750 μLを引き出し、セプタムを消毒した後、試薬キットから0.9% NaClバイアル(青色クリンプ)に注入します。
- 20G ニードル付きの 10 mL 3 ピース ルアー ロック シリンジを使用して、0.9% NaCl + L-メチオニン バイアル (青色クリンプ) の内容物を引き出し、8.6 mL に調整し、B4 の位置にあるスパイクを取り外してから、代わりにシリンジを B4 に接続します。液体表面とシリンジプランジャーシールの間に約2 mLの空気を残して、完全な液体移送を確保します。
- 20G針付きの3mLスリーピースルアーロックシリンジを使用して、セプタムの消毒後に60%エタノールバイアル(オレンジクリンプ)の内容物を引き出します。.容量が少なくとも1.5 mLであることを確認し、B5の位置でスパイクを取り外してから、シリンジをB5に接続します。液体表面とシリンジプランジャーシールの間に約2 mLの空気を残して、完全な液体移送を確保します。
- 20G針付きの低デッドボリューム1 mLシリンジを使用して、事前に調製した0.8 M酢酸ナトリウム緩衝液0.25 mLを引き出し、30 μgの3BP-3940を含むバイアルに注入して、連続した注入/再吸引サイクルで可溶化します。0.25mL溶液を同じシリンジに引き抜き、針を外し、バッファー+ベクターシリンジをB3に入れます。液体表面とシリンジプランジャーの間に約0.25mLの空気を残して、完全な液体の移送を確保します。
- 合成を開始する前に、以下で説明するように最終チェックを行ってください。
- 図3に示すように、すべての試薬がカセットまたはチューブに接続されていることを確認します。
- キットの各接続が十分に締まっていることを確認します。チューブが挟まれたり、角度がついたりしていないことを確認してください。
- システムの準備ができました。フロントパネルを閉じ、シールドセルの換気をオンにします。

図3:キットのセットアップ。 68Gaで3BP-3940のradiolabelingのためのシンセサイザー上のチューブセットと試薬の最終的なインストールこの図の拡大版を表示するには、ここをクリックしてください。
6. [68Ga]Ga-3BP-3940製造のための自動放射性標識シーケンシング
- すべての試薬がランプに配置され、すべての情報がソフトウェアに正しく記録されたら 、Run Synthesis をクリックします。
- 合成シーケンス全体にわたって設定されたチューブ内の放射能分布の典型的なプロファイルは、次のとおりに示されています。 図 4.自動化された方法の連続した手順に従って、[68Ga]Ga-3BP-3940 を以下に説明します。
- キットの完全性テスト:廃バイアルに向かってチューブを短時間パージした後(基本的にC18 カートリッジに残っている液体を除去するため)、システムはA4を開き、蠕動ポンプを介してろ過された空気をポンピングすることにより、内部圧力を上昇させます。A1に接続された圧力センサーが1500 mbar>チューブ圧力を検出するとすぐに、システムが閉じ、ペリスタルティックポンプが停止します。圧力損失が15秒間で400 mbarを超えない場合は、キットの完全性試験が成功したと評価し、合成を開始します。テストが失敗した場合は、システムのリークが疑われ、合成シーケンスを中止します。
- 反応バイアルへのベクターの添加:緩衝液に可溶化された3BP-3940が、マニホールドB2を介して約30秒で反応バイアルに引き込まれることを確認します。
- 反応バイアルへのL-メチオニンの添加:C1のシリンジに含まれるメチオニン溶液がマニホールドB2を介して反応バイアルに移され、ランプCを下り、次にランプAを上ってマニホールドA2によってランプBで分岐することを確認します。
- WFI による C18 カートリッジの活性化: C4 のバッグに含まれる WFI が C18 カートリッジを通過し、ベクター溶液とメチオニン溶液がたどる経路のランプ A、B、C もすすぎます。次に、同じルートをろ過された空気で洗い流し、次のステップでチューブに水が残らないようにします。
- 反応バイアルでのジェネレーター溶出(手動介入):GALLIADジェネレーターを溶出するには、ジェネレーターの上部にある緑色のノブをローディング位置に対して90°まで回してから、10〜20秒待ちます:この時間により、ジェネレーターは1.1 mLの固定溶出液量を調製できます。緑色のノブを初期位置に戻し、Controlソフトウェアのプロンプターをクリックします。次に、蠕動ポンプにより、 68Ga溶出液を3分間かけて反応バイアルに引き込みます。この時間間隔で、反応バイアルの温度を1分間で60°Cまで徐々に上昇させ、次に2分間で90°Cまで上昇させ、放射性標識ステップの設定温度により早く到達します。
- 放射性ラベリング:放射性ラベリングステップの開始時に、120°Cの設定温度が30秒間印加され、迅速で効率的な加熱が可能になることを確認します。次に、設定温度が98°Cに2分間調整されていることを確認します。反応バイアル内の加熱と圧力上昇により、反応媒体の一部はB2に接続されたチューブに逆流する傾向があります。これを制限するために、2分間の加熱後に10秒のラインパージが設定されます。その後、放射性標識は約5.5分間続きます。
- C18 カートリッジへのトラッピング:ろ過された空気がC3によって反応容器に送り込まれていることを確認します。液体の表面に加えられる圧力により、反応媒体はB2で接続されたチューブを通って上向きに流れ、次にSPEカートリッジに流れます。次に、反応バイアルをC4のバッグからWFIですすぎ、このすすぎ液を同じ方法でSPEカートリッジに移します。カートリッジは最終的に新しいWFIですすぎ、ろ過された空気で洗い流されます。
- C18 カートリッジと製剤の溶出(NaCl 0.9% + L-メチオニンの添加):SPEカートリッジは、最初に放射性標識製品と任意のガリウムコロイドを保持し、遊離 68Ga3+ を通過させます。カートリッジを溶出させ、ターミナルバイアル中の[68Ga]Ga-3BP-3940を回収するには、エタノール60%とNaCl 0.9%中のメチオニン~0.9 mg/mL(各0.5mL×3回)の連続画分をカートリッジ上に引き出して溶出させます。次に、B4のシリンジの全内容物をC18カートリッジに通し、製剤化ステップで最終エタノール濃度<10%を達成します。
- フィルター完全性試験(手動介入):ターミナルバイアルの合成と取り外し後、バブルポイントテストを使用してターミナルフィルターの完全性を確認するために、ターミナルフィルターを廃バイアルに接続し、廃バイアルからベントフィルターを取り外すように求めるプロンプトに従います。バブルポイント試験中、フィルターは最初にWFIによって30秒間湿潤されます。ラインをパージした後、システム内の圧力は<2分間で>2500 mbarまでゆっくりと増加し、その間、シンセサイザーはフィルターの出口に圧力が上昇していないことを確認します。次に、システムはゆっくりと圧力を上げてバブルポイントを確認します。シンセサイザーは、フィルター出口の圧力が上昇すると、最終的に圧力を記録してバブルポイントの圧力を決定します。
- 合成の最後に、オートマトンソフトウェアは、放射性標識の経過を説明し、反応バイアル内の温度、システム内の圧力、および関与する放射能の量を追跡する合成レポートを生成します(図4)。補完として、次の式に従って崩壊補正された放射性化学収量(RCY)を手動で計算します。
RCY =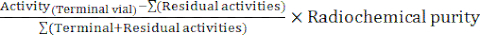
残留活性は、反応バイアル、C18 カートリッジ、および合成終了時の廃バイアルに残っている活性を示しています。

図4:モジュール内の放射能の典型的な分布プロファイル(A)反応バイアル;(B)[68Ga]Ga-3BP-3940の合成中のC18カートリッジ。反応バイアルへの68Ga溶出液の流れは、6分で発生します。この活性は、放射性標識反応全体を通して反応バイアル内に留まります。16 分後、アクティビティーは SPE カートリッジに転送されます。カートリッジは 19.5 分後に溶出され、その後、約 150 MBq の残留活性が固定相に残ります。この図の拡大版を表示するには、ここをクリックしてください。
7. [68Ga]Ga-3BP-3940の分注と品質管理
- 末端バイアルを適切なシールドセルに移し、放射能測定と患者線量調製を行います。
- 適切に校正された用量キャリブレーターでターミナルバイアルの活性を測定し、コンピュータ上で調製を記録します。
- バイアルを正しく識別し、適切なシールド容器に入れます。適切な無菌技術と放射線防護技術を使用して、品質管理のためにターミナルバイアルから~0.5 mLのサンプルを取り出します。
- 目視検査により、製剤の外観を評価します。pHペーパーストリップに製品溶液を一滴沈着させることにより、調製物のpHを評価します。
- radio-TLCによる放射性化学的純度を測定するには、あらかじめ調製した2枚のiTLC-SGプレートのそれぞれに生成物溶液を一滴沈着させます。次に、プレートを対応する移動相に移行させ、ラジオクロマトグラフで読み取ります。得られたラジオクロマトグラムを、製品信号と不純物信号の曲線下面積を測定して積分し、次の式に従って放射性化学的純度を計算します。
RCP (%) = 100 - %AUC不純物 1 - %AUC不純物 2 - 事前に調製したHPLCバイアルに~50 μLの調製物を注入することにより、ラジオHPLCによる放射性化学的純度を測定します(ステップ2.3.7を参照)。バイアルをHPLCオートサンプラーの必要な位置に置き、分析シーケンスを開始します。サンプルがシステムに注入されたら、バイアルをオートサンプラーから取り出し、シールド容器に入れて照射を最小限に抑えます。分析の最後に、製品信号と不純物信号の曲線下面積を測定して、得られたラジオクロマトグラムを統合し、次の式に従って放射性化学的純度を計算します。
RCP (%) = 100 - Σ(%AUC不純物) - 調製物に含まれる放射性同位元素の半減期(ガンマカウンター)を確認するには、1 mLのWFIを含むガンマカウンターチューブに~5 μLの調製物を加えます。ガンマカウンターのあるチューブを10回連続してカウントします(それぞれ1分ずつカウントします)。10回の測定で観測された放射性崩壊に基づいて半減期を計算します。
- 半減期アッセイと同じサンプルに対して、ガンマカウンターを用いたガンマ分光分析を行い、消滅光子から511 keVおよび1077 keVのピークを求めて、放射性核種同一性アッセイを実施します。
- 前のサンプルの48時間の崩壊期間後の放射性核種の純度を評価します。ガンマカウンターで120分間の測定を行い、68Geブレークスルーからin situで形成された残留68Ga活性やその他の半減期の長い放射性核種不純物を検出できます。
8. [68Ga]Ga-3BP-3940調製物の安定性
- 3つのテストバッチの経時的な安定性を評価します。この目的のために、EoSの直後および合成後最大4時間で、1時間ごとに約200μLの調製物をターミナルバイアルから引き出します。
- 各時点で無線HPLC分析を行い、上記の手順に従ってHPLCでRCPを測定します。各タイムポイントでRadio-TLC解析を行い、前述の手順に従ってTLCごとにRCPを測定します。
結果
GAIAモジュールで開発された合成プロセスにより、3BP-3940の高速68Ga放射性標識を21〜22分で行うことができます。このプロトコールは、0.1 M HCl中に1.1 mLの68Ga溶出液を生成する医薬品グレードの68Ge/68GaジェネレーターGALLEIADと併用するように設計されています。反応緩衝液の容量およびモル濃度は、最適な放射性標識45に必要な3.5〜4の反応pHを得るために、この酸の量に応じて微調整された。したがって、最終モル濃度が0.1Mの酢酸ナトリウムを使用しました。メタオニン10 mg/mLを抗放射線分解剤として反応媒体に添加し、加熱ステップ中のベクター分子の分解を抑制しました。最終精製なしの予備試験では、この抗酸化剤をゲンチシン酸16 mg/mLおよびアスコルビン酸12 mg/mLと比較し、メチオニンを使用した最終RCPは、これら2つの他の化合物のいずれかよりも優れていることを示しました(図5)。
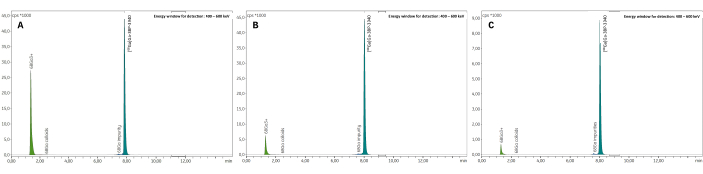
図5:抗放射線分解化合物を比較した予備実験からの粗反応媒体のHPLCラジオクロマトグラム。 (A)ゲンチシン酸16mg / mL(RCP = 75.5%);(B)アスコルビン酸12mg / mL(RCP = 86.4%);(C)メチオニン10 mg / mL(RCP = 94.7%)。 この図の拡大版を表示するには、ここをクリックしてください。
この自動放射性標識法を検証するために、3つのテストバッチを作製し、平均最終活性が737±2.8 MBq(キャリブレーション後+2週間のジェネレーター)の調製物を得ました。注目すべきは、合成中のシングルユースキットシステムの活性損失が小さく、3回のテスト生産で平均24.9%±3.4%であったこと(図6)であり、プロセスの効率性を実証しています。
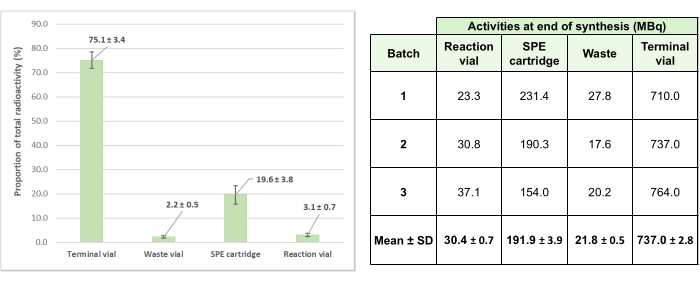
図6:[68Ga]Ga-3BP-3940の3つの検証バッチの平均残留活性の分布。 3つの試験放射性標識操作に関与し、システムのさまざまな要素で見つかった総活性の平均割合は図として詳細に説明されており、各試験合成の対応する絶対放射能値は表として提供されています。 この図の拡大版を表示するには、ここをクリックしてください。
3つのバリデーションバッチは、放射性核種の同定(補足表1)、計算された半減期(補足表2)、放射性核種の純度(補足表3)など、すべての品質管理に合格しました。特に、無線-TLC(平均RCP = 99.19 ± 0.07%;%CV = 0.07)(補足表4)と無線-HPLC(平均RCP = 99.19 ± 0.07%;%CV = 0.07; 図7、 補足表5)。RCP値の再現性は優れており、将来の合成結果によってさらに確認される可能性があります。また、3つの試験バッチのRCP値は、無線TLCと無線HPLCの両方で、EoSの4時間後まで一貫して>98%という高い安定性を示しました(図8、 補足表6)。これらのサンプルで実施された分析の包括的な結果を 表1にまとめました。全体として、3BP-3940の自動化された 68Ga放射性標識法は、平均74.4%±3.3%の崩壊補正RCY(HPLCのRCPから計算)で検証されました。医薬品グレードのベクターを使用することで、この方法はそのまま臨床使用に置き換えることができます。
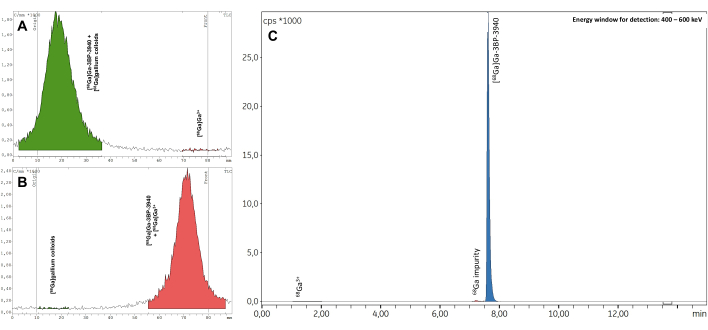
図7:代表的な無線TLC。 結果は、(A)クエン酸緩衝液0.1 M pH 4および(B)酢酸アンモニウム1 Mを1:1の水/メタノール中で調製しました。(C)[68Ga]Ga-3BP-3940のRCPを測定したときに得られた代表的な無線HPLCスペクトル。 この図の拡大版を表示するには、ここをクリックしてください。
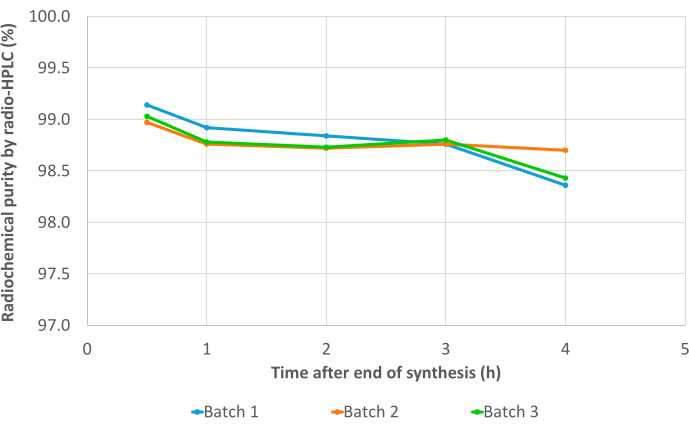
図8:安定性の結果。 [68Ga]Ga-3BP3940の3つのバリデーションバッチの経時的な、EoSから合成後4時間までの放射性純度を、ラジオHPLCで測定。 この図の拡大版を表示するには、ここをクリックしてください。
| 試験 | バッチ 1 | バッチ 2 | バッチ 3 | |
| 様子 | 無色透明の溶液 | 無色透明の溶液 | 無色透明の溶液 | |
| 識別 | ||||
| ガンマ線光子(MeV)のエネルギー | 0.511 と 1.077 | 0.511 と 1.077 | 0.511 と 1.077 | |
| 半減期 (分) | 69.94±1.03 | 69.34±0.66 | 68.66±0.28 | |
| pHの | 6 | 6 | 6 | |
| 放射性核種の純度 | ||||
| (68GA)ガリウム(%) | 99.9999861 | 99.9999861 | 99.9985764 | |
| (68Ge)ゲルマニウムおよびその他のγ発光不純物(%) | 1.39 × 10-5 | 5.47 × 10-6 | 1.42 × 10-3 | |
| 放射性化学的純度 | ||||
| [68ガ]Ga-3BP-3940 (高性能液体クロマトグラフィー) | 99.14 | 98.97 | 99.03 | |
| [68ガリウム]ガリウム不純物(HPLC) | 0.76 | 1.03 | 0.97 | |
| [68ガ]Ga-3BP-3940 (TLC) | 99.2 | 99.25 | 99.11 | |
| [68ガリウム]ガリウム不純物(TLC) | 0.8 | 0.75 | 0.89 | |
| フィルター完全性試験 (mbar) | 4046 | 4082 | 3901 | |
| EoSでの体積活性(MBq/mL)* | 69.27 | 71.9 | 74.54 | |
| EoSでの比放射能 (MBq/μg) | 23.46 | 24.31 | 25.22 | |
| EoSでのモル活性(GBq/μmol) | 34.53 | 35.78 | 37.12 | |
| 放射性化学収量(HPLCで決定されたRCPに基づく) | 70.93 | 74.75 | 77.58 | |
| 4時間以上安定性(HPLC) | ≥98.36% | ≥98.70% | ≥98.43% | |
| *総理論容量10.25mLで計算 | ||||
表1:3つの[68Ga]Ga-3BP-3940テストバッチの主電源品質管理結果。
補足図1:合成モジュールのセットアップ用の電源。このファイルをダウンロードするには、ここをクリックしてください。
補足図 2: 合成モジュールにキットを取り付けるためのチェックリストこのファイルをダウンロードするには、ここをクリックしてください。
補足図3:SCXカートリッジを使用した代替の自動合成プロトコル。このファイルをダウンロードするには、ここをクリックしてください。
補足表1:[68Ga]Ga-3BP-3940の3つの試験バッチの放射性核種の同定。このファイルをダウンロードするには、ここをクリックしてください。
補足表2:[68Ga]Ga-3BP-3940の3つのテストバッチについて計算された半減期。このファイルをダウンロードするには、ここをクリックしてください。
補足表3:[68Ga]Ga-3BP-3940の3つの試験バッチの放射性核種の純度。このファイルをダウンロードするには、ここをクリックしてください。
補足表4:[68Ga]Ga-3BP-3940の3つのテストバッチについてradio-TLCによって決定された放射性化学的純度。このファイルをダウンロードするには、ここをクリックしてください。
補足表5:[68Ga]Ga-3BP-3940の3つの試験バッチについて、無線HPLCによって測定された放射性化学的純度。このファイルをダウンロードするには、ここをクリックしてください。
補足表6:[68Ga]Ga-3BP-3940の3つの試験バッチについて、無線TLCによって測定された4時間にわたる放射化学的安定性。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
この研究では、GAIAモジュールとGALLIADジェネレーターを使用した[68Ga]Ga-3BP-3940の合成のためのGMP準拠の自動調製プロトコルを示します。この方法は、PSMAリガンド44および他のFAP阻害剤43,46などのベクターのガリウム68放射性標識のために当センターで使用されているプロトコルから、わずかな変更を加えて適応した。
製造プロセスはシンプルでわかりやすいように設計されており、(i)すべての試薬の反応バイアルへの移送、(ii) 68Gaによる3BP-3940の放射性標識、(iii)製品の精製と製剤化の3つの主要なフェーズに分けることができます。重要なことに、この自動化された方法の大きな強みの1つは、3つのテストバッチが22.3分±0.6分で生成されるという短い時間です(フィルター完全性テスト時間は含まれていません)。これに対し、Hörmannらは、GRP-3Vモジュール上での[68Ga]Ga-FAP-2286の自動合成について報告し、合成時間が35分38と強調した。
高い比活性を持つ放射性標識製品を確保するために、反応には30μgの3BP-3940のみを使用し、3つのテストバッチのEoSで平均比活性は24.3±0.9MBq/μgでした。比較すると、文献で報告されている平均比活動は、6.9 MBq/μg38 から 19.7 MBq/μg29 の範囲です。唯一の例外は、Pangらによって記載された[68Ga]Ga-FAP-2286調製プロトコルであり、25μgのベクターを使用し、推定比活性は40.7 MBq/μg(合成時間中の崩壊を補正していない)をもたらす17。
文献中のいくつかの自動化されたプロトコルは、反応媒体47に添加された酸性溶液中の68Gaの量を制御するために、強陽イオン交換(SCX)カートリッジ上でのガリウム68溶出液の濃縮および精製の最初のステップを含む。調製時間を短縮するため、またGALLIAD 68Gaジェネレーターの医薬品グレードを考慮して、このステップを省略することにしました。したがって、ここで説明するプロトコルは、0.1 M HCl中に~1.1 mLの68Ga溶出液を含む放射性標識に適合します。
反応バッファーの種類とモル濃度は、68Ga放射性標識反応48を最適化するための重要なパラメータである。課題は、不溶性水酸化ガリウムの形成を最小限に抑えながら、DOTAキレート剤による放射性金属のキレート化を促進するために、約3.6のpHを維持することである49。酢酸ナトリウムは、反応媒体中の最終濃度0.07Mで、我々の実践における他のベクターの放射性標識におけるその優れた性能に基づいて保持された46。一貫して、この研究では、放射性標識[68Ga]Ga-3BP-3940において高い効率を示しました。さらに、このバッファーは、FAP標的偽ペプチドの68Ga放射性標識に関する文献で最も一般的に報告されていますが、通常は高分子濃度(0.25M〜1M)で使用されます17,19,29,35,36。1つの記事では、反応緩衝剤として4-(2-ヒドロキシエチル)ピペラジン-1-エタンスルホン酸(HEPES)の使用について言及しています38。その弱金属錯体特性により、HEPESは68Ga放射性標識反応50のpHを制御するための非常に適切な化合物になります。しかし、この化合物に対する規制上の制約により、最終的な放射性医薬品調製物中の残留量を決定するための追加の試験が必要であり、合成の完了と製品の使用との間にさらに遅延が生じる51,52。
68Ga標識FAP阻害偽ペプチドの調製について報告されている温度設定は、文献で大きく異なります。予備的な研究と対応する科学論文29,36で、リチャード・バウムのチームは、放射性標識反応が90°Cを超える温度で行われたときに副生成物形成の増加を観察しました。 これに関連して、加熱温度を下げることは、劣化生成物の形成を最小限に抑えるための効果的な戦略として登場しました。注目すべきは、これらの条件下で反応混合物に酸化防止化合物が添加されなかったことです。それにもかかわらず、文献で最も一般的に報告されている条件には、85°Cで15分間の加熱が含まれます。さらに低い加熱温度は、3BP-3940の近いアナログの68Ga放射性標識条件で、さらに蛍光基で官能基化され、15分間の80°C加熱を含む53。逆に、[68Ga]Ga-FAP-2286の自動調製のための2つのプロトコルでは、加熱温度がそれぞれ10分間54分、125°Cが6分間38分であったが、2番目の副産物が出現したと記載されていた。したがって、いくつかの公開されたプロセス19,35と同様に、98°Cで8分間加熱する中間温度を選択しました。3つの試験バッチのRCPに基づくと、酸化防止剤の存在下でこれらの条件下で加熱しても、標識中に放射線分解生成物が有意に形成されることはないようです。
体系的に使用されていませんが、反応媒体に抗酸化化合物を添加すると、より高いRCP43を達成することにより、放射性標識の結果を向上させることができます。最終的な放射性医薬品製剤において、酸化防止化合物は、放射線分解現象を制限し、経時的に放射性複合体の安定性を向上させることができる55,56,57。68のGa標識FAP標的DOTA偽ペプチドの場合、いくつかの研究では、アスコルビン酸(反応量~2.6mLで10mgまたは50mg)が放射線分解副産物の形成を防ぐのに不十分であることが示唆された38。興味深いことに、過酸化水素の存在下での強制分解試験では、これらの不純物の割合の増加が示され、これはおそらく疑似ペプチドの1つ以上の硫化基のスルホキシドおよび/またはスルホンへの変換によって形成された酸化生成物を示唆している58。このことは、3BP-3940および関連分子の放射性標識のための反応媒体中の抗酸化物質の重要性を強調しています。本研究では、予備アッセイ(図5を参照)により、この特定の目的に理想的な化合物としてメチオニンが同定されました。上記の仮説を続けると、酸化条件下では、スルホンおよび/またはスルホキシド誘導体がメチオニンと優先的に形成され、それによって3BP-3940の硫化物機能の完全性が効率的に維持される可能性がある。68Ga-59,60または177Lu 56,61,62,63で標識された他のさまざまなベクターの自動化された68Ga放射性標識プロトコルでの使用に加えて、メチオニンは[68Ga]Ga-3BP-394035および[68Ga]Ga-FAP-228619の調製に使用されることが正当に報告されています、アスコルビン酸と組み合わせて。注目すべきことに、このプロトコルでは、各試薬(緩衝液および酸化防止剤)の容量および濃度は、いくつかの方法47,48,64で説明されているように、濃縮HClによる事前調整を必要とせずに最適な反応pHを達成するために選択された。繰り返しになりますが、反応pHの正確な制御は、ガリウム68の放射性標識を成功させるための重要なパラメータです。
固相抽出による最終精製ステップは、3BP-3940と錯体化されていない遊離68Ga3+の微量を除去するために必要です。アッセイに使用したC18カートリッジは、優れた回収率(溶出後にカートリッジに結合した活性の80.3±3.3%)で良好な結果を示したため、他のモデルはテストされませんでした。興味深いことに、[68Ga]Ga-3BP-394029,36の末端精製のために、水湿潤性親水性親油性平衡(HLB)逆相カートリッジも報告されています。
現状では、このプロトコルの主な制限は、68Gaジェネレータの単一モデルとの互換性のみです。ただし、この分析法を他のジェネレーターに適合させるための解決策、たとえば、68Ga溶出液の容量に比例してバッファー容量を増やすなどの解決策を検討できます。たとえば、0.25 mL の代わりに 1.25 mL の 0.8 M 酢酸ナトリウムバッファーを使用すると、5 mL の 68Ga 溶出液が適している可能性があります。別のアプローチでは、SCX カートリッジをセットアップ (通常はマニホールド A2 と B1 の間) に組み込み、ジェネレーター溶出液から 68Ga3+ イオンを濃縮します。次に、pH 1のNaCl(5 M)の飽和溶液でSCXカートリッジを溶出することにより、ガリウムを一定量で回収できます。この変更により、Muellerらが[68Ga]Ga-FAP-228619,35の調製に最大4つの発電機を使用したように、マルチジェネレーター合成も可能になります。したがって、SCXカートリッジを組み込んだ代替プロトコルが補足図3で提案されています。このようなアプローチにより、分析法の大幅な拡大が可能になり、特定の調製物から利益を得ることができる患者の数を大幅に増やすことができます。しかしながら、この方法において、これらの代替条件下で、68Ga放射性標識65に理想的な約3.6の反応pHを可能にするために、緩衝液量を再度慎重に調整する必要があることに留意することが不可欠である。また、放射線分解防止剤とバッファーは、C1の位置をSCXカートリッジ溶離液に対して空けるために、B3の同じシリンジで直接調製する必要があります。
最後に、ここで紹介する自動化プロセスはGMPに準拠しているため、GMPグレードの3BP-3940を追加の品質管理(調製の無菌性、細菌のエンドトキシンレベル、ラジオHPLCによる放射性化学的同一性、残留溶媒含有量の定量化など)の開発と検証に関連して使用することで、臨床アプリケーションへの直接的な移行が保証されます。この実装は、検証されるためには、現在のすべての規制要件、特にIMPDの構成を満たさなければならないことは明らかです。
開示事項
著者は、開示すべきこの作品に関連する実際のまたは認識された利益相反をもたらす可能性のある商業パートナーシップや資金源を持っていません。
謝辞
著者らは、この原稿で提示された放射性標識反応の準備に協力してくれたYasmine Soualy、Stéphane Renaud、およびÉlodieGavenに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 0.2 µ filters | VWR | 514-0515 | For filtration of buffer and antioxidant solutions and final radiolabeling product |
| Acetonitrile for HPLC | Sigma Aldrich | 34851-2.5L | For HPLC control of radiochemical purity |
| Ammonium acetate | Sigma Aldrich | 238074 | For the preparation of one of the mobile phases for TLC control |
| C18 column for HPLC | VWR | EQV-3C18-1503 | For HPLC control of radiochemical purity |
| Calibrated dose calibrator (CRC25) | Capintec | - | For measuring the radioactivity of the final product and the various components of the module post-synthesis |
| Citrate buffer solution, pH 4 | Thermofisher | 258585000 | Mobile phase for TLC controls |
| Eppendorf tube 5 mL Biopur | Sigma Aldrich | EP0030119479 | For the preparation of buffer and antioxidant solutions |
| Extension line (30 cm) | Vygon | 1159.03 | For the connection of the generator to the tubing set |
| Gallium-68 generator | IRE Elit | - | For in situ generation of [68Ga]gallium chloride |
| Gamma counter (Hidex AMG) | Hidex | - | For half-life and radiochemical purity assessment |
| HPLC station | Shimadzu | - | For HPLC control of radiochemical purity |
| iTLC-SG plates | Agilent | SGI0001 | For TLC control of radiochemical purity |
| L-methionine | AppliChem | A1340 | For antioxidant solution preparation |
| Male/male adapter | Vygon | 893.00 | For the connection of the generator to the tubing set |
| Methanol | Sigma Aldrich | 320390-1L | For the preparation of one of the mobile phases for TLC control |
| Needles (21G, Sterican) | B Braun | 4657543B | For solution transfers prior to radiolabeling |
| pH paper | VWR | 85409.600 | To test the pH of the radiolabelling product |
| Pipette 1000 µL (Gilson PIPETMAN) | Fisher Scientific | 12346132-1000 | For precise liquid measurement and transfer |
| Pipette 200 µL (Gilson PIPETMAN) | Fisher Scientific | 12326132-200 | For precise liquid measurement and transfer |
| Pipette Tips, 100-1000 μL | Charles River | D1000IW | For precise liquid measurement and transfer |
| Pipette Tips, 2-200 μL | Charles River | D200IW | For precise liquid measurement and transfer |
| Radiochromatograph | Elysia-Raytest | - | For TLC control of radiochemical purity |
| Radiosensor for HPLC | Elysia-Raytest | - | For HPLC control of radiochemical purity |
| Reagents kit | ABX | RT-101 | Provides ethanol 60%, NaCl 0.9%, WFI bag, C18 cartridge, 0.2 µ terminal filter, aeration needles, terminal needle and waste vial |
| Shielded container | LemerPax | For radiation attenuation of the radiolabeling product | |
| Single-use plastic spatula | Corning | 3005 | For the preparation of reagents |
| Sodium acetate trihydrate EMPROVE | Sigma Aldrich | 1.28204 | For reaction buffer preparation |
| Sterile sealed vials (glass type 1) | Curium | TC-ELU-5 | For final conditioning of buffer, antioxidant and radiolabeling solutions |
| Sterile tubing set | ABX | RT-01-H | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Sterile water for irrigation | B Braun | 0082479E | For the preparation of one of the mobile phases for TLC control |
| Synthesis module (GAIA) | Elysia-Raytest | - | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Syringe (1 mL, low dead-volume) | B Braun | 9166017V | For peptide in buffer conditionning and addition of methionine in NaCl 0.9% |
| Syringes (10 mL) | Becton Dickinson | 309649 | For methionine in NaCl 0.9% and conditionning |
| Syringes (3 mL) | Becton Dickinson | 309658 | For methionine and ethanol 60% conditionning |
| TLC migration tanks | Fisher Scientific | 50-212-281 | For TLC control of radiochemical purity |
| Trifluoroacetic acid (suitable for HPLC) | Sigma Aldrich | 302031-100ML | For HPLC control of radiochemical purity |
| Tubes for gamma counter | - | - | For half-life and radiochemical purity assays preparation |
| Ultrasonic bath | Selecta | 3000683 | For sonication of prepared solutions |
| Vector molecule (3BP-3940) | MedChemExpress | HY-P10131 | Vector molecule to be radiolabeled |
| Vial for HPLC with glass insert | Sigma Aldrich | 29385-U and SU860066 | For HPLC control of radiochemical purity |
| Vortex mixer | VWR | 444-5900P | For stirring the prepared solutions |
| Water for HPLC | Sigma Aldrich | 34877-2.5L-M | For HPLC control of radiochemical purity |
| Water for injection, 10 mL flasks | Aguettan | 34009 370 641 0 1 | For solutions preparation |
参考文献
- Xiao, Y., Yu, D. Tumor microenvironment as a therapeutic target in cancer. Pharmacol Ther. 221, 107753(2021).
- Zhang, L., et al. Targets of tumor microenvironment for potential drug development. MedComm Oncol. 3 (1), e68(2024).
- Fouillet, J., Torchio, J., Rubira, L., Fersing, C. Unveiling the Tumor Microenvironment Through Fibroblast Activation Protein Targeting in Diagnostic Nuclear Medicine: A Didactic Review on Biological Rationales and Key Imaging Agents. Biology. 13 (12), 967(2024).
- Chen, Y., McAndrews, K. M., Kalluri, R. Clinical and therapeutic relevance of cancer-associated fibroblasts. Nat Rev Clin Oncol. 18 (12), 792-804 (2021).
- Lindner, T., et al. Targeting of activated fibroblasts for imaging and therapy. EJNMMI Radiopharm Chem. 4 (1), 16(2019).
- Jansen, K., et al. Extended structure-activity relationship and pharmacokinetic investigation of (4-quinolinoyl)glycyl-2-cyanopyrrolidine inhibitors of fibroblast activation protein (FAP). J Med Chem. 57 (7), 3053-3074 (2014).
- De Decker, A., et al. Novel Small Molecule-Derived, Highly Selective Substrates for Fibroblast Activation Protein (FAP). ACS Med Chem Lett. 10 (8), 1173-1179 (2019).
- Van Rymenant, Y., et al. In Vitro and In Situ Activity-Based Labeling of Fibroblast Activation Protein with UAMC1110-Derived Probes. Front Chem. 9, 640566(2021).
- Lindner, T., et al. Development of Quinoline-Based Theranostic Ligands for the Targeting of Fibroblast Activation Protein. J Nucl Med. 59 (9), 1415-1422 (2018).
- Guglielmo, P., et al. Head-to-Head Comparison of FDG and Radiolabeled FAPI PET: A Systematic Review of the Literature. Life. 13 (9), 1821(2023).
- Ora, M., et al. Fibroblast Activation Protein Inhibitor-Based Radionuclide Therapies: Current Status and Future Directions. J Nucl Med. 64 (7), 1001-1008 (2023).
- Zhao, L., et al. Synthesis, Preclinical Evaluation, and a Pilot Clinical PET Imaging Study of FAPI Dimer. J Nucl Med. 63 (6), 862-868 (2022).
- Ferdinandus, J., et al. Initial clinical experience with radioligand therapy for advanced stage solid tumors: a case series of nine patients. J Nucl Med. 63 (5), 727-734 (2021).
- Rathke, H., et al. Two Tumors, One Target: Preliminary Experience With 90Y-FAPI Therapy in a Patient With Metastasized Breast and Colorectal Cancer. Clin Nucl Med. 46 (10), 842-844 (2021).
- Fendler, W. P., et al. Safety and Efficacy of 90Y-FAPI-46 Radioligand Therapy in Patients with Advanced Sarcoma and Other Cancer Entities. Clin Cancer Res. 28 (19), 4346-4353 (2022).
- Zboralski, D., et al. Preclinical evaluation of FAP-2286 for fibroblast activation protein targeted radionuclide imaging and therapy. Eur J Nucl Med Mol Imaging. 49 (11), 3651-3667 (2022).
- Pang, Y., et al. PET Imaging of Fibroblast Activation Protein in Various Types of Cancer Using 68Ga-FAP-2286: Comparison with 18F-FDG and 68Ga-FAPI-46 in a Single-Center, Prospective Study. J Nucl Med. 64 (3), 386-394 (2023).
- Banihashemian, S. S., et al. [68Ga]Ga-FAP-2286, a novel promising theragnostic approach for PET/CT imaging in patients with various type of metastatic cancers. Eur J Nucl Med Mol Imaging. 51 (7), 1981-1988 (2024).
- Baum, R. P., et al. Feasibility, Biodistribution, and Preliminary Dosimetry in Peptide-Targeted Radionuclide Therapy of Diverse Adenocarcinomas Using 177Lu-FAP-2286: First-in-Humans Results. J Nucl Med. 63 (3), 415-423 (2022).
- Loktev, A., et al. Development of Fibroblast Activation Protein-Targeted Radiotracers with Improved Tumor Retention. J Nucl Med. 60 (10), 1421-1429 (2019).
- Banihashemian, S. S., et al. The complete metabolic/molecular response to chemotherapy combined with [177Lu]Lu-FAP-2286 in metastatic breast cancer. Eur J Nucl Med Mol Imaging. 51 (13), 4185-4187 (2024).
- Rao, Z., Zhang, Y., Liu, L., Wang, M., Zhang, C. [177Lu]Lu-FAP-2286 therapy in a case of right lung squamous cell carcinoma with systemic metastases. Eur J Nucl Med Mol Imaging. 50 (4), 1266-1267 (2023).
- Yang, H., Liu, H., Zhang, Y., Zhang, Y., Chen, Y. Metastatic Lung Adenocarcinoma Received Combined 177Lu-FAP-2286 Radiation Therapy and Targeted Therapy. Clin Nucl Med. 49 (6), 569-571 (2024).
- Wan, Z., Wang, W., Chen, Y., Zheng, W., Huang, Z. 177Lu-FAP-2286 Therapy in a Patient With Metastatic Rhabdoid Meningioma. Clin Nucl Med. 49 (9), 879-881 (2024).
- Yang, H., Liu, H., Li, H., Zhang, Y., Chen, Y. 177Lu-FAP-2286 Therapy in a Metastatic Bone Malignant Solitary Fibrous Tumor. Clin Nucl Med. 49 (5), 472-474 (2024).
- Li, L., Yang, J., Peng, D., Zhang, Y., Chen, Y. 177 Lu-FAP-2286 Therapy in a Case of Recurrent Bladder Cancer With Multiple Metastatic Lesions. Clin Nucl Med. 48 (11), 1012-1014 (2023).
- Compounds comprising a fibroblast activation protein ligand and use thereof. US Patent. , US20230212549A1 https://patents.google.com/patent/US20230212549A1/en (2023).
- Jakobsson, V., et al. First-in-human study of a novel radiolabeled fibroblast activating protein (FAP)-targeted peptide 68Ga-FAP-3BP-3940 for PET/CT imaging in patients with solid tumors. J Nucl Med. 64 (supplement 1), P1615-P1615 (2023).
- Greifenstein, L., et al. 3BP-3940, a highly potent FAP-targeting peptide for theranostics - production, validation and first in human experience with Ga-68 and Lu-177. iScience. 26 (12), 108541(2023).
- Baum, R. P., et al. FAP-Targeted Radiopeptide Therapy using 177Lu-, 225Ac- and 90Y-labeled 3BP-3940 in Diverse Advanced Solid Tumors: First-in-Humans Results (Abstract P1612). J Nucl Med. 64 (supplement 1), P1612-P1612 (2023).
- Meisenheimer, M., Kürpig, S., Essler, M., Eppard, E. Manual vs automated 68Ga-radiolabelling-A comparison of optimized processes. J Labelled Comp Radiopharma. 63 (4), 162-173 (2020).
- Kleynhans, J., et al. Production of [68Ga]Ga-PSMA: Comparing a manual kit-based method with a module-based automated synthesis approach. J Labelled Comp Radiopharma. 63 (13), 553-563 (2020).
- le Roux, J., Rubow, S., Ebenhan, T. A comparison of labelling characteristics of manual and automated synthesis methods for gallium-68 labelled ubiquicidin. Appl Radiation Isotopes. 168, 109452(2021).
- Todde, S., et al. EANM guideline for the preparation of an Investigational Medicinal Product Dossier (IMPD). Eur J Nucl Med Mol Imaging. 41 (11), 2175-2185 (2014).
- Mueller, D., et al. Radiolabeling and Stability of FAP- Seeking Radiopharmaceuticals for Radio-Molecular Imaging and Therapy. J Nucl Med. 61 (supplement 1), 1129-1129 (2020).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract 2532). J Nucl Med. 63 (supplement 2), 2532-2532 (2022).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract P61). Nuklearmedizin. 62, P61(2023).
- Hörmann, A. A., et al. 68Ga]Ga-FAP-2286-Synthesis, Quality Control and Comparison with [18F]FDG PET/CT in a Patient with Suspected Cholangiocellular Carcinoma. Pharmaceuticals. 17 (9), 1141(2024).
- Lütje, S., et al. Optimization of Acquisition time of 68Ga-PSMA-Ligand PET/MRI in Patients with Local and Metastatic Prostate Cancer. PLoS One. 11 (10), e0164392(2016).
- Haendeler, M., et al. Biodistribution and Radiation Dosimetric Analysis of [68Ga]Ga-RM2: A Potent GRPR Antagonist in Prostate Carcinoma Patients. Radiation. 1 (1), 33-44 (2020).
- Daniel, T., Balouzet Ravinet, C., Clerc, J., Batista, R., Mouraeff, Y. Automated synthesis and quality control of [68Ga]Ga-PentixaFor using the Gaia/Luna Elysia-Raytest module for CXCR4 PET imaging. EJNMMI Radiopharm Chem. 8 (1), 4(2023).
- Rusu, T., et al. Fully automated radiolabeling of [68Ga]Ga-EMP100 targeting c-MET for PET-CT clinical imaging. EJNMMI Radiopharm Chem. 8 (1), 30(2023).
- Rubira, L., et al. 68Ga]Ga-FAPI-46 synthesis on a GAIA® module system: Thorough study of the automated radiolabeling reaction conditions. Appl Radiation Isotopes. 206, 111211(2024).
- Fouillet, J., et al. "One Method to Label Them All": A Single Fully Automated Protocolfor GMP-Compliant 68Ga Radiolabeling of PSMA-11, Transposable toPSMA-I&T and PSMA-617. Curr Radiopharm. 17 (3), 285-301 (2024).
- Nelson, B. J. B., Andersson, J. D., Wuest, F., Spreckelmeyer, S. Good practices for 68Ga radiopharmaceutical production. EJNMMI Radiopharm Chem. 7 (1), 27(2022).
- Rubira, L., Torchio, J., Fouillet, J., Vanney, J., Fersing, C. GMP-Compliant Automated Radiolabeling and Quality Controls of [68Ga]Ga-FAPI-46 for Fibroblast Activation Protein-Targeted PET Imaging in Clinical Settings. Chem Pharma Bullet. 72 (11), 1014-1023 (2024).
- Mueller, D., et al. Radiolabeling of DOTA-like conjugated peptides with generator-produced 68Ga and using NaCl-based cationic elution method. Nat Protoc. 11 (6), 1057-1066 (2016).
- Bauwens, M., Chekol, R., Vanbilloen, H., Bormans, G., Verbruggen, A. Optimal buffer choice of the radiosynthesis of 68Ga-Dotatoc for clinical application. Nucl Med Comm. 31 (8), 753-758 (2010).
- Kulprathipanja, S., Hnatowich, D. J. A method for determining the pH stability range of gallium radiopharmaceuticals. Int J Appl Radiation Isotopes. 28 (1-2), 229-233 (1977).
- Martins, A. F., et al. Spectroscopic, radiochemical, and theoretical studies of the Ga3+-N-2-hydroxyethyl piperazine-N'-2-ethanesulfonic acid (HEPES buffer) system: evidence for the formation of Ga3+ - HEPES complexes in (68) Ga labeling reactions. Contrast Media Mol Imaging. 8 (3), 265-273 (2013).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) PSMA-11 injection. Eur Pharma 11.0. 3044, 1276-1277 (2021).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) edotreotide injection. Eur Pharma 11.0. 2482, 1274-1276 (2022).
- Li, D., et al. Development of a fibroblast activation protein-targeted PET/NIR dual-modality probe and its application in head and neck cancer. Front Bioeng Biotechnol. 11, 1291824(2023).
- Koshkin, V. S., et al. Initial Experience with 68Ga-FAP-2286 PET Imaging in Patients with Urothelial Cancer. J Nucl Med. 65 (2), 199-205 (2024).
- De Blois, E., Sze Chan, H., Konijnenberg, M., De Zanger, R. A. P., Breeman, W. Effectiveness of Quenchers to Reduce Radiolysis of 111In- or 177Lu-Labelled Methionine-Containing Regulatory Peptides. Maintaining Radiochemical Purity as Measured by HPLC. Curr Topics Med Chem. 12 (23), 2677-2685 (2013).
- Larenkov, A., Mitrofanov, I., Pavlenko, E., Rakhimov, M. Radiolysis-Associated Decrease in Radiochemical Purity of 177Lu-Radiopharmaceuticals and Comparison of the Effectiveness of Selected Quenchers against This Process. Molecules. 28 (4), 1884(2023).
- Baudhuin, H., et al. 68Ga-Labeling: Laying the Foundation for an Anti-Radiolytic Formulation for NOTA-sdAb PET Tracers. Pharmaceuticals. 14 (5), 448(2021).
- Kaczorowska, K., Kolarska, Z., Mitka, K., Kowalski, P. Oxidation of sulfides to sulfoxides. Part 2: Oxidation by hydrogen peroxide. Tetrahedron. 61 (35), 8315-8327 (2005).
- Breeman, W. A. P., et al. Optimised labeling, preclinical and initial clinical aspects of CCK-2 receptor-targeting with 3 radiolabeled peptides. Nucl Med Biol. 35 (8), 839-849 (2008).
- Haskali, M. B. Automated preparation of clinical grade [68Ga]Ga-DOTA-CP04, a cholecystokinin-2 receptor agonist, using iPHASE MultiSyn synthesis platform. EJNMMI Radiopharm Chem. 4, 23(2019).
- Chen, J., et al. Synthesis, stabilization and formulation of [177Lu]Lu-AMBA, a systemic radiotherapeutic agent for Gastrin Releasing Peptide receptor positive tumors. Appl Radiation Isotopes. 66 (4), 497-505 (2008).
- Chatalic, K. L. S., et al. In Vivo Stabilization of a Gastrin-Releasing Peptide Receptor Antagonist Enhances PET Imaging and Radionuclide Therapy of Prostate Cancer in Preclinical Studies. Theranostics. 6 (1), 104-117 (2016).
- De Zanger, R. M. S., Chan, H. S., Breeman, W. A. P., De Blois, E. Maintaining radiochemical purity of [177Lu]Lu-DOTA-PSMA-617 for PRRT by reducing radiolysis. J Radioanal Nucl Chem. 321 (1), 285-291 (2019).
- Hörmann, A. A., et al. Automated Synthesis of 68Ga-Labeled DOTA-MGS8 and Preclinical Characterization of Cholecystokinin-2 Receptor Targeting. Molecules. 27 (6), 2034(2022).
- Breeman, W. A. P., Jong, M., Visser, T. J., Erion, J. L., Krenning, E. P. Optimising conditions for radiolabelling of DOTA-peptides with 90Y, 111In and 177Lu at high specific activities. Eur J Nucl Med Mol Imaging. 30 (6), 917-920 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved