Method Article
在合成模块上自动制备 [68Ga]Ga-3BP-3940,用于肿瘤微环境的 PET 成像
摘要
本研究描述了使用 GAIA V2 合成器生产 [68Ga]Ga-3BP-3940 的自动化过程,用于成纤维细胞活化蛋白的 PET 成像。还介绍了对三个测试批次进行的质量控制测试的结果。
摘要
在 GAIA 合成模块上开发了一种快速、有效的方法,用于 3BP-3940 的自动镓 68 放射标记,3BP-3940 是一种靶向成纤维细胞活化蛋白的分子成像探针,用于肿瘤微环境的正电子发射断层扫描成像。反应条件包括乙酸盐缓冲液(终浓度:0.1 M)、蛋氨酸作为抗辐射剂(终浓度:5.4 mg/mL)和 30 μg 3BP-3940,在 98 °C 下加热 8 分钟。 为了获得高纯度的放射性标记产物,必须在 C18 小柱上进行最后的纯化步骤。相比之下,发生器生产的 68Ga 直接使用,无需在阳离子交换柱上进行浓缩步骤。三个验证批次的生产证实了该方法的可靠性,允许在 22.3 ± 0.6 分钟内合成 [68Ga]Ga-3BP-3940,具有高放射化学纯度 (RCP),如放射性 HPLC (99.1% ± 0.1%) 和放射性 TLC (99.2% ± 0.1%) 确定。根据放射性 HPLC 测量的 RCP 值,平均放射化学产率为 74.4% ± 3.3%。制备后长达 4 小时的放射性标记产物的稳定性得到证明。该方案为制备 [68Ga]Ga-3BP-3940 提供了一种可靠、快速和有效的方法,其可以很容易地转座到临床环境中。
引言
近年来,靶向肿瘤微环境 (TME) 在诊断和治疗应用中引起了相当大的兴趣1。TME 中丰富的细胞类型、信号转导分子和细胞外基质 (ECM) 大分子提供了广泛的潜在分子靶标2。在驻留和浸润宿主细胞中,癌症相关成纤维细胞 (CAF) 在 TME 内形成一个独特的成纤维细胞亚群,表型与正常成纤维细胞不同。CAF 通过独特的细胞和分子特性在肿瘤进展、转移、免疫逃逸和治疗耐药性中发挥关键作用3。这些间充质细胞表现出以成纤维细胞活化蛋白 (FAP) 表达为特征的活化表型。在分子上,CAF 分泌一系列复杂的细胞因子、趋化因子、生长因子(例如 TGF-β、IL-6 和 CXCL12)和 ECM 蛋白(例如胶原蛋白、纤连蛋白),这些蛋白重塑 ECM 并促进促肿瘤环境4。
作为一种过表达并定位在 CAF 膜细胞外表面的高度特异性蛋白,FAP 显示出可靠分子靶标的所有特性,特别是对于核医学和放射性药物应用5。在此背景下,开发了基于 DOTA 基团功能化的基于喹啉的 FAP 小分子抑制剂 (FAPI) 并迅速投入临床使用 6,7,8。具体来说,用镓 68(β + 发射器,t1/2 = 68 分钟)放射性标记的 FAPI-04 和 FAPI-46 用于正电子发射断层扫描 (PET) 成像,在纤维化疾病、心脏病学和肿瘤学中显示出显着价值 8,9,特别是对于 [18F] 氟脱氧葡萄糖 ([18F]FDG) 效用有限的癌症10.然而,虽然它们对肿瘤学和非恶性疾病成像的贡献是不可否认的,但小分子 FAPI 在靶向放射性核素治疗 (TRT) 应用中表现出一定的局限性,特别是由于它们的瘤内停留时间不理想,这可能导致健康组织的意外照射11。为了解决这个问题,已经探索了几种策略,例如设计多价配体11,12 或使用半衰期短的治疗性放射性核素 13,14,15。还开发了对 FAP 具有高亲和力并触发高比例细胞内化的新型分子支架。
其中之一是假肽衍生物 FAP-2286。它包含一个 7 个氨基酸序列,环化并通过 1,3,5-苯三甲硫醇部分与 DOTA 螯合剂连接16。一项人类初步研究表明,[68Ga]Ga-FAP-2286 表现出类似于 [68Ga]Ga-FAPI-46 的生物分布特征,在肝脏、肾脏和心脏中的生理摄取略高17。在这项研究中,64 名主要患有颈部、肝脏、胃癌、胰腺癌、卵巢癌和食管癌的患者接受了 [68Ga]Ga-FAP-2286 的 PET 成像,用于癌症分期或复发检测:在原发性肿瘤、淋巴结转移和远处转移中,[68Ga]Ga-FAP-2286 的摄取显著高于 [18F]FDG,增强了图像对比度和病灶可检测性。所有原发肿瘤在 [68Ga]Ga-FAP-2286 PET/CT 中可见,而 [18F]FDG PET/CT 漏诊了近 20% 的病灶。对于受累淋巴结,[68Ga]Ga-FAP-2286 以及骨和内脏转移的检出率更高。另一项针对 21 名患有各种癌症疾病的患者的研究也证明了这种显像剂具有出色的灵敏度,反映了 [68Ga]Ga-FAP-228618 的诊断效率。更具体的研究集中在单一类型的癌症上,例如尿路上皮癌或肺癌,再次强调了 [68Ga]Ga-FAP-2286 在临床分子成像中的巨大潜力 4,5。关于治疗,一项初步研究调查了 FAP-2286 放射性标记的镥 177 (β-发射器,t1/2 = 6.7 d) 在 11 名患有不同进行性转移性癌症的患者中的应用19.大多数患者接受两个间隔 8 周的治疗周期,每个周期的平均给药剂量为 5.8 ± 2.0 GBq 的 [177Lu]Lu-FAP-2286。该药物显示瘤内滞留延长,在骨转移中的有效半衰期约为 44 小时。鉴于可接受的副作用,这些发现为更大规模的临床试验铺平了道路:[177Lu]Lu-FAP-2286 的安全性和有效性目前正在由诺华 (NCT04939610)赞助的 1/2 期 LuMIERE 临床试验中进行评估7,8。文献 9,20 中记录了进一步的较小规模的研究方案,并已发表多个病例报告 21,22,23,24,25,26,证明了这种 TRT 的疗效和出色的耐受性。
对 FAP-2286 所做的最小结构修改导致了优化的模拟 3BP-3940(图 1)27。尽管关于这种载体分子的科学文献仍然有限,但已经针对成像和治疗应用进行了早期研究。一份初步报告描述了 [68Ga]Ga-3BP-3940 在 18 名各种终末期转移性癌患者中的使用,并得出结论,这种放射性药物是一种合适的 PET 显像剂,强调其出色的肿瘤背景比和非常低的肾摄取28。在另一项研究中,一名患有肝转移的胰腺癌患者接受了 150 MBq 的 [68Ga]Ga-3BP-3940 用于 PET 成像,结果显示原发肿瘤和转移病灶的摄取强烈29。同一患者随后接受了单剂量 9.7 GBq 的 [177Lu]Lu-3BP-3940 用于 TRT。治疗耐受性良好,生命体征或生物参数无显著变化。另一项研究介绍了使用 3BP-3940 的治疗诊断学方法的初步人体结果:通过 [68Ga]Ga-3BP-3940 PET 成像选择患者,然后接受用不同同位素标记的 3BP-3940(177Lu、 90Y 或 225Ac),单独或串联组合给药(例如, 177Lu + 225Ac),在 1-5 个治疗周期中给药30.结局包括 1 例完全缓解、4 例部分缓解、3 例疾病稳定和 12 例疾病进展。该队列 (n = 28) 的中位总生存期为 TRT 开始后 9 个月。
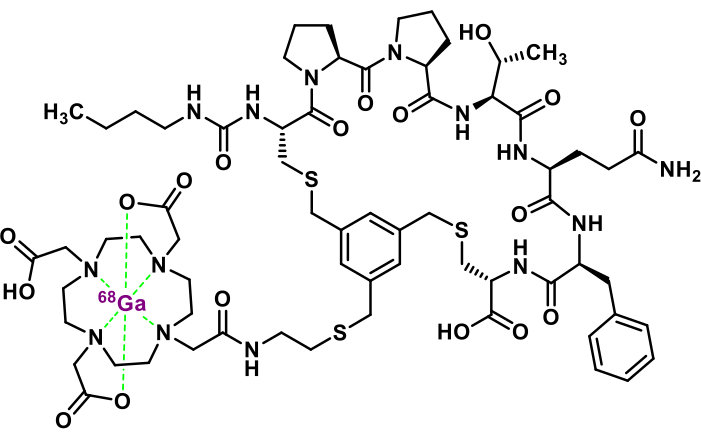
图 1:[68Ga]Ga-3BP-3940 的化学结构。 请单击此处查看此图的较大版本。
FAP-2286 和 3BP-3940 等实验放射性药物的 68Ga 放射性标记过程通常涉及合成模块,以自动化制备步骤。值得注意的是,与手动制备方法相比,方法自动化确保了过程稳定性和 GMP 合规性,并最大限度地减少了作员的辐射暴露 31,32,33。在许多情况下,监管机构在授权中心生产相应的实验放射性药物之前,希望将这种方案作为研究性医药产品档案 (IMPD) 的一部分34。迄今为止,文献 29,35,36,37,38 中关于抗 FAP 假肽的自动 68Ga 放射性标记的详细信息很少。此外,报告的数据通常仅适用于给定的 synthesizer 模型。所使用的 68Ga 发生器类型也可以带来一定的特异性,因为不同的市售解决方案的特点是 HCl 中 68Ga3+ 洗脱液的比体积(通常为 0.1 M),这可能对自动放射性标记条件产生直接影响。
在这种情况下,我们提出了一个详细的方案,用于使用 GAIA V2 合成模块快速有效地对含有 68Ga 的假肽 3BP-3940 进行自动放射性标记。该合成器依赖于使用管路组,该管组由三个斜坡组成,每个斜坡有五个歧管,连接到蠕动泵以控制流体流动。它还具有一个用于反应介质加热的样品瓶烘箱、多个放射性探头和一个用于监测系统内这些参数的压力传感器。虽然不像其他一些型号那样广泛使用,但这种自动玩偶在我们的中心经常使用,并安装在越来越多的设施中 31,39,40,41,42,43,44。本研究中使用了 GALLIAD 68Ge/68Ga 发生器,无需对 68Ga 洗脱液进行预纯化。该方法旨在为 [68Ga]Ga-3BP-3940 的生产提供稳定、快速和方便的解决方案,同时优化放射性标记过程中作员的辐射防护。这也是在该特定合成器模型上报道的这种放射性药物的第一个制备方案,并且如此详细。
研究方案
注意:该协议涉及放射性同位素的工作。执行此程序的任何人都必须接受过处理未密封放射性物质的适当培训,并且必须获得其机构辐射安全官员的批准。自动 synthesizer 应放置在指定的屏蔽热室中。任何涉及放射性物质的手动程序也应在有防护罩的热室中或在适当的辐射屏蔽罩后面进行。
1. 试剂的制备
注:自动化生产 [68Ga]Ga-3BP-3940(参见 材料表)所需的试剂在放射性药物制备装置(GMP C 级洁净室)中制备。试剂可以按任何顺序制备,并在合成前 2 小时制备。
- 缓冲溶液的制备(乙酸钠 0.8 M)
- 获得以下原材料:醋酸钠三水合物 EMPROVE API Ph Eur、BP、JP、USP、FCC、E262。
- 在正确识别的无菌容器(例如微量离心管,5 mL)中,使用精密天平称取接近 544.32 mg 的精确质量的乙酸钠三水合物。
- 使用校准的微量移液器和无菌锥体,将乙酸钠溶解在接近 5 mL 的注射用水 (WFI) 中,使 WFI 如下所述。
WFI 体积 =(称重缓冲液质量 x 5)/544.32 - 涡旋溶液并通过超声波浴(40 kHz,~1 分钟)运行以促进溶解。
- 使用配备 10G 针头的 21 mL 注射器,取出缓冲溶液。在注射器和新针头之间安装一个 0.22 μm 过滤器,然后在对隔膜消毒后将缓冲溶液直接过滤到正确识别的无菌密封小瓶(例如 TC-ELU 5)中。
- 抗辐射化合物溶液(蛋氨酸 10 mg/mL)的制备
- 获取以下原材料:L-蛋氨酸(欧洲药典,USP)纯,医药级。
- 在正确识别的无菌容器(例如,5 mL 微量离心管)中,使用精密天平称取接近 50 mg 的 L-蛋氨酸的精确质量。
- 使用校准的微量移液器和无菌锥体,将 L-蛋氨酸溶解在接近 5 mL 的 WFI 体积中,使 WFI 如下所述。
WFI 体积 = (缓冲液重量 x 5)/50 - 涡旋溶液并通过超声波浴(40 kHz,~1 分钟)运行以促进溶解。
- 使用配备 10G 针头的 21 mL 注射器,抽出蛋氨酸溶液。在注射器和新针头之间安装一个 0.22 μm 过滤器,然后在对隔膜消毒后将溶液直接过滤到正确识别的无菌密封瓶(例如,TC-ELU 5、Curium)中。
2. 准备质量控制设备
- 最终产品的 pH 值控制
- 在适当的防护罩后面,放置一条 pH 试纸,以便随后检查最终产品。
- 放射性 TLC 的放射化学纯度控制
- 准备两个包含适当流动相的 TLC 迁移罐。流动相 A:柠檬酸盐缓冲液 0.1 M pH 4 水溶液,[68Ga]Ga-3BP-3940 的预期 Rf = 0-0.2,游离 68Ga3+ 的预期 Rf = 0.8-1。流动相 B:将 1 M 乙酸铵缓冲液溶于水和甲醇 (v/v) 的 1:1 混合物中,[68Ga]镓胶体的预期 Rf = 0-0.2,[68Ga]Ga-3BP-3940 的预期 Rf = 0.8-1。
- 在适当的防护罩后面,将两个 TLC 迁移罐放置在两个 iTLC-SG 板旁边,以便随后控制最终产品的 RCP。
- 打开放射色谱仪并在作计算机上打开相关的采集软件。预先输入要执行的第一次分析的标识信息。
- 通过放射性 HPLC 控制放射化学纯度
- 检查系统上是否安装了分析所需的色谱柱模型 (C18 ACE Equivalence)。
- 制备用于 HPLC 的新鲜流动相,即用于 HPLC 的水 + 0.1% TFA(溶剂 A)和乙腈 + 0.1% TFA(溶剂 B)。将溶剂 A 和溶剂 B 瓶连接到放射 HPLC 上的相应管路。
- 打开作计算机并连接到控制软件。
- 如有必要,打开泵模块上的吹扫阀并吹扫将用于分析的管路(即管路 A 和管路 B)。此作后关闭吹扫阀。
- 让系统使用等于梯度开始时的溶剂比例(即 95% A/5% B)以 0.6 mL/min 的流速平衡至少 20 min。对于 [68Ga]Ga-3BP-3940 HPLC 分析序列,使用保持 0.6 mL/min 的流速,并按照如下方式设置从 0.1% TFA 水溶液 (A) 到 0.1% TFA 乙腈溶液 (B) 的流动相梯度:0 - 1 min 95/5 A/B;从 95/5 A/B 到 60/40 A/B 的 1 - 8 min 线性梯度;8 - 9 分钟 60/40 A/B;从 60/40 A/B 到 95/5 A/B 的线性梯度为 9 - 10 分钟;10 - 12 分钟 95/5 A/B。
- 使用步骤 2.3.5 中描述的流动相梯度选择分析方法,然后预先输入要执行的第一次分析的标识信息。
- 在屏蔽容器中,准备一个带有玻璃插件的 HPLC 样品瓶,以接收要分析的样品,并将其放置在适当的防护罩后面。
3. 准备合成模块
- 打开屏蔽单元的电源和灯。打开控制 synthesizer 的 laptop 并登录到 module 软件。
- 如果需要,从合成器中取出旧试剂盒,并将废物丢弃在适当的容器中。
- 根据适用的卫生标准,对容纳合成模块的屏蔽柜和合成器本身的内部进行清洁。
- 在合成器软件上,按 User,然后选择一个用户名并在弹出窗口中输入关联的密码。按 方法 并选择先前为 [68Ga]Ga-3BP-3940 合成配置的自动化方案。
- 按 Preparation(制备), 然后在相应的文本框中输入合成标题、载体批号、试剂盒批号和任何注释。在此阶段,还可以设置并遵循包含各种试剂盒制备步骤的清单(补充图 1)。
4. 合成盒的准备和盒的安装
- 用湿巾和适当的清洁剂消毒剂清洁放射性药剂实验室工作台,并在工作台上贴上无菌窗帘。
- 获得无菌 [68Ga]Ga 标记盒(参考 RT-01-H)和试剂盒(补充图 2)。管路组的 3 个斜坡在模块上从左到右标识为 A、B 和 C;每个斜坡的歧管从上到下(斜坡 A 和 C)或从左到右(斜坡 B)从 1 到 5 编号。
- 按照以下步骤组装盒。
- 打开[68Ga]Ga包埋盒信封,检查是否有任何损坏,然后拧紧包埋盒上的每个鲁尔接头。取下所有尖峰帽。
- 使用 5 mL 鲁尔锁注射器和 21G 针头,从试剂盒中吸取 5 mL 无水乙醇,并将其非常缓慢地通过 C18 小柱,然后吸取 5 mL WFI(试剂盒中未提供),并非常缓慢地通过同一 C18 小柱以对其进行预处理。
- 将管路的斜坡 A 放置在合成模块上,然后转动两个闩锁以将斜坡固定到位。将垂直 A1 管的自由端连接到 19G 针头,然后将其插入废液瓶中。
- 在废液瓶中加入一个通气针,并将其向后放置,最好位于将接收排空瓶的屏蔽容器后面。将 0.22 μm 滤光片置于位置 A4。
- 将水平 A1 管连接到模块前面板左下角的压力传感器。
- 使用公/公适配器,在水平 A5 位置连接一个 30 cm 的延长线,末端由 0.22 μ 端子过滤器和 80 mm 20G 针头。
- 将上述 20G 针头插入密封的无菌排空瓶(例如 TC-ELU 5)中,加入曝气针并将排空瓶置于其屏蔽容器中。
- 将连接垂直 A1 和垂直 C1 的管道管线放在斜坡 B 上方的固定钩后面。
- 使用已安装在位置 A2 的适配器,用一条短延长线(不包含在套件中,或最初连接在位置 C5 水平的延长线)连接水平歧管 A2 和 B2。
- 将斜坡 B 放置在合成模块上,并转动两个闩锁以将斜坡固定到位。
- 将预先调节好的 C18 阀芯连接到水平 C2 位置,保持将水平 B5 阀连接到 C2 的适配器位于其左侧。
- 将斜坡 C 放置在合成模块上,并转动两个闩锁以将斜坡固定到位。
- 使用公/公适配器,将水平 C5 的 50 cm 延长线连接到 GALLIAD 68Ga 发生器。
- 将管路组的彩色玻璃反应瓶放入模块的烘箱中。小心地将管路从垂直 A5 到垂直 C5 放入蠕动泵中,关闭泵,检查管路是否正确定位,然后将管路穿过泵左侧的活动传感器。
- 执行中间检查以确保暗盒和管道组装在放射性合成器上,如图 2 所示,还没有试剂。
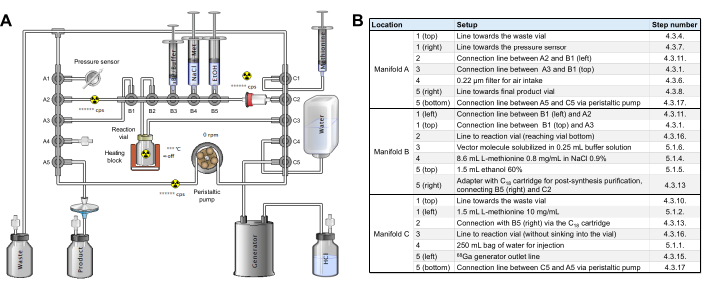
图 2:合成模块配置。 (A) 在合成模块上自动合成 [68Ga]Ga-3BP-3940 的设置。(B) 使用 GAIA 合成模块自动生产 [68Ga]Ga-3BP-3940 的试剂位置的详细信息。 请单击此处查看此图的较大版本。
5. 试剂安装
- 在模块上安装坡道后,请按照以下说明安装试剂。
- 使用 Spike 适配器将试剂盒中的 WFI 250 mL 袋连接到 C4 管路,然后将袋子挂在模块右侧的专用挂钩上。
- 使用配备 20G 针头的 3 mL 三件式鲁尔锁注射器,抽取 1.5 mL 先前制备的 L-蛋氨酸 10 mg/mL 溶液,将注射器连接到水平 C1 管,并将注射器挂在模块右侧的专用槽中。在液体表面和注射器柱塞密封件之间留出大约 2 mL 的空气,以确保液体完全转移。
- 使用带有 20G 针头的 1 mL 注射器,取出 750 μL 先前制备的 10 mg/mL L-蛋氨酸溶液,并在隔膜消毒后从试剂盒中注入 0.9% NaCl 样品瓶(蓝色卷曲)。
- 使用带有 20G 针头的 10 mL 三件式 Luer Lock 注射器,取出 0.9% NaCl + L-蛋氨酸样品瓶(蓝色卷曲)中的内容物,调整至 8.6 mL,取下位置 B4 的加标,然后将注射器连接到 B4 中。在液体表面和注射器柱塞密封件之间留出大约 2 mL 的空气,以确保液体完全转移。
- 使用带有 20G 针头的 3 mL 三件式 Luer Lock 注射器,在隔膜消毒后取出 60% 乙醇小瓶(橙色卷曲)的内容物。检查体积是否至少等于 1.5 mL,取下 B5 位置的加标,然后将注射器连接到 B5。在液体表面和注射器柱塞密封件之间留出大约 2 mL 的空气,以确保液体完全转移。
- 使用带有 20G 针头的低死体积 1 mL 注射器,抽取 0.25 mL 先前制备的 0.8 M 乙酸钠缓冲溶液,并注入含有 30 μg 3BP-3940 的小瓶中,通过连续注射/再吸入循环将其溶解。将 0.25 mL 溶液抽取到同一个注射器中,断开针头,然后将缓冲液 + 载体注射器放入 B3 中。在液体表面和注射器柱塞之间留出大约 0.25 mL 的空气,以确保液体完全转移。
- 在合成开始之前执行最终检查,如下所述。
- 确认所有试剂都连接到透析盒或管路,如图 3 所示。
- 确保套件的每个连接都足够紧密。确保没有管路被挤压或倾斜。
- 系统已准备就绪。关闭前面板并打开屏蔽室的通风。

图 3:试剂盒设置。 在合成仪上最终安装管路组和试剂,用于用 68Ga 对 3BP-3940 进行放射性标记。 请单击此处查看此图的较大版本。
6. 用于 [68Ga]Ga-3BP-3940 生产的自动放射性标记序列
- 当所有试剂都放在梯度上并且所有信息都正确记录在软件中时,单击 Run Synthesis 。
- 在整个合成序列中,管路组中放射性分布的典型曲线如下所示 图 4.按照自动方法中的后续步骤准备[68Ga]Ga-3BP-3940 的 Ga]Ga-3BP-3940 的 Alpha Tho Hal S 的 Gan S S Package
- 试剂盒完整性测试:在将管路吹扫至废液瓶(主要是为了去除 C18 小柱中的任何剩余液体)后,系统通过打开 A4 并通过蠕动泵泵送过滤后的空气来增加其内部压力。一旦连接到 A1 的压力传感器检测到管道压力> 1500 mbar,系统就会关闭,蠕动泵就会停止。如果在 15 秒内压降不超过 400 mbar,则评估试剂盒的完整性测试成功并开始合成。如果测试失败,则怀疑系统泄漏并中止综合序列。
- 向反应样品瓶中添加载体:确保溶解在缓冲溶液中的 3BP-3940 在约 30 秒内通过歧管 B2 吸入反应样品瓶中。
- 向反应瓶中加入 L-蛋氨酸:确保 C1 处注射器中所含的蛋氨酸溶液通过歧管 B2 转移到反应瓶中,然后向下斜坡 C,然后向上斜坡 A 通过歧管 A2 在斜坡 B 处分叉。
- 使用 WFI 激活 C18 小柱:确保 C4 袋中所含的 WFI 通过 C18 小柱,同时在载体和蛋氨酸溶液之后的路径上冲洗斜坡 A、B 和 C。然后用过滤后的空气冲洗相同的路线,以确保管道中没有水残留,以用于后续步骤。
- 反应瓶中的发生器洗脱(手动干预):要洗脱 GALLIAD 发生器,将发生器顶部的绿色旋钮旋转 90° 至上样位置,然后等待 10-20 秒:此时可让发生器制备 1.1 mL 的固定洗脱液体积。将绿色旋钮返回到其初始位置,然后单击 Control 软件上的提词器。然后,蠕动泵在 3 分钟内将 68Ga 洗脱液吸入反应瓶中。在此时间间隔内,反应瓶的温度在 1 分钟内逐渐升高到 60 °C,然后在 2 分钟内升高到 90 °C,以更快地达到放射性标记步骤的设定温度。
- 放射性标记:检查在放射性标记步骤开始时,是否施加了 120 °C 的设定点温度 30 秒,以实现快速、高效的加热。检查设定点温度是否随后调整至 98 °C 2 分钟。由于反应瓶中的加热和压力升高,一些反应介质往往会回流到连接到 B2 的管道中。为了限制这种情况,加热 2 分钟后设置 10 秒的管路吹扫;然后放射性标记持续约 5.5 分钟。
- C18 小柱上的捕集:确保过滤后的空气通过 C3 泵入反应容器。施加在液体表面的压力允许反应介质向上流过连接在 B2 处的管道,然后流向 SPE 小柱。然后用 C4 袋中的 WFI 冲洗反应瓶,并以相同的方式将冲洗液转移到 SPE 小柱中。最后用新鲜的 WFI 冲洗柱,并用过滤后的空气冲洗。
- C18 小柱和配方的洗脱(添加 NaCl 0.9% + L-蛋氨酸):SPE 小柱最初保留放射性标记产物和任何镓胶体,并允许游离的 68Ga3+ 通过。为了洗脱小柱并回收末端样品瓶中的 [68Ga]Ga-3BP-3940,请确保在小柱上吸取 60% 乙醇和 ~0.9 mg/mL NaCl 溶液(每个 3x 0.5 mL)的连续馏分进行洗脱。然后,B4 注射器中的全部内容物在配方步骤中通过 C18 卡式瓶,在终端样品瓶中达到 <10% 的最终乙醇浓度。
- 过滤器完整性测试(手动干预):合成并取出终端样品瓶后,按照提示将终端过滤器连接到废液瓶,并从废液瓶中取出放空过滤器,以便使用泡点测试检查终端过滤器的完整性。在泡点测试期间,过滤器最初被 WFI 润湿 30 秒。吹扫管线后,系统中的压力在 <2 分钟内缓慢增加到 >2500 mbar,在此期间,合成器检查过滤器出口上的压力是否没有增加。然后,系统缓慢增加压力以检查起泡点。当过滤器出口上的压力增加时,合成器最终将记录压力以确定起泡点压力。
- 在合成结束时,自动机软件生成一份合成报告,描述放射性标记的过程并跟踪反应瓶中的温度、系统中的压力以及所涉及的放射性量(图 4)。作为补充,根据以下公式手动计算衰变校正的放射化学产率 (RCY):
RCY =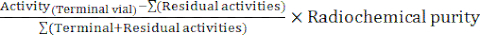
残留活性描述了合成结束时反应瓶中、C18 小柱上和废液瓶中剩余的活性。

图 4:模块内放射性的典型分布曲线。 (A) 反应瓶;(B) C18 小柱在合成 [68Ga]Ga-3BP-3940 过程中。 68Ga 洗脱液流入反应瓶中,时间为 6 分钟。在整个放射性标记反应过程中,活性保持在反应瓶中。16 分钟后,活性转移至 SPE 小柱中。小柱在 19.5 分钟后洗脱,之后固定相上仍残留约 150 MBq 的残留活性。 请单击此处查看此图的较大版本。
7. [68Ga]Ga-3BP-3940 的分液和质量控制
- 将终端样品瓶转移到适当的屏蔽池中,以进行放射性测量和患者剂量制备。
- 使用正确校准的剂量校准器测量末端样品瓶的活性,并在计算机上记录制备过程。
- 正确识别样品瓶并将其放入适当的屏蔽容器中。使用适当的无菌技术和辐射防护技术,从终端样品瓶中取出 ~0.5 mL 样品以进行质量控制。
- 通过目视检查评估制剂的外观。通过在 pH 纸条上滴注一滴产品溶液来评估制剂的 pH 值。
- 通过在先前制备的两个 iTLC-SG 板上分别沉积一滴产品溶液,通过放射性 TLC 测量放射化学纯度。然后,让板迁移到相应的流动相中并由放射色谱仪读取。通过测量产品信号和杂质信号的曲线下面积来积分所得的放射色谱图,然后根据以下公式计算放射化学纯度:
RCP (%) = 100 - %AUC杂质 1 - %AUC杂质 2 - 通过在预先制备的 HPLC 小瓶中注入 ~50 μL 制剂,通过放射性 HPLC 测量放射化学纯度(参见步骤 2.3.7)。将样品瓶放入 HPLC 自动进样器中的所需位置,然后开始分析序列。将样品注入系统后,从自动进样器中取出样品瓶并将其放回屏蔽容器中,以尽量减少照射。在分析结束时,通过测量产品信号和杂质信号的曲线下面积来积分得到的放射色谱图,然后根据公式计算放射化学纯度:
RCP (%) = 100 - Σ(%AUC杂质) - 向含有 1 mL WFI 的 γ 计数管中加入 ~5 μL 制剂,检查制备物中所含放射性同位素的半衰期(γ 计数)。用 γ 计数器连续计数试管 10 次(每次计数 1 分钟)。根据在 10 次测量中观察到的放射性衰变计算半衰期。
- 通过使用 γ 计数器进行伽马能谱分析,从湮灭光子中寻找 511 keV 和 1077 keV 峰,在与半衰期测定相同的样品上进行放射性核素鉴定测定。
- 评估前一个样品 48 小时衰减期后的放射性核素纯度。在 γ 计数器中进行 120 分钟的测量,可以检测由 68Ge 突破原位形成的任何残留 68Ga 活性和其他长半衰期放射性核素杂质。
8. [68Ga]Ga-3BP-3940 制备的稳定性
- 评估三个测试批次随时间推移的稳定性。为此,在 EoS 后立即和合成后 4 小时内每小时从终端小瓶中取出大约 200 μL 的制剂。
- 根据上述程序,在每个时间点进行放射 HPLC 分析以通过 HPLC 测量 RCP。在每个时间点执行 Radio-TLC 分析,以根据先前描述的程序通过 TLC 测量 RCP。
结果
在 GAIA 模块上开发的合成过程允许在 21-22 分钟内对 3BP-3940 进行快速的 68Ga 放射性标记。该方案旨在与医药级 68Ge/68Ga 发生器 GALLIAD 配合使用,后者在 0.1 M HCl 中产生 1.1 mL 的 68Ga 洗脱液。根据该酸量微调反应缓冲液的体积和摩尔浓度,以获得 3.5 到 4 之间的反应 pH 值,这是最佳放射性标记所必需的45。因此,使用最终摩尔浓度为 0.1 M 的乙酸钠。将蛋氨酸 10 mg/mL 作为抗辐射解剂添加到反应介质中,以限制加热步骤中载体分子的降解。未经终末纯化的初步测试将这种抗氧化剂与龙胆酸 16 mg/mL 和抗坏血酸 12 mg/mL 进行了比较,结果显示蛋氨酸的最终 RCP 优于其他两种化合物中的任何一种(图 5)。
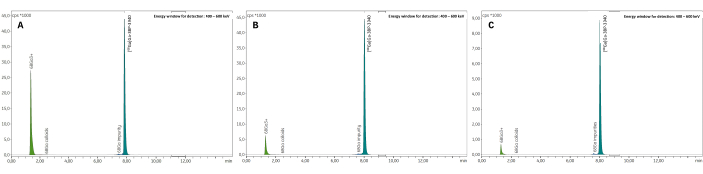
图 5:比较抗辐射化合物的初步实验中粗反应介质的 HPLC 射线色谱图。 (A) 龙胆酸 16 mg/mL (RCP = 75.5%);(B) 抗坏血酸 12 mg/mL (RCP = 86.4%);(C) 蛋氨酸 10 mg/mL (RCP = 94.7%)。 请单击此处查看此图的较大版本。
为了验证这种自动放射性标记方法,生产了三个测试批次,得到的平均最终活性为 737 ± 2.8 MBq 的制剂(校准后 +2 周的发生器)。值得注意的是,在合成过程中,一次性试剂盒系统中的活性损失很低,在三次测试产品中的平均损失为 24.9% ± 3.4%(图 6),证明了该工艺的效率。
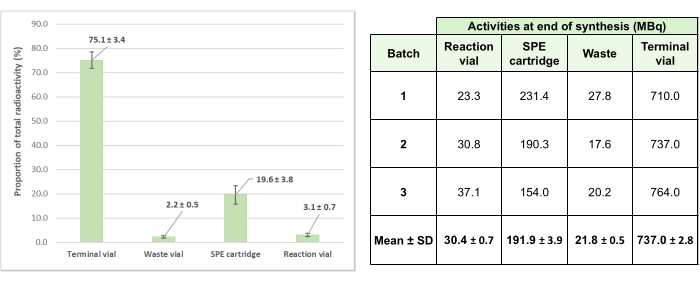
图 6:[68Ga]Ga-3BP-3940 三个验证批次的平均残留活性分布。 3 次测试放射性标记作中涉及的总活性的平均比例和在系统的各个元素中发现的平均比例用图表详细说明,每个测试合成的相应绝对活性值以表格形式提供。 请单击此处查看此图的较大版本。
三个验证批次通过了所有质量控制,包括放射性核素鉴定(补充表 1)、计算的半衰期(补充表 2)和放射性核素纯度(补充表 3)。特别是,在放射TLC(平均RCP = 99.19±0.07%;%CV = 0.07)(补充表4)和放射HPLC(平均RCP = 99.19±0.07%;%CV = 0.07; 图 7, 补充表 5)。RCP 值的可重复性非常好,未来合成的结果可能会进一步证实。此外,三个测试批次的 RCP 值在放射性 TLC 和放射性 HPLC 中都显示出非常稳定的时间,在 EoS 后 4 小时内的值始终为 >98%(图 8, 补充表 6)。对这些样品进行分析的综合结果汇编在 表 1 中。总体而言,3BP-3940 的自动 68Ga 放射性标记方法以 74.4% ± 3.3% 衰变校正 RCY 的平均值(根据 HPLC 中的 RCP 计算)进行了验证。通过使用药物级载体,该方法可以原封不动地转置到临床使用中。
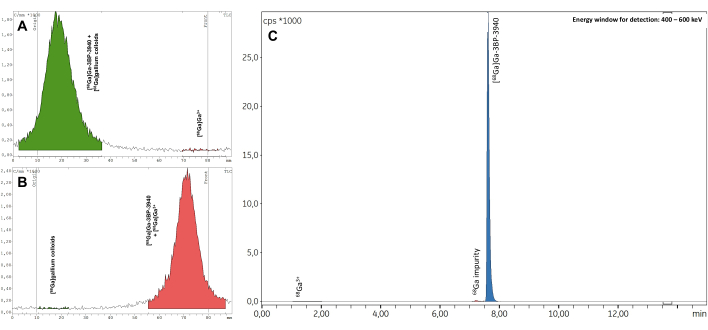
图 7:代表性的无线电 TLC。 在 (A) 柠檬酸盐缓冲液 0.1 M pH 4 和 (B) 乙酸铵 1 M 溶于 1:1 水/甲醇中得到结果。(C) 测量 [68Ga]Ga-3BP-3940 的 RCP 时获得的代表性放射 HPLC 光谱。 请单击此处查看此图的较大版本。
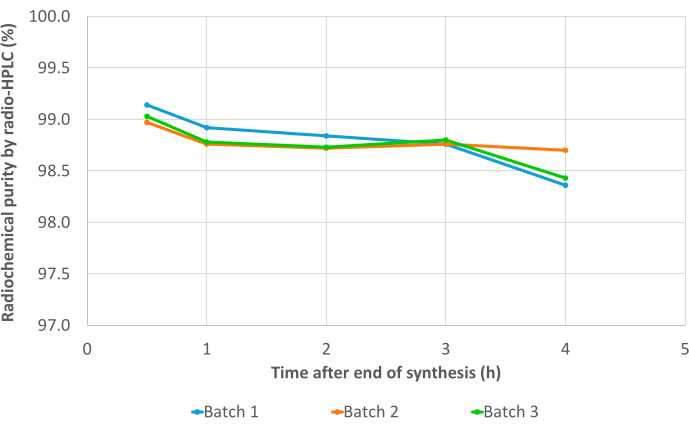
图 8:稳定性结果。 通过放射性 HPLC 测定 [68Ga]Ga-3BP3940 的三个验证批次的放射化学纯度,从 EoS 到合成后 4 小时。 请单击此处查看此图的较大版本。
| 测试 | 第 1 批 | 第 2 批 | 第 3 批 | |
| 外观 | 透明、无色的溶液 | 透明、无色的溶液 | 透明、无色的溶液 | |
| 鉴定 | ||||
| 伽马光子能量 (MeV) | 0.511 和 1.077 | 0.511 和 1.077 | 0.511 和 1.077 | |
| 半衰期(分钟) | 69,94 ± 1,03 | 69,34 ± 0,66 | 68,66 ± 0,28 | |
| 酸碱度 | 6 | 6 | 6 | |
| 放射性核素纯度 | ||||
| (68加)镓 (%) | 99.9999861 | 99.9999861 | 99.9985764 | |
| (68吉)锗和其他γ排放杂质 (%) | 1.39 × 10-5 | 5.47 × 10-6 | 1.42 × 10-3 | |
| 放射化学纯度 | ||||
| [68加]Ga-3BP-3940 (高效液相色谱) | 99.14 | 98.97 | 99.03 | |
| [68Ga] 镓杂质 (HPLC) | 0.76 | 1.03 | 0.97 | |
| [68加]Ga-3BP-3940 (薄层色谱) | 99.2 | 99.25 | 99.11 | |
| [68Ga] 镓杂质 (TLC) | 0.8 | 0.75 | 0.89 | |
| 过滤器完整性测试 (mbar) | 4046 | 4082 | 3901 | |
| EoS 体积活度 (MBq/mL)* | 69.27 | 71.9 | 74.54 | |
| EoS 比活度 (MBq/μg) | 23.46 | 24.31 | 25.22 | |
| EoS 摩尔活性 (GBq/μmol) | 34.53 | 35.78 | 37.12 | |
| 放射化学产率(基于 HPLC 测定的 RCP) | 70.93 | 74.75 | 77.58 | |
| 4 小时稳定性 (HPLC) | ≥98.36% | ≥98.70% | ≥98.43% | |
| *以 10.25 mL 的总理论体积计算 | ||||
表 1:三个 [68Ga]Ga-3BP-3940 测试批次的主质量控制结果。
补充图 1:用于合成模块设置的电源。请点击此处下载此文件。
补充图 2:在合成模块上安装试剂盒的检查表。请点击此处下载此文件。
补充图 3:使用 SCX 小柱的替代自动合成方案。请点击此处下载此文件。
补充表 1:[68Ga]Ga-3BP-3940 的 3 个测试批次的放射性核素鉴定。请点击此处下载此文件。
补充表 2:计算的 3 个测试批次的 [68Ga]Ga-3BP-3940 的半衰期。请点击此处下载此文件。
补充表 3:[68Ga]Ga-3BP-3940 的 3 个测试批次的放射性核素纯度。请点击此处下载此文件。
补充表 4:放射性 TLC 测定的 3 个测试批次 [68Ga]Ga-3BP-3940 的放射化学纯度。请点击此处下载此文件。
补充表 5:通过放射性 HPLC 测定 [68Ga]Ga-3BP-3940 的 3 个测试批次的放射化学纯度。请点击此处下载此文件。
补充表 6:通过放射性 TLC 测定 3 个测试批次的 [68Ga]Ga-3BP-3940 在 4 小时内的放射化学稳定性。请点击此处下载此文件。
讨论
这项工作提出了一种符合 GMP 的自动化制备方案,用于使用 GAIA 模块和 GALLIAD 生成器合成 [68Ga]Ga-3BP-3940。该方法改编自我们中心用于载体的镓 68 放射性标记方案,例如 PSMA 配体44 和其他 FAP 抑制剂43,46,用于临床 PET 成像,稍作修改。
生产过程设计简单明了,可分为三个主要阶段:(i) 将所有试剂转移到反应瓶中,(ii) 用 68Ga对 3BP-3940 进行放射性标记,以及 (iii) 产品纯化和配方。重要的是,这种自动化方法的一大优势是持续时间短,三个测试批次在 22.3 ± 0.6 分钟内产生(不包括过滤器完整性测试时间)。相比之下,Hörmann 等人报道了 GRP-3V 模块上 [68Ga]Ga-FAP-2286 的自动合成,强调合成时间为 35 分钟38。
为确保放射性标记产物具有高比活性,反应中仅使用 30 μg 3BP-3940,三个测试批次的 EoS 平均比活度为 24.3 ± 0.9 MBq/μg。相比之下,文献中报道的平均比活度范围为 6.9 MBq/μg38 至 19.7 MBq/μg29。唯一的例外是 Pang 等人描述的 [68Ga]Ga-FAP-2286 制备方案,该方案使用 25 μg 载体,估计比活度为 40.7 MBq/μg(合成期间未校正衰变)17。
文献中的几种自动化方案包括在强阳离子交换 (SCX) 小柱上富集和纯化镓-68 洗脱液的初始步骤,以控制添加到反应培养基中的酸性溶液中 68Ga 的体积47。为了缩短制备时间并考虑到 GALLIAD 68Ga 发生器的医药级,我们决定省略这一步;因此,此处描述的方案与涉及 ~1.1 mL 68Ga 洗脱液在 0.1 M HCl 中的放射性标记兼容。
反应缓冲液的类型和摩尔浓度是优化 68Ga 放射性标记反应的关键参数48。挑战在于将 pH 值保持在约 3.6 左右,以促进 DOTA 螯合剂对放射性金属的螯合,同时最大限度地减少不溶性氢氧化镓的形成49。在我们的实践中,最终浓度为 0.07 M 的乙酸钠在放射性标记其他载体方面的优异性能被保留46。在这项研究中,它始终显示出放射性标记 [68Ga]Ga-3BP-3940 的高效率。此外,该缓冲液是文献中最常见的 FAP 靶向假肽的 68Ga 放射性标记,尽管通常用于更高的摩尔浓度(0.25 M 至 1 M)17,19,29,35,36。有一篇文章提到了使用 4-(2-羟乙基)哌嗪-1-乙磺酸 (HEPES) 作为反应缓冲液38。其弱金属络合特性使 HEPES 成为非常适合控制 68Ga 放射性标记反应 pH 值的化合物50。然而,对该化合物的监管限制需要额外的测试来确定其在最终放射性药物制剂中的残留量,从而导致合成完成和产品使用之间的进一步延迟51,52。
文献中报道的制备 68Ga标记的 FAP 抑制假肽的温度设置差异很大。在初步工作和相应的科学文章29,36 中,Richard Baum 的团队观察到,当放射性标记反应在超过 90 °C 的温度下进行时,副产物的形成会增加。 在这种情况下,降低加热温度似乎是最大限度地减少降解产物形成的有效策略。值得注意的是,在这些条件下,没有向反应混合物中添加抗氧化化合物。然而,文献中最常见的条件包括在 85 °C 下加热 15 分钟。在 3BP-3940 的紧密类似物的 68Ga 放射性标记条件下,还可以找到更低的加热温度,另外还用荧光基团功能化,涉及 80 °C 加热 15 分钟53。相反,自动制备 [68Ga]Ga-FAP-2286 的两种方案分别提到了 120 °C 10 min54和 125 °C 6 min38 的加热温度,但导致第二种出现副产物。因此,我们选择了中间温度,在 98 °C 下加热 8 分钟,类似于一些已发布的过程19,35。根据三个测试批次的 RCP,在抗氧化剂存在下在这些条件下加热似乎不会导致标记过程中放射性分解产物的显着形成。
尽管它没有被系统地使用,但向反应介质中添加抗氧化化合物可以通过实现更高的 RCP43 来增强放射性标记结果。在最终的放射性药物制剂中,抗氧化化合物可以限制放射性分解现象并提高放射性复合物随时间推移的稳定性 55,56,57。在 68种 Ga标记的、靶向 FAP 的 DOTA 假肽的情况下,一些研究表明抗坏血酸(10 mg 或 50 mg,反应体积为 ~2.6 mL)在防止放射性分解副产物形成方面的功效不足38。有趣的是,在过氧化氢存在下进行的强制降解试验显示这些杂质的比例增加,表明氧化产物可能是通过将假肽的一个或多个硫化基转化为亚砜和/或亚砜而形成的 58。这强调了反应培养基中抗氧化剂对 3BP-3940 和相关分子进行放射性标记的重要性。在本工作中,初步测定(见图 5)已确定蛋氨酸是实现此特定目的的理想化合物。继续上述假设,在氧化条件下,砜和/或亚砜衍生物可能优先与蛋氨酸形成,从而有效地保持 3BP-3940 中硫化物官能团的完整性。除了用于用 68Ga 59,60 或 177Lu56,61,62,63 标记的各种其他载体的自动 68Ga 放射性标记方案外,甲硫氨酸还被合理地用于制备 [68Ga]Ga-3BP-394035 和 [68Ga]Ga-FAP-228619,与抗坏血酸合用。值得注意的是,在该方案中,选择每种试剂(缓冲液和抗氧化剂)的体积和浓度以达到最佳反应 pH 值,而无需事先用浓 HCl 调节,如某些方法 47,48,64 所述。同样,准确控制反应 pH 值是成功进行镓-68 放射性标记的关键参数。
通过固相萃取进行的最终纯化步骤对于去除未与 3BP-3940 络合的痕量游离 68Ga3+ 是必要的。由于分析中使用的 C18 小柱显示出良好的结果,具有出色的回收率(洗脱后回收的与小柱结合的活性的 80.3% ± 3.3%),因此未测试其他型号。有趣的是,水可湿性亲水亲脂平衡 (HLB) 反相小柱也用于 [68Ga]Ga-3BP-3940 的终末纯化29,36。
就目前而言,该协议的主要限制是它仅与单一型号的 68Ga 发生器兼容。然而,可以考虑将该方法应用于其他发生器的解决方案,例如根据 68Ga 洗脱液的体积成比例增加缓冲液体积。例如,使用 1.25 mL 而不是 0.25 mL 的 0.8 M 乙酸钠缓冲液可能适用于 5 mL 68Ga 洗脱液。另一种方法涉及将 SCX 小柱加入设置中(通常在歧管 A2 和 B1 之间),以浓缩来自发生器洗脱液的 68Ga3+ 离子。然后,通过在 pH 值为 1 的 NaCl (5 M) 饱和溶液中洗脱 SCX 小柱,可以回收固定体积的镓。这种修饰还实现了多生成器合成,正如 Mueller 等人所证明的那样,他们使用了多达四个生成器来制备 [68Ga]Ga-FAP-228619,35。因此,补充图 3 中提出了一种包含 SCX 小柱的替代方案。这种方法将允许该方法的显著放大,并可能大大增加可以从给定制剂中受益的患者数量。然而,在该方法中,必须注意的是,应再次仔细调整缓冲液体积,以允许在这些替代条件下,反应 pH 值约为 3.6,非常适合 68Ga 放射性标记65。抗辐射溶解剂和缓冲液也应直接在 B3 的同一注射器中制备,以使 C1 位置为 SCX 小柱淋洗液腾出空间。
最后,由于此处介绍的自动化流程符合 GMP 标准,因此将 GMP 级 3BP-3940 与其他质量控制(即制备无菌、细菌内毒素水平、放射 HPLC 的放射化学鉴定和残留溶剂含量定量)的开发和验证结合使用,将确保直接过渡到临床应用。这种实施显然必须满足所有当前的监管要求才能进行验证,特别是 IMPD 的构成。
披露声明
作者没有商业合作伙伴关系或资金来源,这会导致与本作品相关的实际或感知的利益冲突而被披露。
致谢
作者感谢 Yasmine Soualy、Stéphane Renaud 和 Élodie Gaven 在准备本手稿中介绍的放射性标记反应方面的帮助。
材料
| Name | Company | Catalog Number | Comments |
| 0.2 µ filters | VWR | 514-0515 | For filtration of buffer and antioxidant solutions and final radiolabeling product |
| Acetonitrile for HPLC | Sigma Aldrich | 34851-2.5L | For HPLC control of radiochemical purity |
| Ammonium acetate | Sigma Aldrich | 238074 | For the preparation of one of the mobile phases for TLC control |
| C18 column for HPLC | VWR | EQV-3C18-1503 | For HPLC control of radiochemical purity |
| Calibrated dose calibrator (CRC25) | Capintec | - | For measuring the radioactivity of the final product and the various components of the module post-synthesis |
| Citrate buffer solution, pH 4 | Thermofisher | 258585000 | Mobile phase for TLC controls |
| Eppendorf tube 5 mL Biopur | Sigma Aldrich | EP0030119479 | For the preparation of buffer and antioxidant solutions |
| Extension line (30 cm) | Vygon | 1159.03 | For the connection of the generator to the tubing set |
| Gallium-68 generator | IRE Elit | - | For in situ generation of [68Ga]gallium chloride |
| Gamma counter (Hidex AMG) | Hidex | - | For half-life and radiochemical purity assessment |
| HPLC station | Shimadzu | - | For HPLC control of radiochemical purity |
| iTLC-SG plates | Agilent | SGI0001 | For TLC control of radiochemical purity |
| L-methionine | AppliChem | A1340 | For antioxidant solution preparation |
| Male/male adapter | Vygon | 893.00 | For the connection of the generator to the tubing set |
| Methanol | Sigma Aldrich | 320390-1L | For the preparation of one of the mobile phases for TLC control |
| Needles (21G, Sterican) | B Braun | 4657543B | For solution transfers prior to radiolabeling |
| pH paper | VWR | 85409.600 | To test the pH of the radiolabelling product |
| Pipette 1000 µL (Gilson PIPETMAN) | Fisher Scientific | 12346132-1000 | For precise liquid measurement and transfer |
| Pipette 200 µL (Gilson PIPETMAN) | Fisher Scientific | 12326132-200 | For precise liquid measurement and transfer |
| Pipette Tips, 100-1000 μL | Charles River | D1000IW | For precise liquid measurement and transfer |
| Pipette Tips, 2-200 μL | Charles River | D200IW | For precise liquid measurement and transfer |
| Radiochromatograph | Elysia-Raytest | - | For TLC control of radiochemical purity |
| Radiosensor for HPLC | Elysia-Raytest | - | For HPLC control of radiochemical purity |
| Reagents kit | ABX | RT-101 | Provides ethanol 60%, NaCl 0.9%, WFI bag, C18 cartridge, 0.2 µ terminal filter, aeration needles, terminal needle and waste vial |
| Shielded container | LemerPax | For radiation attenuation of the radiolabeling product | |
| Single-use plastic spatula | Corning | 3005 | For the preparation of reagents |
| Sodium acetate trihydrate EMPROVE | Sigma Aldrich | 1.28204 | For reaction buffer preparation |
| Sterile sealed vials (glass type 1) | Curium | TC-ELU-5 | For final conditioning of buffer, antioxidant and radiolabeling solutions |
| Sterile tubing set | ABX | RT-01-H | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Sterile water for irrigation | B Braun | 0082479E | For the preparation of one of the mobile phases for TLC control |
| Synthesis module (GAIA) | Elysia-Raytest | - | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Syringe (1 mL, low dead-volume) | B Braun | 9166017V | For peptide in buffer conditionning and addition of methionine in NaCl 0.9% |
| Syringes (10 mL) | Becton Dickinson | 309649 | For methionine in NaCl 0.9% and conditionning |
| Syringes (3 mL) | Becton Dickinson | 309658 | For methionine and ethanol 60% conditionning |
| TLC migration tanks | Fisher Scientific | 50-212-281 | For TLC control of radiochemical purity |
| Trifluoroacetic acid (suitable for HPLC) | Sigma Aldrich | 302031-100ML | For HPLC control of radiochemical purity |
| Tubes for gamma counter | - | - | For half-life and radiochemical purity assays preparation |
| Ultrasonic bath | Selecta | 3000683 | For sonication of prepared solutions |
| Vector molecule (3BP-3940) | MedChemExpress | HY-P10131 | Vector molecule to be radiolabeled |
| Vial for HPLC with glass insert | Sigma Aldrich | 29385-U and SU860066 | For HPLC control of radiochemical purity |
| Vortex mixer | VWR | 444-5900P | For stirring the prepared solutions |
| Water for HPLC | Sigma Aldrich | 34877-2.5L-M | For HPLC control of radiochemical purity |
| Water for injection, 10 mL flasks | Aguettan | 34009 370 641 0 1 | For solutions preparation |
参考文献
- Xiao, Y., Yu, D. Tumor microenvironment as a therapeutic target in cancer. Pharmacol Ther. 221, 107753(2021).
- Zhang, L., et al. Targets of tumor microenvironment for potential drug development. MedComm Oncol. 3 (1), e68(2024).
- Fouillet, J., Torchio, J., Rubira, L., Fersing, C. Unveiling the Tumor Microenvironment Through Fibroblast Activation Protein Targeting in Diagnostic Nuclear Medicine: A Didactic Review on Biological Rationales and Key Imaging Agents. Biology. 13 (12), 967(2024).
- Chen, Y., McAndrews, K. M., Kalluri, R. Clinical and therapeutic relevance of cancer-associated fibroblasts. Nat Rev Clin Oncol. 18 (12), 792-804 (2021).
- Lindner, T., et al. Targeting of activated fibroblasts for imaging and therapy. EJNMMI Radiopharm Chem. 4 (1), 16(2019).
- Jansen, K., et al. Extended structure-activity relationship and pharmacokinetic investigation of (4-quinolinoyl)glycyl-2-cyanopyrrolidine inhibitors of fibroblast activation protein (FAP). J Med Chem. 57 (7), 3053-3074 (2014).
- De Decker, A., et al. Novel Small Molecule-Derived, Highly Selective Substrates for Fibroblast Activation Protein (FAP). ACS Med Chem Lett. 10 (8), 1173-1179 (2019).
- Van Rymenant, Y., et al. In Vitro and In Situ Activity-Based Labeling of Fibroblast Activation Protein with UAMC1110-Derived Probes. Front Chem. 9, 640566(2021).
- Lindner, T., et al. Development of Quinoline-Based Theranostic Ligands for the Targeting of Fibroblast Activation Protein. J Nucl Med. 59 (9), 1415-1422 (2018).
- Guglielmo, P., et al. Head-to-Head Comparison of FDG and Radiolabeled FAPI PET: A Systematic Review of the Literature. Life. 13 (9), 1821(2023).
- Ora, M., et al. Fibroblast Activation Protein Inhibitor-Based Radionuclide Therapies: Current Status and Future Directions. J Nucl Med. 64 (7), 1001-1008 (2023).
- Zhao, L., et al. Synthesis, Preclinical Evaluation, and a Pilot Clinical PET Imaging Study of FAPI Dimer. J Nucl Med. 63 (6), 862-868 (2022).
- Ferdinandus, J., et al. Initial clinical experience with radioligand therapy for advanced stage solid tumors: a case series of nine patients. J Nucl Med. 63 (5), 727-734 (2021).
- Rathke, H., et al. Two Tumors, One Target: Preliminary Experience With 90Y-FAPI Therapy in a Patient With Metastasized Breast and Colorectal Cancer. Clin Nucl Med. 46 (10), 842-844 (2021).
- Fendler, W. P., et al. Safety and Efficacy of 90Y-FAPI-46 Radioligand Therapy in Patients with Advanced Sarcoma and Other Cancer Entities. Clin Cancer Res. 28 (19), 4346-4353 (2022).
- Zboralski, D., et al. Preclinical evaluation of FAP-2286 for fibroblast activation protein targeted radionuclide imaging and therapy. Eur J Nucl Med Mol Imaging. 49 (11), 3651-3667 (2022).
- Pang, Y., et al. PET Imaging of Fibroblast Activation Protein in Various Types of Cancer Using 68Ga-FAP-2286: Comparison with 18F-FDG and 68Ga-FAPI-46 in a Single-Center, Prospective Study. J Nucl Med. 64 (3), 386-394 (2023).
- Banihashemian, S. S., et al. [68Ga]Ga-FAP-2286, a novel promising theragnostic approach for PET/CT imaging in patients with various type of metastatic cancers. Eur J Nucl Med Mol Imaging. 51 (7), 1981-1988 (2024).
- Baum, R. P., et al. Feasibility, Biodistribution, and Preliminary Dosimetry in Peptide-Targeted Radionuclide Therapy of Diverse Adenocarcinomas Using 177Lu-FAP-2286: First-in-Humans Results. J Nucl Med. 63 (3), 415-423 (2022).
- Loktev, A., et al. Development of Fibroblast Activation Protein-Targeted Radiotracers with Improved Tumor Retention. J Nucl Med. 60 (10), 1421-1429 (2019).
- Banihashemian, S. S., et al. The complete metabolic/molecular response to chemotherapy combined with [177Lu]Lu-FAP-2286 in metastatic breast cancer. Eur J Nucl Med Mol Imaging. 51 (13), 4185-4187 (2024).
- Rao, Z., Zhang, Y., Liu, L., Wang, M., Zhang, C. [177Lu]Lu-FAP-2286 therapy in a case of right lung squamous cell carcinoma with systemic metastases. Eur J Nucl Med Mol Imaging. 50 (4), 1266-1267 (2023).
- Yang, H., Liu, H., Zhang, Y., Zhang, Y., Chen, Y. Metastatic Lung Adenocarcinoma Received Combined 177Lu-FAP-2286 Radiation Therapy and Targeted Therapy. Clin Nucl Med. 49 (6), 569-571 (2024).
- Wan, Z., Wang, W., Chen, Y., Zheng, W., Huang, Z. 177Lu-FAP-2286 Therapy in a Patient With Metastatic Rhabdoid Meningioma. Clin Nucl Med. 49 (9), 879-881 (2024).
- Yang, H., Liu, H., Li, H., Zhang, Y., Chen, Y. 177Lu-FAP-2286 Therapy in a Metastatic Bone Malignant Solitary Fibrous Tumor. Clin Nucl Med. 49 (5), 472-474 (2024).
- Li, L., Yang, J., Peng, D., Zhang, Y., Chen, Y. 177 Lu-FAP-2286 Therapy in a Case of Recurrent Bladder Cancer With Multiple Metastatic Lesions. Clin Nucl Med. 48 (11), 1012-1014 (2023).
- Compounds comprising a fibroblast activation protein ligand and use thereof. US Patent. , US20230212549A1 https://patents.google.com/patent/US20230212549A1/en (2023).
- Jakobsson, V., et al. First-in-human study of a novel radiolabeled fibroblast activating protein (FAP)-targeted peptide 68Ga-FAP-3BP-3940 for PET/CT imaging in patients with solid tumors. J Nucl Med. 64 (supplement 1), P1615-P1615 (2023).
- Greifenstein, L., et al. 3BP-3940, a highly potent FAP-targeting peptide for theranostics - production, validation and first in human experience with Ga-68 and Lu-177. iScience. 26 (12), 108541(2023).
- Baum, R. P., et al. FAP-Targeted Radiopeptide Therapy using 177Lu-, 225Ac- and 90Y-labeled 3BP-3940 in Diverse Advanced Solid Tumors: First-in-Humans Results (Abstract P1612). J Nucl Med. 64 (supplement 1), P1612-P1612 (2023).
- Meisenheimer, M., Kürpig, S., Essler, M., Eppard, E. Manual vs automated 68Ga-radiolabelling-A comparison of optimized processes. J Labelled Comp Radiopharma. 63 (4), 162-173 (2020).
- Kleynhans, J., et al. Production of [68Ga]Ga-PSMA: Comparing a manual kit-based method with a module-based automated synthesis approach. J Labelled Comp Radiopharma. 63 (13), 553-563 (2020).
- le Roux, J., Rubow, S., Ebenhan, T. A comparison of labelling characteristics of manual and automated synthesis methods for gallium-68 labelled ubiquicidin. Appl Radiation Isotopes. 168, 109452(2021).
- Todde, S., et al. EANM guideline for the preparation of an Investigational Medicinal Product Dossier (IMPD). Eur J Nucl Med Mol Imaging. 41 (11), 2175-2185 (2014).
- Mueller, D., et al. Radiolabeling and Stability of FAP- Seeking Radiopharmaceuticals for Radio-Molecular Imaging and Therapy. J Nucl Med. 61 (supplement 1), 1129-1129 (2020).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract 2532). J Nucl Med. 63 (supplement 2), 2532-2532 (2022).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract P61). Nuklearmedizin. 62, P61(2023).
- Hörmann, A. A., et al. 68Ga]Ga-FAP-2286-Synthesis, Quality Control and Comparison with [18F]FDG PET/CT in a Patient with Suspected Cholangiocellular Carcinoma. Pharmaceuticals. 17 (9), 1141(2024).
- Lütje, S., et al. Optimization of Acquisition time of 68Ga-PSMA-Ligand PET/MRI in Patients with Local and Metastatic Prostate Cancer. PLoS One. 11 (10), e0164392(2016).
- Haendeler, M., et al. Biodistribution and Radiation Dosimetric Analysis of [68Ga]Ga-RM2: A Potent GRPR Antagonist in Prostate Carcinoma Patients. Radiation. 1 (1), 33-44 (2020).
- Daniel, T., Balouzet Ravinet, C., Clerc, J., Batista, R., Mouraeff, Y. Automated synthesis and quality control of [68Ga]Ga-PentixaFor using the Gaia/Luna Elysia-Raytest module for CXCR4 PET imaging. EJNMMI Radiopharm Chem. 8 (1), 4(2023).
- Rusu, T., et al. Fully automated radiolabeling of [68Ga]Ga-EMP100 targeting c-MET for PET-CT clinical imaging. EJNMMI Radiopharm Chem. 8 (1), 30(2023).
- Rubira, L., et al. 68Ga]Ga-FAPI-46 synthesis on a GAIA® module system: Thorough study of the automated radiolabeling reaction conditions. Appl Radiation Isotopes. 206, 111211(2024).
- Fouillet, J., et al. "One Method to Label Them All": A Single Fully Automated Protocolfor GMP-Compliant 68Ga Radiolabeling of PSMA-11, Transposable toPSMA-I&T and PSMA-617. Curr Radiopharm. 17 (3), 285-301 (2024).
- Nelson, B. J. B., Andersson, J. D., Wuest, F., Spreckelmeyer, S. Good practices for 68Ga radiopharmaceutical production. EJNMMI Radiopharm Chem. 7 (1), 27(2022).
- Rubira, L., Torchio, J., Fouillet, J., Vanney, J., Fersing, C. GMP-Compliant Automated Radiolabeling and Quality Controls of [68Ga]Ga-FAPI-46 for Fibroblast Activation Protein-Targeted PET Imaging in Clinical Settings. Chem Pharma Bullet. 72 (11), 1014-1023 (2024).
- Mueller, D., et al. Radiolabeling of DOTA-like conjugated peptides with generator-produced 68Ga and using NaCl-based cationic elution method. Nat Protoc. 11 (6), 1057-1066 (2016).
- Bauwens, M., Chekol, R., Vanbilloen, H., Bormans, G., Verbruggen, A. Optimal buffer choice of the radiosynthesis of 68Ga-Dotatoc for clinical application. Nucl Med Comm. 31 (8), 753-758 (2010).
- Kulprathipanja, S., Hnatowich, D. J. A method for determining the pH stability range of gallium radiopharmaceuticals. Int J Appl Radiation Isotopes. 28 (1-2), 229-233 (1977).
- Martins, A. F., et al. Spectroscopic, radiochemical, and theoretical studies of the Ga3+-N-2-hydroxyethyl piperazine-N'-2-ethanesulfonic acid (HEPES buffer) system: evidence for the formation of Ga3+ - HEPES complexes in (68) Ga labeling reactions. Contrast Media Mol Imaging. 8 (3), 265-273 (2013).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) PSMA-11 injection. Eur Pharma 11.0. 3044, 1276-1277 (2021).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) edotreotide injection. Eur Pharma 11.0. 2482, 1274-1276 (2022).
- Li, D., et al. Development of a fibroblast activation protein-targeted PET/NIR dual-modality probe and its application in head and neck cancer. Front Bioeng Biotechnol. 11, 1291824(2023).
- Koshkin, V. S., et al. Initial Experience with 68Ga-FAP-2286 PET Imaging in Patients with Urothelial Cancer. J Nucl Med. 65 (2), 199-205 (2024).
- De Blois, E., Sze Chan, H., Konijnenberg, M., De Zanger, R. A. P., Breeman, W. Effectiveness of Quenchers to Reduce Radiolysis of 111In- or 177Lu-Labelled Methionine-Containing Regulatory Peptides. Maintaining Radiochemical Purity as Measured by HPLC. Curr Topics Med Chem. 12 (23), 2677-2685 (2013).
- Larenkov, A., Mitrofanov, I., Pavlenko, E., Rakhimov, M. Radiolysis-Associated Decrease in Radiochemical Purity of 177Lu-Radiopharmaceuticals and Comparison of the Effectiveness of Selected Quenchers against This Process. Molecules. 28 (4), 1884(2023).
- Baudhuin, H., et al. 68Ga-Labeling: Laying the Foundation for an Anti-Radiolytic Formulation for NOTA-sdAb PET Tracers. Pharmaceuticals. 14 (5), 448(2021).
- Kaczorowska, K., Kolarska, Z., Mitka, K., Kowalski, P. Oxidation of sulfides to sulfoxides. Part 2: Oxidation by hydrogen peroxide. Tetrahedron. 61 (35), 8315-8327 (2005).
- Breeman, W. A. P., et al. Optimised labeling, preclinical and initial clinical aspects of CCK-2 receptor-targeting with 3 radiolabeled peptides. Nucl Med Biol. 35 (8), 839-849 (2008).
- Haskali, M. B. Automated preparation of clinical grade [68Ga]Ga-DOTA-CP04, a cholecystokinin-2 receptor agonist, using iPHASE MultiSyn synthesis platform. EJNMMI Radiopharm Chem. 4, 23(2019).
- Chen, J., et al. Synthesis, stabilization and formulation of [177Lu]Lu-AMBA, a systemic radiotherapeutic agent for Gastrin Releasing Peptide receptor positive tumors. Appl Radiation Isotopes. 66 (4), 497-505 (2008).
- Chatalic, K. L. S., et al. In Vivo Stabilization of a Gastrin-Releasing Peptide Receptor Antagonist Enhances PET Imaging and Radionuclide Therapy of Prostate Cancer in Preclinical Studies. Theranostics. 6 (1), 104-117 (2016).
- De Zanger, R. M. S., Chan, H. S., Breeman, W. A. P., De Blois, E. Maintaining radiochemical purity of [177Lu]Lu-DOTA-PSMA-617 for PRRT by reducing radiolysis. J Radioanal Nucl Chem. 321 (1), 285-291 (2019).
- Hörmann, A. A., et al. Automated Synthesis of 68Ga-Labeled DOTA-MGS8 and Preclinical Characterization of Cholecystokinin-2 Receptor Targeting. Molecules. 27 (6), 2034(2022).
- Breeman, W. A. P., Jong, M., Visser, T. J., Erion, J. L., Krenning, E. P. Optimising conditions for radiolabelling of DOTA-peptides with 90Y, 111In and 177Lu at high specific activities. Eur J Nucl Med Mol Imaging. 30 (6), 917-920 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。