Method Article
Preparación automatizada de [68Ga]Ga-3BP-3940 en un módulo de síntesis para la obtención de imágenes PET del microambiente tumoral
En este artículo
Resumen
Esta investigación describe el proceso automatizado para la producción de [68Ga]Ga-3BP-3940 con el sintetizador GAIA V2, para la obtención de imágenes PET de la proteína de activación de fibroblastos. También se presentan los resultados de las pruebas de control de calidad realizadas en tres lotes de ensayo.
Resumen
Se ha desarrollado un método rápido y eficiente en el módulo de síntesis GAIA para el radiomarcaje automatizado de galio-68 de 3BP-3940, una sonda de imagen molecular dirigida a la proteína de activación de fibroblastos para la tomografía por emisión de positrones del microambiente tumoral. Las condiciones de reacción incluyeron tampón acetato (concentración final: 0,1 M), metionina como agente antirradiólisis (concentración final: 5,4 mg/mL) y 30 μg de 3BP-3940, con calentamiento durante 8 min a 98 °C. Fue necesario un paso final de purificación en un cartucho C18 para obtener un producto radiomarcado de alta pureza. Por el contrario, el generador de 68Ga se utilizó directamente sin un paso de concentración en un cartucho de intercambio catiónico. La producción de tres lotes de validación confirmó la fiabilidad del método, permitiendo la síntesis de [68Ga]Ga-3BP-3940 en 22,3 ± 0,6 min con alta pureza radioquímica (RCP), determinada tanto por radio-HPLC (99,1% ± 0,1%) como por radio-TLC (99,2% ± 0,1%). El rendimiento radioquímico promedio, basado en los valores de RCP medidos por radio-HPLC, fue del 74,4% ± del 3,3%. La estabilidad del producto radiomarcado se demostró hasta 4 h después de la preparación. Este protocolo proporciona una metodología fiable, rápida y eficiente para la preparación de [68Ga]Ga-3BP-3940, que puede trasladarse fácilmente a un entorno clínico.
Introducción
En los últimos años, el tratamiento del microambiente tumoral (TME) ha atraído un interés considerable en aplicaciones diagnósticas y terapéuticas1. La abundancia de tipos de células, moléculas de señalización y macromoléculas de matriz extracelular (MEC) dentro del TME ofrece una amplia gama de posibles objetivos moleculares2. Entre las células huésped residentes e infiltrantes, los fibroblastos asociados al cáncer (CAF) forman un subconjunto distinto de fibroblastos dentro de la TME, fenotípicamente diferente de los fibroblastos normales. Los CAF desempeñan un papel crucial en la progresión tumoral, la metástasis, la evasión inmunitaria y la resistencia a la terapia a través de características celulares y moleculares únicas3. Estas células mesenquimales exhiben un fenotipo activado marcado por la expresión de la proteína de activación de fibroblastos (FAP). Molecularmente, los CAF secretan una compleja matriz de citocinas, quimiocinas, factores de crecimiento (p. ej., TGF-β, IL-6 y CXCL12) y proteínas de la MEC (p. ej., colágeno, fibronectina), que remodelan la MEC y fomentan un entorno protumorigénico4.
Al ser una proteína altamente específica que se sobreexpresa y localiza en la superficie extracelular de la membrana de CAF, la FAP presenta todas las características de una diana molecular fiable, especialmente para aplicaciones de medicina nuclear y radiofármacos5. En este contexto, se desarrollaron e introdujeron rápidamente en el uso clínico inhibidores de la FAP basados en quinolina(FAPI), funcionalizados con un grupo DOTA 6,7,8. Específicamente, FAPI-04 y FAPI-46 radiomarcados con galio-68 (emisor de β+, t1/2 = 68 min) para imágenes de tomografía por emisión de positrones (PET) han demostrado un valor significativo en enfermedades fibróticas, cardiología y oncología 8,9, particularmente para cánceres donde [18F]fluorodesoxiglucosa ([18F]FDG) tiene una utilidad limitada10. Sin embargo, si bien sus contribuciones a la oncología y a la imagen de enfermedades no malignas son innegables, los FAPI de moléculas pequeñas exhiben ciertas limitaciones para las aplicaciones de terapia con radionúclidos dirigidos (TRT), particularmente debido a su tiempo de residencia intratumoral subóptimo, lo que puede conducir a la irradiación involuntaria del tejido sano11. Para abordar esta cuestión, se han explorado varias estrategias, como el diseño de ligandos polivalentes11,12 o el uso de radionucleidos terapéuticos con vidas medias cortas 13,14,15. También se han desarrollado nuevos andamios moleculares con una alta afinidad por la FAP y que desencadenan una alta proporción de internalización celular.
Uno de ellos es el derivado pseudopeptídico FAP-2286. Contiene una secuencia de 7 aminoácidos, ciclados y unidos a un quelante de DOTA por una fracción16 de 1,3,5-bencenotrimetanotiol. Un estudio inicial en humanos demostró que [68Ga]Ga-FAP-2286 exhibe un perfil de biodistribución similar al [68Ga]Ga-FAPI-46, con una absorción fisiológica ligeramente mayor en el hígado, los riñones y el corazón17. En este estudio, 64 pacientes, principalmente con cánceres de cuello, hígado, estómago, páncreas, ovarios y esófago, se sometieron a imágenes PET con [68Ga]Ga-FAP-2286 para la estadificación del cáncer o la detección de recurrencia: la captación de [68Ga]Ga-FAP-2286 fue notablemente mayor que la de [18F]FDG en tumores primarios, metástasis de ganglios linfáticos y metástasis a distancia, lo que mejoró el contraste de la imagen y la detectabilidad de la lesión. Todos los tumores primarios fueron visibles con [68Ga]Ga-FAP-2286 PET/CT, mientras que [18F]FDG PET/CT no detectó casi el 20 % de las lesiones. Para los ganglios linfáticos comprometidos, las tasas de detección fueron más altas con [68Ga]Ga-FAP-2286, así como para las metástasis óseas y viscerales. En otro estudio en un grupo más pequeño de 21 pacientes con una variedad de enfermedades cancerosas, también se demostró la excelente sensibilidad de este agente de imagen, lo que refleja la eficacia diagnóstica de [68Ga]Ga-FAP-228618. Estudios más específicos se han centrado en un único tipo de cáncer, como el urotelial o el de pulmón, destacando una vez más el alto potencial de [68Ga]Ga-FAP-2286 para la imagen molecular clínica 4,5. En cuanto al tratamiento, en un estudio preliminar se investigó el uso de FAP-2286 radiomarcado con lutecio-177 (emisor de β, t1/2 = 6,7 d) en 11 pacientes con diversos cánceres progresivos y metastásicos19. La mayoría de los pacientes recibieron dos ciclos de tratamiento espaciados por 8 semanas, y la dosis promedio administrada por ciclo fue de 5,8 ± 2,0 GBq de [177Lu]Lu-FAP-2286. El fármaco demostró una retención intratumoral prolongada, con una vida media efectiva de aproximadamente 44 h en las metástasis óseas. Dados los efectos secundarios aceptables, estos hallazgos allanaron el camino para ensayos clínicos a mayor escala: la seguridad y eficacia de [177Lu]Lu-FAP-2286 se están evaluando actualmente en el ensayo clínico de fase 1/2 LuMIERE, patrocinado por Novartis (NCT04939610)7,8. En la literatura se documentan otros protocolos de investigación de menor escala 9,20 y se han publicado múltiples reportes de casos 21,22,23,24,25,26, que demuestran la eficacia y excelente tolerabilidad de esta TRT.
Las mínimas modificaciones estructurales realizadas en el FAP-2286 condujeron al analógico optimizado 3BP-3940 (Figura 1)27. Aunque la literatura científica sobre esta molécula vectorial sigue siendo limitada, se han realizado estudios preliminares tanto para aplicaciones de imagen como terapéuticas. En un informe preliminar se describe el uso de [68Ga]Ga-3BP-3940 en 18 pacientes con varios carcinomas metastásicos terminales y se concluye que este radiofármaco es un agente de imagen PET adecuado, destacando su excelente relación tumor-fondo y su muy baja captación renal28. En otro trabajo, un solo paciente con cáncer de páncreas con metástasis hepáticas recibió 150 MBq de [68Ga]Ga-3BP-3940 para la PET, lo que demostró una intensa captación en el tumor primario y las lesiones metastásicas29. Posteriormente, el mismo paciente recibió una dosis única de 9,7 GBq de [177Lu]Lu-3BP-3940 para TRT. El tratamiento fue bien tolerado, sin cambios significativos en las constantes vitales ni en los parámetros biológicos. En un estudio diferente se presentaron los resultados iniciales en humanos de un abordaje teranóstico con 3BP-3940: los pacientes fueron seleccionados con imágenes PET de [68Ga]Ga-3BP-3940 y luego se les administró 3BP-3940 marcado con diferentes isótopos (177Lu, 90Y o 225Ac), administrados solos o en combinaciones en tándem (p. ej., 177Lu + 225Ac) en 1-5 ciclos de tratamiento30. Los resultados incluyeron una remisión completa, cuatro remisiones parciales, tres enfermedades estables y 12 progresiones de la enfermedad. La mediana de supervivencia global de la cohorte (n = 28) fue de 9 meses desde el inicio de la TRT.
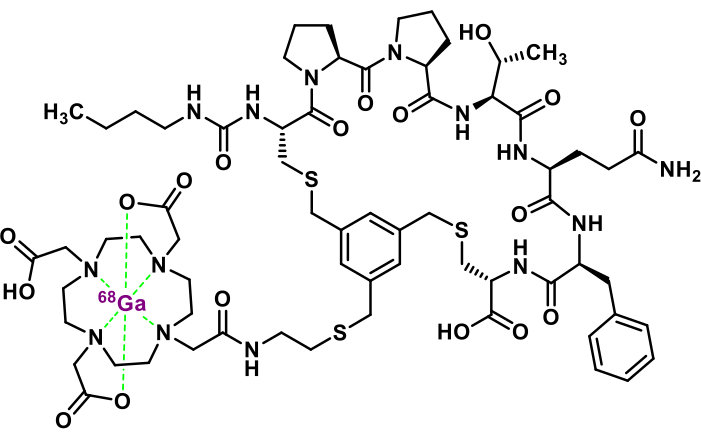
Figura 1: Estructura química de [68Ga]Ga-3BP-3940. Haga clic aquí para ver una versión más grande de esta figura.
El proceso de radiomarcaje de 68Ga para radiofármacos experimentales como FAP-2286 y 3BP-3940 generalmente implica un módulo de síntesis para automatizar el paso de preparación. En particular, la automatización de métodos garantiza la solidez del proceso y el cumplimiento de las GMP y minimiza la exposición a la radiación del operador en comparación con los métodos de preparación manual 31,32,33. En muchos casos, las autoridades reguladoras esperan que dicho protocolo forme parte de un expediente de medicamento en investigación (IMPD) antes de autorizar a un centro a fabricar el radiofármaco experimental correspondiente34. Hasta la fecha, se dispone de muy poca información detallada sobre el radiomarcaje automatizado de 68Ga de pseudopéptidos anti-FAP en la literatura 29,35,36,37,38. Además, los datos reportados generalmente se aplican solo a un modelo dado de sintetizador. El tipo de generador de 68Ga utilizado también puede aportar ciertas especificidades, ya que las diferentes soluciones disponibles en el mercado se caracterizan por volúmenes específicos de eluido de 68Ga3+ en HCl (normalmente 0,1 M), lo que puede tener un impacto directo en las condiciones de radiomarcaje automatizado.
En este contexto, presentamos un protocolo detallado para el radiomarcaje automatizado rápido y eficiente del pseudopéptido 3BP-3940 con 68Ga, utilizando el módulo de síntesis GAIA V2. Este sintetizador se basa en el uso de un conjunto de tubos que comprende tres rampas de cinco colectores cada una, conectadas a una bomba peristáltica para controlar el flujo de fluido. También cuenta con un horno de vial para el calentamiento del medio de reacción, varias sondas de radiactividad y un sensor de presión para monitorear estos parámetros dentro del sistema. Aunque no está tan extendido como otros modelos, este autómata se utiliza de forma rutinaria en nuestro centro y está instalado en un número creciente de instalaciones 31,39,40,41,42,43,44. En este trabajo se utilizó un generador GALLIAD de 68Ge/68Ga sin prepurificación del eluido de 68Ga. Este método está diseñado para ofrecer una solución robusta, rápida y conveniente para la producción de [68Ga]Ga-3BP-3940, optimizando también la protección radiológica para los operadores durante el radiomarcado. Este es también el primer protocolo de preparación de este radiofármaco que se informa sobre este modelo de sintetizador específico, y con tanto detalle.
Protocolo
NOTA: Este protocolo implica trabajar con radioisótopos. Cualquier persona que lleve a cabo este procedimiento debe estar debidamente capacitada en el manejo de materiales radiactivos no sellados y debe contar con la aprobación del oficial de seguridad radiológica de su institución. El sintetizador automatizado debe colocarse en una celda caliente blindada designada. Cualquier procedimiento manual que involucre materiales radiactivos también debe llevarse a cabo en una celda caliente blindada o detrás de un blindaje de radiación adecuado.
1. Preparación de reactivos
NOTA: Los reactivos necesarios para la producción automatizada de [68Ga]Ga-3BP-3940 (ver Tabla de Materiales) se prepararon en una unidad de preparación de radiofármacos (sala limpia de grado C GMP). Los reactivos se pueden preparar en cualquier orden y hasta 2 horas antes de la síntesis.
- Preparación de la solución tampón (acetato de sodio 0,8 M)
- Adquiera la siguiente materia prima: acetato de sodio trihidrato EMPROVE API Ph Eur, BP, JP, USP, FCC, E262.
- En un recipiente estéril (por ejemplo, tubo de microcentrífuga, 5 mL) correctamente identificado, pese una masa exacta de trihidrato de acetato de sodio cercana a 544,32 mg utilizando una balanza de precisión.
- Utilizando una micropipeta calibrada y conos estériles, solubilice el acetato de sodio en un volumen de agua para inyección (WFI) cercano a 5 mL para que el WFI sea como se describe a continuación.
Volumen WFI = (masa tampón pesada x 5)/544,32 - Agite la solución en vórtice y pásela pasar por un baño ultrasónico (40 kHz, ~1 min) para facilitar la solubilización.
- Con una jeringa de 10 ml equipada con una aguja de 21 G, extraiga la solución tampón. Instale un filtro de 0,22 μm entre la jeringa y una aguja nueva, luego filtre la solución tampón directamente en un vial sellado estéril debidamente identificado (por ejemplo, TC-ELU 5) después de la desinfección de su tabique.
- Preparación de una solución compuesta antirradiólisis (metionina 10 mg/mL)
- Adquiera la siguiente materia prima: L-Metionina (Ph. Eur., USP) pura, grado farmacéutico.
- En un recipiente estéril (por ejemplo, tubo de microcentrífuga de 5 mL) correctamente identificado, pese una masa exacta de L-metionina cercana a 50 mg utilizando una balanza de precisión.
- Utilizando una micropipeta calibrada y conos estériles, solubilice la L-metionina en un volumen de WFI cercano a 5 mL para que el WFI sea como se describe a continuación.
Volumen WFI = (masa tampón pesada x 5)/50 - Agite la solución en vórtice y pásela pasar por un baño ultrasónico (40 kHz, ~1 min) para facilitar la solubilización.
- Con una jeringa de 10 ml equipada con una aguja de 21 g, extraiga la solución de metionina. Instale un filtro de 0,22 μm entre la jeringa y la aguja nueva, luego filtre la solución directamente en un vial sellado estéril debidamente identificado (por ejemplo, TC-ELU 5, Curio) después de la desinfección de su tabique.
2. Preparación de equipos para controles de calidad
- Control del pH del producto final
- Detrás de un escudo protector adecuado, coloque una tira de papel de pH para el control posterior del producto final.
- Control de pureza radioquímica por radio-TLC
- Prepare dos tanques de migración TLC que contengan las fases móviles adecuadas. Fase móvil A: tampón de citrato 0,1 M pH 4 en agua, con Rf esperado = 0-0,2 para [68Ga]Ga-3BP-3940 y Rf = 0,8-1 para 68Ga3+ libre. Fase móvil B: tampón de acetato de amonio 1 M en una mezcla 1:1 de agua y metanol (v/v), con Rf esperado = 0-0,2 para los coloides de [68Ga]galio y Rf = 0,8-1 para [68Ga]Ga-3BP-3940.
- Detrás de un escudo protector adecuado, coloque los dos tanques de migración de TLC junto a dos placas iTLC-SG para el control posterior del RCP del producto final.
- Encienda el radiocromatógrafo y abra el software de adquisición asociado en el ordenador de mando. Introduzca previamente la información de identificación para el primer análisis que se va a realizar.
- Control de pureza radioquímica por radio-HPLC
- Compruebe que el modelo de columna necesario para el análisis (C18 ACE Equivalence) esté instalado en el sistema.
- Prepare la fase móvil fresca para HPLC, es decir, agua para HPLC + 0,1% de TFA (disolvente A) y acetonitrilo + 0,1% de TFA (disolvente B). Conecte las botellas de disolvente A y disolvente B a las líneas correspondientes de la radio-HPLC.
- Encienda la computadora operativa y conéctela al software de control.
- Si es necesario, abra la válvula de purga en el módulo de la bomba y purgue las líneas que se utilizarán para el análisis (es decir, la línea A y la línea B). Cierre la válvula de purga después de esta operación.
- Permita que el sistema se equilibre con una proporción de disolvente igual al inicio del gradiente (es decir, 95% A/5% B) con un flujo de 0,6 mL/min durante al menos 20 min. Para la secuencia de análisis de HPLC [68Ga]Ga-3BP-3940, utilice el caudal mantenido en 0,6 mL/min y programe el gradiente de fase móvil de 0,1% TFA en agua (A) a 0,1% TFA en acetonitrilo (B) de la siguiente manera: 0 - 1 min 95/5 A/B; Gradiente lineal de 1 a 8 min de 95/5 A/B a 60/40 A/B; 8 - 9 min 60/40 A/B; Gradiente lineal de 9 a 10 min de 60/40 A/B a 95/5 A/B; 10 - 12 min 95/5 A/B.
- Seleccione el método analítico con el gradiente de fase móvil descrito en el paso 2.3.5., luego introduzca previamente la información de identificación para el primer análisis que se realizará.
- En un recipiente blindado, prepare un vial de HPLC con un inserto de vidrio para recibir la muestra que se va a analizar y colóquela detrás de un escudo protector adecuado.
3. Preparación del módulo de síntesis
- Encienda la alimentación y la luz de la celda blindada. Encienda la computadora portátil que controla el sintetizador e inicie sesión en el software del módulo.
- Si es necesario, retire el kit viejo del sintetizador y deseche los desechos en los contenedores apropiados.
- Realice la limpieza del interior de la caja blindada que alberga el módulo de síntesis y del propio sintetizador de acuerdo con las normas de higiene aplicables.
- En el software del sintetizador, presione Usuario, luego seleccione un nombre de usuario e ingrese la contraseña asociada en la ventana emergente. Presione Método y seleccione el protocolo automatizado previamente configurado para la síntesis [68Ga]Ga-3BP-3940.
- Presione Preparación e ingrese el título de la síntesis, el número de lote del vector, el número de lote del kit de reactivos y cualquier comentario en el cuadro de texto correspondiente. También se puede configurar y seguir una lista de verificación con los distintos pasos de preparación del kit en esta etapa (Figura complementaria 1).
4. Preparación del casete de síntesis e instalación del casete
- Limpie el banco de trabajo del laboratorio de radiofarmacia con una toallita y el desinfectante detergente adecuado y coloque un paño estéril sobre el banco de trabajo.
- Obtenga un casete de etiquetado estéril [68Ga]Ga (referencia RT-01-H) y un kit de reactivos (Figura complementaria 2). Las 3 rampas del conjunto de tubos se identifican como A, B y C de izquierda a derecha en el módulo; los colectores de cada rampa están numerados del 1 al 5 de arriba a abajo (rampas A y C) o de izquierda a derecha (rampa B).
- Ensamble el casete siguiendo los pasos a continuación.
- Desenvuelva la envoltura del casete [68Ga]Ga, compruebe si hay algún daño y apriete cada conexión Luer del casete. Retire todas las tapas de las espigas.
- Con una jeringa Luer Lock de 5 mL y una aguja de 21G, extraiga 5 mL de absoluto de etanol del kit de reactivos y páselo muy lentamente sobre el cartucho C18 , luego extraiga 5 mL de WFI (no suministrado en el kit) y páselo muy lentamente sobre el mismo cartucho C18 para preacondicionarlo.
- Coloque la rampa A del conjunto de tubos en el módulo de síntesis y gire los dos pestillos para mantener la rampa en su lugar. Conecte el extremo libre del tubo vertical A1 a una aguja de 19G e insértelo en el vial de desechos.
- Añada una aguja de ventilación al vial de residuos y colóquelo hacia atrás, de forma óptima detrás del recipiente blindado que recibirá el vial de evacuación. Coloque un filtro de 0,22 μm en la posición A4.
- Conecte el tubo horizontal A1 al sensor de presión en la parte inferior izquierda del panel frontal del módulo.
- Con un adaptador macho/macho, conecte en posición horizontal A5 una extensión de 30 cm terminada por un filtro terminal de 0,22 μ y una aguja 20G de 80 mm.
- Inserte la aguja de 20G mencionada anteriormente en un vial de evacuación estéril y sellado (por ejemplo, TC-ELU 5), agregue una aguja de aireación y coloque el vial de evacuación en su recipiente blindado.
- Coloque la línea de tubería que conecta la vertical A1 con la vertical C1 detrás de los ganchos de retención por encima de la rampa B.
- Conecte los colectores horizontales A2 y B1 con una línea de extensión corta (ya sea no incluida en el kit, o la que inicialmente está conectada en la posición C5 horizontal), utilizando el adaptador ya montado en la posición A2.
- Coloque la rampa B en el módulo de síntesis y gire los dos pestillos para mantener la rampa en su lugar.
- Conecte el cartucho C18 preacondicionado a la posición C2 horizontal, manteniendo el adaptador que conecta la válvula B5 horizontal a C2 a su izquierda.
- Coloque la rampa C en el módulo de síntesis y gire los dos pestillos para mantener la rampa en su lugar.
- Con un adaptador macho/macho, conecte una línea de extensión de 50 cm desde la horizontal C5 al generador GALLIAD 68Ga.
- Coloque el vial de reacción de vidrieras del juego de tubos en el horno del módulo. Coloque con cuidado el tubo de la vertical A5 a la vertical C5 en la bomba peristáltica, cierre la bomba, verificando que el tubo esté correctamente colocado, y pase el tubo a través del sensor de actividad en el lado izquierdo de la bomba.
- Realice una comprobación intermedia para asegurarse de que el casete y el tubo están ensamblados en el radiosintetizador como se muestra en la Figura 2, sin reactivos todavía.
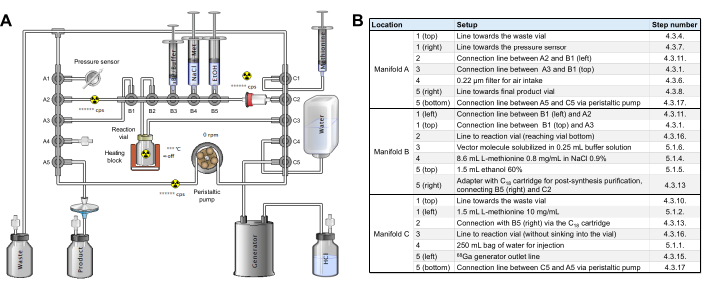
Figura 2: Configuración del módulo de síntesis. (A) Configuración para la síntesis automatizada de [68Ga]Ga-3BP-3940 en el módulo de síntesis. (B) Detalles sobre las posiciones de reactivos para la producción automatizada de [68Ga]Ga-3BP-3940 utilizando un módulo de síntesis GAIA. Haga clic aquí para ver una versión más grande de esta figura.
5. Instalación de reactivos
- Una vez que se hayan instalado las rampas en el módulo, instale los reactivos como se describe a continuación.
- Conecte la bolsa WFI de 250 ml del kit de reactivos al tubo C4 mediante el adaptador Spike y cuelgue la bolsa en el gancho dedicado en el lado derecho del módulo.
- Con una jeringa Luer Lock de tres piezas de 3 mL equipada con una aguja de 20 G, extraiga 1,5 mL de la solución de L-metionina 10 mg/mL preparada anteriormente, conecte la jeringa al tubo horizontal C1 y cuelgue la jeringa en la ranura dedicada en el lado derecho del módulo. Deje aproximadamente 2 ml de aire entre la superficie del líquido y el sello del émbolo de la jeringa para garantizar una transferencia completa del líquido.
- Utilizando una jeringa de 1 mL con una aguja de 20 G, extraiga 750 μL de la solución de L-metionina de 10 mg/mL previamente preparada e inyecte en el vial de NaCl al 0,9% (engarce azul) del kit de reactivos, después de la desinfección del tabique.
- Con una jeringa Luer Lock de tres piezas de 10 ml con una aguja de 20 g, extraiga el contenido del vial de NaCl + L-metionina al 0,9 % (engarce azul), ajústelo a 8,6 ml, retire la espiga en la posición B4 y, a continuación, conecte la jeringa en B4. Deje aproximadamente 2 ml de aire entre la superficie del líquido y el sello del émbolo de la jeringa para garantizar una transferencia completa del líquido.
- Con una jeringa Luer Lock de tres piezas de 3 ml con una aguja de 20 g, extraiga el contenido del vial de etanol al 60% (engarzado naranja) después de desinfectar el tabique. Compruebe que el volumen sea al menos igual a 1,5 ml, retire el pico en la posición B5 y, a continuación, conecte la jeringa a B5. Deje aproximadamente 2 ml de aire entre la superficie del líquido y el sello del émbolo de la jeringa para garantizar una transferencia completa del líquido.
- Utilizando una jeringa de 1 mL de bajo volumen muerto con una aguja de 20 G, extraer 0,25 mL de la solución tampón de acetato de sodio de 0,8 M previamente preparada e inyectar en el vial que contiene 30 μg de 3BP-3940 para solubilizarlo mediante ciclos sucesivos de inyecciones/reaspiraciones. Extraiga la solución de 0,25 ml en la misma jeringa, desconecte la aguja y coloque la jeringa tampón + vectorial en B3. Deje aproximadamente 0,25 ml de aire entre la superficie del líquido y el émbolo de la jeringa para garantizar una transferencia completa del líquido.
- Realice una comprobación final antes del inicio de la síntesis como se describe a continuación.
- Verifique que todos los reactivos estén conectados al casete o tubo, como se muestra en la Figura 3.
- Asegúrese de que cada una de las conexiones del kit esté lo suficientemente apretada. Asegúrese de que ningún tubo esté apretado o en ángulo.
- El sistema está listo. Cierre el panel frontal y encienda la ventilación de la celda blindada.

Figura 3: Configuración del kit. Instalación final del conjunto de tubos y reactivos en el sintetizador para el radiomarcaje de 3BP-3940 con 68Ga. Haga clic aquí para ver una versión más grande de esta figura.
6. Secuencia de radiomarcaje automatizada para la producción de [68Ga]Ga-3BP-3940
- Haga clic en Ejecutar síntesis cuando todos los reactivos estén colocados en las rampas y toda la información se registre correctamente en el software.
- Un perfil típico de la distribución de la radiactividad en el conjunto de tubos a lo largo de la secuencia de síntesis se muestra en Figura 4. Siga los pasos sucesivos del método automatizado para preparar [68Ga]Ga-3BP-3940 como se describe a continuación.
- Pruebas de integridad del kit: después de una breve purga del tubo hacia el vial de residuos (esencialmente para eliminar cualquier resto de líquido en el cartucho de C18 ), el sistema aumenta su presión interna abriendo A4 y bombeando aire filtrado a través de la bomba peristáltica. Tan pronto como el sensor de presión conectado a A1 detecta una presión de tubería > 1500 mbar, el sistema se cierra y la bomba peristáltica se detiene. Si la caída de presión no supera los 400 mbar durante 15 s, evalúe que la prueba de integridad del kit ha sido exitosa y comience la síntesis. Si la prueba falla, sospeche de una fuga del sistema y aborte la secuencia de síntesis.
- Adición de vector al vial de reacción: Asegúrese de que el 3BP-3940 solubilizado en la solución tampón se introduzca en el vial de reacción en aproximadamente 30 s, a través del colector B2.
- Adición de L-metionina al vial de reacción: Asegúrese de que la solución de metionina contenida en la jeringa en C1 se transfiera al vial de reacción a través del colector B2, bajando por la rampa C y luego subiendo la rampa A para ramificarse en la rampa B por el colector A2.
- Activación del cartucho C18 con WFI: Asegúrese de que el WFI contenido en la bolsa en C4 pase sobre el cartucho C18 , también enjuagando las rampas A, B y C en los caminos seguidos por las soluciones vectorial y de metionina. A continuación, las mismas rutas se enjuagan con aire filtrado para garantizar que no quede agua en la tubería para los pasos siguientes.
- Elución del generador en vial de reacción (intervención manual): Para eluir el generador GALLIAD, gire la perilla verde en la parte superior del generador a 90° hasta la posición de carga antes de esperar 10-20 s: este tiempo permite que el generador prepare un volumen de eluido fijo de 1,1 mL. Regrese la perilla verde a su posición inicial y haga clic en el prompter en el software de control. A continuación, la bomba peristáltica extrae el eluido de 68Ga en el vial de reacción durante un periodo de 3 minutos. Durante este intervalo de tiempo, la temperatura del vial de reacción se eleva gradualmente a 60 °C durante 1 min, luego a 90 °C durante 2 min, para alcanzar la temperatura establecida para el paso de radiomarcaje más rápidamente.
- Radiomarcado: Compruebe que al inicio de la etapa de radiomarcaje se aplique una temperatura de consigna de 120 °C durante 30 s para permitir un calentamiento rápido y eficiente. Compruebe que la temperatura de consigna se ajusta a 98 °C durante 2 minutos. Debido al calentamiento y al aumento de presión en el vial de reacción, parte del medio de reacción tiende a fluir de regreso hacia el tubo conectado a B2. Para limitar esto, se establece una purga de línea de 10 segundos después de 2 minutos de calentamiento; A continuación, el radiomarcaje continúa durante unos 5,5 minutos.
- Atrapamiento en el cartucho C18 : Asegúrese de que el aire filtrado sea bombeado al recipiente de reacción por C3. La presión ejercida sobre la superficie del líquido permite que el medio de reacción fluya hacia arriba a través de la tubería conectada en B2 y luego al cartucho SPE. A continuación, el vial de reacción se enjuaga con WFI de la bolsa en C4, y este líquido de enjuague se transfiere al cartucho SPE de la misma manera. Finalmente, el cartucho se enjuaga con WFI fresco y se enjuaga con aire filtrado.
- Elución del cartucho de C18 y formulación (adición de NaCl 0,9% + L-metionina): El cartucho SPE retiene inicialmente el producto radiomarcado y los coloides de galio y permite el paso de 68Ga3+ libre. Para eluir el cartucho y recuperar [68Ga]Ga-3BP-3940 en el vial terminal, asegúrese de que se extraigan fracciones sucesivas de etanol al 60% y metionina ~0,9 mg/mL en NaCl 0,9% (3x 0,5 mL cada una) sobre el cartucho para la elución. A continuación, todo el contenido de la jeringa en B4 se pasa a través del cartucho C18 en una etapa de formulación para lograr una concentración final de etanol del <10% en el vial terminal.
- Prueba de integridad del filtro (intervención manual): Después de la síntesis y extracción del vial terminal, siga las instrucciones que solicitan conectar el filtro terminal al vial de desecho y retire el filtro de ventilación del vial de desecho para verificar la integridad del filtro terminal mediante una prueba de punto de burbuja. Durante la prueba de punto de burbuja, el filtro se humedece inicialmente mediante WFI durante 30 s. Después de purgar las líneas, la presión en el sistema se incrementa lentamente hasta >2500 mbar durante <2 minutos, durante los cuales el sintetizador comprueba que no haya aumento de presión en la salida del filtro. Luego, el sistema aumenta lentamente la presión para verificar el punto de burbuja. El sintetizador finalmente registrará la presión cuando la presión aumente en la salida del filtro para determinar la presión del punto de burbuja.
- Al final de la síntesis, el software autómata genera un informe de síntesis que describe el curso del radiomarcaje y el seguimiento de las temperaturas en el vial de reacción, las presiones en el sistema y las cantidades de radiactividad involucradas (Figura 4). Como complemento, calcule manualmente el rendimiento radioquímico corregido por desintegración (RCY) de acuerdo con la fórmula:
RARO =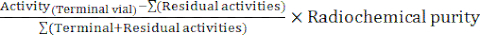
con actividades residuales que describen las actividades restantes en el vial de reacción, en el cartucho C18 y en el vial de desecho al final de la síntesis.

Figura 4: Perfil de distribución típico de la radiactividad dentro del módulo. (A) vial de reacción; (B) Cartucho C18 durante la síntesis de [68Ga]Ga-3BP-3940. El flujo de eluido de 68Ga en el vial de reacción se produce a los 6 min. La actividad permanece en el vial de reacción durante toda la reacción de radiomarcaje. Después de 16 minutos, la actividad se transfiere al cartucho SPE. El cartucho se eluye después de 19,5 min, después de lo cual permanece una actividad residual de alrededor de 150 MBq en la fase estacionaria. Haga clic aquí para ver una versión más grande de esta figura.
7. Dispensación y controles de calidad de [68Ga]Ga-3BP-3940
- Transfiera el vial terminal a una celda blindada apropiada para la medición de la radiactividad y la preparación de la dosis para el paciente.
- Mida la actividad del vial terminal con un calibrador de dosis correctamente calibrado y registre la preparación en el ordenador.
- Identifique correctamente el vial y colóquelo en un recipiente blindado adecuado. Utilizando técnicas asépticas y técnicas de protección radiológica adecuadas, extraiga una muestra de ~0,5 ml del vial terminal para controles de calidad.
- Evalúe la apariencia de la preparación mediante inspección visual. Evalúe el pH de la preparación depositando una gota de solución de producto en la tira de papel de pH.
- Mida la pureza radioquímica por radio-TLC depositando una gota de solución de producto en cada una de las dos placas iTLC-SG previamente preparadas. A continuación, permita que las placas migren a las fases móviles correspondientes y sean leídas por el radiocromatógrafo. Integre el radiocromatograma resultante midiendo el área bajo la curva de la señal del producto y la señal de impurezas, luego calcule la pureza radioquímica de acuerdo con la fórmula:
RCP (%) = 100 - %Impureza AUC 1 - %Impureza AUC 2 - Mida la pureza radioquímica por radio-HPLC inyectando ~50 μL de la preparación en el vial de HPLC preparado previamente (consulte el paso 2.3.7). Coloque el vial en el muestreador automático de HPLC en la posición requerida e inicie la secuencia de análisis. Una vez que la muestra se haya inyectado en el sistema, retire el vial del muestreador automático y reemplácelo en su recipiente blindado para minimizar la irradiación. Al final del análisis, integre el radiocromatograma resultante midiendo el área bajo la curva de la señal del producto y las señales de impurezas, luego calcule la pureza radioquímica de acuerdo con la fórmula:
RCP (%) = 100 - Σ(%impurezas AUC) - Verifique la vida media (contador gamma) del radioisótopo contenido en la preparación agregando ~ 5 μL de preparación a un tubo contador gamma que contenga 1 mL de WFI. Cuente el tubo con el contador gamma 10 veces consecutivamente (recuentos de 1 minuto cada uno). Calcule la vida media en función de la desintegración radiactiva observada en las 10 mediciones.
- Realice el ensayo de identidad radionucleídica en la misma muestra que el ensayo de vida media mediante la realización de un análisis de espectrometría gamma utilizando el contador gamma, buscando los picos de 511 keV y 1077 keV de los fotones de aniquilación.
- Evaluar la pureza radionuclidica después de un período de desintegración de 48 h de la muestra anterior. Realice una medición de 120 minutos en el contador gamma, lo que permite la detección de cualquier actividad residual de 68Ga formada in situ a partir de la ruptura de 68Ge y otras impurezas de radionúclidos de vida media larga.
8. Estabilidad de la preparación [68Ga]Ga-3BP-3940
- Evalúe tres lotes de prueba para determinar su estabilidad a lo largo del tiempo. Para ello, extraiga aproximadamente 200 μL de preparación del vial terminal cada hora inmediatamente después de la EoS y hasta 4 h después de la síntesis.
- Realice un análisis de radio-HPLC en cada punto de tiempo para medir RCP por HPLC de acuerdo con el procedimiento descrito anteriormente. Realice análisis de Radio-TLC en cada punto de tiempo para medir RCP por TLC de acuerdo con el procedimiento descrito anteriormente.
Resultados
El proceso de síntesis desarrollado en el módulo GAIA permite el radiomarcaje rápido de 68Ga de 3BP-3940 en 21-22 min. Este protocolo fue diseñado para trabajar con el generador GALLIAD de grado farmacéutico de 68Ge/68Ga, que produce 1,1 mL de eluido de 68Ga en 0,1 M de HCl. El volumen y la molaridad del tampón de reacción se ajustaron finamente de acuerdo con esta cantidad de ácido para obtener un pH de reacción entre 3,5 y 4, necesario para un radiomarcaje óptimo45. Así, se utilizó acetato de sodio con una molaridad final de 0,1 M. Se añadieron 10 mg/mL de metionina al medio de reacción como agente antirradiólisis para limitar la degradación de la molécula vectorial durante la etapa de calentamiento. Las pruebas preliminares sin purificación terminal compararon este antioxidante con 16 mg/mL de ácido gentísico y 12 mg/mL de ácido ascórbico y mostraron una mejor RCP final con metionina que con cualquiera de estos otros dos compuestos (Figura 5).
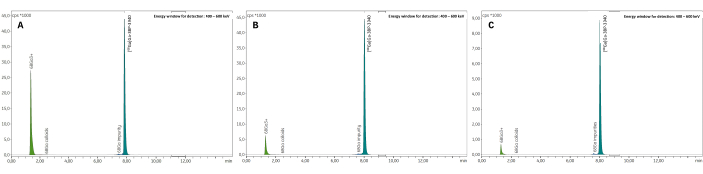
Figura 5: Radiocromatogramas de HPLC de medios de reacción crudos de experimentos preliminares que comparan compuestos antirradiólisis. (A) Ácido gentísico 16 mg/mL (RCP = 75,5%); (B) Ácido ascórbico 12 mg/mL (RCP = 86,4%); (C) Metionina 10 mg/mL (RCP = 94,7%). Haga clic aquí para ver una versión más grande de esta figura.
Para validar este método de radiomarcaje automatizado, se produjeron tres lotes de prueba, lo que dio como resultado preparaciones con una actividad final promedio de 737 ± 2.8 MBq (generador a +2 semanas después de la calibración). Cabe destacar que las pérdidas de actividad en el sistema de kit de un solo uso durante la síntesis fueron bajas, con una media del 24,9% ± del 3,4% en las tres producciones de prueba (Figura 6), lo que demuestra la eficiencia del proceso.
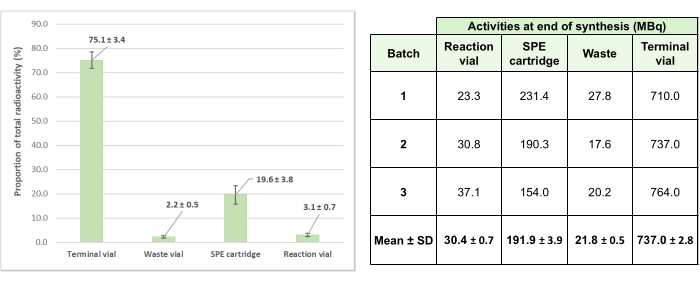
Figura 6: Distribución de las actividades residuales promedio para los tres lotes de validación de [68Ga]Ga-3BP-3940. La proporción media de la actividad total implicada en las 3 operaciones de radiomarcaje de prueba y que se encuentra en los distintos elementos del sistema se detalla en forma de diagrama, y los valores de actividad absoluta correspondientes para cada síntesis de prueba se proporcionan en forma de tabla. Haga clic aquí para ver una versión más grande de esta figura.
Los tres lotes de validación superaron todos los controles de calidad, incluida la identificación de radionúclidos (Tabla complementaria 1), la vida media calculada (Tabla suplementaria 2) y la pureza de los radionúclidos (Tabla suplementaria 3). En particular, se obtuvieron excelentes valores de RCP tanto en radio-TLC (RCP promedio = 99,19 ± 0,07%; %CV = 0,07) (Tabla suplementaria 4) como en radio-HPLC (RCP promedio = 99,19 ± 0,07%; %CV = 0,07; Figura 7, Tabla complementaria 5). La reproducibilidad de los valores de RCP es excelente y puede ser confirmada por los resultados de futuras síntesis. Además, los valores de RCP de los tres lotes de prueba mostraron una gran estabilidad en el tiempo, tanto en radio-TLC como en radio-HPLC, con valores consistentes >98% hasta 4 h después de EoS (Figura 8, Tabla Suplementaria 6). Los resultados completos de los análisis realizados en estas muestras se compilan en la Tabla 1. En general, se validó el método automatizado de radiomarcaje de 68Ga de 3BP-3940 con una media del 74,4% ± un 3,3% de RCY corregido por decaimiento (calculado a partir de RCP en HPLC). Con el uso de un vector de grado farmacéutico, este método podría trasladarse sin cambios al uso clínico.
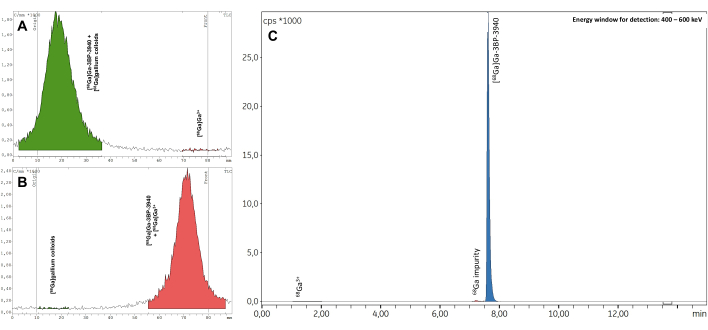
Figura 7: Radio-TLC representativo. Los resultados son (A) tampón de citrato 0,1 M pH 4 y (B) acetato de amonio 1 M en agua/metanol 1:1. (C) Espectros representativos de radio-HPLC obtenidos al medir el RCP de [68Ga]Ga-3BP-3940. Haga clic aquí para ver una versión más grande de esta figura.
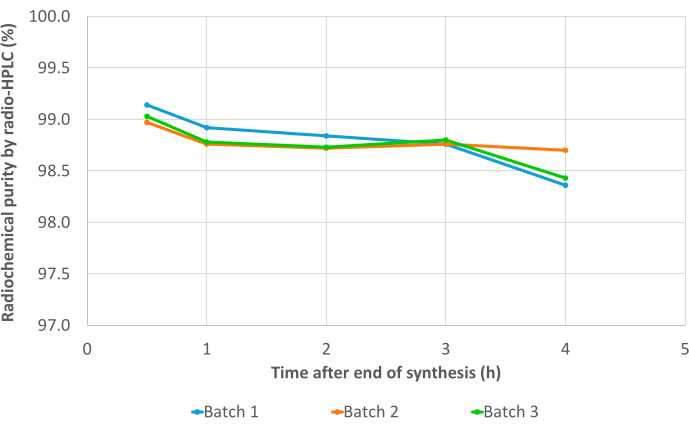
Figura 8: Resultados de estabilidad. Pureza radioquímica de los tres lotes de validación de [68Ga]Ga-3BP3940 a lo largo del tiempo, desde EoS hasta 4 h después de la síntesis, determinada por radio-HPLC. Haga clic aquí para ver una versión más grande de esta figura.
| Prueba | Lote 1 | Lote 2 | Lote 3 | |
| Apariencia | Solución transparente e incolora | Solución transparente e incolora | Solución transparente e incolora | |
| Identificación | ||||
| Energía de los fotones gamma (MeV) | 0,511 y 1,077 | 0,511 y 1,077 | 0,511 y 1,077 | |
| Vida media (min) | 69,94 ± 1,03 | 69,34 ± 0,66 | 68,66 ± 0,28 | |
| pH | 6 | 6 | 6 | |
| Pureza radionucídica | ||||
| (68Ga) Galio (%) | 99.9999861 | 99.9999861 | 99.9985764 | |
| (68Ge) Germanio y otras impurezas emisoras de γ (%) | 1.39 × 10-5 | 5.47 × 10-6 | 1.42 × 10-3 | |
| Pureza radioquímica | ||||
| [68Ga]Ga-3BP-3940 (HPLC) | 99.14 | 98.97 | 99.03 | |
| [68Impurezas de Ga]galio (HPLC) | 0.76 | 1.03 | 0.97 | |
| [68Ga]Ga-3BP-3940 (TLC) | 99.2 | 99.25 | 99.11 | |
| [68Impurezas de Ga]galio (TLC) | 0.8 | 0.75 | 0.89 | |
| Prueba de integridad del filtro (mbar) | 4046 | 4082 | 3901 | |
| Actividad de volumen en EoS (MBq/mL)* | 69.27 | 71.9 | 74.54 | |
| Actividad específica en EoS (MBq/μg) | 23.46 | 24.31 | 25.22 | |
| Actividad molar en EoS (GBq/μmol) | 34.53 | 35.78 | 37.12 | |
| Rendimiento radioquímico (basado en RCP determinado por HPLC) | 70.93 | 74.75 | 77.58 | |
| Estabilidad durante 4 h (HPLC) | ≥98.36% | ≥98.70% | ≥98.43% | |
| *Calculado con un volumen teórico total de 10,25 mL | ||||
Tabla 1: Resultados del control de calidad de la red para tres lotes de prueba [68Ga]Ga-3BP-3940.
Figura complementaria 1: Suministros para la configuración del módulo de síntesis. Haga clic aquí para descargar este archivo.
Figura complementaria 2: Lista de verificación para instalar el kit en el módulo de síntesis. Haga clic aquí para descargar este archivo.
Figura complementaria 3: Protocolo alternativo de síntesis automatizada con cartucho SCX. Haga clic aquí para descargar este archivo.
Tabla suplementaria 1: Identificación de radionúclidos para los 3 lotes de prueba de [68Ga]Ga-3BP-3940. Haga clic aquí para descargar este archivo.
Tabla suplementaria 2: Vida media calculada para los 3 lotes de prueba de [68Ga]Ga-3BP-3940. Haga clic aquí para descargar este archivo.
Tabla suplementaria 3: Pureza del radionúclido para los 3 lotes de prueba de [68Ga]Ga-3BP-3940. Haga clic aquí para descargar este archivo.
Tabla suplementaria 4: Pureza radioquímica determinada por radio-TLC para los 3 lotes de prueba de [68Ga]Ga-3BP-3940. Haga clic aquí para descargar este archivo.
Tabla suplementaria 5: Pureza radioquímica determinada por radio-HPLC para los 3 lotes de prueba de [68Ga]Ga-3BP-3940. Haga clic aquí para descargar este archivo.
Tabla suplementaria 6: Estabilidad radioquímica durante 4 h determinada por radio-TLC para los 3 lotes de prueba de [68Ga]Ga-3BP-3940. Haga clic aquí para descargar este archivo.
Discusión
En este trabajo se presenta un protocolo de preparación automatizado compatible con GMP para la síntesis de [68Ga]Ga-3BP-3940 utilizando un módulo GAIA y un generador GALLIAD. Este método se adaptó de los protocolos utilizados en nuestro centro para el radiomarcaje de galio-68 de vectores como los ligandos PSMA44 y otros inhibidores de FAP 43,46 para la imagen clínica del PET, con ligeras modificaciones.
El proceso de producción fue diseñado para ser simple y directo y se puede dividir en tres fases principales: (i) transferencia de todos los reactivos al vial de reacción, (ii) radiomarcaje de 3BP-3940 con 68Ga, y (iii) purificación y formulación del producto. Es importante destacar que uno de los grandes puntos fuertes de este método automatizado es su corta duración, ya que los tres lotes de prueba se producen en 22,3 ± 0,6 minutos (no se incluye el tiempo de prueba de integridad del filtro). En comparación, Hörmann et al., que informaron sobre la síntesis automatizada de [68Ga]Ga-FAP-2286 en un módulo GRP-3V, subrayaron un tiempo de síntesis de 35 min38.
Para garantizar un producto radiomarcado con alta actividad específica, solo se utilizaron 30 μg de 3BP-3940 en la reacción, lo que resultó en una actividad específica media de 24,3 ± 0,9 MBq/μg en EoS para los tres lotes de prueba. Comparativamente, el promedio de actividades específicas reportadas en la literatura oscila entre 6,9 MBq/μg38 y 19,7 MBq/μg29. La única excepción es el protocolo de preparación [68Ga]Ga-FAP-2286 descrito por Pang et al., que utiliza 25 μg de vector, lo que resulta en una actividad específica estimada de 40,7 MBq/μg (no corregida por decaimiento durante el tiempo de síntesis)17.
Varios protocolos automatizados en la literatura incluyen un paso inicial de enriquecimiento y purificación del eluido de galio-68 en un cartucho de intercambio catiónico fuerte (SCX) para controlar el volumen de 68Ga en una solución ácida añadida al medio de reacción47. Para acortar el tiempo de preparación y dado el grado farmacéutico del generador GALLIAD 68Ga, decidimos omitir este paso; en consecuencia, el protocolo descrito aquí es compatible con el radiomarcaje que involucra ~1,1 mL de eluido de 68Ga en HCl 0,1 M.
El tipo y la molaridad del tampón de reacción son parámetros cruciales en la optimización de las reacciones de radiomarcaje de 68Ga48. El reto consiste en mantener un pH de aproximadamente 3,6 para facilitar la quelación del radiometal por el quelante DOTA y minimizar la formación de hidróxidos de galio insolubles49. El acetato de sodio, a una concentración final de 0,07 M en el medio de reacción, se mantuvo debido a su excelente desempeño en el radiomarcaje de otros vectores en nuestra práctica46. Consistentemente, demostró una alta eficiencia en el radiomarcaje de [68Ga]Ga-3BP-3940 en este estudio. Además, este tampón es el más comúnmente reportado en la literatura para el radiomarcaje de 68Ga de pseudopéptidos dirigidos a FAP, aunque típicamente se usa en molaridades más altas (0,25 M a 1 M)17,19,29,35,36. Un solo artículo menciona el uso del ácido 4-(2-hidroxietil)piperazina-1-etanosulfónico (HEPES) como tampón de reacción38. Sus débiles propiedades complejantes de metales hacen de HEPES un compuesto muy adecuado para controlar el pH de las reacciones de radiomarcaje de 68Ga50. Sin embargo, las restricciones regulatorias sobre este compuesto requieren pruebas adicionales para determinar sus cantidades residuales en la preparación radiofarmacéutica final, lo que causa retrasos adicionales entre la finalización de la síntesis y el uso del producto51,52.
Los ajustes de temperatura reportados para la preparación de 68pseudopéptidos inhibidores de FAP marcados con Ga varían ampliamente en la literatura. En trabajos preliminares y en el artículo científico correspondiente29,36, el equipo de Richard Baum observó un aumento en la formación de subproductos cuando las reacciones de radiomarcaje se llevaron a cabo a temperaturas superiores a 90 °C. En este contexto, la disminución de la temperatura de calentamiento apareció como una estrategia eficaz para minimizar la formación de productos de degradación. Cabe destacar que no se añadieron compuestos antioxidantes a la mezcla de reacción en estas condiciones. Sin embargo, las condiciones más comúnmente reportadas en la literatura incluyen el calentamiento a 85 °C durante 15 min. Se pueden encontrar temperaturas de calentamiento aún más bajas, con las condiciones de radiomarcaje de 68Ga de un análogo cercano de 3BP-3940, funcionalizado adicionalmente con un grupo fluorescente, que implica un calentamiento de 80 °C durante 15 min53. Por el contrario, dos protocolos para la preparación automatizada de [68Ga]Ga-FAP-2286 mencionaron una temperatura de calentamiento de 120 °C durante 10 min54y 125 °C durante 6 min38, respectivamente, pero resultando en la aparición de subproductos para el segundo. Por lo tanto, optamos por una temperatura intermedia, calentando a 98 °C durante 8 min, similar a algunos procesos publicados19,35. Sobre la base del RCP de los tres lotes de prueba, el calentamiento en estas condiciones en presencia de un antioxidante no parece dar lugar a la formación significativa de productos de radiólisis durante el etiquetado.
A pesar de que no se utiliza sistemáticamente, la adición de un compuesto antioxidante al medio de reacción puede mejorar el resultado del radiomarcaje al lograr un RCP43 más alto. En la formulación radiofarmacéutica final, un compuesto antioxidante puede limitar los fenómenos de radiólisis y mejorar la estabilidad del radiocomplejo a lo largo del tiempo 55,56,57. En el caso de 68pseudopéptidos DOTA marcados con Ga y dirigidos a FAP, algunos estudios sugirieron una eficacia insuficiente del ácido ascórbico (10 mg o 50 mg en un volumen de reacción de ~2,6 mL) para prevenir la formación de subproductos de radiólisis38. Curiosamente, las pruebas de degradación forzada en presencia de peróxido de hidrógeno mostraron un aumento en la proporción de estas impurezas, lo que sugiere productos de oxidación, probablemente formados a través de la transformación de uno o más grupos sulfuro del pseudopéptido en sulfóxidos y/o sulfonas58. Esto subraya la importancia de los antioxidantes en el medio de reacción para el radiomarcaje de 3BP-3940 y moléculas relacionadas. En el presente trabajo, los ensayos preliminares (ver Figura 5) han identificado a la metionina como un compuesto ideal para este propósito específico. Continuando con la hipótesis anterior, es posible que en condiciones de oxidación, los derivados de sulfona y/o sulfóxido se formen preferentemente con metionina, preservando así de manera eficiente la integridad de las funciones de sulfuro en 3BP-3940. Además de su uso en los protocolos automatizados de radiomarcaje de 68Ga de varios otros vectores marcados con 68Ga59,60 o 177Lu 56,61,62,63, se ha informado justificadamente que la metionina se utiliza en la preparación de [68Ga]Ga-3BP-394035 y [68Ga]Ga-FAP-228619, en combinación con ácido ascórbico. Cabe destacar que en este protocolo se seleccionó el volumen y la concentración de cada reactivo (tampón y antioxidante) para lograr el pH óptimo de reacción sin requerir ajuste previo con HCl concentrado, como se describe en algunos métodos 47,48,64. Una vez más, el control preciso del pH de la reacción es un parámetro clave para el éxito del radiomarcaje con galio-68.
El paso final de purificación por extracción en fase sólida es necesario para eliminar las trazas de 68Ga3+ libre que no han sido complejadas con 3BP-3940. Dado que el cartucho deC18 utilizado en los ensayos mostró buenos resultados, con una excelente tasa de recuperación (80,3% ± 3,3% de la actividad ligada al cartucho recuperada después de la elución), no se probaron otros modelos. Curiosamente, también se han reportado cartuchos de fase reversa hidrófilo-lipofílica balanceados (HLB) humectables en agua para la purificación terminal de [68Ga]Ga-3BP-394029,36.
En la actualidad, la principal limitación de este protocolo es su compatibilidad con un solo modelo de generador de 68Ga. Sin embargo, se pueden considerar soluciones para adaptar el método a otros generadores, como aumentar el volumen del tampón proporcionalmente al volumen de eluido de 68Ga. Por ejemplo, el uso de 1,25 mL en lugar de 0,25 mL de tampón de acetato de sodio de 0,8 M podría ser adecuado para un eluido de 5 mL de 68Ga. Otro enfoque consistiría en incorporar un cartucho SCX en la configuración (normalmente entre los colectores A2 y B1) para concentrar los 68Ga3+ iones del eluido del generador. A continuación, el galio podría recuperarse en un volumen fijo eluyendo el cartucho SCX con una solución saturada de NaCl (5 M) a pH 1. Esta modificación también permite síntesis de múltiples generadores, como lo demostraron Mueller et al., quienes emplearon hasta cuatro generadores para la preparación de [68Ga]Ga-FAP-228619,35. Por lo tanto, en la Figura complementaria 3 se propone un protocolo alternativo que incorpora un cartucho SCX. Este enfoque permitiría una mejora significativa del método y podría aumentar en gran medida el número de pacientes que podrían beneficiarse de una preparación determinada. Sin embargo, en el método, es esencial tener en cuenta que los volúmenes de tampón deben ajustarse cuidadosamente una vez más para permitir, en estas condiciones alternativas, un pH de reacción de alrededor de 3,6, ideal para el radiomarcaje de 68Ga65. El agente antirradiólisis y el tampón también deben prepararse directamente en la misma jeringa en B3 para que la posición C1 quede libre para el eluyente del cartucho SCX.
Por último, dado que el proceso automatizado presentado aquí cumple con las GMP, el uso de 3BP-3940 de grado GMP en asociación con el desarrollo y la validación de controles de calidad adicionales (es decir, la esterilidad de la preparación, los niveles de endotoxinas bacterianas, la identidad radioquímica por radio-HPLC y la cuantificación del contenido de solventes residuales) garantizaría una transición directa a las aplicaciones clínicas. Obviamente, esta implantación tendría que cumplir con todos los requisitos normativos vigentes para ser validada, en particular, la constitución de un IMPD.
Divulgaciones
Los autores no tienen asociaciones comerciales ni fuentes de financiación que puedan dar lugar a un conflicto de intereses real o percibido en relación con este trabajo para divulgar.
Agradecimientos
Los autores agradecen a Yasmine Soualy, Stéphane Renaud y Élodie Gaven por su ayuda en la preparación de las reacciones de radiomarcaje presentadas en este manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.2 µ filters | VWR | 514-0515 | For filtration of buffer and antioxidant solutions and final radiolabeling product |
| Acetonitrile for HPLC | Sigma Aldrich | 34851-2.5L | For HPLC control of radiochemical purity |
| Ammonium acetate | Sigma Aldrich | 238074 | For the preparation of one of the mobile phases for TLC control |
| C18 column for HPLC | VWR | EQV-3C18-1503 | For HPLC control of radiochemical purity |
| Calibrated dose calibrator (CRC25) | Capintec | - | For measuring the radioactivity of the final product and the various components of the module post-synthesis |
| Citrate buffer solution, pH 4 | Thermofisher | 258585000 | Mobile phase for TLC controls |
| Eppendorf tube 5 mL Biopur | Sigma Aldrich | EP0030119479 | For the preparation of buffer and antioxidant solutions |
| Extension line (30 cm) | Vygon | 1159.03 | For the connection of the generator to the tubing set |
| Gallium-68 generator | IRE Elit | - | For in situ generation of [68Ga]gallium chloride |
| Gamma counter (Hidex AMG) | Hidex | - | For half-life and radiochemical purity assessment |
| HPLC station | Shimadzu | - | For HPLC control of radiochemical purity |
| iTLC-SG plates | Agilent | SGI0001 | For TLC control of radiochemical purity |
| L-methionine | AppliChem | A1340 | For antioxidant solution preparation |
| Male/male adapter | Vygon | 893.00 | For the connection of the generator to the tubing set |
| Methanol | Sigma Aldrich | 320390-1L | For the preparation of one of the mobile phases for TLC control |
| Needles (21G, Sterican) | B Braun | 4657543B | For solution transfers prior to radiolabeling |
| pH paper | VWR | 85409.600 | To test the pH of the radiolabelling product |
| Pipette 1000 µL (Gilson PIPETMAN) | Fisher Scientific | 12346132-1000 | For precise liquid measurement and transfer |
| Pipette 200 µL (Gilson PIPETMAN) | Fisher Scientific | 12326132-200 | For precise liquid measurement and transfer |
| Pipette Tips, 100-1000 μL | Charles River | D1000IW | For precise liquid measurement and transfer |
| Pipette Tips, 2-200 μL | Charles River | D200IW | For precise liquid measurement and transfer |
| Radiochromatograph | Elysia-Raytest | - | For TLC control of radiochemical purity |
| Radiosensor for HPLC | Elysia-Raytest | - | For HPLC control of radiochemical purity |
| Reagents kit | ABX | RT-101 | Provides ethanol 60%, NaCl 0.9%, WFI bag, C18 cartridge, 0.2 µ terminal filter, aeration needles, terminal needle and waste vial |
| Shielded container | LemerPax | For radiation attenuation of the radiolabeling product | |
| Single-use plastic spatula | Corning | 3005 | For the preparation of reagents |
| Sodium acetate trihydrate EMPROVE | Sigma Aldrich | 1.28204 | For reaction buffer preparation |
| Sterile sealed vials (glass type 1) | Curium | TC-ELU-5 | For final conditioning of buffer, antioxidant and radiolabeling solutions |
| Sterile tubing set | ABX | RT-01-H | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Sterile water for irrigation | B Braun | 0082479E | For the preparation of one of the mobile phases for TLC control |
| Synthesis module (GAIA) | Elysia-Raytest | - | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Syringe (1 mL, low dead-volume) | B Braun | 9166017V | For peptide in buffer conditionning and addition of methionine in NaCl 0.9% |
| Syringes (10 mL) | Becton Dickinson | 309649 | For methionine in NaCl 0.9% and conditionning |
| Syringes (3 mL) | Becton Dickinson | 309658 | For methionine and ethanol 60% conditionning |
| TLC migration tanks | Fisher Scientific | 50-212-281 | For TLC control of radiochemical purity |
| Trifluoroacetic acid (suitable for HPLC) | Sigma Aldrich | 302031-100ML | For HPLC control of radiochemical purity |
| Tubes for gamma counter | - | - | For half-life and radiochemical purity assays preparation |
| Ultrasonic bath | Selecta | 3000683 | For sonication of prepared solutions |
| Vector molecule (3BP-3940) | MedChemExpress | HY-P10131 | Vector molecule to be radiolabeled |
| Vial for HPLC with glass insert | Sigma Aldrich | 29385-U and SU860066 | For HPLC control of radiochemical purity |
| Vortex mixer | VWR | 444-5900P | For stirring the prepared solutions |
| Water for HPLC | Sigma Aldrich | 34877-2.5L-M | For HPLC control of radiochemical purity |
| Water for injection, 10 mL flasks | Aguettan | 34009 370 641 0 1 | For solutions preparation |
Referencias
- Xiao, Y., Yu, D. Tumor microenvironment as a therapeutic target in cancer. Pharmacol Ther. 221, 107753(2021).
- Zhang, L., et al. Targets of tumor microenvironment for potential drug development. MedComm Oncol. 3 (1), e68(2024).
- Fouillet, J., Torchio, J., Rubira, L., Fersing, C. Unveiling the Tumor Microenvironment Through Fibroblast Activation Protein Targeting in Diagnostic Nuclear Medicine: A Didactic Review on Biological Rationales and Key Imaging Agents. Biology. 13 (12), 967(2024).
- Chen, Y., McAndrews, K. M., Kalluri, R. Clinical and therapeutic relevance of cancer-associated fibroblasts. Nat Rev Clin Oncol. 18 (12), 792-804 (2021).
- Lindner, T., et al. Targeting of activated fibroblasts for imaging and therapy. EJNMMI Radiopharm Chem. 4 (1), 16(2019).
- Jansen, K., et al. Extended structure-activity relationship and pharmacokinetic investigation of (4-quinolinoyl)glycyl-2-cyanopyrrolidine inhibitors of fibroblast activation protein (FAP). J Med Chem. 57 (7), 3053-3074 (2014).
- De Decker, A., et al. Novel Small Molecule-Derived, Highly Selective Substrates for Fibroblast Activation Protein (FAP). ACS Med Chem Lett. 10 (8), 1173-1179 (2019).
- Van Rymenant, Y., et al. In Vitro and In Situ Activity-Based Labeling of Fibroblast Activation Protein with UAMC1110-Derived Probes. Front Chem. 9, 640566(2021).
- Lindner, T., et al. Development of Quinoline-Based Theranostic Ligands for the Targeting of Fibroblast Activation Protein. J Nucl Med. 59 (9), 1415-1422 (2018).
- Guglielmo, P., et al. Head-to-Head Comparison of FDG and Radiolabeled FAPI PET: A Systematic Review of the Literature. Life. 13 (9), 1821(2023).
- Ora, M., et al. Fibroblast Activation Protein Inhibitor-Based Radionuclide Therapies: Current Status and Future Directions. J Nucl Med. 64 (7), 1001-1008 (2023).
- Zhao, L., et al. Synthesis, Preclinical Evaluation, and a Pilot Clinical PET Imaging Study of FAPI Dimer. J Nucl Med. 63 (6), 862-868 (2022).
- Ferdinandus, J., et al. Initial clinical experience with radioligand therapy for advanced stage solid tumors: a case series of nine patients. J Nucl Med. 63 (5), 727-734 (2021).
- Rathke, H., et al. Two Tumors, One Target: Preliminary Experience With 90Y-FAPI Therapy in a Patient With Metastasized Breast and Colorectal Cancer. Clin Nucl Med. 46 (10), 842-844 (2021).
- Fendler, W. P., et al. Safety and Efficacy of 90Y-FAPI-46 Radioligand Therapy in Patients with Advanced Sarcoma and Other Cancer Entities. Clin Cancer Res. 28 (19), 4346-4353 (2022).
- Zboralski, D., et al. Preclinical evaluation of FAP-2286 for fibroblast activation protein targeted radionuclide imaging and therapy. Eur J Nucl Med Mol Imaging. 49 (11), 3651-3667 (2022).
- Pang, Y., et al. PET Imaging of Fibroblast Activation Protein in Various Types of Cancer Using 68Ga-FAP-2286: Comparison with 18F-FDG and 68Ga-FAPI-46 in a Single-Center, Prospective Study. J Nucl Med. 64 (3), 386-394 (2023).
- Banihashemian, S. S., et al. [68Ga]Ga-FAP-2286, a novel promising theragnostic approach for PET/CT imaging in patients with various type of metastatic cancers. Eur J Nucl Med Mol Imaging. 51 (7), 1981-1988 (2024).
- Baum, R. P., et al. Feasibility, Biodistribution, and Preliminary Dosimetry in Peptide-Targeted Radionuclide Therapy of Diverse Adenocarcinomas Using 177Lu-FAP-2286: First-in-Humans Results. J Nucl Med. 63 (3), 415-423 (2022).
- Loktev, A., et al. Development of Fibroblast Activation Protein-Targeted Radiotracers with Improved Tumor Retention. J Nucl Med. 60 (10), 1421-1429 (2019).
- Banihashemian, S. S., et al. The complete metabolic/molecular response to chemotherapy combined with [177Lu]Lu-FAP-2286 in metastatic breast cancer. Eur J Nucl Med Mol Imaging. 51 (13), 4185-4187 (2024).
- Rao, Z., Zhang, Y., Liu, L., Wang, M., Zhang, C. [177Lu]Lu-FAP-2286 therapy in a case of right lung squamous cell carcinoma with systemic metastases. Eur J Nucl Med Mol Imaging. 50 (4), 1266-1267 (2023).
- Yang, H., Liu, H., Zhang, Y., Zhang, Y., Chen, Y. Metastatic Lung Adenocarcinoma Received Combined 177Lu-FAP-2286 Radiation Therapy and Targeted Therapy. Clin Nucl Med. 49 (6), 569-571 (2024).
- Wan, Z., Wang, W., Chen, Y., Zheng, W., Huang, Z. 177Lu-FAP-2286 Therapy in a Patient With Metastatic Rhabdoid Meningioma. Clin Nucl Med. 49 (9), 879-881 (2024).
- Yang, H., Liu, H., Li, H., Zhang, Y., Chen, Y. 177Lu-FAP-2286 Therapy in a Metastatic Bone Malignant Solitary Fibrous Tumor. Clin Nucl Med. 49 (5), 472-474 (2024).
- Li, L., Yang, J., Peng, D., Zhang, Y., Chen, Y. 177 Lu-FAP-2286 Therapy in a Case of Recurrent Bladder Cancer With Multiple Metastatic Lesions. Clin Nucl Med. 48 (11), 1012-1014 (2023).
- Compounds comprising a fibroblast activation protein ligand and use thereof. US Patent. , US20230212549A1 https://patents.google.com/patent/US20230212549A1/en (2023).
- Jakobsson, V., et al. First-in-human study of a novel radiolabeled fibroblast activating protein (FAP)-targeted peptide 68Ga-FAP-3BP-3940 for PET/CT imaging in patients with solid tumors. J Nucl Med. 64 (supplement 1), P1615-P1615 (2023).
- Greifenstein, L., et al. 3BP-3940, a highly potent FAP-targeting peptide for theranostics - production, validation and first in human experience with Ga-68 and Lu-177. iScience. 26 (12), 108541(2023).
- Baum, R. P., et al. FAP-Targeted Radiopeptide Therapy using 177Lu-, 225Ac- and 90Y-labeled 3BP-3940 in Diverse Advanced Solid Tumors: First-in-Humans Results (Abstract P1612). J Nucl Med. 64 (supplement 1), P1612-P1612 (2023).
- Meisenheimer, M., Kürpig, S., Essler, M., Eppard, E. Manual vs automated 68Ga-radiolabelling-A comparison of optimized processes. J Labelled Comp Radiopharma. 63 (4), 162-173 (2020).
- Kleynhans, J., et al. Production of [68Ga]Ga-PSMA: Comparing a manual kit-based method with a module-based automated synthesis approach. J Labelled Comp Radiopharma. 63 (13), 553-563 (2020).
- le Roux, J., Rubow, S., Ebenhan, T. A comparison of labelling characteristics of manual and automated synthesis methods for gallium-68 labelled ubiquicidin. Appl Radiation Isotopes. 168, 109452(2021).
- Todde, S., et al. EANM guideline for the preparation of an Investigational Medicinal Product Dossier (IMPD). Eur J Nucl Med Mol Imaging. 41 (11), 2175-2185 (2014).
- Mueller, D., et al. Radiolabeling and Stability of FAP- Seeking Radiopharmaceuticals for Radio-Molecular Imaging and Therapy. J Nucl Med. 61 (supplement 1), 1129-1129 (2020).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract 2532). J Nucl Med. 63 (supplement 2), 2532-2532 (2022).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract P61). Nuklearmedizin. 62, P61(2023).
- Hörmann, A. A., et al. 68Ga]Ga-FAP-2286-Synthesis, Quality Control and Comparison with [18F]FDG PET/CT in a Patient with Suspected Cholangiocellular Carcinoma. Pharmaceuticals. 17 (9), 1141(2024).
- Lütje, S., et al. Optimization of Acquisition time of 68Ga-PSMA-Ligand PET/MRI in Patients with Local and Metastatic Prostate Cancer. PLoS One. 11 (10), e0164392(2016).
- Haendeler, M., et al. Biodistribution and Radiation Dosimetric Analysis of [68Ga]Ga-RM2: A Potent GRPR Antagonist in Prostate Carcinoma Patients. Radiation. 1 (1), 33-44 (2020).
- Daniel, T., Balouzet Ravinet, C., Clerc, J., Batista, R., Mouraeff, Y. Automated synthesis and quality control of [68Ga]Ga-PentixaFor using the Gaia/Luna Elysia-Raytest module for CXCR4 PET imaging. EJNMMI Radiopharm Chem. 8 (1), 4(2023).
- Rusu, T., et al. Fully automated radiolabeling of [68Ga]Ga-EMP100 targeting c-MET for PET-CT clinical imaging. EJNMMI Radiopharm Chem. 8 (1), 30(2023).
- Rubira, L., et al. 68Ga]Ga-FAPI-46 synthesis on a GAIA® module system: Thorough study of the automated radiolabeling reaction conditions. Appl Radiation Isotopes. 206, 111211(2024).
- Fouillet, J., et al. "One Method to Label Them All": A Single Fully Automated Protocolfor GMP-Compliant 68Ga Radiolabeling of PSMA-11, Transposable toPSMA-I&T and PSMA-617. Curr Radiopharm. 17 (3), 285-301 (2024).
- Nelson, B. J. B., Andersson, J. D., Wuest, F., Spreckelmeyer, S. Good practices for 68Ga radiopharmaceutical production. EJNMMI Radiopharm Chem. 7 (1), 27(2022).
- Rubira, L., Torchio, J., Fouillet, J., Vanney, J., Fersing, C. GMP-Compliant Automated Radiolabeling and Quality Controls of [68Ga]Ga-FAPI-46 for Fibroblast Activation Protein-Targeted PET Imaging in Clinical Settings. Chem Pharma Bullet. 72 (11), 1014-1023 (2024).
- Mueller, D., et al. Radiolabeling of DOTA-like conjugated peptides with generator-produced 68Ga and using NaCl-based cationic elution method. Nat Protoc. 11 (6), 1057-1066 (2016).
- Bauwens, M., Chekol, R., Vanbilloen, H., Bormans, G., Verbruggen, A. Optimal buffer choice of the radiosynthesis of 68Ga-Dotatoc for clinical application. Nucl Med Comm. 31 (8), 753-758 (2010).
- Kulprathipanja, S., Hnatowich, D. J. A method for determining the pH stability range of gallium radiopharmaceuticals. Int J Appl Radiation Isotopes. 28 (1-2), 229-233 (1977).
- Martins, A. F., et al. Spectroscopic, radiochemical, and theoretical studies of the Ga3+-N-2-hydroxyethyl piperazine-N'-2-ethanesulfonic acid (HEPES buffer) system: evidence for the formation of Ga3+ - HEPES complexes in (68) Ga labeling reactions. Contrast Media Mol Imaging. 8 (3), 265-273 (2013).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) PSMA-11 injection. Eur Pharma 11.0. 3044, 1276-1277 (2021).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) edotreotide injection. Eur Pharma 11.0. 2482, 1274-1276 (2022).
- Li, D., et al. Development of a fibroblast activation protein-targeted PET/NIR dual-modality probe and its application in head and neck cancer. Front Bioeng Biotechnol. 11, 1291824(2023).
- Koshkin, V. S., et al. Initial Experience with 68Ga-FAP-2286 PET Imaging in Patients with Urothelial Cancer. J Nucl Med. 65 (2), 199-205 (2024).
- De Blois, E., Sze Chan, H., Konijnenberg, M., De Zanger, R. A. P., Breeman, W. Effectiveness of Quenchers to Reduce Radiolysis of 111In- or 177Lu-Labelled Methionine-Containing Regulatory Peptides. Maintaining Radiochemical Purity as Measured by HPLC. Curr Topics Med Chem. 12 (23), 2677-2685 (2013).
- Larenkov, A., Mitrofanov, I., Pavlenko, E., Rakhimov, M. Radiolysis-Associated Decrease in Radiochemical Purity of 177Lu-Radiopharmaceuticals and Comparison of the Effectiveness of Selected Quenchers against This Process. Molecules. 28 (4), 1884(2023).
- Baudhuin, H., et al. 68Ga-Labeling: Laying the Foundation for an Anti-Radiolytic Formulation for NOTA-sdAb PET Tracers. Pharmaceuticals. 14 (5), 448(2021).
- Kaczorowska, K., Kolarska, Z., Mitka, K., Kowalski, P. Oxidation of sulfides to sulfoxides. Part 2: Oxidation by hydrogen peroxide. Tetrahedron. 61 (35), 8315-8327 (2005).
- Breeman, W. A. P., et al. Optimised labeling, preclinical and initial clinical aspects of CCK-2 receptor-targeting with 3 radiolabeled peptides. Nucl Med Biol. 35 (8), 839-849 (2008).
- Haskali, M. B. Automated preparation of clinical grade [68Ga]Ga-DOTA-CP04, a cholecystokinin-2 receptor agonist, using iPHASE MultiSyn synthesis platform. EJNMMI Radiopharm Chem. 4, 23(2019).
- Chen, J., et al. Synthesis, stabilization and formulation of [177Lu]Lu-AMBA, a systemic radiotherapeutic agent for Gastrin Releasing Peptide receptor positive tumors. Appl Radiation Isotopes. 66 (4), 497-505 (2008).
- Chatalic, K. L. S., et al. In Vivo Stabilization of a Gastrin-Releasing Peptide Receptor Antagonist Enhances PET Imaging and Radionuclide Therapy of Prostate Cancer in Preclinical Studies. Theranostics. 6 (1), 104-117 (2016).
- De Zanger, R. M. S., Chan, H. S., Breeman, W. A. P., De Blois, E. Maintaining radiochemical purity of [177Lu]Lu-DOTA-PSMA-617 for PRRT by reducing radiolysis. J Radioanal Nucl Chem. 321 (1), 285-291 (2019).
- Hörmann, A. A., et al. Automated Synthesis of 68Ga-Labeled DOTA-MGS8 and Preclinical Characterization of Cholecystokinin-2 Receptor Targeting. Molecules. 27 (6), 2034(2022).
- Breeman, W. A. P., Jong, M., Visser, T. J., Erion, J. L., Krenning, E. P. Optimising conditions for radiolabelling of DOTA-peptides with 90Y, 111In and 177Lu at high specific activities. Eur J Nucl Med Mol Imaging. 30 (6), 917-920 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados