Method Article
Préparation automatisée de [68Ga]Ga-3BP-3940 sur un module de synthèse pour l’imagerie TEP du microenvironnement tumoral
Dans cet article
Résumé
Cette recherche décrit le processus automatisé de production de [68Ga]Ga-3BP-3940 avec le synthétiseur GAIA V2, pour l’imagerie TEP de la protéine d’activation des fibroblastes. Les résultats des tests de contrôle de la qualité effectués sur trois lots d’essai sont également présentés.
Résumé
Une méthode rapide et efficace a été développée sur le module de synthèse GAIA pour le radiomarquage automatisé au gallium-68 de 3BP-3940, une sonde d’imagerie moléculaire ciblant la protéine d’activation des fibroblastes pour l’imagerie par tomographie par émission de positons du microenvironnement tumoral. Les conditions de réaction impliquaient un tampon d’acétate (concentration finale : 0,1 M), de la méthionine comme agent anti-radiolyse (concentration finale : 5,4 mg/mL) et 30 μg de 3BP-3940, avec chauffage pendant 8 min à 98 °C. Une dernière étape de purification sur une cartouche de C18 a été nécessaire pour obtenir un produit radiomarqué de haute pureté. En revanche, le 68Ga produit par générateur a été utilisé directement sans pas de concentration sur une cartouche d’échange cationique. La production de trois lots de validation a confirmé la fiabilité de la méthode, permettant la synthèse de [68Ga]Ga-3BP-3940 en 22,3 ± 0,6 min avec une pureté radiochimique élevée (RCP), déterminée à la fois par radio-HPLC (99,1 % ± 0,1 %) et par radio-CCM (99,2 % ± 0,1 %). Le rendement radiochimique moyen, basé sur les valeurs RCP mesurées par radio-HPLC, était de 74,4 % ± 3,3 %. La stabilité du produit radiomarqué a été démontrée jusqu’à 4 h après la préparation. Ce protocole fournit une méthodologie fiable, rapide et efficace pour la préparation de [68Ga]Ga-3BP-3940, qui peut facilement être transposée dans un cadre clinique.
Introduction
Ces dernières années, le ciblage du microenvironnement tumoral (TME) a suscité un intérêt considérable pour les applications diagnostiques et thérapeutiques1. L’abondance de types de cellules, de molécules de signalisation et de macromolécules de matrice extracellulaire (MEC) au sein du TME offre un large éventail de cibles moléculaires potentielles2. Parmi les cellules hôtes résidentes et infiltrantes, les fibroblastes associés au cancer (CAF) forment un sous-ensemble distinct de fibroblastes au sein du TME, phénotypiquement différent des fibroblastes normaux. Les CAF jouent un rôle crucial dans la progression tumorale, les métastases, l’évasion immunitaire et la résistance aux traitements grâce à des caractéristiques cellulaires et moléculaires uniques3. Ces cellules mésenchymateuses présentent un phénotype activé marqué par l’expression de la protéine d’activation des fibroblastes (FAP). Sur le plan moléculaire, les CAF sécrètent un ensemble complexe de cytokines, de chimiokines, de facteurs de croissance (par exemple, TGF-β, IL-6 et CXCL12) et de protéines ECM (par exemple, collagène, fibronectine), qui remodèlent l’ECM et favorisent un environnement pro-tumorigène4.
En tant que protéine très spécifique, surexprimée et localisée à la surface extracellulaire de la membrane CAF, la FAP présente toutes les caractéristiques d’une cible moléculaire fiable, en particulier pour les applications de médecine nucléaire et de radiopharmacie5. Dans ce contexte, des inhibiteurs de la PAF à base de quinoléine (FAPI), fonctionnalisés avec un groupe DOTA, ont été développés et rapidement introduits en utilisation clinique 6,7,8. Plus précisément, les gènes FAPI-04 et FAPI-46 radiomarqués avec du gallium-68 (émetteur β+, t1/2 = 68 min) pour l’imagerie par tomographie par émission de positons (TEP) ont démontré une valeur significative dans les maladies fibrotiques, la cardiologie et l’oncologie 8,9, en particulier pour les cancers où le [18F]fluorodésoxyglucose ([18F]FDG) a une utilité limitée10. Cependant, bien que leurs contributions à l’oncologie et à l’imagerie des maladies non malignes soient indéniables, les FAPI à petites molécules présentent certaines limites pour les applications de thérapie ciblée par radionucléides (TRT), notamment en raison de leur temps de séjour intratumoral sous-optimal, qui peut conduire à une irradiation involontaire de tissus sains11. Pour résoudre ce problème, plusieurs stratégies ont été explorées, telles que la conception de ligands multivalents 11,12 ou l’utilisation de radionucléides thérapeutiques à demi-vies courtes 13,14,15. De nouveaux échafaudages moléculaires avec une forte affinité pour la PAF et déclenchant une forte proportion d’internalisation cellulaire ont également été développés.
L’un d’eux est le dérivé pseudopeptidique FAP-2286. Il contient une séquence de 7 acides aminés, cyclisée et liée à un chélateur DOTA par un groupement 1,3,5-benzènetrimanethiol16. Une première étude chez l’homme a démontré que le [68Ga]Ga-FAP-2286 présente un profil de biodistribution similaire à celui du [68Ga]Ga-FAPI-46, avec une absorption physiologique légèrement plus élevée dans le foie, les reins et le cœur17. Dans cette étude, 64 patients, principalement atteints de cancers du cou, du foie, de l’estomac, du pancréas, des ovaires et de l’œsophage, ont subi une imagerie TEP avec [68Ga]Gap-FAP-2286 pour la stadification du cancer ou la détection de la récidive : l’absorption de [68Ga]Ga-FAP-2286 était nettement plus élevée que celle de [18F]FDG dans les tumeurs primaires, les métastases ganglionnaires et les métastases à distance, améliorant le contraste de l’image et la détectabilité des lésions. Toutes les tumeurs primaires étaient visibles avec la TEP/TDM [68Ga]Ga-FAP-2286, tandis que la TEP/TDM [18F]FDG manquait près de 20 % des lésions. Pour les ganglions lymphatiques impliqués, les taux de détection étaient plus élevés avec [68Ga]Ga-FAP-2286, ainsi que pour les métastases osseuses et viscérales. Une autre étude portant sur un groupe plus restreint de 21 patients atteints de diverses maladies cancéreuses a également démontré l’excellente sensibilité de cet agent d’imagerie, reflétant l’efficacité diagnostique de [68Ga]Ga-FAP-228618. Des études plus spécifiques se sont concentrées sur un seul type de cancer, comme le cancer urothélial ou le cancer du poumon, mettant en évidence une fois de plus le fort potentiel de [68Ga]Ga-FAP-2286 pour l’imagerie moléculaire clinique 4,5. En ce qui concerne le traitement, une étude préliminaire a examiné l’utilisation de FAP-2286 radiomarqué avec du lutécium-177 (émetteur β-, t1/2 = 6,7 j) chez 11 patients atteints de divers cancers métastatiques progressifs19. La plupart des patients ont reçu deux cycles de traitement espacés de 8 semaines, et la dose moyenne administrée par cycle était de 5,8 ± 2,0 GBq de [177Lu]Lu-FAP-2286. Le médicament a démontré une rétention intratumorale prolongée, avec une demi-vie efficace d’environ 44 h dans les métastases osseuses. Compte tenu des effets secondaires acceptables, ces résultats ont ouvert la voie à des essais cliniques à plus grande échelle : l’innocuité et l’efficacité du [177Lu]Lu-FAP-2286 sont actuellement évaluées dans le cadre de l’essai clinique de phase 1/2 LuMIERE, parrainé par Novartis (NCT04939610)7,8. D’autres protocoles de recherche à plus petite échelle sont documentés dans la littérature 9,20, et de multiples rapports de cas ont été publiés 21,22,23,24,25,26, démontrant l’efficacité et l’excellente tolérabilité de cette TRT.
Des modifications minimes de la structure du FAP-2286 ont conduit à l’optimisation de l’analogique 3BP-3940 (Figure 1)27. Bien que la littérature scientifique sur cette molécule vectorielle reste limitée, des études précoces ont été menées tant pour l’imagerie que pour des applications thérapeutiques. Un rapport préliminaire décrit l’utilisation du [68Ga]Ga-3BP-3940 chez 18 patients atteints de divers carcinomes métastatiques en phase terminale et conclut que ce produit radiopharmaceutique est un agent d’imagerie TEP approprié, en mettant l’accent sur son excellent rapport tumeur/bruit de fond et sa très faible absorption rénale28. Dans un autre travail, un seul patient atteint d’un cancer du pancréas présentant des métastases hépatiques a reçu 150 MBq de [68Ga]Ga-3BP-3940 pour l’imagerie TEP, ce qui a démontré une absorption intense dans la tumeur primitive et les lésions métastatiques29. Le même patient a par la suite reçu une dose unique de 9,7 GBq de [177Lu]Lu-3BP-3940 pour la TRT. Le traitement a été bien toléré, sans changement significatif des signes vitaux ou des paramètres biologiques. Une autre étude a présenté les premiers résultats chez l’homme d’une approche théranostique utilisant le 3BP-3940 : les patients ont été sélectionnés avec l’imagerie TEP [68Ga]Ga-3BP-3940, puis ont reçu du 3BP-3940 marqué avec différents isotopes (177Lu, 90Y ou 225Ac), administrés seuls ou en combinaison (par exemple, 177Lu + 225Ac) en 1 à 5 cycles de traitement30. Les critères de jugement comprenaient une rémission complète, quatre rémissions partielles, trois maladies stables et 12 progressions de la maladie. La survie globale médiane de la cohorte (n = 28) était de 9 mois à partir du début de la TRT.
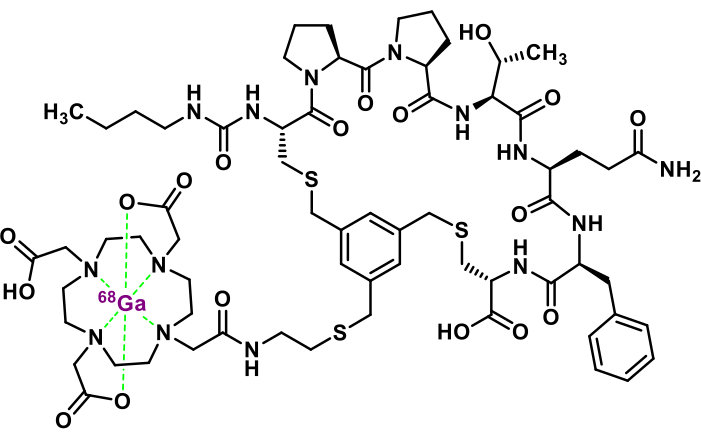
Figure 1 : Structure chimique du [68Ga]Ga-3BP-3940. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le processus de radiomarquage 68Ga pour les produits radiopharmaceutiques expérimentaux tels que le FAP-2286 et le 3BP-3940 implique généralement un module de synthèse pour automatiser l’étape de préparation. Notamment, l’automatisation des méthodes garantit la robustesse du processus et la conformité aux BPF et minimise l’exposition de l’opérateur aux rayonnements par rapport aux méthodes de préparation manuelles 31,32,33. Dans de nombreux cas, un tel protocole est attendu par les autorités réglementaires dans le cadre d’un dossier de médicament expérimental (DMPI) avant d’autoriser un centre à fabriquer le produit radiopharmaceutique expérimental correspondant34. À ce jour, très peu d’informations détaillées sur le radiomarquage automatisé 68Ga des pseudopeptides anti-FAP sont disponibles dans la littérature 29,35,36,37,38. De plus, les données rapportées ne s’appliquent généralement qu’à un modèle donné de synthétiseur. Le type de générateur de 68Ga utilisé peut également apporter certaines spécificités, car les différentes solutions disponibles dans le commerce sont caractérisées par des volumes spécifiques d’éluate de 68Ga3+ dans HCl (généralement 0,1 M), ce qui peut avoir un impact direct sur les conditions de radiomarquage automatisé.
Dans ce contexte, nous présentons un protocole détaillé pour le radiomarquage automatisé rapide et efficace du pseudopeptide 3BP-3940 avec 68Ga, à l’aide du module de synthèse GAIA V2. Ce synthétiseur repose sur l’utilisation d’un ensemble de tubes comprenant trois rampes de cinq collecteurs chacune, reliées à une pompe péristaltique pour contrôler l’écoulement du fluide. Il dispose également d’un four à flacons pour le chauffage du fluide réactionnel, de plusieurs sondes de radioactivité et d’un capteur de pression pour surveiller ces paramètres au sein du système. Bien qu’il ne soit pas aussi répandu que certains autres modèles, cet automate est utilisé régulièrement dans notre centre et est installé dans un nombre croissant d’installations 31,39,40,41,42,43,44. Un générateur GALLIAD 68Ge/68Ga a été utilisé dans ce travail sans prépurification de l’éluat 68Ga. Cette méthode est conçue pour offrir une solution robuste, rapide et pratique pour la production de [68Ga]Ga-3BP-3940, tout en optimisant la radioprotection des opérateurs lors du radiomarquage. Il s’agit également du premier protocole de préparation de ce radiopharmaceutique à être rapporté sur ce modèle de synthétiseur spécifique, et de manière aussi détaillée.
Protocole
REMARQUE : Ce protocole implique de travailler avec des radio-isotopes. Toute personne qui effectue cette procédure doit recevoir une formation adéquate sur la manipulation de matières radioactives non scellées et doit avoir l’approbation du responsable de la radioprotection de son établissement. Le synthétiseur automatisé doit être placé dans une cellule chaude blindée désignée. Toute procédure manuelle impliquant des matières radioactives doit également être effectuée dans une cellule chaude blindée ou derrière un blindage anti-rayonnement approprié.
1. Préparation des réactifs
REMARQUE : Les réactifs nécessaires à la production automatisée du [68Ga]Ga-3BP-3940 (voir le tableau des matières) ont été préparés dans une unité de préparation de produits radiopharmaceutiques (salle blanche BPF de classe C). Les réactifs peuvent être préparés dans n’importe quel ordre et jusqu’à 2 h avant la synthèse.
- Préparation de la solution tampon (acétate de sodium 0,8 M)
- Acquérir la matière première suivante : acétate de sodium trihydraté EMPROVE API Ph Eur, BP, JP, USP, FCC, E262.
- Dans un contenant stérile (p. ex., tube de microcentrifugation, 5 ml) correctement identifié, peser une masse exacte d’acétate de sodium trihydraté près de 544,32 mg à l’aide d’une balance de précision.
- À l’aide d’une micropipette calibrée et de cônes stériles, solubiliser l’acétate de sodium dans un volume d’eau pour injection (WFI) proche de 5 mL de sorte que le WFI soit tel que décrit ci-dessous.
Volume WFI = (masse tampon pesée x 5)/544,32 - Vortex la solution et passez-la dans un bain d’ultrasons (40 kHz, ~1 min) pour faciliter la solubilisation.
- À l’aide d’une seringue de 10 mL munie d’une aiguille 21G, prélever la solution tampon. Installez un filtre de 0,22 μm entre la seringue et une aiguille neuve, puis filtrez la solution tampon directement dans un flacon scellé stérile correctement identifié (p. ex., TC-ELU 5) après désinfection de son septum.
- Préparation d’une solution de composé anti-radiolyse (méthionine 10 mg/mL)
- Acquérir la matière première suivante : L-Méthionine (Ph. Eur., USP) pure, qualité pharmaceutique.
- Dans un contenant stérile (p. ex., tube de microcentrifugation de 5 ml) correctement identifié, peser une masse exacte de L-méthionine proche de 50 mg à l’aide d’une balance de précision.
- À l’aide d’une micropipette calibrée et de cônes stériles, solubiliser la L-méthionine dans un volume de WFI proche de 5 mL de sorte que la WFI soit conforme à la description ci-dessous.
Volume WFI = (masse tampon pondérée x 5)/50 - Vortex la solution et passez-la dans un bain d’ultrasons (40 kHz, ~1 min) pour faciliter la solubilisation.
- À l’aide d’une seringue de 10 mL munie d’une aiguille 21G, prélever la solution de méthionine. Installez un filtre de 0,22 μm entre la seringue et la nouvelle aiguille, puis filtrez la solution directement dans un flacon scellé stérile correctement identifié (p. ex., TC-ELU 5, Curium) après désinfection de son septum.
2. Préparation de l’équipement pour les contrôles de qualité
- Contrôle du pH du produit final
- Derrière un écran de protection approprié, placez une bande de papier pH pour le contrôle ultérieur du produit final.
- Contrôle de la pureté radiochimique par radio-TLC
- Préparez deux réservoirs de migration TLC contenant les phases mobiles appropriées. Phase mobile A : tampon citrate 0,1 M pH 4 dans l’eau, avec Rf = 0-0,2 attendu pour [68Ga]Ga-3BP-3940 et Rf = 0,8-1 pour 68Ga3+ libre. Phase mobile B : tampon d’acétate d’ammonium 1 M dans un mélange 1:1 d’eau et de méthanol (v/v), avec Rf = 0-0,2 attendu pour les colloïdes de [68Ga]gallium et Rf = 0,8-1 pour [68Ga]Ga-3BP-3940.
- Derrière un bouclier de protection approprié, positionnez les deux réservoirs de migration TLC à côté de deux plaques iTLC-SG pour un contrôle ultérieur du RCP du produit final.
- Allumez le radiochromatographe et ouvrez le logiciel d’acquisition correspondant sur l’ordinateur de commande. Saisissez à l’avance les informations d’identification pour la première analyse à effectuer.
- Contrôle de la pureté radiochimique par radio-HPLC
- Vérifiez que le modèle de colonne requis pour l’analyse (équivalence C18 ACE) est installé sur le système.
- Préparez la phase mobile fraîche pour la HPLC, c’est-à-dire de l’eau pour la HPLC + 0,1 % d’AGZ (solvant A) et de l’acétonitrile + 0,1 % d’AGT (solvant B). Connectez les flacons de solvant A et de solvant B aux lignes correspondantes sur la radio-HPLC.
- Allumez l’ordinateur de commande et connectez-vous au logiciel de contrôle.
- Si nécessaire, ouvrez la vanne de purge sur le module de pompe et purgez les conduites qui seront utilisées pour l’analyse (c’est-à-dire la ligne A et la ligne B). Fermez la vanne de purge après cette opération.
- Laisser le système s’équilibrer avec une proportion de solvant égale au début du gradient (c.-à-d. 95 % A/5 % B) avec un débit de 0,6 mL/min pendant au moins 20 min. Pour la séquence d’analyse HPLC [68Ga]Ga-3BP-3940, utilisez le débit maintenu à 0,6 mL/min et programmez le gradient de phase mobile de 0,1 % TFA dans l’eau (A) à 0,1 % TFA dans l’acétonitrile (B) comme suit : 0 - 1 min 95/5 A/B ; Pente linéaire de 1 à 8 min de 95/5 A/B à 60/40 A/B ; 8 à 9 min 60/40 A/B ; Pente linéaire de 9 à 10 min de 60/40 A/B à 95/5 A/B ; 10 à 12 min 95/5 A/B.
- Sélectionnez la méthode d’analyse avec le gradient de phase mobile décrit à l’étape 2.3.5., puis pré-entrez les informations d’identification pour la première analyse à effectuer.
- Dans un récipient blindé, préparez un flacon HPLC avec un insert en verre pour recevoir l’échantillon à analyser et positionnez-le derrière un écran de protection approprié.
3. Préparation du module de synthèse
- Allumez l’alimentation et la lumière de la cellule blindée. Allumez l’ordinateur portable contrôlant le synthétiseur et connectez-vous au logiciel du module.
- Si nécessaire, retirez l’ancien kit du synthétiseur et jetez les déchets dans les conteneurs appropriés.
- Effectuer le nettoyage de l’intérieur de l’armoire blindée abritant le module de synthèse et du synthétiseur lui-même conformément aux normes d’hygiène applicables.
- Sur le logiciel de synthétiseur, appuyez sur Utilisateur, puis sélectionnez un nom d’utilisateur et entrez le mot de passe associé dans la fenêtre contextuelle. Appuyez sur Méthode et sélectionnez le protocole automatisé précédemment configuré pour la synthèse de [68Ga]Ga-3BP-3940.
- Appuyez sur Préparation et saisissez le titre de la synthèse, le numéro de lot du vecteur, le numéro de lot du kit de réactifs et tout commentaire dans la zone de texte appropriée. Une liste de contrôle avec les différentes étapes de préparation du kit peut également être établie et suivie à ce stade (figure supplémentaire 1).
4. Préparation de la cassette de synthèse et installation de la cassette
- Nettoyez l’établi du laboratoire de radiopharmacie à l’aide d’une lingette et d’un détergent désinfectant approprié, puis placez un champ stérile sur l’établi.
- Procurez-vous une cassette d’étiquetage stérile de [68Ga]Ga (référence RT-01-H) et un kit de réactifs (Figure supplémentaire 2). Les 3 rampes de l’ensemble de tubes sont identifiées comme A, B et C de gauche à droite sur le module ; les collecteurs de chaque rampe sont numérotés de 1 à 5 de haut en bas (rampes A et C) ou de gauche à droite (rampe B).
- Assemblez la cassette en suivant les étapes ci-dessous.
- Déballez l’enveloppe de la cassette [68Ga]Ga, vérifiez qu’il n’y a pas de dommages et serrez chaque connexion Luer sur la cassette. Retirez tous les embouts de pointe.
- À l’aide d’une seringue Luer Lock de 5 ml et d’une aiguille 21G, prélevez 5 ml d’éthanol absolu du kit de réactifs et passez-le très lentement sur la cartouche C18 , puis prélevez 5 ml de WFI (non fourni dans le kit) et passez-le très lentement sur la même cartouche C18 pour le préconditionner.
- Positionnez la rampe A de la tubulure sur le module de synthèse et tournez les deux loquets pour maintenir la rampe en place. Connectez l’extrémité libre du tube vertical A1 à une aiguille 19G et insérez-la dans le flacon de déchets.
- Ajoutez une aiguille de ventilation dans le flacon de déchets et positionnez-le vers l’arrière, de manière optimale derrière le récipient blindé qui recevra le flacon d’évacuation. Placez un filtre de 0,22 μm en position A4.
- Connectez le tube horizontal A1 au capteur de pression en bas à gauche du panneau avant du module.
- À l’aide d’un adaptateur mâle/mâle, connectez en position A5 horizontale une rallonge de 30 cm terminée par un filtre terminal de 0,22 μ et une aiguille 20G de 80 mm.
- Insérez l’aiguille 20G mentionnée ci-dessus dans un flacon d’évacuation scellé et stérile (par exemple, TC-ELU 5), ajoutez une aiguille d’aération et placez le flacon d’évacuation dans son récipient blindé.
- Placez le câble de tuyauterie reliant la verticale A1 à la verticale C1 derrière les crochets de retenue au-dessus de la rampe B.
- Connectez les collecteurs horizontaux A2 et B1 avec une ligne d’extension courte (soit non incluse dans le kit, soit celle initialement connectée en position C5 horizontale), à l’aide de l’adaptateur déjà monté en position A2.
- Positionnez la rampe B sur le module de synthèse et tournez les deux loquets pour maintenir la rampe en place.
- Connectez la cartouche C18 préconditionnée à la position horizontale C2, en maintenant l’adaptateur reliant la vanne horizontale B5 à C2 sur sa gauche.
- Positionnez la rampe C sur le module de synthèse et tournez les deux loquets pour maintenir la rampe en place.
- À l’aide d’un adaptateur mâle/mâle, connectez une ligne d’extension de 50 cm de l’horizontale C5 au générateur GALLIAD 68Ga.
- Placez le flacon de réaction en vitrail du jeu de tubes dans le four du module. Placez soigneusement le tube de la verticale A5 à la verticale C5 dans la pompe péristaltique, fermez la pompe en vérifiant que le tube est correctement positionné et passez le tube à travers le capteur d’activité sur le côté gauche de la pompe.
- Effectuez une vérification intermédiaire pour vous assurer que la cassette et la tubulure sont assemblées sur le radiosynthétiseur, comme illustré à la figure 2, sans réactifs pour le moment.
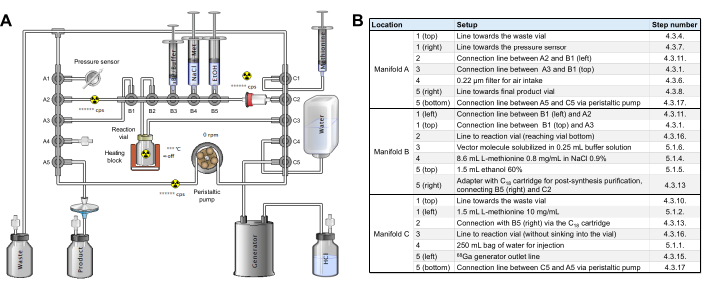
Figure 2 : Configuration du module de synthèse. (A) Configuration pour la synthèse automatisée de [68Ga]Ga-3BP-3940 sur le module de synthèse. (B) Détails sur les positions des réactifs pour la production automatisée de [68Ga]Ga-3BP-3940 à l’aide d’un module de synthèse GAIA. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Installation des réactifs
- Une fois les rampes installées sur le module, installez les réactifs comme décrit ci-dessous.
- Connectez le sac WFI de 250 ml du kit de réactifs au tube C4 à l’aide de l’adaptateur Spike, puis accrochez le sac au crochet dédié sur le côté droit du module.
- À l’aide d’une seringue Luer Lock en trois parties de 3 mL équipée d’une aiguille de 20 G, prélever 1,5 mL de la solution de L-méthionine à 10 mg/mL préparée précédemment, connecter la seringue à la tubulure horizontale C1 et suspendre la seringue dans la fente prévue à cet effet sur le côté droit du module. Laissez environ 2 ml d’air entre la surface du liquide et le joint du piston de la seringue pour assurer un transfert complet du liquide.
- À l’aide d’une seringue de 1 mL munie d’une aiguille de 20 G, prélever 750 μL de la solution de L-méthionine à 10 mg/mL préalablement préparée et injecter dans le flacon de NaCl à 0,9 % (sertissage bleu) de la trousse de réactifs, après désinfection du septum.
- À l’aide d’une seringue Luer Lock en trois parties de 10 ml avec une aiguille de 20 G, prélevez le contenu du flacon de NaCl + L-méthionine à 0,9 % (sertissage bleu), ajustez à 8,6 ml, retirez le Spike en position B4, puis connectez la seringue en B4 à la place. Laissez environ 2 ml d’air entre la surface du liquide et le joint du piston de la seringue pour assurer un transfert complet du liquide.
- À l’aide d’une seringue Luer Lock en trois parties de 3 mL munie d’une aiguille de 20 G, prélever le contenu de la fiole d’éthanol à 60 % (sertissage orange) après désinfection du septum. Vérifiez que le volume est au moins égal à 1,5 ml, retirez le Spike en position B5, puis connectez la seringue à B5 à la place. Laissez environ 2 ml d’air entre la surface du liquide et le joint du piston de la seringue pour assurer un transfert complet du liquide.
- À l’aide d’une seringue de 1 mL à faible volume mort munie d’une aiguille de 20 G, prélever 0,25 mL de la solution tampon d’acétate de sodium 0,8 M préalablement préparée et l’injecter dans le flacon contenant 30 g de 3BP-3940 pour le solubiliser par cycles successifs d’injections et de réaspirations. Prélever la solution de 0,25 mL dans la même seringue, débrancher l’aiguille et placer le tampon + seringue vectorielle dans B3. Laissez environ 0,25 mL d’air entre la surface du liquide et le piston de la seringue pour assurer un transfert complet du liquide.
- Effectuez une dernière vérification avant le début de la synthèse comme décrit ci-dessous.
- Vérifiez que tous les réactifs sont connectés à la cassette ou à la tubulure, comme illustré à la Figure 3.
- Assurez-vous que chacune des connexions du kit est suffisamment serrée. Assurez-vous qu’aucun tube n’est pincé ou incliné.
- Le système est prêt. Fermez le panneau avant et activez la ventilation de la cellule blindée.

Figure 3 : configuration du kit. Installation finale du jeu de tubes et des réactifs sur le synthétiseur pour le radiomarquage du 3BP-3940 avec 68Ga. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Séquence de radiomarquage automatisée pour la production de [68Ga]Ga-3BP-3940
- Cliquez sur Exécuter la synthèse lorsque tous les réactifs sont placés sur les rampes et que toutes les informations sont correctement enregistrées dans le logiciel.
- Un profil typique de la distribution de la radioactivité dans le jeu de tubes tout au long de la séquence de synthèse est illustré dans Graphique 4. Suivez les étapes successives de la méthode automatisée de préparation [68Ga]Ga-3BP-3940 comme décrit ci-dessous.
- Tests d’intégrité du kit : après une brève purge de la tubulure vers la fiole de déchets (essentiellement pour éliminer tout liquide restant dans la cartouche C18 ), le système augmente sa pression interne en ouvrant A4 et en pompant de l’air filtré via la pompe péristaltique. Dès que le capteur de pression connecté à A1 détecte une pression de tube > 1500 mbar, le système se ferme et la pompe péristaltique s’arrête. Si la perte de charge ne dépasse pas 400 mbar sur 15 s, évaluer le succès du test d’intégrité du kit et commencer la synthèse. Si le test échoue, suspectez une fuite du système et interrompez la séquence de synthèse.
- Ajout du vecteur au flacon de réaction : S’assurer que le 3BP-3940 solubilisé dans la solution tampon est aspiré dans le flacon de réaction en 30 s environ, à travers le collecteur B2.
- Ajout de L-méthionine dans le flacon réactionnel : S’assurer que la solution de méthionine contenue dans la seringue en C1 est transférée dans le flacon réactionnel via le collecteur B2, la rampe C descendante, puis la rampe A pour se ramifier sur la rampe B par le collecteur A2.
- Activation de la cartouche C18 avec WFI : S’assurer que le WFI contenu dans le sac en C4 est passé sur la cartouche C18 , en rinçant également les rampes A, B et C sur les chemins suivis par les solutions vectorielles et méthionine. Les mêmes voies sont ensuite rincées à l’air filtré pour s’assurer qu’il ne reste pas d’eau dans le tube pour les étapes suivantes.
- Élution du générateur dans le flacon réactionnel (intervention manuelle) : Pour éluer le générateur GALLIAD, tournez le bouton vert situé sur le dessus du générateur à 90° jusqu’à la position de chargement avant d’attendre 10-20 s : ce temps permet au générateur de préparer un volume d’éluat fixe de 1,1 mL. Remettez le bouton vert dans sa position initiale et cliquez sur le prompteur du logiciel de contrôle. La pompe péristaltique aspire ensuite l’éluat de 68Ga dans le flacon de réaction sur une période de 3 minutes. Sur cet intervalle de temps, la température du flacon de réaction est progressivement portée à 60 °C pendant 1 min, puis à 90 °C pendant 2 min, pour atteindre plus rapidement la température de consigne pour l’étape de radiomarquage.
- Radiomarquage : vérifiez qu’au début de l’étape de radiomarquage, une température de consigne de 120 °C est appliquée pendant 30 s pour permettre un chauffage rapide et efficace. Vérifiez que la température de consigne est ensuite réglée à 98 °C pendant 2 min. En raison de l’échauffement et de l’augmentation de la pression dans le flacon de réaction, une partie du fluide réactionnel a tendance à remonter dans le tube relié à B2. Pour limiter cela, une purge de ligne de 10 secondes est réglée après 2 min de chauffage ; Ensuite, le radiomarquage se poursuit pendant environ 5,5 min.
- Piégeage sur cartouche C18 : Assurez-vous que l’air filtré est pompé dans la cuve de réaction par C3. La pression exercée à la surface du liquide permet au fluide réactionnel de s’écouler vers le haut à travers le tube relié en B2 puis à la cartouche SPE. Le flacon de réaction est ensuite rincé avec du WFI à partir du sac en C4, et ce liquide de rinçage est transféré dans la cartouche SPE de la même manière. La cartouche est finalement rincée avec du WFI frais et rincée à l’air filtré.
- Élution de la cartouche C18 et formulation (ajout de NaCl 0,9 % + L-méthionine) : La cartouche SPE retient initialement le produit radiomarqué et les éventuels colloïdes de gallium et laisse passer libre 68Ga3+ . Pour éluer la cartouche et récupérer le [68Ga]Ga-3BP-3940 dans le flacon terminal, assurez-vous que des fractions successives d’éthanol à 60 % et de méthionine ~0,9 mg/mL dans du NaCl à 0,9 % (3 x 0,5 mL chacune) sont aspirées sur la cartouche pour l’élution. L’ensemble du contenu de la seringue en B4 est ensuite passé à travers la cartouche C18 dans une étape de formulation pour atteindre une concentration finale d’éthanol de <10 % dans le flacon terminal.
- Test d’intégrité du filtre (intervention manuelle) : Après la synthèse et le retrait du flacon terminal, suivez l’invite qui demande de connecter le filtre terminal au flacon de déchets et de retirer le filtre de ventilation du flacon de déchets afin de vérifier l’intégrité du filtre terminal à l’aide d’un test de point de bulle. Lors du test du point de bulle, le filtre est d’abord mouillé par WFI pendant 30 s. Après la purge des conduites, la pression dans le système est lentement augmentée jusqu’à >2500 mbar pendant <2 min, au cours de laquelle le synthétiseur vérifie qu’il n’y a pas d’augmentation de pression à la sortie du filtre. Ensuite, le système augmente lentement la pression pour vérifier le point de bulle. Le synthétiseur enregistrera enfin la pression lorsque la pression augmente à la sortie du filtre pour déterminer la pression du point de bulle.
- À la fin de la synthèse, le logiciel de l’automate génère un rapport de synthèse décrivant le déroulement du radiomarquage et le suivi des températures dans le flacon de réaction, des pressions dans le système et des quantités de radioactivité impliquées (Figure 4). En complément, calculez manuellement le rendement radiochimique corrigé de la décroissance (RCY) selon la formule :
RCY =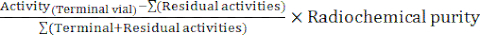
les activités résiduelles décrivant les activités restantes dans le flacon de réaction, sur la cartouche C18 et dans le flacon de déchets à la fin de la synthèse.

Figure 4 : Profil de distribution typique de la radioactivité à l’intérieur du module. (A) flacon de réaction ; (B) Cartouche C18 pendant la synthèse de [68Ga]Ga-3BP-3940. L’écoulement de l’éluat de 68Ga dans le flacon de réaction se produit à 6 min. L’activité reste dans le flacon de réaction tout au long de la réaction de radiomarquage. Après 16 min, l’activité est transférée à la cartouche SPE. La cartouche est éluée au bout de 19,5 min, après quoi une activité résiduelle d’environ 150 MBq reste sur la phase stationnaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
7. Distribution et contrôles de qualité de [68Ga]Ga-3BP-3940
- Transférez le flacon terminal dans une cellule blindée appropriée pour la mesure de la radioactivité et la préparation de la dose au patient.
- Mesurez l’activité du flacon terminal à l’aide d’un calibrateur de dose correctement calibré et enregistrez la préparation sur l’ordinateur.
- Identifiez correctement le flacon et placez-le dans un récipient blindé approprié. À l’aide de techniques d’asepsie et de radioprotection appropriées, prélever un échantillon de ~0,5 mL du flacon terminal pour les contrôles de qualité.
- Évaluez l’apparence de la préparation par inspection visuelle. Évaluer le pH de la préparation en déposant une goutte de solution de produit sur la bande de papier pH.
- Mesurez la pureté radiochimique par radio-TLC en déposant une goutte de solution de produit sur chacune des deux plaques iTLC-SG préalablement préparées. Ensuite, laissez les plaques migrer dans les phases mobiles correspondantes et lues par le radiochromatographe. Intégrez le radiochromatogramme résultant en mesurant l’aire sous la courbe du signal du produit et du signal d’impureté, puis calculez la pureté radiochimique selon la formule :
RCP ( %) = 100 - %d’impuretés AUC 1 - %d’impuretés AUC 2 - Mesurer la pureté radiochimique par radio-HPLC en injectant ~50 μL de la préparation dans le flacon HPLC préparé au préalable (voir étape 2.3.7). Positionnez le flacon dans l’échantillonneur automatique HPLC à la position requise et démarrez la séquence d’analyse. Une fois l’échantillon injecté dans le système, retirez le flacon de l’échantillonneur automatique et replacez-le dans son contenant blindé pour minimiser l’irradiation. A la fin de l’analyse, intégrez le radiochromatogramme obtenu en mesurant l’aire sous la courbe du signal du produit et des signaux d’impuretés, puis calculez la pureté radiochimique selon la formule :
RCP ( %) = 100 - Σ( %d’impuretés de l’AUC) - Vérifiez la demi-vie (compteur gamma) du radio-isotope contenu dans la préparation en ajoutant ~5 μL de préparation dans un tube compteur gamma contenant 1 mL de WFI. Comptez le tube avec le compteur gamma 10x consécutivement (en comptant 1 min chacun). Calculez la demi-vie en fonction de la désintégration radioactive observée au cours des 10 mesures.
- Effectuer l’analyse d’identité radionucléidique sur le même échantillon que l’analyse de demi-vie en effectuant une analyse par spectrométrie gamma à l’aide du compteur gamma, en recherchant les pics de 511 keV et 1077 keV à partir des photons d’annihilation.
- Évaluer la pureté radionucléidique après une période de désintégration de 48 heures de l’échantillon précédent. Effectuer une mesure de 120 min dans le compteur gamma, permettant de détecter toute activité résiduelle de 68Ga formée in situ à partir de la percée de 68Ge et d’autres impuretés radionucléides à longue demi-vie.
8. Stabilité de la préparation du [68Ga]Ga-3BP-3940
- Évaluez la stabilité de trois lots d’essai au fil du temps. À cette fin, prélever environ 200 μL de préparation du flacon terminal toutes les heures immédiatement après l’EoS et jusqu’à 4 h après la synthèse.
- Effectuez une analyse radio-HPLC à chaque point temporel pour mesurer le RCP par HPLC selon la procédure décrite ci-dessus. Effectuer des analyses Radio-CCM à chaque point temporel pour mesurer la RCP par CCM selon la procédure décrite précédemment.
Résultats
Le processus de synthèse développé sur le module GAIA permet un radiomarquage rapide 68Ga du 3BP-3940 en 21-22 min. Ce protocole a été conçu pour fonctionner avec le générateur GALLIAD de 68Ge/68Ga de qualité pharmaceutique, qui produit 1,1 mL d’éluat de 68Ga dans 0,1 M HCl. Le volume et la molarité du tampon réactionnel ont été finement ajustés en fonction de cette quantité d’acide pour obtenir un pH de réaction compris entre 3,5 et 4, nécessaire pour un radiomarquage optimal45. Ainsi, on a utilisé de l’acétate de sodium avec une molarité finale de 0,1 M. De la méthionine à 10 mg/mL a été ajoutée au milieu réactionnel en tant qu’agent anti-radiolyse pour limiter la dégradation de la molécule vectrice lors de l’étape de chauffage. Des tests préliminaires sans purification terminale ont comparé cet antioxydant à l’acide gentisique 16 mg/mL et à l’acide ascorbique 12 mg/mL et ont montré une meilleure RCP finale avec la méthionine qu’avec l’un ou l’autre de ces deux autres composés (Figure 5).
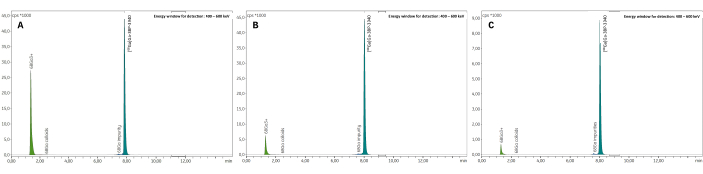
Figure 5 : Radiochromatogrammes HPLC de milieux réactionnels bruts issus d’expériences préliminaires comparant des composés anti-radiolyse. (A) Acide gentisique 16 mg/mL (RCP = 75,5 %) ; (B) Acide ascorbique 12 mg/mL (RCP = 86,4 %) ; (C) Méthionine 10 mg/mL (RCP = 94,7 %). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Pour valider cette méthode de radiomarquage automatisé, trois lots d’essai ont été produits, aboutissant à des préparations avec une activité finale moyenne de 737 ± 2,8 MBq (générateur à +2 semaines après étalonnage). Il convient de noter que les pertes d’activité dans le système de kits à usage unique pendant la synthèse ont été faibles, avec une moyenne de 24,9 % ± 3,4 % sur les trois productions d’essai (figure 6), ce qui démontre l’efficacité du procédé.
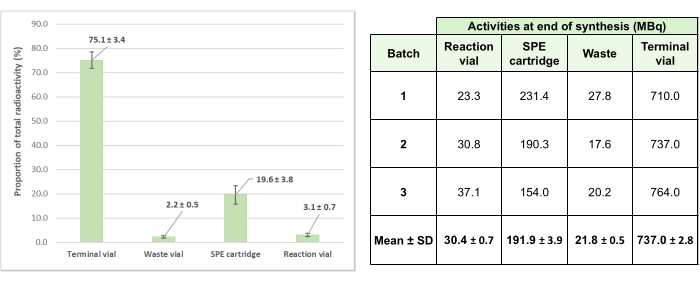
Figure 6 : Répartition des activités résiduelles moyennes pour les trois lots de validation de [68Ga]Ga-3BP-3940. La proportion moyenne de l’activité totale impliquée dans les 3 opérations de radiomarquage d’essai et trouvée dans les différents éléments du système est détaillée sous forme de diagramme, et les valeurs d’activité absolues correspondantes pour chaque synthèse d’essai sont fournies sous forme de tableau. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les trois lots de validation ont réussi tous les contrôles de qualité, y compris l’identification des radionucléides (tableau supplémentaire 1), la demi-vie calculée (tableau supplémentaire 2) et la pureté des radionucléides (tableau supplémentaire 3). En particulier, d’excellentes valeurs RCP ont été obtenues à la fois dans la radio-CCM (RCP moyenne = 99,19 ± 0,07 %; %CV = 0,07) (tableau supplémentaire 4) et la radio-HPLC (RCP moyenne = 99,19 ± 0,07 %; %CV = 0,07 ; Figure 7, tableau supplémentaire 5). La reproductibilité des valeurs RCP est excellente et pourrait être confirmée par les résultats de futures synthèses. De plus, les valeurs RCP des trois lots d’essai ont montré une grande stabilité dans le temps, à la fois dans la radio-CCM et la radio-HPLC, avec des valeurs constantes >98 % jusqu’à 4 h après l’EoS (Figure 8, Tableau supplémentaire 6). Les résultats complets des analyses effectuées sur ces échantillons sont compilés dans le tableau 1. Dans l’ensemble, la méthode de radiomarquage automatisé 68Ga du 3BP-3940 a été validée avec une moyenne de 74,4 % ± 3,3 % de RCY corrigée de la décroissance (calculée à partir du RCP en HPLC). Avec l’utilisation d’un vecteur de qualité pharmaceutique, cette méthode pourrait être transposée telle quelle à un usage clinique.
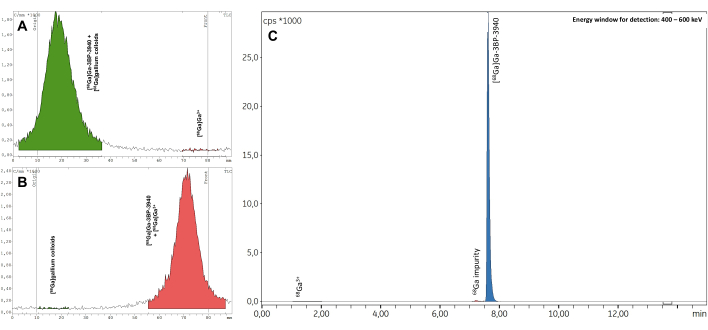
Figure 7 : Radio-TLC représentatif. Il en résulte (A) un tampon de citrate de 0,1 M pH 4 et (B) de l’acétate d’ammonium 1 M dans de l’eau 1:1/méthanol. (C) Spectres radio-HPLC représentatifs obtenus lors de la mesure du RCP de [68Ga]Ga-3BP-3940. Veuillez cliquer ici pour voir une version agrandie de cette figure.
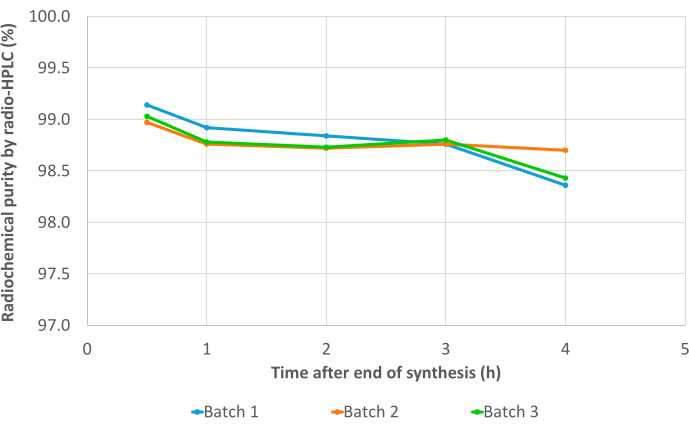
Figure 8 : Résultats de stabilité. Pureté radiochimique des trois lots de validation de [68Ga]Ga-3BP3940 dans le temps, de l’EoS à 4 h après la synthèse, déterminée par radio-HPLC. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Test | Lot 1 | Lot 2 | Lot 3 | |
| Apparence | Solution claire et incolore | Solution claire et incolore | Solution claire et incolore | |
| Identification | ||||
| Énergie des photons gamma (MeV) | 0,511 et 1,077 | 0,511 et 1,077 | 0,511 et 1,077 | |
| Demi-vie (min) | 69,94 ± 1,03 | 69,34 ± 0,66 | 68,66 ± 0,28 | |
| pH | 6 | 6 | 6 | |
| Pureté radionucléidique | ||||
| (calibre 68) Gallium ( %) | 99.9999861 | 99.9999861 | 99.9985764 | |
| (68Ge) Germanium et autres impuretés émettrices de γ ( %) | 1.39 × 10-5 | 5.47 × 10-6 | 1,42 × 10-3 | |
| Pureté radiochimique | ||||
| [Calibre 68]Ga-3BP-3940 (HPLC) | 99.14 | 98.97 | 99.03 | |
| [68Impuretés de ga]gallium (HPLC) | 0.76 | 1.03 | 0.97 | |
| [Calibre 68]Ga-3BP-3940 (TLC) | 99.2 | 99.25 | 99.11 | |
| [68Impuretés de ga]gallium (TLC) | 0.8 | 0.75 | 0.89 | |
| Test d’intégrité du filtre (mbar) | 4046 | 4082 | 3901 | |
| Activité volumique à l’EoS (MBq/mL)* | 69.27 | 71.9 | 74.54 | |
| Activité spécifique à l’EoS (MBq/μg) | 23.46 | 24.31 | 25.22 | |
| Activité molaire à l’EoS (GBq/μmol) | 34.53 | 35.78 | 37.12 | |
| Rendement radiochimique (basé sur le RCP déterminé par HPLC) | 70.93 | 74.75 | 77.58 | |
| Stabilité sur 4 h (HPLC) | ≥98,36 % | ≥98,70 % | ≥98,43 % | |
| *Calculé avec un volume théorique total de 10,25 mL | ||||
Tableau 1 : Résultats du contrôle de la qualité du réseau pour trois lots d’essai de [68Ga]Ga-3BP-3940.
Figure supplémentaire 1 : Fournitures pour la configuration du module de synthèse. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Liste de contrôle pour l’installation du kit sur le module de synthèse. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3 : Protocole de synthèse automatisé alternatif avec cartouche SCX. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 1 : Identification des radionucléides pour les 3 lots d’essai de [68Ga]Ga-3BP-3940. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 2 : Demi-vie calculée pour les 3 lots d’essai de [68Ga]Ga-3BP-3940. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 3 : Pureté des radionucléides pour les 3 lots d’essai de [68Ga]Ga-3BP-3940. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 4 : Pureté radiochimique déterminée par radio-CCM pour les 3 lots d’essai de [68Ga]Ga-3BP-3940. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 5 : Pureté radiochimique déterminée par radio-HPLC pour les 3 lots d’essai de [68Ga]Ga-3BP-3940. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 6 : Stabilité radiochimique sur 4 h déterminée par radio-CCM pour les 3 lots d’essai de [68Ga]Ga-3BP-3940. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Ce travail présente un protocole de préparation automatisé conforme aux BPF pour la synthèse de [68Ga]Ga-3BP-3940 à l’aide d’un module GAIA et d’un générateur GALLIAD. Cette méthode a été adaptée des protocoles utilisés dans notre centre pour le radiomarquage au gallium-68 de vecteurs tels que les ligands PSMA44 et d’autres inhibiteurs de la FAP 43,46 pour l’imagerie TEP clinique, avec de légères modifications.
Le processus de production a été conçu pour être simple et direct et peut être divisé en trois phases principales : (i) le transfert de tous les réactifs dans le flacon de réaction, (ii) le radiomarquage du 3BP-3940 avec 68Ga, et (iii) la purification et la formulation du produit. Il est important de noter que l’une des grandes forces de cette méthode automatisée est sa courte durée, les trois lots de test étant produits en 22,3 ± 0,6 min (temps de test d’intégrité du filtre non inclus). En comparaison, Hörmann et al., qui ont rapporté la synthèse automatisée de [68Ga]Ga-FAP-2286 sur un module GRP-3V, ont souligné un temps de synthèse de 35 min38.
Pour garantir un produit radiomarqué à haute activité spécifique, seulement 30 μg de 3BP-3940 ont été utilisés dans la réaction, ce qui a entraîné une activité spécifique moyenne de 24,3 ± 0,9 MBq/μg à l’EoS pour les trois lots d’essai. En comparaison, les activités spécifiques moyennes rapportées dans la littérature varient de 6,9 MBq/μg38 à 19,7 MBq/μg29. La seule exception est le protocole de préparation du [68Ga]Ga-FAP-2286 décrit par Pang et al., qui utilise 25 μg de vecteur, ce qui donne une activité spécifique estimée à 40,7 MBq/μg (non corrigée pour la décomposition pendant le temps de synthèse)17.
Plusieurs protocoles automatisés dans la littérature incluent une première étape d’enrichissement et de purification de l’éluat de gallium-68 sur une cartouche d’échange de cations forts (SCX) afin de contrôler le volume de 68Ga dans une solution acide ajoutée au milieu réactionnel47. Pour raccourcir le temps de préparation et compte tenu de la qualité pharmaceutique du générateur GALLIAD 68Ga, nous avons décidé de ne pas respecter cette étape ; par conséquent, le protocole décrit ici est compatible avec le radiomarquage impliquant ~1,1 mL d’éluat de 68Ga dans 0,1 M HCl.
Le type et la molarité du tampon réactionnel sont des paramètres cruciaux pour optimiser les réactions de radiomarquage 68Ga48. Le défi consiste à maintenir un pH d’environ 3,6 pour faciliter la chélation du radiométal par le chélateur DOTA tout en minimisant la formation d’hydroxydes de galliuminsolubles 49. L’acétate de sodium, à une concentration finale de 0,07 M dans le milieu réactionnel, a été retenu en raison de ses excellentes performances de radiomarquage d’autres vecteurs dans notre pratique46. De manière constante, il a démontré une grande efficacité dans le radiomarquage du [68Ga]Ga-3BP-3940 dans cette étude. De plus, ce tampon est le plus fréquemment signalé dans la littérature pour le radiomarquage 68Ga de pseudopeptides ciblant la FAP, bien qu’il soit généralement utilisé à des molarités plus élevées (0,25 M à 1 M)17,19,29,35,36. Un seul article mentionne l’utilisation de l’acide 4-(2-hydroxyéthyl)pipérazine-1-éthanesulfonique (HEPES) comme tampon de réaction38. Ses faibles propriétés de complexation des métaux font de HEPES un composé très approprié pour contrôler le pH des réactions de radiomarquage de 68Ga50. Cependant, les contraintes réglementaires sur ce composé nécessitent des tests supplémentaires pour déterminer ses quantités résiduelles dans la préparation radiopharmaceutique finale, ce qui entraîne des délais supplémentaires entre la fin de la synthèse et l’utilisation du produit51,52.
Les réglages de température rapportés pour la préparation de pseudopeptides inhibiteurs de la FAP marqués au Ga 68varient considérablement dans la littérature. Dans les travaux préliminaires et dans l’article scientifique correspondant29,36, l’équipe de Richard Baum a observé une augmentation de la formation de sous-produits lorsque des réactions de radiomarquage ont été menées à des températures supérieures à 90 °C. Dans ce contexte, l’abaissement de la température de chauffage est apparu comme une stratégie efficace pour minimiser la formation de produits de dégradation. Il convient de noter qu’aucun composé antioxydant n’a été ajouté au mélange réactionnel dans ces conditions. Néanmoins, les conditions les plus fréquemment rapportées dans la littérature incluent donc le chauffage à 85 °C pendant 15 min. Des températures de chauffage encore plus basses peuvent être trouvées, avec les conditions de radiomarquage 68Ga d’un analogue proche de 3BP-3940, en plus fonctionnalisées avec un groupe fluorescent, impliquant un chauffage à 80 °C pendant 15 min53. À l’inverse, deux protocoles de préparation automatisée du [68Ga]Ga-FAP-2286 mentionnaient une température de chauffage de 120 °C pendant 10 min54et de 125 °C pendant 6 min38, respectivement, mais entraînant l’apparition de sous-produits pour le second. Nous avons donc opté pour une température intermédiaire, chauffant à 98 °C pendant 8 min, similaire à certains procédés publiés19,35. Sur la base du RCP des trois lots d’essai, le chauffage dans ces conditions en présence d’un antioxydant ne semble pas entraîner la formation significative de produits de radiolyse lors de l’étiquetage.
Même s’il n’est pas utilisé systématiquement, l’ajout d’un composé antioxydant au milieu réactionnel peut améliorer le résultat du radiomarquage en atteignant un RCP43 plus élevé. Dans la formulation radiopharmaceutique finale, un composé antioxydant peut limiter les phénomènes de radiolyse et améliorer la stabilité du radiocomplexe dans le temps 55,56,57. Dans le cas depseudopeptides DOTA marqués au Ga et ciblant la FAP, certaines études ont suggéré une efficacité insuffisante de l’acide ascorbique (10 mg ou 50 mg dans un volume de réaction de ~2,6 mL) pour prévenir la formation de sous-produits de radiolyse38. Il est intéressant de noter que des essais de dégradation forcée en présence de peroxyde d’hydrogène ont montré une augmentation de la proportion de ces impuretés, suggérant des produits d’oxydation, probablement formés par la transformation d’un ou plusieurs groupes sulfures du pseudopeptide en sulfoxydes et/ou sulfones58. Cela souligne l’importance des antioxydants dans le milieu réactionnel pour le radiomarquage du 3BP-3940 et des molécules apparentées. Dans le présent travail, des essais préliminaires (voir Figure 5) ont identifié la méthionine comme un composé idéal pour cet objectif spécifique. En poursuivant l’hypothèse ci-dessus, il est possible que, dans des conditions oxydantes, les dérivés du sulfone et/ou du sulfoxyde soient formés préférentiellement avec la méthionine, préservant ainsi efficacement l’intégrité des fonctions sulfures dans 3BP-3940. En plus de son utilisation dans les protocoles automatisés de radiomarquage 68Ga de divers autres vecteurs marqués avec 68Ga59,60 ou 177Lu 56,61,62,63, la méthionine est signalée à juste titre comme étant utilisée dans la préparation de [68Ga]Ga-3BP-3940 35 et [68Ga]Ga-FAP-228619, en association avec l’acide ascorbique. Notamment, dans ce protocole, le volume et la concentration de chaque réactif (tampon et antioxydant) ont été sélectionnés pour obtenir le pH de réaction optimal sans nécessiter d’ajustement préalable avec du HCl concentré, comme décrit dans certaines méthodes 47,48,64. Encore une fois, un contrôle précis du pH de la réaction est un paramètre clé pour un radiomarquage réussi au gallium 68.
L’étape finale de purification par extraction en phase solide est nécessaire pour éliminer les traces de 68Ga3+ libres qui n’ont pas été complexées avec le 3BP-3940. La cartouche C18 utilisée dans les dosages ayant montré de bons résultats, avec un excellent taux de récupération (80,3 % ± 3,3 % de l’activité liée à la cartouche récupérée après élution), d’autres modèles n’ont pas été testés. Il est intéressant de noter que des cartouches en phase inverse équilibrées hydrophiles-lipophiles (HLB) mouillables dans l’eau sont également signalées pour la purification terminale de [68Ga]Ga-3BP-394029,36.
En l’état, la principale limitation de ce protocole est sa compatibilité avec un seul modèle de générateur de 68Ga. Cependant, des solutions peuvent être envisagées pour adapter la méthode à d’autres générateurs, comme l’augmentation du volume du tampon proportionnellement au volume d’éluat de 68Ga. Par exemple, l’utilisation de 1,25 mL au lieu de 0,25 mL de tampon d’acétate de sodium 0,8 M pourrait convenir pour un éluat de 68Ga de 5 mL. Une autre approche consisterait à incorporer une cartouche SCX dans la configuration (généralement entre les collecteurs A2 et B1) pour concentrer les ions 68Ga3+ de l’éluat du générateur. Ensuite, le gallium a pu être récupéré dans un volume fixe en éluant la cartouche SCX avec une solution saturée de NaCl (5 M) à pH 1. Cette modification permet également des synthèses multi-générateurs, comme l’ont démontré Mueller et al., qui ont utilisé jusqu’à quatre générateurs pour la préparation de [68Ga]Ga-FAP-228619,35. Ainsi, un protocole alternatif incorporant une cartouche SCX est proposé à la figure supplémentaire 3. Une telle approche permettrait une mise à l’échelle significative de la méthode, et pourrait augmenter considérablement le nombre de patients qui pourraient bénéficier d’une préparation donnée. Cependant, dans la méthode, il est essentiel de noter que les volumes tampons doivent à nouveau être soigneusement ajustés pour permettre, dans ces conditions alternatives, un pH de réaction d’environ 3,6, idéal pour le radiomarquage 68Ga65. L’agent anti-radiolyse et le tampon doivent également être préparés directement dans la même seringue en B3 pour libérer la position C1 pour l’éluant de la cartouche SCX.
Enfin, étant donné que le processus automatisé présenté ici est conforme aux BPF, l’utilisation du 3BP-3940 de qualité BPF en association avec le développement et la validation de contrôles de qualité supplémentaires (c’est-à-dire la stérilité de la préparation, les niveaux d’endotoxines bactériennes, l’identité radiochimique par radio-HPLC et la quantification de la teneur résiduelle en solvants) garantirait une transition simple vers les applications cliniques. Cette mise en œuvre devrait évidemment répondre à toutes les exigences réglementaires en vigueur pour être validée, notamment, la constitution d’une IMPD.
Déclarations de divulgation
Les auteurs n’ont aucun partenariat commercial ou source de financement qui entraînerait un conflit d’intérêts réel ou perçu lié à ce travail à divulguer.
Remerciements
Les auteurs remercient Yasmine Soualy, Stéphane Renaud et Élodie Gaven pour leur aide dans la préparation des réactions de radiomarquage présentées dans ce manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| 0.2 µ filters | VWR | 514-0515 | For filtration of buffer and antioxidant solutions and final radiolabeling product |
| Acetonitrile for HPLC | Sigma Aldrich | 34851-2.5L | For HPLC control of radiochemical purity |
| Ammonium acetate | Sigma Aldrich | 238074 | For the preparation of one of the mobile phases for TLC control |
| C18 column for HPLC | VWR | EQV-3C18-1503 | For HPLC control of radiochemical purity |
| Calibrated dose calibrator (CRC25) | Capintec | - | For measuring the radioactivity of the final product and the various components of the module post-synthesis |
| Citrate buffer solution, pH 4 | Thermofisher | 258585000 | Mobile phase for TLC controls |
| Eppendorf tube 5 mL Biopur | Sigma Aldrich | EP0030119479 | For the preparation of buffer and antioxidant solutions |
| Extension line (30 cm) | Vygon | 1159.03 | For the connection of the generator to the tubing set |
| Gallium-68 generator | IRE Elit | - | For in situ generation of [68Ga]gallium chloride |
| Gamma counter (Hidex AMG) | Hidex | - | For half-life and radiochemical purity assessment |
| HPLC station | Shimadzu | - | For HPLC control of radiochemical purity |
| iTLC-SG plates | Agilent | SGI0001 | For TLC control of radiochemical purity |
| L-methionine | AppliChem | A1340 | For antioxidant solution preparation |
| Male/male adapter | Vygon | 893.00 | For the connection of the generator to the tubing set |
| Methanol | Sigma Aldrich | 320390-1L | For the preparation of one of the mobile phases for TLC control |
| Needles (21G, Sterican) | B Braun | 4657543B | For solution transfers prior to radiolabeling |
| pH paper | VWR | 85409.600 | To test the pH of the radiolabelling product |
| Pipette 1000 µL (Gilson PIPETMAN) | Fisher Scientific | 12346132-1000 | For precise liquid measurement and transfer |
| Pipette 200 µL (Gilson PIPETMAN) | Fisher Scientific | 12326132-200 | For precise liquid measurement and transfer |
| Pipette Tips, 100-1000 μL | Charles River | D1000IW | For precise liquid measurement and transfer |
| Pipette Tips, 2-200 μL | Charles River | D200IW | For precise liquid measurement and transfer |
| Radiochromatograph | Elysia-Raytest | - | For TLC control of radiochemical purity |
| Radiosensor for HPLC | Elysia-Raytest | - | For HPLC control of radiochemical purity |
| Reagents kit | ABX | RT-101 | Provides ethanol 60%, NaCl 0.9%, WFI bag, C18 cartridge, 0.2 µ terminal filter, aeration needles, terminal needle and waste vial |
| Shielded container | LemerPax | For radiation attenuation of the radiolabeling product | |
| Single-use plastic spatula | Corning | 3005 | For the preparation of reagents |
| Sodium acetate trihydrate EMPROVE | Sigma Aldrich | 1.28204 | For reaction buffer preparation |
| Sterile sealed vials (glass type 1) | Curium | TC-ELU-5 | For final conditioning of buffer, antioxidant and radiolabeling solutions |
| Sterile tubing set | ABX | RT-01-H | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Sterile water for irrigation | B Braun | 0082479E | For the preparation of one of the mobile phases for TLC control |
| Synthesis module (GAIA) | Elysia-Raytest | - | For automated synthesis of [68Ga]Ga-3BP-3940 |
| Syringe (1 mL, low dead-volume) | B Braun | 9166017V | For peptide in buffer conditionning and addition of methionine in NaCl 0.9% |
| Syringes (10 mL) | Becton Dickinson | 309649 | For methionine in NaCl 0.9% and conditionning |
| Syringes (3 mL) | Becton Dickinson | 309658 | For methionine and ethanol 60% conditionning |
| TLC migration tanks | Fisher Scientific | 50-212-281 | For TLC control of radiochemical purity |
| Trifluoroacetic acid (suitable for HPLC) | Sigma Aldrich | 302031-100ML | For HPLC control of radiochemical purity |
| Tubes for gamma counter | - | - | For half-life and radiochemical purity assays preparation |
| Ultrasonic bath | Selecta | 3000683 | For sonication of prepared solutions |
| Vector molecule (3BP-3940) | MedChemExpress | HY-P10131 | Vector molecule to be radiolabeled |
| Vial for HPLC with glass insert | Sigma Aldrich | 29385-U and SU860066 | For HPLC control of radiochemical purity |
| Vortex mixer | VWR | 444-5900P | For stirring the prepared solutions |
| Water for HPLC | Sigma Aldrich | 34877-2.5L-M | For HPLC control of radiochemical purity |
| Water for injection, 10 mL flasks | Aguettan | 34009 370 641 0 1 | For solutions preparation |
Références
- Xiao, Y., Yu, D. Tumor microenvironment as a therapeutic target in cancer. Pharmacol Ther. 221, 107753(2021).
- Zhang, L., et al. Targets of tumor microenvironment for potential drug development. MedComm Oncol. 3 (1), e68(2024).
- Fouillet, J., Torchio, J., Rubira, L., Fersing, C. Unveiling the Tumor Microenvironment Through Fibroblast Activation Protein Targeting in Diagnostic Nuclear Medicine: A Didactic Review on Biological Rationales and Key Imaging Agents. Biology. 13 (12), 967(2024).
- Chen, Y., McAndrews, K. M., Kalluri, R. Clinical and therapeutic relevance of cancer-associated fibroblasts. Nat Rev Clin Oncol. 18 (12), 792-804 (2021).
- Lindner, T., et al. Targeting of activated fibroblasts for imaging and therapy. EJNMMI Radiopharm Chem. 4 (1), 16(2019).
- Jansen, K., et al. Extended structure-activity relationship and pharmacokinetic investigation of (4-quinolinoyl)glycyl-2-cyanopyrrolidine inhibitors of fibroblast activation protein (FAP). J Med Chem. 57 (7), 3053-3074 (2014).
- De Decker, A., et al. Novel Small Molecule-Derived, Highly Selective Substrates for Fibroblast Activation Protein (FAP). ACS Med Chem Lett. 10 (8), 1173-1179 (2019).
- Van Rymenant, Y., et al. In Vitro and In Situ Activity-Based Labeling of Fibroblast Activation Protein with UAMC1110-Derived Probes. Front Chem. 9, 640566(2021).
- Lindner, T., et al. Development of Quinoline-Based Theranostic Ligands for the Targeting of Fibroblast Activation Protein. J Nucl Med. 59 (9), 1415-1422 (2018).
- Guglielmo, P., et al. Head-to-Head Comparison of FDG and Radiolabeled FAPI PET: A Systematic Review of the Literature. Life. 13 (9), 1821(2023).
- Ora, M., et al. Fibroblast Activation Protein Inhibitor-Based Radionuclide Therapies: Current Status and Future Directions. J Nucl Med. 64 (7), 1001-1008 (2023).
- Zhao, L., et al. Synthesis, Preclinical Evaluation, and a Pilot Clinical PET Imaging Study of FAPI Dimer. J Nucl Med. 63 (6), 862-868 (2022).
- Ferdinandus, J., et al. Initial clinical experience with radioligand therapy for advanced stage solid tumors: a case series of nine patients. J Nucl Med. 63 (5), 727-734 (2021).
- Rathke, H., et al. Two Tumors, One Target: Preliminary Experience With 90Y-FAPI Therapy in a Patient With Metastasized Breast and Colorectal Cancer. Clin Nucl Med. 46 (10), 842-844 (2021).
- Fendler, W. P., et al. Safety and Efficacy of 90Y-FAPI-46 Radioligand Therapy in Patients with Advanced Sarcoma and Other Cancer Entities. Clin Cancer Res. 28 (19), 4346-4353 (2022).
- Zboralski, D., et al. Preclinical evaluation of FAP-2286 for fibroblast activation protein targeted radionuclide imaging and therapy. Eur J Nucl Med Mol Imaging. 49 (11), 3651-3667 (2022).
- Pang, Y., et al. PET Imaging of Fibroblast Activation Protein in Various Types of Cancer Using 68Ga-FAP-2286: Comparison with 18F-FDG and 68Ga-FAPI-46 in a Single-Center, Prospective Study. J Nucl Med. 64 (3), 386-394 (2023).
- Banihashemian, S. S., et al. [68Ga]Ga-FAP-2286, a novel promising theragnostic approach for PET/CT imaging in patients with various type of metastatic cancers. Eur J Nucl Med Mol Imaging. 51 (7), 1981-1988 (2024).
- Baum, R. P., et al. Feasibility, Biodistribution, and Preliminary Dosimetry in Peptide-Targeted Radionuclide Therapy of Diverse Adenocarcinomas Using 177Lu-FAP-2286: First-in-Humans Results. J Nucl Med. 63 (3), 415-423 (2022).
- Loktev, A., et al. Development of Fibroblast Activation Protein-Targeted Radiotracers with Improved Tumor Retention. J Nucl Med. 60 (10), 1421-1429 (2019).
- Banihashemian, S. S., et al. The complete metabolic/molecular response to chemotherapy combined with [177Lu]Lu-FAP-2286 in metastatic breast cancer. Eur J Nucl Med Mol Imaging. 51 (13), 4185-4187 (2024).
- Rao, Z., Zhang, Y., Liu, L., Wang, M., Zhang, C. [177Lu]Lu-FAP-2286 therapy in a case of right lung squamous cell carcinoma with systemic metastases. Eur J Nucl Med Mol Imaging. 50 (4), 1266-1267 (2023).
- Yang, H., Liu, H., Zhang, Y., Zhang, Y., Chen, Y. Metastatic Lung Adenocarcinoma Received Combined 177Lu-FAP-2286 Radiation Therapy and Targeted Therapy. Clin Nucl Med. 49 (6), 569-571 (2024).
- Wan, Z., Wang, W., Chen, Y., Zheng, W., Huang, Z. 177Lu-FAP-2286 Therapy in a Patient With Metastatic Rhabdoid Meningioma. Clin Nucl Med. 49 (9), 879-881 (2024).
- Yang, H., Liu, H., Li, H., Zhang, Y., Chen, Y. 177Lu-FAP-2286 Therapy in a Metastatic Bone Malignant Solitary Fibrous Tumor. Clin Nucl Med. 49 (5), 472-474 (2024).
- Li, L., Yang, J., Peng, D., Zhang, Y., Chen, Y. 177 Lu-FAP-2286 Therapy in a Case of Recurrent Bladder Cancer With Multiple Metastatic Lesions. Clin Nucl Med. 48 (11), 1012-1014 (2023).
- Compounds comprising a fibroblast activation protein ligand and use thereof. US Patent. , US20230212549A1 https://patents.google.com/patent/US20230212549A1/en (2023).
- Jakobsson, V., et al. First-in-human study of a novel radiolabeled fibroblast activating protein (FAP)-targeted peptide 68Ga-FAP-3BP-3940 for PET/CT imaging in patients with solid tumors. J Nucl Med. 64 (supplement 1), P1615-P1615 (2023).
- Greifenstein, L., et al. 3BP-3940, a highly potent FAP-targeting peptide for theranostics - production, validation and first in human experience with Ga-68 and Lu-177. iScience. 26 (12), 108541(2023).
- Baum, R. P., et al. FAP-Targeted Radiopeptide Therapy using 177Lu-, 225Ac- and 90Y-labeled 3BP-3940 in Diverse Advanced Solid Tumors: First-in-Humans Results (Abstract P1612). J Nucl Med. 64 (supplement 1), P1612-P1612 (2023).
- Meisenheimer, M., Kürpig, S., Essler, M., Eppard, E. Manual vs automated 68Ga-radiolabelling-A comparison of optimized processes. J Labelled Comp Radiopharma. 63 (4), 162-173 (2020).
- Kleynhans, J., et al. Production of [68Ga]Ga-PSMA: Comparing a manual kit-based method with a module-based automated synthesis approach. J Labelled Comp Radiopharma. 63 (13), 553-563 (2020).
- le Roux, J., Rubow, S., Ebenhan, T. A comparison of labelling characteristics of manual and automated synthesis methods for gallium-68 labelled ubiquicidin. Appl Radiation Isotopes. 168, 109452(2021).
- Todde, S., et al. EANM guideline for the preparation of an Investigational Medicinal Product Dossier (IMPD). Eur J Nucl Med Mol Imaging. 41 (11), 2175-2185 (2014).
- Mueller, D., et al. Radiolabeling and Stability of FAP- Seeking Radiopharmaceuticals for Radio-Molecular Imaging and Therapy. J Nucl Med. 61 (supplement 1), 1129-1129 (2020).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract 2532). J Nucl Med. 63 (supplement 2), 2532-2532 (2022).
- Greifenstein, L., et al. Radiolabeling of 3BP-3940 with 68Ga, 90Y, 177Lu and 225Ac for imaging and Peptide Targeted Radiotherapy (PTRT) (Abstract P61). Nuklearmedizin. 62, P61(2023).
- Hörmann, A. A., et al. 68Ga]Ga-FAP-2286-Synthesis, Quality Control and Comparison with [18F]FDG PET/CT in a Patient with Suspected Cholangiocellular Carcinoma. Pharmaceuticals. 17 (9), 1141(2024).
- Lütje, S., et al. Optimization of Acquisition time of 68Ga-PSMA-Ligand PET/MRI in Patients with Local and Metastatic Prostate Cancer. PLoS One. 11 (10), e0164392(2016).
- Haendeler, M., et al. Biodistribution and Radiation Dosimetric Analysis of [68Ga]Ga-RM2: A Potent GRPR Antagonist in Prostate Carcinoma Patients. Radiation. 1 (1), 33-44 (2020).
- Daniel, T., Balouzet Ravinet, C., Clerc, J., Batista, R., Mouraeff, Y. Automated synthesis and quality control of [68Ga]Ga-PentixaFor using the Gaia/Luna Elysia-Raytest module for CXCR4 PET imaging. EJNMMI Radiopharm Chem. 8 (1), 4(2023).
- Rusu, T., et al. Fully automated radiolabeling of [68Ga]Ga-EMP100 targeting c-MET for PET-CT clinical imaging. EJNMMI Radiopharm Chem. 8 (1), 30(2023).
- Rubira, L., et al. 68Ga]Ga-FAPI-46 synthesis on a GAIA® module system: Thorough study of the automated radiolabeling reaction conditions. Appl Radiation Isotopes. 206, 111211(2024).
- Fouillet, J., et al. "One Method to Label Them All": A Single Fully Automated Protocolfor GMP-Compliant 68Ga Radiolabeling of PSMA-11, Transposable toPSMA-I&T and PSMA-617. Curr Radiopharm. 17 (3), 285-301 (2024).
- Nelson, B. J. B., Andersson, J. D., Wuest, F., Spreckelmeyer, S. Good practices for 68Ga radiopharmaceutical production. EJNMMI Radiopharm Chem. 7 (1), 27(2022).
- Rubira, L., Torchio, J., Fouillet, J., Vanney, J., Fersing, C. GMP-Compliant Automated Radiolabeling and Quality Controls of [68Ga]Ga-FAPI-46 for Fibroblast Activation Protein-Targeted PET Imaging in Clinical Settings. Chem Pharma Bullet. 72 (11), 1014-1023 (2024).
- Mueller, D., et al. Radiolabeling of DOTA-like conjugated peptides with generator-produced 68Ga and using NaCl-based cationic elution method. Nat Protoc. 11 (6), 1057-1066 (2016).
- Bauwens, M., Chekol, R., Vanbilloen, H., Bormans, G., Verbruggen, A. Optimal buffer choice of the radiosynthesis of 68Ga-Dotatoc for clinical application. Nucl Med Comm. 31 (8), 753-758 (2010).
- Kulprathipanja, S., Hnatowich, D. J. A method for determining the pH stability range of gallium radiopharmaceuticals. Int J Appl Radiation Isotopes. 28 (1-2), 229-233 (1977).
- Martins, A. F., et al. Spectroscopic, radiochemical, and theoretical studies of the Ga3+-N-2-hydroxyethyl piperazine-N'-2-ethanesulfonic acid (HEPES buffer) system: evidence for the formation of Ga3+ - HEPES complexes in (68) Ga labeling reactions. Contrast Media Mol Imaging. 8 (3), 265-273 (2013).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) PSMA-11 injection. Eur Pharma 11.0. 3044, 1276-1277 (2021).
- European Directorate for the Quality of Medicines & Healthcare (EDQM). Gallium (68Ga) edotreotide injection. Eur Pharma 11.0. 2482, 1274-1276 (2022).
- Li, D., et al. Development of a fibroblast activation protein-targeted PET/NIR dual-modality probe and its application in head and neck cancer. Front Bioeng Biotechnol. 11, 1291824(2023).
- Koshkin, V. S., et al. Initial Experience with 68Ga-FAP-2286 PET Imaging in Patients with Urothelial Cancer. J Nucl Med. 65 (2), 199-205 (2024).
- De Blois, E., Sze Chan, H., Konijnenberg, M., De Zanger, R. A. P., Breeman, W. Effectiveness of Quenchers to Reduce Radiolysis of 111In- or 177Lu-Labelled Methionine-Containing Regulatory Peptides. Maintaining Radiochemical Purity as Measured by HPLC. Curr Topics Med Chem. 12 (23), 2677-2685 (2013).
- Larenkov, A., Mitrofanov, I., Pavlenko, E., Rakhimov, M. Radiolysis-Associated Decrease in Radiochemical Purity of 177Lu-Radiopharmaceuticals and Comparison of the Effectiveness of Selected Quenchers against This Process. Molecules. 28 (4), 1884(2023).
- Baudhuin, H., et al. 68Ga-Labeling: Laying the Foundation for an Anti-Radiolytic Formulation for NOTA-sdAb PET Tracers. Pharmaceuticals. 14 (5), 448(2021).
- Kaczorowska, K., Kolarska, Z., Mitka, K., Kowalski, P. Oxidation of sulfides to sulfoxides. Part 2: Oxidation by hydrogen peroxide. Tetrahedron. 61 (35), 8315-8327 (2005).
- Breeman, W. A. P., et al. Optimised labeling, preclinical and initial clinical aspects of CCK-2 receptor-targeting with 3 radiolabeled peptides. Nucl Med Biol. 35 (8), 839-849 (2008).
- Haskali, M. B. Automated preparation of clinical grade [68Ga]Ga-DOTA-CP04, a cholecystokinin-2 receptor agonist, using iPHASE MultiSyn synthesis platform. EJNMMI Radiopharm Chem. 4, 23(2019).
- Chen, J., et al. Synthesis, stabilization and formulation of [177Lu]Lu-AMBA, a systemic radiotherapeutic agent for Gastrin Releasing Peptide receptor positive tumors. Appl Radiation Isotopes. 66 (4), 497-505 (2008).
- Chatalic, K. L. S., et al. In Vivo Stabilization of a Gastrin-Releasing Peptide Receptor Antagonist Enhances PET Imaging and Radionuclide Therapy of Prostate Cancer in Preclinical Studies. Theranostics. 6 (1), 104-117 (2016).
- De Zanger, R. M. S., Chan, H. S., Breeman, W. A. P., De Blois, E. Maintaining radiochemical purity of [177Lu]Lu-DOTA-PSMA-617 for PRRT by reducing radiolysis. J Radioanal Nucl Chem. 321 (1), 285-291 (2019).
- Hörmann, A. A., et al. Automated Synthesis of 68Ga-Labeled DOTA-MGS8 and Preclinical Characterization of Cholecystokinin-2 Receptor Targeting. Molecules. 27 (6), 2034(2022).
- Breeman, W. A. P., Jong, M., Visser, T. J., Erion, J. L., Krenning, E. P. Optimising conditions for radiolabelling of DOTA-peptides with 90Y, 111In and 177Lu at high specific activities. Eur J Nucl Med Mol Imaging. 30 (6), 917-920 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon